lectura
Anuncio

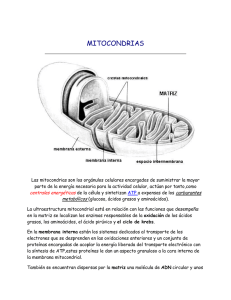
Tomado de La Célula de Cooper. Marban 00, 2da edición Bioenergética y metabolismo Mitocondrias, cloroplastos y P eroxisomas LOS ORGÁNULOS CITOPLÁSMICOS, ADEMÁS DE ESTAR IMPLICADOS EN EL TRANSPORTE Y DISTRIBUCIÓN DE LAS PROTEÍNAS, proporcionan compartimentos especializados en los que tienen lugar diversas actividades metabólicas. Una actividad fundamental de todas las células es generar energía metabólica, y son dos los orgánulos que están dedicados específicamente al metabolismo energético y a la producción de ATP. Las mitocondrias son responsables de generar la mayoría de la energía útil derivada de la degradación de los lípidos y de los carbohidratos, y los cloroplastos utilizan la energía obtenida de la luz solar para generar tanto ATP como poder reductor para sintetizar carbohidratos a partir de CO2 y H2O. El tercer orgánulo que se trata en este Capítulo, el peroxisoma, contiene enzimas que intervienen en diversas rutas metabólicas, incluyendo la degradación de los ácidos grasos y el metabolismo de un derivado de la fotosíntesis. Las mitocondrias, los cloroplastos y los peroxisomas difieren de los orgánulos tratados en el Capítulo anterior no sólo en sus funciones, sino también en su mecanismo de formación. Las proteínas destinadas a los peroxisom as, mitocondrias y cloroplastos, en lugar de sintetizarse en los ribosomas unidos a membrana y ser trasladadas al retículo endoplásmico, se sintetizan en los ribosomas libres del citosol y son importadas a sus orgánulos de destino en forma de cadenas polipeptídicas completas. Las mitocondrias y los cloroplastos también contienen sus propios genomas, que incluyen algunos genes que se transcriben y traducen en el propio orgánulo. Por lo tanto, la distribución de las proteínas a los orgánulos citoplásmicos tratados en este Capítulo es diferente de las rutas de transporte vesicular que conectan el retículo endoplásmico, el aparato de Golgi, los lisosomas y la membrana plasmática. 1 Mitocondrias Las mitocondrias desempeñan un papel crucial en la generación de energía metabólica en las células eucariotas. Como ya se comentó en el Capítulo 2, son responsables de la mayor parte de la energía útil derivada de la degradación de los carbohidratos y de los ácidos grasos, que es convertida en ATP por el proceso de la fosforilación oxidativa. La mayoría de las proteínas mitocondriales son traducidas en los ribosomas citoplásmicos libres, y son importadas al orgánulo debido a señales directoras específicas. Además, las mitocondrias son únicas entre los orgánulos citoplásmicos ya tratados en que contienen su propio ADN, que codifica ARNt, ARNr, y algunas proteínas mitocondriales. El ensamblaje de las mitocondrias implica, por tanto, a proteínas codificadas por su genoma propio y traducidas en el orgánulo, así como a proteínas codificadas por el genoma nuclear e importadas desde el citosol. Organización y función de las mitocondrias Las mitocondrias están rodeadas por un sistema de doble membrana, constituido por una membrana mitocondrial interna y otra externa separadas por un espacio intermembrana (Fig. 10.1). La membrana interna forma numerosos pliegues (crestas), que se extienden hacia el interior (o matriz) del orgánulo. Cada uno de estos componentes desempeña un papel funcional distinto, siendo la matriz y la membrana interna los principales compartimentos funcionales de las mitocondrias. 2 Figura 10.1 Estructura de una mitocondria. Las mitocondrias están rodeadas por un sistema de doble membrana, constituido por una membrana interna y una externa. Los pliegues de la membrana interna y una externa. Los pliegues de la membrana interna (crestas) se extienden hacia el interior de la matriz.(Microfotografía por K.R. Poster/Photo Rechearches, Inc.) La matriz contiene el sistema genético mitocondrial así como las enzimas responsables de las reacciones centrales del metabolismo oxidativo (Fig. 10.2). Como ya se trató en el Capítulo 2, la fuente principal de energía metabólica en las células animales es la degradación oxidativa de la glucosa y de los ácidos grasos, Las etapas iniciales del metabolismo de la glucosa (glicolisis) tienen lugar en el citoplasma, donde la glucosa es convertida a piruvato (véase Fig. 2.32). El piruvato es posteriormente transportado al interior de la mitocondria, donde su oxidación completa a C02 produce la mayor parte de la energía utilizable (ATP) procedente del metabolismo de la glucosa. Esto implica la oxidación inicial del piruvato a acetil CoA, que posteriormente es degradado hasta CO2 a través del ciclo del ácido cítrico (véanse Figs. 2.33 y 2.34). La oxidación de los ácidos grasos también produce acetil CoA (véase Fig. 2.36), que de forma similar es metabolizado por el ciclo del ácido cítrico en las mitocondrias. Por lo tanto, las enzimas del ciclo del ácido cítrico (localizadas en la matriz mitocondrial) tienen un papel 3 central en la degradación oxidativa tanto de los carbohidratos como de los ácidos grasos. Figura 10.2 Metabolismo en la matriz de las mitocondrias. El piruvato y los áciso grasos son importados desde el citosol y convertidos en acetil CoA en la matriz mitocondrial. El acetil CoA se oxida a CO2 a través del ciclo del ácido cítrico, la ruta principal del metabolismo oxidativo. La oxidación del acetil CoA a CO2 está acoplada a la reducción de NAD+ y FAD a NADH y FADH2 respectivamente. Por lo tanto, la mayor parte de la energía derivada del metabolismo oxidativo es producida por el proceso de fosforilación oxidativa (que se tratará en detalle en la siguiente sección), que tiene lugar en la membrana mitocondrial interna. Los electrones de alta energía del NADH y FADH2 se transfieren al oxígeno molecular a través de una serie de transportadores de la membrana. La energía derivada de estas reacciones de transferencia de electrones se convierte en energía potencial acumulada en forma de un gradiente de protones a través de la membrana, que es utilizada para dirigir la síntesis de ATP. La membrana interna mitocondrial representa de esta manera el lugar principal de generación de ATP, y este papel fundamental se refleja en su estructura. Primero, el incremento de su 4 superficie mediante su plegamiento en crestas. Además, la membrana interna mitocondrial contiene una proporción inhabitualmente elevada (mas del 70%) de proteínas, que intervienen en la fosforilación oxidativa así como en el transporte de metabolitos (p. ej., piruvato y ácidos grasos) entre el citosol y la mitocondria. Por otra parte, la membrana interna es impermeable a la mayoría de los iones y de las moléculas pequeñas una propiedad crítica para mantener el gradiente de protones que dirige la fosforilación oxidativa. A diferencia de la membrana interna, la membrana externa mitocondrial es completamente permeable a las moléculas pequeñas. Esto es debido a que contiene unas proteínas denominadas porinas, que forman canales que permiten la difusión libre de moléculas menores de 6.000 daltons. Por lo tanto, la composición del espacio intermembrana es similar a la del citosol respecto a los iones y a las moléculas pequeñas. Consecuentemente, la membrana mitocondrial interna es la barrera funcional para el paso de moléculas pequeñas entre el citosol y la matriz y mantiene el gradiente de protones que dirige la fosforilación oxidativa. Sistema genésico de las mitocondrias Las mitocondrias contienen su propio sistema genético, el cual está separado y es distinto del genoma nuclear de la célula. Como ya se comentó en el Capítulo 1, se cree que las mitocondrias evolucionaron a partir de bacterias que desarrollaron una relación simbiótica viviendo dentro de células más grandes (endosimbiosis). Esta hipótesis ha sido confirmada recientemente por los resultados del análisis de secuencias de ADN, que han revelado similitudes notables entre el genoma de las mitocondrias y el de la bacteria Rickettsia prowazekii. Las rickettsias son parásitos intracelulares que, al igual que las mitocondrias, sólo son capaces de reproducirse dentro de células eucariotas. De acuerdo con sus estilos de vida similares simbióticos, las secuencias de ADN genómico de Rickettsia y de las mitocondrias sugieren que compartieron un ancestro común, a partir del cual se originó el sistema genético de las mitocondrias actuales. 5 El genoma mitocondrial está constituido por moléculas circulares de ADN, como los de las bacterias, presentes en varias copias por orgánulo. Varían considerablemente en tamaño entre las diferentes especies. Los genomas de las mitocondrias humanas y de la mayoría de los animales tienen sólo alrededor del 6 kb, pero se han encontrado genomas mitocondriales sustancialmente más grandes en las levaduras (aproximadamente 80 kb) y en las plantas (más de 20o kb). Sin embargo, estos genomas mitocondriales más grandes están compuestos fundamentalmente por secuencias no codificantes y no parece que contengan mucha más información genética. Por ejemplo, el genoma mitocondrial más grande secuenciado es el de la planta Arabidopsis thaliana Aunque el ADN mitos condrial de Arabidopsis tiene alrededor de 367 kb, codifica sólo 32 proteínas: Un poco más del doble de las que codifica el ADN mitocondrial humano. El ADN mitocondrial con mayor número de genes es el del protozoo Reclinomonas americana, que tiene 69 kb y contiene 97 genes. El genoma mitocondrial de Reclinomonas parece que se asemeja más al genoma bacteriano del que evolucionaron las mitocondrias que la mayoría de los genomas mitocondriales actuales, que sólo codifican un pequeño número de proteínas que son componentes esenciales del sistema de fosforilación oxidativa. Además, el genoma mitocondrial codifica todos los ARNs ribosómicos y la mayoría de los ARNs de transferencia necesarios para la traducción en la mitocondria de estas secuencias codificantes. Otras proteínas mitocondriales son codificadas por genes nucleares; se piensa que éstas han sido transferidas al núcleo desde el genoma mitocondrial ancestral. El genoma mitocondrial humano codifica 13 proteínas implicadas en el transporte de electrones y en la fosforilación oxidativa (Fig. 10.3). Además, el ADN mitocondrial humano codifica ARNr 16S y 12S y 22 ARNt que se requieren para la traducción de las proteínas codificadas por el genoma del orgánulo. Los dos ARNr son los únicos componentes de ARN de los ribosomas mitocondriales de los animales y levaduras, mientras que los ribosomas bacterianos contienen tres ARNr (23S, 16S y 5S). Sin embargo, el ADN mitocondrial de las plantas también codifica un tercer ARNr de 5S. Las mitocondrias de las plantas y de los protozoos también difieren de las de los animales en que importan y utilizan ARNT codificados tanto por el genoma nuclear como por el mitocondrial, mientras que en las mitocondrias animales 6 todos los ARNt son codificados por el orgánulo. Figura 10.3 Genoma mitocondrial humano. El genoma contiene 13 secuencias codificadoras de proteinas, que son designadas como componentes de los complejos respiratorios I, III, IV, o V. Además, el genoma contiene genes para los ARNr 12S y 16S y para 22 ARNt, que son designados ´por el código de una letra para el aminoácido correspondiente. La región del genoma designada <<bucle D>> contiene un origen de replicación del DN y secuencias promotoras de la transcripción. El pequeño número de ARNt codificados por el genoma mitocondrial pone de manifiesto una característica importante del sistema genético mitocondrial -el uso de un código genético ligeramente diferente, que es distinto del código genético "universal" utilizado por las células procariotas y eucariotas (Tabla 10. l). Como ya se trató en el Capítulo 3, hay 64 codones posibles, de los cuales 61 codifican los 20 aminoácidos diferentes incorporados en las proteínas (véase Tabla 3. l).Muchos ARNt tanto en las células procariotas como en las eucariotas son capaces de reconocer más de un único codón en el ARNm debido al ,balanceo», que permite el desapareamiento entre el anticodón del ARNt y la tercera posición 7 de determinados codones complementarios (véase Fig. 7.3). Sin embargo, se requieren al menos 30 ARNt diferentes para traducir el código universal de acuerdo a las reglas del balanceo. Sin embargo, el ADN mitocondrial humano codifica sólo 22 especies de ARNt, y estos son los únicos ARNt que se utilizan para la traducción de los ARNm mitocondriales. Esto se lleva a cabo por una forma extrema de balanceo en la que la U en el anticodón del ARNt puede aparearse con cualquiera de las cuatro bases en la tercera posición del codón de ARNm, lo que permite que un único ARNt reconozca cuatro codones. Además, en las mitocondrias algunos codones especifican aminoácidos distintos de los que codifica el código universal. Al igual que el ADN de los genomas nucleares, el ADN mitocondrial puede alterarse por mutaciones, que frecuentemente son nocivas para el orgánulo. Puesto que casi todas las mitocondrias del óvulo fecundado las aporta el oocito en vez del espermatozoide, las mutaciones germinales en el ADN mitocondrial son transmitidas a la siguiente generación por la madre. Dichas mutaciones se han asociado con varias enfermedades. Por ejemplo, la neuropatía óptica hereditaria de Leber, una enfermedad que conduce a la ceguera, puede producirse por mutaciones en los genes mitocondriales que codifican los componentes de la cadena de transporte de electrones. Además, se ha sugerido que la acumulación progresiva de mutaciones en el ADN mitocondrial durante la vida de los idividuos contribuye al proceso de envejecimiento. Internalización de proteínas y formación de las mitocondrias A diferencia de lo que sucede con los ARN miembros del aparato de traducción e las mitocondrias (ARNr y ARNt), la mayoría de los genomas mitocondriales 0 codifican las proteínas requeridas para la replicación, transcripción o traducción del ADN. Los enes que codifican las proteínas requeridas para la replicación y expresión del ADN mitocondrial se encuentran en el núcleo. Además, el núcleo contiene los genes que codifican la mayoría de las proteínas mitocondriales requeridas para la fosforilación oxidativa y todas las enzimas que intervienen en el metabolismo mitocondrial (p. ej., las enzimas del ciclo del ácido cítrico). Las proteínas 8 codificadas por estos genes (más del 95 % de las proteínas mitocondriales) son sintetizadas en ribosomas citosólicos libres e introducidas en las mitocondrias como cadenas polipeptídicas completas. Debido a la estructura de doble membrana de las mitocondrias, la internalización de las proteínas es considerablemente más complicada que la transferencia de un polipéptido a través de una única bicapa fosfolipídica. Las proteínas destinadas a la matriz tienen que atravesar tanto la membrana mitocondrial interna como la externa, mientras que otras proteínas han de distribuirse a distintos compartimentos en el orgánulo (p. ej., el espacio intermembrana). La internalización de proteínas a la matriz es el aspecto mejor conocido de la distribución de las proteínas en la mitocondria (Fig. 10.4). La mayoría de las proteínas son marcadas y dirigidas a la mitocondria mediante secuencias amino terminales de 20 a 35 aminoácidos (denominadas presecuencias) que se escinden por rotura proteolítica tras entrar en el orgánulo. Las presecuencias de las proteínas mitocondriales, caracterizadas por primera vez por Gottfried Schatz, contienen múltiples residuos de aminoácidos con carga positiva, habitualmente en forma de hélice 3( antipática. El primer paso en la internalización de la proteína es la unión de estas presecuencias a receptores en la superficie de la mitocondria. A continuación la cadena polipeptídica se inserta en un complejo proteínico que dirige la translocación a través de la membrana externa (la transiocasa de la membrana externa o complejo Tom). Después, las proteínas se transfieren a un segundo complejo proteínico en la membrana interna (la transiocasa de la membrana interna o complejo Tim). La translocación de proteínas requiere el potencial electroquímico que se establece a través de la membrana interna mitocondrial durante el transporte de electrones. Como se verá en la siguiente sección de este Capítulo, la transferencia de electrones de alta energía desde el NADH y FADH2 al oxígeno molecular está acoplada a la transferencia de protones desde la matriz mitocondrial al espacio intermembrana. Puesto que los protones son partículas cargadas, esta transferencia establece un potencia¡ eléctrico a través de la membrana interna, siendo la matriz negativa. Durante la internalización de las proteínas, este potencia] eléctrico dirige la translocación de la presecuencia cargada positivamente. 9 Figura 10.4 Internalización de las proteinas en las mitocondrias. Las proteinas son marcadas y dirigidas a las mitocondrias mediante una presecuencia amino terminal que contiene aminoácidos con carga positiva. Las proteinas se mantienen parcialmente desplegadas mediante la asociaron con una Hsp 70 citosólica y son reconocidas porun receptor en la superficie de la mitocondria. Las cadenas polipeptídicas sin plegar son trnasferidas a través del complejo Tom en la membrana externa y tranferida al complejo Tim en la membrana interna. El componente de voltaje del gradiente electroquimico es requerido para la traslocación a través de la membrana interna. La presecuencia es escidida por una proteasa de la matriz, y una Hsp70 mitocondrial se une a la cadena polipeptídica al atravesar la membrana interna, dirigiendo la translocación del resto de la proteina. A continuación una Hsp60 mitocondrial facilita el plegamiento del polipéptido 10 internalizado en la matriz Para ser trasladadas a través de la membrana mitocondrial, las proteínas deben estar, al menos parcialmente, desplegadas. Por lo tanto, la internalización de las proteínas en las mitocondrias requiere chaperonas moleculares además de las proteínas de membrana implicadas en la translocación (véase Fig. 10.4). En el lado citoplásmico, los miembros de la familia de chaperonas Hsp7O mantienen las proteínas parcialmente desplegadas para que puedan ser insertadas en la membrana mitocondrial. A medida que cruzan la membrana interna, las cadenas polipeptídicas sin plegar se unen a otro miembro de la familia Hsp7O, que está asociado con el complejo Tim y que actúa como un motor que dirige la internalización de las proteínas. El polipéptido es transferido a continuación a una chaperona de la familia Hsp6O (una chaperonina), dentro de la cual se produce el plegamiento de la proteína. Puesto que estas interacciones de las cadenas polipeptídicas con las chaperonas moleculares dependen de ATP, la internalización de proteínas requiere ATP tanto fuera como en el interior de las mitocondrias, además del potencial eléctrico a través de la membrana interna. Como se ha mencionado previamente, algunas proteínas mitocondriales se dirigen a la membrana externa, a la membrana interna o al espacio intermembrana en lugar de a la matriz, por lo que se requieren mecanismos adicionales para dirigir estas proteínas al compartimento submitocondrial correcto. Estas proteínas son dirigidas a sus destinos mediante una segunda señal de distribución tras la presecuencia con carga positiva que dirige la internalización a laitocondria. La distribución de las proteínas a las membranas mitocondriales parece estar mediada por secuencias hidrófobas de terminación de la transferencia que interrumpen la translocación de las cadenas polipeptídicas a través de los complejos Tim o Tom, quedando insertadas en la membrana mitocondrial interna o externa, respectivamente (Fig. 10.5). Las proteínas pueden dirigirse al espacio intermembrana mediante varios mecanismos diferentes (Fig. 10.6). Algunas proteínas son transferidas a través de la membrana externa mediante el complejo Tom pero a continuación se liberan en el espacio intermembrana en lugar de ser transferidas al complejo Tim. Otras proteínas son transferidas al complejo Tim pero a continuación se liberan al espacio intermembrana como consecuencia de la escisión de las secuencias hidrófobas de interrupción de la 11 transferencia. Aún, otras proteínas pueden entrar en la matriz mitocondrial y después ser exportadas a través de la membrana interna al espacio intermembrana. Figura 10.5 Inserción de las proteínas de la membrana mitocondriales. Las proteínas dirigidas a las membranas mitocondriales contienen secuencias hidrófobas de terminación de la transferencia que interrumpen su translocación a través de los complejos Tom o Tim, dan lugar a su incorporación en las membranas externa o interna respectivamente. No sólo las proteínas, sino también los fosfolípidos de las membranas mitocondriales son importados desde el citosol. En las células animales, la fosfatidilcolina y la fosfatidiletanolamina se sintetizan en el RE y se transportan a las mitocondrias mediante proteínas de transferencia de fosfolípidos, que extraen moléculas aisladas de fosfolípidos de la membrana del RE. 12 Figura 10.6 Distribución de las proteínas al espacio intermembrana. Las proteínas pueden dirigirse al espacio intermembrana mediante varios mecanismos. Algunas proteínas (I) son transportadas a través del complejo Tom y se liberan en el espacio intermembrana. Otras proteínas (II) se transfieren desde el complejo Tom al complejo Tim, pero contienen secuencias hidrofóbicas de terminación de la transferencia que interrumpen el transporte a través delcomplejo Tim. Entonces, se escinden estas secuencias de interrupción de la transferencia para que las proteínas se liberen al espacio intermembrana. Aún, otras proteínas (III) entran en la matriz, como se representó en la Fig. 10.4. La liberación de la presecuencia en la matriz expone una secuencia señal hidrófoba, que dirige a la proteína de vuelta a través de la membrana interna hacia el espacio intermembrana. Entonces el lípido puede transportarse a través del ambiente acuoso del citosol, protegido por el sitio de unión hidrofóbico de la proteína, y liberarse cuando el complejo llega a una nueva membrana, como la de las mitocondrias. Las mitocondrias sintetizan fosfatidilserina a partir de fosfatidiletanolamina, y además catalizan la síntesis del fosfolípido poco frecuente cardiolipina, que contiene cuatro cadenas de ácidos grasos (Fig. 10.7). 13 Figura 10.7 Estructura de la Cardiología. La cardiolipina es un fosfolípido <<doble>> poco frecuente, que se encuentra principalmente en la membrana mitocondrial interna. Mecanismo de la fosforilación oxidativa La mayor parte de la energía utilizable obtenida de la degradación de los hidratos de carbono o de las grasas, deriva de la fosforilación oxidativa que tiene lugar en el interior de la mitocondria. Por ejemplo, la degradación de la glucosa mediante la glicálisis y el ciclo del ácido cítrico rinde un total de cuatro moléculas de ATP diez moléculas de NADH, y dos moléculas de FADH2 (véase Cap. 2). Los electrones del NADH y del FADH2 son transferidos después al oxígeno molecular, lo cual está acoplado a la formación de 32 a 34 moléculas adicionales de ATP mediante la fosforilación oxidativa. El transporte de electrones y la fosforilación oxidativa son actividades críticas de los complejos de las proteínas de la membrana mitocondrial interna, que puede considerarse como la fuente principal de energía celular. Cadena de transporte de electrones 14 Durante la fosforilación oxidativa los electrones derivados del NADH y FADH2 se combinan con el O2, y la energía liberada de estas reacciones de oxidación/reducción es utilizada para dirigir la síntesis de ATP a partir del ADP. La transferencia de electrones desde el NADH al 02 es una reacción que desprende mucha energía, con una AG'= -52,5 kcal/mol por cada par de electrones transferidos. Para poderse utilizar, esta energía debe producirse gradualmente, mediante el paso de los electrones a través de una serie de transportadores que constituyen la cadena de transporte de electrones. Estos transportadores están organizados en cuatro complejos en la membrana mitocondrial interna. Un quinto complejo de proteínas sirve después para acopiar las reacciones del transporte de electrones, productoras de energía, a la síntesis de ATP. 15 16 Los electrones del NADH entran en la cadena de transporte de electrones en el complejo I, constituido aproximadamente por 40 cadenas polipeptídicas (Fig. 10.8). Estos electrones primero se transfieren desde el NADH a un mononucleótido de flavina, y después, a través de un transportador de hierro-azufre, a la coenzima a -un proceso que desprende energía con una AG '= -1 6,6 kcal/mol-. La coenzima Q (también denominada ubiquinona) es una molécula pequeña, liposoluble, que transporta los electrones desde el complejo I, a través de la membrana, hasta el complejo III, que está constituido aproximadamente por 10 polipéptidos. En el complejo III los electrones se transfieren desde el citocromo b al citocromo c -una reacción que libera energía con una AG ' = -10,1 kcal/mol-. El citocromo c, una proteína de membrana periférica, unida a la cara externa de la membrana interna, transporta a continuación los electrones al complejo IV ( citocromo oxidasa), donde finalmente son transferidos al O2 (AG ' = -25,8 kcal/mol). Un complejo de proteínas diferente (complejo II), constituido por cuatro polipéptidos, recibe los electrones del succinato, que es un producto intermediario del ciclo del ácido cítrico (Fig. 10.9). Estos electrones son transferidos al FADH2, en lugar de al NADH, y después a la coenzima Q. Desde la coenzima Q, los electrones se transfieren al complejo III y después al complejo IV, como ya se ha descrito. A diferencia de la transferencia de electrones desde el NADH a la coenzima Q en el complejo I, la transferencia de electrones desde el FADH2 a la coenzima Q no lleva asociada una disminución significativa de la energía libre, por lo que no está acoplada a la síntesis de ATP. Por lo tanto, el paso de los electrones derivados del FADH2 a través de la cadena de transporte de electrones sólo rinde energía libre en los complejos III y IV. La energía libre derivada del paso de electrones a través de los complejos I, III, y IV se obtiene al acoplarse con la síntesis de ATP. Es importante destacar que el mecanismo por el que la energía derivada de estas reacciones de transporte de electrones se acopla a la síntesis de ATP, es fundamentalmente diferente de la síntesis de ATP durante la glicólisis o el ciclo del ácido cítrico, En estos últimos, un fosfato rico en energía se transfiere directamente al ADP desde otro sustrato, en una reacción que libera energía. Por ejemplo, en la reacción 17 final de la glicólisis, el fosfato rico en energía del fosfoenolpiruvato es transferido al ADP, dando lugar a piruvato más ATP (véase Fig. 2.32). Esta transferencia directa de grupos fosfato de alta energía no tiene lugar durante el transporte de electrones. En su lugar, la energía derivada del transporte de electrones está acoplada a la generación de un gradiente de protones a través de la membrana mitocondrial interna. La energía potencial almacenada en este gradiente se obtiene mediante un quinto complejo proteínico que acopla el flujo, energéticamente favorable, de los protones a través de la membrana, a la síntesis de ATP. Acoplamiento quimiosmótico El mecanismo de acoplamiento del transporte de electrones a la generación de ATP, el acoplamiento quimiosmótico, es un ejemplo significativo de la relación entre estructura y función en la biología celular. La hipótesis del acoplamiento quimiosmótico fue propuesta por primera vez en 1961 por Peter Mitchell, quien sugirió que el ATP se genera utilizando la energía almacenada en forma de un gradiente de protones a través de las membranas biológicas, en lugar de por una transferencia química directa de grupos ricos en energía. Inicialmente, los bioquímicos fueron muy escépticos con este planteamiento, y la hipótesis quimiosmática tardó más de una década en ganar la aceptación general de la comunidad científica. Sin embargo, con el tiempo se acumuló una evidencia abrumadora a su favor, y actualmente el acoplamiento quimiosmótico se reconoce como un mecanismo general de generación de ATP, que interviene no sólo en las mitocondrias sino también en los cloroplastos y en las bacterias, donde se genera ATP mediante un gradiente de protones a través de la membrana plasmática. El transporte de electrones a través de los complejos I, III y IV está acoplado al transporte de protones fuera del interior de la mitocondria (véase Fig. 10.8). Por lo tanto, las reacciones del transporte de electrones que liberan energía están acopladas a la transferencia de protones desde la matriz al espacio intermembrana, lo que establece un gradiente de protones a través de la membrana interna. Los complejos I y IV parece que actúan como bombas de protones, que tranfieren protones a través de la membrana como consecuencia de cambios conformacionales inducidos por el transporte de electrones. En el complejo III, los protones 18 son transportados a través de la membrana mediante la coenzima Q, que acepta protones de la matriz en los complejos I y II y los libera en el espacio intermembrana en el complejo 19 III. Los complejos I y III transfieren cuatro protones cada uno a través de la membrana por cada par de electrones. En el complejo IV, por cada par de electrones se bombean dos protones a través de la membrana y otros dos protones se combinan con el O2 para formar H2O en la matriz. Así, en cada uno de estos tres complejos, se transporta fuera de la matriz mitocondrial el equivalente de cuatro protones por cada par de electrones. Esta transferencia de protones desde la matriz al espacio intermembrana desempeña el papel fundamental de convertir la energía derivada de las reacciones de oxidación/reducción del transporte de electrones en la energía potencial almacenada en un gradiente de protones. Debido a que los protones son partículas cargadas eléctricamente, la energía potencial almacenada en el gradiente de protones es de naturaleza tanto eléctrica como química. El componente eléctrico corresponde a la diferencia de voltaje a través de la membrana mitocondrial interna, siendo la matriz de la mitocondria negativa y el espacio intermembrana positivo. La energía libre correspondiente viene dada por la ecuación AG = -FA V donde F es la constante de Faraday y AV es el potencial de membrana. La energía libre adicional que corresponde a la diferencia en la concentración de protones a través de la membrana, viene dada por la ecuación:G = RT in [H+]j [H+]o donde [H+]j y [H+]o se refieren a la concentración de protones dentro y fuera de la mitocondria, respectivamente. En las células metabólicamente activas, los protones son bombeados fuera de la matriz de tal manera que el gradiente de protones a través de la membrana interna corresponde aproximadamente a una unidad de pH, o a una concentración de protones en el interior de la mitocondria diez veces menor (Fig. 10. 10). Por lo tanto, el pH de la matriz mitocondrial 20 es aproximadamente 8, comparado con el pH neutro (aproximadamente 7) del citosol y del espacio intermembrana. Este gradiente también genera un potencial eléctrico de aproximadamente 0, 14 V a través de la membrana, siendo la matriz negativa. Tanto el gradiente de pH como el potencia¡ eléctrico dirigen el flujo de protones desde el citosol de vuelta a la matriz, por lo que su combinación supone un gradiente electroquímico a través de la membrana mitocondrial interna, con una AG correspondiente de alrededor de -5 kcal/mol por protón. Debido a que la bicapa fosfolipídica es impermeable a los iones, los protones sólo pueden atravesar la membrana a través de un canal de proteínas. Esta restricción permite aprovechar la energía de¡ gradiente electroquímico y que sea convertida en ATP, mediante la acción del quinto complejo que interviene en la fosforilación oxidativa, el complejo V, o ATP sintetasa (véase Fig. 10.8). La ATP sintetasa está constituida por dos componentes estructuralmente diferentes, Fo y F1, que están unidos por un tallo estrecho (Fig. 1 0.11). La porción Fo atraviesa la membrana interna y proporciona un canal a través del cual los protones fluyen de vuelta desde el espacio intermembrana a la matriz. El retorno energéticamente favorable de los protones a la matriz está acoplado con la síntesis de ATP mediante la subunidad Fl, que cataliza la síntesis de ATP a partir de ADP e iones fosfato (Pi). Estudios estructurales detallados han establecido el mecanismo de acción de la ATP sintetasa, que implica el acoplamiento mecánico entre las subunidades Fo y F1. Concretamente, el flujo de protones a través de Fo determina la rotación de F1 que actúa como un motor de rotación que dirige la síntesis de ATP. 21 Figura 10.10 Naturaleza electroquímica del gradiente de protones. Debido a que los protones están cargados positivamente, el gradiente de protones que se establece a través de la membrana mitocondrial interna tiene un componente tanto químico como eléctrico. El componente químico es el gradiente de la concentración de protones, o de pH, que se corresponde con una concentración de protones aproximadamente diez veces superior en el lado cito- sólico de la membrana mitocondrial interna (una diferencia de una unidad de pH). Además, hay un potencial eléctrico a través de la membrana, debido al incremento neto de la carga positiva en el lado cito-plásmico. Parece que se requiere el flujo de vuelta a través de la membrana de cuatro protones a través de Fo para dirigir la síntesis de una molécula de ATP por F1, lo que concuerda con que cada una de las transferencias de protones en los complejos I, III y IV, contribuye con la suficiente energía libre al gradiente de protones como para dirigir la síntesis de una molécula de ATP. De esta manera, la oxidación de una molécula de NADH da lugar a la síntesis de tres moléculas de ATP, mientras que la oxidación de FADH2, que entra en la cadena de transporte de electrones en el complejo II, genera sólo dos moléculas de ATP. 22 Transporte de metabolitos a través de la membrana interna Además de dirigir la síntesis de ATP, la energía potencia¡ almacenada en el gradiente electroquímico dirige el transporte de moléculas pequeñas dentro y fuera de la mitocondria. Por ejemplo, el ATP sintetizado en las mitocondrias tiene que ser exportado al citosol, mientras que el ADP y el Pj, tienen que ser importados desde el citoplasma para que continúe la síntesis de ATP. El gradiente electroquímico generado por el bombeo de protones proporciona la energía requerida para el transporte de estas moléculas y de otros metabolitos que se necesitan en las mitocondrias (Fig. 10.12). Figura 10. 11 Estructura de la ATP sintetasa. La ATP sintetasa mitocondrial (complejo V) está constituida por dos subunidades, Fo y F1, que están unidas por un tallo estrecho. Fo atraviesa la bicapa lipídica, formando un canal a través de¡ cual los protones pueden atravesar la membrana. F1 aprovecha la energía libre derivada del flujo de protones a favor de¡ gradiente electroquímico, catalizando la síntesis de ATP. 23 El transporte de ATP y ADP a través de la membrana interna está mediado por una proteína integral de membrana, el transportador de nucleótidos de adenina, que transporta una molécula de ADP al interior de la mitocondria a cambio de una molécula de ATP transferida desde la mitocondria al citosol. Debido a que el ATP tiene una carga negativa mayor que el ADP (-4 en comparación con -3), este intercambio está dirigido por el componente eléctrico del gradiente electroquímico. Puesto que el gradiente de protones establece una carga positiva en el lado citosólico de la membrana, el intercambio de ATP por ADP es energéticamente favorable. Además de ADP, la síntesis de ATP en la mitocondria también requiere iones fosfato (Pj), por lo Esto lo realiza otra proteína que también debe importarse Pj desde el citoplasma. transportadora de membrana, que importa fosfato (H2PO4-) y exporta iones hidroxilo (OH-). Este intercambio es eléctricamente neutro porque tanto los iones fosfato como los iones hidroxilo tienen una carga de -1. Sin embargo, el intercambio está dirigido por el gradiente de la concentración de protones; el pH más elevado en el interior de las mitocondrias se corresponde con una mayor concentración de iones hidroxilo, lo que favorece su translocación al lado citosólico de la membrana. Figura 10.12 Transporte de metabolitos a través de la membrana interna mitocondrial. El transporte de moléculas pequeñas a través de la membrana interna mitocondrial está mediado por proteínas transportadoras que atraviesan la membrana y está dirigido por el gradiente electroquímico. Por ejemplo, el ATP es exportado desde las mito-condrias al citosol mediante un transportador que lo intercambia por ADP. El componente eléctrico del gradiente elec- troquímico dirige este intercambio: el ATP tiene una mayor carga negativa (-4) que el ADP (-3), por lo que el ATP es exportado desde la matriz mitocondrial al citosol mientras que el ADP es importado a la m¡-tocondria. Por el contrario, el transporte de fosfato (P,) y de piruvato está acoplado a un intercambio de iones hidroxilo (OH ); en este caso el componente de pH del gradiente electroquímico dirige la exportación de iones hidroxilo, acoplada al transporte de P, y piruvato al interior de las mitocondrias. 24 La energía del gradiente electroquímico se utiliza de forma similar para dirigir el transporte de otros metabolitos al interior de las mitocondrias. Por ejemplo, el transporte de piruvato desde el citoplasma (donde se produce por la glicólisis) al interior de la mitocondria está mediado por un transportador que intercambio piruvato por iones hidroxilo. Otros intermediarios del ciclo del ácido cítrico son capaces de ir y venir entre las mitocondrias y el citosol mediante mecanismos de intercambio similares. 25