CambiosdeFase
Anuncio
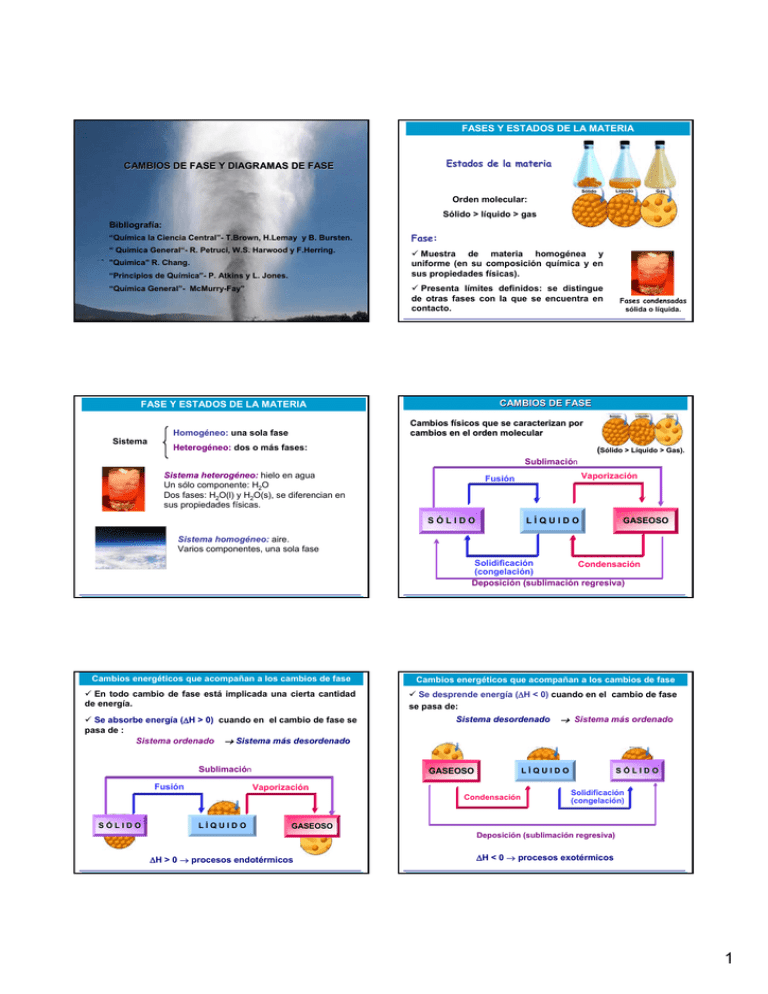
FASES Y ESTADOS DE LA MATERIA Estados de la materia CAMBIOS DE FASE Y DIAGRAMAS DE FASE Orden molecular: Sólido > líquido > gas Bibliografía: “Química la Ciencia Central”- T.Brown, H.Lemay y B. Bursten. Fase: “ Quimica General“- R. Petruci, W.S. Harwood y F.Herring. 9 Muestra de materia homogénea y uniforme (en su composición química y en sus propiedades físicas). "Quimica" R. Chang. “Principios de Química”- P. Atkins y L. Jones. 9 Presenta límites definidos: se distingue de otras fases con la que se encuentra en contacto. “Química General”- McMurry-Fay” CAMBIOS DE FASE FASE Y ESTADOS DE LA MATERIA Sistema Fases condensadas sólida o líquida. Cambios fí físicos que se caracterizan por cambios en el orden molecular Homogéneo: una sola fase Heterogéneo: dos o más fases: (Sólido > Lí Líquido > Gas). Sublimación Sistema heterogéneo: hielo en agua Un sólo componente: H2O Dos fases: H2O(l) y H2O(s), se diferencian en sus propiedades físicas. Vaporización Fusión LÍQUIDO SÓLIDO GASEOSO Sistema homogéneo: aire. Varios componentes, una sola fase Solidificación Condensación (congelación) Deposición (sublimación regresiva) Cambios energéticos que acompañan a los cambios de fase Cambios energéticos que acompañan a los cambios de fase 9 En todo cambio de fase está implicada una cierta cantidad de energía. 9 Se desprende energía (ΔH < 0) cuando en el cambio de fase se pasa de: 9 Se absorbe energía (ΔH > 0) cuando en el cambio de fase se pasa de : Sistema ordenado → Sistema más desordenado Sublimación Fusión Sistema desordenado GASEOSO LÍQUIDO Vaporización Condensación SÓLIDO LÍQUIDO → Sistema más ordenado SÓLIDO Solidificación (congelación) GASEOSO Deposición (sublimación regresiva) ΔH > 0 → procesos endotérmicos ΔH < 0 → procesos exotérmicos 1 EQUILIBRIO LÍ LÍQUIDOQUIDO-VAPOR Proceso de Vaporizació Vaporización: Liquído EQUILIBRIO LÍ LÍQUIDOQUIDO-VAPOR ΔH > 0 Gas Liquído Gas ΔH > 0 El cambio de fase puede tener lugar de dos maneras distintas: 9 Evaporación: sólo las partículas que se encuentran en la superficie del líquido escapan de la atracción de las demás partículas. - Deben adquirir suficiente energía para liberarse. - El proceso ocurre lentamente a cualquier T. Recipiente cerrado Recipiente abierto 9 Ebullición: a una temperatura determinada, (Teb), la vaporización se produce en todo el volumen del líquido y no sólo en la superficie. Cualquier partícula, del interior o de la superficie, adquiere suficiente energía para escapar de sus vecinas (la energía es proporcionada por una fuente calorífica). EQUILIBRIO LÍ LÍQUIDOQUIDO-VAPOR EQUILIBRIO LÍ LÍQUIDOQUIDO-VAPOR Calor de vaporización o entalpía de vaporización (ΔHvap) 9 Cantidad de calor que debe ser absorbido para que una cierta cantidad de líquido se vaporice a T = cte. Liquído Gas Gas proceso inverso al de vaporización. ΔHcond < 0 Liquído ΔHcond = - ΔHvap ΔH > 0 endotérmico 9 Su valor depende de la intensidad de las intermoleculares entre las partículas. Condensació Condensación: fuerzas H2O(l) → H2O(g) ΔHvap = + 44 kJ mol–1 H2O(g) → H2O(l) ΔHcond = – 44 kJ mol–1 ¿Por qué una quemadura con vapor es más grave que una con agua caliente? EQUILIBRIO LÍ LÍQUIDOQUIDO-VAPOR - PRESIÓN DE VAPOR Presión de vapor: presión ejercida por el vapor en equilibrio dinámico con su líquido. Es constante a T constante. Vaporv3.swf PRESIÓN DE VAPOR 9 Su valor depende de la naturaleza del líquido y de la T. Pv Patm = Pvapor + PHg Cuando las velocidades de ambos procesos se igualan: vvaporización = v condensación A T = 25°C el líquido y el vapor se encuentran en un estado de equilibrio dinámico. 2 PRESIÓ PRESIÓN DE VAPOR – PUNTO DE EBULLICIÓ EBULLICIÓN 9 La presión de vapor de un líquido aumenta al aumentar la temperatura. Curva de Presión de vapor Curva de equilibrio entre dos fases: líquidoquido-gas. Tº(C) Pv (mm Hg) 0 20 50 80 100 4,584 17,55 92,65 355,6 760,0 Pv(mm Hg) Pv del agua líquida (entre 0°C y 100 °C) Punto de ebullición: temperatura a la cual la presión vapor de un líquido iguala a la presión externa. Punto de ebullición normal: T a la cual la presión vapor del líquido iguala a la presión externa de 1 atm Líquido Gas T (°C) En cada punto hay un par de valores (P, T) para los cuales existe equilibrio PRESIÓ PRESIÓN DE VAPOR Y NATURALEZA DEL LÍ LÍQUIDO Líquidos volátiles: Líquidos no volátiles: Mayor volatilidad ∴ mayor ↔ tienen Pv alta a T ambiente tienen Pv baja a T ambiente. Punto de ebullición normal del H2O(l): Presión de vapor (Torr) PRESIÓN DE VAPOR Pv = Pext = 1 atm Teb = 100°C Temperatura (°C) Ej: En la cumbre del Monte Everest donde la Patm = 260 mmHg el agua hierve a Teb= 71°C CAMBIOS DE FASE: CURVA DE CALENTAMIENTO Al suministrar calor a una sustancia en estado sólido: F. Intermoleculares más débiles Presión de vapor, menor Punto de ebullición PE. F. Intermoleculares: éter dietílico < etanol < agua Cuanto má más dé débiles sean las F.I: F.I: 9 Se necesita menor temperatura para alcanzar una determinada presión. Teb: éter < etanol < agua 9 A T = cte, mayor cantidad de partículas pasan a la fase vapor ∴ mayor Pv. Pv: éter > etanol > agua Durante un cambio de fase la temperatura de la sustancia no se modifica DIAGRAMAS DE FASE DIAGRAMAS DE FASE Representación gráfica de las condiciones de temperatura y presión a las que existen los sólidos, líquidos y gases como fases únicas de los estados de la materia o como dos o más fases en equilibrio. Líneas AB, BD y BC: Cada punto corresponde a un par de valores P,T en las que coexisten dos fases en equilibrio: AB: equilibrio sólido - gas . BD: equilibrio sólido - líquido. BC: equilibrio líquido- gas. Punto triple: caracterizado por valores únicos de P y T en los que coexisten las tres fases en equilibrio. PUNTO CRÍ CRÍTICO: Punto por encima del cual la fase líquida y gaseosa de una sustancia son indistinguibles (caracterizado por Tc y Pc). T << Tc T ≈Tc T > Tc Fluído supercrítico 3 DIAGRAMA DE FASE DEL AGUA DIAGRAMA DE FASES Fluido Supercrítico Curva Pto. fusión: Pendiente negativa C= Punto crí crítico (Tc (Tc y Pc) Pc) Temperatura crítica Tc Temperatura más alta a la cual puede existir una sustancia en estado líquido. Temperatura Por encima de la Tc un gas no puede licuarse independiente de la P que se le aplique. Presión crítica: Mínima presión que debe aplicarse para producir la licuefacción del gas a la Tc. Línea AC: Curva de presión de vapor. Corresponde al equilibrio L-V H2O(l) Presió ón ((atm atm)) Presi No condensa Condensa Presión D H2O(g) Línea AD: Curva de equilibrio S-L B H2O(s) ↔ H2O(l) Línea AB: Curva de equilibrio S-G Temperatura A = Punto triple H2O(s) T = 0,01° 0,01°C y P = 0,00603 atm ↔ H2O(g) DIAGRAMA DE FASE DEL CO2 DIAGRAMAS DE FASE: Aplicaciones Curva Pto. fusión: Pendiente positiva Liofilizació Liofilización: deshidratació deshidratación a baja presió presión Presió ón ((atm atm)) Presi Tc= 31ºC y Pc= 73 atm 1) El café molido se congela 2) Se disminuye la presión 3) El agua sólida pasa a agua gaseosa la que se elimina. 20°C Ventajas: (destruirí (destruiría molé moléculas del sabor) 9 En ausencia de agua no crecen bacterias. 30°C 31°C El CO2 no puede existir en estado líquido a presiones por debajo de 5,11 atm. 9 Evita el secado por calentamiento Temperatura Punto triple: T= -57°C, P= 5,11 atm A 1 atm sublima P(pto triple) > 1 atm). DIAGRAMAS DE FASE H2O vs CO2 1.- Recordemos las principales diferencias ↔ DIAGRAMA DE FASES 1.- Considere una muestra de hielo, representada por el punto X en el diagrama, a 1 atm de presión y a una temperatura T. Describa lo que sucede cuando: a) Aumenta la T, a P = cte, hasta el punto Y. Z X Y Luego, a la T del punto Y aumenta la presión hasta el punto Z. b) Disminuye la P, a T = cte, hasta el punto R. R G Luego, a la P del punto R, aumenta la T hasta el punto G. 4 DIAGRAMAS DE FASE H2O 2.- Considere el punto de fusión normal del agua (0°C, 1 atm). Describa lo que sucede cuando: a) aumenta la P a T = cte b) disminuye la T a P = cte 3.- Considere el punto de ebullición normal del agua (100°C, 1atm). Describa lo que sucede cuando: a) disminuye la P a T = cte b) aumenta la P a T = cte b) disminuye T hasta 0°C, a P = cte, 4.- Marque en el diagrama el punto de fusión y de ebullición del agua a P = 0,5 atm. 5

