METABOLISMO DE AZÚCARES I. Glucólisis y gluconeogénesis
Anuncio

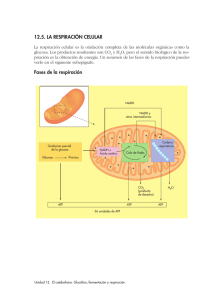
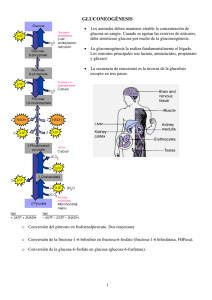
METABOLISMO DE AZÚCARES I. Glucólisis y gluconeogénesis Introducción En Bioquímica I ustedes estudiaron los fundamentos de la estructura y función de las macromoléculas celulares. Ahora vamos a comenzar con la parte central de esta asignatura donde se estudia las interconversiones metabólicas, aplicando los conceptos aprendidos. Encontrarán que, de ahora en adelante vamos a revisar un gran número de moléculas biológicas (y su estructura química), las reacciones enzimáticas donde ellas están involucradas (y su mecanismo de reacción) y el nombre de las enzimas que catalizan estas interconversiones. A primera vista parecería un ejercicio de memoria titánico. Sin embargo, vamos a encontrar caminos que faciliten este aprendizaje. Es absolutamente necesario aprender las estructuras químicas de los metabolitos involucrados en el metabolismo celular. En particular las que comenzamos a estudiar aquí que pertenecen a las rutas centrales del metabolismo. Vamos a ver que no son tantas como parecen a primera vista, que muchas de ellas están relacionadas en grupos de fácil incorporación y que, en muchos casos, las volveremos a encontrar en conexión con otras rutas metabólicas. Recuerden que los nombres de las enzimas provienen de la estructura química de los metabolitos y reflejan su especificidad de sustrato y el tipo de reacción catalizada. Tabla 1. CLASIFICACION METABOLICA DE LOS ORGANISMOS Organismos Fuente de ATP Fuente de NADPH Fuente de Carbono Ejemplos Quimioautótrofos Oxidación de compuestos inorgánicos Oxidación de compuestos inorgánicos CO2 Bacterias Sulfurosas, hidrogenantes, férricas y denitrificantes Fotoautótrofos Luz solar H2O CO2 Plantas, algas azulverdosas, bacterias fotosintéticas Fotoheterótrofos Luz solar Oxidación de compuestos orgánicos Compuestos orgánicos Bacterias púrpuras no sulfurosas Heterótrofos Oxidación de compuestos orgánicos Oxidación de compuestos orgánicos Compuestos orgánicos Animales, bacterias no fotosintéticas, células no fotosintéticas de plantas Así, con un manejo adecuado de la terminología estarán ustedes preparados para disfrutar la elegancia química del metabolismo intermediario. Sin embargo, es importante no perder de vista los conceptos importantes y las estrategias generales del metabolismo mientras se memorizan los detalles. Los nombres de las enzimas pueden ser olvidados fácilmente después de terminar la cursada, pero lo que aquí esperamos es que ustedes comprendan y retengan los principios y la lógica que hay detrás de la interconversión de los metabolitos en cualquier célula. Los organismos biológicos pueden ser clasificados de acuerdo a sus comportamiento metabólico en varias clases (ver tabla 1). Para ello se toman en cuenta cuales son las fuentes principales de las que los distintos organismos obtienen la energía, el poder reductor y el C, para poder realizar la síntesis de sus propias macromoléculas y, en definitiva, desarrollarse y vivir. Glucólisis La glucólisis es una secuencia de 10 reacciones catalizadas por enzimas por medio de las cuales la glucosa (u otro azúcar) es convertida en piruvato. Este camino metabólico es común a la mayoría de los organismos conocidos. Por ello, se piensa que esta ruta apareció bien temprano durante la evolución biológica, mucho antes que hubiera una abundante cantidad de O2 en la atmósfera y mucho antes, también, de que aparecieran los eucariotes. Glucólisis es una palabra de raíz griega que significa ruptura del azúcar, como veremos la ruptura real del azúcar ocurre en la etapa catalizada por la enzima denominada aldolasa. Las características más salientes de las enzimas glucolíticas se encuentran en la tabla 2 y la ruta aparece en detalle en la figura 1.1. Tabla 2. REACCIONES Y ENZIMAS INVOLUCRADAS EN LA GLUCOLISIS Reacción Enzima ΔGº’ A-1 Glucosa + ATP Î Glucosa-6-fosfato + ADP + H+ Hexokinasa - 5,0 B-1 (glucosa)n + Pi Î (glucosa)n-1 + glucosa-1-fosfato Glucógeno fosforilasa B-2 Glucosa-1-fosfato Î Glucosa-6-fosfato Fosfoglucomutasa - 1,7 2 Glucosa-6-fosfato Î Fructosa-6-fosfato Fosfohexosa isomerasa + 0,4 3 Fructosa-6-fosfato + ATP Î Fructosa-1,6-bisfosfato + ADP + H+ Fosfofructokinasa - 5,4 4 Fructosa-1,6-bisfosfato Î Gliceraldehido-3-P + Dihidroxiacetona-fosfato Aldolasa + 5,5 5 Dihidroxiacetona-fosfatoÎ Gliceraldehido-3-P Triosa-fosfato isomerasa + 1,8 6 Gliceraldehido-3-P + Pi + NAD+Î Glicerato-1,3-bisfosfato + NADH + H+ Gliceraldehido-3-fosfato deshidrogenasa + 1,5 7 Glicerato-1,3-bisfosfato + ADP + H+Î Glicerato-3-fosfato + ATP 3-Fosfoglicerato kinasa - 4,5 8 Glicerato-3-fosfato Î Glicerato-2-fosfato Fosfogliceromutasa + 1,1 9 Glicerato-3-fosfato Î Fosfoenolpiruvato + H2O + H+ Enolasa + 0,4 10 Fosfoenolpiruvato + ADP + H+ Î Piruvato + ATP Piruvato kinasa - 6,5 Etapa Reacción neta: C6H12O6 + 2 NAD+ + 2 ADP + 2 Pi Î 2 C3H4O3 + 2 NADH + 2 H+ + 2 ATP + 2 H2O -12,4 Pi Glucógeno ADP(o UDP) Glucógeno sintasa ADP-G Glucógeno Fosforilasa Glucosa ATP (o UDP-G) Pi Hexokinasa Glucosa-6fosfatasa PPi ADP G1P-Uridil transferasa O H C P O O C H C O C OH HO C C H Fosfogluco H C mutasa C OH H C C OH H2C CH2OH Glucosa-1-P NAD+ Etanol NADH NAD+ NADH bisfosfatasa Fructosa-6-P Pi H2O H2C OH O P O C O O O O H C O P O H Aldolasa 2 O OH Dihidroxiacetona-P OHO Triosa fosfato isomerasa O P O O H O Alcohol C deshidrogenasa CH3 co2 O H C H C OHO H2C O P O Fructosa-1,6bisfosfato Fermentación láctica O O C H C OH CH3 Lactato o CH2OH CH3 O O Glucosa-6-P Fermentación alcohólica O H2C H CH2OH C C O Fosfofructo kinasa OH H O C HO C H H H C Fosfohexo H C OH OH isomerasa H C H C OHO OHO H2C H2C O P O Fructosa-1,6 O P O O ATP(o UTP) HO H HO H H ATP ADP H2O O Gliceraldehido-3-P Pi NADH O O O P O C O H C OHO H2C O P O Lactato deshidrogenasa Piruvato descarboxilasa Gliceraldehido-3-P deshidrogenasa NAD+ NAD+ O NADH Otras fermentaciones O S C CoA CH3 co2 Condiciones Aeróbicas Acetil-CoA al ciclo de Krebs ADP NADH Condiciones Anaeróbicas O 1,3-bisfosfoglicerato NAD+ ATP O C C O CH3 ATP O ADP Piruvato kinasa Piruvato ATP ADP O O H2O O O O C O C O C H C OHO H C O P O C O P O H2C O P O H2C OHO Fosfoglicero CH2 O Enolasa mutasa O Fosfoenolpiruvato co2 Piruvato carboxilasa O 3-fosfoglicerato kinasa Fosfoenolpiruvato carboxikinasa O C C O CH2 2-fosfoglicerato 3-fosfoglicerato co2 ADP (o GDP) ATP (o GTP) O O Oxalacetato Figura 1.1. Resumen de las rutas de degradación y síntesis de glucosa y glucógeno. En la figura se resaltan como cuadros con fondo de color verde, naranja y celeste, los tres pooles de metabolitos. Además, el ATP se encuentra resaltado con un fondo amarillo y el NADH con un fondo rojo. Las flechas que indican reacciones que exclusivamente pertenecen a las rutas de degradación de azúcares (glucólisis o glucogenólisis) se muestran en color rojo. En cambio, las reacciones exclusivas de rutas de biosíntesis de glucosa (gluconeogénesis), se indican en flechas de color azul y las de glucógeno (glucogenogénesis) de color celeste. Como se muestra en la figura, junto con la degradación de la glucosa, se sintetizan dos moléculas de ATP a partir de ADP y Pi y 2 moléculas de NAD+ son reducidas a NADH. La reacción neta es la siguiente: Glucosa + 2 ADP + 2 NAD+ + 2 Pi 2 piruvato + 2 ATP + 2 NADH + 2H+ + 2 H2O De acuerdo a esta reacción global la glucólisis puede ser utilizada para la producción de ATP y NADH. El ATP es un transportador energético y el NADH es un transportador de poder reductor. Ambos son utilizados, en reacciones acopladas en las biosíntesis celulares. De esta manera la energía que se encontraba en el alimento celular (glucosa) es transformada y mantenida dentro de los pooles de metabolitos transportadores (ATP y NADH), con la producción de un metabolito de deshecho (piruvato en este caso). A pesar de que una de los principales funciones de esta ruta es la producción de ATP, dos de las tres primeras reacciones de la glucólisis consumen ATP (figura 1.2). Esta aparente paradoja se plantea para impedir que la célula pierda metabolitos importantes. Este ATP es utilizado para fosforilar los sustratos principales de la ruta. Como veremos más adelante estos sustratos son la glucosa y la fructosaH O 6-fosfato. La glucosa es una molécula que no H O C C posee carga eléctrica en solución, por lo que H C OH H C OH su constante de difusión a través de la HO C H HexoKinasa HO C H membrana plasmática es relativamente H C OH H C OH grande. En cambio, la glucosa fosforilada, H C OH H C OHO posee una carga eléctrica neta (entre –1 y –2 CH2OH H2C O P O O en solución fisiológica), por lo que su constante de difusión es mucho menor que la H2C OH O de la glucosa sin fosforilar. De esta manera, al H2C O P O C O incorporar la carga del fosfato en un metabolito O C O O H2C O P O descargado, la célula impide su difusión hacia Aldolasa O el exterior y, por lo mismo, su pérdida. HO C H + Además, la célula posee en la membrana H C OH O H C plasmática un conjunto de transportadores H C OHO H2C O P O H C OH O específicos para la glucosa. Estos O H2C O P O transportadores pueden ser utilizados tanto O Figura 1.2 para incorporar como para excretar glucosa. Como la glucosa fosforilada no es un sustrato del transportador, la reacción catalizada por la hexokinasa cumple la función de eliminar el sustrato del transportador y, para todos los efectos prácticos, convierte al transportador en incorporador de glucosa. Veremos más adelante que el hígado, el órgano de los mamíferos que es capaz de regular la concentración sanguínea de la glucosa posee una enzima que desfosforila la glucosa-6-fosfato, que se activa solamente cuando la concentración de la glucosa sanguínea baja más allá de los niveles normales. La actividad de esta enzima, produce un aumento de la concentración intracelular de glucosa, por lo que el transportador de la membrana plasmática comienza a tener sustrato dentro de la célula y comienza a trabajar en la exportación de la glucosa a la sangre. La fructosa-6-fosfato ya posee una carga, sin embargo si analizamos la reacción posterior catalizada por la aldolasa, en la que está involucrado el producto bi-fosforilado, vemos que es una reacción de escisión, donde una molécula de 6 C da lugar a dos moléculas de 3 C. Si el sustrato no fuera bifosforilado, entonces uno de los productos no poseería carga neta y por ello podría ser perdido de la misma manera que la glucosa. Este gasto le permite a la célula ser más eficiente en la utilización de los metabolitos combustibles. En este caso, la célula consume 2 enlaces de alta energía para “cebar” las moléculas combustibles que van a ser degradadas. Después de la “ruptura” del azúcar en la reacción catalizada por la aldolasa hay 2 etapas en las que se genera ATP (4 moléculas de ATP por molécula de glucosa en total), por lo que, en el camino de esta degradación, se recupera con creces la energía produciendo un mayor número de moléculas de ATP que las consumidas en las primeras reacciones. El primer mecanismo celular relacionado con la glucólisis involucra la captura de la glucosa del medio externo. Los organismos (como las bacterias o las arkeas) que son incapaces de controlar la composición del medio que rodea a las células poseen, normalmente, mecanismos de captura activa de la glucosa. Estos mecanismos requieren del aporte de la energía celular ya sea en la forma de enlaces fosfato de alta energía o en la forma de gradientes de concentración generados por el metabolismo. Por ejemplo, E. coli posee un conjunto de proteínas que conforman el sistema de la fosfotransferasa, que utiliza para el transporte activo de azúcares hacia el interior de la célula. El sistema tiene varios componentes, e involucra al menos 5 etapas. En este caso la energía se obtiene del enlace fosfato del fosfoenolpiruvato, cuyo aporte energético es casi el doble que el del ATP. Sin embargo la equivalencia energética de esta reacción es de sólo una molécula de ATP ya que, como vemos en la figura 1.3, la entrada de una molécula de glucosa va acompañada de la conversión de una molécula de fosfoenolpiruvato en piruvato. Además, el fosfato es transferido, utilizando los distintos componentes proteicos del sistema, a la glucosa en el interior de EII, de manera que la glucosa es liberada dentro de la célula ya fosforilada, disminuyendo su capacidad de atravesar la membrana lipídica y por lo mismo de perderse. Espacio extracelular Gluc Gluc EII Glucosa Membrana plasmática Gluc P O O C P C EIII Gluc P P HPr P EI O O C Glucosa-6-P Citosol Figura 1.3 CH2 PEP C O CH3 Piruvato O P En los organismos que si tienen sistemas para controlar la concentración de algunos metabolitos en el medio exterior de sus células, como los mamíferos con su sistema circulatorio, la incorporación de glucosa a las células, aunque siempre mediada por transportadores proteicos, puede ser pasiva, sin gasto energético. Una vez dentro de la célula la glucosa es fosforilada (por medio de una hexokinasa) convirtiéndola en glucosa-6-fosfato que es incapáz de salir de la célula. En los hongos y en los mamíferos encontramos cuatro isoformas diferentes de Hexokinasas, denominadas I, II, III y IV. Estas isoformas se diferencian en sus parámetros cinéticos. Las tres primeras tienen valores de KM para la glucosa relativamente bajos (entre 10-6 y 10-4) por lo que su afinidad por la glucosa es relativamente alta. En cambio el KM para la glucosa de la hexokinasa IV es más alto (aproximadamente 10-2) por lo que su afinidad por la glucosa es relativamente baja. De hecho esta isoforma de la enzima comienza a actuar cuando los valores de la concentración de glucosa superan la media estándar en el tejido extracelular, como ocurre, por ejemplo, en los mamíferos inmediatamente después de una comida. La isoforma IV era antes conocida como glucokinasa, pues se suponía que no tenía actividad sobre otros azúcares. Sin embargo hace poco tiempo se demostró que todas las isoformas mencionadas son capaces de fosforilar tanto glucosa como fructosa (entre otros) pero los valores de los respectivos KM para los dos azúcares eran bien distintos. Por ejemplo el KM para fructosa es (en todos los casos) aproximadamente el doble que el KM para la glucosa, lo que implica una menor afinidad para la fructosa. Como la concentración fisiológica de fructosa no supera practicamente nunca la de la glucosa, es muy raro que, incluso después de una comida pueda llegar hasta valores que permitan la fosforilación de este azúcar utilizando la hexokinasa IV, lo que sin embargo, no deja de ser posible. Pooles metabólicos Excepto el 1,3-bisfosfoglicerato, el resto de los intermediarios pertenece a tres “pooles” metabólicos (señalados con rectángulos de colores en la figura 1). Dentro de cada pool los intermediarios son fácilmente convertidos unos en otros ya que las reacciones que los conectan se encuentran prácticamente en equilibrio en las condiciones celulares. Entre los pools, las concentraciones de los intermediarios pueden ser muy diferentes, debido a la carencia de una interconversión rápida o, más probablemente, debido a que los valores de equilibrio son o demasiado altos o demasiado bajos. Como los intermediarios, dentro de un pool metabólico, están en concentraciones cercanas al equilibrio, las reacciones pueden proceder en una u otra dirección como resultado de pequeños cambios en concentración. El flujo dentro de un pool está determinado por consideraciones termodinámicas. En cambio las reacciones que conectan los distintos pooles, se encuentran en condiciones de irreversibilidad termodinámica, por lo que su actividad es controlada por parámetros cinéticos. Estas enzimas son los puntos clave de regulación de la ruta. Gluconeogénesis La ruta de síntesis neta de glucosa a partir de piruvato utiliza prácticamente las mismas enzimas que la glucólisis. Las excepciones a esto se observan en las reacciones que conectan los pooles. En la figura 1.1, las reacciones que son exclusivas de la vía glucolítica se señalan en rojo, las exclusivas de la vía gluconeogénica, en azul y las de la ruta de síntesis de glucógeno en celeste. En cada uno de los puntos de divergencia, encontramos lo que se denominan pseudociclos. Aquí abajo vemos versiones simplificadas de dos de estos ciclos. Pi Glucógeno ADP(o UDP) Fructosa-6-P Glucógeno sintasa ATP ADP-G Fosfofructo kinasa (o UDP-G) Glucógeno Fosforilasa G1P-Uridil transferasa Glucosa-1-P Pirofosfatasa Inorgánica PPi H2O Pi 2 Pi Fructosa-1,6bisfosfatasa ADP H2O Fructosa-1,6-bisP ATP(o UTP) En cada uno de estos ciclos la reacción neta es la hidrólisis del ATP. por lo mismo, el funcionamiento continuo de estos sistemas provocaría la pérdida de la energía metabólicamente utilizable de la célula por su conversión en calor. Debido a la regulación, estos ciclos no tienen existencia real, salvo en contadas excepciones. Por ejemplo, tanto la Fosfofructokinasa como la Fructosa-1,6-bisfosfatasa son enzimas reguladas por el metabolismo celular y la regulación es tal que en el momento en que la Fosfofructokinasa se encuentra activa, la Fructosa-1,6-bisfosfatasa no y viceversa. En algunas situaciones particulares algunos animales suelen generar calor por intermedio de su metabolismo, para lo que podrían utilizar estos pseudociclos. Sin embargo el mecanismo más utilizado para la generación de calor, es el desacoplamiento inducido de los gradientes de concentración intracelulares que analizaremos más adelante en el curso. El primer pseudociclo desde el punto de vista de la gluconeogénesis es el que se encuentra entre el piruvato y el fosfoenolpiruvato (PEP) en la figura 1.1. La hidrólisis del PEP es muy exergónica (ΔGº= -15 kcal/mol, prácticamente el doble que la hidrólisis del ATP), por lo que su inversión requiere del aporte de más de una molécula de ATP como dador de energía. El piruvato es primero “cebado” por incorporación de una molécula de CO2 con gasto de un enlace fosfato de alta energía para rendir oxalacetato. Inmediatamente, el oxalacetato se convierte en PEP gracias al aporte energético de dos fuentes. Una es la liberación de la molécula de CO2 recién incorporada la cual tiene un componente entrópico muy importante ya que el producto liberado es un gas, y la otra es el consumo de otro enlace fosfato de alta energía proveniente del GTP en animales o del ATP en algunos microorganismos. O O C O C O CH2 ATP O ADP + Pi O O P C O Biotina H HCO3Piruvato Bicarbonato N O C O CH2 C O O P O P O CH2 O N O O H H H H O O NH O OH N OH GTP Oxalacetato O CO2 N O C O O C O P O CH2 NH2 O Fosfoenolpiruvato O NH O O P O P O CH2 O N O O H H H H GDP OH N NH2 OH II. Regulación de la glucólisis y gluconeogénesis La degradación de la glucosa hasta piruvato es un proceso metabólico que ocurre prácticamente en todas las células. Este proceso es, además, regulado por una variedad de mecanismos. Aquí haremos incapié en los mecanismos de control de la actividad enzimática por los controles internos de la célula, ya que son aplicables a todos los organismos. En cambio, dejaremos para más adelante en el curso la discusión de los mecanismos de regulación debidos a la actividad hormonal, ya que son una característica particular de los organismos pluricelulares. En la glucólisis la mayoría de las enzimas catalizan reacciones que se encuentran prácticamente en el equilibrio. Los KMs de estas enzimas tienen valores cercanos a la concentración celular de sus sustratos. Así, un cambio en la concentración de uno de los sustratos hace cambiar rápidamente el flujo metabólico de la reacción involucrada determinando un acercamiento al estado de equilibrio. En cambio, los KMs de las enzimas que catalizan las reacciones irreversibles (hexokinasa, fosfofructokinasa y piruvatokinasa), están alejados de la concentración celular de sus sustratos. De esta manera un cambio en la concentración de uno de los sustratos no cambia significativamente el flujo metabólico de la reacción involucrada. Sin embargo, la unión de un metabolito que cambie el valor del KM puede modificar rápidamente el flujo metabólico a través de esta reacción. En los organismos pluricelulares, las hexokinasas I, II y III, son inhibidas alostéricamente por el producto de su reacción, la glucosa-6-fosfato. La hexokinasa IV en cambio no es regulada de esta manera ya que su utilidad, como mencionamos antes, es para captar glucosa cuando en el medio externo hay un exceso momentáneo de este azúcar. En muchas bacterias la fosforilación de la glucosa se realiza en complejos enzimáticos anclados en la membrana del estilo del de la fosfotransferasa de E. coli. La actividad de estos complejos no está regulada ya que su función es incorporar la máxima cantidad de azúcar posible a la célula. La regulación en la reacción inversa de este pseudociclo, la de la enzima glucosa-6-fosfatasa, se realiza fundamentalmente por control de la síntesis de la enzima. En los mamíferos en particular, esta enzima se encuentra solamente en los órganos que son capaces de exportar glucosa al torrente circulatorio. Estos órganos son el hígado y el riñón. El hígado es el principal órgano que controla la homeostasis de la glucosa y la actividad de la glucosa-6-fosfatasa es esencial para lograr la liberación de la glucosa de la célula hepática cuendo esta escasea en el organismo. El segundo pseudociclo es el sitio principal de regulación de la glucólisis y de la gluconeogénesis. En particular, la reacción catalizada por la fosfofructokinasa. Esta enzima tiene dos tipos de metabolitos reguladores. Por un lado están los nucleótidos de adenosina cuya relación se utiliza para mantener la carga energética celular, y por el otro los productos metabólicos que se utilizan para sensar el flujo metabólico a través de una reacción en particular. En este caso, el metabolito utilizado por la mayoría de las células es el citrato. Un aumento de la concentración de citrato implica un alta tasa metabólica a través de la glucólisis hacia el ciclo de Krebs y, por lo mismo, un flujo metabólico elevado a través de esta reacción. Así, un aumento de la concentración de citrato inhibe la actividad de la fosfofructokinasa, aumentando el KM por sus sustratos. La actividad de los nucleótidos de adenosina varía con el tipo celular. El ATP es a la vez un sustrato y, en la mayoría de las especies, un inhibidor alostérico de la reacción. El ATP disminuye la afinidad de la enzima (aumentando el KM) por el sustrato fructosa-6-fosfato. Esto que podría parecer una paradoja se basa en el hecho que un alto flujo metabólico a través de esta enzima implica un alto flujo a través de la glucólisis como un todo y, por lo mismo una alta producción de ATP. En células de mamífero, el AMP es un activador alostérico de la fosfofructokinasa, que actúa liberando la inhibición provocada por el ATP. Dependiendo de la especie considerada, el ADP funciona como un activador (en mamíferos) o como un inhibidor (plantas). En microorganismos el efecto regulatorio de estos nucleótidos varía entre especies. La fructosa-1,6-bisfosfatasa es inhibida por AMP, lo que indica que la carga energética celular es muy baja y por lo mismo el organismo detiene las reacciones biosintéticas. El tercer pseudociclo también se encuentra regulado por el metabolismo. En tejidos de mamífero la enzima piruvato kinasa es activada por fructosa-1,6bisfosfato e inhibida por ATP. Además, la enzima piruvato carboxilasa, la primer enzima de la gluconeogénesis, es activada por Acetil CoA. Sin embargo esta regulación tiene más que ver con un rol alternativo de esta reacción, que también funciona en el aporte de metabolitos para el ciclo de Krebs tal como discutiremos en las próximas teorías. Destino del piruvato Destino del piruvato. • Glucosa y glucógeno • Lactato • etanol