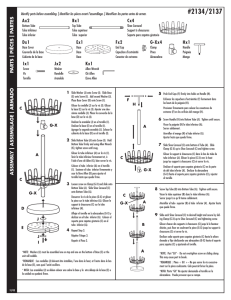
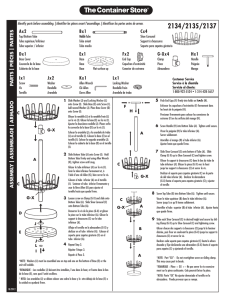
,e uq isy hP h C i ei m te ec ne ic S sal ed V ei
Anuncio

REPUBLIQUE LIBANAISE Ministère de l’Education Et de l’Enseignement Supérieur Centre de Recherche et de Développement Pédagogiques Verbes d’Action Physique, Chimie et Sciences de la Vie Définitions et Exemples 2012 Elaboré par: Coordinateur Chef du Département des Sciences au CRDP Membres de la Direction Générale de l’Education Membres du Centre de Recherche et de Développement Pédagogiques Contrôle Linguistique Chef du Département de Français au CRDP Le comité responsable de l’uniformisation de certains verbes d’action en physique, chimie et sciences de la vie. Ibtihaj Saleh Afaf El Hajj Fouad Nabhan Huguette Dagher Michel Zeitunlian Mohamad Abdelmalak Mohamad Issa Riad Dakroub Antoine Skaf Brenda Ghazale Fouad Yehya Jamila Azar Rana Abdallah Hala Fayad Avant – Propos Ce document a été conçu en vue d’unifier la définition de certains verbes d’action entre les différentes disciplines scientifiques : physique, chimie et sciences de la vie. Il comporte une liste de certains verbes d’action le plus fréquemment utilisés dans ces disciplines avec des exemples à l’appui. Cette liste n’est pas une liste exhaustive de tous les verbes d’action qui pourraient être utilisés dans la formulation des questions. Les exemples proposés donnent une idée des réponses exigées pour chacun de ces verbes. Le Comité Index Contenu Liste des verbes d’Action Page 1 Exemples de Verbes d’Action – Examen Officiel EB9 Physique 3 Chimie 15 Sciences de la Vie 29 Exemples de Verbes d’Action – Examen Officiel Troisième année du cycle secondaire Physique 49 Chimie 57 Sciences de la Vie 69 Liste de certains verbes d'action et leurs exigences 1- Analyser : Décomposer un tout en ses éléments constitutifs pour mettre en évidence les variations. 2- Calculer : Opérer sur des nombres. 3- Citer: Enoncer sans expliquer. 4- Comparer : Indiquer les ressemblances et/ou les différences entre deux ou plusieurs entités. 5- Compléter: Ajouter ce qui manque. 6- Conclure: Aboutir à une décision. 7- Déterminer: Aboutir à une décision, à un résultat, … par un raisonnement logique, par un calcul, … 8- Décrire : S’exprimer en utilisant un langage scientifique, pour donner les détails d’une observation, d’une expérience, d’un schéma, d’un appareil, … 9- Démontrer (Montrer que): Prouver qu’une chose est évidente par un raisonnement logique, par une expérience, par un calcul,… 10- Déduire : Tirer, par un raisonnement logique, une nouvelle information à partir de la donnée ou à partir d’informations existantes. 11- Dégager : Tirer d’un ensemble de données, une relation, un rôle, une loi,… sans faire un raisonnement. 12- Distinguer: Reconnaître une chose d’une autre selon des traits particuliers. 13- Expliquer: Rendre clair, faire comprendre un phénomène, un résultat, … 14- Identifier: Reconnaître une chose d’après ses caractéristiques ou ses propriétés. 15- Interpréter: Analyser et donner une signification au résultat. 16- Indiquer: Désigner quelque chose sans justifier. 17- Justifier: Prouver quelque chose comme vraie et réelle. 18- Préciser : Indiquer et justifier. 19- Relever : Extraire une ou plusieurs information(s) d’un document. 20- Vérifier: Confirmer par des arguments, par un raisonnement logique, … que quelque chose est vraie ou fausse. 1 2 EXEMPLES DE VERBES D’ACTION EXAMEN OFFICIEL - EB9 PHYSIQUE 3 4 1- Analyser : Décomposer un tout en ses éléments constitutifs pour mettre en évidence les variations. Exemple : Analyser le fonctionnement d’un tournevis-testeur l’identification des bornes d’une prise de courant. dans Réponse : Eléments constitutifs : une lampe au néon, une tête métallique et une extrémité métallique. Variations : On introduit la tête métallique dans une borne de la prise et on touche avec le pouce l’extrémité métallique (pour fermer le circuit avec la terre) : Si la lampe s’allume, la borne est la phase. Si la lampe ne s’allume pas, la borne est le neutre. 2- Calculer: Opérer sur des nombres. Exemple : un conducteur ohmique (D), de résistance R= 20Ω, est traversé par un courant d’intensité I=0,6A. Calculer la tension U aux bornes de (D). Réponse : La tension U est donnée par : U= R x I=20x0,6=12V. 3- Citer : Enoncer sans expliquer. Exemple : Citer les différents éléments du circuit électrique ci-dessous. Réponse : Le circuit électrique cicontre comporte : - un générateur (G) de tension continue et constante ; - un ampèremètre (A) ; - une lampe(L) ; - deux conducteurs ohmiques de résistances R1etR2 ; - un interrupteur (K) ; - des fils de connexion. P E K N D A R1 A L 5 C B R2 4- Comparer : Indiquer les ressemblances et les différences entre deux entités. Exemple : - Une lentille convergente (L), de distance focale f=20cm, donne d’un objet AB=5cm, A sur l’axe, une image : - A’B’ lorsque l’objet est à la distance d1=30cm de (L). (figure 1) - A’’B’’ lorsque l’objet est à la distance d2=10cm de (L). (figure 2) En se référant aux figures 1 et 2, comparer A’B’ et A’’B’’ (Nature, orientation, position et grandeur). (L) 5cm B F X’ F’ A A’ 10cm X O Figure 1 B’ (L) B’’ 5cm B X’ F’ F A’’ 10cm O Figure 2 Réponse : - A’ B’ est réelle alors que A’’B’’ est virtuelle. - A’B’ est droite par rapport à AB alors que A’’B’’ est renversée par rapport à AB. - A’B’ et A’’B’’ sont de part et d’autre par rapport à (L). - A’B’ est à 60 cm de (L) alors que A’’B’’ est à 20cm de (L). - A’B’ et A’’B’’ ont la même grandeur de 10cm. 6 X 5- Compléter : Ajouter ce qui manque Exemple : Une lentille convergente (L) donne d’un objet AB, perpendiculaire à son axe optique, A sur l’axe, une image réelle A’B’. Compléter le trajet du rayon incident BI. (L) I B F X’ X A’ A O F’ B’ Réponse : (L) I B F X’ A X A’ O F’ B’ 6- Conclure : Aboutir à une décision Exemple : On immerge un solide (S) successivement dans trois récipients contenant respectivement de l’eau, de masse volumique ρ1=1g.cm-3, de l’huile, de masse volumique ρ2=0,9 g.cm-3 et de l’alcool, de masse volumique ρ3=0,8g.cm-3. Le tableau ci-dessous montre la valeur du volume immergé de (S) dans chacun des trois liquides. liquide Masse volumique en (g.cm-3) Volume immergé en (cm3) eau ρ1 = 1 V1=500 huile ρ2= 0,9 V2= 555 alcool ρ3= 0,8 V3= 633 Conclure à propos de la variation du volume immergé de (S) en fonction de la masse volumique du liquide. Réponse : D’après le tableau ci-dessus on remarque que lorsque la masse volumique diminue le volume immergé de (S) augmente. 7 7- Déterminer : Aboutir à une décision, à un résultat, ……par un raisonnement logique, un calcul, Exemple : le circuit électrique ci-contre comporte : maintient entre ses bornes une tension UPN=12V ; - un ampèremètre (A) de résistance négligeable ; - une lampe L (6V) ; A - deux conducteurs ohmiques R1=R2=20Ω ; - un interrupteur (K) ; A - des fils de connexion. L Déterminer l’indication l’ampèremètre (A). un générateur (G) qui continue et constante P E K N D R1 C B R2 de Réponse : La loi d’additivité des tensions donne : UPN=UPA+UAB+UBC+UCD+UDN (1). Avec UPA=0V (résistance de l’ampèremètre négligeable). UAB=6V ( la lampe s’allume normalement). 𝑅1𝑋𝑅2 UBC=RexI=10I avec Re =𝑅1+𝑅2=10Ω. UCD=0 (fil de connexion). UDN=0(interrupteur fermé) 12−6 On trouve: 12=0+6+10I+0+0 => I = 10 = 0,6A. L’ampèremètre (A) indique alors 0,6A. 8- Décrire : S’exprimer en utilisant un langage scientifique, pour donner les détails d’une observation, d’une expérience, d’un schéma, d’un appareil,--- Exemple : Voir la figure ci-dessous et décrire les deux phénomènes physiques subis par le rayon incident SI lorsqu’il rencontre la surface (AB) de séparation air-verre. N S R1 i=45o i1=45o Air A Verre B I r=30o R N’ 8 Réponse : Le rayon lumineux SI rencontre la surface de séparation (AB) du système air-verre sous un angle d’incidence i=45o. Ce rayon subit : - la réfraction en traversant (AB) suivant le rayon réfracté IR sous un angle de réfraction r=30o. - la réflexion partielle suivant le rayon réfléchi IR1faisant un angle de réflexion i1=45o. 9- Démontrer (montrer que) : Prouver qu’une chose est évidente par un raisonnement logique, par une expérience, par un calcul,……… Exemple : Une lampe L (10V) est alimentée par un G.B.F qui délivre une tension sinusoïdale u. La figure ci-contre montre l’écran d’un oscilloscope qui visualise l’oscillogramme de u. La sensibilité verticale de l’oscilloscope est réglée à : Sv=5v/div. Prendre : √2=1.4. Démontrer que la lampe s’allume normalement. Réponse : Une lampe s’allume normalement si la tension efficace du G.B.F est égale à sa tension nominale. 𝑈𝑚 La tension efficace Ue= √2 14 Or Um=(5v/div)x2.8div=14V => Ue= =10V. 1.4 La tension nominale de la lampe étant de 10v, par suite (L) s’allume normalement. 10- Déduire : Tirer, par un raisonnement logique, une nouvelle information à partir de la donnée ou à partir d’informations existantes. Exemple : Le circuit électrique de la figure ci-dessous comprend, placés en série, - un générateur (G) délivrant entre ses bornes une tension contenue et constante UPN=12v ; - un ampèremètre (A) de résistance négligeable ; - une lampe (L) portant les indications (6v, 3w) ; - un conducteur ohmique (D) de résistance R ; - un interrupteur (K). On ferme (K). (L) s’allume normalement. 9 Déduire la valeur de R. G P N A K A L C R B Réponse : La loi d’additivité des tensions donne : UG=UA+UL+UR+UK 12=0+6+UR+0 Avec : UA=0, la résistance de (A) est négligeable, UK=0, l’interrupteur est fermé, UL=6v, la lampe fonctionne normalement. On trouve : UR=12-6=6V. La lampe fonctionne normalement : UL=6v et P 3w. 𝑃 3 Avec P=U.I, on obtient : I= = =0.5A. 𝑈 6 𝑈𝑅 La loi d’ohm donne : UR=R.I et R= =12Ω. 𝐼 11- Dégager : Tirer d’un ensemble de données, une relation, un rôle, un loi,... Exemple : Soit (R) un ressort de longueur à vide Lo=10cm. Soumis à une certaine force, sa longueur devient L lorsque la valeur de sa tension est T. Le tableau ci-dessous donne certaines valeurs de T et les valeurs correspondantes de L. T (N) L (m) 2 0,14 En comparant le rapport Réponse : 𝑇 𝐿−𝐿𝑜 = 𝑇 𝐿−𝐿𝑜 = 0,22−0,10=0,12 =50N/m. 𝑇 = 4 4 = 0,18−0,10 0,08 6 6 0,22 , dégager une relation entre T, L et Lo. 𝑇 𝐿−𝐿𝑜 𝑇 𝐿−𝐿𝑜 2 2 = 0,14−0,10 0,04 4 0,18 =50N/m. =50N/m. 6 On trouve : 𝐿−𝐿𝑜 = 50N/m. 10 12- Distinguer : Reconnaître une chose d’une autre selon des traits particuliers. Exemple : Distinguer une lentille convergente d’une autre divergente. Réponse : On éclaire la lentille par un faisceau lumineux cylindrique. Si le faisceau émergent correspondant est : - Convergent, la lentille est convergente. - Divergent, la lentille est divergente. 13- Expliquer: Rendre clair ; faire comprendre un phénomène, un résultat,… Exemple : Le circuit ci-contre comporte, placés en série : - un générateur (G) de L tension continue et R A constante UPN=12V ; B C - un ampèremètre (A) de résistance négligeable ; - un conducteur ohmique E K A (D) de résistance R=10Ω ; - une lampe (L) portant P l’indication 6V ; N G - et un interrupteur (K). On ferme (K). L’ampèremètre indique 0,6A et (L) s’allume normalement. Expliquer pourquoi la lampe (L) s’allume normalement. Réponse :Tension aux bornes de la lampe. La loi d’additivité des tensions s’écrit: UPN = UA+UD +UL+UK. Avec : UA= 0V, la résistance de (A) étant négligeable, Uk= 0V, l’interrupteur est fermé, et UR= RI (d’après la loi d’Ohm), on trouve : UPN = 0+ RI+ UL + 0 12 = 10x 0,6 + UL UL = 12-6= 6V. Comme la tension aux bornes de la lampe est égale à sa tension nominale ,donc la lampe s’allume normalement. 14- Identifier : Reconnaître une chose d’après ses caractéristiques ou ses propriétés. Exemple : On immerge un solide (S), de masse M=400g, dans un liquide (L) de masse volumique ρ. (S) flotte à la surface du liquide et à l’équilibre, le volume immergé de (S) est Vi=500 cm3. Le tableau ci-dessous donne la masse volumique de quelques liquides. liquide 3 Masse volumique (g.cm ) alcool 0.8 hui l e 0.9 eau 1 En se basant sur le tableau ci-dessous, identifier (L). 11 eau salée 1.02 Réponse : Le solide (S) est soumis à deux forces : son poids 𝑃�⃗ et la poussée d’Archimède ���⃗ 𝐹 . A l’équilibre de (S) : 𝑀 400 � ⃗ �⃗ ���⃗ 𝑃 + 𝐹 = 0 =>P=F =>Mg=ρVig =>M=ρVi donc ρ= = =0.8g.cm-3. 𝑉𝑖 500 En se référant au tableau ci-dessus et comme la masse volumique du liquide est 0.8g.cm-3, (L) est alors l’alcool. 15- Interpréter : Analyser et donner une signification au résultat. Exemple : On considère un récipient contenant une certaine quantité d’eau de masse volumique ρ=1g.cm-3. On immerge, complètement dans le récipient, un solide (S) de masse M=600g et de volume 800cm3.Quand on lâche (S), on remarque qu’il monte à la surface de l’eau. Interpréter. ( prendre g = 10 N / kg ) Réponse : Le solide (S) est soumis à deux forces : son poids 𝑃�⃗ et la poussée d’Archimède ���⃗ 𝐹. �⃗ La valeur du poids 𝑃 est : P=M x g= 0.6 x 10= 6N. La valeur de la poussée d’Archimède est : F=ρ x Vi x g =1000 x 0.0008 x 10=8N. (Vi=VS=0.0008m3 car le solide est complètement immergé dans l’eau). Comme F >P, par suite le solide monte à la surface de l’eau et émerge du liquide. Ainsi Vi diminue par suite F diminue jusqu’à F=P et le solide flotte à la surface du liquide. F W 16- Indiquer: Désigner quelque chose sans justifier. Exemple : Indiquer, dans le circuit cicontre, le sens du courant électrique i. Réponse : Le sens de i, à l’extérieur de (G), est de la borne positive P vers la borne négative N. A A P D L B C E G K N 17- Justifier : Prouver quelque chose comme vrai et réel. Exemple : Justifier que la résistance d’une lampe n’est pas un conducteur ohmique Réponse : Les caractéristiques (I,U) d’une lampe n’est pas une droite passant par l’origine, alors la résistance d’une lampe n’est pas un conducteur ohmique. 12 18- Préciser : Indiquer et justifier Exemple : La figure ci-dessous montre une lentille convergente (L), de distance focale f=10cm, son axe optique x’ x, son centre optique O et deux points A et B. Préciser la position du foyer objet de (L). (L) Sens de la lumière lumie X’ 5cm A X B O Réponse : A est la position du foyer objet de (L) car dans le cas d’une lentille convergente, le foyer objet est un point de l’axe optique du côté de la lumière incidente et à la distance f=10cm de son centre optique O. Or la distance OA=2divx5cm/div=10cm. Donc , A est la position du foyer objet de (L). 19- Relever: Extraire une ou plusieurs informations d’un document. Exemple : La figure 1 montre l’oscillogramme d’une tension sinusoïdale u. En se référant à la figure 1, relever les caractéristiques de u. 5V 5ms Figure 1 Réponse : D’après la figure 1, les caractéristiques de u sont : La tension maximale : Um=Svxy= 5V/divx2,8div=14V. 𝑈𝑚 14 La tension efficace : Ue= = =10V. √2 1,4 La période : T=Sh×x=5ms/div×5div=25ms. 1 1 La fréquence : f= = =40Hz. 𝑇 0,025 13 20- Vérifier: Confirmer par des arguments, par raisonnement logique que quelque chose est vrai ou faux. Exemple : - Le circuit ci-contre comporte : - un générateur (G) de tension continue UPN=12V ; - un ampèremètre (A) de résistance négligeable ; - une lampe (L) de tension nominale 6V ; - un conducteur ohmique (D) de résistance R=10Ω ; - un interrupteur (K). On ferme (K). L’ampèremètre indique 0,3A. Vérifier que la lampe risque d’être grillée. (L) B A (D) A E P (G ) K N C Réponse : La loi d’additivité des tensions s’écrit : UPN= UPA+ UAB+ UBC+ UCN Avec : UPA= 0V (ampèremètre de résistance négligeable), UBC = RxI=10x0,3=3V(loi d’ohm), UCN = 0V (interrupteur fermé), on trouve : 12=0+UAB+3+0 UAB=9V. La tension aux bornes de la lampe est supérieure à sa tension nominale, la lampe risque alors d’être grillée. 14 EXEMPLES DE VERBES D’ACTION EXAMEN OFFICIEL - EB9 CHIMIE 15 16 1- Analyser: Décomposer un tout en ses éléments constitutifs pour mettre en évidence les variations. Exemple : L’effet de serre est associé à l’augmentation de la quantité de dioxyde de carbone dans l’air. La courbe ci- dessous montre la variation de la quantité du dioxyde de carbone en ppm entre les années 1975 et1991. Analyser cette courbe. Réponse : La quantité du dioxyde de carbone est 320 ppm en 1975. La courbe est croissante et la quantité du dioxyde de carbone augmente dans deux années de 2ppm, et devient 322ppm en 1977, mais après 2 autres années, elle augmente 4 ppm et devient 326ppm en année 1979. Cette variation est répétée dans les intervalles de quatre ans, de 1979 à 1983, de 1983 à 1987et de 1987 à 1991 et devient 344 ppm dans l’année 1991. 17 2- Calculer : Opérer sur des nombres. Exemple : L'élément chlore existe dans la nature sous forme de mélange d’isotopes. La figure ci-dessous montre la représentation des isotopes du chlore et leurs pourcentages (%) d’abondance relative exprimés comme X % et Y %. Calculer en se référant à la figure, le % d'abondance relative de l’isotope Réponse : Le % d’abondance relative de % 3177 Cl X% 90 u 100 360 37 17 37 17 Cl. Cl est : 25% 3- Citer: Enoncer sans expliquer. Exemple : La corrosion des tuyaux et des réservoirs métalliques sous terrains peut être considérablement empêchée en reliant les tuyaux ou les réservoirs à un métal plus actif tel que le zinc ou le magnésium Citer comment la corrosion des réservoirs de stockage sous terrains en fer peut être empêchée. Réponse : La corrosion des réservoirs de stockage sous terrains en fer peut être empêchée en les reliant à un métal plus actif tel que le zinc. 18 4- Comparer : Indiquer les ressemblances et/ou plusieurs entités. les différences entre deux ou Exemple 1 : Le graphe donné ci-dessous montre la variation de la quantité de NO2 dans l’air en 103 tonnes entre les années1950 et 2005. Comparer la quantité de dioxyde d’azote dégagée dans l’air en1970 à celle de NO2 dégagée en 2005. Réponse : Exemple 2: On donne ci-dessous deux schémas (I) et (II) d’une pile électrochimique zinc-cuivre. La quantité du dioxyde d’azote dégagée dans l’air en 1970 est : 250x103 tonnes. La quantité du dioxyde d’azote dégagée dans l’air en l’année 2005 est : 150x103 tonnes. La quantité du dioxyde d’azote dégagée en 1970 > de celle dégagée en 2005. Comparer ces deux schémas donnés. 19 Réponse : Les schémas (I) et (II) représentent une demi-pile de zinc et une demi-pile de cuivre reliées par un pont salin. La partie extérieure de chaque pile renferme une lampe et un interrupteur en série. Dans le schéma (I), l’interrupteur est ouvert, la lampe est éteinte. Dans le schéma (II), l’interrupteur est fermé, la lampe est allumée. La partie immergée de la lame de zinc du schéma (II) est plus mince que celle du schéma (I), et la partie de la lame de cuivre immergée dans le schéma ((II) est plus épaisse que celle immergée dans le schéma (I). Dans le schéma (I), la couleur de la solution contenant les ions Cu2+ est plus intense que celle du schéma (II). 5- Compléter: Ajouter ce qui manque. Exemple : Les histogrammes ci-dessous montrent les constituants du noyau de chacun des atomes de fluor, de sodium et de néon. Compléter le tableau ci-dessous : Numéro atomique Nombre de masse Nombres d’électrons Atomes Numéro atomique Nombre de masse Nombres d’électrons Fluor (F) 9 19 9 Sodium ( Na) 11 23 11 Atomes Fluor (F) Sodium ( Na) Réponse : 20 6- Conclure: Aboutir à une décision. Exemple : Alcanes La température d’ébullition normale et le nom selon IUPCA des alcanes à chaîne linéaire sont indiqués dans le tableau ci-dessous: éthane propane butane pentane hexane octane Température d’ébullition normale (oC) -89 -42 0 36 69 126 Indiquer en se référant au tableau, la variation de la température d’ébullition normale de ces alcanes selon le nombre d’atomes de carbone dans leur molécule. Conclure. Réponse : La température d’ébullition normale de ces alcanes augmente de (-89oC) pour l’éthane à (126oC) pour l’octane. On peut conclure que la température d’ébullition des alcanes à chaîne linéaire s’élève avec l’augmentation du nombre d’atomes de carbone dans leurs molécules. 7- Déterminer : Aboutir à une décision, à un résultat, … par un raisonnement logique, par un calcul … Exemple : À la raffinerie, le craquage de l'heptane donne un alcane (A) de formule moléculaire C4 H10 et un hydrocarbure (B) de formule moléculaire CXHY selon l'équation: C7 H16 o C4 H10 + CXHY Déterminer la formule moléculaire de (B). Réponse : D’après la loi de conservation de masse, le nombre d’atomes de chaque élément est conservé dans une réaction chimique. Pour l’élément C : 7 = 4 + x x = 3 et pour l’élément H : 16 = 10 + y y = 6 D’où la formule de B est C3H6. 8- Décrire : S’exprimer en utilisant un langage scientifique, pour donner les détails d’une observation, d’une expérience, d’un schéma, d’un appareil… Exemple : Matériel disponible : - Lames de cuivre, de magnésium Solution contenant des ions de cuivre (II) (Cu2+) Solution contenant des ions de magnésium (Mg2+) - Deux béchers Pont salin en U Fils de connexion Un voltmètre Décrire la construction de la pile électrochimique schématisée ci-dessous : 21 Réponse : 1- Dans un bécher on verse une quantité de la solution contenant les ions Mg2+ et on y plonge la lame de magnésium Mg. 2- Dans l’autre bécher on verse une quantité de la solution contenant les ions Cu2+ et on y plonge la lame de cuivre Cu. 3- On relie les deux solutions par un pont salin. 4- On relie les deux lames de Mg et de Cu au moyen des fils de connexion en intercalant le voltmètre. 9- Démontrer (Montrer que): Prouver qu’une chose est raisonnement logique, par une expérience, par un calcul,… évidente par un Exemple 1 : La température d'ébullition normale d'un alcane, à chaîne linéaire dépend du nombre d'atomes de carbone dans sa molécule. 22 Montrer, en se référant au texte et au schéma, que la température d’ébullition normale du pentane (C5H12) est entre 0 oC et 70 oC. Réponse : Exemple 2 : Le noyau de sodium a une charge relative égale à +11 (La charge relative du proton = +1) La molécule de pentane comporte 5 atomes de carbone à chaîne linéaire, sa chaîne carbonée est plus longue que celle de la molécule de butane et plus courte que celle de la molécule d’hexane. La température d'ébullition normale du pentane est entre 0 oC et 70 oC. Montrer que le numéro atomique du sodium est 11. Réponse : La charge relative du noyau est Qn = (+1)Z, où Z est le nombre de protons dans le noyau. +11 = (+1)Z⇒Z = 11 Numéro atomique = nombre de protons dans le noyau ⇒ le numéro atomique du sodium est 11. 10- Déduire: Tirer par un raisonnement logique une nouvelle information à partir d’informations existantes. Exemple : Au laboratoire, le dioxygène peut être obtenu par électrolyse de l'eau, additionnée d’une faible quantité d’acide sulfurique. Les électrodes utilisées sont inattaquables. La demi-équation électronique à l’anode est : 2H2O → 4H+ + O2 + 4 e(I) La demi-équation électronique à la cathode est : 2H+ +2 e- → H2 ( II ) Déduire l’équation-bilan de cette électrolyse. Réponse : Le nombre d’électrons perdus à l’anode doit être égal au nombre d’électrons gagnés à la cathode. La demi-équation électronique à l’anode est : 2H2O → 4H+ + O2 + 4e- On multiplie la demi-équation (II) par 2 La demi-équation électronique à la cathode est : On additionne les deux demi-équations. L’équation-bilan de la réaction est : 23 4H++4e- → 2H2 2H2O → 2 H2 + O2 11- Dégager : Tirer d’un ensemble de données, une relation, un rôle, une loi...sans faire un raisonnement. Exemple : Le tableau donné ci-après montre le s noms systématiques(IUPAC) de trois alcanes et leurs températures d'ébullition normales. Alcane Température d’ébullition normale oC Pentane 2-méthylbutane 2,2-diméthylpropane 36 28 10 Dégager une relation entre la variation de la température d’ébullition normale et le nombre de ramifications dans les molécules des isomères mentionnés. Réponse : La température d’ébullition normale des molécules des isomères diminue lorsque le nombre de ramifications augmente dans la molécule des isomères. 12- Distinguer : Reconnaître une chose d’une autre selon des traits particuliers. Exemple : L’addition du dihydrogène à un alcène produit un alcane. Distinguer la structure moléculaire d’un alcène de celle d’un alcane. Réponse : Dans la structure moléculaire d’un alcène, il existe une liaison covalente double entre deux atomes de carbone consécutifs. Dans la structure moléculaire d’un alcane, toutes les liaisons carbone-carbone sont simples. 13- Expliquer: Rendre clair, faire comprendre un phénomène, un résultat… Exemple : Une molécule d’éthène réagit avec une molécule de dichlore ; un composé (D) est formé. Expliquer laquelle des deux formules développées suivante (I) ou (II) peut être associée au composé (D). 24 Réponse : L’éthène est un alcène de formule C2H4. Il fait une réaction d'addition avec le dichlore. Un doublet de la double liaison de la molécule C2H4 et la liaison de la molécule de dichlore sont brisés. Un atome de chlore est additionné à chaque atome de carbone. La formule (I) peut être associée au composé (D). 14- Identifier : Reconnaître une chose d’après ses caractéristiques ou ses propriétés. Exemple : 1 H: K1 ; Configurations électroniques de : 6C: K2, L4; 7N: K2, L5; 8 O: K2, L6 et 16S: K 2 , L8, M6 Identifier parmi les éléments donnés (H, C, N, O et S), ceux qui appartiennent à la même période (ligne) et ceux qui appartiennent au même groupe (colonne). Réponse : Les éléments qui appartiennent à la même période (ligne) sont : C, N et O, car leurs électrons occupent le même nombre de niveaux d’énergie. Les éléments qui appartiennent au même groupe (colonne) sont : O et S ,car ils ont le même nombre d’électrons périphériques (électrons de valence). 15- Interpréter: Analyser et donner une signification au résultat. Exemple : Le graphique donné ci-dessous, montre la quantité moyenne du dioxyde de soufre gazeux SO2 émis dans l'air par la combustion des carburants contenant le soufre comme impureté. Le gaz SO2 contribue à la formation de pluies acides. Le niveau tolérable maximal de SO2 dans l’air est 75(P g/m3). 25 Interpréter la contribution de la quantité moyenne du dioxyde de soufre gazeux SO2 émis durant les mois cités dans le graphique sur la formation de pluie acide. Réponse : La quantité moyenne de SO2 dans l’air : en Juin est 19 (P g/m3), en Juillet est 60 (P g/m3) et en septembre est70 (P g/m3). La contribution de SO2 sur la formation de pluie acide est faible car la quantité moyenne de SO2 dans l’air n’a pas dépassé le niveau tolérable maximal 75 (P g/m3 ). La quantité moyenne de SO2 dans l’air : en Aout est 80 (P g/m3), en Octobre est100 (P g/m3), en Novembre est115 (P g/m3) et en Décembre est140 (P g/m3).Durant ces mois l'émission du dioxyde de soufre a dépassé le niveau tolérable maximal 75 (P g/m3). La contribution de SO2 sur la formation de pluie acide est forte. 16- Indiquer: Désigner quelque chose sans justifier. Exemple : La structure de Lewis de la molécule du composé organique (A) est donnée dans la figure -1. Indiquer le type de liaison entre l'atome d'azote et chacun des atomes de carbone dans la molécule du composé (A). Réponse : La liaison Azote – Carbone (C1-N) est une liaison covalente simple. (N - C) La liaison Azote – Carbone (C2=N) est une liaison covalente double. (N ═ C) 17- Justifier : Prouver quelque chose comme vrai et réel. Exemple : CH3-H Les halogénométhanes sont des composés utilisés comme réfrigérants, solvants, anesthésiques… Ils sont obtenus à partir de la réaction du méthane avec les dihalogènes selon l’équation: + X2 Lumière CH3-X + HX Où X2 est la formule d'une molécule de dihalogène comme Cl2 ou Br2. Justifier que la réaction, représentée par l’équation ci-dessus, est une réaction de substitution. 26 Réponse : C’est une réaction de substitution, car un atome d’hydrogène du méthane est remplacé par un atome d’un halogène. 18- Préciser : Indiquer et justifier. Exemple : Les tendances à perdre des électrons des trois métaux: argent, cuivre et zinc sont classées dans un ordre croissant sur un axe horizontal. Ag | Cu | Zn | Ordre croissant de la tendance à perdre des électrons. Dans une pile électrochimique, plus la différence de la tendance à perdre des électrons des métaux servant comme électrodes est grande, plus la tension (voltage) de la pile électrochimique est grande. Deux piles électrochimiques(G1) et (G2) ont les représentations schématiques suivantes : a) Zn | Zn2+ ― pont salin ― Cu2+| Cu b) Zn | Zn2+ ― pont salin ― Ag+ | Ag Préciser, parmi ces représentations schématiques, celle qui peut être associée à la pile électrochimique ayant la tension la plus grande. Réponse : La représentation schématique de la pile ayant la tension la plus grande est: Zn | Zn2+ ― pont salin ― Ag+ | Ag car la différence de la tendance à perdre des électrons entre Zn et Ag est plus grande que celle entre le Zn et Cu. 19- Relever : Extraire une ou plusieurs information(s) d’un document. Exemple : Les fruits et les légumes frais ont diverses couleurs, goûts et odeurs. Ils sont très importants pour notre santé. Le persil contient la vitamine C, le carotène, le potassium, le calcium... . Le chou rouge contient plus de vitamine C que l'orange. Le chou rouge est riche en composés qui contiennent l’élément soufre. Relever les noms des trois éléments chimiques mentionnés dans le texte. Réponse : Les noms des trois éléments chimiques mentionnés dans le texte sont : potassium, calcium et soufre. 27 20- Vérifier : Confirmer par des arguments, par un raisonnement logique quelque « chose » est vrai ou faux. Exemple : que Les graphes (1) et (2) montrent le nombre d'atomes de carbone et d'hydrogène dans les molécules de (A) et (B). Graphe (1) Graphe (2) Vérifier, en se référant aux graphes (1) et (2) si la formule moléculaire de (A) est C2H4 et si celle de (B) est C4H8. Réponse : Pour (A) : graphe (1)� nombre d'atomes de C = 2 ; graphe (2) � nombre d'atomes d'H = 4 La formule moléculaire de (A) est : C2H4. Pour (B) : graphe (1) � nombre d'atomes de C = 4 ; graphe (2) � nombre d'atomes d’H = 10 La formule moléculaire de (B) n’est pas C4H8 28 EXEMPLES DE VERBES D’ACTION EXAMEN OFFICIEL - EB9 SCIENCES DE LA VIE 29 30 1- Analyser: Décomposer un tout en ses éléments constitutifs pour mettre en évidence les variations. Exemple 1 : Au niveau des alvéoles pulmonaires, l'hémoglobine (Hb) des globules rouges du sang fixe le dioxygène (O2) en formant un produit instable : l'oxyhémoglobine (HbO2). En présence du monoxyde de carbone (CO), gaz nocif contenu dans la fumée de tabac, l'hémoglobine fixe le CO en formant un produit stable le HbCO. Des études ont été faites pour montrer l'effet du monoxyde de carbone sur le transport du dioxygène par l’hémoglobine. Les résultats de ces études figurent dans le tableau ci-dessous. Taux de CO dans les alvéoles (en %) 0, 5 1 1,5 2 2,5 Taux de HbO2 dans le sang (en %) 90 80 70 60 50 Analyser les résultats obtenus. Réponse : Exemple 2 : On place dans trois tubes à essai A, B et C une même quantité (100g) d’empois d’amidon. On ajoute une trypsine au tube A, une lipase au tube B, et une amylase au tube C. Ces trois tubes sont placés dans un bainmarie à une température de 37oC pendant 20 minutes. Dans ces tubes, les milieux sont convenables : Les tubes A et B ont un pH =8 et le tube C a un pH= 7. Les résultats figurent dans le document cicontre. Le taux de HbO2 dans le sang est 90% quand le taux de CO dans les alvéoles est 0,5%. Ce taux de HbO2 diminue et atteint 50% avec l'augmentation de celui de CO jusqu’à 2,5%. Analyser les résultats obtenus. 31 Réponse : La quantité d’empois d’amidon est restée constante et égale à 100g tout au long de l’expérience, dans le tube A contenant la trypsine et dans le tube B, contenant la lipase. Par contre, dans le tube C contenant une amylase, cette quantité a diminué de 100g pour devenir presque nulle, après 20min. 2- Calculer : Opérer sur des nombres. Exemple 1 : Un épi de maïs présente à maturité 225 grains noirs et 75 grains jaunes. Calculer les proportions des grains obtenus. Réponse : Ou Calcul des proportions : Nombre total des grains= 225 + 75= 300 Proportions des maïs à grains noirs : 225 / 300 = ¾ Proportions des maïs à grains jaunes : 75 /300= ¼ On divise par le nombre le plus petit. Maïs à grains noirs 225 / 75 = 3 ; Maïs à grains jaunes 75 /75 = 1 Total= 3 + 1 = 4 → proportions des maïs à grains noirs est ¾ et proportions des maïs à grains jaunes est ¼ . Exemple 2 : Un épi de maïs présente à maturité 225 grains noirs et 75 grains jaunes. Calculer les pourcentages des grains obtenus. Réponse : Calcul des pourcentages : Total des grains = 225 +75= 300 Pourcentages des grains noirs : 225 x 100 = 75% 300 Pourcentages des grains jaunes : 75 x 100 = 25% 300 3- Citer: Enoncer sans expliquer. Exemple 1 : Citer les caractéristiques de la surface d’échanges respiratoires. Réponse : Exemple 2 : Citer deux facteurs capables d’arrêter la transformation d’un aliment déterminé lors de la digestion. Réponse : Les caractéristiques de la surface d’échanges respiratoires sont : - paroi mince - grande surface d’échanges - surface riche en vaisseaux sanguins. La température, le pH du milieu, la durée, l’enzyme. (Il faut en citer deux) 32 4- Comparer : Indiquer les ressemblances et/ou plusieurs entités. les différences entre deux ou Exemple 1 : Les chromosomes sont le support de l'information génétique. Tout changement du nombre ou de la forme du chromosome entraîne une modification de l'expression du programme génétique. Le fragment "S" localisé uniquement sur le chromosome Y porte l’information génétique responsable de l’apparition du caractère masculin. Le document ci-dessus représente les chromosomes sexuels de trois individus. Comparer les chromosomes sexuels de l'individu 3 à ceux de l’individu 2. Réponse : Exemple 2 : Les gaz respiratoires se déplacent entre l’air alvéolaire et le sang, du milieu où leur pression est forte vers le milieu où leur pression est faible. Le tableau ci-contre représente les pressions respectives du dioxygène et du dioxyde de carbone dans l’air alvéolaire et dans le sang. L’individu 3 a un de ses chromosomes X de même taille que celui du chromosome X de l’individu 2. Alors que l’autre chromosome X chez l’individu 3 est plus long ( il porte en plus un fragment S) que celui de l’individu 2. Pression d’O2 (en mm d’Hg) Air alvéolaire 105 Sang 45 Pression de CO2 (en mm d’Hg) 40 45 Comparer les pressions d’O2 et de CO2 dans l’air alvéolaire à celles dans le sang. Réponse : La pression d’O2 dans l’air alvéolaire, 105mm d’Hg, est plus grande que celle dans le sang, 45mm d’Hg. Alors que la pression de CO2 dans l’air alvéolaire, 40mm d’Hg, est plus petite que celle dans le sang, 45mm d’Hg. 33 5- Compléter: Ajouter ce qui manque. Exemple : Le document ci-contre représente deux phases du cycle cellulaire d’une cellule à 4 chromosomes. Compléter le schéma en dessinant les chromosomes obtenus dans chacune de ces cellules-filles. Réponse : 6- Conclure: Aboutir à une décision. Exemple 1 : Dans une région polluée par le dioxyde de soufre (SO2), on a constaté que le nombre de malades hospitalisés pour des difficultés respiratoires varie avec la teneur de l'air en SO2 , document 1. 1- Analyser le graphe du document 1. 2- Que peut-on en conclure? 34 Réponses : Exemple 2 : Le document ci-dessous présente les variations des volumes du dioxygène et du dioxyde de carbone dans le sang au niveau des poumons. Sang (100 mL) entrant dans sortant des les poumons poumons Dioxygène 15 20 (en mL) Dioxyde de carbone 53 48 (en mL) 1- Le nombre de malades hospitalisés pour difficultés respiratoires par jour est 106 pour une teneur en SO2 de 2 mg/m3. Ce nombre augmente progressivement avec l'augmentation de la teneur en SO2 et atteint 112 malades par jour pour une teneur en SO2 de 14 mg/m3. 2- Le SO2 favorise les difficultés respiratoires. 1- Comparer les volumes du dioxygène et du dioxyde de carbone dans le sang à son entrée et à sa sortie des poumons. 2- Que peut-on en conclure? Réponses : 1- Le volume du dioxygène 15mL/100mL dans le sang entrant dans les poumons est plus petit que celui dans le sang sortant des poumons, 20 mL/100mL. Le volume du dioxyde de carbone 53mL/100mL dans le sang entrant dans les poumons est plus grand que celui dans le sang sortant des poumons, 48mL/100mL. 2- Au niveau des poumons, le sang s’enrichit en dioxygène et s’appauvrit en dioxyde de carbone. 7- Déterminer : Aboutir à une décision, à un résultat, … par un raisonnement logique, par un calcul, … Exemple 1 : La thalassémie ou anémie méditerranéenne est une maladie récessive qui affecte les enfants dès la naissance et provoque la mort si elle n’est pas traitée. Certaines personnes hétérozygotes, porteuses de l’allèle récessif, ne présentent aucun symptôme de la maladie, mais on peut les identifier par un examen de sang. Déterminer les pourcentages phénotypiques et génotypiques des enfants d’un couple hétérozygote. Réponse : Soit T le symbole de l’allèle normal dominant. Soit t le symbole de l’allèle récessif déterminant la maladie. 35 Les parents étant hétérozygotes (Tt), alors chacun d’eux porte l’allèle (t) récessif de la maladie à l’état masqué. Les pourcentages phénotypiques et génotypiques, dans ce cas, seront les mêmes que ceux de la génération F2 d’un monohybridisme à dominance. Alors les enfants de ce couple auront théoriquement comme phénotypes et génotypes : Phénotypes : 75% Enfants sains Génotypes: 25% TT 50% Tt 25% tt 25% Enfants malade Ou Analyse factorielle Soit T le symbole de l’allèle dominant normal (sain). Soit t le symbole de l’allèle récessif déterminant la maladie. Phénotypes des Parents : Génotypes des Parents : γP : ♂ [T] ♂ Tt 50%T 50% t x x ♀ [T] ♀ Tt 50%T 50% t Echiquier de croisement : ♂ 50%T 50%t 50%T 25%TT 25%Tt 50%t 25%Tt 25%tt ♀ Génotypes 25% TT 25% tt 50% Tt Phénotypes 75% Enfants sains ou [T] 25% Enfants thalassémiques [t] Exemple 2 : Les groupes sanguins du système ABO sont commandés par un gène situé sur la paire chromosomique no9. Ce gène possède 3 allèles A, B et O. Les allèles A et B sont codominants entre eux et dominants par rapport à l’allèle O. L’allèle O étant récessif ne s’exprime qu’à l’état homozygote. Un couple a trois enfants : Ziad est de groupe sanguin O, Zeina, de groupe AB et Nada, de groupe sanguin B. Déterminer les allèles présents chez chacun des parents ainsi que leur groupe sanguin. 36 Réponse : Ce couple a eu un enfant (Ziad) de groupe sanguin O qui ne s’exprime qu’à l’état homozygote. Alors, cet enfant a pris un allèle O de son père et un allèle O de sa mère. Cela nous permet de dire que chacun des parents possède l’allèle O. De même, ce couple a eu un autre enfant (Zeina) de groupe AB. Cet enfant a pris un allèle A de l’un de ses parents et un allèle B de l’autre parent. Alors, un des parents possède les allèles A et O et il est de groupe sanguin A et l’autre parent possède les allèles B et O et il est de groupe sanguin B. 8- Décrire : S’exprimer en utilisant un langage scientifique, pour donner les détails d’une observation, d’une expérience, d’un schéma, d’un appareil, … Exemple 1 : Décrire l’activité cardiaque durant les deux phases mentionnées dans le document ci-dessous. Réponse : La systole auriculaire: une contraction simultanée des deux oreillettes propulse le sang de l’oreillette droite vers le ventricule droit à travers la valvule tricuspide ouverte et de l’oreillette gauche vers le ventricule gauche à travers la valvule bicuspide ouverte. Durant cette phase, les valvules sigmoïdes sont fermées. La systole ventriculaire: une contraction simultanée des deux ventricules propulse le sang du ventricule droit dans l’artère pulmonaire et du ventricule gauche dans l’artère aorte, à travers les valvules sigmoïdes ouvertes. Durant cette phase, les valvules bicuspide et tricuspide sont fermées. 37 Exemple 2 : Le document cicontre résume les conditions expérimentales de la digestion in vitro de l’empois d’amidon. Décrire cette expérience. Réponse : On met 2mL d’empois d’amidon dans chacun des deux tubes A et B. On ajoute au tube A de la salive fraîche et au tube B, du suc gastrique. On place les deux tubes dans un bain-marie à une température de 37oC, pendant 15 minutes. 9- Démontrer (Montrer que): Prouver qu’une chose est raisonnement logique, par une expérience, par un calcul,… évidente par un Exemple 1 : Le tableau ci-dessous résume le montage expérimental d’une série d’expériences réalisées au laboratoire. Tous ces tubes qui ont un pH=8, sont placés à une température favorable de 37oC, et pour une durée suffisante : 60 minutes pour les protéines et 20 minutes pour l’empois d’amidon. Tube A Tube B Tube C Tube D Contenu au début de l’expérience Protéines Eau Trypsine Protéines Eau Amylase Contenu en d’expérience Acides aminés Eau Trypsine Empois d’amidon Eau Amylase Maltose Eau Amylase Empois d’amidon Eau Trypsine Empois d’amidon Eau Trypsine f in Protéines Eau Amylase Démontrer que l’enzyme reste intacte durant la transformation chimique des aliments. Réponse : En fin d’expérience, on constate qu’une transformation a eu lieu dans les tubes A et B puisque les protéines et l’empois d’amidon ont disparu et ont été remplacés respectivement par des acides aminés et du maltose. Mais, on retrouve qu’on a toujours dans le tube A, de la trypsine et dans le tube B, de l’amylase. Alors, on peut dire que l’enzyme reste intacte en fin d’expérience. 38 l’espèce Exemple 2 : Dans humaine, le caractère droitier ou gaucher se transmet selon le mode autosomal. Le gène responsable de cette hérédité se présente en deux allèles. L’allèle droitier D est dominant par rapport à l’allèle gaucher g. Le pedigree ci-dessus représente l’arbre généalogique d’une famille dont certains membres sont gauchers. Démontrer que si la fille 9 se marie avec un homme droitier homozygote, tous ses enfants seront droitiers. Réponse : La fille 9 est gauchère. Ce phénotype est récessif et la récessivité est un critère de pureté. Alors, cette fille ne peut avoir pour génotype que gg et ne peut donner que l’allèle g à ses enfants. Si cette fille se marie avec un homme droitier homozygote de génotype DD, cet homme ne peut donner que l’allèle, dominant D, à ses enfants. Et, dans ce cas l’allèle g de la mère sera masqué par l’allèle D du père. Donc, tous les enfants seront droitiers de génotype Dg. 10- Déduire : Tirer, par un raisonnement logique, une nouvelle information à partir de la donnée ou à partir d’informations existantes. Exemple 1 : Dans une série de cinq tubes à essai, on introduit dans chaque tube 2g d’ovalbumine coagulée et hachée (protéine), de la pepsine et de l’acide chlorhydrique. On place ces tubes à des températures différentes. Après une heure, on dose la quantité d’ovalbumine dans chacun de ces tubes. Les résultats figurent dans le document ci-dessous. Tube Contenu Température (en oC) A B C D E 2g d’ovalbumine + pepsine + HCl 2g d’ovalbumine + pepsine + HCl 2g d’ovalbumine + pepsine + HCl 2g d’ovalbumine + pepsine + HCl 2g d’ovalbumine + pepsine+ HCl 0 20 37 45 60 Quantité d’ovalbumine (en g) 2 1,7 0 1,7 2 Déduire la température favorable à l’activité de la pepsine. 39 Réponse : Exemple 2 : Le document ci-dessous présente les variations des volumes du dioxygène et du dioxyde de carbone dans l’air et dans le sang au niveau des poumons. Les résultats, en fin d’expérience, révèlent qu’une transformation totale de l’ovalbumine a eu lieu, uniquement, dans le tube C où la température est 37oC. Donc, 37oC est la température la plus favorable à l’activité de la pepsine. Air (100mL) Inspiré Dioxygène (en mL) Dioxyde de carbone (en mL) Expiré Sang (100mL) Entrant dans les poumons Sortant des poumons 21 16 15 20 0,03 5 53 48 1-Calculer les variations des volumes du dioxygène et du dioxyde de carbone dans l’air et dans le sang. 2- Que peut-on déduire quant au devenir des gaz échangés ? Réponses : 1- Variations du volume d’O2 entre l’air inspiré et l’air 21-16 = 5 mL Variations du volume de CO2 entre l’air inspiré expiré : 5-0,03 ≈ 5 mL Variations du volume d’O2 entre le sang entrant et sortant des poumons : 20-15 = 5 mL Variations du volume de CO2 entre le sang entrant et sortant des poumons : 53-48 = 5 mL expiré : et l’air le sang le sang 2- Le volume d’O2 (5 mL) qui est resté dans les poumons est égal à celui qui a augmenté dans le sang sortant des poumons (5mL). Le volume de CO2 qui a quitté le sang entrant dans les poumons (5mL) est approximativement égal à celui qui se trouve dans l’air expiré ≈ 5 mL. On déduit que l’O2 apporté par l’air inspiré est passé des poumons dans le sang et le CO2 qui a quitté le sang vers les poumons est sorti avec l’air expiré. 40 11- Dégager : Tirer d’un ensemble de données, une relation, un rôle, une loi, ... sans faire un raisonnement. Exemple 1 : Certains individus ne tolèrent pas le gluten, protéine de la farine de blé, dans leur alimentation. Cette intolérance apparaît généralement chez les bébés, âgés de 6 à 18 mois et se traduit par des diarrhées, un amaigrissement, une hyponutrition, une fatigue… Un prélèvement de la muqueuse intestinale révèle une atrophie (diminution du volume et mauvais fonctionnement) des villosités intestinales. On fait disparaître les troubles digestifs avec un régime alimentaire strict : suppression du gluten c'est-à-dire suppression de toutes les farines de blé, d’orge, d’avoine… Les analyses montrent que l’intestin reprend en quelques mois son aspect normal mais que toute réintroduction du gluten entraîne une nouvelle atrophie villositaire. Dégager du texte le phénomène biologique perturbé par l’intolérance au gluten. Réponse : Exemple 2 : Dans une région polluée par le dioxyde de soufre (SO2), on a constaté que le nombre de malades hospitalisés pour des difficultés respiratoires varie avec la teneur de l'air en SO2 Le document ci-contre montre l'aspect des bronches d'un individu sain A et d'un autre individu B qui vit dans cette région polluée par le SO2. Le phénomène biologique perturbé par l’intolérance au gluten est l’absorption intestinale. Dégager l'effet du dioxyde de soufre sur les bronches à l’origine des difficultés respiratoires. Réponse : Le dioxyde de soufre rétrécit les bronches rendant difficile la circulation de l’air à leur niveau d’où les difficultés respiratoires. 41 12- Distinguer : Reconnaître une chose d’une autre selon des traits particuliers. Exemple : Comment peut-on distinguer une artère d’une veine ? Réponse : La paroi de l’artère est épaisse et celle de la veine, mince. L’ouverture de l’artère est béante et celle de la veine, flasque. 13- Expliquer: Rendre clair, faire comprendre un phénomène, un résultat, … Exemple 1 : Dans le cadre de l’étude de l’action de la pepsine sur l’ovalbumine (protéines), on place à une température de 37oC, pendant 1 heure, deux tubes A et B qui contiennent respectivement : Tube A: eau + ovalbumine + pepsine ; pH =7 Tube B: eau + ovalbumine + pepsine; pH =2 Les résultats, en fin d’expérience, indiquent un test de coagulation positif dans le tube A et négatif dans le tube B. Expliquer les résultats obtenus. Réponse : Exemple 2 : La fumée de cigarette comprend de nombreuses substances toxiques : nicotine, goudrons, monoxyde de carbone (CO : un gaz)… Ce gaz se fixe facilement aux molécules d’hémoglobine, d’où la formation d’un composé stable le HbCO. Le test de coagulation positif indique la présence de protéines et le test négatif son absence. Alors, on peut dire qu’une transformation a eu lieu dans le tube B où l’ovalbumine a disparu et, aucune transformation dans le tube A où l’ovalbumine existe toujours. Or, dans les deux tubes, l’enzyme pepsine, spécifique des protéines, n’est active que dans un milieu acide. Pour cela, la transformation a eu lieu dans le tube B où le pH est égal à 2 (milieu acide) et elle est restée inactive dans le tube A où le pH=7 (milieu neutre). Expliquer pourquoi une teneur élevée du CO dans le sang peut causer une intoxication. Réponse : Le CO forme un composé stable avec l’hémoglobine. De même, l’hémoglobine transporte l’oxygène et le dioxyde de carbone. Dans le cas où le HbCO se forme, l’hémoglobine n’est plus libérée et ne peut plus fixer ni l’O2 ni le CO2. Alors, le CO2 n’est plus transporté jusqu’aux poumons pour être éliminé, il reste dans le sang et cause une intoxication. 42 14- Identifier : Reconnaître une chose d’après ses caractéristiques ou ses propriétés. Exemple : o On réalise, sur deux aliments, les tests suivants : Banane + eau iodée à froid coloration bleu foncé. o Jus de raisin + Liqueur de Fehling à chaud précipité rouge brique. Identifier le glucide contenu dans chacun de ces aliments. Réponse : L’amidon donne une coloration bleue avec l’eau iodée, alors la banane contient de l’amidon. Le sucre réducteur donne un précipité rouge brique avec la liqueur de Fehling à chaud, alors le jus de raisin contient un sucre réducteur. 15- Interpréter: Analyser et donner une signification au résultat. Exemple 1 : Dans le cadre de l’étude du rôle du suc pancréatique dans la digestion, on a réalisé les expériences qui figurent dans le document c idessous. Interpréter les résultats obtenus. Réponse : Exemple 2 : Pour réaliser la digestion in vitro du lactose, sucre du lait, on met 5mℓ de lait et 0,5 mℓ de NaOH (pour rendre le milieu basique) dans chacun des deux tubes A et B. On ajoute de la lactase au tube B seulement. Puis, on place ces deux tubes à une température de 37°C et pendant une durée convenable. Par ailleurs, on dose la quantité des sucres présents dans chacun des deux tubes au début et à la fin de l'expérience. Les résultats du dosage figurent dans le document ci-dessous. Les résultats en fin d’expériences indiquent une transformation complète de l’huile en acides gras et glycérol dans le tube A où se trouvent la bile et le suc pancréatique. Par contre, dans le tube B où se trouve la bile sans le suc pancréatique, l’huile reste intacte, dispersée en gouttelettes dans l’eau. Ceci signifie que le suc pancréatique est responsable de la transformation de l’huile en acides gras et glycérol. 43 Interpréter les résultats obtenus. Réponse : Ou La quantité du lactose est 100% dans les deux tubes A et B au début de l'expérience. En fin d’expériences, cette quantité reste la même (100%) dans le tube A qui ne contient pas de lactase mais dans le tube B, contenant une lactase, le lactose a disparu et il y a eu apparition de 50% de galactose et 50% de glucose. Cela signifie que la lactase a permis la transformation du lactose en galactose et glucose. Dans le tube A ne contenant pas de lactase, la quantité de lactose reste constante et égale à 100% tout au long de l’expérience. Par contre, dans le tube B contenant une lactase, la quantité de lactose, 100% au début de l’expérience, a disparu à la fin de l’expérience et a été remplacée par 50% de galactose et 50% de glucose. Cela signifie que la lactase a permis la transformation du lactose en galactose et glucose. 16- Indiquer: Désigner quelque chose sans justifier. Exemple 1 : Indiquer les expressions exactes. 1- Durant la systole ventriculaire, le sang est propulsé des ventricules dans les veines. 2- La systole auriculaire est la contraction simultanée des deux oreillettes. 3- Durant la diastole, les oreillettes et les ventricules se contractent. 4- Durant la systole auriculaire, les valvules tricuspide et bicuspide sont fermées. 5- Les valvules empêchent le reflux du sang. 44 2- Correcte 5- Correcte Réponse : Exemple 2 : Le cœur se contracte et se relâche de façon rythmique. Il assure ainsi la circulation du sang. Le document ci-dessous montre l’organisation du cœur, les principaux vaisseaux sanguins et deux phases de l’activité cardiaque. Indiquer, en se référant au document ci-dessus: a- les vaisseaux sanguins qui assurent l'arrivée du sang au cœur et ceux qui assurent sa sortie du cœur. b- ce qui se passe durant les phases de contraction ventriculaire et de relâchement du cœur. Réponses : a- Les vaisseaux sanguins qui assurent l'arrivée du sang au cœur sont la veine cave supérieure, la veine cave inférieure et les veines pulmonaires. Les vaisseaux sanguins qui assurent la sortie du sang du cœur sont les artères aorte et pulmonaire. b- Durant la phase de contraction ventriculaire, le sang est propulsé des ventricules dans les artères. Durant la phase de relâchement, le sang arrive aux oreillettes par les veines. 17- Justifier : Prouver quelque chose comme vrai et réel. Exemple 1 : La drépanocytose, maladie héréditaire caractérisée par la synthèse d’une hémoglobine anormale, est due à un gène situé sur la paire de chromosomes no11. Pour qu’une personne soit atteinte de la maladie, il faut que l’allèle anormal soit présent sur chacun des deux chromosomes de cette paire. Si l’un des chromosomes porte l’allèle anormal et l’autre l’allèle normal, le sujet n’est pas atteint de la maladie. Justifier qu’un couple non malade peut avoir un enfant atteint de drépanocytose. 45 Réponse : Exemple 2 : L’hémoglobine est dite "protéine de fonction". L’allèle anormal est récessif. Un couple non malade mais hétérozygote c.à.d. chacun des parents porte l’allèle responsable de la drépanocytose à l’état caché. Dans ce cas, chacun d’eux peut donner l’allèle anormal à l’enfant qui sera homozygote, malade. Justifier cette affirmation. Réponse : L’hémoglobine est dite protéine de fonction car elle assure le transport des gaz respiratoires : O2 et CO2. 18- Préciser : Indiquer et justifier Exemple 1 : Les chromosomes sont le support de l'information génétique. Tout changement du nombre ou de la forme du chromosome entraîne une modification de l'expression du programme génétique. Le fragment " S " localisé uniquement sur le chromosome Y porte l’information génétique responsable de l’apparition du caractère masculin. Le document ci-contre représente les chromosomes sexuels de trois individus. Préciser le sexe des individus 1 et 2. Réponse : L’individu 1 est un mâle et l’individu 2 est une femelle. Car l’individu 1 a deux chromosomes sexuels différents X et Y et l’individu 2 a deux chromosomes sexuels identiques X. Exemple 2 : Les groupes sanguins du système ABO sont commandés par un gène situé sur la paire chromosomique no9. Ce gène possède 3 allèles A, B et O. Les allèles A et B sont codominants entre eux et dominants par rapport à l’allèle O. L’allèle O étant récessif ne s’exprime phénotypiquement qu’à l’état homozygote. Un homme de groupe sanguin A a épousé une femme de groupe B. Ce couple a eu une fille de groupe B. Préciser les allèles déterminants le groupe sanguin de cette fille. 46 Réponse : Cette fille a les allèles B et O. Etant de groupe B, elle a pris l’allèle B de sa mère de groupe B, et l’allèle O, récessif par rapport à l’allèle A, de son père de groupe A. Sinon, elle ne serait pas de groupe B. 19- Relever : Extraire une ou plusieurs information(s) d’un document. Exemple : L'amidon du blé est une molécule complexe constituée de plusieurs molécules de glucose. Au cours de sa digestion, l'amidon réagit avec l'eau et il est dégradé en molécules de plus petite taille. Cette réaction chimique s’appelle hydrolyse. Les enzymes, contenues dans la salive et le suc pancréatique, activent la réaction d'hydrolyse, favorisent la simplification moléculaire de l'amidon et restent intactes à la fin de la réaction. 1- Relever du texte : a- Les molécules qui constituent la molécule de l'amidon du blé. b- La définition de l’hydrolyse. c- La phrase qui indique le rôle des enzymes. Réponses : 1- a- Les molécules constituant la molécule de l'amidon du blé sont : plusieurs molécules de glucose. b- L’hydrolyse est une réaction où l'amidon réagit avec l'eau et il est dégradé en molécules plus petites de taille. c- Les enzymes activent la réaction d'hydrolyse, favorisent la simplification moléculaire de l'amidon. 20- Vérifier : Confirmer par des arguments, par un raisonnement logique, … que quelque chose est vrai ou faux. Exemple 1 : Pour vérifier l’hypothèse " le tabac favorise le cancer des poumons", des études ont été réalisées dans un centre médical dont les résultats figurent dans le document ci-dessous. Non fumeurs Quantité de tabac consommé (en g/personne/jour) Pourcentage des malades atteints de cancer des poumons Fumeurs 0 1-4 5-14 15-24 >25 31 36 48 53 73 Vérifier, d’après les résultats obtenus, si l’hypothèse est valide. 47 Réponse : Exemple 2 : La drépanocytose, maladie héréditaire caractérisée par la synthèse d’une hémoglobine anormale, est due à un gène situé sur la paire de chromosomes no11. Pour qu’une personne soit atteinte de la maladie, il faut que l’allèle anormal soit présent sur chacun des deux chromosomes de la paire. Si l’un des chromosomes porte l’allèle anormal et l’autre l’allèle normal, le sujet n’est pas atteint de la maladie. Le pourcentage des malades atteints de cancer de poumons est 31 chez les non fumeurs et il augmente à 36 chez les fumeurs qui consomment 1 à 4g/personne/jour. Ce pourcentage continue à augmenter avec la quantité de tabac consommé pour devenir 73% lorsque la consommation de tabac dépasse 25 g/personne/jour. Alors, le tabac augmente le risque de cancer des poumons et l’hypothèse formulée est valide. Vérifier, en faisant l’analyse factorielle nécessaire, qu’un couple non atteint peut avoir un enfant malade. Réponse : Soit N le symbole de l’allèle dominant normal. Soit d le symbole de l’allèle récessif responsable de la drépanocytose. Dans le cas où les deux parents sont normaux, hétérozygotes, chacun d’eux peut donner l’allèle anormal d à l’enfant qui sera homozygote atteint. Phénotypes des parents : ♂ [N] x ♀ [N] Génotypes des parents : ♂ Nd x ♀ Nd γP: ½N ½d ½N ½d ♀ ½N ½d ♂ ½N ½d ¼ NN ¼ Nd ¼ Nd ¼ dd Résultats: ¾ [N] ¼ [d] D’après l’échiquier, l’enfant ayant comme génotype dd sera malade. Alors, les parents non atteints peuvent avoir un enfant malade. 48 EXEMPLES DE VERBES D’ACTION EXAMEN OFFICIEL TROISIEME ANNEE DU CYCLE SECONDAIRE PHYSIQUE 49 50 1- Analyser : Décomposer un tout en ses éléments constitutifs pour mettre en évidence les variations. Exemple : Analyser le fonctionnement d’un H.P . Réponse : Les éléments constitutifs sont : un aimant ,une bobine située dans le champ magnétique de l’aimant, une membrane accrochée à la bobine ; lorsqu’un courant variable traverse la bobine, il provoque la vibration de la membrane sous l’action de la force électromagnétique créée. 2- Calculer : Opérer sur des nombres. Exemple : Calculer la valeur de la capacité C d’un condensateur dans un dipôle RC série alimenté par une tension constante, connaissant les valeurs de la constante de temps du circuit et de la résistance R. Réponse : La constante de temps d’un tel dipôle est W =RC. Connaissant W et W R, on peut calculer C= . R 3- Citer: Enoncer sans expliquer. Exemple: Citer les principaux constituants d’un transformateur. Réponse : Ces principaux constituants sont : les deux bobines et le cadre en fer doux. 4- Comparer : Indiquer les ressemblances et/ou plusieurs entités. les différences entre deux ou Exemple 1 : Comparer le fonctionnement d’un H.P et celui d’un microphone. Réponse : Un H.P produit un signal sonore à partir d’un signal électrique. Un microphone produit un signal électrique à partir d’un signal sonore. Exemple 2 : Comparer la pseudo-période T et la période propre T0 d’un oscillateur élastique. Réponse : La pseudo-période T est légèrement supérieure à la période propre T0 51 5- Compléter: Ajouter ce qui manque. Exemple: Un mobile A est en mouvement sur un axe x' x . A une date t, sa position est donnée par son abscisse x et par sa vitesse v. Le tableau ci-dessous donne des valeurs de x et v à des dates successives. Compléter ce tableau : Temps t en ms Position x e n mm v e n m/s 0 A0 0 0 Réponse : V2 = t1 = W = 60 A1 7,2 0,24 x 3 x1 = 2W t2 = 2 W A2 28,9 57,7 u 103 0,12 t3 = 3 W A3 64,9 0,72 t4 = 4 W t5=5 W t6 = 6 W A4 115 A5 181 1,20 A6 259 0,48m / s et V4= 116,1u 10 3 0,12 0,97 m / s. 6- Conclure: Aboutir à une décision. Exemple : Sans transformateur, le transport de l’énergie électrique s’effectue avec une perte d’énergie par effet joule P ; avec un transformateur fonctionnant comme survolteur, la perte est P’<< P ; conclure à propos du rôle du transformateur dans le transport de l’énergie électrique à grande distance. Réponse : Le transformateur, fonctionnant comme survolteur, réduit énormément la perte par effet joule, à travers les lignes de transport. 7- Déterminer : Aboutir à une décision, à un résultat, … par un raisonnement logique, par un calcul, … Exemple : Un pendule élastique horizontal constitué par un solide de masse m et d’un ressort de raideur k, a une équation différentielle k xcc x 0, où x est l’abscisse du centre d’inertie du solide par m rapport à l’origine O de l’axe, position de G à l’équilibre. Déterminer l’expression de la période propre T0 du pendule en fonction de m et de k. k 2 Réponse : L’équation différentielle x cc x 0, étant de la forme x cc Z 0 x 0 m k 2S la pulsation propre est telle que Z 0 2 = , avec T0= , on obtient m Z0 T0= 2 S m . k 52 8- Décrire : S’exprimer en utilisant un langage scientifique, pour donner les détails d’une observation, d’une expérience, d’un schéma, d’un appareil, … Exemple : Décrire l’aspect des franges observées sur l’écran dans l’expérience des fentes de Young. Réponse : Les franges sont parallèles aux fentes- Les franges sont alternativement brillantes et obscures- Les franges sont équidistantes. 9- Démontrer (Montrer que): Prouver qu’une chose est raisonnement logique, par une expérience, par un calcul,… évidente par un Exemple 1: Montrer que le parachutiste, en chute verticale, va atteindre une vitesse limite. Réponse : La deuxième loi de Newton, appliquée au parachutiste donne : P + R = m a . Au début du mouvement, la valeur P du poids est plus grande que la valeur R de la résistance de l’air. Au cours du temps, la vitesse augmente, ceci entraîne une augmentation de R (R augmente avec V) , P restant constant. Il arrive un moment où R = P, dans cette phase du mouvement a=0, le parachutiste atteint alors une vitesse limite et le mouvement sera rectiligne uniforme. Exemple 2 : Montrer, qu’en régime permanent, l’intensité du courant, dans un circuit comportant le dipôle RL série et alimenté par une tension constante E E e st I = . R E L + R di . En régime permanent i =cte, dt di E et = 0 E = RI, d’où I= . R dt Réponse : On a E = Ri + L 10- Déduire : Tirer, par un raisonnement logique, une nouvelle information à partir de la donnée ou à partir d’informations existantes. Exemple 1 : Quelle condition doit satisfaire l’élongation angulaire T pour que le mouvement d’un pendule pesant soit harmonique simple? Déduire l’expression de la période propre des oscillations sachant que l’équation différentielle qui régit le mouvement du Mga sin T 0. pendule est : Tcc I 53 Réponse : Si T est faible, sin T = T (en radian) ; dans ce cas , l’équation Mga différentielle est alors : Tcc T 0, elle est de la forme I 2 Tcc Z0 T 0 le mouvement est sinusoïdal de pulsation propre Z0 I 2S Mga et la période propre est T0 = = 2S Mga Z0 I Exemple 2 : Calculer la masse avant et la masse après dans une réaction nucléaire. Déduire si cette réaction nucléaire libère de l’énergie. Réponse : On calcule la masse (avant la réaction ) et la masse (après la réaction), si la masse(avant la réaction ) est supérieure à la masse (après la réaction) il ya diminution de masse au cours de cette réaction nucléaire, cette perte de masse se transforme en énergie libérée. 11- Dégager : Tirer d’un ensemble de données, une relation, un rôle, une loi, ... sans faire un raisonnement. Exemple : Dégager du tableau des planètes du système solaire, comment évolue la période de révolution d’une planète en fonction de sa distance du Soleil. Réponse : En s’éloignant du Soleil, la période de révolution d’une planète augmente. 12- Distinguer : Reconnaître une chose d’une autre selon des traits particuliers. Exemple : Distinguer le spectre d’émission du spectre d’absorption d’un atome. Réponse : Le spectre d’émission d’un atome est formé de raies colorées sur un fond noir tandis que le spectre d’absorption est composé de raies noires sur un fond coloré. 13- Expliquer: Rendre clair, faire comprendre un phénomène, un résultat, … Exemple : Expliquer le phénomène de la charge d’un condensateur sous une tension continue constante. Réponse : Le pôle positif du générateur attire des électrons libres de l’armature A du condensateur et, en même temps, des électrons se déplacent du pôle négatif du A E R C B 54 générateur vers l’armature B du condensateur ; une tension uAB apparaît . Ce processus continue jusqu’à ce que la tension uC = uAB = E (f.é.m du générateur) ; le courant cesse alors de passer et le condensateur se charge complètement. 14- Identifier : Reconnaître une chose d’après ses caractéristiques ou ses propriétés. Exemple: En s’aidant de l’oscillogramme de la figure ci-contre, identifier le dipôle électrique (D), placé dans un circuit série formé par le dipôle, un conducteur ohmique de résistance R et un générateur délivrant une tension alternative sinusoïdale. Réponse uD Ri La tension uD aux bornes du dipôle (D) est en retard de S rad par rapport au courant i ; 2 (D) est alors un condensateur. 15- Interpréter: Analyser et donner une signification au résultat. Exemple : Interpréter le fonctionnement d’un H.P . Réponse : Un circuit parcouru par un courant d’intensité (I) variable et placé dans un champ magnétique de valeur B, est soumis à une force électromagnétique (de Laplace) de valeur F variable, proportionnelle à (I); d’où la vibration de la membrane. 16- Indiquer: Désigner quelque chose sans justifier. Exemple : Indiquer le sens du déplacement de la frange centrale dans le dispositif des fentes de Young lorsqu’on couvre une des fentes par une lame à faces parallèles. Réponse : La frange centrale se déplace du même côté de la lame. 55 17- Justifier : Prouver quelque chose comme vrai et réel. Exemple : Le transformateur ne fonctionne pas en tension continue. Justifier. Réponse : Si une tension continue est appliquée aux bornes du primaire d’un transformateur, l’intensité du courant dans le primaire est constante, le flux qui le traverse est constant ; le flux M 2 dans le secondaire est constant, par suite , la f.é. m induite aux bornes du dM secondaire est e2 = 2 0 , le transformateur ne fonctionne donc dt pas. 18- Préciser : Indiquer et justifier. Exemple : Préciser le mode des oscillations électriques établies dans le circuit constitué par un condensateur de capacité C, initialement chargé, et relié à une bobine d’inductance L et de résistance négligeable. Réponse : Les oscillations sont libres non amorties puisqu’on laisse le circuit évoluer sans intervention extérieure (libres) et R= 0 (non amorties). 19- Relever : Extraire une ou plusieurs information(s) d’un document. Exemple : Relever de l’extrait ci-dessous d’un texte, la phrase qui indique la transformation de l’énergie rayonnante en énergie thermique : « …, l’énergie rayonnante, en apparence peu utilisée, est pourtant l’une des plus importantes. Les rayons qui nous parviennent du Soleil, réchauffent la Terre, permettant la vie et tout particulièrement la croissance des plantes… de nos jours , on utilise les piles solaires pour produire de l’énergie électrique… » Réponse : Les rayons qui nous viennent du Soleil réchauffent la Terre. 20- Vérifier : Confirmer par des arguments, par un raisonnement logique, … que quelque chose est vraie ou fausse. Exemple : Vérifier que i = i + RC di dt t E RC e est une solution de l’équation différentielle R 0. t di 1 E RC u e et remplaçons Réponse : Dérivons i par rapport au temps : dt RC R t t E RC 1 E RC u e ) = 0. dans l’équation différentielle: e + RC ( RC R R Ce qui est vérifié. 56 EXEMPLES DE VERBES D’ACTION EXAMEN OFFICIEL TROISIEME ANNEE DU CYCLE SECONDAIRE CHIMIE 57 58 1- Analyser: Décomposer un tout en ses éléments constitutifs pour mettre en évidence les variations. Exemple : On réalise un titrage pH- métrique d’un acide fort par une base forte. On donne ci-dessous la courbe représentant la variation : pH = f (V). Analyser cette courbe. Réponse : Pour : 0 < V < 14 mL, le pH varie d’une façon légère. 14 < V < 18 mL, le pH varie d’une façon brusque (saut du pH). V > 18 mL, le pH reprend sa variation légère. 2- Calculer : Opérer sur des nombres. Exemple : On chauffe un mélange de 0,5 mol d’acide éthanoïque et 0,5 mol d’éthanol, en présence d’acide sulfurique concentré. Il se déroule une réaction dont l’équation est : CH3 – CH2OH + CH3 – COOH ⇌ CH3 – COO CH2 –CH3 + H2O 59 L‘étude de la variation de la quantité de matière de l’ester formé en fonction du temps donne le résultat suivant : Calculer le rendement de cette réaction. Réponse : Rendement de cette réaction : R= n(ester) équilibre n(ester) maximal attendu = 0,33 = 0,66. 0,50 3- Citer: Enoncer sans expliquer Exemple : On chauffe à reflux un mélange d’acide salicylique et un excès de méthanol en présence de quelques gouttes d’acide sulfurique concentré. Citer les deux facteurs cinétiques qui interviennent dans cette activité expérimentale. Réponse : Les deux facteurs cinétiques qui interviennent dans cette activité sont : La température et le catalyseur représenté par l’acide sulfurique concentré. 4- Comparer: Indiquer les ressemblances et/ou plusieurs entités. Exemple : les différences entre deux ou Les corps gras tels que le suif, les huiles d’arachide, d’olive,… sont des triesters d’acides gras (saturés ou non saturés) et du glycérol. Comparer la structure d’un acide gras saturé à celle d’un acide gras mono-insaturé. Réponse : Dans la molécule d’acide gras saturé, toutes les liaisons carbonecarbone sont covalentes simples tandis que dans la molécule 60 d’acide gras mono-insaturé , il y a une liaison covalente double entre deux atomes de carbone consécutifs en plus des liaisons covalentes simples carbone-carbone. Ces deux acides gras ont le même groupe fonctionnel - COOH. 5- Compléter: Ajouter ce qui manque. Exemple : On mesure, à des instants différents, le volume V de diazote dégagé dans la réaction de décomposition de C6H5 – N2Cl dont l’équation est : C6H5 – N2Cl (aq) → C6H5 – Cl (aq) + N2 (g). Les résultats sont groupés dans le tableau suivant : t (min) V (ml) [C6H5 – Cl] t10-4 (mol.l-1) 0 0 3 10,5 6 19 9 27 12 33 14 36 18 41 22 45 Compléter le tableau précédent sachant que : [C6H5 – Cl] t = 4.10-5x V, où V (exprimé en ml) est le volume de diazote formé à l’instant t. Réponse : En multipliant par 0,4, on tire : t (min) [C6H5 – Cl]t x10-4 mol.L-1 0 3 6 9 12 14 18 22 0 4,2 7,6 10,8 13,2 14,4 16,4 18,0 6- Conclure: Aboutir à une décision. Exemple : Les ions iodure réagissent avec les ions peroxodisulfate selon l'équation suivante : S2O 82 + 2 I – → 2 SO 24 + I2 On prépare un système réactionnel constitué d'un volume V1 d’une solution d’iodure de potassium (K+ + I – ) et d'un volume V2 = 100 ml d’une solution de peroxodisulfate de sodium (2 Na+ + S2O 82 ). On maintient ce système à une température constante T. On dose des prélèvements du mélange réactionnel, pour déterminer la concentration du diode formé. On recommence, à la même température T, la même expérience (système réactionnel identique au précédent) en présence de quelques gouttes d'une solution de sulfate de fer II. Des résultats des deux expériences : Expérience sans Fe2+ Expérience avec Fe2+ Temps de demi-réaction : t1/2 24 min 11 min Conclure quant au rôle des ions Fe2+. 61 Réponse : Comme t1/2 (avec Fe2+) < t1/2 (sans Fe2+), on conclut que la présence des ions Fe2+ fait augmenter, à une température donnée, la vitesse de la réaction ; donc Fe2+ est un catalyseur de cette réaction. 7- Déterminer: Aboutir à une décision, à un résultat, … par un raisonnement logique, par un calcul, … Exemple : On dose un volume Va = 20,0 mL de (S) par une solution d'hydroxyde de sodium (Na++HO –) de concentration Cb = 3,0x10-2 mol.L-1, en présence d'un indicateur coloré convenable. Le volume ajouté pour atteindre l'équivalence est VbE = 13,6 mL. L'équation de la réaction de dosage est : C6H5COOH + HO – → C6H5COO – + H2O Déterminer la concentration Ca de la solution (S). Réponse : À l'équivalence : n(HO – ) ajouté = n(C6H5COOH) apporté dans Va ; CaxVa = CbxVbE. 3,0 x10 2 x13,6 D'où : Ca = = 2,0 x10-2 mol.L-1. 20,0 8- Décrire: S’exprimer en utilisant un langage scientifique, pour donner les détails d’une observation, d’une expérience, d’un schéma, d’un appareil, … Exemple : On veut préparer 500 mL d'une solution (B) de chlorure d'ammonium (NH 4 + Cl –) de concentration C2 = 0,10 mol.L-1. Donnée : On dispose d’un flacon contenant des cristaux de chlorure d’ammonium NH4Cl(S) pur. M (NH4Cl) = 53,5 g.mol-1. Décrire, brièvement, le mode de préparation de cette solution tout en choisissant le matériel convenable de la liste suivante : Liste de matériel disponible : balance de précision, verre de montre, spatule, entonnoir, agitateur magnétique. béchers : 100, 200 et 500 mL. éprouvettes graduées : 100, 200 et 500 mL. fioles jaugées : 100, 200 et 500 mL. pipettes jaugées : 10 et 20 mL. 62 Réponse : Pour préparer 500 mL de la solution (B) on a besoin d''une masse m = 0,1x500x10-3x53,5 = 2,675 g. À l'aide de la balance de précision, la spatule et le verre de montre, on pèse 2,675 d de NH4Cl (s). À l’aide de l'entonnoir, on introduit ce solide dans une fiole jaugée de 500 mL, partiellement remplie d'eau distillée. On agite pour faire dissoudre le solide. On complète avec l'eau distillée jusqu'au trait de jauge. On bouche la fiole et on la renverse plusieurs fois pour homogénéiser la solution préparée. 9- Démontrer (Montrer que) : Prouver qu’une chose est raisonnement logique, par une expérience, par un calcul,… Exemple : évidente par un C6H5 – N2Cl est un explosif non oxygéné qu’on conserve à une température inférieure à 5 ºC. La décomposition de C6H5 – N2Cl, dans un milieu aqueux et à la température de 25 ºC, est lente. Cette décomposition a lieu selon l’équation suivante : C6H5 – N2Cl (aq) → C6H5 – Cl (aq) + N2 (g). Donnée : - Volume molaire gazeux dans les conditions de l’expérience : Vm = 25 L.mol-1. - C6H5 – N2Cl se décompose dans une solution de volume 1 L. Montrer qu’à chaque instant t, la concentration de C6H5 – Cl, exprimée en mol.L-1, est donnée par l’expression : [C6H5 – Cl] t = 4.10-5x V, où V, exprimé en mL, est le volume de diazote formé à l’instant t. Réponse : A tout instant t : n (C6H5Cl) formé = n (N2) formé. En divisant par le volume de la solution (1 L), on obtient : V (N 2 ) Vx10 3 Vx10 3 [C6H5Cl] t = = = 4.10-5 x V Vm xVsolution Vm x1 25 10- Déduire: Tirer, par un raisonnement logique, une nouvelle information à partir de la donnée ou à partir d’informations existantes. Exemple : On traite 0,05 mol de chlorure de propanoyle avec un excès d'un monoalcool saturé non cyclique (D) noté (R-OH) en présence d'un catalyseur convenable. A la fin de la réaction, on obtient un ester (E) d’odeur fruitée et de masse égale à 5,8 g selon l'équation suivante: C2H5 – CO – Cl + R – OH Ester + HCl (E) 1- Déterminer la masse molaire de l’ester (E). 2- Déduire la formule moléculaire de l'alcool (D). 63 Réponse : 1- D'après la loi de conservation de masses : M (C2H5COCl) + M(D) = M(ester) + M(HCl) M (D) = (116 + 36.5) - 92.5 = 60 g.mol -1. 2- L'alcool (D) a pour formule CxH2x+1 OH ; d’où M (CxH2x+1 OH) = 14x +18 = 60 et x = 3. Par conséquent la formule moléculaire de l'alcool (D) est C3H7OH. 11- Dégager: Tirer d’un ensemble de données, une relation, un rôle, une loi, ... sans faire un raisonnement. Exemple : Le monoxyde de carbone est largement utilisé dans l’industrie pour synthétiser différents produits de base de la chimie organique. Le traitement du propène par un mélange de monoxyde de carbone et de dihydrogène, en présence d’un catalyseur convenable, conduit à un mélange de deux aldéhydes isomères à 4 atomes de carbone et par conséquent au butan-1-ol. De même, le traitement du but-1-ène par un mélange de monoxyde de carbone et de dihydrogène permet d’obtenir le pentan-1-ol. Dégager, de ce qui précède, l’intérêt que présente le monoxyde de carbone dans l’industrie organique. Réponse : Dans l’industrie organique, le monoxyde de carbone participe aux synthèses de certains composés organiques de chaînes carbonées plus longues que celles des composés de départ. 12- Distinguer : Reconnaître une chose d’une autre selon des traits particuliers. Exemple : On réalise un suivi pH-métrique dans les deux cas suivants : - Acide fort – base forte - Acide faible – base forte. Le résultat de ce suivi est donné par le graphe suivant : 64 Distinguer, en se basant sur ces résultats, un acide fort d’un acide faible. Réponse : Dans le cas d’un acide fort- base forte : la courbe présente un point d’inflexion dont le pH est égal à 7. Dans le cas d’un acide faible- base forte : la courbe présente deux points d’inflexion. 13- Expliquer: Rendre clair, faire comprendre un phénomène, un résultat, … Exemple : Un comprimé d’aspirine effervescente contient de l’acide acétylsalicylique et de l’hydrogénocarbonate de sodium (NaHCO3) en excès. Ces deux ingrédients sont inertes en milieu anhydre et sont réactifs en solution aqueuse donnant des ions A –. Ces ions redonnent HA, dans un milieu acide, sous forme de cristaux dispersés très fins. Expliquer comment la formulation de l’aspirine effervescente facilite l’absorption de l’aspirine par l’estomac. Réponse : La formulation de l'aspirine effervescente a l'avantage de disperser le principe actif sous la forme ionique (A – ) dans une solution aqueuse. Dans l'estomac, cet ion réagit avec le suc gastrique (H3O+) pour reproduire HA (acide acétylsalicylique) sous forme de cristaux très fins dispersés sur l'ensemble de la muqueuse de l'estomac où il sera absorbé d’une façon rapide. 14- Identifier: Reconnaître une chose d’après ses caractéristiques ou ses propriétés. Exemple : On verse un volume d’une solution d’eau oxygénée dans une fiole jaugée de 100 mL. On place cette fiole sur une balance de précision. À t = 0, on verse dans la fiole 2 mL d’une solution de nitrate de fer (III). Quelques instants plus tard, un abondant dégagement gazeux est observé, provenant de la décomposition du peroxyde d’hydrogène selon la réaction d’équation : 2 H2O2 (aq) → 2 H2O(l) + O2 (g) La balance indique une diminution de masse au cours du temps. On relève durant cette décomposition, la variation de masse Δm qui représente pratiquement la masse de dioxygène dégagé à tout instant t. Donnée : - Le dioxygène gazeux est pratiquement insoluble dans l’eau. Δm - n(H2O2) restant à t = 4,46×10-2 16 65 Identifier les espèces chimiques présentes dans la solution obtenue à l’instant où Δm égale à 713 mg. Réponse : Pour Δm = 713 mg, on tire n(H2O2) restant à t ≈ 0. H2O2 a réagi totalement et les espèces chimiques présentes dans la solution obtenue sont : H2O qui est solvant et un produit de la réaction, Fe3+ qui est un catalyseur et NO 3 qui est indifférente. 15- Interpréter: Analyser et donner une signification au résultat. Les ions permanganate (MnO 4 ) réagissent avec l'acide oxalique (H2C2O4) en milieu acide selon l'équation suivante : 2 MnO 4 (aq) + 5 H2C2O4(aq) + 6 H3O+(aq) → 2 Mn2+(aq) + 10 CO2(g) + 14 H2O(l) Exemple : (MnO 4 est la seule espèce colorée dans ce milieu réactionnel). Pour étudier l’effet de quelques facteurs cinétiques sur la vitesse de cette réaction, on réalise les trois mélanges ci-dessous : (Pour chacun des mélanges, la solution de permanganate de potassium est introduite à t = 0). -2 -1 H2C2O4 : C1 = 2,0x10 mol.L H2SO4 concentré Eau distillée Température θ KMnO4 : C3 = 1,0x10-2 mol.L-1 Δt Mélange (A) V1 = 20 mL V2 = 10 mL 0 20 ºC V3 = 10 mL Δt (A) = 140 s Mélange (B) V1 = 20 mL V2 = 10 mL 60 mL 20 ºC V3 = 10 mL Δt (B) = 190 s Mélange (C) V1 = 20 mL V2 = 10 mL 0 40 º C V3 = 10 mL Δt (C) = 22 s Δt est la durée nécessaire à l'obtention de la décoloration du mélange. Interpréter la décoloration de la solution dans chaque mélange à la fin de la réaction. Réponse : Dans chacun de ces mélanges, MnO 4 est la seule espèce colorée. A la fin de la réaction, il y a disparition totale de cette espèce et formation d’espèces incolores; ceci interprète la décoloration de la solution dans chaque mélange. 16- Indiquer: Désigner quelque chose sans justifier. Exemple : L’ion carboxylate (R – COO –) d’un savon est formé de deux parties, la chaîne hydrocarbonée (R –) et le groupe carboxylate (– COO –). Indiquer, dans l’ion carboxylate, la partie correspondante au groupe hydrophile et celle correspondante au groupe hydrophobe. 66 Réponse : Le groupe hydrocarboné (R –) est hydrophobe et le groupe ( – COO – ) est hydrophile. 17- Justifier : Prouver quelque chose comme vrai et réel. Exemple : On ajoute, progressivement, une solution d’acide chlorhydrique (H3O+ + Cl –) dans un bécher contenant un volume d’une solution d’éthanolate de sodium et quelques gouttes de bleu de bromothymol, jusqu’à atteindre l’équivalence. Le pH de la solution obtenue à l’équivalence est égal à 7. Justifier ce résultat à partir des espèces chimiques présentes dans cette solution. Réponse : À l’équivalence les espèces majoritaires présentes dans la solution sont : Na+ , Cl –, C2H5OH et l’eau. Les espèces : Na+, Cl – et C2H5OH (acide conjugué d'une base forte) sont indifférentes dans l’eau. Le pH sera celui de l’eau pure à 25oC; pH = 7. 18- Préciser: Indiquer et justifier. Exemple : On ajoute, progressivement, une solution d’acide chlorhydrique (H3O+ + Cl –) dans un bécher contenant un volume d’une solution d’éthanolate de sodium et quelques gouttes de bleu de bromothymol, jusqu’à atteindre l’équivalence. Donnée : Bleu de bromothymol : jaune 6,0 vert 7,6 bleu Préciser le changement de couleur observé à l’équivalence. Réponse : À l’équivalence, la couleur de la solution dans le bécher varie du bleu au vert, à une goutte près. 19- Relever : Extraire une ou plusieurs information(s) d’un document. Exemple : Une alimentation saine aide à améliorer la santé générale et le bien-être. Un régime alimentaire sain peut aider à mieux se sentir, assure plus d’énergie, aide à rester actif et en bonne forme et à combattre le stress.… Relever (Extraire) en se référant au texte, quatre avantages d’un régime alimentaire sain. Réponse : Les quatre avantages sont: aide à se sentir mieux, assure plus d’énergie, aide à rester actif et en bonne forme et aide à combattre le stress… 67 20- Vérifier: Confirmer par des arguments, par un raisonnement logique, … que quelque chose est vrai ou faux. Exemple : Couple acide/base pKa L’hydrogénocarbonate de sodium (NaHCO3) connu dans le commerce sous le nom de bicarbonate de soude, est très utilisé dans la vie courante : HCO 3 /CO 32 (CO2,H2O) / HCO 3 H2O/HO – H3O+/H2O 10,3 6,4 14 0 On introduit un volume Vb = 20 mL d’une solution d’hydrogénocarbonate de sodium. On y ajoute progressivement une solution d’acide chlorhydrique de concentration Ca = 0,10 mol.L-1. On suit l’évolution du pH à l’aide d’un pH-mètre déjà étalonné. Les résultats sont groupés dans le tableau suivant : Va(mL) pH 0 1 2 4 6 10 12 14 16 17 18 19 20 21 22 25 8,0 7,2 7,0 6,8 6,6 6,3 6,2 6,1 6,0 5,8 5,3 4,0 2,8 2,4 2,3 2,1 1- Tracer, sur un papier millimétré, la courbe pH = f(Va). Prendre les échelles suivantes : abscisses : 1 cm pour 2 mL ; ordonnées : 1 cm pour une unité de pH. 2- Vérifier, graphiquement, la valeur du pKa du couple (CO2,H2O)/ HCO 3 . Réponse : 1- [base] avec [base] = [acide]. [acide] On aura pH = pKa. Pour Va = 9,5 mL, on tire pKa = 6,4. 2- À la demi-équivalence, on a : pH = pKa + log 68 EXEMPLES DE VERBES D’ACTION EXAMEN OFFICIEL TROISIEME ANNEE DU CYCLE SECONDAIRE SCIENCES DE LA VIE 69 70 1- Analyser: Décomposer un tout en ses éléments constitutifs pour mettre en évidence les variations. Exemple 1 : Les glandes parathyroïdes, situées à la base du cou, sont au nombre de quatre. Leur structure ne montre pas de canaux excréteurs, mais on constate qu’elles sont très richement irriguées par des vaisseaux sanguins. Les glandes parathyroïdes ne sécrètent pas de calcium. Dans le but de déterminer le rôle de ces glandes, on injecte à un animal normal une substance isolée d’extraits parathyroïdiens et on mesure l’évolution de la calcémie. Les résultats figurent dans le document ci-joint. Analyser les résultats obtenus. Réponse : Exemple 2 : On prélève des cellules adipeuses (adipocytes) d’une personne saine et d’une autre ayant un diabète de type 2, DT2. On met ces cellules en culture dans un milieu contenant du glucose marqué au 14C. On ajoute de l’insuline à ce milieu puis on mesure le 14C contenu dans les adipocytes. Les résultats figurent dans le document ci-contre. Avant l’injection des extraits parathyroïdiens, du Jour 0 au Jour 2, la calcémie est constante et égale à 100 mg.L- 1. Par contre, cette calcémie augmente de 100mg.L-1 à 210mg.L-1 du Jour 2 au Jour 4,5 suite à deux injections successives d’extraits parathyroïdiens effectuées au Jour 2 et au Jour 3. Analyser les résultats obtenus. 71 Réponse : La quantité de 14C absorbée par les adipocytes d’un individu sain augmente de 120 u.a à 300 u.a lorsque la quantité d’insuline ajoutée au milieu de culture augmente de 0,01mmol à 100 mmol. De même, chez l’individu atteint de DT2, la quantité de 14C absorbée par les adipocytes augmente mais faiblement en fluctuant entre 100 et 150u.a (150ua < 300ua), pour la même quantité d’insuline ajoutée. 2- Calculer : Opérer sur des nombres. Exemple 1 : Des généticiens croisent une lignée de souris à poil frisé et à œil mal formé avec des souris à poil lisse et œil normal. Tous les individus de la première génération (F1), sont à poil frisé et œil normal. Les résultats de la (F2), issue du croisement des individus de la F1 entre eux, sont les suivants : 42 à poil lisse et œil normal. 127 à poil frisé et œil normal. 41 à poil frisé et œil mal formé. 14 à poil lisse et œil mal formé. Calculer les proportions phénotypiques de la génération F2. Réponse : Calcul des proportions de F2 : 42/14 = 3 ; 127 / 14 = 9,07 ≈9 ; 41/14 = 2,92 ≈ 3 Total = 3 + 9 +3 +1 = 16 soient : 14 / 14 = 1 3/16 souris à poil lisse et œil normal 9/16 souris à poil frisé et œil normal 3/16 souris à poil frisé et œil mal formé 1/16 souris à poil lisse et œil mal formé. Exemple 2 : Calculer l’indice de masse corporelle (IMC) d’un individu de masse 80kg et de taille 160cm ; sachant que IMC = M/T2 (masse en kg, taille en m). Réponse : IMC = M/T2 = 80 / (1,6) 2 = 31,25 kg/m2 3- Citer: Enoncer sans expliquer. Exemple 1 : Citer les étapes de la transmission du message nerveux au niveau d’une synapse. Réponse : Arrivée du P.A au niveau du bouton terminal du neurone présynaptique. Entrée des ions Ca++ dans le bouton terminal. Exocytose des vésicules à neurotransmetteur. 72 Libération du neurotransmetteur dans la fente synaptique. Fixation sur les récepteurs de la membrane postsynaptique. Ouverture des canaux postsynaptiques. Déclenchement d’un potentiel postsynaptique (PPS). Dégradation du neurotransmetteur par des enzymes spécifiques et/ou recapture du neurotransmetteur par la membrane présynaptique. Exemple 2 : Citer trois effets biologiques dus à une décharge du cortisol lors du stress. Réponse : Trois des cinq effets : Augmente le taux de glucose dans le sang. Ralentit l’excrétion d’eau par les reins. Contribue à la résistance de l’organisme aux agressions. A un effet anti-inflammatoire. Diminue la consommation du glucose par les cellules, sauf les cellules du cerveau. 4- Comparer : Indiquer les ressemblances et / ou les différences entre deux ou plusieurs entités. Exemple 1 : Afin d’étudier le rôle de l’insuline, des chercheurs ont mesuré l’absorption du glucose ainsi que la quantité de glycogène mise en réserve, sur un muscle placé dans un milieu avec ou sans insuline. Les résultats figurent dans le document suivant. Quantité de glucose absorbé par le muscle (en mg/g de muscle) toutes les 10 minutes Milieu sans Milieu avec insuline insuline 1,43 1,88 Quantité de glycogène contenu dans le muscle (en mg/g de muscle) après 10 minutes Milieu sans Milieu avec insuline insuline 2,45 2,85 Comparer les résultats obtenus. Réponse : Exemple 2 : Le document 1 révèle les aliments consommés par une personne pendant une journée, le document 2 révèle la répartition des apports énergétiques de ces aliments et le document 3, Dans un milieu avec insuline, la quantité de glucose prélevée par le muscle, 1,88 mg /g de muscle toutes les 10 minutes, est plus grande que celle prélevée en milieu sans insuline, 1,43 mg/g de muscle pour la même durée. De même, dans un milieu avec insuline, la quantité de glycogène contenue dans le muscle, 2,85 mg/g de muscle après 10 minutes, est plus grande que celle contenue dans le muscle, en milieu sans insuline, 2,45mg/g de muscle. 73 la répartition des apports énergétiques conseillée par les nutritionnistes. Petit déjeuner: thé, cake, céréales, jus d'orange. Déjeuner: demi-avocat, pâtes, viande de mouton, ananas frais, eau. Goûter: deux biscuits, pomme, eau. Dîner: poisson, carottes, pommes de terre, yaourt, orange, pain, eau. Petit déjeuner: 20% Petit déjeuner: 25% Déjeuner: 40% Déjeuner: 30% Goûter: 10% Goûter: 15% Dîner: 30% Dîner: 30% Document 1 Document 2 Document 3 Comparer la répartition des apports énergétiques des aliments consommés par cette personne à celle conseillée par les nutritionnistes. Réponse : Chez cette personne, les apports énergétiques du petit déjeuner 20%, sont plus faibles que ceux conseillés par les nutritionnistes, 25%. Mais, les apports énergétiques 40% du déjeuner, sont plus élevés que ceux qui sont conseillés par les nutritionnistes, 30%. Les apports énergétiques du goûter chez cette personne, 10%, sont plus petits que ceux conseillés 15% mais les apports du dîner 30% sont les mêmes que ceux conseillés par les nutritionnistes. 5- Compléter: Ajouter ce qui manque. Exemple 1 : L’ocytocine est une hormone élaborée par la posthypophyse dont l’activité est sous la dépendance de l’hypothalamus. Cette hormone stimule l’éjection du lait par les glandes mammaires. Pour cela, on dose la concentration d’ocytocine présente dans le sang d’une femelle lactante (brebis ou chèvre) pendant la tétée (succion du lait). Compléter le schéma fonctionnel illustrant le mécanisme de l’éjection du lait, en nommant les structures qui correspondent aux cases numérotées 1, 2 et 3. 1 Succion Agit sur Provoquer Réponse : Message nerveux sensitif Ejection du lait 1 : récepteur sensoriel 2 : hypothalamus 3 : glandes mammaires 74 2 Posthypophyse 3 Ocytocine Exemple 2 : Le document ci-dessous représente le schéma fonctionnel de la transmission du message nerveux au niveau d’une synapse excitatrice. Compléter ce schéma en écrivant l’expression convenable à chacune des cases vides 3 et 5. 1 2 3 4 5 2 3 4 5 Réponse : 1 6- Conclure: Aboutir à une décision. Exemple 1 : Le réflexe myotatique e st une réponse musculaire déclenchée par un stimulus dont le récepteur est le fuseau neuromusculaire. On applique des percussions sur le tendon d’Achille ce qui provoque des étirements de longueur variable du muscle Document1 extenseur du pied. En même temps, on enregistre, pour la même durée, le message nerveux véhiculé le long d’une fibre nerveuse issue du fuseau neuromusculaire de ce muscle. Les résultats figurent dans le document 1. 1- 1.1 Interpréter les enregistrements obtenus. 1.2 Que peut-on en conclure ? Réponses : 1- 1.1 Suite à un étirement faible du fuseau neuromusculaire, 6 potentiels d’action (PA) de 100mV d’amplitude chacun sont enregistrés. Ce nombre augmente à 34 PA, pour la même durée, lorsque l’étirement augmente (étirement fort), tandis que l’amplitude de ces PA reste constante. Alors, la réponse de la fibre nerveuse augmente seulement en fréquence avec l’augmentation de l’intensité du stimulus. 75 1.2 Au niveau d’une fibre nerveuse, le message nerveux est codé en fréquence de P.A et non pas en amplitude. Exemple 2 : On injecte avec une micropipette une certaine quantité d’un neurotransmetteur, l’acétylcholine, au niveau de deux catégories de neurones A et B dont l’état d’activité est différent. On mesure parallèlement la fréquence des potentiels d’action transmis au niveau de ces neurones. Les résultats figurent dans le tableau cidessous. Temps (en secondes) Fréquence des PA Neurones A Neurones B 10 15 20 30 50 3 40 10 30 14 20 14 20 3 40 Injection d’acétylcholine 1- 1.1 Analyser les résultats obtenus. 1.2 Que peut-on conclure quant l’acétylcholine ? Réponses : à l’action de 1- 1.1 Au temps 10 secondes et avant l’injection d’acétylcholine, la fréquence de PA est de 3 au niveau des neurones A et de 40 au niveau des neurones B. Suite à l’injection de l’acétylcholine au temps 15 secondes, la fréquence des PA augmente au niveau des neurones A pour devenir 10 PA, par contre elle diminue au niveau des neurones B pour atteindre 30 PA. Cette fréquence continue à augmenter au niveau des neurones A pour devenir 14 PA et à diminuer au niveau des neurones B pour atteindre 20 PA à t= 20 secondes où elle se stabilise dans les deux types de neurones tant que l’injection dure, jusqu’à 30 secondes. Après l’arrêt de l’injection de l’acétylcholine à t=50 secondes, la fréquence au niveau de chacun de ces groupes de neurones retourne à l’état initial : 3PA, pour les neurones A et 40 PA pour les neurones B. 1.2 l’Ach a une action excitatrice sur les neurones A et une action inhibitrice sur les neurones B. Ou l’acétylcholine a un double effet sur les neurones : excitateur et inhibiteur. 76 7- Déterminer : Aboutir à une décision, à un résultat, …… par un raisonnement logique, par un calcul, … Exemple 1 : La phénylcétonurie est une maladie liée à un déficit en une enzyme hépatique: la PAH responsable de la transformation d’un acide aminé, la phénylalanine, en un autre acide aminé, la tyrosine. En Europe, le risque d’être hétérozygote est de 1/50. Document 1 Le document 1 représente les arbres généalogiques de deux familles, A et B, dont certains membres sont atteints par cette maladie. Les couples (3-4) de la famille A et (1-2) de la famille B, demandent un diagnostic prénatal. 1- Déterminer, par une analyse rigoureuse du pedigree de la famille B, si l’allèle responsable de la maladie est dominant ou récessif et la localisation du gène qui en est responsable. 2- Déterminer, pour chacun des fœtus, le risque d’être atteint par la maladie. Réponses : 1- Le pedigree de la famille B révèle que les parents normaux ont eu une fille et un garçon, tous les deux atteints, ce qui signifie que l’allèle responsable de la maladie se trouve à l’état masqué chez les parents alors, il est récessif. L’allèle ne se transmet pas selon le mode gonosomique car s’il est lié à la partie propre au chromosome Y, le père devrait être atteint et jamais les filles ne le seront, ce qui n’est pas le cas. S’il est lié à la partie propre au chromosome X, la fille malade aurait dû prendre un X porteur de l’allèle malade de son père, ce qui n’est pas le cas. S’il est sur la partie commune à X et Y, le père devrait être atteint pour donner un X portant l’allèle malade à sa fille et un Y porteur du même allèle à son fils, ce qui n’est pas le cas. Alors, l’allèle responsable de la maladie se transmet selon le mode autosomal. 2- Le risque pour le fœtus de la famille A : La mère 3 est saine et sans antécédents familiaux, alors la probabilité d’être hétérozygote est de 1/50 et dans ce cas la moitié de ses gamètes porte l’allèle atteint. Le père 4 est sain mais a un frère malade, alors la probabilité d’être sain hétérozygote est de 2/3 des sains et d’être sain homozygote est de 1/3. S’il est 77 sain homozygote, le risque est nul car il ne peut donner que l’allèle sain à ces enfants s’il est sain hétérozygote, la moitié de ses gamètes porte l’allèle de la maladie. Alors le risque serait 2/3 x ½ x ½ x1/50 =1/300. Le risque pour le fœtus de la famille B : Les parents sont hétérozygotes, alors la moitié de leur gamète porte l’allèle de la maladie et la probabilité d’avoir un enfant atteint est de ½ x ½ = ¼. Alors le risque est de ¼. Exemple 2 : Un expérimentateur connecte deux micro-électrodes, R1 et R2, à un neurone sensoriel d’insecte placé dans un liquide physiologique (document 1). Document 1 L’extrémité sensorielle du neurone est stimulée mécaniquement par des stimuli (St) d’intensité croissante (I1< I2< I3 < I4). Les résultats obtenus sont représentés dans le document 2. Document 2 Déterminer, en se référant au document 2, la forme du codage du message nerveux dans la fibre nerveuse. Réponse : Le nombre de potentiels d’action dans R1 et R2 augmente durant 4ms de 3 PA à 6 PA suite à des stimulations d’intensité supraliminaire, croissante d’I2 à I4 mais, l’amplitude de ces PA reste constante. Alors, on peut dire que le message nerveux au niveau de la fibre nerveuse est modulé en fréquence de PA et non en amplitude. 78 8- Décrire: S’exprimer en utilisant un langage scientifique, pour donner les détails d’une observation, d’une expérience, d’un schéma, d’un appareil, … Exemple 1 : Pour étudier une des caractéristiques de la réponse immunitaire, on réalise l’expérience schématisée dans le document ci-contre. Décrire l’expérience réalisée ainsi que les résultats obtenus. Réponse : Exemple 2 : La soie d’araignée est une protéine plus résistante que l’acier et plus légère que la fibre de carbone. Souple et recyclable, cette protéine intéresse l’homme pour diverses applications : fils de suture pour la chirurgie, prothèses osseuses, gilets anti-balles … Seul inconvénient, l’élevage des araignées est difficile et la production de cette soie est rare. On injecte, au temps t=0, un antigène A à une souris. 7 jours plus tard, on prélève des lymphocytes des ganglions lymphatiques, et on les met dans trois milieux de culture : sans antigène dans le milieu (1), avec un antigène A dans le milieu (2) et avec un antigène B dans le milieu (3). On observe l’absence de prolifération des lymphocytes dans le premier et le troisième milieu de culture et une prolifération des lymphocytes dans le deuxième milieu. Des études sur les glandes mammaires ont montré qu’elles sont similaires aux glandes à soie des araignées, d’où l’idée de transférer le gène de la soie d’araignée à un mammifère, comme la chèvre. Le document ci-dessus révèle la technique de transfert de gène réalisée. Décrire cette technique. 79 Réponse : On extrait le gène de la protéine de la soie d’une cellule d’araignée et on le transfère dans le noyau d’une cellule de peau prélevée d’une chèvre A. D’une autre chèvre B, on prélève une cellule-œuf et on lui ôte le noyau. Puis, on transplante le noyau de A dans la cellule-œuf B et on obtient une cellule-œuf transgénique qui donne un embryon puis une chèvre C transgénique. Le lait produit par cette chèvre contient la protéine de la soie qui, après purification, donne du fil de la soie d’araignée. 9- Démontrer (Montrer que): Prouver qu’une chose est raisonnement logique, par une expérience, par un calcul,… évidente par un Exemple 1 : Au milieu du XXe siècle, deux hypothèses étaient proposées pour expliquer la très grande diversité des anticorps. Première hypothèse : n’importe quel lymphocyte qui rencontre n’importe quel antigène est capable de produire l’anticorps spécifique à celui-ci. Deuxième hypothèse : seuls quelques lymphocytes correspondent à un antigène et sont capables de produire l’anticorps spécifiquement dirigé contre lui. Pour savoir laquelle de ces deux hypothèses est valide, une expérience a été réalisée sur des souris de même souche dont les étapes ainsi que les résultats sont représentés dans le document ci-dessous. Démontrer laquelle de ces deux hypothèses est valide. 80 Réponse : Exemple 2 : La progression de l'obésité infantile dans certains pays est alarmante. De tous les enfants en surpoids ou obèses avant la puberté, 20 à 50% le resteront à l’adolescence. De ces adolescents obèses, 50 à 70% le resteront à l'âge adulte. Le document ci-contre révèle les variations du pourcentage de l’obésité parmi les enfants de 5 à 11 ans dans 2 pays différents X et Y. A la suite d’un contact avec un antigène BSA, les lymphocytes (lot 1) qui proviennent de la souris normale S1, injectés à une souris dépourvue de lymphocytes (S2), ont pu produire des anticorps anti-BSA et ont produit des anticorps anti-BCG après un contact avec l’antigène BCG (S2). Mais ces lymphocytes qui proviennent de la même souris S1 (lot2), mis en présence des mêmes antigènes, ont pu produire des anticorps anti-BCG mais pas des anticorps anti BSA (S3) après leur passage dans la colonne de billes de verre recouverte de l’antigène BSA. On peut dire que la souris S3 n’a pas reçu des lymphocytes spécifiques de l’antigène BSA et que ces derniers sont restés dans la colonne de billes et les autres ont pu traverser cette colonne. Alors, pour chaque antigène, il y a des lymphocytes spécifiques qui produisent des anticorps spécifiques, et non pas n’importe quel lymphocyte qui rencontre n’importe quel antigène est capable de produire l’anticorps spécifique à celui-ci, d’où la deuxième hypothèse est valide. Démontrer que l'obésité infantile est vraiment alarmante. Réponse : De 1960 à l’an 2000, le pourcentage d’obésité infantile a augmenté de 2% à 16% dans le pays X et de 2% à 20%, dans le pays Y. Puisque l’obésité a augmenté dans les deux pays et, comme 20 à 50% de ces enfants resteront obèses jusqu'à l’adolescence et, 50 à 70% de ces adolescents le resteront à l’âge adulte, alors, on peut dire que l’obésité infantile est vraiment alarmante. 81 10- Déduire : Tirer, par un raisonnement logique, une nouvelle information à partir de la donnée ou à partir d’informations existantes. Exemple 1 : Afin de comprendre la ou le s réponses immunitaire(s) déclenchée(s) contre le virus EBV, on suit l’évolution des anticorps anti-VCA et anti-EBNA dirigés respectivement contre deux peptides de surface du virus : VCA et EBNA. Les résultats figurent dans le document ci-contre. Déduire, en se référant au document, que la réponse immunitaire est spécifique au déterminant antigénique. Réponse : Exemple 2 : Dans le cadre de l’étude de la transmission du message nerveux au niveau d’une synapse, on réalise le montage qui figure dans le document 1. On stimule l’axone présynaptique et on effectue des enregistrements grâce à une électrode E placée au niveau de la membrane postsynaptique. Le document 2 révèle les résultats obtenus dans deux cas différents : Comme il y a eu sécrétion de deux anticorps différents, antiVCA et anti-EBNA, pour deux peptides de surface portés par le même virus, on déduit que la réponse immunitaire est spécifique au déterminant antigénique. 1e cas : Une stimulation efficace du neurone présynaptique. 2e cas : Une stimulation efficace du neurone présynaptique précédée d’une injection d’une substance chimique, le curare, dans la fente synaptique. Cette substance a une affinité élevée pour les récepteurs à acétylcholine, neurotransmetteur intervenant dans la synapse neuromusculaire. 82 Document 1 Document 2 Déduire le rôle du curare. Réponse : Suite à l’injection du curare, le PPSE n’a plus été enregistré après la stimulation efficace du neurone présynaptique. On déduit que le curare bloque l’action de l’acétylcholine. 11- Dégager : Tirer d’un ensemble de données, une relation, un rôle, une loi, ... sans faire un raisonnement. Exemple 1 : Pour comprendre le fonctionnement des circuits neuroniques concernés dans le maintien de la posture lors de la danse et comment les muscles interviennent pour maintenir l’équilibre, on réalise l’expérience suivante. On stimule une fibre nerveuse issue d’un fuseau neuromusculaire du muscle extenseur, le triceps sural. Cette stimulation entraîne des modifications de l’état électrique de deux motoneurones, M1 et M2, localisés au niveau de la substance grise de la moelle épinière. Un de ces motoneurones innerve le muscle extenseur et l’autre, le muscle fléchisseur : le jambier antérieur. Le document ci-dessus révèle le montage expérimental et les résultats d’enregistrements. Dégager, du document, l’effet de l’activité des motoneurones sur les muscles concernés. 83 Réponse : Exemple 2 : M1 a envoyé un message excitateur au triceps sural qui se contracte. M2 n’a envoyé aucun message au jambier antérieur qui reste relâché. "Le scorbut est l'une des maladies les plus anciennement connues. Il a été la principale cause de mortalité parmi les équipages des navires. Cette maladie débutait par de la fatigue, elle se manifestait ensuite par des œdèmes des bras et des jambes, puis des saignements de nez et de gencives. Les dents devenaient instables et tombaient. Incapables de se tenir debout, les sujets atteints mouraient d'épuisement ou d'une complication infectieuse respiratoire. En 1593, l'équipage d'un navire anglais en route vers les Indes échappa à la maladie du fait que son capitaine, avait fait absorber chaque jour à ses marins quelques gouttes de jus d'agrumes frais : orange, citron. Le 20 mai 1747, James Lind, médecin britannique, administra six traitements différents à 12 marins scorbutiques répartis par groupe de deux. Six jours après, seuls les marins qui avaient mangé des oranges et des citrons frais étaient guéris. Les analyses montrent que les agrumes sont riches en acide ascorbique. ״ D'après le Docteur C. BINET, Vitamines et vitaminothérapie Dégager à partir du texte, la cause de cette maladie. Réponse : Le scorbut est lié à l'absence d’acide ascorbique se trouvant dans les agrumes frais. 12- Distinguer : Reconnaître une chose d’une autre selon des traits particuliers. Exemple 1 : Distinguer l’anaphase I de l’anaphase II. Réponse : A l’anaphase I, les chromosomes homologues se séparent et chacun, à deux chromatides, migre vers un pôle de la cellule. A l’anaphase II, les deux chromatides d’un même chromosome se séparent et chacune d’elles migre vers un pôle de la cellule. 13- Expliquer: Rendre clair, faire comprendre un phénomène, un résultat, … Exemple 1 : Des lapines sont accouplées avec des mâles stériles de manière à provoquer l’ovulation, puis sont inséminées à l’aide de spermatozoïdes prélevés à différents niveaux de l’appareil génital de lapins adultes dont la fertilité a été préalablement prouvée. Un jour après l’insémination, l’aspect des ovocytes prélevés dans l’oviducte est observé au microscope. Le document ci-contre représente le pourcentage des deux principaux aspects (schémas X et Y) observés en fonction du lieu de prélèvement des spermatozoïdes. 84 Expliquer brièvement les modifications structurales permettant le passage de l’aspect X à l’aspect Y. Aspect des ovocytes prélevés dans les oviductes un jour après l’insémination Lieu de prélèvement des spermatozoïdes Tête de l’épididyme Testicule Partie proximale du corps de l’épididyme Partie distale du corps de l’épididyme Queue de l’épididyme Canal déférent Réponse : X 100% Y 0% 85% 15% 35% 65% 8% 92% Document 1 Le schéma X représente l’ovocyte II bloqué en métaphase II après l’expulsion de son premier globule polaire. Une fois fécondée par un spermatozoïde, cette cellule libère le contenu des granules corticaux pour former la membrane de fécondation et achève la deuxième division méiotique en expulsant le second globule polaire. Les deux pronuclei mâle et femelle se forment, et ainsi le schéma X devient le schéma Y. 14- Identifier : Reconnaître une chose d’après ses caractéristiques ou ses propriétés. Exemple 1 : La myopathie de Duchenne est une maladie dégénérative des fibres musculaires ; elle est due à un gène porté par la partie propre au Document 1 chromosome X. Les garçons atteints de myopathie ne synthétisent pas, ou synthétisent de façon incorrecte, une protéine musculaire, la dystrophine. Le document 1 représente le pedigree d’une famille dont l’un des enfants est malade. 85 Les parents 1 et 2, attendent un enfant et ils souhaitent savoir si leur enfant à naître sera atteint. Ils consultent un médecin. Celui-ci Document 2 leur propose un diagnostic prénatal par la technique de Southern Blot dont les résultats obtenus figurent dans le document 2. Identifier, d’après le document 1 et l’autoradiographie du document 2, l’allèle responsable de la maladie. Réponse : Exemple 2 : On réalise des stimulations d’intensités croissantes sur un neurone présynaptique et on enregistre l’activité électrique des neurones présynaptique et postsynaptique. Le document 1 montre le Document 1 montage expérimental et le document 2 représente les enregistrements obtenus durant un temps donné t. Le garçon 5 est malade de génotype Xm//Y (document 1) et l’autoradiographie (document 2) montre qu’il possède l’allèle dont la taille est de 1,3Kb. Alors, l’allèle responsable de la maladie correspond au fragment de 1,3Kb. Document 2 Identifier le type de synapse mis en évidence. Réponse : Suite à la stimulation du neurone présynaptique, l’activité électrique enregistrée au niveau du neurone postsynaptique, révèle des P.A. indiquant le passage du message nerveux du neurone présynaptique au neurone postsynaptique. Ce qui signifie que la synapse est excitatrice. 86 15- Interpréter: Analyser et donner une signification au résultat. Exemple 1 : Afin d’étudier les caractéristiques du message nerveux, lors d’un réflexe achilléen, avant et après son passage dans la moelle épinière, on utilise le dispositif expérimental Document 1 présenté dans le document 1 et on réalise l’expérience décrite ci-contre. Le dispositif expérimental du document 1 montre l’emplacement des électrodes stimulatrices sur les fibres afférentes et des électrodes réceptrices des différents oscilloscopes. L’oscilloscope O1 permet d’enregistrer l’effet des stimulations sur une ou plusieurs fibres afférentes ; les oscilloscopes O2 et O3 permettent d’enregistrer respectivement, au niveau du cône d’implantation, les réponses électriques des deux motoneurones M1 et M2. L’oscilloscope O4 permet d’enregistrer l’activité électrique au niveau de l’axone du motoneurone M1. On effectue deux stimulations successives efficaces sur une des fibres afférentes Fa1. On fait varier Document 2 le délai entre les deux stimulations. Les résultats enregistrés sur l’oscilloscope O2 sont consignés dans le document 2. Interpréter les résultats du document 2 Réponse : Deux hypopolarisations de même amplitude sont obtenues suite à deux stimulations successives espacées de 16 ms environ ; elles se rapprochent ensuite et se somment pour donner un potentiel d’action de 100 mV d’amplitude lorsque le temps séparant les deux stimulations successives diminue pour devenir 6 ms. Ceci montre que le motoneurone M1 a intégré les messages provenant du neurone afférent Fa1 en effectuant une sommation temporelle des PPSE. 87 Exemple 2 : L’ocytocine est une hormone élaborée par la posthypophyse. Elle stimule l’éjection du lait par les glandes mammaires. Les cellules musculaires des glandes mammaires cultivées in vitro, se contractent sous l’action d’ocytocine ajoutée au milieu. Afin de déterminer le stimulus à l’origine de la sécrétion de l’ocytocine, on dose sa concentration dans le sang d’une femelle lactante (brebis ou chèvre) avant et pendant la tétée (succion du lait) en prélevant 15 ml de sang toutes les 10 secondes. Les résultats de ce dosage figurent dans le document ci-contre. Interpréter les résultats obtenus. Réponse : 10 secondes avant de commencer la succion, la concentration d’ocytocine est de 5 μU/mL. Cette concentration augmente au maximum et atteint 40 μU/mL après 10 secondes de la succion. Puis, elle diminue jusqu’à 5 μU/mL à la 40ième seconde et audelà elle reste constante jusqu'à la 50e seconde malgré que la succion persiste. Ceci montre que la succion stimule la sécrétion d’ocytocine mais son effet est momentané et non durable. 16- Indiquer: désigner quelque chose sans justifier. Exemple 1 : Indiquer la ou les expressions correctes. 1- Les protéines sont de longues chaînes d’acides gras. 2- Les dépenses énergétiques d’un organisme dépendent de l’activité de ses cellules. 3- Pour former l’hémoglobine du sang, l’organisme a besoin de calcium. Réponse : Exemple 2 : Dans le cadre de l’étude de l’hérédité autosomale chez la drosophile, on croise une drosophile de race pure au corps gris, aux yeux rouges et aux ailes bien formées, avec une drosophile de race pure au corps noir, aux yeux pourpres et aux ailes mal formées. On obtient en F1 100% de drosophiles grises, aux yeux rouges et aux ailes bien formées. 2 : Correcte. Indiquer l’allèle dominant et l’allèle récessif pour chacun des gènes étudiés. 88 Réponse : Pour le premier caractère couleur du corps, l’allèle gris est dominant par rapport à l’allèle noir, récessif. Pour le deuxième caractère couleur des yeux, l’allèle rouge est dominant par rapport à l’allèle pourpre, récessif. Pour le troisième caractère aspect des ailes, l’allèle bien formé est dominant par rapport à l’allèle mal formé, récessif. 17- Justifier : Prouver quelque chose comme vrai et réel. Exemple 1 : Le pedigree cicontre représente une famille dont certains membres sont atteints de phénylcétonurie. Justifier que la maladie est récessive. Réponse : Exemple 2 : Les couples (3-4) et (5-6) normaux ont eu respectivement des enfants (7) et (10 et 11) atteints par la maladie. Ceci nous permet de dire que chacun des parents porte l’allèle de la maladie à l’état caché. Alors, l’allèle responsable de la maladie est récessif par rapport à l’allèle normal. "Des médecins ont voulu comprendre ce qui poussait les fumeurs à continuer de fumer. Ils ont placé des rats dans une cage pourvue de deux trous. Quand les rats passent la tête dans l’un des deux trous, rien ne se passe. Quand ils passent la tête dans l’autre trou, ils reçoivent une dose de nicotine. Au début de l’expérience, les rats se dirigent autant vers un trou que vers l’autre puis, peu à peu, ils se dirigent de plus en plus vers le trou à nicotine. L’analyse du tissu cérébral de ces rats, à la fin de l’expérience, montre que des modifications sont apparues : les connexions entre neurones sont plus lâches, de nombreux neurones dégénèrent et moins de neurones ont été renouvelés." Justifier, en se référant au texte et aux connaissances acquises, que la nicotine contenue dans le tabac est une drogue. 89 Réponse : Lors de l’expérience, les rats se sont dirigés de plus en plus vers le trou à nicotine. Alors, la nicotine a modifié le comportement des rats en induisant un état de dépendance. Aussi, la nicotine a agi sur le fonctionnement et le renouvellement des neurones comme la drogue modifie le fonctionnement des neurones et induit un état de dépendance. Alors, on peut dire que la nicotine contenue dans le tabac agit comme une drogue. 18- Préciser : Indiquer et justifier. Exemple 1 : La myopathie de Duchenne est une maladie dégénérative de s fibres musculaires; elle est due à un gène porté par la partie propre au chromosome X. Le document ci-contre représente le pedigree d’une famille dont l’un des enfants est atteint de cette maladie. Préciser les génotypes des parents. Le génotype du père est XN//Y. Le génotype de la mère est XN//Xm. Le père est sain, alors il possède l’allèle N sur son seul chromosome X. La mère est aussi saine, alors elle possède l’allèle N (XN) et possède l’allèle m (Xm) qu’elle a transmis à son fils 5 malade. Réponse : réalise des Exemple 2 : On stimulations d’intensité croissante sur un nerf et sur une fibre nerveuse et on enregistre l’activité électrique de chacun d’eux. Les amplitudes des réponses sont représentées dans les deux documents, 1 et 2. Préciser le document qui correspond à la réponse du nerf et celui qui correspond à la réponse de la fibre. 90 Réponse : Le document 1 correspond à la réponse d’un nerf et le document 2 correspond à celle d’une fibre nerveuse. Car, dans le document 1, l’amplitude de la réponse croît de 0% à 100% avec l’intensité de la stimulation à partir de l’intensité minimale efficace (intensité seuil) 3u.a jusqu’à l’intensité maximale 10 u.a. et dans le document 2, la réponse enregistrée est maximale de 100% quelle que soit l’intensité efficace utilisée au-delà de 3ua. 19- Relever : extraire une ou plusieurs information(s) d’un document. Exemple 1 : Dans le cadre de l’étude de quelques aspects du mécanisme de contrôle de l’activité musculaire durant l’exécution de la danse, des études ont été réalisées et sont résumées dans le document cidessous. Les évolutions d’un danseur s’enchaînent selon des séquences qui ne sont pas toujours prévisibles, car chacun de ses gestes succède à une intention: le corps est utilisé comme instrument d’expression. Mais tout mouvement du corps est entravé par une force qui l’attire vers le sol : la gravité. Pour la maîtriser et trouver son équilibre, le danseur fait intervenir des muscles bloquant certaines articulations et s’opposant à sa chute. La posture est ainsi maintenue grâce à un ajustement constant des commandes musculaires : par exemple à chaque fois qu’un muscle est étiré, il se contracte. Relever du document, une phrase qui justifie la présence d’un réflexe myotatique et une autre, la présence d’une motricité dirigée. Réponse : 1- Réflexe myotatique : chaque fois que le muscle est étiré, il se contracte. 2- Motricité dirigée : certains gestes succèdent à une intention. 91 Exemple 2 : Les riz transgéniques Depuis 5 ans, la production du riz est en chute libre, alors que la population chinoise ne cesse d’augmenter. Les pyrales (insectes) attaquent 75% des rizières chinoises et causent des pertes d’un milliard de dollars par an. Des chercheurs ont mis au point un riz résistant aux insectes empêchant les ravageurs de le digérer. Ce riz transgénique ayant le gène CPTi, prélevé du pois, évitera des milliers de cas d’empoisonnement par les pesticides. Il sauvera aussi les poissons et les crabes qui vivent dans les rizières inondées ; il améliorera la santé des consommateurs chinois qui avalent régulièrement des produits toxiques dans leurs aliments. D’autres riz transgéniques résistants aux herbicides, à la salinité de l’eau ou à la sécheresse, ont été aussi mis au point. Si tous les riziculteurs chinois adoptaient ces riz transgéniques OGM, l’économie en termes de pesticides et de main d’œuvre pourrait s’élever à 4 milliards de dollars par an. Relever du texte : 1-1- L’origine du gène CPTi introduit dans le riz. 1-2- Deux types de riz transgénique. 1-3- L’avantage du riz transgénique sur la santé humaine. Réponses : 1-1- Origine : le pois. 1-2- Le riz transgénique résistant aux insectes et riz transgénique résistant aux herbicides, ou riz transgénique résistant à la salinité de l’eau ou riz transgénique résistant à la sècheresse. 1-3- Evitera des milliers de cas d’empoisonnement par les pesticides. 20- Vérifier : Confirmer par des arguments, par un raisonnement logique, … que quelque chose est vrai ou faux. Exemple 1 : Pour déterminer la cause du diabète juvénile chez l’homme, on réalise sur des rats mutants de même souche, chez qui le diabète apparaît dans les premiers mois de leur vie, les expériences suivantes. 1ère expérience: On Nombre de rats diabétiques prend 100 rats L o t A 5/ 50 mutants, juste à la 30/ 50 naissance. On les Lot B partage en deux lots, A et B. On pratique sur les rats du lot A l’ablation du thymus, organe où les lymphocytes T subissent leur maturation, et on garde le lot B comme témoin. Quelques mois plus tard, on détermine le nombre de rats qui présentent le diabète, document ci-dessus. 2ème expérience: On prend deux lots de rats sains, C et D, non mutants. On injecte les rats du lot C par des LT qui proviennent 92 de rats mutants diabétiques et les rats du lot D, par des LT qui proviennent des rats sains. Seuls les rats du lot C développent un diabète. Vérifier, à partir de ces deux expériences, que les LT des rats mutants sont à l’origine du diabète juvénile. Réponse : Exemple 2 : Un singe à jeun est placé dans une cage munie d’un levier. Lorsqu’il s’accroche à ce levier, il reçoit une injection de drogue. Au bout de quelques heures, le singe appuie de façon répétitive sur le levier. On dose la quantité moyenne de drogue que le singe s’est injecté durant une période de 7 semaines. Les résultats figurent dans le document ci-contre. Le document de l’expérience 1 révèle que l’ablation du thymus, juste à la naissance, chez les rats mutants (lot A), a permis l’apparition du diabète juvénile dans des proportions de 5/50. Mais, chez les rats témoins, 30/50 (inférieur à 5/50) ont été atteints (lot B). Ceci nous permet de dire que le thymus, lieu de maturation des lymphocytes T, est impliqué dans l’apparition du diabète et comme chez le lot A, les LT ne sont pas mâtures, le nombre de rats atteints de diabète a diminué. L’expérience 2 révèle que les rats sains du lot C, injectés par des LT prélevés de rats mutants développent un diabète, alors que les rats sains du lot D, injectés par des LT de rats sains ne développent pas de diabète. Cela signifie que l'apparition de la maladie est liée à la présence des LT des rats mutants. Alors ces deux expériences vérifient que les LT des rats mutants sont à l’origine du diabète juvénile. Vérifier que le singe se trouve dans un état de tolérance par rapport à la drogue. Réponse : La tolérance est l’augmentation de la dose de drogue par l’utilisateur pour obtenir les mêmes sensations de plaisir ressenties avec des doses précédentes plus faibles. L’histogramme révèle que le singe est en train d’augmenter les doses avec le temps, de 5mg/kg/ jour à la 1ère semaine à 70mg/kg/ jour à la sixième semaine et ceci probablement pour obtenir les mêmes effets. Alors, le singe se trouve en état de tolérance. 93