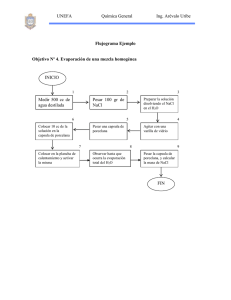
Flúor Cloro Bromo Iodo OBTENCIÓN DE HALOGÉNOS
Anuncio

OBTENCIÓN DE HALOGÉNOS Flúor CaF2 + H2SO4 →CaSO4 + 2HF KF +HF → K[HF2] Ánodo (oxidación) Cátodo (reducción) Electrolisis HF +K[HF2] → H2 + F2 2F- ––> F2 + 2e2H+ + 2e- ––> H2 Cloro H2SO4 + NaCl -----------Æ HCl + NaHSO4 4 HCl + MnO2 ------------Æ MnCl2 + 2 H2O + Cl2 a) electrólisis de disoluciones acuosas de NaCl (proceso cloro-álcali). Electrolisis 2 NaCl + 2 H2O → 2 NaOH + 2 H2 + Cl2 b) electrólisis de NaCl fundido (fabricación de sodio). Electrolisis 2 NaCl −− → Ánodo: Cátodo: 2 Na + Cl2 oxidación: 2 Cl- ( ac) --------------→ Cl2 (g) + 2 ereducción: 2 H2O (l) + 2 e- -----→ 2 OH- (ac) + H2 (g) La reacción global : 2 H2O (l) + 2 Na+ ( ac) + 2 Cl- ( ac) → 2 NaOH + Cl2 (g)+ H2 (g) ∆G(25ºC)=+421,7 kJ mol-1 Reducción 2 H2O (l) + 2 e- → 2 OH- (ac) + H2 (g) Oxidación 2 Cl- ( ac) → Cl2 (g) + 2 e- +1.36V 2 H2O (l) → 4 H+ (ac) + O2 (g) + 4e- + 1.23V Para evitar la oxidación del agua se utiliza en el proceso industrial, ánodos de RuO2 Bromo 2 Br- + Cl2 ---------Æ Br2 + 2 Cl- Iodo 2 IO3- + 6 HSO3- ---------------------Æ 2 I- + 6 SO42- + 6 H+ IO3- + 5 I- + 6 H+ -------------------Æ 3 I2 + 3 H2O IO3- + 2 HSO3--------------------------Æ I2 + 2 SO42La reducción con SO2 o carbón es un camino alternativo: 2 IO3- + 3 SO2 + 3 H2O -----------------Æ 2 I- + 3 SO42- + 6 H+ IO3- + 5 I- + 6 H+ ---------------------------Æ 3 I2 + 3 H2O 4 IO3- + 5 SO2 + 3 H2O --------------------Æ 2 I2 + 6 H+ + 5 SO42-