las meninges duramadre
Anuncio
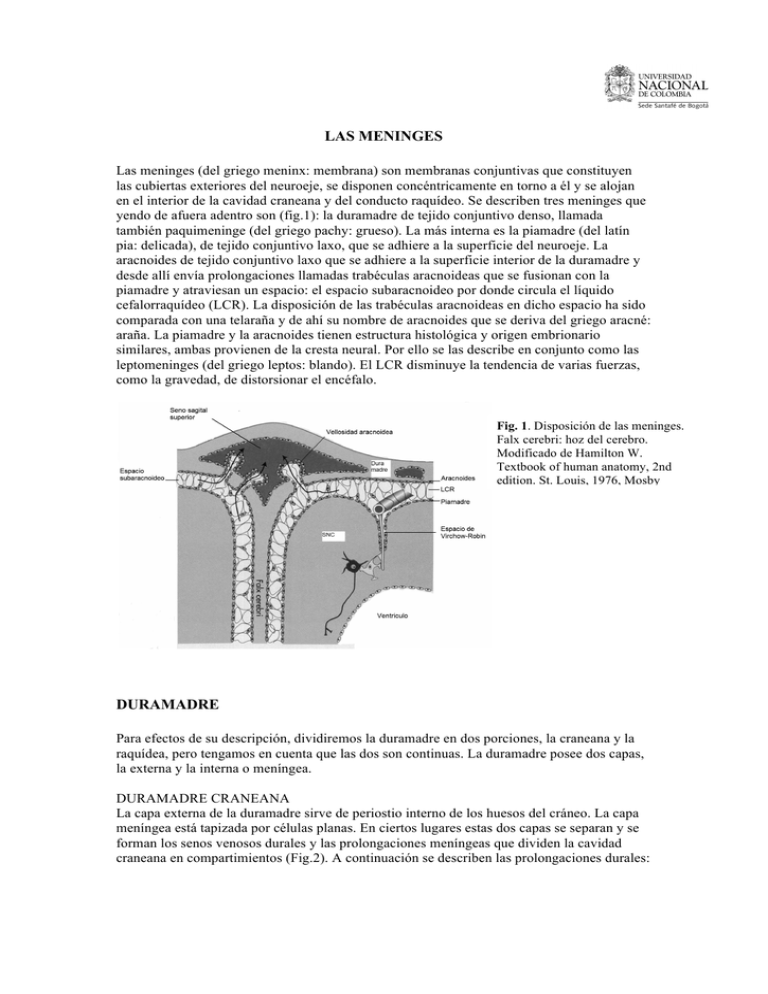
LAS MENINGES Las meninges (del griego meninx: membrana) son membranas conjuntivas que constituyen las cubiertas exteriores del neuroeje, se disponen concéntricamente en torno a él y se alojan en el interior de la cavidad craneana y del conducto raquídeo. Se describen tres meninges que yendo de afuera adentro son (fig.1): la duramadre de tejido conjuntivo denso, llamada también paquimeninge (del griego pachy: grueso). La más interna es la piamadre (del latín pia: delicada), de tejido conjuntivo laxo, que se adhiere a la superficie del neuroeje. La aracnoides de tejido conjuntivo laxo que se adhiere a la superficie interior de la duramadre y desde allí envía prolongaciones llamadas trabéculas aracnoideas que se fusionan con la piamadre y atraviesan un espacio: el espacio subaracnoideo por donde circula el líquido cefalorraquídeo (LCR). La disposición de las trabéculas aracnoideas en dicho espacio ha sido comparada con una telaraña y de ahí su nombre de aracnoides que se deriva del griego aracné: araña. La piamadre y la aracnoides tienen estructura histológica y origen embrionario similares, ambas provienen de la cresta neural. Por ello se las describe en conjunto como las leptomeninges (del griego leptos: blando). El LCR disminuye la tendencia de varias fuerzas, como la gravedad, de distorsionar el encéfalo. Fig. 1. Disposición de las meninges. Falx cerebri: hoz del cerebro. Modificado de Hamilton W. Textbook of human anatomy, 2nd edition. St. Louis, 1976, Mosby DURAMADRE Para efectos de su descripción, dividiremos la duramadre en dos porciones, la craneana y la raquídea, pero tengamos en cuenta que las dos son continuas. La duramadre posee dos capas, la externa y la interna o meníngea. DURAMADRE CRANEANA La capa externa de la duramadre sirve de periostio interno de los huesos del cráneo. La capa meníngea está tapizada por células planas. En ciertos lugares estas dos capas se separan y se forman los senos venosos durales y las prolongaciones meníngeas que dividen la cavidad craneana en compartimientos (Fig.2). A continuación se describen las prolongaciones durales: 1. La hoz del cerebro: es una prolongación vertical, arqueada que ocupa el surco interhemisférico y se extiende desde la apófisis crista galli hasta la protuberancia occipital interna. El borde inferior o libre de la hoz se relaciona con el cuerpo calloso. 2. El tentorio del cerebelo: es una prolongación horizontal que separa la cara superior del cerebelo de los lóbulos occipitales. Se inserta en la cresta superior de la porción petrosa del hueso temporal, cursa por encima del cerebelo y se inserta en el canal horizontal del occipital. Los bordes libres del tentorio forman la incisura tentorial. De esta forma las dos prolongaciones meníngeas dividen la cavidad craneana en un par de compartimientos laterales para los hemisferios cerebrales (compartimientos supratentoriales) y un solo compartimiento posterior (infratentontorial) para el cerebelo y parte del tronco cerebral, conocido como fosa posterior. El mesencéfalo pasa a través de la incisura tentorial. 3. La hoz del cerebelo: es una pequeña prolongación medial, caudal al tentorio. Su borde libre se relaciona con el vermis del cerebelo y se fija en la línea occipital interna. 4. El diafragma de la silla: es una extensión de la duramadre que forma el techo de la fosa pituitaria y que está perforada por el infundibulo. Fig. 2 Prolongaciones durales con los senos venosos que se forman. Los senos venosos durales reciben las venas corticales o superficiales del encéfalo. Estos senos tienen forma triangular en los cortes coronales y están tapizados con endotelio. La duramadre craneana está irrigada principalmente por la arteria meníngea media, rama de la arteria maxilar interna, que penetra en la cavidad craneana por el agujero espinoso y se ramifica sobre la mayor parte de la superficie lateral de la duramadre. La arteria oftálmica da ramas que irrigan la parte anterior de la duramadre y ramas de las arterias vertebrales y occipital irrigan la parte posterior. Las principales estructuras intracraneanas sensibles al dolor son la durmadre y la porción proximal de los vasos sanguíneos en la base del encéfalo. La duramadre supratentorial está inervada por ramas de nervio trigémino, mientras que la duramadre infratentorial recibe inervación de las ramas cervicales superiores y del nervio vago. DURAMADRE RAQUÍDEA La duramadre raquídea o espinal es una membrana única, es decir no tiene el componente perióstico y es continuación de la duramadre craneana. Está separada del periostio de las vértebras por el espacio epidural que contiene tejido graso y plexos venosos vertebrales. La duramadre raquídea se extiende, como un tubo cerrado, desde los bordes del agujero magno hasta la segunda vértebra sacra. La terminación caudal, fondo de saco dural, envuelve el filum terminale y se continúa como ligamento coccígeo que se inserta en el cóccix. ARACNOIDES La aracnoides es una delicada membrana, no vascularizada, formada por varias capas de células planas entremezcladas con fibras de colágeno, localizada entre la duramadre y la piamadre. Está completamente adherida a la capa meníngea de la duramadre y sus prolongaciones trabeculares se extienden desde la aracnoides hasta la piamadre. El espacio entre la aracnoides y la piamadre, que contiene LCR, se conoce como el espacio subaracnoideo. La extensión del espacio muestra variaciones locales, por ejemplo a nivel de la base del encéfalo y alrededor del tronco cerebral la piamadre y la aracnoides se separan formándose así las cisternas subaracnoideas. La de mayor volumen a nivel del encéfalo es la cisterna cerebelo-medular o magna, que se localiza entre el cerebelo y la medula. El LCR del cuarto ventrículo pasa a través de los agujeros laterales y medial a esta cisterna. Se describen otras cisternas de menor tamaño como la cisterna póntica que se localiza alrededor de la cara anterior del puente, la cisterna interpeduncular localizada entre los dos pedúnculos cerebrales, la cisterna quiasmática y la cisterna superior o ambiens. Esta última rodea la parte posterior, superior y lateral del masencéfalo, contiene la gran vena cerebral o de Galeno y las arterias cerebrales posteriores y las cerebelosas superiores. A nivel raquídeo se describe la cisterna lumbar que se extiende desde el cono medular (L1) hasta el fondo de saco dural (S2). Esta cisterna contiene el filum terminale y las raíces nerviosas que forman la cauda equina. Es en esta cisterna de donde se obtiene LCR durante la punción lumbar. En las regiones adjacentes al seno sagital superior, la aracnoides presenta evaginaciones que atraviesan la duramadre y se introducen dentro del seno venoso. Estas prolongaciones denominadas las granulaciones aracnoideas, están constituídas por las vellosidades aracnoideas. A este nivel, no hay tejido conjuntivo aracnoideo y solamente una capa de células aracnoideas y de endotelio vascular constituyen la barrera entre el LCR y la sangre venosa (fig.3). Con el envejecimiento las granulaciones aracnoideas tienden a aumentar en tamaño, en número y a calcificarse (cuerpos de Pacchioni). Modificado de Shabo A, J Neurosurg, 24: 451,1968 Fig.3 Las vellosidades se considera son el sitio principal de drenaje del LCR hacia el sistema venoso. Las granulaciones aracnoideas funcionan como una válvula unidireccional, dependiente de la presión. Esto hace que el LCR solamente se mueva hacia los senos venosos y no en dirección contraria, ya que la presión hidrostática del LCR es mayor que la del seno venoso. Si el gradiente de presión se invierte, como ocurre durante la maniobra de Valsalva, el flujo no. PIAMADRE La piamadre (del latín pia: delicado) está compuesta de una capa interna, la íntima, y de una capa externa la epipia. La íntima, compuesta de fibras elásticas y reticulares, se adhiere a toda la superficie del neuroeje y sigue sus contornos. Las arterias y venas del encéfalo transcurren por el espacio subaracnoideo antes de penetrar en el tejido nervioso. En el lugar donde los vasos sanguíneos penetran o abandonan el neuroeje la íntima se invagina y forma el espacio perivascular (espacio de Virchow-Robins, Fig.-1). La íntima es avascular y deriva sus nutrientes del líquido cefalorraquídeo (LCR) y del tejido nervioso subyacente. La epipia está compuesta de fibras colágenas que se continúan con las trabéculas aracnoideas. La diferenciación de las dos capas no es fácil y por ello algunos autores se refieren al complejo pia-aracnoides. Sobre la superficie lateral de los hemisferios cerebrales no se encuentra epipia. El cordón espinal se ahdiere al tubo dural a través de una serie de prolongaciones o bandas triangulares de la epipia, los ligamentos dentados. La base de cada ligamento se localiza en el cordón lateral, entre las raíces anteriores y dorsales, y sus vértices se unen firmemente a la aracnoides y la superficie interna de la duramadre. Estos ligamentos están presentes a lo largo de todo el cordón espinal. A nivel del cono medular, la epipia forma el filum terminale o hilo terminal, que se confunde caudalmente con el ligamento coccígeo. LIQUIDO CEFALORRAQUIDEO-LCR El LCR es transparente, inoloro, incoloro, contiene proteínas, glucosa, sodio y linfocitos entre 1 a 5 por milímetro cúbico. El LCR permite que el neuroje flote, lo que reduce el peso efectivo a menos de 50 grs. El LCR cumple una función de protección contra los movimientos bruscos y también ayuda a remover metabolitos que potencialmente sean dañinos para el tejido nervioso. Varias hormonas polipéptidas secretadas por el hipotalámo se transportan en el LCR para actuar en sitios remotos del neuroeje. El pH del LCR afecta la ventilación pulmonar y el flujo vascular cerebral. Cerca del 70 % del LCR es secretado por los plexos coroideos localizados en los ventrículos laterales, en el tercero y cuarto ventrículos. El 30 % restante del LCR se deriva del agua producida por el metabolismo. El LCR producido en los ventrículos laterales pasa al tercer ventrículo a través de los agujeros interventriculares y fluye a través del acueducto cerebral al cuarto ventrículo. De allí, el LCR pasa al espacio subaracnoideo a través de los agujeros laterales (en los recesos laterales) y medial (en el velo medular inferior). Una vez en el espacio subaracnoideo el LCR circula y es reabsorbido en las vellosidades aracnoideas. El volumen total del LCR en los ventrículos y el espacio subaracnoideo se estima en alrededor de 140 ml. El LCR se absorbe y se secreta en forma continua. La producción neta de LCR en 24 horas está entre 400 a 500 ml. NEUROANATOMÍA FUNCIONAL La neuroanatomía funcional es el estudio de las “cadenas de neuronas”, llamadas sistemas funcionales que cumplen funciones determinadas en el sistema nervioso. Los sistemas funcionales constituyen dos grupos: I. Un primer grupo posee una porción de la cadena de neuronas en el sistema nervioso periférico (SNP) y otra porción de la cadena en el sistema nervioso central (SNC). En este primer grupo están los sistemas aferentes al neuroeje y los sistemas eferentes de él. Son sistemas aferentes al neuroeje: a. Los sistemas aferentes somáticos, el sistema olfativo, el sistema gustativo, el sistema visual, el sistema auditivo, el sistema vestibular. b. El sistema aferente visceral general, porción aferente del sistema nervioso visceral, vegetativo o autónomo. Son sistemas eferentes del neuroje: II. a. El sistema eferente somático con sus dos porciones: la cortico-espinal (vía piramidal) y la cortico-troncal (cortico-mesencefálica, cortico-póntica y cortico-medular). b. El sistema eferente visceral general con sus dos divisiones: la simpática (toraco-lumbar) y la parasimpática (craneo-sacra). El sistema eferente visceral es la porción eferente del sistema nervioso visceral, vegetativo o autónomo. El segundo grupo se halla fundamentalmente en el SNC, pero posee conexiones con las porciones periféricas de otros sistemas funcionales. En este grupo están los llamados sistemas integradores del neuroeje: el sistema cerebeloso, el sistema extrapiramidal, el sistema reticular, el sistema talámico, el sistema hipotalámico y el sistema límbico. SISTEMAS AFERENTES SOMÁTICOS Los sistemas aferentes somáticos son los encargados de llevar información hacia el SNC proveniente de estructuras somáticas. La información es transportada por medio de algunos pares craneanos y por los pares raquídeos o nervios espinales. Los sistemas somáticos aferentes tienen dos principales componentes: un subsistema (vía) para la detección de estímulos dolorosos (nociceptivos) y térmicos y un subsistema (vía) para la detección de estímulos mecánicos que registran un continuum tacto-presión (tacto superficial, tacto profundo o propioceptivo y vibración). El proceso de identificación de los estímulos se inicia por la activación de una diversa población de somatoreceptores, que con efectividad asombrosa, generan un potencial de acción como respuesta. Hay diferentes clasificaciones de los somatoreceptores, una de las más usadas los subdivide en: 1. Nociceptores para el dolor. 2. Termoreceptores que responden a los cambios de temperatura (calor y frío). 3. Mecanoreceptores que son muy variados y responden a cambios físicos. Dentro de este grupo se incluyen por ejemplo: receptores cutáneos para el tacto, receptores que detectan la longitud y tensión musculares o tendinosas o las vibraciones. Si los receptores están localizados en la piel o en el tejido conjuntivo subcutáneo y responden a estímulos externos, se les denomina exteroceptores. Aquellos localizados en los órganos viscerales se denominan interoceptores o visceroceptores. Los propioceptores son receptores localizados en los músculos esqueléticos, tendones y articulaciones. Los receptores también se clasifican en encapsulados y no encapsulados, dependiendo si hay una cápsula que rodea el extremo distal del nervio aferente (fig.1). Los nociceptores y termoreceptores se hallan en extremidades nerviosas (terminaciones) libres que como su nombre lo indica, están formadas por ramificaciones terminales de las fibras sensitivas sin tejido especializado a su alrededor. Las extremidades nerviosas libres también sirven como receptores para el tacto superficial y profundo. La precisión con la que un estímulo puede ser identificado varía de una región a otra, debido a la diferencia en el número de receptores por área. Por ejemplo los labios y la punta de los dedos de la mano están más densamente inervados que el dorso. fig. 1 Receptor. A: encapsulado (Vater Paccini), B: no encapsulado (extremidad libre) A B La mayoría de los receptores presentan algún grado de adaptación, lo que significa que se tornan menos sensibles cuando el estímulo es sostenido. Los receptores de adaptación rápida o fásicos, presentan una respuesta máxima pero breve, su capacidad de respuesta disminuye si el estímulo se mantiene. Por el contrario, los receptores de adaptación lenta o tónicos, continúan generando impulsos en la medida que el estímulo persista. Los receptores con cápsula en capas son de adaptación rápida. Las neuronas aferentes son pseudomonopolares. El cuerpo se localiza en los ganglios de las raíces posteriores de los nervios espinales o en ganglios de algunos pares craneanos, como el ganglio del trigémino. La prolongación central de las neuronas va del ganglio al neuroeje y la periférica viene de la piel, los músculos esqueléticos, los tendones o las articulaciones hacia el ganglio (fig 2). Las fibras nerviosas periféricas varían en grosor y pueden ser mielinizadas o no mielinizadas. Las fibras más gruesas conducen el impulso nervioso más rápido que las más delgadas o las no mielinizadas. Fig 2 tomado de Kandel E. Principles of Neural Science 4 th ed. McGraw Hill, 2000 Fig.1A Desde el punto de vista de velocidad de conducción las fibras se clasifican en A (α,β,γ,δ), B y C. Las fibras A son mielinizadas y las más rápidas son las Aα, las B corresponden a fibras poco mielinizadas como las viscerales preganglionares y las C son fibras no mielinizadas como las viscerales postganglionares y somáticas para el dolor. Desde el punto de vista microscópico las fibras mielinizadas se clasifican en orden decreciente del grosor en los grupos I, II, III. Las fibras no mielinizadas se clasifican en el grupo IV. VIA DEL DOLOR Y LA TEMPERATURA DEL TRONCO Y EXTREMIDADES El dolor es una sensación compleja, en la que un estímulo nociceptivo lleva no solamente a la percepción del sitio donde se presenta y también desencadena una serie de fenómenos como aumento en los niveles de atención, reacción emocional, respuesta autonómica y una tendencia a recordar el evento y sus circunstancias. En correspondencia a esta complejidad, múltiples vías llevan la información nociceptiva rostralmente desde el cordón espinal. La sensación de dolor tiene varias modalidades de presentación. El dolor superficial que se desencadena a partir de estímulos en la piel y se localiza fácilmente. El dolor profundo que se origina en los músculos esqueléticos, tendones y articulaciones son pobremente localizados. La sensación térmica se puede distinguir en dos modalidades: calor y frío. Los receptores para el frío se activan con T° por debajo de 33 °C y los receptores para el calor aumentan su actividad a T° por encima de 33°C. La mayoría de los nociceptores (receptores para el dolor) y de los termoreceptores (receptores para el calor y el frío) están representados por extremidades nerviosas libres que se continúan con fibras aferentes tipo C y Aδ (poco mielinizadas). La vía del dolor y la vía de la temperatura tienen el mismo curso y para facilitar la descripción de las dos vías, se hará referencia únicamente al dolor. fig.2 Fig. 3 Los cuerpos neuronales de estas fibras se localizan en el ganglio de la raíz dorsal y la porción central se continúa a través de la raíz dorsal hasta penetrar en el cordón espinal, donde las fibras se bifurcan y forman ramas ascendentes y descendentes. Estas fibras transcurren por el tracto de Lissauer y envían colaterales que terminan en las láminas I (zona marginal) y II (sustancia gelatinosa) o en capas más profundas en el asta posterior (fig.3). Tomado de Brodal P. The Central Nervous System, Oxford U Press, 1992 Varias de las fibras que transmiten dolor y temperatura toman parte en diversos tipos de reflejos, por ejemplo: respuestas autónomas y la respuesta de retirada. Otras fibras establecen sinapsis con neuronas cuyos axones forman los fascículos ascendentes para el dolor y temperatura que se describen a continuación. TRACTO ESPINO-TALAMICO VENTROLATERAL (TETVL) fig.4 El TETVL es la principal vía espinal para la conducción de dolor y la T°, aunque sus fibras también llevan información de tacto superficial Los cuerpos de estas neuronas se localizan principalmente en la lámina I y en el núcleo proprio (lámina IV y V). La mayoría de los axones se dirigen adelante y en el mismo segmento o en un segmento adyacente, cruzan por delante del conducto del epéndimo, por la comisura blanca y ascienden por el fascículo antero-lateral (cordón anterior y lateral) en el hemicordón contralateral y forman el TETVL. Fig 4 Tomado de Brodal P. The Central Nervous System, Oxford U Press, 1992 Las fibras que se cruzan en segmentos superiores o rostrales van ocupando porciones internas del fascículo, esto provee una organización somatotópica en el sentido que las porciones inferiores del cuerpo están representadas lateralmente y las superiores medialmente. El TETVL asciende hacia el tronco cerebral, se localiza dorsolateral a la oliva y al lemnisco medial. Las fibras del TETVL terminan somatotópicamente organizadas en el núcleo ventralposterior y lateral (VPL) del tálamo. Los núcleos intralaminares del tálamo también reciben terminaciones del TETVL (fig.4). La destrucción del TETVL produce analgesia contralateral. Del tálamo proyecciones tálamo-corticales se distribuyen en la corteza somatosensorial (cirvunvolución post-central) y se organizan en forma somatotópica (fig.4). TRACTO ESPINO-RETICULAR Las fibras del TETVL están acompañadas por fibras que terminan en la formación reticular del tronco cerebral y constituyen el tracto espino-reticular. Este tracto formado por fibras cruzadas y directas, está relacionado con varios reflejos y representa una conexión con los núcleos intralaminares del tálamo. TRACTO ESPINO-MESENCEFALICO Las fibras del TETVL también están acompañadas por fibras que terminan en los colículos superiores, en la sustancia gris periacueductal y en los núcleos del rafé del mesencéfalo. Estos dos últimos tienen relación con el sistema inhibitorio del dolor, dan origen a fibras descendientes y vías polisinápticas que terminan en los cordones posteriores. VIA DEL DOLOR Y TEMPERATURA DE LA CARA La información del dolor y temperatura se transmite a través de los componentes del nervio trigémino, es decir, de sus ramas V1 (oftálmica), V2 (maxilar) y V3 (mandibular). Los cuerpos de las neuronas están localizados en el ganglio del trigémino y sus prolongamientos centrales terminan en el núcleo espinal del trigémino, en la medula y porción superior del cordón espinal. Fibras nerviosas que acompañan el VII, IX y X pares craneanos y que provienen del oído externo, oído medio, faringe, laringe, parte posterior de la lengua y del esófago también terminan en el núcleo espinal del trigémino. Del núcleo espinal del trigémino, se originan fibras que se cruzan, forman el lemnisco trigeminal y ascienden hasta alcanzar el núcleo ventral-posterior y medial (VPM) del tálamo y los núcleos intralaminares del tálamo (fig.5). Del los núcleos talámicos se originan fibras que constituyen las proyecciones tálamocorticales. Estas proyecciones contienen fibras nociceptivas que terminan en la circunvolución postcentral (corteza somatosensorial) y en giro del cíngulo. Fig. 5 Tomado de Brodal P. The Central Nervous System, Oxford U Press, 1992 fig.4 Fig. 5 VIAS DESCENDENTES QUE REGULAN EL DOLOR En las últimas décadas se ha prestado atención a los mecanismos intrínsecos de inhibición del dolor, especialmente a las proyecciones descendentes que se originan en la sustancia gris periacueductal y núcleos reticulares adyacentes. La sustancia gris periacueductal recibe información nociceptiva a través del fascículo espinomesencefálico, del hipotálamo y áreas corticales cerebrales relacionadas con el comportamiento. Eferencias a partir de este núcleo terminan en el núcleo rafé magno (en la medula y porción caudal del puente) y núcleos reticulares del puente. Las fibras descendentes que se originan del núcleo reticular póntico dorsolateral poseen noradrenalina, mientras que las originadas en el núcleo magno poseen serotonina. Estas fibras terminan en el asta posterior en el cordón espinal, particularmente en la lámina II, donde ejercen su actividad inhibitoria. Los receptores opiáceos se encuentran en abundancia en la sustancia gris periacueductal, el núcleo magno y en las láminas de las astas posteriores. Las sustancias endógenas que interactúan con los receptores opiáceos son varios, entre ellos se incluyen encefalinas y dinorfinas. VIA DEL TACTO PROFUNDO DEL TRONCO Y EXTREMIDADES El tacto es la experiencia de un estímulo suave sobre la piel, pero cuando los receptores profundos de la piel son activados se origina la sensación de presión. El tacto y la presión se pueden considerar como un continuum de acuerdo con la intensidad del estímulo. La vía del tacto profundo está involucrada en la percepción y apreciación de los estímulos mecánicos. A través del tacto profundo tenemos capacidad para discriminar la forma (estereognosia), textura, movimiento y el sentido de posición de nuestro cuerpo en el espacio (propiocepción). La vibración (palestesia) se origina ante estímulos oscilantes como al colocar un diapasón sobre la superficie de una articulación. El propósito de los propioceptores es principalmente dar información detallada y continua del sentido de posición de las extremidades en reposo (estático) y durante el movimiento (cinético). En contraste con los receptores del dolor y la temperatura que están representados en su mayoría por extremidades libres, los receptores relacionados con el tacto profundo, vibración y propiocepción, además de hallarse en extremidades libres, son encapsulados y no son tan especializados. Los receptores para la presión están representados por los cilindros terminales, corpúsculos táctiles, discos contráctiles, corpúsculos lamelares y los receptores en los folículos pilosos (arborizaciones peritraquiales). La vibración está mediada por los corpúsculos de Paccini. El sentido de posición depende de varios propioceptores localizados en las articulaciones, los tendones y en los músculos (husos neurotendinosos y neuromusculares). Los cuerpos de las neuronas relacionadas con estos receptores están localizados en los ganglios de las raíces dorsales, sus prolongamientos centrales, formados por fibras Aα, continúan por las raíces posteriores, penetran en el cordón posterior, donde se dividen en ramas ascendentes y descendentes, ambas contienen colaterales que sinapsan con varios grupos de células en el cordón espinal. La mayoría de las ramas ascendentes entran al cordón espinal ipsolateral y forman los fascículos grácil y cuneatus. El fascículo grácil lleva información de la extremidad inferior y de la parte inferior del tronco, mientras el fascículo cuneatus lleva información de la parte superior del tronco y la extremidad superior ipsolateral. Estos fascículos terminan en la medula en forma somatotópicamente organizada en los núcleos(tubérculos) grácil y cuneatus. A partir de estos núcleos, se originan fibras que se cruzan para formar el lemnisco (del griego lemniskos: cinta) medial contralateral. Las fibras que se cruzan forman la decusación del lemnisco medial, localizada justamente por encima de la decusación de las pirámides. (fig.5) El lemnisco medial está localizado inicialmente en la línea media, pero a medida que asciende se ubica más lateral, hasta alcanzar el núcleo VPL del tálamo. Fibras colaterales de los cordones posteriores, que llevan información proprioceptiva de la extremidad inferior del mismo lado, terminan en las neuronas del núcleo de Clarke (T1L1/2). A partir de este núcleo se proyectan fibras al cordón lateral del mismo lado y forman el tracto espinocerebeloso dorsal que penetra al cerebelo por el pedúnculo cerebeloso inferior y termina en el hemisferio y vermis cerebeloso ipsolateral. Del tálamo se proyectan fibras a la corteza somatosensorial y lo hacen en forma topográficamente organizada. Fig. 6 Via del tacto profundo de la cara. fig.5 Tomado de Brodal P. The Central Nervous System, Oxford U Press, 1992 Se han descrito vías adicionales para la transmisión del tacto profundo como la vía del tacto superficial y en menor grado la del dolor. Una ruta consiste en fibras que se originan en el asta posterior, ascienden por la porción posterior del cordón lateral (fascículo dorsolateral) y terminan en el núcleo grácil. Estas fibras llevan información proprioceptiva de la extremidad inferior. VIA DEL TACTO PROFUNDO DE LA CARA Las fibras responsables del sentido de posición en la cara, de los músculos masticadores y ligamentos periodontales poseen un cuerpo pseudomonopolar dentro del neuroeje, específicamente en el núcleo mesencefálico del trigémino (fig.6), la porción central de estas neuronas envía colaterales al núcleo motor del trigémino, al núcleo principal (póntico) y espinal del trigémino, a los núcleos de la formación reticular y al cerebelo. De este núcleo se originan fibras que se cruzan y forman el tracto trigémino-talámico (lemnisco trigeminal) que se dirige al NVP del tálamo. Las fibras del lemnisco medial y del tracto trigeminotalámico terminan somatotópicamente organizadas en los núcleos VPL y VPM respectivamente. Del tálamo y guardando la misma organización, se proyectan fibras talamocorticales, que ascienden por el brazo posterior de la cápsula interna y terminan en la corteza somatosensorial. El SISTEMA NERVIOSO VISCERAL El sistema nervioso visceral (autónomo o vegetativo) es el sistema funcional formado por las cadenas de neuronas que inervan las vísceras (estructuras corporales periféricas viscerales). Dentro del sistema nervioso visceral hay dos subsitemas: 1. El sistema nervioso aferente visceral encargado de recoger información en las vísceras para llevarla al sistema nervioso central. 2. El sistema nervioso eferente visceral encargado de llevar a las vísceras la respuesta del sistema nervioso central ante la información recibida. El sistema nervioso visceral provee el control neuronal del músculo liso, el músculo cardiaco y las secreciones glandulares exocrinas principalmente. El sistema nervioso eferente visceral tiene dos componentes (divisiones): el simpático (toraco-lumbar) y el parasimpático (cráneo-sacro) que en general tienen influencias sobrepuestas y antagónicas sobre las vísceras que inervan. Las estructuras viscerales que constituyen la pared de las cavidades y las de las extremidades solamente reciben inervación simpática. La inervación simpática tiene una distribución global ya que inerva las estructuras viscerales en todas partes del cuerpo, mientras que la inervación parasimpática inerva únicamente las estructuras viscerales de la cabeza y las cavidades torácica, abdominal y pélvica. Los sistemas visceral aferente y eferente están constituidos por estructuras nerviosas que pertenecen al sistema nervioso periférico (SNP) y al sistema nervioso central (SNC). A nivel periférico se encuentra los ganglios (aferentes y eferentes) y las fibras (aferentes y eferentes). A nivel central se encuentra los núcleos en tronco cerebral, que contienen las neuronas preganglionares (parasimpáticas) y las láminas a nivel del cordón espinal que contienen las neuronas preganglionares (simpáticas y parasimpáticas), además fascículos que cursan dentro del neuroeje y llevan información visceral. Diferentes tipos de información sensitiva es integrada dentro del SNC por una serie que constituyen la red autonómica central (central autonomic network-CAN). Esta red genera información que integra el sistema visceral motor, el sistema endocrino y el sistema somático eferente. Aunque la actividad visceral motora está generalmente mas allá del control voluntario, el estado emocional y la actividad mental tienen influencia sobre el sistema visceral. En consecuencia, la CAN integra información de centros superiores a nivel del SNC (sistema hipotalámico y límbico) involucrados en funciones cognitivas y de comportamientos complejos. A. ORGANIZACIÓN DEL SISTEMA VISCERAL EFERENTE (MOTOR) El sistema simpático y parasimpático constituyen la vía final eferente, que se origina en el SNC y termina en los efectores viscerales. Esta vía está formada por dos grupos de neuronas: 1. Las neuronas preganglionares que poseen el cuerpo en el tronco cerebral o en el cordón espinal y sus axones que se proyectan como fibras mielinizadas (preganglionares) a los ganglios simpáticos (cadena paravertebral y ganglios prevertebrales) y ganglios parasimpáticos. 2. Las neuronas postganglionares tienen su cuerpo en los ganglios autonómicos y envían los axones no mielinizados (fibras postganglionares) a las células efectoras viscerales. En general los ganglios parasimpáticos se localizan cercanos al órgano efector y los ganglios simpáticos cerca al SNC. En consecuencia el sistema parasimpático tiene fibras preganglionares largas y postganglionares cortas, mientras que el simpático posee, con mayor frecuencia, fibras preganglionares cortas y postgangionares largas. Las ramas terminales de las fibras postganglionares poseen una serie de vesículas, que le dan apariencia varicosa, que contienen los neurotransmisores. Los cuerpos de las neuronas preganglionares se originan de la porción basal del neurotubo, mientras que los cuerpos de las neuronas localizadas en los ganglios se derivan de la cresta neural. 1. DIVISIÓN SIMPATICA LAS NEURONAS PREGANGLIONARES Las cuerpos de las neuronas preganglionares simpáticas se localizan en el cordón espinal entre los segmentos T1 a L2 (en algunas ocasiones en C8 y L3) a nivel de la lámina VII de Rexed, principalmente en el núcleo intermediolateral de las astas laterales. Los prolongamientos axonales toman las raíces ventrales y abandonan los nervios espinales como ramos comunicantes blancos y se dirigen a los ganglios de las cadenas paravertebrales. Una vez en los ganglios, las fibras preganglionares pueden: 1. Hacer sinapsis, al mismo nivel, con las neuronas postganglionares cuyos axones no mielinizados (ramos comunicantes grises) se unen de nuevo al nervio espinal. 2. Ascender o descender en la cadena paravertebral para hacer sinapsis con neuronas postganglionares localizadas en otros ganglios de la cadena. 3. Atravesar la cadena ganglionar paravertebral, sin hacer sinapsis y continuarse como nervios esplácnicos e inervar los ganglios prevertebrales y las células cromafines en la medula suprarrenal. Los ganglios cervicales superior, medio e inferior reciben neuronas preganglionares de los segmentos torácicos superiores del cordón espinal. Los ganglios lumbares inferiores y sacros están suplidos por neuronas preganglionares provenientes de los segmentos torácicos inferiores y lumbares superiores. Los ganglios entre estos dos grupos reciben información de los segmentos torácicos del nivel correspondiente. Las neuronas preganglionares que inervan la glándula suprarrenal también se dirigen a la glándula suprarrenal estimulan la secreción de catecolaminas (principalmente adrenalina) en el torrente sanguíneo. De esta manera el sistema simpático, a través de esta vía endocrina, regula funciones de células que no están directamente conectadas por las terminaciones nerviosas. LOS GANGLIOS SIMPATICOS Y LAS NEURONAS POSTGANGLIONARES Los cuerpos de las neuronas postganglionares se agrupan en ganglios localizados en la cadena ganglionar paravertebral y los ganglios prevertebrales. La cadena simpática paravertebral, constituida por ganglios que se localizan a cada lado de los cuerpos vertebrales, se extiende a lo largo de toda la columna vertebral. El número de ganglios no corresponde con el número de nervios espinales, hay 3 ganglios cervicales, 10-11 torácicos, 3-5 lumbares y un solo ganglio (ganglio impar) coccígeo donde las dos cadenas se unen caudalmente. El ganglio cervical inferior y el primer torácico se fusionan y forman el ganglio estrellado. Los ganglios paravertebrales se conectan con los nervios espinales a través de los ramos comunicantes blancos y grises. Los primeros contienen fibras preganglionares mielinizadas y los segundos están compuestos de fibras postganglionares no mielinizadas. Con base en lo anterior, se puede deducir que solamente los nervios espinales T1 a L2 poseen ramos comunicantes blancos, mientras que cada nervio espinal está conectado con la cadena simpática por los ramos comunicantes grises que llevan axones postganglionares. De los ganglios paravertebrales se originan fibras postganglionares que toman dos vías: 1) Algunas se unen a los nervios espinales a través de los ramos comunicantes grises e inervan los vasos sanguíneos de los músculos y la piel, las glándulas sudoríparas y los músculos piloerectores de la pared toracoabdominal y las extremidades. La distribución de esas fibras simpáticas es similar a la que corresponde a los nervios somáticos. Estas estructuras no reciben innervación parasímpatica, por lo que la inervación dual no se presenta. La inervación simpática de la extremidad superior se origina del ganglio estrellado y las fibras cursan con el nervio mediano y ulnar. La inervación simpática de las extremidades inferiores se origina en los ganglios lumbares paravertebrales y las fibras acompañan los nervios tibiales y peroneros. 2) La otra vía está constituida por fibras postganglionares que se originan de la cadena cervical y torácica superior e inervan el corazón, el esófago y el tracto respiratorio. Estas fibras postganglionares junto con ramas del nervio vago, forman plexos localizados en la proximidad de cada órgano. Las fibras postganglionares que se originan del ganglio cervical superior inervan vasos sanguíneos y estructuras que corresponden a los territorio de los primeros cuatro nervios cervicales (cara, cuero cabelludo, cuello), además inervan las glándulas salivares, nasales, lacrimales, los músculos tarsales superior (Müller) e inferior y el músculo dilatador de la pupila. Los ganglios prevertebrales se relacionan con la aorta abdominal o sus ramas principales (ganglio celíaco, aorticorenal, mesentérico superior y mesentérico inferior) y reciben fibras preganglionares que forman los nervios esplacnicos. En general, las fibras postganglionares que se originan de cada uno de estos ganglios, inervan las mismas estructuras viscerales que la rama de la aorta correspondiente. De tal manera que las fibras postganglionares que se originan del ganglio celíaco, acompañan la arteria celíaca e inervan el bazo y estructuras derivadas del intestino anterior, las que se originan del ganglio aorticorenal acompañan las arterias renales e inervan los vasos del riñón, las que se originan del ganglio mesentérico superior acompañan la arteria mesentérica superior e inervan estructuras viscerales que provienen del intestino medio, y las neuronas que se originan del ganglio mesentérico inferior se proyectan a estructuras que se derivan del intestino posterior, la vejiga, la uretra y los órganos reproductores. Las neuronas preganglionares se ramifican y hacen sinapsis con múltiples neuronas postganglionares, por consiguiente estas neuronas son divergentes. El número de neuronas postganglionares excede el número de las preganglionares en una relación 100:1. Cada neurona postganglionar hace sinapsis con varias preganglionares, de tal forma que hay considerable convergencia a nivel de los ganglios simpáticos. Los ganglios prevertebrales constituyen un complejo de procesos nerviosos ya que no solamente terminan allí fibras preganglionares, también reciben colaterales del sistema aferente visceral y de neuronas locales. Estas conexiones indican un alto grado de integración en los ganglios prevertebrales. Aunque todas las neuronas preganglionares son colinérgicas, algunas expresan uno o más neuropéptidos, como sustancia P y encefalinas. Fenómeno similar ocurre con las neuronas postganglionares, ya que la mayoría de ellas expresan noradrenalina como neurotransmisor, pero algunas son colinérgicas. Estas últimas proveen inervación a las glándulas sudoríparas y posiblemente a los músculos piloerectores y arteriolas de la piel y músculo. Adicionalmente las neuronas postganglionares expresan gran variedad de neuropéptidos como el neuropéptido Y. Este péptido tiene múltiples efectos que incluyen la estimulación del músculo liso vascular, potencia los efectos de la adrenalina y paradójicamente, inhibe de la liberación de noradrenlaina. Los efectos de la noradrenalina, el principal neurotransmisor de las neuronas postganglionares, y de la adrenalina, la principal hormona de la medula suprarrenal, varía de acuerdo al tipo de receptor con el que interactúan (α,β). Por ejemplo, los receptores α1 en el músculo liso vascular median vasoconstricción, mientras que la activación de los β2 producen relajación del músculo liso, responsable de la vasodilatación, broncodilatación y relajación de las vísceras incluida la vejiga. El aumento en la frecuencia cardiaca y el volumen de eyección son mediados por receptores β1 del músculo cardíaco. La adrenalina es un ligando más potente que la noradrenalina en la mayoría de los receptores α y β, en consecuencia la adrenalina se utiliza para contrarrestar los síntomas del shock anafiláctico, incluido el broncoespasmo y el colapso cardiovascular. ASPECTOS FUNCIONALES El sistema simpático produce respuesta masiva en situaciones estresantes o extremas, en las que se presenta aumento en la frecuencia cardiaca, la presión arterial, en el flujo sanguíneo a los músculos esqueléticos, en la sudoración, en los niveles de glucosa sanguínea y en el diámetro pupilar. Al mismo tiempo hay disminución en el peristaltismo y en el flujo sanguíneo hacia las vísceras abdominales y la piel. En situaciones no extremas, la respuesta simpática es selectiva, por ejemplo, la inervación simpática de los vasos de la piel está influenciada por la temperatura y la estabilización del flujo sanguíneo hacia la cabeza durante movimientos de incorporación desde el decúbito es una función de la división simpática. La causalgia (síndrome regional doloroso complejo tipo II), es un síndrome que resulta de lesión parcial de un nervio periférico que usualmente inerva una extremidad. Se caracteriza por dolor tipo ardor, hiperestesia, dolor desencadenado por el ruido o las emociones fuertes, sudoración y disminución de la temperatura y edema de la extremidad. Una característica de esta condición es que la simpatectomía o el bloqueo de la actividad simpática, alivia los síntomas. 2. DIVISION PARASIMPATICA LAS NEURONAS PREGANGLIONARES En comparación con el sistema simpático, la división parasimpático es más restringido en su distribución. Los cuerpos neuronales de las neuronas preganglionares se localizan en los segmentos sacros S2-S4 o en núcleos del tronco cerebral cuyas prolongaciones axónicas acompañan los pares III, VII, IX y X. Con base en esta distribución el sistema parasimpático se conoce como la división craneosacra y se distingue de la división toracolumbar o simpática. VIAS PARASIMPATICAS Las fibras preganglionares que acompañan el nervio oculomotor se origina en el núcleo Edinger-Westphal y termina en el ganglio ciliar. Las fibras postganglionares inervan el músculo iris (para la constricción pupilar) y el músculo ciliar (para acomodación de la visión cercana). Las fibras parasimpáticas que acompañan el nervio facial se originan en el núcleo salivatorio superior y forman el nervio intermedio o de Wrisberg. Algunas toman el nervio petroso mayor para terminar en el ganglio pterigopalatino (esfenopalatino) y las fibras postganglionares suplen los vasos sanguíneos y las glándulas de la cavidad nasal y el paladar, la glándula lacrimal y los vasos sanguíneos del ojo. Las otras fibras preganglionares que acompañan el nervio facial, cursan con el nervio cuerda del tímpano al ganglio submandibular y las postganglionares inervan las glándulas sublinguales y submandibulares. El nervio glosofaríngeo contiene fibras preganglionares que se originan del núcleo salivatorio inferior. Estas fibras tienen un curso tortuoso, acompañan el nervio cuerda del tímpano y forman el nervio petroso menor que termina en el ganglio ótico. Las fibras postganglionares se unen al nervio auriculotemporal hasta alcanzar la glándula parótida. El componente eferente visceral del nervio vago provee inervación parasimpático a los órganos de las cavidades torácica y abdominal. La mayoría de las fibras preganglionares se originan en el núcleo motor dorsal del vago, otras en el núcleo ambiguo, acompañan el nervio en su recorrido y hacen sinapsis con plexos nerviosos en la pared de las vísceras (ganglio terminal o intramural) que se mezclan con neuronas del sistema nervioso entérico. Es decir, las neuronas postganglionares del nervio vago no se agrupan en ganglios , como ocurre con los pares precedentes. El nervio vago controla diferentes efectores en cada órgano y dos vías vagales independientes con efectos opuestos pueden controlar un órgano en particular. El nervio vago derecho y las fibras simpáticas inervan predominantemente el nodo sinusal y el nervio vago izquierdo y las fibras simpáticas el nodo atrioventricular. El nervio vago izquierdo inerva la parte anterior y superior del estómago y el nervio vago derecho la superficie posterior e inferior. El componente sacro de la división parasimpática inerva la porción distal del tubo digestivo (desde la flexura cólica izquierda), la vejiga, la uretra y los órganos reproductores. Los cuerpos de las neuronas preganglionares se localizan entre los segmentos S2-S4, en el núcleo parasimpático sacro (NPS) localizado en las láminas V a VII. El NPS contiene además interneuronas y neuronas de tractos espinales que se proyectan a otras regiones del cordón espinal, el tronco cerebral y el hipotálamo. Las fibras preganglionares abandonan el cordón espinal por las raíces anteriores y forman los nervios pélvicos (erigentes). Estos nervios se mezclan con las fibras simpáticas del plexo hipogástrico para formar el plexo visceral pélvico lateral al recto, la vejiga y el útero. ASPECTOS FUNCIONALES Las fibras preganglionares parasimpáticos, al igual que las simpáticas, utilizan acetilcolina como su principal neurotransmisor. Las fibras postganglionares parasimpáticos también son colinérgicas. Tanto las fibras preganglionares como las postganglionares, además de acetilcolina, liberan otros neuropéptidos como el péptido intestinal vasoactivo, que actúa como modulador de la acetilcolina. Se describen dos tipos de receptores para la acetilcolina: los nicotínicos y los muscarínicos. Los receptores nicotínicos están distribuidos en los músculos esqueléticos y en las sinapsis colinérgicas en los ganglios y a nivel del sistema nervioso central. Los receptores muscarínicos están involucrados en la respuesta del músculo liso, músculo cardíaco y células glandulares. La naturaleza de la respuesta depende de que tipo de receptor se expresa (M1, M2, etc.). Por ejemplo, la estimulación parasimpática de la secreción gástrica está mediada por receptores M1, mientras que los receptores M2 median la respuesta parasimpática depresora del músculo cardiaco. La acetilcolina produce vasodilatación a través de los receptores M3, estos receptores se localizan en el endotelio y activan la producción de óxido nitrico. Tabla 1. Resumen y comparación de algunas de las funciones que cumplen tanto el sistema simpático como el parasimpático. PROCESO FISIOLOGICO Diámetro de la pupila Refracción del lente Lacrimación Salivación Piloerección Sudoración Flujo sanguíneo periférico Flujo sanguíneo músculo esquelético Frecuencia cardiaca Resistencia vascular periférica Diámetro bronquial Peristaltismo Secreción tubo digestivo (TD) Tono de esfínteres TD Flujo vascular TD Glucogenolisis hepática Secreción insulina pancreática Tono del detrusor Tono del esfínter uretral Erección peneana/ clítoris Eyaculación Estimulación simpática + 0 0 – + + – ± + + + – – + – + – – + 0 + Estimulación parasimpática – + + + – – 0 0 – – – + + – + 0 + + ± + 0 Tabla 2 Aspectos neurofuncionales del sistema parasimpático Nervio Neuronas pregangliona res Oculomoto r Mesencéfalo: núcleo E-W Facial Glosofarín geo Vago Pélvico Curso de las fibras pregangliona res III par Ganglio de las neuronas postgangliona res Ciliar Puente: núcleo salivatorio sup. VII par, nervio intermedio Pterigopalatin oy submandibular Medula: núcleo salivatorio inf. Medula: núcleo motor dorsal X IX par Otico X par Pared de la víscera Segmentos S2-S4 Nervio pélvico Pared de la víscera Organo blanco Efecto Músculo ciliar e iris Glándulas lacrimal, nasal, mandibula ry sublingual Glándula parótida Contracción Corazón, grandes vasos, sistema respiratori oy digestivo Colon, aparato urinario y reproducti vo Bradicardia, broncoconsticc ión, aumento peristaltismo y flujo sanguíneo vísceras digestivas Aumento secreción Aumento secreción B. ORGANIZACIÓN DEL SISTEMA AFERENTE VISCERAL El sistema nervioso visceral aferente está formado por nervios periféricos constituidos por neuronas pseudomonopolares cuyos cuerpos se localiza en los ganglios aferentes craneales (superior e inferior de los pares IX y X) y los ganglios de las raíces dorsales de los pares raquídeos. El prolongamiento periférico de las neuronas aferentes ganglionares viscerales tiene en su extremo distal los receptores viscerales (visceroceptores o interoceptores) y el prolongamiento central termina en la sustancia gris del neuroeje haciendo sinapsis con el núcleo solitario (fibras aferentes viscerales de los nervios IX y X) y las astas posteriores del cordón espinal (fibras aferentes viscerales de los nervios raquídeos o espinales). El prolongamiento periférico de las aferencias espinales hace parte de los nervios esplácnicos. Las aferencias viscerales llevan información de eventos mecánicos o químicos, que son trasportados por el sistema aferente visceral para producir sensaciones viscerales concientes (incluido el dolor) e iniciar reflejos viscerales y respuestas neuroendocrinas. Debido a la diversidad de conexiones, el núcleo solitario es la estructura del tronco cerebral más importante en coordinar las funciones autonómicas. Este núcleo recibe aferencias generales y especiales y se proyecta al núcleo motor dorsal del vago, los núcleos salivatorios y reticulares que a su vez se proyectan a neuronas preganglionares simpáticas, además el núcleo solitario tiene conexiones recíprocas con otros componentes del CAN. El reflejo baroreceptor funciona como regulador de la presión arterial cuando se producen cambios súbitos de posición. Los mecanoreceptores en el seno carotídeo y aórtico envían información a través del IX y X pares respectivamente, que termina en el núcleo solitario. Las proyecciones de las neuronas del núcleo solitario influyen sobre la actividad tónica parasímpatica (vagal) hacia el corazón y simpática hacia el corazón y los vasos periféricos. Cuando un individuo pasa de la posición supina y se incorpora súbitamente, hay una reducción en la descarga de los baroreceptores, que resulta en disminución de la señales que se originan en el núcleo solitario. Esto lleva a una disminución en la estimulación del núcleo motor dorsal del vago y disminución en la inhibición que el núcleo solitario ejerce sobre las neuronas del núcleo vasopresor (ventrolateral de la medula), lo que resulta en aumento del influjo simpático (aumento en la frecuencia cardíaca y aumento en la resistencia vascular de las vísceras y músculos esqueléticos). La disminución en la PO2 y PCO2 es detectada por los cuerpos carotídeos y aórticos y transmitida hacia el núcleo solitario por el IX y X pares respectivamente. Dentro de la medula la vía refleja para los efectos cardiovasculares es similar a la del reflejo baroreceptor. Al mismo tiempo se coordina el reflejo respiratorio por otras neuronas reticulares en el tronco cerebral. El X par, posee fibras aferentes viscerales que provienen del tubo digestivo desde el esófago hasta el colon transverso, el hígado, las vías biliares y el páncreas. Cerca del 80 % de las fibras que constituyen el nervio vago son viscerales aferentes y tienen sus cuerpos en el ganglio inferior o nodoso y terminan en el núcleo solitario. Estas aferencias están relacionadas con reflejos que controlan funciones cardiovasculares, respiratorias y digestivas. Las aferencias viscerales espinales están distribuidas en proporciones diferentes de acuerdo al tipo y función de los órganos viscerales. Los órganos de las cavidades toracoabdominal están menos densamente inervados por aferencias espinales, que la piel. Los órganos pélvicos reciben mayor inervación aferente espinal y llevan información de dolor y contribuyen a la regulación del vaciamiento vesical y rectal. Las fibras aferentes espinales tienen su cuerpo en los ganglios de las raíces dorsales de T1 a L2, se acompañan de fibras eferentes simpáticas en los nervios espinales respectivos. En forma similar, las fibras aferentes viscerales que tienen su cuerpo en los ganglios de las raíces dorsales S2 a S4 se acompañan de fibras parasimpáticos en los nervios espinales. SISTEMA NERVIOSO ENTERICO El sistema nervioso autónomo influye sobre las actividades del aparato digestivo a través del sistema simpático y parasimpático. Sin embargo, el tracto digestivo es capaz de llevar a cabo funciones reflejas como absorción, secreción y actividad motora del tubo digestivo, con un grado asombroso de independencia de SNC. Es decir la actividad del SNE es independiente de la inervación extrínseca pero es modulada por influjo del nervio vago que se origina en el núcleo motor dorsal de X y el influjo simpático que proviene de los ganglios prevertebrales. Este alto grado de autonomía de las funciones digestivas es posible, debido a que la pared del tubo digestivo está equipada con una compleja red intrínseca de neuronas que constituyen el sistema nervioso entérico (SNE), que inerva el tubo digestivo desde el esófago hasta el recto y también las vías biliares y pancreáticas. Se ha estimado que lo constituyen cerca de 100 millones de neuronas, cantidad similar a la encontrada en el cordón espinal. La mayoría de las neuronas se distribuyen dentro de los plexos mientérico (Auerbach) y submucoso (Meissner), aunque también se distribuyen en la mucosa y la serosa. Se describen diversidad de neuronas intrínsecas, entre las que se destacan: sensitivas (mecanoreceptores, quimiorreceptores, nociceptores), interneuronas (exitatorias, inhibitorias, con proyección caudal u oral) y motoneuronas ((secretomotoras, exitatorias e inhibitorias). Además de este complejo neuronal intrínseco, la pared del tubo digestivo contiene células similares al músculo liso, denominadas intersticiales de Cajal, que mantienen actividad eléctrica rítmica espontánea, semejando un marcapaso. Estas células se conectan entre sí y con células de músculo liso de la pared, por modo que las células intersticiales son responsables de la generación y propagación de ondas lentas de despolarización en las capas de músculo liso. Esta actividad junto con la generada por otras neuronas del SNE, se traduce en ondas útiles de contracción muscular. El peristaltismo, es una función específica del SNE, donde el material ingerido evoca ondas de contracción y relajación que lentamente lleva el bolo alimenticio hacia el ano. El peristaltismo se inicia por la distensión mecánica que el bolo produce sobre la pared del tubo digestivo y la distorsión mecánica de la mucosa lo que activa neuronas mecanoreceptoras, o por la respuesta de las células enteroendocrinas que se localizan en el epitelio y responden a los cambios químicos del contenido en la luz del tubo (pH, osmolaridad, ácidos grasos, sales biliares etc.) y activan neuronas quimioreceptoras. En cualquier caso, las neuronas sensitivas activan interneuronas en el plexo mientérico que producirán estimulación de motoneuronas en dirección rostral e inhibición de motoneuronas en dirección caudal. El resultado es la propulsión del bolo alimenticio hacia el ano por la combinación de la contracción del segmento intestinal por encima del bolo y la relajación (dilatación) del segmento intestinal por debajo del bolo. Además de la generación del peristaltismo, circuitos neuronales intrínsecos desencadenan cambios reflejos en otras actividades como la absorción, el flujo vascular local y la secreción. Aunque el peristaltismo y otras funciones reflejas ocurren independientemente de estímulos externos, ellos están normalmente sujetos a regulación extrínseca por influjo parasimpático (generalmente facilitador) y simpático (generalmente inhibidor). La influencia vagal, mediada por acetilcolina principalmente, promueve la secreción y motilidad del tracto gastrointestinal. Los ganglios prevertebrales son el lugar de integración de los reflejos visceroviscerales. El reflejo simpático prevertebral es un mecanismo de retroalimentación (feedback) que regula la actividad motora del tubo digestivo. La distensión del tubo digestivo, desencadena impulsos que activan las neuronas prevertebrales, que a través de las fibras postganglionares que contienen norepinefrina producen inhibición de la motilidad del tubo digestivo, en parte por activación de los receptores α-2. Reflejos complejos como la defecación y el reflejo enterogástrico son generados por circuitos parasimpáticos y simpáticos. Con esta gran población neuronal, no es difícil imaginar que hay gran cantidad de neurotransmisores y neuromoduladores que hacen parte del SNE, entre los que se incluye la acetilcolina, la serotonina, la noradrenalina, el oxído nitrico, la sustancia P, el péptido intestinal vasoactivo, neuropéptido Y, encefalinas, colecistoquinina. CORRELACIONES CLINICAS 1. MEDICAMENTOS QUE SE RELACIONAN CON LA ACETILCOLINA (ACh) Diferentes medicamentos afectan la transmisión a nivel presináptico, sináptico y postsináptico. Dentro de las toxinas presinápticas para las terminaciones colinérgicas se incluye las toxinas botulínicas, que interfieren con la fusión y transporte de las vesículas sinápticas. Los medicamentos que inhiben la acetilcolinesterasa (AchE) potencian la transmisión colinérgica. Hay bloqueadores reversibles de la AchE como la piridostigmina, el edrofonio y el donepezilo, los dos primeros se utilizan en miastenia gravis y el último en el tratamiento de la demencia. Dentro de los bloqueadores irreversibles de la AchE se encuentran los agentes organofosforados como algunos insecticidas (paratión y malatión). Los agonistas de los receptores muscarínicos se pueden dividir en dos grupos: 1) esteres relacionados con la colina como la metacolina, el betanecol y el carbacol y 2) los alcaloides colinomiméticos naturales como la muscarina y la pilocarpina. La metacolina es hidrolizada por la AchE más lentamente que la ACh, el betanecol y el carbacol no son hidrolizados por la AchE. Como estos agentes replican los efectos de la ACh sobre los órganos blanco, ellos producen miosis y contracción del músculo ciliar, estimulan el músculo liso del árbol traqueobronquial, del tracto gastrointestinal y del músculo detrusor de la vejiga; y secreción exocrina de las glándulas salivares, lacrimales, traqueobronquiales, digestivas y sudoríparas. El betanecol se ha utilizado para el tratamiento de la retención urinaria debida a alteración en la contracción del músculo detrusor. La pilocarpina se aplica tópicamente en el ojo y se utiliza en el tratamiento del glaucoma. La intoxicación con champiñones (mimetismo) se produce por alto contenido de muscarina y se caracteriza por salivación intensa, lacrimación, vomito, cólicos abdominales, diarrea, broncoespasmo, bradicardia, hipotensión y shock. Dentro de los antagonistas de los receptores muscarínicos se incluyen los alcaloides de la belladona como la atropina y la escopolamina. Estas sustancias, de acuerdo a la dosis, producen disminución en la salivación, la secreción bronquial, la sudoración y a dosis altas producen taquicardia, midriasis, alteración de la acomodación, retención urinaria e inhibición de la motilidad y secreción gastrointestinal. Antagonistas muscarínicos inhalados como el ipratropium (que bloquea todos los receptores muscarínicos) y el tiotropium (bloqueador selectivo de M1 y M3) producen broncodilatación, disminuyen la secreción bronquial por lo que se utilizan en el tratamiento del asma. 2. MEDICAMENTOS RELACIONADOS CON LAS CATECOLAMINAS La adrenalina liberada por la medula suprarrenal es un potente estimulante de los receptores α y β adrenérgicos. La administración rápida intravenosa aumenta la presión arterial debido a su efecto combinado sobre los receptores α1 que median vasoconstricción en varias redes vasculares, especialmente la de la piel, el riñón y redes venosas y sobre los receptores β1 que median la cardioestimulación. La noradrenalina (NA) es equipolente a la adrenalina en la estimulación de los receptores β1, pero es estimulador alfa menos potente. Hay medicamentos que actúan liberando NA de las terminales nerviosas y se comportan como medicamentos simpaticomiméticos. Dentro de este grupo se incluye las anfetaminas, el metilfenidato y la efedrina. Los bloqueadores α1 son utilizados como antihipertensivos y como relajantes del músculo liso del trígono vesical para reducir la resistencia a la evacuación vesical en pacientes con hipertrofia prostática, dentro de este grupo se destaca la prazosina, la terazosina y la doxazosina. Algunos medicamentos de uso neurológico pueden producir bloqueo de los receptores α1, produciendo efectos secundarios no deseados como hipotensión arterial. Dentro de este grupo de medicamentos los más usados están la clozapina y la amitriptilina. Un prototipo del grupo de medicamentos que actúa como agonistas de los receptores α2 es la clonidina. Tal vez dentro del grupo de medicamentos más utilizados, en relación con el sistema simpático, están los agonistas de los receptores β que incluye los no selectivos como el isoproterenol y la dobutamina y los selectivos β2 como la terbutalina y el albuterol. Los agonistas selectivos son utilizados como broncodilatadores. Los antagonistas o bloqueadores β incluye agentes no selectivos como el propanolol, el nadol, el timolol y bloqueadores β1 como el atenolol, metoprolol. SISTEMA GUSTATIVO El término sabor es usado por algunos autores como el sentido del gusto, es decir el conjunto de sensaciones que se originan al estimular los botones gustativos. Nosotros comúnmente asumimos que esto es lo mismo que la sensación compleja que percibimos cuando comemos o bebemos, pero esta integración en la degustación de los alimentos es el resultado de la combinación de tres diferentes tipos de estímulos simultáneos: la estimulación olfatoria por los vapores de la comida, estimulación directa de los botones gustativos y de las terminaciones libres del sistema trigeminal quemosensitivo. Este último detecta lo condimentado, lo picante, la temperatura y la textura del alimento. En la superficie de la lengua se encuentran los botones gustativos, receptores para el gusto, que se localizan en las papilas gustativas, que por sus características morfológicas se denominan: fungiformes, foliadas y circunvaladas. Las papilas fungiformes se encuentran más abundantes en la parte anterior de la lengua, cada una contiene entre 3 a 5 botones gustativos. Las foliadas se localizan en el borde de la lengua, hacia la parte posterior y están formadas por pliegues de mucosa y contienen entre 100 a 150 botones gustativos. Finalmente una serie de 8 a 9 papilas circunvaladas (valleculas) organizadas en forma de V, delimitan los dos tercios anteriores de la lengua (Fig.1). Cada una de ellas contiene 250 botones gustativos. En resumen se considera que hay cerca de 5000 botones gustativos distribuidos en la lengua. Las papilas circunvaladas y foliadas se relacionan con las glándulas de von Ebner, que drenan su producto en la base de estas papilas e influyen en el microambiente. En el velo del paladar, la faringe y parte superior de la laringe también se encuentran botones gustativos que no están localizados en papilas gustativas sino distribuidas en el epitelio. Al parecer están relacionados con los mecanismos de la deglución y de respuestas reflejas. Fig. 1 Distribución de las papilas gustativas y las regiones de los pares craneanos. Tomado de Nolte J. The human brain, an introduction to its functional anatomy. 5th ed. Mosby, 2002 RECEPTOR GUSTATIVO Cada botón gustativo contiene 40 a 60 células receptoras para el gusto que se extienden desde la lamina basal hasta la superficie del epitelio. Estas son células fusiformes, con microvellosidades que se extienden hacia un pequeño orificio, el poro gustativo. El poro forma una especie de bolsillo que permite el contacto entre las microvellosidades y el medio externo. Fibras aferentes penetran la membrana basal y se ramifican en la base del botón gustativo. Las células receptoras responden a más de un tipo de sabor. Las fibras gustativas, aferentes viscerales especiales, se ramifican e inervan múltiples botones gustativos que pueden estar localizados en diferentes papilas, y ellas también responden a más de un tipo de sabor. En la parte profunda del botón gustativo, las células receptoras hacen sinapsis con fibras aferentes viscerales especiales del nervio facial, glosofaríngeo y vago (Fig 2). Las células receptoras tienen una vida media de una a dos semanas antes de ser remplazadas células que se originad de la diferenciación de las células basales, las cuales migran de las células epiteliales que rodean al botón gustativo. Fig. 2 El botón gustativo. Tomadas de Haines D. Fundamental Neuroscience for Basic and Clinical Applications. 3th Ed. Elsevier 2006 Las fibras del nervio facial inervan los botones gustativos de las papilas fungiformes y foliadas de los 2/3 anteriores de la lengua y los botones gustativos del paladar blando. Las fibras del glosofaríngeo inervan las papilas circunvaladas, la mayoría de las foliadas y los botones gustativos de la faringe. Las fibras del vago inervan las papilas de la epiglotis y el esófago (Fig.1). Las células receptoras se diferencian a partir del epitelio lingual que las rodea y dependen de la interacción con las fibras viscerales para garantizar su existencia ya que la denervación de un área de la lengua causa degeneración de los receptores. LA TRANSDUCCION GUSTATIVA Los cuatro sabores básicos, tradicionalmente reconocidos, son el dulce, el salado, el amargo y el ácido, pero seguramente hay otros. Aunque algunas partes de la lengua son más sensitivas para algunos sabores como la punta de la lengua para lo dulce, los lados para lo salado y ácido y la parte posterior para lo amargo, en realidad todas las partes de la lengua son sensibles a estos cuatro tipos de sabores. Las células receptoras utilizan múltiples métodos para convertir el estímulo químico en un estímulo eléctrico. Los procesos de transducción incluyen los siguientes: 1. Para el proceso de transducción del cloruro de sodio no interviene una molécula receptora, simplemente los canales de sodio, en la porción apical de la célula receptora, permiten la entrada de los iones de Na+, lo que despolariza la membrana. 2. Los sabores ácidos contienen abundante H+ que despolarizan la membrana de la célula receptora ya sea por un movimiento de protones a través de los canales de Na+ o bloqueando la conductancia de los canales de K+. 3. Las sustancias dulces, por el contrario, se unen al receptor que activa la proteína G se aumenta el AMPc lo que conduce a al cierre de los canales de K+, que normalmente están abiertos. 4. Las sustancias amargas, que se encuentran en muchas de las sustancias tóxicas, tienen una función protectora y son evitadas por los humanos y otros animales. Estas sustancias interactúan con la proteína G o bloquean los canales de K+ directamente. La mayoría de las células contienen en su membrana apical más de un tipo de mecanismo de transducción gustativa, aunque uno predomina en una célula dada. LA VIA GUSTATIVA La información gustativa no solamente alcanza niveles de conciencia para la percepción del sabor, además su papel en las respuestas autonómicas y la adquisición del alimento la colocan como el sistema sensorial que está más íntimamente relacionado con el hipotálamo y el sistema límbico. La información gustativa transportada por los pares VII, IX y X a través de fibras aferentes viscerales especiales. El nervio cuerda del tímpano trae información gustativa de los 2/3 anteriores de la lengua y se une al VII par. El nervio petroso superficial mayor también se une al VII par y trae información gustativa del paladar blando. Los cuerpos de las neuronas del nervio facial que transportan información gustativa se localizan en el ganglio geniculado, y de allí las fibras centrales hacen parte del nervio intermedio, parte del VII, penetran al tronco cerebral por el ángulo pontocerebeloso se unen al tracto solitario y terminan en la porción caudal del núcleo solitario (Fig. 3). La información gustativa proveniente de las papilas circunvaladas (valléculas) y de la parte posterior de las papilas foliadas es transportada por las ramas linguo-tonsilares del IX par y la proveniente de la epiglotis y el esófago es transportada por fibras del nervio laríngeo superior, rama del X par. Los cuerpos de estas neuronas se localizan en los ganglios inferiores (petroso y nodoso respectivamente) y la porción central de estas fibras penetran al tronco cerebral por el surco retro-olivar y terminan en el núcleo solitario (Fig.3). Fig. 3 vía periférica del gusto. NPSM: nervio petroso superficial mayor. NCT: nervio cuerda del tímpano. Tomado de Nolte J. The human brain, an introduction to its functional anatomy. 5th ed. Mosby, 2002 El núcleo solitario, principal núcleo aferente visceral del tronco cerebral, se divide desde el punto de vista funcional en la porción rostral (gustativa) y caudal (cardiorrespiratoria). De la porción rostral proyectan fibras a núcleos circunvecinos, que participan en actividades reflejas como la deglución, la salivación, la masticación y la tos. Otras fibras se proyectan hacia el tálamo ipsolateral a través del tracto central del tegmento y terminan en la porción más medial del núcleo ventral posterior y medial (VPM) del tálamo. De este núcleo se proyectan fibras que terminan en la ínsula, en la superficie medial del opérculo frontal cerca de la base del surco central y en el área 3b de la circunvolución post-central. Esta vía, en contraste con otra aferencias, es exclusivamente iposolateral. De la corteza gustativa se proyecta información hacia la corteza orbitaria del lóbulo frontal, donde la información gustativa se integra con la olfatoria, y hacia el complejo amigdalino a través del cual la información gustativa termina en el hipotálamo y el sistema límbico. SISTEMA RETICULAR DEFINICION El sistema reticular es el conjunto estructural y funcional formado por la llamada formación reticular y por las conexiones que ella tiene con otras estructuras del encéfalo y con el cordón espinal. La formación reticular es un conglomerado de neuronas multipolares de tamaño variable difusamente distribuidas en agrupaciones pericariales (núcleos reticulares) que se hallan interconectados con un retículo de fibras multidireccionales a todo lo largo del tronco cerebral y en el tálamo. La formación reticular constituye la porción central del tronco cerebral. En la mayoría de los niveles del tronco cerebral, la formación reticular se puede dividir en tres zonas longitudinales organizadas en dirección medio-lateral y se describen: La zona medial constituida por los núcleos del rafé (del griego rhaphe que significa costura y hace referencia a la línea media del tronco cerebral) son placas de células que están en y adyacentes al plano sagital. La zona intermedia está formada por neuronas de diverso tamaño y es la fuente de la mayoría de las proyecciones ascendentes y descendentes del sistema reticular. Algunas de las neuronas en la zona intermedia de la porción rostral en la medula son tan grandes que son referidas como el núcleo gigantocelular reticular. La zona lateral, que es muy prominente en la unión medulopóntica, está relacionada con los reflejos de los nervios craneanos y las funciones viscerales. ASPECTOS EMBRIOLOGICOS Filogenéticamente la formación reticular es la parte más antigua del tronco cerebral, cuya parte central precede en su aparición a las estructuras que la rodean. Son los ciclóstomos los primeros en presentar neuronas inequívocamente reticulares en la escala zoológica. A lo largo de ésta se da en general un proceso creciente de mejor definición y conexiones de la formación reticular, sobre todo a partir de los reptiles. En este proceso, la formación reticular va quedando rodeada por estructuras que cumplen funciones específicas en los sistemas aferentes que median tanto funciones somáticas como víscerales. En los mamíferos el patrón estructural básico de la formación reticular es similar. Sin embargo existen diferencias en la extensión y organización de los grupos nucleares individuales. Ramón y Cajal mostró que las neuronas de la formación reticular aparecen en estadios iniciales del desarrollo embrionario. Ellas derivan del diencéfalo, mesencéfalo y del rombencéfalo. ASPECTOS NEUROANATOMICO-FUNCIONALES. La formación reticular, en términos generales consta de: 1. Núcleos reticulares: que son agrupaciones pericariales mal definidas y profundamente colocados en el neuroeje, lo que hace difícil su división anatómica. Las neuronas dentro de la formación reticular cumplen una gran variedad de funciones que incluyen: control cardiovascular y respiratorio, control motor, organización de los movimientos oculares, regulación de los estados de vigilia y sueño y una gran cantidad de reflejos sensitivo-motores. 2. Fibras nerviosas reticulares que poseen un patrón difuso de conexiones, son funcionalmente ascendentes y descendentes, directas (ipsolaterales) y cruzadas (contralaterales). Las fibras nerviosas reticulares son muy difíciles de precisar y seguir estructuralmente, pero hay evidencia fisiológica de su existencia, de su complejidad y de su participación en cadenas neuronales polisinápticas. Histológicamente la formación reticular está constituida por neuronas multipolares que, en su mayoría son Golgi tipo I provistas de dendritas ampliamente arborizadas e imbricadas complejamente para hacer sinapsis con una multitud de terminales axónicos que también contactan el soma. El axon largo, pasa a la sustancia blanca siguiendo el curso longitudinal que puede ser ascendente descendente o puede bifurcarse para dar ramas bidireccionales. En su trayecto el axón o sus ramas dan colaterales que se desprenden de ángulos rectos para terminar en otros núcleos reticulares o en núcleos vecinos. La presencia de neuronas Golgi tipo II de axón corto es muy rara. La estructura histológica de la formación reticular provee oportunidades masivas para la convergencia y divergencia del impulso nervioso. Las neuronas reticulares son funcionalmente excitatorias o inhibitorias y la proporción de cada una de ellas varía en las diferentes regiones. NUCLEOS RETICULARES DE LA MEDULA OBLONGA Yendo de adentro hacia afuera y de abajo hacia arriba se encuentran: 1. Los núcleos del rafé: se hallan situados en la línea media y son el oscuro, el pálido y la parte caudal del magno. Contienen neuronas que, en su gran mayoría son serotoninérgicas. Dan origen a fibras retículo-espinales directas y cruzadas que cursan por los cordones espinales lateral y ventral. Las primeras procedentes del núcleo magno terminan a nivel de las astas posteriores y ejercen un efecto analgésico. Las segundas terminan en las astas laterales donde provocan un efecto inhibitorio sobre las neuronas simpáticas. Los tractos reticuloespinales son la ruta alterna (a la vía piramidal) ya que influyen sobre las motoneuronas directamente y regulando los arcos reflejos espinales. 2. Los núcleos reticulares para-medianos: son un conglomerado de núcleos pequeños colocados cerca del fascículo longitudinal medio y del lemnisco medial. De estos núcleos parten fibras retículocerebelosos que terminan principalmente en el vermis y a ellos llegan fibras cerebelo-reticulares originadas en los núcleos fastigial y dentado. 3. Los núcleos reticulares laterales: se hallan en la parte anterolateral de la médula oblonga. Aparecen por debajo de la oliva y ascienden hasta su parte media, colocada por dentro y por detrás de ella. Se describen tres núcleos llamados: núcleos gigantocelular, parvicelular y sub-trigerminal. A ellos les llega información proveniente del cordón espinal de los tractos espinoreticular y espinotalámico. Reciben también aferencias auditivas, vestibulares, trigeminales, del núcleo rojo y viscerales. Las fibras corticoreticulares provienen de áreas extensas de la corteza cerebral, en su mayor parte de las áreas sensitivas y la mayoría de ellas terminan en la formación reticular del puente y médula oblongada. Las eferencias se desprenden principalmente a partir del núcleo gigantocelular que da lugar a la formación de dos tipos de grupos de fibras: A. Ascendentes: que acompañan el tracto central del tegmento y terminan en los núcleos talámicos intralaminares, este sistema juega un papel importante en el despertar. B. Descendentes: que da lugar a la formación de los tractos o retículo-espinales. La estimulación de las porciones rostral y dorsal produce potencias postsinápticas excitadoras en motoneuronas que suplen los músculos axiales de la nuca y dorso. La estimulación de la porción caudal produce potenciales postsinápticos inhibitorios en las motoneuronas en todos los niveles. Por consiguiente se puede dividir la formación reticular medular en una región exitadora y otra inhibidora. NUCLEOS RETICULARES DEL PUENTE. 1. Núcleos reticulares pónticos caudal y oral: el primero posee células gigantes similares a las observadas en la médula, las fibras de estos núcleos descienden como un componente del fascículo longitudinal medio ipsolateral y otros ascienden por el haz central del tegmento hacia los núcleos talámicos intralaminares. 2. Núcleos del rafé: El núcleo central inferior ubicado en la unión medulo-póntica, y representa la porción rostral del núcleo magnocelular. Los núcleos pónticos del rafé están formados por dos subgrupos; uno ubicado rostral al núcleo central inferior, el núcleo central superior y el otro colocado posterior, el núcleo dorsal del rafé, las neuronas de estos núcleos contienen serotonina. Las fibras ascendentes, provienen de neuronas serotoninérgicas, localizadas en los núcleos central y superior, se unen al haz medial del cerebro anterior, algunas fibras abandonan este haz y terminan en la sustancia nigra y núcleos intralaminares del tálamo. Las proyecciones descendentes son menos voluminosas, y terminan en el cerebelo, el locus ceruleus, y otros núcleos reticulares pónticos. 3. Locus ceruleus (del latín mancha azul): están formados por colección de células pigmentadas localizadas cerca a la región periventricular superior del IV ventrículo. Las células son de dos tipos: unas que contienen gránulos con pigmentos de neuromelanina y otras con citoplasma escaso y sin pigmento, estas células son ricas en noradrenalina. Las proyecciones ascendentes cursan rostrales en el haz medial del cerebro anterior que van hacia y a través del hipotálamo. Las fibras noradrenérgicas se distribuyen ampliamente en la corteza cerebral, en la formación hipocampal y en los núcleos intralaminares del tálamo. Las proyecciones descendentes terminan en la corteza cerebelosa ( a través del pedúnculo cerebeloso superior) al rededor de las células de Purkinge, en el tronco cerebral en núcleos sensitivos, motores viscerales y en el cordón espinal. Tanto del locus cereleus y del sub-ceruleus (ventral al locus ceruleus) se proyectan fibras que descienden al cordón espinal que terminan en neuronas preganglionares simpáticas. El locus ceruleus y sus aferencias se han considerado que juegan papel importante en el sueno REM. NUCLEOS RETICULARES DEL MESENCEFALO 1. Núcleo rojo: es el núcleo reticular de mayor volumen en el tegmento del mesencéfalo caracterizado por su color rojizo y su cápsula formada por fibras del pedúnculo cerebeloso superior (brazo conjuntivo). Las fibras aferentes al núcleo rojo se derivan principalmente de los núcleos cerebelosos, de la corteza cerebral (áreas pre-central y pre-motora). Las fibras terminan somatópicamente dentro del núcleo. Las fibras eferentes se proyectan hacía: cerebelo, núcleo sensitivo del trigémino, núcleo del facial, núcleos gracil y cuneatus, en los núcleos reticulares laterales en la medula, y en el cordón espinal (haz rubro-espinal). Algunas observaciones sugieren que el haz rubro-espinal transmite impulsos que facilitan el tono de los músculos flexores. 2. Núcleo pedúnculo-póntico: ubicado en la porción lateral del tegmento, ventral al colículo inferior, recibe aferencias provenientes de la corteza cerebral, la porción medial del núcleo pálido y de la sustancia nigra. Las aferencias principales van al núcleo pálido y sustancia nigra. 3. Núcleo interpeduncular: se localiza dorsal a la fosa interpeduncular y recibe aferencia de los núcleos habenulares. NUCLEOS RETICULARES DEL TALAMO Desde el punto de vista funcional los núcleos talámicos se subdividen en: 1. 2. Núcleos talámicos específicos que están relacionados con áreas sensitivas y motoras. Núcleos talámicos no específicos, que reciben aferencias de la formación reticular, la corteza y otros núcleos talámicos, y que se proyecta a todas las áreas corticales a través de las proyecciones tálamo-corticales. Los núcleos no específicos incluye: Los núcleos mediales, los núcleos intralaminares y los núcleos reticulares, localizados en el borde lateral del tálamo. Las fibras ascendentes reticulares y los núcleos no específicos se denominan en conjunto como el sistema reticular ascendente activador (SRAA). Las proyecciones difusas a partir de los núcleos no específicos, que se conectan con el SRAA y se distribuyen en áreas difusas corticales conforman el sistema tálamocortical. Ellas juegan un papel importante en la regulación de la actividad eléctrica cortical cerebral y en los estados de conciencia y alertamiento. MECANISMOS QUE PROMUEVEN LA VIGILIA En 1916 Constantin von Economo, un neurólogo austríaco, describió pacientes con un nuevo tipo de encefalitis que específicamente atacaba las regiones del cerebro que regulaban el sueño y la vigilia (fig. 1). Esta entidad se denominó encefalitis letárgica o la enfermedad del sueño de von Economo. Aunque el virus nunca se identificó, von Economo fue capaz de identificar las áreas del cerebro comprometidas en esta entidad. Fig. 1 Diagrama que von Ecónomo utilizó para ilustrar los sitios de lesión en la unión mesencéfalo-diencéfalo (líneas oblicuas verticales) que causaban somnolencia prolongada y en la parte anterior del hipotálamo (líneas horizontales) que causaban insomnio prolongado. Tomado de Saper C, Hypothalamic regulation of sleep and circadian rhythms. Nature 437,1257-1263;2005 Solamente en las últimas décadas la exactitud de sus observaciones ha empezado a ser apreciada, ya que los componentes claves de los sistemas reguladores del sueño residen en las áreas que von Economo describió inicialmente. La mayoría de pacientes con encefalitis letárgica, dormían durante 20 horas o más por día, pero su función cognitiva estaba intacta. von Economo encontró que estos pacientes presentaban lesiones en la unión mesencéfalo-diencefálica. Posteriormente se estableció que por allí transcurren las fibras que constituyen el sistema reticular ascendente activador (SRAA), encargado de promover la actividad cortical cerebral. El SRAA tiene dos grupos de fibras, uno constituido por neuronas colinérgicas que provienen de dos núcleos en el puente (pedunculopontico-PP y tegmento dorsolateral- TDL) y terminan en el tálamo activando las neuronas de relevo que son cruciales para la transmisión de la información hacia la corteza cerebral. La otra porción se origina a partir de neuronas monoaminergicas ubicadas en el tronco cerebral y terminan en el tálamo, hipotálamo y en la corteza cerebral directamente, e incluyen las neuronas noradrenérgicas del locus coeruleus (LC), las serotoninérgicas de los núcleos del rafé (NR), las dopaminérgicas de la porción ventral del mesencéfalo (PVM-sustancia nigra) y las histaminérgicas de los tubérculos mamilares (TM). La activación de la corteza cerebral se complementa por neuronas colinérgicas en la región basal del encéfalo que se proyectan hacia el hipocampo, el complejo amigdalino y la corteza frontal (fig. 2). En resumen las neuronas colinérgicas permanecen activas durante la vigilia y el sueño REM, pero su actividad disminuye considerablemente durante el sueño NREM. Fig. 2 Sistema reticular ascendente activador que envía proyecciones a la corteza a través del tálamo e hipotálamo, constituido por fibras que se originan en: NPP y TDL (núcleo pedúnculo-póntico y tegmento dorsolateral: acetilcolina), LC (locus ceruleus: norepinefrina), NR (núcleos del rafé: serotonina), SN (sustancia nigra: dopamina), TM (tubérculos mamilares: histamina), TAL: tálamo, RBE (región basal del encéfalo: acetilcolina). Tomado de España R, Scammell T. Sleep neurobiology for the clinician. Sleep, 27,811-820;2004 Del núcleo lateral del hipotálamo (NLH) que contiene neuronas que poseen orexina/hipocretinas (para efectos de este capítulo usaré el término orexinas), se desprenden prolongaciones neuronales que terminan en el tronco cerebral y modulan la actividad de las neuronas monoaminérgicas descritas anteriormente (Fig. 3). Una lesión en el NLH produce la forma más prolongada y profunda de somnolencia y aún de coma. Las neuronas monoaminérgicas y las que contienen orexina son muy activas durante la vigilia, pero a diferencia de las neuronas colinérgicas su actividad disminuye durante el sueño NREM y cesa durante el sueño REM. Fig. 3 Las neuronas orexinérgicas/hipocretinérgicas en el núcleo lateral del hipotálamo que envían prolongaciones neuronales a los núcleos del tronco cerebral relacionados con el sistema reticular activador y a la corteza cerebral. Tomado de España R, Scammell T. Sleep neurobiology for the clinician. Sleep, 27,811-820;2004 La noradrenalina promueve la vigilia especialmente en situaciones de estrés y aunque estudios iniciales sugerían que la serotonina estaba relacionada con la producción de sueño, estudios recientes indican que la 5-HT (serotonina) promueve la vigilia, de ahí que varios de los inhibidores de la recaptación de la serotonina aumentan la vigilia y disminuyen el sueño REM. Aún no esta claramente establecido que las neuronas dopaminérgicas promuevan la vigilia, pero estudios con agonistas de los receptores dopamina D1, D2 y D3 aumentan la vigilia y disminuyen el sueño NREM y REM, de la misma manera las anfetaminas promueven la vigilia al aumentar la liberación de dopamina y bloquear su retoma. Algunos datos sugieren que la histamina promueve la vigilia, especialmente al inicio del despertar y en condiciones que requieren un marcado alertamiento. LAS OREXINAS Y SU PAPEL EN LA VIGILIA En 1998 dos grupos de investigadores, en forma simultánea, descubrieron un par de neuropéptidos denominados orexinas A y B por un grupo e hipocretinas 1 y 2 por el otro. Estos neuropéptidos se producen exclusivamente en la mitad posterior del NLH. Un año después, otros dos grupos, también en forma simultánea, encontraron que la falta de orexinas o de su receptor tipo 2 producía síntomas compatibles con narcolepsia en animales de experimentación. Al año siguiente, se reportó que en el 90 & de pacientes con narcolepsia y cataplexia presentaban niveles muy bajos o ausencia de orexinas en el líquido cefalorraquídeo. De tal forma que en un período muy corto se identificó la base molecular de la narcolepsia. Las neuronas productoras de orexinas están muy activas durante la vigilia, se proyectan a la corteza cerebral y a los núcleos monoaminérgicos y colinérgicos del sistema reticular ascendente activador en el tronco cerebral (fig3 y fig.6). Las neuronas orexinérgicas juegan un papel esencial en la estabilización del sueño y la vigilia. Son activadas tónicamente por el glutamato, posiblemente liberado a partir de neuronas circunvecinas. Los niveles de orexinas son más altos al final de la tarde, posiblemente como mecanismo opositor al sueño. Estas neuronas están localizadas en un sitio que permite la coordinación de la vigilia y el control de la ingesta, la actividad locomotora, la temperatura corporal y algunas funciones autonómicas. A continuación se resumen los neurotransmisores relacionados con la vigilia. NEUROTRANSMISOR Acetilcolina Serotonina Noradrenalina Histamina Orexinas/hipocretinas SITIO DE ORIGEN Puente y región basal Núcleos del rafé Locus ceruleus Tuberculos mamilares Región lateral del hipotalamo PROYECCIÓN CORTICAL Difusa Difusa Difusa Difusa Difusa EL SUEÑO NORMAL Durante muchos años se asumió que la actividad cerebral estaba reducida en forma significativa durante el sueño. La experiencia subjetiva de pérdida de la conciencia y el no tener presente indicios de actividad mental durante este estado soportaba esa idea. Esta idea fue derrumbada cuando se describió la presencia de ciclos alternantes de sueño con movimientos rápidos de los ojos, denominado sueño REM (de la sigla en inglés Rapid Eye Movements) y de sueño sin movimiento rápido de los ojos conocido como sueño non-REM (NREM) en los años cincuenta y sesenta del siglo pasado. Diferentes patrones de ondas detectadas en el electroencefalograma (EEG) han permitido dividir el sueño NREM en cuatro estados denominados 1,2, 3 y 4. Los dos primeros se conocen como sueño NREM superficial y los dos últimos como sueño NREM profundo. En adultos jóvenes sanos, que mantienen un horario regular de sueño y vigilia, la proporción del tiempo total dormido en sueño NREM es cerca del 80 %. El estado 1 representa cerca del 5 %, el estado 2 cerca del 55 % y el sueño profundo cerca del 20 %. De un estado de somnolencia, el individuo pasa al estado 1, luego progresa secuencialmente a través de los otros estados de sueño NREM. Una vez se alcanza el estado 4 o sueño profundo, el patrón del EEG se invierte a través de los estados 3, 2 y finalmente da lugar a que ocurra el primer período de sueño REM. Como se aprecia en la figura 4, la distribución de los estados de sueño, sigue un patrón cíclico altamente estructurado y bien organizado, con predominio de sueño profundo durante el primer tercio del ciclo de sueño y el sueño REM se hace más prominente e intenso en la última parte del ciclo de sueño. Fig. 4. Histograma que muestra la distribución de los estados de sueño a lo largo de una noche, desde las 12 a m (0:00) hasta las 7 a m. Las barras horizontales gruesas corresponden al sueño REM. Nótese que en la medida que transcurre la noche los episodios de sueño REM son más prolongados y que en la porción inicial predomina el sueño profundo El descubrimiento del sueño REM y su correlación con la actividad onírica mostró cómo el cerebro esta activo durante el sueño. Posteriormente se estableció que el sueño REM se presenta cada 90 minutos y ocupa cerca del 20 % del tiempo total dormido. Este hecho invalidaba la creencia de que el sueño era causado por y estaba asociado con el cese de la actividad cerebral. En el sueño REM la actividad del EEG es similar a la del estado 1, pero se presentan los movimientos rápidos de los ojos. El sueño REM es frecuentemente referido como el “sueño paradójico” porque se caracteriza por pérdida del tono muscular, mientras que la actividad del encéfalo y del sistema nervioso autónomo están a niveles similares a los observados durante la vigilia. El cuerpo está esencialmente paralizado durante este período de sueño. Los estudios descriptivos del sueño, han sido complementados en la última década a través de estudios con imágenes funcionales cerebrales y mapeo electroencefalográfico. Las técnicas por imágenes han mostrado que la activación regional del cerebro es diferente durante la vigilia, el sueño NREM y el sueño REM. MECANISMOS QUE PROMUEVEN EL SUEÑO Experimentos realizados en animales mostraron que al lesionar el área pre-óptica ventrolateral (APOV) en el hipotálamo, se producía insomnio. Las neuronas del APOV están activas durante el sueño, especialmente durante el sueño NREM y la mayoría de las neuronas contienen neurotransmisores inhibitorios, galanina y ácido gama amino butírico (GABA). Las neuronas del APOV envían eferencias a otros núcleos en el hipotálamo y el tronco cerebral que participan en los mecanismos del despertar. Fig. 5 Las neuronas en el área pre-óptica ventro lateral (APOV) inhiben las neuronas del sistema reticular ascendente activador en el tronco cerebral, lo que permite el inicio del sueño NREM. Tomado de España R, Scammell T. Sleep neurobiology for the clinician. Sleep, 27,811-820;2004 A través de estas conexiones las neuronas del APOV generan el sueño al inhibir las regiones del sistema reticular activador. Si se lesiona una parte de esta región se disminuye en forma considerable el sueño NREM, pero si la lesión es más extensa se afectará también el sueño REM, lo que sugiere que estas células son necesarias en la génesis del sueño. El APOV recibe aferencias provenientes de los sistemas aminérgicos mencionados anteriormente y se ha establecido que tanto la serotonina como la noradrenalina inhiben las neuronas del APOV. Entonces el APOV puede ser inhibido por el sistema activador que a su vez es inhibido por el APOV durante el sueño. Las neuronas del APOV no expresan receptores para las orexinas, por lo tanto se acepta que las neuronas que contienen orexinas refuerzan las neuronas del sistema reticular activador pero no inhiben directamente las neuronas del APOV. En la producción del sueño NREM también participa la región basal del prosencéfalo, las neuronas de esta región están muy activas durante el sueño NREM y lo inducen cuando son estimuladas. Por el contrario, al lesionar esta región se reduce en forma considerable la cantidad de sueño. Estas neuronas actúan a través de proyecciones inhibitorias directas e indirectas sobre las neuronas aminérgicas, colinérgicas y orexinérgicas en el prosencéfalo y el tronco cerebral. La región del puente y el mesencéfalo adyacente contiene un grupo específico de neuronas colinérgicas generadoras del sueño REM (NPP, TDL). Si se destruyen no se produce sueño REM durante un período prolongado. Las neuronas promotoras del sueño REM son inhibidas por células noradrenérgicas, serotoninérgicas, orexinérgicas e histaminérgicas, durante la vigilia y el sueño NREM. Sin embargo, estas neuronas aminergicas permanecen silenciosas durante el sueño REM desinhibiendo las neuronas generadoras del sueño REM. Las neuronas generadoras de sueño REM, producen pérdida del tono muscular, de los músculos posturales, al desencadenar inhibición simultánea de las motoneuronas en el cordón espinal. Estas neuronas contienen acetilcolina, glutamato y probablemente otros neurotransmisores y estimulan neuronas localizadas en la medula, que contienen glicina cuyas prolongaciones axónicas se distribuyen en el cordón espinal en la región motora, produciendo inhibición de las motoneuronas. La actividad metabólica cerebral es máxima durante la vigilia y el sueño REM y muy reducida durante el sueño NREM. Trabajos recientes sugieren que la disminución en la actividad de las neuronas histaminérgicas está asociada con la pérdida de la conciencia durante el sueño, mientras que el cese de actividad de las neuronas noradrenérgicas está ligada a la supresión de la actividad muscular durante el sueño REM. Grandes adelantos sobre los mecanismos intrínsecos en la génesis de la vigilia, el sueño NREM y el sueño REM se han venido realizando, por supuesto resta mucho por aprender sobre estos mecanismos y los relacionados con la presentación recurrente o ultradiana del sueño REM.