01/04/2016 1 Experimentalmente se observa........
Anuncio
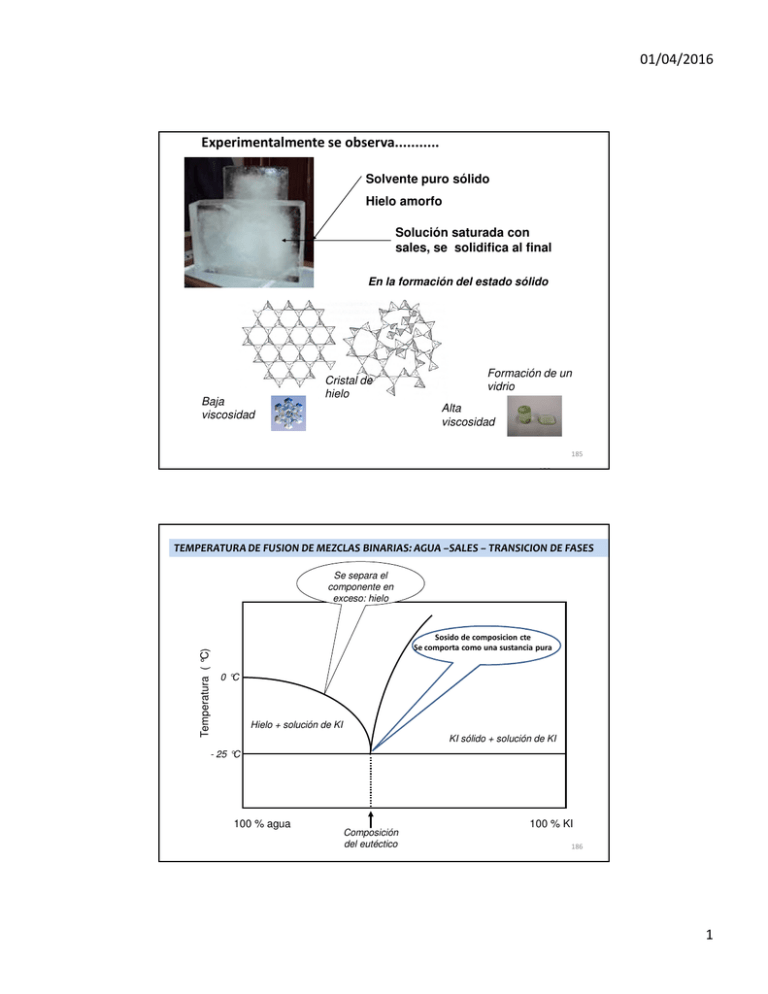
01/04/2016 Experimentalmente se observa........... Solvente puro sólido Hielo amorfo Solución saturada con sales, se solidifica al final En la formación del estado sólido Baja viscosidad Cristal de hielo Formación de un vidrio Alta viscosidad 185 186 TEMPERATURA DE FUSION DE MEZCLAS BINARIAS: AGUA –SALES – TRANSICION DE FASES Temperatura ( °C) Se separa el componente en exceso: hielo Sosido de composicion cte Se comporta como una sustancia pura 0 °C Hielo + solución de KI KI sólido + solución de KI - 25 °C 100 % agua Composición del eutéctico 100 % KI 186 1 01/04/2016 Análisis Termodinámico de una transición de fase La diferencia entre sólido cristalino y sólido amorfo Transiciones Volumen vs. T e Só li do cri stal in o Sólido cristalino Altamente ordenado Sólido amorfo Volúmen molar b d cris ta li za ció n Sól id o a mo rfo líq ui do a poco ordenado c Tg Tf Temperatura 187 La diferencia entre sólido cristalino y sólido amorfo Transiciones Cp vs. T liquido a Cp b cristalización c vidrio d cristal Tg Tf Temperatura 188 2 01/04/2016 Proceso de cristalización PRIMERA ETAPA NUCLEACIÓN PROCESO INVERTIBLE donde se junta ordenadamente y al zar algunas moléculas del soluto en solución y constituyen el nucleo SEGUNDA ETAPA FORMACION DEL CRISTAL PROCESO NO INVERTIBLE los nucleos crecen porque se depositan sobre ellos nuevas moléculas del soluto hasta hacerse macroscópicos. 189 VISCOSIDAD VELOCIDAD DE CRECIMIENTO DE LOS NUCLEOS NUMERO DE NUCLEOS / VOLUMEN TIEMPO FORMACION DE NUCLEOS VS FORMACION DE CRISTALES ZONA DONDE SE FORMAN CRISTALES FORMACION DE NUCLEOS T4 T3 FORMACION DEL CRISTALES T2 TF TEMPERATURA 190 3 01/04/2016 VISCOSIDAD ZONA DONDE SE FORMAN CRISTALES FORMACION DE NUCLEOS T4 T3 FORMACION DEL CRISTALES TF T2 VELOCIDAD DE CRECIMIENTO DE LOS NUCLEOS NUMERO DE NUCLEOS / VOLUMEN TIEMPO FORMACION DE NUCLEOS VS FORMACION DE CRISTALES TEMPERATURA 191 VS FORMACION DE CRISTALES VISCOSIDAD ZONA DONDE SE FORMAN CRISTALES FORMACION DE NUCLEOS T4 T3 FORMACION DEL CRISTALES T2 TF VELOCIDAD DE CRECIMIENTO DE LOS NUCLEOS NUMERO DE NUCLEOS / VOLUMEN TIEMPO FORMACION DE NUCLEOS TEMPERATURA 192 4 01/04/2016 Formación de cristales de hielo vs formación de vidrio Agua liquida Nucleos de hielo grandes Cristales de hielo grandes Nucleos pequeños pequeños estado no cristalino estado no cristalino (vidrio) Aumento de la viscosidad del medio / o disminución rapido de la temper. Velocidad de enfriamiento (°C / s ) 193 Conclusión: Debo evitar o disminuir la formación de nucleos Temperatura y viscosidad Agua liquida Núcleos de hielo Proceso cínético controlado por la difusión de las moléculas de agua hacia el cristal o núcleo D= kB T Aη R Como se logra que no se formen nucleos o se formen pocos? AUMENTANDO LA VISCOSIDAD EVITANDO LA FORMACION DE PUENTE HIDROGENO AGUA-AGUA 194 5 01/04/2016 Vitrificación Significa pasaje de una sustancia del estado liquido al sólido sin formar cristales. MEDIO DE ALTA VISCOSIDAD Se emplean sustancias llamadas vitrificadoras, que trabajan en concentraciones muy elevadas: 0,5 a 2 M (o 40 al 60% P/V) Formación de puentes de hidrogeno agua- glicerol Glicerol u otro compuesto poli hidroxilado Se rompen puentes de hidrogeno agua- agua Medio mas estructurado. Solución de alta viscosidad D= kB T Aη R Conducta similar a un vidrio 195 ¿ Cual es el punto de partida para saber que sustancia es formadora de vidrio (vitrificadora) y en que concentración ? Curvas de equilibrio entre fases en mezclas reales Ufa!! Otra vez la Fisicoquímica RECORDANDO ¿ Que ocurre cuando se enfría una solución de un soluto por debajo de su temperatura de congelación ? ¿ QUE OCURRE CUANDO SE BAJA LA TEMPERATURA POR DEBAJO DE LOS VALORES DE TEMPERATURA DE EQUILIBRIO ? 196 6 01/04/2016 Curvas de equilibrio agua- glicerol 30% 65% Tfusión -60 -40 -20 ZONA METAESTABLE -80 ZONA INESTABLE Tformación Tformación hielo cristalino de vidrio -120 -100 Temperatura ( °C) 0 ZONA ESTABLE 0 20 40 60 80 Glicerol % (P/V) 197 ¿ Que consecuencia produce la formación de hielo cristalino en productos biológicos sobre….. ? -Congelamiento de células -Congelamiento de tejidos -Congelamiento de soluciones de macromoléculas ¡¡¡¡¡ La destrucción celular y de tejidos !!!!! 198 7 01/04/2016 CONCLUSION: si se pretende conservar un sistema biológico por congelación, generalmente se destruye Daño celular y de tejidos: Los estudios aparecen cuando se pretendió guardar en el tiempo: Ovulos Espermatozoides Embriones Criobiología Crioproctectores Vitrificadores 199 MECANISMO DE DAÑO CELULAR DURANTE EL CONGELAMIENTO - formación de cristales de hielo Aumento del volumen y estallido celular CELULAS Perdida de liquido citoplasmatico MACROMOLECULAS Estado Nativo deshidratación Estado Desnaturalizado 200 8 01/04/2016 -Disminución del pH citoplasmático por cambio en el grado de disociación del buffer α Depende de la fuerza iónica -acumulación de metabolitos, - incremento del contacto entre moléculas (agregación) MACROMOLECULAS - Ruptura de puentes H - Pérdida de la actividad enzimática CÉLULAS Perdida de agua - deshidratación: aumento de la concentración de osmolitos, 201 ¿ Qué ocurre en una célula ? agua Enfriamiento rápido Solutos mas concentrados célula La célula no tiene tiempo de deshidratarse Enfriamiento muy rápido Al final se forma hielo intracelular agua Solutos mas concentrados célula 202 9 01/04/2016 Enfriamiento muy lento La deshidratación es extrema agua Solutos mas concentrados celula hay colapso celular 203 Velocidad de Enfriamiento adecuado agua célula La célula tiene tiempo de deshidratarse Se deshidratara y se concentrara intracelularmente antes de alcanzar la temperatura de nucleación, de manera que la posibilidad de congelación intracelular y el `posterior daño celular será mínimo. 204 10 01/04/2016 ¿ Como actúan los vitrificadores o crio protectores ? INTERACCIONAN FUERTEMENTE CON EL SOLVENTE AGUA IMPIDIENDO LA FORMACION DEL CRISTAL Durante el proceso de vitrificación, se disminuye bruscamente el movimiento molecular, de modo que las moléculas de agua no tienen el tiempo suficiente para ordenar. SUSTANCIAS CON ALTA CAPACIDAD DE FORMAR PUENTE DE HIDROGENO: Mono sacaridos Disacaridos Polisacaridos Poli alcoholes Polímeros de cadena flexible !!!!!! RANA DE LAS ZONAS FRIAS DE CANADA Se congela, y descongela en la primavera. Posee alto contenido de gluosa en su circulación 205 SUSTANCIAS CRIOPROTECTORES: 1) DE BAJO PESO MOLECULAR Y PERMEABLES A LA CELULA: ETILENGLICOl, 1-2 PROPANODIOL, GLICEROL. (el mas usado porque es económico, actualmente es subproducto de la industria del biodiesel. ACTUAN: Reemplazan al agua estructurada minimizando la formación de cristales. Regulan la deshidratación de proteínas 206 11 01/04/2016 2) DE BAJO PERO MOLECULAR Y NO PERMEABLES: glucosa, sacarosa, Trealosa Deshidratan a las células antes de la congelación minimizando la formación de cristales. Estabilizan la estructura de las membranas. 207 3) DE ALTO PESO MOLECULAR Y NO PERMEABLES: polivinilpirrolidona, polivinil alcohol, ficol otros polímeros (polisacaridos), polielectrolitos. Este tema continuará dentro de una semana!!!!!! 208 12 01/04/2016 Soluciones vitrificadoras-crioprotectoras empleadas para congelar cuerpos humanos http://criogenizacion.net/hielo-el-enemigo-de-la-criogenizacion/ VS41A Veg VM3 M22 Dimethyl sulfoxide 3.10 M 3.10 M 2.855 M 2.855 M Formamide 3.10 M 3.10 M 2.855 M 2.855 M Propylene glycol 2.21 M Ethylene glycol - N-methylformamide - 3-methoxy-1,2propanediol - Polyvinyl pyrrolidone K12* - - 2.713 M 2.713 M - - 0.508 M - - 0.377 M - - 7% w/v 2.8% w/v X-1000 ice blocker* - - 1% w/v 1% w/v Z-1000 ice blocker* - - 1% w/v 2% w/v 8.41 M 9.345 M Total Molarity 8.41 M 2.71 M - 8.91 M 209 Tipos De Congelación • Por aire: una corriente de aire frío extrae el calor del producto hasta que se consigue la temperatura final 0 a - 5 ºC • Por contacto: una superficie fría en contacto con el producto que extrae el calor 0 a -20 ºC • Criogénico: Se utilizan fluidos criogénicos, nitrógeno o dióxido de carbono, que sustituyen al aire frío para conseguir el efecto congelador. 0 a -180ºC 210 13 01/04/2016 OPERACION UNITARIA DE ESTABILIZACION Teóricos 2016 - Prof. Picó ESTABILIZACION Y ESTABILIDAD DE MACROMOLECULAS Estabilizando una enzima Estabilizador de enzimas 211 EL EMPLEO DE ENZIMAS EN DIFERENTES PROCESOS BIOTECNOLOGICOS 212 14 01/04/2016 213 214 15 01/04/2016 ENZIMAS EMPLEADAS EN PROCESOS INDUSTRIALES -SE GUARDAN Y TRANSPORTAN EN SOLUCION ACUOSAS - SE EMPLEAN EN SOLUCION ACUOSA EN BIORECTORES PERDIDA PARCIAL DE LA ESTRUCTURA TERCIARIA PERDIDA PARCIAL DE LA ESTRUCTURA SECUNDARIA DEGRADACION PARCIAL DE SU MOLECULA PER SEC PERDIDA DE LA ACTIVIDAD BIOLOGICA Dificultad para ser empleada en procesos en macro escala Aumentos de los costos - Disminución de los rendimientos Dificultad para ser transportada DESNATURALIZACION 215 ¿ Qué se entiende por estabilizar una enzima ? Lograr que retenga su estructura secundaria, terciaria y cuaternaria: NATIVA vs. TIEMPO Lograr que no pierda su actividad biológica Secreto de fabricación 216 16 01/04/2016 El camino para estabilizar una macromolécula en solución Termodinámica la interacción de una macromolécula con el solvente Termodinámica del proceso de desnaturalización térmica de una macromolécula ESTABILIDAD Y ESTABILIZACION DE MACROMOLECULAS Ufa!! Otra vez la Fisicoquímica Cinética del proceso de desnaturalización de macromoléculas 217 17



