laboratorio de química - Universidad Tecnológica Equinoccial
Anuncio
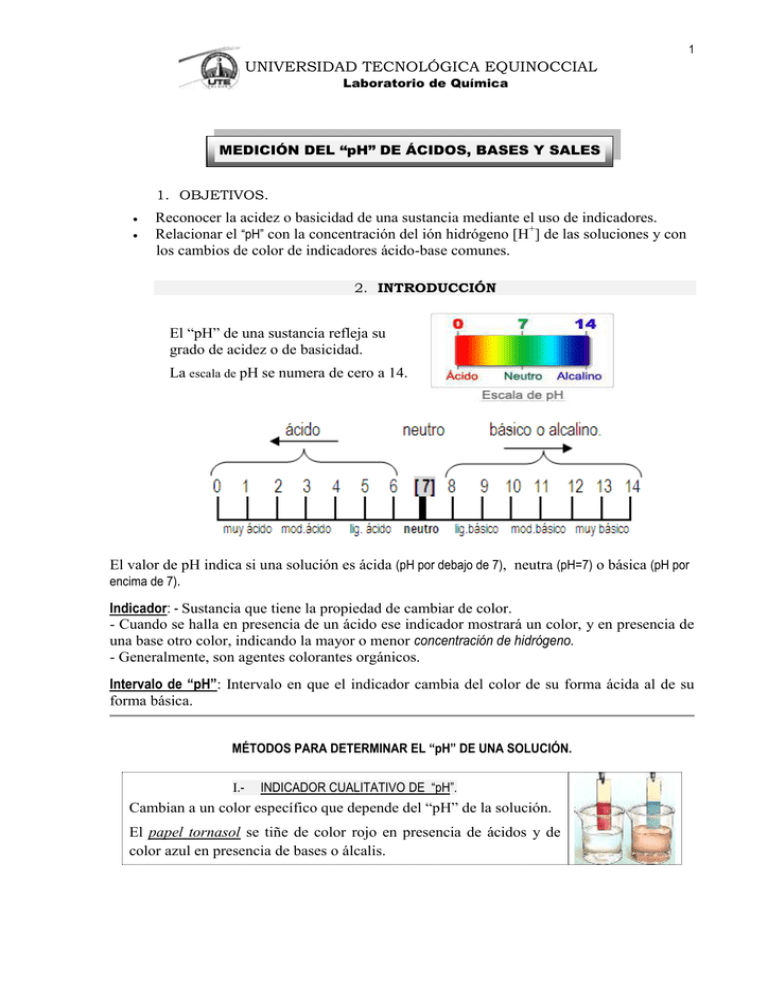
1 UNIVERSIDAD TECNOLÓGICA EQUINOCCIAL Laboratorio de Química MEDICIÓN DEL “pH” DE ÁCIDOS, BASES Y SALES 1. OBJETIVOS. Reconocer la acidez o basicidad de una sustancia mediante el uso de indicadores. Relacionar el “pH” con la concentración del ión hidrógeno [H+] de las soluciones y con los cambios de color de indicadores ácido-base comunes. 2. INTRODUCCIÓN El “pH” de una sustancia refleja su grado de acidez o de basicidad. La escala de pH se numera de cero a 14. El valor de pH indica si una solución es ácida (pH por debajo de 7), neutra (pH=7) o básica (pH por encima de 7). Indicador: - Sustancia que tiene la propiedad de cambiar de color. - Cuando se halla en presencia de un ácido ese indicador mostrará un color, y en presencia de una base otro color, indicando la mayor o menor concentración de hidrógeno. - Generalmente, son agentes colorantes orgánicos. Intervalo de “pH”: Intervalo en que el indicador cambia del color de su forma ácida al de su forma básica. MÉTODOS PARA DETERMINAR EL “pH” DE UNA SOLUCIÓN. I.- INDICADOR CUALITATIVO DE “pH”. Cambian a un color específico que depende del “pH” de la solución. El papel tornasol se tiñe de color rojo en presencia de ácidos y de color azul en presencia de bases o álcalis. 2 II.- INDICADOR CUANTITATIVO DE “pH”: Es el papel indicador universal que mide el valor aproximado del “pH” de una solución. Tiene una escala de comparación que va del cero al 14. III.- SOLUCIONES DE INDICADORES ÁCIDO-BASE: Sustancias que cambian de color en función de variación de la magnitud de “pH”. Como ejemplo tomaremos: Fenolftaleína : (C20H14O4) Indicador ácido, cuyo intervalo de pH es (8.3-10). - En presencia de soluciones ácidas, es incolora. - En presencia de soluciones básicas o alcalinas es de color rojo-violeta. Naranja de metilo o heliantina: (C14H14N3NaO3S). Su peso molecular es de 327,34 g/mol. Indicador básico, cuyo intervalo de pH es (3.1- 4.4). - En presencia de soluciones ácidas, toma una coloración rosa. - En presencia de soluciones básicas, toma una coloración amarillo-anaranjada. IV.- POTENCIÓMETRO o pH-METRO ELECTRÓNICO Se utiliza para determinar la acidez o alcalinidad que posee cada sustancia. Este equipo usa electrodo para medir el “pH exacto” de una solución. Potenciómetro mide dos variables: “pH” y temperatura. Electrodo no se ve afectado por gases disueltos, agentes oxidantes o reductores, materia orgánica, etc. USO DEL POTENCIÓMETRO: Calibrarlo con buffer precisos. Usar buffers próximos al valor del pH de soluciones que vaya a medir. USO DEL ELECTRODO: Si usa electrodo: Mantenerlo en solución KCl (3M) o buffer de pH 4. No usa electrodo: Mantenerlo en solución KCl (3M) dentro del capuchón. Nunca almacenarlo en agua destilada o buffer 7, porque iones resbalarán por bulbo de vidrio y electrodo se volvería inútil. Limpiar electrodo sin frotarlo, sino secarlo suavemente con papel absorbente. Realizar ajuste de calibración diario, siempre y cuando vaya a utilizar equipo. Calibrar el equipo en dos puntos. Si pendiente (% slope) está baja, sumergir electrodo en alcohol o acetona unos minutos y luego lavar con agua destilada. 3 3. MATERIALES Y MÉTODOS. 3.1. M A T E R I A L E S EQUIPO MATERIALES Gradilla pH-metro electrónico Tubos de ensayo Varillas de agitación Pinza para tubo de ensayo Placas portaobjetos. INDICADORES Papel tornasol. Papel indicador universal. Solución de fenolftaleína, al 0,1% en alcohol. Solución acuosa de anaranjado de metilo al 0,1%. REACTIVOS: SOLUCIONES ACUOSAS DILUÍDAS, de concentración 0.1 Molar 1 2 3 4 5 6 7 8 9 10 11 12 [HNO3] [NaOH] [NaCl] [H3PO4] [KOH] [Na2CO3] [CH3COOH] [NH4OH] [NH4Cl] [KCl] [H2SO4] [HCl] Ácido nítrico Hidróxido de sodio Cloruro de sodio Ácido Fosfórico Hidróxido de potasio Carbonato de sodio Ácido acético Hidróxido de amonio Cloruro de amonio Cloruro de potasio Äcido sulfúrico Ácido clorhídrico 0,1 molar 0,1 molar 0,1 molar 0,1 molar 0,1 molar 0,1 molar 0,1 molar 0,1 molar 0,1 molar 0,1 molar 0.1molar 0,1 molar MUESTRAS LÍQUIDAS a b c d e f g h i j k l m n o p alcohol antiséptico agua mineral. vinagre. bebida alcohólica gaseosa (transparente) zumo de limón zumo de naranja. agua potable. agua destilada. agua carbonatada vino. cerveza. café. leche. té. jabón líquido. 3.2. M É T O D O Prepare las “TABLAS DE DATOS”, donde anotará los cambios de color o los valores de “pH” para cada una de las soluciones y muestras. Determine si son ácidas (A), básicas (B) o neutras (N), según el modelo siguiente: Tabla I.- MEDICIÓN DEL “pH” DE SOLUCIONES ACUOSAS DILUÍDAS, de concentración 0.1 Molar INDICADORES SOLUCIONES Papel tornasol Papel indicador universal Fenolftaleína. Naranja de metilo Potenciómetro (temperatura) 4 Tabla II.- MEDICIÓN DEL “pH” DE MUESTRAS LÍQUIDAS. MUESTRAS INDICADORES Papel tornasol Papel indicador universal Fenolftaleína. Naranja de metilo Potenciómetro (temperatura) * NOTA: Una vez utilizados, desechar los papeles tornasol y universal. Parte I.- INDICADORES CUALITATIVOS DE “pH” - En tubos de ensayo, poner aprox. 2 ml. de cada una de las soluciones. - Con la varilla tocar por un extremo, la solución del tubo de ensayo y transferir algunas gotas a la tira de papel indicador tornasol. (Asegúrese de que solamente se humedece el papel con la solución. Si se humedece demasiado, simplemente se retira todo el colorante del papel). - Observar y anotar de qué color están teñidas las tiras humedecidas y determinar si las soluciones son ácidas, básicas o neutras. - Una vez utilizados, desechar los papeles tornasol. Parte II.- INDICADOR CUANTITATIVO DE “pH” - Humedecer la banda de colores de cada tira de papel indicador universal, con las soluciones contenidas en los tubos de ensayo. - Comparar la tira de papel indicador universal humedecida, con la escala de colores y anotar a qué valor de “pH” se aproxima, indicando si las soluciones son ácidas, básicas o neutras. - Una vez utilizado, desechar el papel indicador universal. Parte III.- SOLUCIONES DE INDICADORES ÁCIDO-BASE. - De las soluciones contenidas en los tubos de ensayo, poner algunas gotas en placas portaobjetos. Añadir una gota de fenolftaleína. Observar la coloración que toma la solución.- Anote en la “Tabla de datos” respectiva. Proceder de la misma forma, pero añadir una gota de naranja de metilo. Parte IV.- POTENCIÓMETRO o pH-METRO ELECTRÓNICO: - Calibrar el equipo con 2 soluciones buffer, tampón o reguladoras (pH= 4, 7, 10). Se calibra una sola vez y se puede medir el pH de “n” cantidad de muestras. Enjuagar el electrodo con agua destilada y luego secarlo. (Para cada determinación). - Realizar la medición del “pH” en las soluciones analizadas, anotando la temperatura de la muestra. - Los valores del “pH”, se dan corrientemente, con dos cifras decimales. 5 CÁLCULOS.- PREPARACIÓN DE SOLUCIONES. Realizar el cálculo respectivo. Anote como prepararía la solución en el laboratorio. *Datos de densidad de algunos líquidos. LÍQUIDOS DENSIDAD Ácido clorhídrico (HCl) Ácido sulfúrico (H2SO4) Ácido acético (CH3COOH) Hidróxido de amonio (NH4OH) 1,19 g/mL 1,84 g/mL 1,055 g/mL 0,9 g/mL Preparar …………mL de una solución de ácido clorhídrico HCl(l) (…….. molar). Preparar …………mL de una solución de hidróxido de sodio NaOH(s) (………molar). 3) Preparar …………mL de una solución de cloruro de sodio NaCl(s) (………molar). 1) 2) Preparar ……….. mL de una solución de ácido sulfúrico H2SO4(l) (……..molar) 5) Preparar …………mL. de una solución de hidróxido de potasio KOH(s) (………molar). 6) Preparar ………... mL. de una solución de carbonato de sodio Na2CO3(s) (……..molar). 4) Preparar …………mL de una solución de ácido acético CH3COOH(l) (……..molar). 8) Preparar ………...mL de una solución de hidróxido de amonio NH4OH(l) (……..molar). 9) Preparar ……….. mL de una solución de cloruro de amonio NH4Cl(s) (……..molar). 7) 10) Preparar …………mL de una solución de cloruro de potasio 4. KCl(s) (……..molar). CUESTIONARIO DE INVESTIGACIÓN 4.1. 4.2. 4.3. 4.4. ¿Qué es el “pH” y la temperatura influye o no en su medición, por qué?. ¿Qué es una solución buffer, amortiguadora, reguladora o tampón de pH?. ¿Qué es un pH-metro y defina lo que es el electrodo de pH?. ¿Anote 2 tipos de electrodo de “pH” y cuál es el más utilizado?. 4.5. Anote 2 indicadores ácido-base con su intervalo de “pH” y la coloración que toman en medio ácido y en medio básico o alcalino.





