CC Cl Cl HHCCH Cl H Cl CC Cl HH Cl
Anuncio

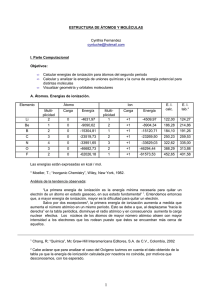
ESTRUCTURA DE LA MATERIA SEMESTRE 2012-II EXAMEN DEPARTAMENTAL 1- ¿Por qué el dióxido de carbono (CO2) es no polar mientras que el dióxido de azufre (SO2) es polar? a) Porque el SO2 es angular y el CO2 es lineal. b) Porque el azufre está en la misma familia que el oxígeno. c) Porque el SO2 presenta estructuras resonantes y el CO2 no. d) Porque el azufre es menos electronegativo que el carbono. 2- ¿Qué concepto explica que la primera energía de ionización del oxígeno sea menor que la primera energía de ionización del nitrógeno? a) Capas llenas y semillenas. b) Radio atómico. c) Carga nuclear efectiva. d) Electronegatividad. 3- La estructura de Lewis que respeta la regla del octeto y representa a la molécula de ácido nítrico (HNO3) tiene: a) dos enlaces sencillos N-O, un enlace doble N=O y un enlace sencillo O-H. b) un enlace sencillo N-O, dos enlaces dobles N=O y un enlace sencillo O-H. c) tres enlaces sencillos N-O y un enlace sencillo O-H. d) tres enlaces sencillos N-O y un enlace sencillo N-H. 4- Un compuesto con fórmula molecular C2H2Cl2 no presenta momento dipolar, ¿cuál de las siguientes estructuras explicaría este hecho? Cl H C a) Cl H Cl C C H b) Cl Cl Cl C C H c) H Cl C H d) H H C C H H Cl 5- Considerando las moléculas H2O y F2O, ¿cómo varía el ángulo de enlace? PREGUNTA CANCELADA a) Aumenta el ángulo conforme disminuye el tamaño de los elementos. b) Aumenta el ángulo conforme aumenta el tamaño de los elementos. c) No varía pues tienen similar estructura de Lewis. d) No se pueden comparar pues poseen diferentes estructuras de Lewis. 6- De acuerdo con la teoría de repulsión de pares electrónicos en la capa de valencia, la geometría molecular del amoniaco (NH3) es: a) tetragonal con ángulos menores de 109° b) piramidal con ángulos menores de 109° c) triangular con ángulos menores de 109° d) tetraédrica con ángulos menores a 109° 7- Para la molécula ClF5, podemos afirmar que: a) no es estable debido a que no se cumple la regla del octeto. b) presenta una geometría molecular tipo bipirámide triangular. c) adopta una geometría molecular piramidal de base cuadrada. d) su geometría molecular es octaédrica. 8- El enlace iónico “puro” se explica: a) considerando que los electrones se encuentran localizados en sus átomos correspondientes. b) con el traslape de orbitales y considerando que los electrones no se comparten. c) considerando que uno de los átomos cede electrones mientras otro los acepta. d) con el traslape de orbitales y considerando que se comparten los electrones. 9- Un elemento A tiene 2 electrones desapareados en su capa de valencia y otro elemento B presenta en su capa de valencia la configuración 3s23p5. Si estos dos elementos se combinan entre sí, una posible fórmula del compuesto que originan será: a) AB b) AB2 c) A2B d) A7B2 10- Teniendo en cuenta que los valores de la electronegatividad según la escala de Pauling de los siguientes elementos son: 1H: 2.1; 8O: 3.5; 11Na: 0.9; 16S: 2.5 y 17Cl: 3.0 ¿Cuál de los siguientes enlaces es más polar? a) HCl b) HO c) HNa d) HS 11- ¿Para cuál de los siguientes átomos, un electrón situado en el orbital 3p, sentirá una mayor carga nuclear efectiva? a) 50Sn c) 17Cl d) 12Mg b) 36Kr 12- En la tabla se muestran algunas energías de ionización para Na, Mg y Al. De esta tabla se puede afirmar que: Energías de ionización (kJ/mol) Elemento EI1 EI2 EI3 EI4 496 4560 11Na 738 1450 7730 12Mg 577 1816 2744 11600 13Al a) se necesita más energía para ionizar al átomo neutro que a sus respectivos cationes. b) se necesita de más energía para ionizar a Na+, Mg2+ y Al 3+. c) se necesita menos energía para ionizar al Mg que al Al. d) el proceso de ionización libera energía. 13- ¿Cuál de las siguientes combinaciones de números cuánticos (n, l, m) no está permitida? a) 9, 6, 3 b) 3, 3, 2 c) 5, 0, 0 d) 4, 2, 0 14- ¿Cuál de las siguientes combinaciones representa a un orbital 4f? a) n = 4, l = 3, m = 2 b) n = 4, l = 2, m = -1 c) n = 4, l = 1, m = 1 d) n = 4, l = 0, m = 0 15- Al analizar la especie química 2He+ mediante la ecuación de Schrödinger, se obtienen, para el nivel n = 4: a) 16 estados degenerados. b) 9 estados degenerados. c) 4 estados degenerados. d) 0 estados degenerados. 16- ¿Cuál de los siguientes tipos de radiación electromagnética interactúa con los grados de libertad vibracionales de un enlace en una molécula? a) Microondas c) Visible b) Infrarrojo d) Ultravioleta 17- ¿Cuál de las siguientes combinaciones de números cuánticos describen de manera correcta y completa a un electrón en un átomo? a) n = 4, l = 1, m = 1, ms = 1 b) n = 4, l = 2, m = 3, ms = -½ c) n = 2, l = 2, m = 0, ms = ½ d) n = 2, l = 0, m = 0, ms = ½ 18- Elija la opción que indique el orden adecuado, de mayor a menor radio. a) 7N3– > 9F– > 12Mg2+ > 10Ne b) 12Mg2+ > 10Ne > 9F– > 7N3– c) 7N3– > 9F– > 10Ne > 12Mg+2 d) 12Mg2+ > 7N3– > 9F– > 10Ne 19- ¿Cuántos electrones desapareados hay en el estado fundamental de cada una de las especies químicas: 2+ 3– y 2+ 50Sn , 5B 26Fe ? a) 0, 2 y 4 b) 0, 2 y 6 c) 2, 3 y 4 d) 2, 3 y 6 20- De la siguiente tabla, señale cuáles cuartetas de números cuánticos son válidas para un electrón en un átomo. n l m ms A 2 1 0 -½ B 3 0 1 +½ C 4 4 -3 -½ D 5 2 -2 +½ a) A y C b) B y D c) B y C d) A y D 21- ¿En cuál de los siguientes fenómenos experimentales no está de manifiesto la cuantización de la energía? a) El espectro de absorción-emisión del átomo de hidrógeno. b) La difracción de electrones cuando pasan por una rejilla. c) Los valores de la energía de ionización de los átomos. d) Los espectros fotoelectrónicos de los átomos. 22- La ecuación mv = h/λ se refiere a una teoría que explica directamente: a) el espectro de absorción-emisión del átomo de hidrógeno. b) la difracción de electrones cuando pasan por una rejilla. c) los valores de la energía de ionización de los átomos. d) los espectros fotoelectrónicos de los átomos. 23- Al duplicar la cantidad de movimiento de un electrón: a) Su longitud de onda se reduce a la mitad. b) Su longitud de onda aumenta al doble. c) Su energía disminuye a la mitad. d) Su energía aumenta al doble. 24- Un electrón que viaja libremente tiene una energía de 8.9375 eV, su longitud de onda asociada es: a) 1.4x10-7 m b) 4.1x10-7 m c) 1.4x10-10 m d) 4.1x10-10 m