L - UNAM
Anuncio
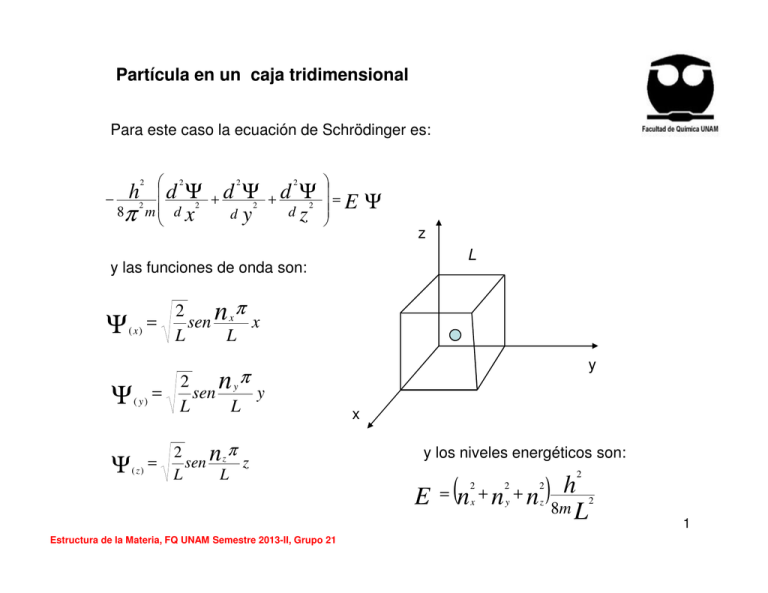
Partícula en un caja tridimensional Para este caso la ecuación de Schrödinger es: 2 2 2 − h2 d Ψ2 + d Ψ2 + d Ψ 2 d 8π m d x d y z 2 = E Ψ z L y las funciones de onda son: Ψ ( x) = Ψ( y) = Ψ ( z) = π 2 sen n x x L L y nyπ 2 sen y L L π 2 sen n z z L L x y los niveles energéticos son: E Estructura de la Materia, FQ UNAM Semestre 2013-II, Grupo 21 = (n + n + n )8mh 2 2 2 x y z 2 L 2 1 Figura. Características de las ondas. Cresta (Wave peak), valle (wave trough), longitud de onda wavelength. Longitud de onda (λ); distancia entre los máximos de dos crestas o valles. La λ se mide en nm. Amplitud, altura máxima de un cresta o valle. La amplitud de la onda se relaciona con la intensidad de la radiación. Frecuencia (ν), se define como un ciclo completo de una onda en un segundo, s-1 o Hz. Estructura de la Materia, FQ UNAM Semestre 2013-II, Grupo 21 Figura. La energía radiante, tiene características de onda; consta de ondas electromagnéticas. 2 Naturaleza ondulatoria de la luz •La luz visible, es un tipo de radiación electromagnética. •La radiación electromagnética transporta energía a través del espacio y por eso se le conoce como energía radiante. •Todos los tipos de radiación electromagnética se mueven en el vacío a una velocidad de 3x108 m/s, velocidad de la luz. •La radiación electromagnética presenta características ondulatorias debidas a las oscilaciones periódicas de las intensidades de las fuerzas electrónicas y magnéticas asociadas a la radiación, ver Figura de energía radiante. La Figura siguiente muestra los diversos tipos de radiación electromagnética, en orden creciente de longitud de onda. Estructura de la Materia, FQ UNAM Semestre 2013-II, Grupo 21 Figura. Espectro electromagnético 4 Estructura de la Materia, FQ UNAM Semestre 2013-II, Grupo 21 El espectro electromagnético muestra los diferentes tipo de radiación electromagnética, el cual abarca desde los rayos gama hasta las ondas de radio. La región visible está compuesta por diferente tipos de luz, correspondientes a diferentes colores, en un rango de 400-750 nm, (1nm=1x10-9m). 5 Estructura de la Materia, FQ UNAM Semestre 2013-II, Grupo 21 FOTONES Y ENERGÍA CUANTIZADA Aunque el modelo ondulatorio de la luz explica muchos aspectos de su comportamiento, hay fenómenos que no puede explicar. Estos son: 1. La emisión de la luz por parte de objetos calientes (radiación del cuerpo negro) 2. La emisión de electrones por superficies metálicas en los que incide la luz (el efecto fotoeléctrico) 3. La emisión de luz por parte de átomos de gas excitados electrónicamente (espectros de emisión). Max Planck (1858-1947) propuso que la energía solo puede ser liberada (emitida) o absorbida por átomos en paquetes de energía discretos con cierto tamaño mínimo. A estos paquetes de energía, Planck los llamó CUANTOS (cantidad fija). La energía, E, de un solo CUANTO es igual a una constante multiplicada por su frecuencia: E = hν Energía de un fotón Estructura de la Materia, FQ UNAM Semestre 2013-II, Grupo 21 6 h= Constante de Planck h= 6.63 x 10-34 J s ν = frecuencia Según la teoría de Planck, la teoría cuántica, la materia siempre emite o absorbe energía en múltiplos enteros de hv; hv, 2hv, 3hv, etc …(Cuantos de enrgía) Si la cantidad de energía emitida por un átomo es de 3hv, decimos que se emitieron 3 cuantos de energía. Es decir las energías permitidas están cuantizadas o que sus valores están restringidos a ciertas cantidades. En objetos macroscópicos, como las personas, la ganancia o pérdida de un solo cuanto de energía pasa completamente desapercibido, mientras que si tratamos con materia a nivel atómico (microscópico), el impacto de la energía cuantizada es muy importante. La comprobación de la teoría cuántica de Planck sirvió de base para la explicación el efecto fotoeléctrico por Albert Einstein (1879-1955). 7 Estructura de la Materia, FQ UNAM Semestre 2013-II, Grupo 21 RADIACION DEL CUERPO NEGRO La superficie de un cuerpo negro es un caso límite, en el que toda la energía incidente desde el exterior es absorbida, y toda la energía incidente desde el interior es emitida. Pero, en la naturaleza no existe un cuerpo negro, este es un modelo de la física para explicar la absorción total de la luz. El color negro de humo, que es carbón en forma de hollín refleja el 1% de la energía incidente !!!. Estructura de la Materia, FQ UNAM Semestre 2013-II, Grupo 21 8 Sea una cavidad cuyas paredes están a una cierta temperatura. Los átomos que componen las paredes están emitiendo radiación electromagnética y al mismo tiempo absorben la radiación emitida por otros átomos de las paredes. Cuando la radiación encerrada dentro de la cavidad alcanza el equilibrio con los átomos de las paredes la cantidad de energía que emiten los átomos en la unidad de tiempo es igual a la que absorben. En consecuencia, cuando la radiación dentro de la cavidad está en equilibrio con las paredes, la densidad de energía del campo electromagnético es constante. Max Planck sugirió que: 1. La radiación dentro de la cavidad está en equilibrio con los átomos de las paredes que se comportan como osciladores armónicos de frecuencia dada v . 2. Cada oscilador puede absorber o emitir energía de la radiación en una cantidad proporcional a v. Cuando un oscilador absorbe o emite radiación electromagnética, su energía aumenta o disminuye en una cantidad hv . 9 Estructura de la Materia, FQ UNAM Semestre 2013-II, Grupo 21 EFECTO FOTOELECTRICO Figura. El efecto fotoeléctrico. a) Cuando los fotones con energía lo suficientemente alta chocan con una superficie metálica, el metal emite electrones. b) Los electrones emitidos son atraídos hacia la terminal positiva. Es decir fluye una corriente en el circuito. Estructura de la Materia, FQ UNAM Semestre 2013-II, Grupo 21 10 Luz incidente o Energía radiante Electrones emitidos Fotón= Diminutos paquetes de energía La energía radiante que incide sobre la superficie metálica es una corriente de diminutos paquetes de energía o fotones. Cada fotón tiene una energía proporcional a la frecuencia de la luz. E fotón = hν 11 Estructura de la Materia, FQ UNAM Semestre 2013-II, Grupo 21 Energía de un fotón absorbido = Energía necesaria para liberar 1 electrón + energía cinética del electrón emitido. Cuando un fotón de energía hv choca con la superficie metálica y este fotón supera la función trabajo Φ, se libera un electrón con una energía Ek, que es la energía cinética. La ley de conservación de la energía nos dice que: 1 2 = + h h 0 2 m vm ν ν hν =φ + E k h es la constante de Planck, hv0 es la frecuencia de corte o frecuencia mínima de los fotones Φ es la función trabajo, o mínima energía necesaria Ek es la máxima energía cinética de los electrones Si la energía del fotón (hv) no es mayor que la función de trabajo (Φ), no se emite ningún electrón. Checar la siguiente página: http://www.sc.ehu.es/sbweb/fisica/cuantica/fotoelectrico/fotoelectrico.htm 12 Estructura de la Materia, FQ UNAM Semestre 2013-II, Grupo 21



