tema 1 qo estrucutra y propiedades clase
Anuncio
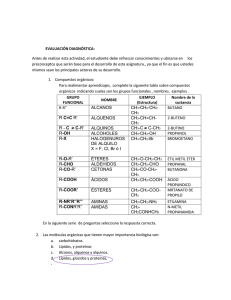
1.‐ Introducción La Química Orgánica es la parte de la química que estudia los Compuestos de Carbono Más del 95% de las sustancias químicas conocidas son compuestos del carbono y más de la mitad de los químicos actuales en el mundo se denominan a sí mismos químicos orgánicos. Todos los compuestos responsables de la vida ( ácidos nucleicos, proteínas, enzimas, hormonas, azúcares, lípidos, vitaminas, etc.) son sustancias orgánicas. La industria química (fármacos, polímeros, pesticidas, herbicidas, etc.) juega un papel muy importante en la economía mundial e incide en muchos aspectos de nuestra vida diaria con sus productos. 1.1.- Breve Historia de la Química Orgánica El Finales del XVIII enigma de la Química Orgánica: La fuerza vital. Se observa que los compuestos orgánicos están formados por un número muy limitado de elementos. Se Principios del XIX intuyen ciertos visos de ordenamiento estructural. Se establece la ley de proporciones múltiples. Síntesis 1820’s de la urea: se tiende el puente entre la Química Inorgánica y la Orgánica. Se mejora la precisión del análisis elemental. Se produce una complicación insospechada: la isomería. Los 1830’s 1830’s-1840’s radicales orgánicos como un principio de ordenación. El descubrimiento y la profusión de los radicales orgánicos. Orden entre los radicales orgánicos: la sustitución. Definición de radicales derivados. 1840’s-1850’s 1850’s 1860’s 1870’s 1880’s 1930’s-1940’s Ordenación por tipos de compuestos. La unificación de radicales y tipos. • Estructura interna de los radicales: la tetravalencia del carbono y su capacidad para formar cadenas. • Primeras formulaciones modernas. • Estructura tetraédrica del carbono: isomería optica. • Estructura hexagonal del benceno. • Planteamiento de la Teoría de la Resonancia. Desarrollo de la Espectroscopía de rayos X. Desarrollo de la Espectrometría de masas. • • • 1950’s • Análisis conformacional: estereoquímica del ciclohexano. Descubrimiento de la Resonancia Magnética Nuclear. 2.‐ Estructura de los átomos CAPA DE VALENCIA DE LOS 18 PRIMEROS ELEMENTOS CONECTIVIDAD Grupos del Sistema Periódico PROPIEDADES PERIÓDICAS: RADIO ATÓMICOS PROPIEDADES PERIÓDICAS: ELECTRONEGATIVIDAD 3.‐ Enlace y moléculas 3.1.- ENLACE IÓNICO – ENLACE COVALENTE IÓNICO COVALENTE APOLAR COVALENTE POLAR ENLACE IÓNICO ENLACE COVALENTE NO POLAR POLAR TIPO DE ENLACE Y ELECTRONEGATIDAD CONTORNOS DE POTENCIAL ELECTROSTATICO Rojo < Naranja < Amarillo < Verde < Azul 3.3.-TEORÍA DE LEWIS Átomos Los átomos forman moléculas porque compartiendo electrones alcanzan el octeto electrónico Moléculas Diatómicas En el establecimiento de las estructuras de Lewis es muy importante tener en cuenta tres aspectos 1.- Asignar cargas formales a los átomos 2.- Valorar la existencia de formas resonantes 3.- Hay átomos que no cumplen la regla del octeto Cargas formales Para determinar cargas formales sobre los átomos: Carga Formal = Número e Capa valencia - Número e Desapareados + Mitad e compartidos Resonancia. No siempre existe una única estructura de Lewis que pueda explicar las propiedades de una molécula o ión. A cada una de ellas se le denomina forma resonante y al conjunto híbrido de resonancia En el caso del ion CO32–, se podrían formar tres estructuras de Lewis en las que el doble enlace se forma con cada uno de los átomos de oxigeno, siendo las tres válidas. Cada una de estas formas contribuye por igual al la estructura del ion CO32–, siendo la verdadera estructura una mezcla de las tres. Condiciones para escribir formas resonantes: 1. Para pasar de una forma resonante a otra solamente puedo mover electrones, nunca átomos. 2. Todas las estructuras resonantes que yo escriba deben ser estructuras de Lewis válidas. 3. Las estructuras resonantes deben poseer el mismo número de electrones desapareados. 4. Las estructuras resonantes más importantes son las de menor energía potencial. Ejercicio: Escribir las formas resonantes del nitrometano y DMAP Nitrometano (N,N-dimetilamino)piridina DMAP ¿Cuál de todas las estructuras resonantes se parece más al compuesto real? 1. Aquella en la que todos los átomos tienen el octete completo. 2. Aquellas en las que no existe separación de carga es más importante que la que en la que existe separación de carga. 3. Cuando en dos formas resonantes existe separación de carga es más estable aquella que tiene las cargas más alejadas. 4. Las estructuras de resonancia que lleven carga negativa sobre un átomo electronegativo contribuye más que cuando esa carga va sobre otro átomo. 5. Si hay dos formas resonantes iguales la resonancia será más importante. Cuando una forma resonante es muchísimo más estable que las demás la resonancia no existe y la molécula real se parece mucho a esta forma. Cuando todas las formas resonantes son importantes, entonces la molécula real sí es un híbrido de todas las formas resonantes. 3.4.- TEORÍA DEL ENLACE-VALENCIA. HIBRIDACIÓN Los enlaces covalentes se producen por solapamiento de orbitales atómicos semiocupados de distintos átomos Orbital 1s semiocupado de un átomo de H Orbital 1s semiocupado de un átomo de H Molécula de hidrógeno Tipos de enlace covalente según el solapamiento Enlace tipo sigma σ: solapamiento frontal Enlace tipo pi π: solapamiento lateral 3.4.- HIBRIDACIÓN: Geometría molecular según TEV HIBRIDACIÓN sp3 METANO El carbono sólo podría formar dos enlaces C-H Todos los enlaces C-H del metano son idénticos – 4 enlaces sencillos. Ejemplo: metano – 3 enlaces sencillos + 1 par e– sin compartir. Ej: NH3 – 2 enlaces sencillos + 2 par e– sin compartir. Ej: H2O Un carbono unido a cuatro átomos siempre tendrá hibridación sp3 y una estructura tetraédrica. Así son los alcanos, haluros de alquilo, alcoholes, éteres y aminas, entre otros. Todos estos compuestos tienen estabilidad suficiente como para poder ser almacenados sin problemas especiales. Un carbono unido a menos de cuatro átomos también puede tener hibridación sp3 pero la estructura variará dependiendo del número de sustituyentes: Estructura Tipo de compuesto Geometría Carbaniones Carbenos Piramidal Angular Los carbaniones y carbenos son especies altamente reactivas (intermedios de reacción) y en general tienen un tiempo de vida muy corto. HIBRIDACIÓN sp2 ETENO Hibridación sp2 sp2 2pz – 3 enlaces sencillos. Ejemplo: BF3 – 1 enlace doble y 2 sencillos . Ejemplo: eteno Un carbono unido a tres átomos, que mantiene un doble enlace con uno de ellos, siempre tendrá hibridación sp2 y una geometría trigonal plana. Así son compuestos estables tales como olefinas, hidrocarburos aromáticos, aldehídos, cetonas y ácidos carboxílcos y derivados, entre otros. Existen otras situaciones donde un átomo de carbono unido a tres átomos también posee hibridación sp2: Estructura Tipo de compuesto Carbocatión (ion carbenio) Radical Geometría Trigonal plana Trigonal plana Carbocationes y radicales son especies altamente reactivas (intermedios de reacción) y en general tienen un tiempo de vida muy corto. HIBRIDACIÓN sp2 C 6H 6 Kekule BENCENO Problema: El benceno es mucho más estable que lo que cabría esperar de la estructura propuesta por Kekule La hidrogenación del benceno libera mucha menos energía que la esperable Hibridación sp2 sp2 2pz Estabilidad debida a la deslocalización de los electrones del anillo (aromaticidad) HIBRIDACIÓN sp2 GRUPO CARBONILO Átomo carbono: Hibridación sp2 Átomo oxígeno: Hibridación sp2 HIBRIDACIÓN sp ACETILENO (Dos regiones de densidad electrónica alrededor del C) – 2 enlaces sencillos. Ejemplo: BeF2 – 2 enlaces dobles. Ejemplo: CO2 – 1 enlace triple y 1 sencillo. Ejemplo: etino Un carbono unido a dos átomos, que mantiene un triple enlace con uno de ellos, siempre tendrá una hibridación sp y una estructura lineal. Existen otras posibilidades: Estructura Tipo de compuesto Aleno Acetiluro Geometría Lineal Lineal Los alenos son compuestos estables. Los acetiluros son especies reactivas (intermedios de reacción). Electronegatividad del carbono en función de su hibridación El carbono tiene mayor electronegatividad a medida que aumenta el carácter s de la hibridación. Por tanto los carbonos del etano (sp3) son menos electronegativos que los del eteno (sp2) y éstos a su vez menos electronegativos que los del etino (sp). El cálculo de las densidades electrónicas en estos tres compuestos refleja claramente este hecho: (azul +, rojo -) Etano Eteno Etino Los hidrógenos tienen una coloración azul más acusada desde el etano al etino, prueba de su menor densidad electrónica como consecuencia de la electronegatividad creciente del carbono. HIBRIDACIÓN DE ORBITALES ATÓMICOS EN NITRÓGENO Y OXÍGENO sp3 Nitrógeno Oxígeno Estructura Tipo Geometría Aminas Sales de amonio Alcoholes Éteres Alcóxidos Piramidal Tetraédrica Angular - Las aminas, sales de amonio, alcoholes y éteres son especies estables. Los alcóxidos son especies muy reactivas (intermedios de reacción). sp2 Nitrógeno Oxígeno Estructura Tipo Geometría Iminas Sales de imonio Carbonilos Trigonal plana Trigonal plana Trigonal plana Los tres tipos de compuestos tienen en general estabilidad suficiente como para poder almacenarse sin problemas especiales. Los compuestos con grupos carbonilo son muy variados: pueden ser aldehídos, cetonas, ácidos carboxílicos, haluros de ácido, anhídridos, ésteres y amidas, entre otros. Estructura sp .Nitrógeno Tipo Nitrilos Geometría Lineal Los nitrilos son compuestos estables PARÁMETROS DE ENLACE Enlace Longitud típica (A) Momento dipolar (D) Energía de disociación (kcal/ mol) C-H 1.07 0.40 99 X-H 1.01(N) 0.96(O) 1.31(N) 1.51(O) 93(N) 111(O) C-C 1.54 0 83 C=C 1.33 0 146 C≡C 1.20 0 200 C-N 1.47 0.22 73 C=N 1.30 1.90 147 C≡N 1.16 3.50 213 C-O 1.43 0.74 86 C=O 1.23 2.30 184 C-Cl 1.78 1.46 81 C-Br 1.93 1.38 68 C-I 2.14 1.19 51 3.5.-TEORÍA DEL ORBITAL MOLECULAR La mezcla de N orbitales atómicos da lugar a N orbitales moleculares Ej.: Hidrógeno La combinación de dos orbitales atómicos 1s da lugar a un orbital molecular enlazante σ y a un orbital antienlazante σ*. Los dos electrones de la molécula ocupan el orbital molecular enlazante Los orbitales moleculares tipo σ también se pueden formar por solapamiento frontal de orbitales p o de orbitales híbridos Los orbitales moleculares tipo π se producen por solapamiento lateral de orbitales p Formación de dos orbitales π por solapamiento lateral de orbitales p. Triple enlace carbono-carbono. 3.6.- Enlace covalente polar: Polaridad de los enlaces y las moléculas Un enlace covalente será polar si los átomos enlazados tienen cierta diferencia de electronegatividad Cada enlace tiene un momento dipolar “µ” (magnitud vectorial que depende la diferencia de electronegatividad entre los átomos cuya dirección es la línea que une ambos átomos y cuyo sentido va del menos electronegativo al más electronegativo). Momentos Dipolares de enlaces Enlace Momento Dipolar, D Enlace Momento Dipolar, D H-F 1.7 C-F 1.4 H-Cl 1.1 C-O 0.7 H-Br 0.8 C-N 0.4 H-I 0.4 C=O 2.4 H-C 0.3 C=N 1.4 H-N 1.3 C≡N 3.6 H-O 1.5 La dirección del momento dipolar es hacia el átomo más electronegativo. La polaridad de las moléculas depende de dos factores: a) La existencia de enlaces covalentes polares b) Una geometría que lo permita CO2 BF3 CH4 H2O NH3 4.‐ REPRESENTACIÓN DE LAS MOLÉCULAS EN QUÍMICA ORGÁNICA 4.1.- TIPOS DE FÓRMULAS Fórmula Molecular C 2H 6O C4H10 Formula Estructural Fórmula Desarrollada En 2 D En 3 D Formula Esqueletal 4.2.- PRINCIPALES GRUPOS FUNCIONALES. Clase Grupo funcional Ejemplo alcanos ninguno CH3-CH3 Etano alquenos CH3CH=CH2 Propeno alquinos CH3-C≡C-CH3 2-Butino haluros de alquilo -halógeno CH3-CH2-Br Bromuro de etilo Clase (homo) aromáticos (hetero) aromáticos Grupo funcional Ejemplo Tolueno 3-Metilpiridina Clase Grupo funcional Ejemplo alcoholes fenoles -OH CH3-CH2-OH Etanol Ph-OH Fenol éteres -O- CH3-CH2-O-CH2-CH3 Dietiléter aldehídos cetonas Etanal Propanona Clase ácidos carboxílicos Grupo funcional Ejemplo Ácido acético ésteres Acetato de etilo amidas haluros de acilo anhídridos Acetamida Cloruro de acetilo Anhídrido acético Clase Grupo funcional Ejemplo nitrilos -C≡N CH3CN nitroderivados -NO2 Acetonitrilo CH3NO2 Nitrometano iminas Metilimina de la propanona tioles -SH CH3-CH2-SH sulfuros -S- (CH3)2S sulfonas -SO2- CH3SO2CH3 ácidos sulfónicos -SO2-OH CH3CH2CH2SO2OH Etiltiol Dimetilsulfuro Dimetilsulfona Ácido propanosulfónico Clasificación de los compuestos orgánicos Clasificación de los compuestos orgánicos Solo con C-H C-H y otros elementos hidrocarburos Cadena abierta Saturados Cadena cerrada insaturados alcanos ciclos aromáticos alquenos Ciclo alcano alquinos Ciclo alqueno Ciclo alquino 5.‐ ISOMERÍA ¿QUE SON ISOMEROS? Dos especies químicas diferentes se dice que son isómeras cuando tienen la misma composición elemental y el mismo peso molecular Los isómeros no son superponibles y tienen el mismo número de átomos de cada tipo TIPOS DE ISOMERIA TIPOS FUNDAMENTALES DE ISOMEROS: • ESTRUCTURALES • ESTEREOISOMEROS TIPOS DE ISOMERÍA 5.1.- ISOMERÍA ESTRUCTURAL Son isómeros que difieren entre sí en que sus átomos están unidos de diferente forma Isomería de cadena Isomería de posición Isomería de función - No todos los grupos están unidos a los mismos centros -Son moléculas muy diferentes tanto en sus propiedades físicas como químicas ISOMERÍA DE CADENA Los isómeros de cadena difieren en la forma en que están unidos los átomos de carbono entre sí para formar una cadena ¿Cuántos isómeros tiene el butano? ¿Cuántos isómeros tiene el pentano? ISOMERÍA DE POSICIÓN Los isómeros de posición difieren en las posiciones que ocupan sus grupos en la estructura carbonada Hay dos isómeros estructurales con la fórmula molecular C3H7Br Del alcohol con fórmula molecular Dos isómeros de posición C4H9OH se obtienen: Dos isómeros de cadena En los derivados del benceno se dan casos muy importantes de isomería de posición Fórmula molecular C7H8Cl ISOMERÍA DE FUNCIÓN Los isómeros de función difieren en sus grupos funcionales - La forma en que están unidos los átomos da lugar a grupos funcionales distintos Fórmula molecular C3H6O 2-propen-1-ol Fórmula molecular C3H6O2 4.3.- EL NOMBRE DE LOS COMPUESTOS ORGÁNICOS ALCANOS Nombre Molecular Formula Estructural Formula Isomeros Nombre Molecular Formula Estructural Formula Isomeros Metano CH4 CH4 1 hexano C6H14 CH3(CH2)4CH3 5 Etano C 2H 6 CH3CH3 1 heptano C7H16 CH3(CH2)5CH3 9 propano C 3H 8 CH3CH2CH3 1 octano C8H18 CH3(CH2)6CH3 18 butano C4H10 CH3CH2CH2CH3 2 nonano C9H20 CH3(CH2)7CH3 35 pentano C5H12 CH3(CH2)3CH3 3 decano C10H22 CH3(CH2)8CH3 75 GRUPOS ALQUILO Grup o CH3– C 2H 5– CH3CH2CH2– (CH3)2CH– CH3CH2CH2CH2– (CH3)2CHCH2– CH3CH2CH(CH3)– (CH3)3C– Nom bre Metil Etil Propil Isopropill Butil Isobutil sec-Butil tert-Butil R– Alquil CICLOALCANOS Nombre Molecular Formula Estructural Formula Esqueletal Formula Ciclopropano C 3H 6 Ciclobutano C 4H 8 Ciclopentano C5H10 Ciclohexano C6H12 Cicloheptano C7H14 Cicloalcano CnH2n (CH2)n Reglas IUPAC para nombrar alcanos 1. Encuentre y nombre la cadena continua más larga de carbonos. 2. Identifique y nombre los grupos unidos a esta cadena. 3. Numere la cadena empezando por el extremo más próximo a un sustituyente. 4. Designe la localización de cada grupo sustituyente por el apropiado número y nombre. 5. Construya el nombre, listando los grupos en orden alfabético. Los prefijos di, tri, tetra etc., usados para designar varios grupos iguales, no se consideran en la ordenación alfabética. 3-metilhexano 3,4-dicloro-4-etil-5-metilheptano Carbono 1rio, 2rio, 3rio, 4rio Reglas IUPAC para la nomenclatura de Alquenos 1. El sufijo -eno indica un alqueno o cicloalqueno. 2. La cadena principal debe incluir los dos átomos de carbono unidos por el doble enlace. 3. La cadena principal debe ser numerada por el extremo más próximo al doble enlace. Si la insaturación está en el centro de la cadena se empieza a numerar por el extremo que tenga más próximo un sustituyente. 4. El más pequeño de los números asignados a los átomos del doble enlace se utiliza para indicar la posición de la insaturación. Si hay más de un doble enlace el compuesto es denominado dieno, trieno,.. 5. En los cicloalquenos a los carbonos del doble enlace se les asigna los números 1 y 2. El número 1 puede ser determinado por la regla de los sustituyentes. 6. Grupos sustituyentes más importantes conteniendo doble enlace son: H2C=CH– Grupo vinilo H2C=CH–CH2– Grupo alilo ¿Cuál es el nombre de los siguientes alquenos? 1.- (CH3)2C=CHCH2C(CH3)3 3.- (C2H5)2C=CHCH(CH3)2 2.- 4.- (CH3CH2CH2)2C=CH2 CH2=C(CH3)CH(CH3)C(C2H5)=CH2 Reglas IUPAC para la Nomenclatura de Alquinos 1. El sufijo -ino indica alquino o cicloalquino. 2. La cadena principal debe contener a los dos carbonos unidos por el triple enlace. 3. La cadena principal debe ser numerada desde el extremo más próximo al triple enlace. Si el triple enlace está situado en el centro de la cadena se aplica la regla de los sustituyentes. 4. El menor número de los carbonos unidos por triple enlace debe ser usado como localizador de la insaturación. 5. Si están presentes varios enlaces múltiples, cada uno debe tener su localizador. Los dobles enlaces preceden a los triples en los nombres IUPAC, pero la cadena debe ser numerada a partir del extremo que tenga más próximo un enlace múltiple sea cual sea su naturaleza. 6. A causa de su carácter linear, los anillos que pueden acomodar un triple enlace deben tener al menos diez carbonos. En los cicloalquinos simples los carbonos unidos por el triple enlace son numerados con el 1 y el 2. El número 1 se determina por la proximidad de los sustituyentes. 7. Grupos sustituyentes conteniendo triple enlace son: HC≡C– Grupo Etinil HC≡CH–CH2– Grupo Propargil Ejemplos alquenos y alquinos PROBLEMAS DE MORRISON & BOYD pag. 120 PROBLEMAS DE MORRISON & BOYD pag.290