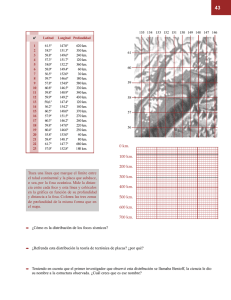
Biodiversidad y comunidades del talud continental del Pacífico
Anuncio

Biodiversidad y comunidades del talud continental del Pacífico mexicano Biodiversidad y comunidades del talud continental del Pacífico mexicano Pablo Zamorano, Michel E. Hendrickx y Margarita Caso (editores) Secretaría de Medio Ambiente y Recursos Naturales Instituto Nacional de Ecología Universidad Nacional Autónoma de México Instituto Nacional de Pesca Universidad Autónoma de Sinaloa Primera edición: 2012 D.R. © Secretaría de Medio Ambiente y Recursos Naturales Blvd. Adolfo Ruiz Cortines 4209. Col. Jardines en la Montaña C.P. 14210. Delegación Tlalpan, México, D.F. www.semarnat.gob.mx Instituto Nacional de Ecología (INE-Semarnat) Periférico Sur 5000. Col. Insurgentes Cuicuilco C.P. 04530. Delegación Coyoacán, México, D.F. www.ine.gob.mx Diseño de portada: Pluralia Foto de portada: Hugo Aguirre Villaseñor ISBN 978-607-8246-48-9 Impreso y hecho en México Índice Prólogo Agradecimientos 11 17 Sección I. El proyecto TALUD y la Zona de Mínimo Oxígeno Operaciones oceanográficas en aguas profundas: los retos del pasado, del presente y del proyecto TALUD en el Pacífico mexicano (1989-2009) Michel E. Hendrickx La zona mínimo del oxígeno en el Pacífico mexicano David Serrano 23 105 Sección II. Meiofauna Meiofauna de mar profundo del golfo de California: algunos aspectos acerca de la distribución y abundancia de 123 Copepoda S. Gómez y F. N. Morales-Serna Generalidades de los copépodos parásitos de peces en aguas profundas y el caso de Lophoura brevicollum (Siphonostomatoida: Sphyriidae) Francisco Neptalí Morales-Serna y Samuel Gómez 145 Sección III. Macroinvertebrados Poliquetos (Annelida, Polychaeta) del talud continental suroriental del golfo de California y su relación con algunas variables ambientales Nuria Méndez Recolección y cuantificación de macrofauna de mar profundo: el caso de estudio del poliqueto Melinnampharete gracilis Hartman, 1969 (Ampharetidae) Nuria Méndez y Michel E. Hendrickx Moluscos de aguas profundas del sur del golfo de California Pablo Zamorano y Michel E. Hendrickx 161 225 243 Crustáceos decápodos (Arthropoda: Crustacea: Decapoda) de aguas profundas 283 del Pacífico mexicano: lista de especies y material recolectado durante el proyecto TALUD Michel E. Hendrickx Los Glyphocrangonidae y Crangonidae (Crustacea: Decapoda: Caridea) recolectados durante los cruceros TALUD en el Pacífico mexicano Michel E. Hendrickx 319 Distribución de Stereomastis pacifica (Faxon, 1893) (Crustacea; Decapoda; Polychelidea; Polychelidae) y notas sobre la distribución de Willemoesia inornata Faxon, 1893 en el Pacífico mexicano Michel E. Hendrickx 357 Listado sistemático de los equinodermos de aguas profundas del Pacífico mexicano Michel E. Hendrickx 373 Sección IV. Vertebrados Nuevo registro de la quimera prieta del Pacífico este, Hydrolagus melanophasma James, Ebert, Long y Didier, 2009, (Halocephali, Chimaeiformes, Chimaeridae) en el Pacífico central mexicano Hugo Aguirre-Villaseñor, Carolina Salas-Singh y Juan Madrid Vera 397 Distribución geográfica de cuatro especies de la familia Macrouridae (Teleostei; Gadiformes) en el centro-sur del golfo de California Hugo Aguirre-Villaseñor y Daniel de Jesús Moreno Flores 411 Discusión 429 Síntesis curricular de los autores Índice analítico 453 459 Prólogo El volumen Biodiversidad y comunidades del talud continental del Pacífico mexicano se ha elaborado y se presenta con motivo del año internacional de la biodiversidad. En este volumen el Dr. Michel Hendrickx del ICML Mazatlán y sus colaboradores presentan en diversos capítulos un recuento de los hallazgos principales de las campañas oceanográficas denominadas TALUD, iniciadas en 1989 y el avance hasta el año 2009. A lo largo de este proyecto que aún continúa hubo la participación de colegas de al menos 7 instituciones nacionales e internacionales que contribuyeron con su experiencia complementando los campos de la oceanografía regional del Golfo de California. Leer este volumen genera un gran placer al ver la gran cantidad de productos académicos, resultado del trabajo sistemático y continuo. El éxito de este proyecto ha sido por una parte la disponibilidad regional de una excelente plataforma oceanográfica, el B/O “El Puma” de la UNAM y por otra la atinada inversión con financiamiento prioritariamente de la Universidad Nacional Autónoma de México y una contribución parcial del CONACYT. Esta serie de campañas, divididas en cinco etapas, han permitido contribuir con valiosa información de la diversidad biológica de la zona del talud continental del Golfo de California. Las campañas continúan permitiendo en la actualidad iniciar la cobertura restante del Pacífico Oriental de la Zona Económica Exclusiva de México. Tal vez el lector quiera conocer la relevancia de estudiar la zona del talud continental. Para ello es importante dar como marco de referencia que de los 510 11 millones de km2 de la superficie de la Tierra 362 millones de km2 corresponden al suelo marino con casi 90% de éste en mar profundo donde se ubica el talud continental a profundidades de 200 a 3500m. Con base en el conocimiento de la oceanografía geológica y geoquímica actual, el avance de los sensores remotos y los levantamientos batimétricos realizados se ha podido establecer a nivel global que los taludes continentales que cubren 40 millones de km2, extensión inmediata a las planicies abisales. Los taludes colindan en su frontera inferior con la elevación continental y en la frontera superior con los márgenes continentales y plataforma continental. Dentro de los procesos que se llevan a cabo en los taludes, y que son considerados servicios ecosistémicos, se reconoce el flujo y almacén de carbono que queda atrapado en diversas estructuras geológicas que coexisten con hábitats únicos característicos del talud como son: los sustratos sedimentarios que cubren infiltraciones frías, volcanes de lodo, los cañones submarinos que recorren perpendicularmente los taludes y que cuentan con cantiles rocosos que albergan corales de profundidad, fallas con ventilas hidrotermales. En el caso del talud continental de la región del Pacífico oriental todas estas estructuras geológicas que caracterizan al talud se encuentran embebidas en la zona de oxígeno mínimo (ZOM con <0.5 mL L−1 ó 22μM O2) más extensa a nivel global; tanto latitudinal (desde la zona fría del hemisferio norte al hemisferio sur), longitudinal (desde la costa hasta la porción central del Pacífico subtropical) y batimétricamente (desde la profundidad de 25 hasta casi 1500m). Esta zona, carente de recursos pesqueros y fauna compleja, sostienen ensambles de microorganismos bajo condiciones reductoras, salpicada ocasionalmente de fauna en relaciones complejas que combinan fuentes fotoautotróficas y quimioautotróficas para su supervivencia. La cobertura de la zona del talud continental en México es desconocida y una gran parte permanece inexplorada. Los capítulos de este volumen contribuyen con conocimiento que por vez primera nos presentan una impresión de quienes habitan el talud continental en la región del Golfo de California definiendo la línea base para futuros estudios de impacto ambiental, o para el establecimiento de áreas marinas protegidas. Por su naturaleza los taludes continentales son inestables, reciben continuamente el aporte de sedimentos provenientes de los ríos, el flujo de partículas generadas en la columna de agua por lo que se caracterizan por corrientes erosivas, turbiditas, que le dan condiciones propias de heterogeneidad, con implicaciones de cambio constante en el tiempo de la abundancia y biomasa de la fauna y comunidades existentes. La diversidad que caracteriza esta zona batimétrica depende 12 Biodiversidad y comunidades del talud continental del Pacífico mexicano de la disponibilidad de oxígeno disuelto en el ambiente, de la calidad del aporte de alimento que es exportado al fondo y su distribución cambia por la variabilidad constante del sustrato. Esta diversidad es la biblioteca esencial para la sustentabilidad en la región. Cada especie representa un conjunto único de soluciones para un conjunto de problemas biológicos; cada especie es de importancia crítica para el avance de la medicina, la farmacología, el éxito de la economía de la región basada en pesca sostenible y apoya a la población local contribuyendo con soluciones actuales al reto ambiental. Las especies que habitan el talud continental viven en bandas o estratos de profundidad bien definidos y presentan, por el dinamismo propio, un recambio de especies elevado. Dependiendo de los grupos taxonómicos la mayor diversidad de especies se presenta en una franja muy estrecha colindando con el límite inferior de la ZOM, a profundidades entre 1400 a 1800 m, donde también alcanzan la mayor talla. Este patrón varía regionalmente por la productividad, el flujo al fondo, la confluencia de fauna de la plataforma y margen continental con la de la elevación continental y planicie abisal en hábitats arquitectónicamente complejos como son los corales de profundidad dando patrones biogeográficos específicos para cada taxon. Los capítulos resaltan claramente la relevancia de la diversidad del talud continental del Golfo de California. Los autores presentan listados faunísticos actualizados resultado de los muestreos intensivos con diversas estrategias de colecta que permiten presentar los componentes de fauna de diferente talla: la meiofauna, la macrofauna y la megafauna, incluyendo algunas especies de importancia comercial. Las especies que ocurren en mar profundo (>200 m) se caracterizan por historias de vida de tipo K (longevas, con madurez tardía, de crecimiento lento y de baja fecundidad) que difieren de las especies de la plataforma continental. Los patrones de agregación en el talud continental se vinculan a los frentes oceánicos, a las estructuras topográficas como los cañones submarinos y los montes marinos. En éstos las especies son altamente vulnerables a la sobrepesca ya que tienen una resilencia baja. En la región del Pacífico la plataforma continental es estrecha y la presencia de una ZOM aunado a las características típicas de los ecosistemas tropicales (elevada diversidad, abundancia baja) han limitado la extracción de recursos pesqueros conllevando rápidamente a la sobrepesca de los recursos. Lo anterior ha sugerido la posibilidad de explorar recursos en la zona batimétrica inmediata, el talud continental. P rólogo 13 Aunque se cita que el mar profundo es la última frontera de estudio para la oceanografía en México. Cabe la pena aclarar que en este caso el capítulo que lo cita se refiere a un zona pobremente explorada, pero debe evitar considerarse que no quiere decir que este espacio pudiera por ello tener un acceso abierto a los recursos y a una jurisdicción menos diferenciada a las actividades. Desde el marco económico en zonas etiquetadas como últimas fronteras los usuarios aprovechan extensivamente los recursos naturales hasta agotarlos ya que posterior a los descubrimientos se sucede la sobreexplotación de recursos, de manera similar que en los ecosistemas terrestres. Uno de los efectos irreversible y más pernicioso de la competencia en las “últimas fronteras” es el daño sin restricción a la diversidad y a los usuarios de ésta. Conforme el uso de los recursos se intensifica se generan externalidades negativas, hay competencia entre usuarios y los intereses entre actividades aumentan al punto en el cual la explotación de los recursos no sirve para el bien público con un decremento en la diversidad biológica, aumento de especies oportunistas, eliminación de niveles tróficos altos, reducción en abundancia y biomasa y afección a los ciclos biogeoquímicos. En las últimas décadas, conforme las comunidades costeras han reducido los recursos en los ecosistemas más cercanos, actividades como la pesca y la extracción de energéticos han buscado mar adentro nuevas oportunidades. Para garantizar la sostenibilidad de los recursos es necesario proponer opciones basadas en conocimiento científico, en valores éticos y cambios institucionales para usuarios como la propuesta de cuotas de pesca, la creación de oportunidades y el ordenamiento de las actividades futuras en los taludes continentales. Desde los años 60s la pesquería de profundidad ha contribuido con 800000 a 1 millón de T anuales que en periodos de 5 a 10 años han casi extinguido comercialmente diversas especies de niveles tróficos medios y altos. Lo anterior puede tener efectos en el largo plazo especialmente en aquellos hábitats donde se agregan los individuos. Lo anterior sugiere tomar medidas de planeación que garanticen salvaguardad la diversidad biológica de especies de interés pesquero como calamares, peces y crustáceos. El esfuerzo presentado en este volumen en monumental y sin embargo queda por preguntar: Qué requiere tomarse en consideración a futuro para la exploración de recursos en el talud continental? Con objeto de garantizar un manejo sostenible de los recursos es fundamental mejorar la resolución de la obtención de datos ambientales en la columna de agua con mediciones continuas de oxígeno disuelto y potencial redox que permitan definir los límites de la ZOM. La principal problemática es el desconocimiento de la distribución del oxígeno disuelto, cómo varía éste 14 Biodiversidad y comunidades del talud continental del Pacífico mexicano a lo largo de la columna de agua, en el tiempo y cómo se vincula a estructuras de mesoescala como surgencias, la productividad primaria en superficie, la circulación y las tasas de descomposición. Los levantamientos batimétricos deben tener una mejor resolución para establecer las estructuras geológicas como son los cañones submarinos que a la fecha son zonas de acceso difícil y hábitats esenciales para la fauna o las agregaciones de corales de profundidad que permitan ubicar las zonas de agregación de las poblaciones, explorar los recursos garantizando no perder los equipos y proteger la destrucción de artes y muestreos invasivos. Lo anterior permitirá establecer los patrones y variación en la distribución de la diversidad biológica que ocurre en una zona de importancia como un conjunto anidado de bioregiones basadas en estructuras geomorfológicas que requiere información en la escala fina. Elva Escobar Briones, ICML P rólogo 15 Agradecimientos El Instituto Nacional de Ecología quiere agradecer la respuesta oportuna a la convocatoria que los autores de los capítulos que conforman la presente publicación tuvieron para compartir parte de los resultados de sus investigaciones basadas en el proyecto TALUD. No dudamos que este libro tendrá una aceptación positiva por la comunidad académica y resaltará la importancia que guardan los ecosistemas de aguas profundas entre las diversas entidades del gobierno federal. Asimismo, los editores queremos agradecer a todos y cada uno de los investigadores involucrados en al revisión de los respectivos capítulos y en estricto orden alfabético a: − Anna Bozzano del Departament de Recursos Marins Renovables, Institut de Ciències del Mar-CSIC, España. − Arturo Toledano Granados del Instituto de Ciencias del Mar y Limnología, Universidad Nacional Autónoma de México, Unidad Académica Puerto Morelos, México. − Cristóbal Reyes Hernández de la Universidad del Mar, Campus Puerto Ángel, Oaxaca, México. − Eduardo Ríos Jara del Centro Universitario de Ciencias Biológicas y Agropecuarias, Universidad de Guadalajara, México. − Edward M. Peters Recagno del Instituto Nacional de Ecología, Secretaría del Medio Ambiente y Recursos Naturales (Semarnat), México. 17 − Elaine Espino Barr del Centro Regional de Investigaciones Pesqueras (CRIPManzanillo, Colima), Instituto Nacional de Pesca, México. − Elva Escobar Briones del Instituto de Ciencias del Mar y Limnología, Universidad Nacional Autónoma de México, Distrito Federal, México. − Emilio Beier del Departamento de Oceanografía Física del Centro de Investigación Científica y Educación Superior de Ensenada. − Emilio Palacios Hernández del Centro Universitario de Ciencias Exactas e Ingenierías, Universidad de Guadalajara, México. − Emma Fajer Ávila del Centro de Investigación en Alimentación y Desarrollo, A.C., Unidad Mazatlán, México. − Enrique Mcpherson Mayol del Departamento de Ecología Marina, Centre d'Estudis Avançats de Blanes, España. − Francisco Benítez Villalobos de la Universidad del Mar, Campus Puerto Ángel, Oaxaca, México. − Francisco Javier García Rodríguez del Centro Interdisciplinario de Ciencias Marinas (CICIMAR), Instituto Politécnico Nacional, Unidad La Paz, México. − Ingo Wehrtmann de la Escuela de Biología, Universidad de Costa Rica, Costa Rica. − Isabel Muñoz de la Facultad de Ciencias del Mar, Universidad Autónoma de Sinaloa, Mazatlán, Sinaloa, México. − Jesús Ángel de León González de la Facultad de Ciencias Biológicas, Universidad Autónoma de Nuevo León, México. − José Salgado Barragán del Instituto de Ciencias del Mar y Limnología, Universidad Nacional Autónoma de México, Unidad Académica Mazatlán, México. − Judith Alicia de Jesús Arciniega Flores del Centro Universitario de la Costa Sur, Universidad de Guadalajara, México. − Julio Parapar de la Facultad de Ciencias de la Universidade da Coruña, España. − Kai Horst George del Forschungs Institut und Natur Museum Senckenberg, Deutsches Zentrum für Marine Biodiversitätsforschung, Frankfurt, Alemania. − Maite Mascaró Miquelajauregui de la Unidad Multidisciplinaria de Docencia e Investigación- Facultad de Ciencias, Universidad Nacional Autónoma de México, Unidad Sisal, Campeche, México. − María Teresa Gaspar Dillanes de la Dirección General de Investigación Pesquera en el Pacífico Norte, Instituto Nacional de Pesca, México. 18 Biodiversidad y comunidades del talud continental del Pacífico mexicano − Mary K. Wicksten de la Texas A&M University, College Station-Texas, Estados Unidos de América. − Milena Benavides Serrato del Instituto de Investigaciones Marinas y Costeras, Museo de Historia Natural Marina de Colombia, Colombia. − Néstor Hernando Campos del Instituto de Investigaciones Marinas y Costeras, Colombia. − Norma Arcelia Barrientos Luján de la Universidad del Mar, Campus Puerto Ángel, Oaxaca y estudiante de doctorado del Centro Universitario de Ciencias Biológicas y Agropecuarias, Universidad de Guadalajara, México. − Sammy De Grave del Oxford University Museum of Natural History, Reino Unido. − Sandra Bravo de la Universidad Austral de Chile, Chile. − Sergio Salazar Vallejo de El Colegio de la Frontera Sur, Unidad Chetumal, México. − Terue C. Kihara del Departamento de Zoologia, Universidade de São Paulo, Brasil. − Yuri Hooker del Departamento de Ciencias Biológicas y Fisiológicas, Universidad Peruana Cayetano Heredia, Perú. A gradecimientos 19 Sección I El proyecto TALUD y la Zona de Mínimo Oxígeno Operaciones oceanográficas en aguas profundas: los retos del pasado, del presente y del proyecto TALUD en el Pacífico mexicano (1989-2009) Michel E. Hendrickx1 Exploración de las aguas profundas en el mundo Las aguas profundas de los océanos mundiales han sido consideradas como uno de los pocos ambientes naturales de la Tierra que todavía requieren de un fuerte esfuerzo exploratorio. Este ambiente constituye una de las últimas fronteras del planeta Tierra, extraordinariamente vasto, misterioso y de muy difícil acceso. Los océanos cubren un 71 % de la superficie de la Tierra. De estos, 76 % corresponden a aguas con una profundidad de entre 3000 y 6000 m. El océano Pacífico es, en promedio, el más profundo de todos, con una profundidad media de 4282 m. A nivel mundial, es en la plataforma continental, con una profundidad media de 130 m pero que alcanza en algunas zonas casi los 200 m, que se realiza la mayoría de las actividades humanas en los mares y donde el efecto de la contaminación y del deterioro ambiental es más notorio. Sin embargo, corresponde solo a un 9 % de la superficie total de los océanos (Herring y Clarke 1971, Smith 1992, Facebook 2010, Farlex 2010). 1 Laboratorio de Invertebrados Bentónicos. Instituto de Ciencias del Mar y Limnología, Unidad Académica Mazatlán, Universidad Nacional Autónoma de México, Joel Montes Camarena s/n, Mazatlán 82040, Sinaloa, México. Correo-e: [email protected]. 23 Las investigaciones más recientes han podido demostrar que las comunidades de macroinvertebrados de las aguas profundas se caracterizan por una alta diversidad (Grassle 1989, Smith et al. 1998, Zamorano et al. 2007). Este concepto vino a reemplazar la idea muy anclada hasta el siglo XIX de que los fondos marinos, más allá de la zona donde penetra la luz, no eran propicios para la vida, tanto por la ausencia de plantas (i.e., las algas y el fitoplancton) que conforman el primer eslabón de las cadenas alimenticias, como por las fuertes presiones ocasionadas por la columna de agua. Se necesitaron muchos esfuerzos e inversiones en personal científico y en infraestructura para llegar a modificar este concepto, así como aproximadamente 120 años de atención específica y sostenida en la exploración progresiva de estos ambientes para poder acumular una cantidad razonable de información acerca de las comunidades animales que lograron establecerse allí permanentemente (Soule 1970, Gage y Tyler 1992). Los primeros descubrimientos relacionados con la fauna de aguas profundas se remontan al principio del siglo XIX. Sin embargo, estos primeros datos fueron anecdóticos y son el resultado de muestreos incidentales o ligados a las exploraciones de los fondos para la instalación de cables submarinos trans-oceánicos (Soule 1970). Si bien se consiguieron muestras de representantes de los diferentes grupos animales que habitan las zonas batiales (entre 200 y 2000 m de profundidad) y abisales (entre 2000 y 6000 m), estos no fueron adecuadamente registrados y estudiados (Gage y Tyler 1992). La ausencia de luz, aunada a las enormes presiones que existen a grandes profundidades mantuvieron por mucho tiempo la noción de que la vida no era posible en estos ambientes, calificados de “zonas azoicas” (Gage y Tyler 1992). Sin embargo, basándose en los primeros descubrimientos incidentales que demostraban la presencia de vida en aguas profundas, como por ejemplo la colección montada por G.O. Sars a partir de muestras profundas obtenidas en aguas del Fjord de Lofoten, en Noruega, se organizaron dos expediciones a bordo de los buques H.M.S “Lightning” y H.M.S. “Porcupine” (1868-1870) en el Atlántico este. Según Thomson (1873), se efectuaron con éxito 57 arrastres a más de 500 fm (915 m), 16 en más de 1000 fm (1830 m) y dos a profundidades mayores a 2000 fm (3660 m). La profundidad máxima alcanzada fue de más de 4200 m. Las muestras obtenidas revelaron la presencia de una fauna muy particular alrededor de las islas británicas y frente a la península ibérica, en un área de muestreo de aproximadamente 1500 mn de largo por 100-150 mn de ancho (Thomson 1873, Gage y Tyler 1992). Estos hallazgos motivaron, en parte, la planeación del viaje alrededor de la Tierra del buque de investigación H.M.S “Challenger” (Lám. 1 A) de 1872 24 Biodiversidad y comunidades del talud continental del Pacífico mexicano a 1876, que efectuó muestreos en profundidades de hasta 5500 m (Soule 1970). El H.M.S. “Challenger”, construido en Inglaterra y botado el 13 de febrero de 1858, era un barco de tipo “corvette” de 61 m de eslora. En aquella época, y a pesar de parecerse a los galeones españoles del siglo XVIII, los barcos grandes contaban con velas y motores de vapor que les daban seguridad y versatilidad; era el caso del “Challenger”. Curiosamente, este buque participó, en 1862, en las operaciones bélicas de los EE.UU. en contra de México e, incluso, participó en la ocupación de Veracruz. Asignado a la primera campaña de exploración marítima alrededor del mundo, la renombrada “Challenger Expedition”, el H.M.S. “Challenger” fue modificado de lo que era un barco de guerra a un buque de investigación, instalando laboratorios y plataformas de muestreo, así como almacenes para conservar los especímenes capturados. Ya se contaba con termómetros de precisión así como botellas para muestrear agua y dragas para conseguir sedimentos. Entre sus equipos más importantes, tenía a disposición unos 291000 m de cable y redes para muestrear en aguas profundas. Los resultados de esta campaña, consignados en 34 volúmenes, representan todavía hasta hoy la base de muchos estudios taxonómicos de la fauna de aguas profundas a nivel mundial. Lám. 1. A, “Challenger”; B. “Albatross”; C. “Velero IV”; D, batiscafo “FNRS 2”. A B C D O peraciones oceanográficas en aguas profundas 25 Posteriormente, una amplia serie de campañas de vasto alcance fueron organizadas por países europeos o por los EE.UU. con el fin de ampliar los conocimientos acerca de esta fauna profunda. Fueron los cruceros de los barcos “Travailleur” y “Talisman” (Francia), “Hirondelle” y “Princesse Alice” (Mónaco), “Ingolf” (Dinamarca), “Michael Sars” (Noruega), “Valdivia” (Alemania), “Blake” y “Albatross” (EE.UU.), “Albatross” (Suecia; bautizado en honor al ”Albatross” británico) y “Galathea” (Dinamarca). El “Galathea” consiguió las muestras más profundas de la fauna marina recolectadas a la fecha, con la exploración de la fosa de las Filipinas, a 10190 m de profundidad. Esta serie de expediciones, que llevaron los nombres de los barcos en los cuales se realizaron, se iniciaron a mediados del siglo XIX y terminaron en 1952 (Soule 1970, Groueff 1973, Gage y Tyler 1992). De particular interés para México fueron las campañas del “Albatross” de los EE.UU. (Lám. 1 B). A cargo de la Comisión de Pesca del gobierno de los EE.UU. el “Albatross” fue construido en 1882, específicamente para realizar investigaciones acerca de los peces y de las condiciones hidrológicas en las áreas visitadas. A cambio del pago de los costos de operaciones del buque, Alexander Agassiz realizó tres expediciones en el Pacífico, de las cuales la primera (1891) fue la más significativa para la fauna profunda del Pacífico de México (véase infra). Sin embargo, es de señalar que durante la segunda expedición (1899-1900) en el Pacífico sur y centro, se alcanzó la mayor profundidad de arrastre para esta época: 4137 fm (7570 m) en una cuenca del Pacífico central (Soule 1970, Groueff 1973). Otro personaje histórico, Allan Hancock, nacido el 26 de julio 1875 en San Francisco, mostraría durante su vida un particular interés para la investigación científica en el mar. Después de obtener su certificado para operar embarcaciones mayores (lo que le valió el título de “Capitán”), A. Hancock financió expediciones a bordo de la serie de barcos que mando construir, los “Veleros”. Las campañas del “Velero III” fueron probablemente las más importantes para la región que se extiende desde México a Ecuador, pues fueron muchas las campañas de recolecciones de muestras en esta zona y los resultados fueron consignados en una multitud de publicaciones en la serie “Allan Hancock Pacific Expeditions” que son referencias base hasta el día de hoy (e.g., Dawson 1944, Strong y Hertlein 1939, Garth 1958, H.L. Clark 1948). Sin embargo, el “Velero III” estudio esencialmente la flora y la fauna de aguas litorales. A partir de 1948, el “Velero IV” (Lám. 1 C), construido en 1948, efectuó cruceros bajo el mando del propio Capitán Allan Hancock en las costas de California, Baja California y en el golfo de California. Esta embarcación fue una de las pioneras en el uso de fotografía y de equipos específicamente dise26 Biodiversidad y comunidades del talud continental del Pacífico mexicano ñados para operar en aguas profundas, entre otros el “bentoscopo” de O. Barton. La información recabada por el “Velero IV” en aguas profundas ha sido utilizada en una amplia serie de publicaciones (e.g., Parker 1963, Wicksten 1989). La institución “Scripps Institution of Oceanography” de los EE.UU., con base en La Jolla, California, organizó también una serie de cruceros en aguas mexicanas entre 1958 y 1961. Durante estos cruceros, se recolectaron de manera incidental muestras de la fauna de aguas profundas. Solamente dos de estas campañas, la “Baja Slope Expedition” y la “Holt Expedition”, que visitaron las costas de la península de Baja California, tenían como objetivos principales recolectar material biológico, parte del cual fue utilizado por Parker (1963) en su estudio de las comunidades de invertebrados del golfo de California. A partir de los años 50, el polo de interés en la exploración de las aguas profundas se desplazó en la entonces URSS, con la organización de una serie de campañas de investigación de las fosas oceánicas y de diversas partes de los océanos del mundo. Posteriormente, entre 1960 y finales de los años 70, diferentes instituciones de los EE.UU. retomaron cierto liderazgo en la materia, en particular con las expediciones organizadas por la Woods Hole Oceanographic Institution y la Scripps Institution of Oceanography. Con un enfoque más ecológico y adoptando el uso de instrumentos de muestreo más precisos y menos selectivos (i.e., uso de artes permitiendo recolectar un amplio espectro de organismos, desde tallas grandes hasta muy pequeñas), lograron demostrar la existencia de una abundante y muy diversificada fauna en las aguas profundas. De particular interés en esta época fue el uso de redes bien calibradas y de trineos bentónicos confiables, así como de nucleadores de caja que permitían, por primera vez, contar con muestras de sedimentos abundantes y bien estratificadas (Gage y Tyler 1992). En 1946 se fundó el “Institute of Oceanology” de la Academia de Ciencias de la ex-URSS. El primer buque oceanográfico, el “Vitiaz”, un barco re-equipado para la investigación oceánica, tenía una capacidad de 136 tripulantes y una autonomía de 120 días. Comparativamente, el B/O “El Puma de la UNAM tiene una capacidad para 35 personas y cuenta con 30 días de autonomía. El “Vitiaz” contaba con una cadena de anclaje de 11 km para poder inmovilizarse en las aguas más profundas del mundo, una marca jamás igualada desde entonces, y un cabestrante gigantesco, con una capacidad de pesca de hasta 11000 m de profundidad. Además de explorar las aguas territoriales de la URSS, el “Vitiaz” contribuyó al estudio de los océanos Índico (junto con la IIE Expedition), Pacífico y Atlántico entre 1954 y 1979 (Anónimo 2010). Barcos soviéticos participaron O peraciones oceanográficas en aguas profundas 27 muy activamente en los programas IGY-IGC (“International Geophysical Year” y “Year of International Geophysical Cooperation”) en 1957-1959, y en la exploración del océano Índico entre 1960 y 1965, en colaboración con unos 36 barcos de Australia, Francia, Nueva Zelanda, Japón, entre otros (Benson y Rehbock 2002, Britannica 2010). Por otra parte, el uso cada vez más común de métodos de observación directa revolucionó nuestra percepción de los procesos biológicos y ecológicos en ambientes profundos. El sueño del científico −poder observar con sus propios ojos los ambientes profundos y las especies animales que allí viven− estaba por concretarse. En 1930, William Beebe, zoólogo y naturalista nacido en Brooklyn, y Otis Barton, miembro de una familia bien establecida, diseñaron la primera “batisfera”, que consistía en una esfera de grueso metal, sostenida con un largo cable, con escotilla de acceso y ventanilla de observación en cristal reforzado. Esta batisfera se usó para realizar las primeras exploraciones in situ de las grandes profundidades marinas. En 1930, la primera inmersión alcanzó 183 m, en las aguas cercanas a las islas Galápagos. En 1934, la batisfera llegó a unos 908 m de profundidad. En 1948, O. Barton bajó en solitario en una versión modificada de la batisfera, el “bentoscopo”, hasta 1370 m (Wikipedia 2010). El primer “submarino” de exploración en aguas profundas fue concebido en 1937-1939 por Auguste Piccard, de nacionalidad suiza, con el apoyo del “Fonds National pour la Recherche Scientifique” (FNRS) de Bélgica. Profesor en la Université Libre de Bruxelles, Piccard tuvo que interrumpir sus trabajos durante la segunda guerra mundial y retomó su proyecto en 1946. Es hasta 1948 que se realizaron los primeros ensayos de su sumergible frente a la costa de Senegal, con el apoyo de barcos de la marina francesa. El “submarino” utilizado, mejor conocido como “batiscafo” y bautizado FNRS 2 (Lám. 1 D), logró su primera inmersión sin equipaje hasta 1380 m de profundidad. El proyecto fue retomado por la marina francesa y, después de haber recibido varias modificaciones que aumentaban la seguridad del batiscafo, se terminó la construcción del FNRS 3. Sin embargo, debido a múltiples problemas administrativos y de política interna, Piccard fue alejado del proyecto y de la toma de decisiones por lo que buscó otros apoyos. Posteriormente, logró conseguir la ayuda incondicional del gobierno italiano al inicio de los años 50’s y, después de establecerse en la ciudad porteña de Trieste, en el norte del mar Adriático, Piccard puso en marcha la construcción del batiscafo “Trieste” (Lám. 2 A.). Durante los primeros ensayos realizados en Italia, el “Trieste” alcanzó una profundidad de 3150 m. El resto es historia... Con el apoyo de la marina de los EE.UU., 28 Biodiversidad y comunidades del talud continental del Pacífico mexicano el “Trieste” realizó su hundimiento controlado en el “Challenger Deep”, en la fosa de Las Marianas. Alcanzó la profundidad de 10916 m el 26 de enero 1960 (Soule 1970, Groueff 1973). La epopeya del “Trieste” motivó a diversas empresas y centros de investigación a construir sumergibles capaces de explorar las aguas profundas. Los formatos, tamaños y capacidad de inmersión variaron mucho, desde equipos Lam. 2. A, batiscafo “Trieste”; B, submarino de investigación “Denise”; C, “Calypso”; D, submarino de investigación “Alvin”. A B C D O peraciones oceanográficas en aguas profundas 29 limitados a inmersiones hasta un máximo de 100-200 m (e.g., “Star”, “Shelf Diver”, “Benthos”), hasta sumergibles de mayor capacidad (e.g., “Dive Saucer”, “Deep Star”, “Alvin”, “Aluminaut”, “Deep Quest”). Sin lugar a dudas, el campeón absoluto fue el “Archimède”, sin límites teóricos de profundidad (hasta 12000 m, más allá de la profundidad máxima conocida en los océanos: 11524 m, en la fosa de Mindanao). Todos estos sumergibles eran basados en los mismos principios: una esfera o habitáculo de acero o de titanio (con la excepción del “Johnson Sea-Link”, equipado con una esfera de plexiglás de 10 cm de espesor), con pequeñas ventanas de plexiglás muy gruesas, una escotilla de acceso y equipos de control y de comunicación que forman el habitáculo donde pueden permanecer 2-4 personas. La estructura externa consiste de un sistema de flotación no compresible, equipos de filmación y de muestreo, y lastre para el hundimiento. Son pocos los submarinos con tripulación capaces de alcanzar profundidades superiores a los 1000 m con toda seguridad. El “Cyana” francés llegaba hasta 3000 m y el “Alvin” (EE.UU.) hasta 4500 m. Otros fueron diseñados para llegar hasta 6000 m: el “Nautile” (Francia), el “Sea Cliff” de la marina de los EE.UU., los sumergibles rusos “Mir I” y “Mir II” y el japonés “Shinkai 6500” (Soule 1970, Gage y Tyler 1992). Entre estos sumergibles, los más celebres por la enorme publicidad que recibieron en los medios son, sin lugar a dudas, el “Denise”, el “Alvin”, el “Cyana” y el “Ben Franklin”. El “Denise” (Lám. 2 B) era un pequeño submarino con un habitáculo de 2 m de diámetro, con capacidad para dos investigadores que alcanzaba inicialmente hasta 350 m de profundidad. Recorrió el mundo a bordo de la célebre “Calypso” (Lám. 2 C) del Comandante Jacques-Yves Cousteau. En operaciones desde 1959, fue el primer equipo de manejo simple y rutinario que permitió explorar las aguas profundas. Fue sustituido, en 1965, con equipos con un alcance de hasta 500 m (Soule 1970). El “Alvin” (Lám. 2 D.), construido en 1964, fue concebido para alcanzar hasta 4500 m de profundidad con 2-3 miembros de equipaje. Propiedad de la marina de los EE.UU. y operado por la Woods Hole Oceanographic Institution (WHOI), fue utilizado por primera vez en 1965 frente a las Bahamas. Su nombre es derivado de uno de los ingenieros pioneros de WHOI, Allyn Vine, y ha realizado más de 4400 sumersiones en todos los lugares del globo, incluyendo México. Quizás sus acciones más famosas fueron la localización en 1966 de una bomba de hidrógeno perdida frente a España, el descubrimiento de las ventilas hidrotermales en 1970 30 Biodiversidad y comunidades del talud continental del Pacífico mexicano Lam. 3. A, submarino de investigación “Cyana”; B, submarino de investigación “Ben Franklin”; C, sistema de observación submarina por control remoto (ROV, Remote Operated Vehicle); D, “Glomar Challenger”. (A, cortesía del Ifremer/Genavir/A. Bonfiglio). B A C D y su participación en la exploración del naufragio del “Titanic” en 1986 (WHOI 2007). El “Cyana” (Lám. 3 A), propiedad del IFREMER (Francia), ha realizado más de 1300 inmersiones. Con un alcance de hasta 3000 m de profundidad fue puesto en operaciones en 1969 y podía llevar tres miembros de equipaje. Inicialmente conocido como el proyecto SP 3000, del cual el Comandante Jacques-Yves Cousteau fue uno de los instigadores, “Cyana” participó en 1974, junto con el “Archimède” y el “Alvin”, en la expedición “Famous” (“French American Mid Ocean Undersea Survey”) en la dorsal medio-Atlántica, con el fin de explorar y estudiar esta zona de extensión de los fondos del océano. “Cyana” fue retirado de servicio en 2003 (Laubier 2010, IFREMER 2010). El “Ben Franklin” (Lám. 3 B) fue construido en Suiza, en colaboración con la compañía Grumman Aerospace, la misma compañía que construyó el módulo lunar del “Apolo XI” que efectuó el histórico “aterrizaje” en la Luna con Neil Armstrong y Buzz Aldrin en 1969. Con un alcance práctico de unos 700 m de profundidad, O peraciones oceanográficas en aguas profundas 31 su recorrido más famoso lo realizó dentro de la corriente del “Gulf Stream”, donde permaneció a la deriva a una profundidad de unos 200 m (o más), desde Florida hasta el Atlántico NO, viajando un total de 1444 mn (unos 2650 km) en 30 días (Soule 1970). Actualmente existe una amplia serie de submarinos con equipaje capaces de bajar hasta profundidades intermedias y que han sido utilizados para diversas tareas, desde la exploración científica, el manejo industrial y las actividades recreativas. El “Dual Deep Worker 3” (DDW 3), por ejemplo, es un pequeño submarino con capacidad para alcanzar 2000 pies (unos 700 m) de profundidad. Ha sido utilizado ocasionalmente por el equipaje del “Arctic Sunrise” de Greenpeace para monitorear problemas ambientales y por el realizador de películas James Cameron (Farlex 2010). Otro elemento fundamental vendría a agregarse a la exploración de los fondos en aguas profundas: los sistemas de filmación y recolección de material por control remoto. Desde 1966, cuando se perdieron cuatro bombas termonucleares cerca de Palomares, Almería, en las aguas del sudeste de España, se utilizó un aparato robotizado equipado con sonares, cámaras y brazos articulados controlado con un cable desde la superficie para recuperar una de estas. Este equipo, el “CURV” (“Cable Controlled Research Vehicule”) permitía bajar en la columna de agua y hasta el fondo con un sistema de controles a distancia, sin personas a bordo. El CURV fue el precursor de los conocidos “” (“Remote Operated Vehicle”) (Lám. 3 C), de uso ya muy común en las operaciones de exploraciones oceanográficas. Son “ROV” similares que sirvieron para explorar los restos del “Titanic” y para reparar y colmatar la fuga de petróleo de la plataforma Deepwater Horizon, administrada por la British Petroleum en el golfo de México, en abril de 2010. En el Pacífico mexicano, se han utilizado este tipo de equipos para explorar las chimeneas hidrotermales. Además de sus cámaras de registro de imágenes, están equipadas de brazos, redes, trampas, palas, tubos de aspiración y recipientes para recolectar muestras del fondo y especímenes vivos. Equipos más modernos llamados “ROPOS” (“Remotely Operated Platform for Ocean Science”) son usados para recolectar y almacenar informaciones oceanográficas, al igual que las unidades REMUS (“Remote Environmental Monitoring Units”). Todas están conectadas al barco nodriza mediante un cable de control y de transmisión instantánea de datos e imágenes. La tecnología moderna está actualmente orientada hacia el uso de equipos autónomos, o “AUV” (“Autonomous Underwater Vehicle”), que pueden permanecer en el agua por meses, moverse de manera autónoma usando sus com32 Biodiversidad y comunidades del talud continental del Pacífico mexicano putadoras, almacenar datos y detectar modificaciones en el medio ambiente. Una vez concluido su ciclo de actividades, algunos son capaces de regresar a su base de manera autónoma (Alden 2010). Más adelante en el siglo XX, se organizaron varios programas de muestreo internacionales y multidisciplinarios, cuyos objetivos principales eran elucidar las relaciones entre el medio ambiente y las comunidades existentes, así como analizar la dinámica entre estas comunidades y los flujos de materia orgánica desde la superficie, fuentes esenciales para el balance energético de las especies que no pueden contar con los procesos de producción primaria (i.e., fotosíntesis de las micro y macro algas) en aguas desprovistas de luz. Algunos de estos programas siguen vigentes. El “Glomar Challenger” (Lám. 3 D) emprendió entre 1968 y 1983 el mayor reconocimiento de los fondos a nivel del globo, realizando perforaciones en el sedimento de más de un kilómetro en profundidades mayores a 6700 m (Soule 1970). La colección de núcleos de sedimentos obtenidos por este barco es inigualada hasta la fecha. Las campañas MUSORSTOM fueron organizadas por Francia en el océano Pacifico oeste, y dieron lugar a la publicación de una muy extensa serie de trabajos taxonómicos sobre virtualmente todos los grupos de invertebrados y peces de aguas profundas de esta región (e.g., Forest 1985, Hanley y Burke 1991, Vadon 1991, Chan y Crosnier 1997, Galil 1997, McCosker 1999). Las aguas profundas del Pacífico de México A pesar de todas estas actividades a nivel internacional, hasta recientemente no se contaba con un programa global y bien organizado de exploración sistemática de las aguas profundas del Pacífico mexicano. Este hecho era evidentemente contradictorio con la importancia económica y ecológica de los múltiples ambientes en la región. El Pacífico de México se extiende desde la frontera oeste de México con los Estados Unidos de América del Norte (EE.UU.) hasta la frontera con Guatemala (incluyendo el golfo de California). Incluyendo ambas costas del continente americano , México cuenta con una plataforma continental que cubre unos 393000 km2 (Wri-Org 2010). Según Hendrickx (1993), considerando la totalidad de la superficie de la Zona Económica Exclusiva (ZEE) del Pacífico de México (un total de 2364200 km2), el área que corresponde a la plataforma continental (profundidades inferiores a 200 m), donde se realizan la enorme mayoría de las actividades pesqueras y de exploración, cubre solamente 154300 km2, o sea un 6.5 % de O peraciones oceanográficas en aguas profundas 33 esta superficie total. Las zonas con profundidades de 200 a 2000 m cubren unos 288900 km2 (12.2 %), pero aquellas con profundidades >2000 m totalizan unos 1921000 km2 (81.3 %), lo cual permite evaluar la importancia de los ecosistemas de aguas profundas en el país. A pesar de ello, la exploración de las aguas profundas del Pacífico mexicano (en particular las áreas tropicales y subtropicales) por parte de grupos de investigación nacionales, hasta fechas recientes, ha sido incidental o inexistente; así lo refleja la literatura disponible. Las razones son esencialmente: 1) la dificultad de muestrear en alta mar, y más aún en aguas oceánicas, donde las profundidades rebasan rápidamente los 1000 m y las operaciones de muestreo son difíciles y largas; 2) el alto costo para mover una embarcación de mediano o gran calado en aguas oceánicas, en particular considerando las distancias que se deben recorrer para cubrir la ZEE. Sin embargo, resulta incongruente que ni siquiera la parte más accesible de estas aguas profundas, en la porción central y sur del golfo de California, haya sido explorada adecuadamente. La accesibilidad a los ambientes naturales en aguas profundas es extremadamente complicada y el nivel de complejidad aumenta drásticamente con el aumento de la profundidad. La presión del agua aumenta de una atmósfera cada 10 m. Si bien las estructuras metálicas tales como las dragas o los trineos equipados de redes no sufren daños debido a la presión, otros equipos son muy sensibles a estas variaciones (e.g., los medidores de parámetros dentro del agua). Por otro lado, el bajar un equipo de muestreo de 100 kg de peso a 2000 m de profundidad con un cable de acero de 2 km de longitud y 1 cm de espesor equivale a bajar un peso de un kilogramo desde lo alto de un edificio de 100 m de altura amarrándolo a un hilo de medio milímetro de grosor. Por si fuera poco, las corrientes superficiales y de fondo, la deriva de la embarcación por el viento y los movimientos del oleaje hacen todavía más difíciles las operaciones de muestreo. Por los mismos motivos, las operaciones en alta mar deben realizarse en embarcaciones grandes, capaces de resistir los posibles embates de las marejadas o de las tormentas que pueden desatarse repentinamente. Para evitar percances y pérdidas de tiempo en alta mar por averías, los equipos que se usan para muestrear en aguas profundas deben ser muy resistentes, robustos, relativamente pesados y de despliegue rápido. Evitar problemas técnicos o descomposturas es primordial, pues el tiempo de uso de los buques grandes está limitado por el alto costo de operación de los mismos: desde 5000 hasta 50000 USD o más por día de operación. Para aprovechar mejor el tiempo de barco, es muy recomendable adoptar una estrategia multidisciplinaria, 34 Biodiversidad y comunidades del talud continental del Pacífico mexicano formar grupos de trabajo con objetivos comunes o, dentro de lo posible, compartir las campañas con colegas con interés distintos en la misma área de muestreo. Si bien el H.M.S. “Challenger”, pionero de la investigación en aguas profundas, visitó parte de la costa del Pacífico americano, no llegó hasta México. Su zona de muestreo en el Pacífico Este se limitó a las aguas de Chile, entre el continente y las islas Juan Fernández (Wicksten 1989). En 1875, el barco de investigaciones U.S. “Narragansett” visitó la costa oeste de México, pero no muestreó en aguas profundas. Para tener las primeras informaciones acerca de la fauna profunda del Pacífico de México, se tendría que esperar la llegada del “Albatross” de los EE.UU. que visitó la costa del Pacífico Este desde las islas Galápagos hasta Guaymas, en la parte central del golfo de California, en 1891 (véase Faxon 1895). El material recolectado por esta expedición dio como resultado la publicación de una serie de monografías editadas por el “Museum of Comparative Zoology” de Harvard, EE.UU. Estos trabajos representan todavía hoy en día la base para el estudio de la fauna de aguas profundas del Pacífico este tropical, particularmente debido a los muestreos realizados entre las islas Galápagos y Ecuador, frente a Panamá-Colombia, alrededor Fig. 1. Derrotero del “Albatross” entre Ecuador y México en 1891 (adaptado de Faxon, 1895). O peraciones oceanográficas en aguas profundas 35 de las islas Malpelo y del Coco (“Cocos Island”), y en el golfo de California surcentro (Fig. 1). Entre estos trabajos destacan el estudio de los moluscos (e.g., Dall 1908), de los cangrejos, de los camarones y de otros macrocrustáceos (e.g., Faxon 1893, 1895), de las estrellas de mar (e.g., Ludwig 1905), de las ofiuras (e.g., Lutken y Mortensen 1899), de los erizos (e.g., A. Agassiz 1898), de los pepinos de mar (e.g., Ludwig 1894) y de los peces (e.g., Garman 1899). Las embarcaciones de la serie “Velero”, que operaron en aguas mexicanas bajo el mando del Capitán Allan Hancock, trabajaron sobre todo la zona litoral. El “Velero IV” exploró aguas tanto someras como profundas y efectuó algunas incursiones en la costa de Baja California y en el golfo de California a partir de 1948, año en el cual inició sus operaciones. La información relacionada con estos muestreos está muy dispersa en la literatura. De manera incidental, otros barcos de instituciones norteamericanas (e.g., “T. Washington”, “Orca”, “E. W. Scripps”, “Horizon”, “Agassiz”, “S.F. Baird”, “Calafia”) también han visitado las costas de Baja California y del golfo de California entre 1957 y 1972. Han operado diversos tipos de artes en aguas profundas (dragas de penetración y de arrastre, nucleadores, trampas de control remoto) con la subsecuente captura de especímenes hasta profundidades de más de 3000 m (véase Parker 1963, Luke 1977, SIO 1992, Hendrickx 2012a, 2012b). Otras embarcaciones que operaron de manera más sostenida en aguas profundas del Pacífico mexicano entre 1958 y 1960 participaron en dos expediciones: la “Baja Slope Expedition” y la “Holt Expedition”, ambas patrocinadas por la Scripps Institution of Oceanography (Parker 1963). Algunos intentos de muestreo exploratorio en la parte norte-central del golfo de California se realizaron en 1971-1972, esencialmente para determinar la presencia de bancos de peces [e.g., Merluccius sp. (Mathews et al. 1974)]. Por otro lado, algunos investigadores nacionales y extranjeros han mantenido una fuerte actividad exploratoria en las zonas de chimeneas hidrotermales (i.e., en la cuenca de Guaymas, golfo de California; en la zona del 21º N, “dorsal o cresta del Pacífico este”) a bordo de submarinos de los EE.UU. (véase Blake 1985, Escobar-Briones y Soto 1993). Por su parte, Solís-Weiss y Hilbig (1992) y Solís-Weiss y HernándezAlcántara (1994), por ejemplo, estudiaron poliquetos recolectados entre 2000 y 2020 m de profundidad por el “Alvin” en 1988 en la cuenca de Guaymas, en el golfo de California. El reciente interés por descubrir nuevos recursos pesqueros más allá del límite de la plataforma continental ha motivado la organización de proyectos de pesca 36 Biodiversidad y comunidades del talud continental del Pacífico mexicano exploratoria en diversos países, por ejemplo en Perú (Vélez et al. 1992, Kameya et al. 1997), en Chile (e.g., Retamal 1993, Arana y Vega 2000, Arana 2003), en El Salvador (Hendrickx y López 2006) y en Costa Rica (e.g., Wehrtmann y Nielsen-Muñoz 2009, Wehrtmann et al. 2010).). Sin embargo, en el Pacífico de México, hasta la fecha, las investigaciones han sido limitadas y muy desproporcionadas comparadas con la extensión de aguas profundas que encontramos frente a las costas del país. La zona del mínimo de oxígeno (ZMO) Una parte significativa de las aguas profundas del mundo se caracterizan por las muy bajas concentraciones de oxígeno disponible. Estas áreas, conocidas como las zonas del mínimo de oxígeno (ZMO) son extremadamente hostiles para la vida marina y, donde interceptan la pendiente del talud continental, dan origen a franjas bentónicas anóxicas o severamente hipóxicas donde la riqueza en especies baja drásticamente. En aguas todavía más profundas, el oxígeno se recupera y las comunidades que allí se encuentran son ricas en especies, a veces muy abundantes. En estos ecosistemas, las concentraciones de oxígeno y la profundidad son factores muy importantes para la supervivencia de las especies, las cuales deben contar con adaptaciones muy especificas para poder sobrevivir y reproducirse (Díaz y Rosenberg 1995, Levin y Gage 1998, Rogers 2000, Levin et al. 2001, McClain y Rex 2001, McClain 2004). La ZMO del Pacífico este es la más importante a nivel mundial y ha sido detectada desde el golfo de California central hasta la porción central de Chile, y hasta los 50° N en el Pacífico NE (Díaz y Rosenberg 1995). Representa un ambiente muy adverso para la fauna, tanto en el ámbito pelágico como en el bentónico. A nivel del fondo, la ZMO actúa como barrera fisiológica entre la fauna de la plataforma y del talud. En México, abarca la totalidad del País, salvo el extremo norte del golfo de California (véase Díaz y Rosenberg 1995, Helly y Levin 2004). Es extremadamente amplia en el sur del golfo de California y a lo largo de la costa SO de México (Hendrickx 2001, Hendrickx y Serrano 2007, Serrano 2012). Este fenómeno tiene consecuencias muy negativas sobre el ambiente marino, ya que limita la anchura y (sobre todo) la profundidad de la franja costera en la cual los organismos no adaptados a concentraciones de oxígeno reducidas o extremadamente bajas logran vivir (véase Childress y Seibel 1998, Rogers 2000, Levin 2003, Hendrickx y Serrano 2010). A pesar de su importancia sobre la disponibilidad de los recursos marinos en el Pacífico mexicano, O peraciones oceanográficas en aguas profundas 37 poco se sabe acerca de la ubicación exacta (latitudinal y batimétrica), la amplitud y las variaciones anuales o interanuales de la ZMO en el área. Entre las pocas evaluaciones de la extensión de este fenómeno en aguas mexicanas, existe un trabajo recapitulativo publicado a principios de los 60 por Parker (1963), quien utilizó toda la información disponible en esta época para proponer un mapa de distribución de la ZMO en el golfo de California. La información publicada posteriormente se refiere esencialmente a datos aislados (e.g., hidrocalas, algunos perfiles o transectos, mediciones en algunas localidades) (e.g., Gaxiola-Castro et al. 2002, Sánchez-Velasco et al. 2004) y no hay un estudio integral o sostenido en la columna de agua a lo largo de la ZEE en México, en áreas suficientemente amplias para ser consideradas representativas del nivel de influencia de este fenómeno sobre la biología y la distribución de las especies en la región (Hendrickx y Serrano 2010). Aún la información recabada durante el proyecto TALUD, por mas amplia que sea, es insuficiente para poder entender con claridad este fenómeno en las aguas mexicanas (véase Serrano 2012). El proyecto TALUD Los recursos pesqueros de la plataforma continental y de las aguas oceánicas superficiales del Pacífico mexicano son relativamente bien conocidos. En el golfo de California, a pesar de caracterizarse por una diversidad faunística muy alta que alcanza más de 6,000 especies macro-bentónicas y macro-pelágicas (Brusca et al. 2005), las pesquerías se limitan esencialmente a las aguas más someras (e.g., pesca de camarones Penaeidae, recolección de moluscos, pesca de escama). En el Pacífico SO se vive una situación parecida, aunque localmente las condiciones batimétricas (i.e., plataforma muy angosta, fondos rocosos en aguas someras) dificultan hasta cierto punto la explotación de los recursos. A pesar de eso, ciertas áreas del SO de México están pobladas por comunidades ricas y abundantes que ofrecen cierto potencial pesquero para las comunidades locales (Hendrickx et al. 1997, Godínez-Domínguez y González-Sansón 1998, 1999, Arciniega-Flores et al. 1998, 2008). En el noroeste del Pacífico mexicano, en el ámbito pelágico, además de la pesca deportiva existe una flota atunera muy activa que cuenta con aproximadamente 137 barcos (CIAT 2010). La pesquería de los atunes en México es una de las mejor establecidas, con una captura anual en 2009 de 131621 toneladas, casi exclusivamente en el Pacífico (SAGARPA 2010). Los progresos técnicos realizados recientemente en el manejo de redes de pesca en aguas profundas (i.e., por debajo de los 400 m de profundidad), progresos 38 Biodiversidad y comunidades del talud continental del Pacífico mexicano motivados en gran parte por la escasez o la insuficiencia de recursos para la pesca tradicional en aguas someras (i.e., hasta los 100-150 m), han dado como resultado la explotación de recursos antes considerados de difícil acceso. En el Mediterráneo, por ejemplo, después de haber realizado las investigaciones pertinentes, la pesca de Aristeus antennatus (Risso, 1816) y de Nephrops norvegicus (Linnaeus, 1758) a más de 400 m se ha vuelto rutinaria (Sardà y Demestre 1987, Cartes y Sardà 1989, Sardà y Valladares 1990). Investigaciones más recientes indican que muchas otras especies comparten este hábitat (Cartes et al. 1994); muchos géneros registrados (e.g., Gennadas, Solenocera, Acanthephyra, Pasiphaea, Nematocarcinus, Plesionika) tienen uno o varios representantes en aguas del golfo de California y del Pacífico mexicano tropical (Hendrickx y Estrada-Navarrete 1996, Wicksten y Hendrickx 2003). Frente a Perú, los arrastres exploratorios han dado excelentes resultados, con el descubrimiento de áreas propicias para la pesca de camarones de aguas profundas tales como Heterocarpus vicarius Faxon, 1893, H. hostilis Faxon, 1893, Nematocarcinus agassizii Faxon, 1893, Haliporoides diomedeae (Faxon, 1893), Plesionika trispinus Squires y Barragán, 1976, Psathyrocaris fragilis Wood-Mason, 1893 y Pasiphaea magna Faxon, 1893 (Kameya et al. 1997). Nuevamente, varias de estas especies se encuentran distribuidas hasta el golfo de California sur o central (Wicksten y Hendrickx 1992, Hendrickx 1995a, 2001, 2003a, 2004, Hendrickx y Estrada Navarrete 1996). Existe, en consecuencia, una verdadera necesidad de explorar estos fondos para obtener, en conjunto con información básica acerca de la composición y de la dinámica de las comunidades naturales, información acerca de un posible potencial pesquero. Por otro lado, varias instituciones dedicadas a la investigación en el mar y en los océanos han desarrollado instrumentos de medición o de muestreo adaptados a las condiciones adversas encontradas en aguas profundas. En particular, se desarrollaron diferentes modelos de trineos bentónicos, aptos a recoger la macrofauna que vive apoyada sobre el sustrato, redes de media agua con capacidad hasta 400-500 m de profundidad o más (King y Iversen 1962, Guennegan y Martin 1985), así como instrumentos que penetran en el sedimento y logran traer hasta la superficie trozos del fondo marino poco o nada perturbados: los nucleadores de caja (Sorbe 1983, Gage y Tyler 1992). En la columna de agua, sistemas equipados de sensores colocados en una estructura de titanio (CTD, “Conductivity-Temperature-Density”), a veces equipados con sensores para medir las concentraciones de oxígeno disuelto o el pH, están diseñados para realizar mediciones continuas hasta varios miles de metros de profundidad (Idronaut 2010). O peraciones oceanográficas en aguas profundas 39 Los objetivos del proyecto TALUD, el cual inició en 1989, fueron: 1) determinar la composición faunística a nivel específico de los invertebrados y peces batiales en profundidades mayores a 200 m, con especial énfasis en la fauna localizada por debajo de la ZMO y en el interfase “zona anóxica-zona hipóxica”; 2) determinar la composición de los sedimentos en la franja batial explorada y medir las características hidrologicas básicas (i.e., oxígeno disuelto, temperatura y salinidad) en la columna de agua, con énfasis en las condiciones predominantes en el ambiente epibentónico; 3) poner especial énfasis en las mediciones de oxigenación con el fin de establecer un modelo de distribución de este parámetro en la zona de muestreo y extrapolar los resultados a la porción tropical-subtropical del Pacífico mexicano; 4) determinar la composición faunística a nivel de grupos de la meiofauna presente en las muestras de sedimentos y estudiar detalladamente los copépodos Harpacticoidea; 5) analizar la presencia de copépodos parásitos en las muestras de peces recolectados de zonas profundas y proceder a su análisis taxonómico; 6) estudiar la fauna epi y endobentónica de invertebrados (principalmente los poliquetos, moluscos, crustáceos y equinodermos) asociados con las aguas profundas y analizar la composición de las comunidades acorde con los parámetros ambientales; 7) estudiar las comunidades de crustáceos pelágicos presentes entre la superficie y hasta 1500 m de profundidad; 8) estudiar la fauna de peces asociados con las aguas profundas y analizar la composición de las comunidades acorde con los parámetros ambientales. Como parte de los resultados de los cruceros TALUD, se obtuvieron indicadores claros de que, tanto en el golfo de California como a lo largo de la costa del SO de México (Jalisco hasta Chiapas), la franja costera somera donde existen especies con potencial pesquero es extremadamente reducida debido a la influencia de la ZMO. La magnitud de este fenómeno es tan fuerte que, en algunas zonas, la ZMO ha sido detectada en aguas someras, a partir de 50 m de profundidad (Hendrickx y Serrano 2007). Por lo anterior, el proyecto se enfocó muy rápidamente al estudio de las comunidades que se ubican por debajo de esta ZMO, en particular en el umbral donde se inicia la recuperación del oxígeno disuelto. Materiales y métodos Con una eslora de 50 m, un desplazamiento de 1058 tm y una velocidad de crucero de 12.5 nudos, el B/O “El Puma” fue el primer buque mexicano dedicado 100 % a la investigación oceanográfica. Puede llevar, además de la tripulación de 15 personas, un total de 20 científicos acomodados en confortables cabinas. 40 Biodiversidad y comunidades del talud continental del Pacífico mexicano Cuenta con una serie de cabestrantes para realizar diversas operaciones (e.g., pesca, hidrocalas, núcleos, dragados, sondeos, arrastres pequeños), tres plataformas hidráulicas de abatimiento ajustables, una grúa hidráulica de 12 ton de capacidad y un estructura de tipo “unigan” de ocho ton de capacidad en la popa. En total cuenta con cuatro laboratorios, una biblioteca, una sala de juntas, dos congeladores de gran capacidad y dos cuartos de preparación de equipos y recuperación de muestras (Figs. 2, 3). Fig. 2. Vista lateral del B/O “El Puma”. (http://www.buques.unam.mx/planos_ PUMA.htm) Fig. 3. Plano de las cubiertas de botes y de abrigo donde se encuentran todas las plataformas, los puestos de trabajo y los laboratorios para las operaciones oceanográficas. O peraciones oceanográficas en aguas profundas 41 Desde 1981, después de la llegada a México del primer buque oceanográfico de la UNAM, el B/O “El Puma” (Lám. 4 A), el Laboratorio de Invertebrados Bentónicos (LIB) inició una amplia serie de cruceros oceanográficos orientados hacia el estudio de las comunidades bentónicas y pelágicas en la plataforma continental del Pacífico mexicano tropical y subtropical. Estas campañas fueron enfocadas, en primer termino, al estudio de la plataforma de Sinaloa, en el SE del golfo de California, con los cruceros SIPCO I, II y III (1981-82). Posteriormente, se organizaron tres campañas que cubrieron la totalidad del golfo de California (CORTES 1, 2 y 3; 1982 y 1985) con el apoyo parcial del CONACYT (proyecto PCCBBNA-021996) (Hendrickx y Salgado-Barragán 1992). En estas campañas se contó con la participación de académicos del Instituto de Ciencias del Mar y Limnología y de la Facultad de Ciencias de la UNAM. Además, el grupo de académicos del LIB participó de manera ocasional o activamente en otras campañas dirigidas por otros científicos o bien estudiaron material recolectado por otros proyectos: (e.g., campañas BIOCAPESS frente a Sinaloa, en 1991-92; campañas GUAYTEC en el golfo de California central, en 1987; campañas CEEMEX frente a las costas de Sinaloa, en 1990-1991, y en el golfo de Tehuantepec, en 19911992 (véase Hendrickx 1990, Hendrickx y Salgado-Barragán 1994, Hendrickx et al. 1997, Hendrickx y Vázquez-Cureño 1998). Sin ninguna excepción, el material biológico y los datos ambientales recolectados u obtenidos a lo largo de estas campañas oceanográficas, dieron como resultado, por lo menos, una publicación por campaña por parte del propio LIB (i.e., SIPCO, 6 publicaciones; CORTES, 21 publicaciones; GUAYTEC, 2 publicaciones; CEEMEX, 3 publicaciones; BIOCAPESS, 1 publicación). Además, 14 artículos científicos y cuatro libros resultaron de la síntesis de información de varias de estas campañas. La participación de grupos de investigación asociados en las campañas organizadas por el mismo LIB o el acceso, por parte de otros grupos, a material recolectado durante estas campañas, ha generado una lista impresionante de contribuciones que todavía sigue creciendo (e.g., Caso 1986, HernándezAlcántara y Solís-Weiss 1991, 1993a, 1993b, 1994, 1998a, 1998b, Licea et al. 1995, Moreno et al. 1996). Esta amplia experiencia en la organización de actividades en alta mar y en el manejo de operaciones a bordo de “El Puma” fue aprovechada para la planeación, la organización y la realización de las campañas TALUD, entre 1989 y 2009. Todas las operaciones realizadas durante el proyecto TALUD fueron efectuadas a bordo del B/O “El Puma”, de la Universidad Nacional Autónoma de México 42 Biodiversidad y comunidades del talud continental del Pacífico mexicano Lam. 4. A, B/O “El Puma”; B, mismo, vista de popa a proa indicándose el cabrestante geológico de uso múltiple (w) y el sistema de tambores para redes (tr); C, mismo, vista hacia la popa. Las flechas indican el winche del CTD (w), la plataforma hidrológica con su pescante (ph), los tambores para redes (tr) y el unigan de pesca de popa (u); D, mismo, unigan de pesca de popa. A C B D (UNAM). Hasta la fecha se han efectuado en total 13 campañas. De éstas, los TALUD I-III se realizaron cuando B/O “El Puma” estaba todavía bajo la responsabilidad del Instituto de Ciencias del Mar y Limnología (ICMyL). En las campañas TALUD IV-XIII, el buque ya había pasado bajo la responsabilidad de la Coordinación de la Investigación Científica de la misma UNAM. El uso del B/O “El Puma” como plataforma de trabajo resultó indispensable para el éxito del proyecto TALUD. En efecto, los muestreos en aguas profundas reO peraciones oceanográficas en aguas profundas 43 quieren de una embarcación grande, con equipos de muestreo que permitan contar con cables resistentes y suficientemente largos para alcanzar el nivel del fondo y resistir las fuertes tracciones ocasionadas por los equipos durante los muestreos, ya sea a nivel del fondo o dentro de la columna de agua. Durante las campañas TALUD se necesitó, por ejemplo, soltar cerca de 5000 m de cable para poder efectuar muestreos de la fauna bentónica a profundidades del orden de 2350 m. Este tipo de equipamiento no se encuentra en embarcaciones pequeñas. Campañas del proyecto TALUD En el contexto del proyecto TALUD, se realizaron tres campañas preliminares en la franja del talud continental del golfo de California por parte del LIB entre 1989 y 1991. Posteriormente, con el apoyo de CONACYT (proyecto 31805-N), se realizaron las campañas oceanográficas TALUD IV-VII (2000-2001). Las campañas TALUD VIII-XII (2005-2008) recibieron apoyo parcial del PAPIIT (PAPIIT, DGAPA, UNAM, proyecto IN 217306-3). Estas actividades permitieron obtener la serie de Fig. 4. Posición de las estaciones de muestreo visitadas durante: A. las campañas TALUD I-III; B. la campaña TALUD IV; C. la campaña TALUD V; D. la campaña TALUD VI. 44 A B C D Biodiversidad y comunidades del talud continental del Pacífico mexicano O peraciones oceanográficas en aguas profundas 45 1 2 3 4 5 6 7 8 9 1A 1B 1C 6 7 8 Est. TALUD I TALUD I TALUD I TALUD I TALUD I TALUD I Crucero TALUD II TALUD II TALUD II TALUD II TALUD II TALUD II TALUD II TALUD II TALUD II Est. Crucero 23-mar-90 24-mar-90 24-mar-90 24-mar-90 23-mar-90 24-mar-90 24-mar-90 24-mar-90 25-mar-90 13-dic-89 13-dic-89 13-dic-89 12-dic-89 12-dic-89 12-dic-89 Fecha Fecha 23º03'36" 22º59'36" 22º58'12" 22º56'24" 22º55'54" 22º55'12" 22º54'18" 22º52'42" 22º22'48" 22º54'00" 22º53'00" 22º52'12" 23º15'54" 23º30'42" 23º33'00" Lat. N Lat. N 106º25'48" 106º26'18" 106º30'12" 106º31'24" 106º32'30" 106º34'00" 106º35'12" 106º35'36" 106º07'12" 106º30'00" 106º31'00" 106º31'54" 107º31'12" 107º09'01" 107º14'00" Long. O Long. O No No No No No No No No No No No No No No No Karling Karling Tipo de arrastre Red 80' Red 80' Red 80' Zoopl Red 80' Red 80' Tipo de arrastre Red 80' Red 80' Red 80' Red 80' Agassiz Agassiz Agassiz Agassiz Red 80' Prof. de arrastre (m) 170 220-230 310 1550 220 130 Prof. de arrastre (m) 61 90 133 162 285 380 495 565 55 Prof. núcleos (m) No No No No No No Prof. núcleos (m) No No No No No No No No No 2.0 0.35 0.30 0.25 0.16 0.44 0.23 0.23 ND ND ND ND ND ND ND Oxígeno (ml l-1) Oxígeno (ml l-1) Cuadro 1. Estaciones de muestreo visitadas durante las campañas TALUD I-XIII entre 1989 y 2009. Se incluye la fecha, la posición y las actividades principales desarrolladas en cada estación. ND, no hay datos; K, draga Karling; IK, red de media agua Isaac Kids; H, hidrocala; MN, micronecton; No, no se realizó la operación. Cuadro 1. Continúa. Est. 10 11 12 13 14 14 15 17 19 20A 20B 21 22 24 26 27A 27B 28 29 30 Crucero TALUD II TALUD II TALUD II TALUD II TALUD II TALUD II TALUD II TALUD II TALUD II TALUD II TALUD II TALUD II TALUD II TALUD II TALUD II TALUD II TALUD II TALUD II TALUD II TALUD II 46 Biodiversidad y comunidades del talud continental del Pacífico mexicano 25-mar-90 25-mar-90 25-mar-90 25-mar-90 24-mar-90 24-mar-90 25-mar-90 26-mar-90 26-mar-90 26-mar-90 26-mar-90 26-mar-90 25-mar-90 25-mar-90 27-mar-90 27-mar-90 27-mar-90 27-mar-90 27-mar-90 27-mar-90 Fecha 22º33'30" 22º22'36" 22º25'30" 22º24'24" 22º25'36" 22º25'36" 22º23'48" 21º40'48" 21º37'42" 21º47'07" 21º47'07" 21º48'42" 21º48'24" 21º50'36" 23º21'54" 24º05'06" 24º11'42" 24º00'00" 23º59'12" 23º59'54" Lat. N 106º13'00" 106º17'30" 106º18'30" 106º19'54" 106º21'12" 106º21'12" 106º22'30" 105º57'54" 106º12'00" 106º17'36" 106º17'36" 106º19'24" 106º22'00" 106º23'42" 107º10'00" 107º40'36" 107º35'24" 107º40'04" 107º44'12" 107º46'06" Long. O No No No No No No No No No No No No No No No No No No No No Karling Tipo de arrastre Red 80' Red 80' Red 80' Agassiz Agassiz IK Agassiz No No Red 80' Agassiz Agassiz Agassiz IK No Red 80' Red 80' Red 80' Red 80' Agassiz Prof. de arrastre (m) 82 130 188 282 370 370 465 ND ND 167 167 280 416 500 ND 64 39 90 130 225 Prof. núcleos (m) No No No No No No No H H No No No No No H No No No No No 0.90 0.34 0.10 ND 0.35 0.35 0.18 ND ND 0.25 0.25 0.13 0.23 0.14 ND 2.50 4.20 0.70 0.41 0.34 Oxígeno (ml l-1) O peraciones oceanográficas en aguas profundas 47 Est. 31 32 33 34 35 36 38A 38B 39 40A 40B 41 42 43 44 46 47 48 Crucero TALUD II TALUD II TALUD II TALUD II TALUD II TALUD II TALUD II TALUD II TALUD II TALUD II TALUD II TALUD II TALUD II TALUD II TALUD II TALUD II TALUD II TALUD II Cuadro 1. Continúa. 27-mar-90 28-mar-90 28-mar-90 28-mar-90 28-mar-90 30-mar-90 28-mar-90 28-mar-90 28-mar-90 28-mar-90 28-mar-90 29-mar-90 29-mar-90 29-mar-90 29-mar-90 29-mar-90 30-mar-90 30-mar-90 Fecha 23º59'18" 23º58'42" 23º58'06" 23º59'12" 23º54'12" 24º21'54" 24º55'54" 24º57'24" 24º54'42" 24º54'54" 24º54'00" 24º53'36" 24º51'00" 24º48'06" 24º46'00" 24º38'24" 23º41'42" 23º04'54" Lat. N 107º49'30" 107º52'36" 107º54'36" 107º55'36" 107º55'48" 108º13'00" 108º36'30" 108º33'42" 108º39'30" 108º39'42" 108º40'09" 108º42'00" 108º43'30" 108º43'30" 108º42'30" 108º27'00" 107º33'06" 107º28'36" Long. O No No No No No No No No No No No No No No No No No No Karling Tipo de arrastre Agassiz Agassiz No No No No Agassiz Agassiz Red 80' Red 80' No Red 80' Agassiz Agassiz Agassiz No No No Prof. de arrastre (m) 272 380 ND ND ND ND 64 40 94 131 ND 215 300 371 550 ND ND ND Prof. núcleos (m) No No H H H H No No No No H No No No No H H H 0.20 0.20 ND ND ND ND 2.80 3.00 2.50 ND ND 0.30 0.18 0.18 0.14 ND ND ND Oxígeno (ml l-1) Cuadro 1. Continúa. Est. 2 3A 3B 5 6 9 10A 10B 10 13 14 14A 14B 15 16A 16B 17 19 19B 20A Crucero TALUD III TALUD III TALUD III TALUD III TALUD III TALUD III TALUD III TALUD III TALUD III TALUD III TALUD III TALUD III TALUD III TALUD III TALUD III TALUD III TALUD III TALUD III TALUD III TALUD III 48 Biodiversidad y comunidades del talud continental del Pacífico mexicano 17-ago-91 17-ago-91 17-ago-91 24-ago-91 18-ago-91 18-ago-91 18-ago-91 18-ago-91 18-ago-91 18-ago-91 19-ago-91 19-ago-91 19-ago-91 20-ago-91 20-ago-91 20-ago-91 19-ago-91 20-ago-91 20-ago-91 24-ago-91 Fecha 22º44'36" 22º35'48" 22º36'36" 23º22'00" 23º17'54" 23º41'00" 23º44'18" 23º43'24" 23º41'54" 23º38'30" 24º44'48" 24º38'48" 24º39'12" 24º45'06" 24º52'00" 24º47'00" 24º33'00" 25º12'00" 25º18'24" 25º12'36" Lat. N 106º32'00" 106º37'42" 106º35'54" 107º10'00" 107º30'18" 107º23'36" 107º38'36" 107º39'06" 107º31'48" 107º58'48" 108º22'48" 108º26'54" 108º37'48" 108º19'12" 108º35'06" 108º38'30" 108º50'54" 109º07'00" 109º18'36" 109º06'03" Long. O No No No No No No No No No No No No No No No No No No No No Karling Tipo de arrastre Agassiz Agassiz IK IK Agassiz Agassiz Agassiz IK Agassiz IK Agassiz Agassiz Agassiz Agassiz Agassiz Agassiz IK IK IK Agassiz Prof. de arrastre (m) 520-535 980-1000 275 365 (698) 996-1148 491-535 968 630 823 0-720 720-732 1016-1020 1188-1208 444-496 216-224 579-608 770 410 (920) 600 (1890) 966 Prof. núcleos (m) No No No No No No No No No No No No No No No No No No No No ND ND ND ND ND <0.1 ND ND ND ND <0.1 0.15 ND <0.1 ND ND ND ND ND ND Oxígeno (ml l-1) O peraciones oceanográficas en aguas profundas 49 Est. 24 24A 25 A1 25 A1 25 A2 25B 26 27 28 Est. 1 3 4 5 6 7 12 13 Crucero TALUD III TALUD III TALUD III TALUD III TALUD III TALUD III TALUD III TALUD III TALUD III Crucero TALUD IV TALUD IV TALUD IV TALUD IV TALUD IV TALUD IV TALUD IV TALUD IV Cuadro 1. Continúa. 23-ago-00 23-ago-00 23-ago-00 23-ago-00 23-ago-00 23-ago-00 24-ago-00 24-ago-00 21-ago-91 24-ago-91 21-ago-91 21-ago-91 21-ago-91 23-ago-91 23-ago-91 23-ago-91 23-ago-91 Fecha Fecha 21º59'36" 21º58'28" 21º59'00" 22º03'18" 22º00'30" 22º00'22" 23º14'48" 23º17'30" 25º33'36" 25º45'12" 25º51'00" 25º51'00" 25º50'54" 25º03'18" 26º10'18" 26º32'48" 26º28'54" Lat. N Lat. N 106º23'42" 106º28'53" 106º35'00" 106º41'18" 106º47'48" 106º49'18" 107º28'24" 107º29'51" 109º42'01" 109º46'48" 109º57'00" 109º57'00" 109º56'54" 109º47'24" 109º58'24" 109º51'00" 109º45'42" Long. O Long. O No K K K No No No No No No No No No No No No No Karling Karling Tipo de arrastre Agassiz Agassiz Agassiz IK IK IK Agassiz Agassiz Agassiz Tipo de arrastre No Trineo Trineo Trineo No MN No Trineo Prof. de arrastre (m) 1043 1027-1060 1280-1360 200 (2000) 230 (ND) 150 (ND) 712-730 395-415 221-244 Prof. de arrastre (m) 460-490 785-800 1200-1290 1340-1360 ND 500 (1970) ND 860 Prof. núcleos (m) No No No No No No No No No Prof. núcleos (m) H 800 1228 1540 1970 No 1045 1550 0.33 0.28 0.84 1.60 ND ND ND 0.34 ND ND ND ND ND ND ND ND ND Oxígeno (ml l-1) Oxígeno (ml l-1) 14 24-ago-00 14 bis 24-ago-00 15 17 18 19 20 21 22 24 25 26 27 28 29 31 TALUD IV TALUD IV TALUD IV TALUD IV TALUD IV TALUD IV TALUD IV TALUD IV TALUD IV TALUD IV TALUD IV TALUD IV TALUD IV TALUD IV TALUD IV TALUD IV Biodiversidad y comunidades del talud continental del Pacífico mexicano 27-ago-00 25-ago-00 25-ago-00 25-ago-00 28-ago-00 26-ago-00 26-ago-00 26-ago-00 26-ago-00 26-ago-00 28-ago-00 27-ago-00 25-ago-00 24-ago-00 Est. Crucero Fecha Cuadro 1. Continúa. 50 25º46'02" 24º15'12" 24º15'18" 24º27'24" 24º29'30" 24º17'20" 24º58'00" 24º53'12" 24º56'24" 24º59'0" 24º52'30" 24º57'48" 24º14'42" 23º23'30" 23º13'24" 23º13'24" Lat. N 109º39'59" 108º17'10" 108º24'06" 108º35'16" 108º55'48" 108º50'30" 108º55'18" 108º59'24" 109º05'36" 109º12'06" 109º37'00" 109º37'00" 108º10'59" 107º47'48" 107º41'48" 107º41'48" Long. O No K K K No No No K K No K No No No No No Karling No Trineo Trineo Trineo No MN No Trineo Trineo Trineo Trineo MN No MN Tipo de arrastre Trineo No 908-944 1196-1200 1500-1540 ND 1325 (ND) ND 778-800 1200-1274 1605-1620 2024-2040 1280 (2080) ND 1500 (2350) Prof. de arrastre (m) 2220-2250 ND H (635) H (605620) 960 1240 1510 1850 No 549 848 1235 1565 2120 No Prof. núcleos (m) 2120 H (20502100) No ND 0.43 0.70 ND ND ND 0.18 0.25 0.76 1.35 2.1 ND ND 2.23 2.45 ND Oxígeno (ml l-1) O peraciones oceanográficas en aguas profundas 51 37 Est. TALUD IV Crucero 2 3 4 5 6 11 12 14 15 32 33 34 35 36 TALUD IV TALUD IV TALUD IV TALUD IV TALUD IV TALUD V TALUD V TALUD V TALUD V TALUD V TALUD V TALUD V TALUD V TALUD V Est. Crucero Cuadro 1. Continúa. 13-dic-00 13-dic-00 13-dic-00 13-dic-00 13-dic-00 17-dic-00 14-dic-00 14-dic-00 14-dic-00 Fecha 28-ago-00 27-ago-00 27-ago-00 27-ago-00 27-ago-00 27-ago-00 Fecha 21º59'54" 21º59'14" 22º04'39" 22º00'57" 22º00'00" 23º14'00" 23º18'00" 23º16'20" 23º23'24" Lat. N 24º53'49" 25º46'00" 25º45'54" 25º40'42" 25º53'59" 25º51'59" Lat. N 106º23'53" 106º28'30" 106º34'42" 106º40'00" 106º48'05" 107º00'00" 107º26'59" 107º40'45" 107º47'54" Long. O 109º36'48" 109º42'06" 109º48'06" 109º54'24" 110º11'17" 110º11'00" Long. O No K No K K K K K No Karling No No K K K No Karling Tipo de arrastre No Trineo No Trineo Trineo Trineo Trineo Trineo Trineo MN Tipo de arrastre No Trineo Trineo Trineo MN Prof. de arrastre (m) ND 1060-1080 1240 2000-2100 1000 (2100) (20402080) Prof. de arrastre (m) ND 730 ND 1515-1620 1950-2010 850-870 1160-1170 2080-2140 2340 Prof. núcleos (m) 460 730 1190 1495 1925 825 1120 2020 No No Prof. núcleos (m) H (860) 1040 1244 2020 No 0.22 0.13 0.56 1.15 1.88 0.07 0.54 1.98 ND Oxígeno (ml l-1) ND 0.25 0.55 0.79 1.68 ND Oxígeno (ml l-1) 52 Biodiversidad y comunidades del talud continental del Pacífico mexicano Est. 15 17 18 19 20 24 25 26 27 29 31 32 34 35 36 Crucero TALUD V TALUD V TALUD V TALUD V TALUD V TALUD V TALUD V TALUD V TALUD V TALUD V TALUD V TALUD V TALUD V TALUD V TALUD V Cuadro 1. Continúa. 17-dic-00 17-dic-00 17-dic-00 17-dic-00 17-dic-00 15-dic-00 15-dic-00 15-dic-00 15-dic-00 16-dic-00 16-dic-00 16-dic-00 16-dic-00 17-dic-00 14-dic-00 Fecha 25º45'53" 25º46'01" 25º40'41" 25º54'30" 25º54'30" 24º14'39" 24º15'12" 24º16'24" 24º14'44" 24º57'50" 24º51'46" 24º56'18" 24º58'22" 25º14'36" 23º21'30" Lat. N 109º39'49" 109º42'39" 109º54'24" 110º11'23" 110º11'24" 108º11'01" 108º17'09" 108º24'18" 108º35'18" 108º55'14" 108º57'59" 109º11'48" 109º12'08" 109º24'15" 107º48'12" Long. O No No No No No No K K K No K K No No No Karling No Trineo No No MN No Trineo Trineo Trineo No Trineo Trineo No MN Tipo de arrastre MN Prof. de arrastre (m) 1350 (2384) ND 940-990 1180-1200 1470-1525 ND 800-860 1280-1310 ND 1290 (2040) ND 850-900 ND ND 1340 (1990) 645 810 1225 1970 No 590 900 1160 1515 525 815 1220 1580 No Prof. núcleos (m) No 0.06 0.10 0.61 1.3 ND 0.07 0.15 0.38 1.20 ND 0.13 0.53 1.23 ND ND Oxígeno (ml l-1) O peraciones oceanográficas en aguas profundas 53 11 12 13 15 TALUD VI TALUD VI TALUD VI TALUD VI 18 19 20 22 25 26 27 29 29 3 4 5 7 TALUD VI TALUD VI TALUD VI TALUD VI TALUD VI TALUD VI TALUD VI TALUD VI TALUD VI TALUD VI TALUD VI TALUD VI TALUD VI Est. Crucero Cuadro 1. Continúa. 15-mar-01 15-mar-01 15-mar-01 15-mar-01 16-mar-01 16-mar-01 16-mar-01 16-mar-01 16-mar-01 14-mar-01 14-mar-01 14-mar-01 14-mar-01 13-mar-01 13-mar-01 13-mar-01 14-mar-01 Fecha 24º14'56" 24º16'24" 24º14'48" 24º17'26" 24º51'41" 24º56'18" 25º01'12" 25º16'24" 25º16'24" 23º14'59" 23º18'36" 23º14'59" 23º14'42" 22º00'01" 22º00'51" 22º00'42" 22º21'39" Lat. N 108º16'17" 108º24'18" 108º35'11" 108º50'05" 108º57'54" 109º06'42" 109º11'36" 109º24'54" 109º24'54" 106º59'00" 107º26'56" 107º30'03" 107º30'00" 106º28'06" 106º34'42" 106º39'55" 107º01'42" Long. O K K K No K K K K No K K No No K K K No Karling Trineo Trineo Trineo No Trineo Trineo Trineo Trineo MN Trineo Trineo No MN Tipo de arrastre Trineo Trineo Trineo MN Prof. de arrastre (m) 770-780 1190-1250 1470-1530 1305 (2100) 825-855 1050-1160 ND 1230 (2390) 850-890 1160-1200 1250-1440 ND 830-850 1190-1270 1580-1600 2080 1440 (2080) 820 1200 1530 No 850 1270 1585 No No 760 1110 1345 No Prof. núcleos (m) 780 1300 1535 No 0.29 0.73 1.27 ND 0.22 1.40 1.44 ND ND 0.17 0.50 0.50 ND 0.21 ND 1.74 ND Oxígeno (ml l-1) Cuadro 1. Continúa. Est. 32 33 34 36 Est. 3 4 5 11 12 13B 18 18 bis 19 20 25 26 Crucero TALUD VI TALUD VI TALUD VI TALUD VI Crucero TALUD VII TALUD VII TALUD VII TALUD VII TALUD VII TALUD VII TALUD VII TALUD VII TALUD VII TALUD VII TALUD VII TALUD VII 54 Biodiversidad y comunidades del talud continental del Pacífico mexicano 05-jun-01 05-jun-01 05-jun-01 06-jun-01 06-jun-01 06-jun-01 07-jun-01 10-jun-01 07-jun-01 07-jun-01 08-jun-01 08-jun-01 Fecha 17-mar-01 17-mar-01 17-mar-01 17-mar-01 Fecha 22º13'18" 22º03'18" 22º00'24" 23º16'54" 23º18'18" 23º30'18" 24º14'30" 24º52'46" 24º16'12" 24º14'48" 24º52'48" 24º25'24" Lat. N 25º46'15" 25º45'49" 25º43'50" 25º53'15" Lat. N 106º31'36" 106º34'42" 106º39'54" 106º59'48" 107º26'48" 107º44'00" 108º16'24" 108º58'05" 108º23'42" 108º35'12" 108º58'00" 109º05'21" Long. O 109º42'08" 109º48'40" 109º53'59" 110º10'08" Long. O K K No K K K K No K No K K Karling No K K No Karling Tipo de arrastre Trineo Trineo Trineo Trineo Trineo Trineo Trineo No Trineo Trineo Trineo Trineo Tipo de arrastre No Trineo Trineo No Prof. de arrastre (m) ND 1120-1160 1240-1270 1360 (2000) Prof. de arrastre (m) 740-750 1200-1230 1490-1520 780-790 1040-1120 1400-1450 950-1010 ND 1160-1180 1480-1520 780-850 1180-1220 Prof. núcleos (m) 750 1190 1520 760 1130 1470 830 865 1200 1530 905 1260 Prof. núcleos (m) 780 1105 1295 No 0.77 0.82 1.81 0.15 0.18 1.04 ND ND 0.08 0.79 0.04 0.35 Oxígeno (ml l-1) 0.28 0.57 0.86 ND Oxígeno (ml l-1) O peraciones oceanográficas en aguas profundas 55 Est. 27 32B 33B 34B Est. 2 3 6 7 9 10 11 12 13 15 16 Crucero TALUD VII TALUD VII TALUD VII TALUD VII Crucero TALUD VIII TALUD VIII TALUD VIII TALUD VIII TALUD VIII TALUD VIII TALUD VIII TALUD VIII TALUD VIII TALUD VIII TALUD VIII Cuadro 1. Continúa. 18-abr-05 18-abr-05 18-abr-05 16-abr-05 16-abr-05 17-abr-05 17-abr-05 17-abr-05 17-abr-05 17-abr-05 17-abr-05 08-jun-01 09-jun-01 09-jun-01 09-jun-01 Fecha Fecha 25º23'06" 25º24'48" 25º21'00" 24º37'06" 24º32'36" 24º51'18" 25º04'00" 25º01'48" 24º58'12" 24º54'24" 25º02'00" 25º01'30" 26º03'00" 26º06'30" 26º05'30" Lat. N Lat. N 110º18'24" 110º34'48" 110º17'00" 109º25'6" 109º30'30" 109º48'24" 110º04'00" 110º06'54" 110º16'06" 110º25'36" 110º27'00" 109º12'00" 109º55'24" 110º06'42" 110º10'30" Long. O Long. O K No No K K No No K K K No K K K K Karling Karling Trineo Trineo MN Tipo de arrastre Trineo Trineo Trineo Trineo Tipo de arrastre No Trineo MN MN Trineo Trineo Trineo MN Prof. de arrastre (m) 1580-1600 850-880 1260-1300 1500-1520 Prof. de arrastre (m) 2150 1600 580 (1700) 510 (1600) 1650-1680 1500 895-920 1150 (1280) 1625 (2100) 2100 (?) 1030 2100 1030 No Prof. núcleos (m) 1600 780 1295 1500 Prof. núcleos (m) 2200 2180?? No No 1650 1550 920 No 1.02 0.20 ND ND 0.39 (?) ND ND 0.84 ND 0.20 ND 1.39 0.15 0.60 0.78 Oxígeno (ml l-1) Oxígeno (ml l-1) Cuadro 1. Continúa. Est. 17B 18 20 21 22 Est. 1 2 3 4 5 6 7A 7B 8 10 11 14 Crucero TALUD VIII TALUD VIII TALUD VIII TALUD VIII TALUD VIII Crucero TALUD IX TALUD IX TALUD IX TALUD IX TALUD IX TALUD IX TALUD IX TALUD IX TALUD IX TALUD IX TALUD IX TALUD IX 56 Biodiversidad y comunidades del talud continental del Pacífico mexicano 10-nov-05 11-nov-05 11-nov-05 11-nov-05 11-nov-05 12-nov-05 15-nov-05 15-nov-05 12-nov-05 12-nov-05 12-nov-05 15-nov-05 18-abr-05 19-abr-05 19-abr-05 19-abr-05 19-abr-05 Fecha Fecha 24º37'54" 24º38'42" 24º32'52" 24º28'42" 24º33'20" 24º49'38" 25°11'30" 25°11'19" 25º07'28" 24º56'24" 24º53'33" 25º31'30" 24º24'24" 25º50'00" 25º56'56" 26º02'18" 26º03'42" Lat. N Lat. N 109º22'36" 109º17'36" 109º29'04" 109º34'06" 109º49'30" 109º47'58" 109°41'06" 109°42'45" 109º49'48" 110º16'42" 110º25'38" 110º07'24" 110º50'06" 110º34'00" 110º43'00" 110º37'06" 110º23'54" Long. O Long. O No K K K No MN No No K No No No K No K K K Karling Karling Tipo de arrastre Trineo MN Trineo Trineo Trineo Tipo de arrastre MN Trineo Trineo Trineo No No MN MN Trineo Trineo No Trineo Prof. de arrastre (m) 700-750 690 (1300) 1140-1150 1380 2200 Prof. de arrastre (m) 1050 (2285) 2195-2300 1454-1620 1901-2120 ND 920 (1650) 1510 (2377) 850 (2392) 1657 969-1225 ND 2010-2244 Prof. núcleos (m) 700 No 1150 1380 2200 Prof. núcleos (m) No 2250 1625 1395 470 No No No 1595 1254 875 2000 ND 2.37 1.19 0.85 ND ND ND ND 1.16 0.11 (?) ND 1.86 0.13 ND 0.30 0.51 1.27 Oxígeno (ml l-1) Oxígeno (ml l-1) O peraciones oceanográficas en aguas profundas 57 Est. 12 15 15 B 16 16B 17 18 19 20B 21B 22 23 Est. 3 4 5 6 7 Crucero TALUD IX TALUD IX TALUD IX TALUD IX TALUD IX TALUD IX TALUD IX TALUD IX TALUD IX TALUD IX TALUD IX TALUD IX Crucero TALUD X TALUD X TALUD X TALUD X TALUD X Cuadro 1. Continúa. 09-feb-07 09-feb-07 09-feb-07 09-feb-07 10-feb-07 12-nov-05 13-nov-05 15-nov-05 13-nov-05 13-nov-05 13-nov-05 13-nov-05 14-nov-05 14-nov-05 14-nov-05 14-nov-05 15-nov-05 Fecha Fecha 28º16'38" 28º16'06" 28º14'50" 28º01'34" 27º53'09" 25°30’24” 25º21'27" 25º21'32" 24º23'48" 25º26'54" 25º19'54" 25º49'38" 25º53'09" 25º58'07" 26º04'42" 26º03'42" 26º03'59" Lat. N Lat. N 112º35'12" 112º32'50" 112º24'53" 112º17'25" 112º16'42" 110°26’30” 110º18'18" 110º18'32" 110º36'42" 110º38'01" 110º47'42" 110º34'45" 110º41'54" 110º40'04" 110º34'48" 110º20'36" 110º24'45" Long. O Long. O No K K K No No No No No No No No No No No No No Karling Karling Tipo de arrastre MN Trineo No Trineo No Trineo MN Trineo Trineo Trineo Trineo MN Tipo de arrastre Trineo Trineo Trineo Trineo MN Prof. de arrastre (m) 1150 (1595) 1985-2290 ND 997-1021 ND 626-846 ND 1078-1084 1229-1343 1349-1369 2214-2309 1450 (2318) Prof. de arrastre (m) 377-379 587-633 820-837 1037-1043 900 (1191) Prof. núcleos (m) No 2018 1983 1015 610 800 No 1050 1192 1330 2220 No Prof. núcleos (m) 379 625 No No No 0.96 0.39 0.11 0.30 ND ND 1.78 ND 0.15 ND 0.03 ND 0.24 0.57 0.57 1.63 ND Oxígeno (ml l-1) Oxígeno (ml l-1) Cuadro 1. Continúa. Est. 8 9 10 11 12 13 14 15 17 18 19 20 21 22 23 23 25 26 Crucero TALUD X TALUD X TALUD X TALUD X TALUD X TALUD X TALUD X TALUD X TALUD X TALUD X TALUD X TALUD X TALUD X TALUD X TALUD X TALUD X TALUD X TALUD X 58 Biodiversidad y comunidades del talud continental del Pacífico mexicano 14-feb-07 14-feb-07 13-feb-07 13-feb-07 14-feb-07 14-feb-07 10-feb-07 10-feb-07 10-feb-07 11-feb-07 11-feb-07 11-feb-07 11-feb-07 11-feb-07 12-feb-07 12-feb-07 12-feb-07 13-feb-07 Fecha 26º39'04" 26º35'16" 27º14'31" 27º02'46" 27º00'58" 27º00'30" 28º05'56" 27º52'51" 27º48'30" 27º34'16" 28º01'31" 27º49'46" 27º44'53" 27º40'24" 27º08'00" 27º09'06" 27º13'30" 27º14'41" Lat. N 111º18'20" 111º05'59" 111º14'39" 110º52'57" 110º12'23" 111º12'00" 112º26'50" 112º15'53" 112º17'12" 111º40'30" 111º51'10" 111º43'18" 111º36'58" 111º39'54" 111º44'10" 111º46'54" 111º36'08" 111º36'15" Long. O K K K K No No K K K No K K K K K K K No Karling Trineo Trineo Trineo Trineo No MN Tipo de arrastre Trineo Trineo Trineo MN Trineo Trineo Trineo Trineo Trineo Trineo Trineo MN Prof. de arrastre (m) 975-1007 1205-1215 1396-1422 1220 (1800) 465-486 668-704 905-943 1528-1530 1289-1326 1526 1786-1816 Aprox. 1250 (1785) 1864-1865 1575-1586 ND aprox. 1250 (1770) 837-840 1292-1301 830 1310 1900 1640 1754 1750 Prof. núcleos (m) No 1216 1426 No 460 680 901 1560 1330 1440 1930 No 0.17 0.36 0.65 0.88 0.48 ND 0.26 0.31 0.44 ND 0.14 0.12 0.20 0.51 0.46 0.51 0.58 ND Oxígeno (ml l-1) O peraciones oceanográficas en aguas profundas 59 Est. 27 29 30 Est. 1 2 3 5 6 6A 8 9 11 12 13 14 15 Crucero TALUD X TALUD X TALUD X Crucero TALUD XI TALUD XI TALUD XI TALUD XI TALUD XI TALUD XI TALUD XI TALUD XI TALUD XI TALUD XI TALUD XI TALUD XI TALUD XI Cuadro 1. Continúa. 08-jun-07 08-jun-07 08-jun-07 08-jun-07 08-jun-07 09-jun-07 09-jun-07 07-jun-07 07-jun-07 07-jun-07 07-jun-07 07-jun-07 07-jun-07 15-feb-07 15-feb-07 15-feb-07 Fecha Fecha 17º06'30" 17º10'23" 17º23'28" 17º49'24" 17º45'00" 17º32'24" 17º23'00" 16º52'00" 16º47'42" 16º50'18" 16º52'35" 16º16'57" 16º58'00" 26º40'18" 26º35'36" 26º36'50" Lat. N Lat. N 101º40'16" 101º37'21" 101º25'06" 101º59'30" 102º00'06" 102º02'28" 102º04'00" 100º22'00" 100º28'12" 100º42'09" 100º47'34" 100º54'30" 100º57'00" 110º37'00" 110º35'44" 110º21'10" Long. O Long. O No No No No No No No K No No No No No No No No Karling Karling No No No No No No No Tipo de arrastre No Trineo Trineo Tipo de arrastre Trineo No No No No MN Prof. de arrastre (m) ND 1383-1439 1203-1213 Prof. de arrastre (m) 740-790 ND ND ND ND 1400 (1960) ND ND ND ND ND ND ND 1778 1404 695 580 1195 1539 2140 Prof. núcleos (m) 1474 1395 1249 Prof. núcleos (m) 880 990 1380 1550 2000 No 1.48 0.20 0.17 ND 0.65 ND ND 0.14 0.24 0.92 1.25 1.73 ND 0.77 0.55 ND Oxígeno (ml l-1) Oxígeno (ml l-1) Cuadro 1. Continúa. Est. 15B 16 17 18 19 19B 20 23 24 25 26 27 28 29 30 30B Crucero TALUD XI TALUD XI TALUD XI TALUD XI TALUD XI TALUD XI TALUD XI TALUD XI TALUD XI TALUD XI TALUD XI TALUD XI TALUD XI TALUD XI TALUD XI TALUD XI 60 Biodiversidad y comunidades del talud continental del Pacífico mexicano 10-jun-07 10-jun-07 10-jun-07 10-jun-07 10-jun-07 11-jun-07 11-jun-07 11-jun-07 11-jun-07 11-jun-07 09-jun-07 09-jun-07 09-jun-07 09-jun-07 09-jun-07 09-jun-07 Fecha 17º53'18" 18º30'25" 18º29'21" 18º23'22" 18º33'12" 18º41'00" 18º48'05" 19º18'00" 19º26'23" 19º28'10" 17º48'00" 18º07'30" 18º05'02" 17º58'12" 17º56'01" 17º56'00" Lat. N 103º11'30" 103º54'28" 104º01'18" 104º13'16" 104º32'12" 104º33'07" 104º32'36" 105º26'19" 105º19'00" 105º17'30" 102º30'42" 103º02'32" 103º04'07" 103º05'21" 103º08'24" 103º10'00" Long. O No No No No No No No No No No No No No No No No Karling No No No No No No No No No No Tipo de arrastre No No No No No MN Prof. de arrastre (m) ND ND ND ND ND 1490 (1750) ND ND ND ND ND ND ND ND ND ND 2677 994 1502 1800 1918 1305 1050-1120 1590-1595 1225 860 Prof. núcleos (m) CTD (285) 250 560 1270 1843 No 1.94 0.09 0.27 0.80 0.89 0.03 0.54 1.13 0.60 0.12 ND 0.12 ND 0.68 1.68 ND Oxígeno (ml l-1) O peraciones oceanográficas en aguas profundas 61 Est. 2 3 4 5 8 9 10 13 14 15 15C 16 17 18 19 20 22 Crucero TALUD XII TALUD XII TALUD XII TALUD XII TALUD XII TALUD XII TALUD XII TALUD XII TALUD XII TALUD XII TALUD XII TALUD XII TALUD XII TALUD XII TALUD XII TALUD XII TALUD XII Cuadro 1. Continúa. 31-mar-08 31-mar-08 27-mar-08 27-mar-08 31-mar-08 31-mar-08 28-mar-08 29-mar-08 29-mar-08 28-mar-08 30-mar-08 30-mar-08 30-mar-08 31-mar-08 28-mar-08 28-mar-08 28-mar-08 Fecha 18º08'03" 18º05'08" 17º58'08" 17º56'30" 17º54'20" 18º11'27" 16º58'28" 17º04'16" 17º10'26" 17º11'03" 17º45'16" 17º36'20" 17º25'33" 17º27'51" 16º49'18" 16º54'35" 16º59'39" Lat. N 103º02'24" 103º03'33" 103º05'30" 103º09'57" 103º10'45" 103º52'29" 100º55'20" 101º39'28" 101º37'37" 101º28'05" 102º00'29" 102º01'59" 102º07'20" 102º10'43" 100º30'52" 100º44'10" 100º58'07" Long. O No No No No No No K K K K K K K No K K No Karling No No No No No MN Trineo Trineo Trineo Trineo Trineo Trineo Trineo MN Tipo de arrastre Trineo Trineo MN Prof. de arrastre (m) 990-1088 1380-1456 1200 (1995) 1977-1925 1880-1940 1392-1420 1180-1299 1199-1100 1415-1476 2080-2125 1530 (1880) ND ND ND ND ND 1340 (2200) 296 740 1283 1625 1992 No 1849 1928 1520 1290 1200 1245 2018 No Prof. núcleos (m) 980 1386 No ND ND 0.64 1.59 ND ND 1.48 1.49 0.75 0.51 0.36 0.80 1.61 ND 0.20 0.80 ND Oxígeno (ml l-1) Cuadro 1. Continúa. Est. 23 24 25 26 27 28 28B 29 30 30B Est. B B 34 36 37 Crucero TALUD XII TALUD XII TALUD XII TALUD XII TALUD XII TALUD XII TALUD XII TALUD XII TALUD XII TALUD XII Crucero TALUD XIII TALUD XIII TALUD XIII TALUD XIII TALUD XIII 62 Biodiversidad y comunidades del talud continental del Pacífico mexicano 13-ene-09 13-ene-09 14-ene-09 15-ene-09 15-ene-09 02-abr-08 26-mar-08 26-mar-08 Fecha 01-abr-08 01-abr-08 01-abr-08 01-abr-08 02-abr-08 02-abr-08 02-abr-08 Fecha 26º19'54" 26º17'04" 26º33'36" 26º07'12" 26º03'54" 19º19'37" 19º22'05" 19º30'37" Lat. N 18º33'43" 18º28'00" 18º26'45" 18º33'27" 18º40'28" 18º50'19" 18º56'00" Lat. N 110º29'12" 110º27'53" 111º02'00" 110º30'53" 110º20'06" 105º26'20" 105º16'18" 105º19'16" Long. O 103º57'45" 104º14'10" 104º16'10" 104º28'21" 104º35'51" 104º34'14" 104º59'57" Long. O No No No No No K K K Karling K K K K K K No Karling Trineo Trineo Trineo Tipo de arrastre Agassiz No Agassiz Agassiz Agassiz Tipo de arrastre Trineo Trineo Trineo Trineo Trineo Trineo MN Prof. de arrastre (m) 1058-1088 1535-1542 1858-1879 2125-2165 1040-1095 1101-1106 1450 (1425) 1609-1643 1350-1380 865-1045 Prof. de arrastre (m) 1295-1330 ND 1485-1530 2360-2300 2056-2195 No 1350 825 Prof. núcleos (m) 1780 1785 1484 2326 1860 Prof. núcleos (m) 1150 1507 1627 1956 1158 1080 No 0.87 0.87 0.95 1.83 1.68 1.03 0.71 0.11 Oxígeno (ml l-1) 0.22 0.95 1.39 1.97 0.26 0.27 ND Oxígeno (ml l-1) muestras de la endo y epifauna más grande jamás vista para las aguas profundas del Pacífico mexicano. Las campañas TALUD se dividieron en cinco etapas: Etapa 1 (TALUD I-III; 1989-1990). Frente a Sinaloa, SE del golfo de California (Fig. 4 A; Cuadro 1). Esta etapa puede ser considerada como la etapa preliminar o de exploración. La primera campaña del proyecto TALUD se efectuó en 1989 (TALUD I). El conocimiento local acerca de la ubicación y de la extensión de la ZMO era muy somero, razón por la cual se optó por realizar transectos desde la plataforma continental externa (aproximadamente entre 110 y 180 m de profundidad) hacia aguas más profundas. Rápidamente se encontraron problemas técnicos muy serios, pues parte de los fondos de la zona intermedia entre la plataforma y el talud superior resultó cubierta de ramas y troncos de árboles hundidos. Los daños ocasionados a las redes utilizadas fueron considerables y se optó por limitar el número de estaciones visitadas. Además, se pudo constatar que esta zona relativamente somera, al límite entre la plataforma y el talud continentales, se carecterizaba por tener concentraciones de oxígeno disuelto muy bajas. Sin lugar a dudas, los mejores resultados de esta primer etapa en lo que se refiere a la fauna profunda correspondieron al TALUD III, ya que se efectuaron 22 arrastres, de los cuales 15 fueron por debajo de los 700 m, y se recolectaron muchas especies de la fauna típicamente asociada con la franja bentónica ubicada al limite inferior o por debajo de la ZMO. Etapa 2 (TALUD IV-VII; 2000-2001). Frente a Sinaloa, SE del golfo de California (Figs. 4 B-D, 5 A; Cuadro 1). Basándose en los resultados de los tres cruceros anteriores, se modificaron algunos aspectos esenciales del estudio (e.g., intervalo de profundidad de los muestreos, equipos utilizados, académicos involucrados) y se efectuaron cuatro cruceros, intentando visitar las mismas localidades cuatro veces. En algunas ocasiones eso no fue posible; sin embargo, la serie de datos y de información obtenida fue muy amplia y resultó ser un avance muy significativo para el estudio de las aguas profundas en México. En esta segunda etapa se visitaron 90 estaciones y se realizaron 57 arrastres profundos. Etapa 3 (TALUD VIII y IX; 2005). Baja California Sur, SO del golfo de California (Fig. 5 B, C; Cuadro 1). Estos dos cruceros fueron organizados frente a la porción SE de la península de Baja California, entre las islas Cerralvo y Carmen. Las dificultades encontradas durante estos cruceros fueron esencialmente por causa de la proximidad de la costa rocosa y la irregularidad de los fondos. De hecho, en una de las estaciones, los equipos de arrastre pegaron una zona rocosa, se perdió la draga O peraciones oceanográficas en aguas profundas 63 Fig. 5. Posición de las estaciones de muestreo visitadas durante: A. la campaña TALUD VII; B. la campaña TALUD VIII; C. la campaña TALUD IX; D. las campañas TALUD X-XIII. A B C D Karling (ruptura del cable de arrastre) y se doblaron los patines del trineo bentónico. A pesar de las dificultades encontradas en una zona caracterizada por la abundancia de salientes rocosos profundos, se efectuaron 37 estaciones de muestreo y 23 arrastres bentónicos en esta etapa. Etapa 4 (TALUD X y XIII; 2007 y 2009). Golfo de California central (Fig. 5 D; Cuadro 1). Con el fin de completar el estudio del talud superior del golfo de California y realizar el análisis de la composición de las comunidades presentes por debajo de la ZOM, se efectuaron dos campañas en el área comprendida entre el norte de isla Carmen y el sur de isla Tiburón. En el crucero TALUD X se realizaron unas de las estaciones de muestreo más someras del proyecto posteriores a 1990, entre 379 y 633 m. Eso se debió a la variación del nivel de la ZOM comparativamente con los cruceros anteriores en el SE y SO del golfo de California. En total se visitaron 25 estaciones en esta campaña, incluyendo 18 arrastres con el trineo bentónico. La campaña TALUD XIII fue muy corta (cuatro arrastres) y consistió en la recuperación de algunas estaciones que no se pudieron realizar al final de la campaña TALUD X por mal tiempo. Estas estaciones fueron todas ubicadas en la cuenca del Carmen y proximidades. 64 Biodiversidad y comunidades del talud continental del Pacífico mexicano Etapa 5 (TALUD XI y XII; 2007 y 2008). Costa SO de México, Jalisco-Guerrero (Fig. 5 D; Cuadro 1). Debido a un error de maniobra del buque en la estación 2 del TALUD XI, el cable de arrastre del trineo y de la draga Karling fue cortado causando el hundimiento de los equipos. Como consecuencia, no se pudo realizar la gran mayoría de los arrastres programados en esta campaña (de 18 solo se realizó uno) y, considerando que al momento de la pérdida de los equipos el buque se encontraba justo al norte de Acapulco, se optó por realizar las hidrocalas y los muestreos de sedimentos con el nucleador de caja camino de regreso al puerto de embarque. Al año siguiente, se consiguió tiempo de uso del buque para recorrer de nuevo esta zona y, esta vez, se visitaron 27 estaciones y se realizaron 18 arrastres completos con éxito. A lo largo del proyecto TALUD, en total se realizaron 666 operaciones de muestreo. Estos muestreos comprenden: 142 hidrocalas; 125 muestreos con el nucleador múltiple; 99 muestreos de sedimentos con la draga Karling y 80 con el nucleador de caja; 179 muestras de la fauna bentónica con la red camaronera de 80’ (21 muestras), con las dragas tipo Agassiz (41) y con el trineo bentónico (117); y 41 muestreos de la fauna pelágica, la mayoría (28) con una red para micronecton y con la red Isaacs Kidd (12) (Cuadro 1). Una lista de los equipos e instalaciones utilizadas durante las campañas del proyecto TALUD aparece en el Cuadro 2. En la totalidad de las operaciones de muestreo se utilizaron los localizadores vía satélite para determinar la posición exacta de los muestreos y las ecosondas para revisar el perfil del fondo y determinar las profundidades de cada estación al momento de efectuar un muestreo o una hidrocala. En los TALUD I-IX se utilizó una ecosonda analógica Edo Western con impresión directa en papel, mientras que a partir del TALUD X se contó con una ecosonda digital SIMRAD con sistema de conservación de datos en soporte digital. Considerando el amplío abanico de grupos faunísticos estudiados y la necesidad de efectuar algunos análisis directamente a bordo, se usaron todos los laboratorios de la cubierta de trabajo así como los “winches” (malacates o cabrestantes) hidráulicos, de uso múltiple y del CTD (Lám. 4 B-D), y los congeladores de popa. Hidrocalas En cada estación de muestreo, se procuró realizar una hidrocala entre la superficie y el fondo para obtener información acerca de los perfiles de temperatura, de salinidad y de oxígeno disuelto. Este último parámetro es particularmente importante O peraciones oceanográficas en aguas profundas 65 Hidrocalas y soporte para CTD Winkler Hidrocala (salinidad, temperatura, concentración oxigeno) Hidrocala (salinidad, temperatura, concentración oxigeno) Zooplancton Micronecton Estructura Rosette Titulador de oxígeno CTD O2 Sea-bird 19 Red pelágica Isaacs-Kidd Red Bongo CTD SBE-911-plus Monitoreo de la profundidad Ecosondas (analógica y digital) Marco de popa y cabestrante de uso múltiple Cabestrante del CTD Tambor de redes CTD, rosette y nucleador múltiple Maniobras de recuperación de redes y trineo Redes de arrastre y nucleador de caja Hidrocalas y soporte para CTD ICML, UNAM B/O El Puma B/O El Puma B/O El Puma B/O El Puma Adquisición CONACyT TALUD II y III TALUD I TALUD XII y XIII Analógica: TALUD I a IX. Digital: TALUD X-XIII TALUD IV-XIII Todas B/O El Puma B/O El Puma Todas Todas Todas B/O El Puma B/O El Puma B/O El Puma C: Según la longitud de cable disponible D: 2 redes de 500 m, boca de 0.3 m2 C: Hasta 500 m de profundidad D: ca 3 m2 C: Aprox. 5500 m de cable sintético C: Aprox. 3000 m de cable conductor C: Analógica, impresión directa. Digital, conservación de datos en formato electrónico C: 12 botellas; 10500 m C: Indefinida C: 3500 m; sensor O2 hasta 2000 m. C: 6500 m C: Aprox. 3000 m de cable de acero C: Redes grandes y cable sintético Características Malacate hidrológico Campañas donde se uso Uso Equipo Biodiversidad y comunidades del talud continental del Pacífico mexicano Origen Cuadro 2. Equipos e instalaciones utilizadas durante las campañas del proyecto TALUD. C, capacidad; D, dimensiones. 66 O peraciones oceanográficas en aguas profundas 67 Sedimentos Sedimentos-meiofauna Sedimentos-meiofauna Draga Smith McIntyre Nucleador de caja Nucleador múltiple Macrofauna superficial Macrofauna (grandes muestras de crustáceos y peces) Todos los grupos Draga Agassiz (grande) Congeladores Laboratorios (varios) Macrofauna superficial Draga Agassiz (chica) Trineo bentónico Sedimentos hasta 7 cm de profundidad Macrofauna superficial Micronecton Red para micronecton Draga Karling Uso Equipo Cuadro 2. Continúa. B/O El Puma Construcción local (CONACYT) Construcción local (CONACyT-PAPIIT) Construcción local (CONACyT) Construcción local (ICML) B/O El Puma B/O El Puma B/O El Puma B/O El Puma Construcción local Origen Todas TALUD II y III TALUD IIII a XII TALUD XIII TALUD IV-XII TALUD IV-XII TALUD IV-IX TALUD I-III TALUD VIII-XIII TALUD IV-XIII Campañas donde se uso C: Espacio de trabajo para 12 personas simultáneamente C: Hasta 1500 m de profundidad; boca de 0.81 m2 C: Hasta 600-700 m; 20 l C: Hasta 2500 m de profundidad; 80 l C: Hasta 2020 m de profundidad; 6 núcleos C: Hasta 80 l de capacidad. D: 1.10 m por 0.40 m D: Anchura, 2.35 m; altura, 0.90 m D: Anchura, 1.80 m; altura, 0.80 m D: Anchura, 2.50 m; altura, 1.0 m C: hasta -20 °C; 30 m3 Características en el contexto del proyecto TALUD, pues, como se vio anteriormente la ZMO representa un factor limitativo en los patrones de distribución batimétrica y geográfica de las especies pelágicas y bentónicas en casi la totalidad de la costa del Pacífico mexicano (Hendrickx y Serrano 2010). Para bajar los equipos en la columna de agua, se utilizó el cabestrante especialmente diseñado para el uso de la estructura Rosette y de los CTD de control directo (i.e., con una conexión directa a través del cable de descenso-ascenso). Desafortunadamente, en la mayoría de los cruceros TALUD los equipos de medición de salinidad, temperatura y oxígeno in situ (CTD) del B/O El Puma estaban descompuestos o no confiables por no haber recibido su mantenimiento rutinario y sus calibraciones en la fábrica. En la mayoría de los cruceros se midió la concentración de oxígeno por medio del método Winkler, utilizando muestras de agua recolectadas en botellas instaladas en una estructura tipo Rossette (Lám. 5 A), con sistema de cierre controlado vía el cable del cabestrante hidrológico. Estas mediciones se hicieron con un sistema de titulación por micropipeta instalado a bordo. En el TALUD III se contó con algunos datos de oxígeno disuelto obtenido con un CTD O2 (i.e., un CTD autónomo equipado de un sensor para medición del oxígeno disuelto en el agua) propiedad de la University of South Carolina, EE.UU. Los perfiles correspondientes (véase un ejemplo en la Fig. 6) sirvieron para reconocer la amplitud del fenómeno en la zona y convencieron a los participantes del proyecto TALUD de la necesidad de poder contar con un equipo similar. A partir de la campaña TALUD VII se consiguió un CTD O2 Seabird 19 (Lám. 5 A-B) con capacidad de medición hasta 3500 m (2000 en el caso del sensor de oxígeno) que permitió realizar de manera rutinaria los perfiles en las siguientes campañas; además, se siguió con el análisis de muestras de agua por el método Winkler en tres niveles (subsuperficie, media agua, cerca del fondo). Durante el crucero TALUD XI y a solicitud del Instituto Tecnológico del Mar, Mazatlán, se conservaron muestras de agua recolectadas a nivel del fondo para análisis químicos. Sedimentos De manera muy ocasional se utilizó una draga Smith-McIntyre (Lám. 5 C) en los cruceros TALUD I y II. Desafortunadamente, las muestras de sedimentos de estas campañas no fueron analizadas. Debido a las altas profundidades, en el crucero TALUD III no se intentó conseguir muestras de sedimentos ya que no se contaba con un equipo adecuado para realizar este tipo de muestreo. En los cruceros TALUD IV-VII se utilizaron dos tipos de recolectores de sedimentos, cada uno con un pro68 Biodiversidad y comunidades del talud continental del Pacífico mexicano Fig. 6. Perfiles de oxígeno disuelto medidos a través de la columna de agua durante la campaña TALUD III. pósito distinto. Para la meiofauna se diseñó un nucleador múltiple con una capacidad de seis pequeños núcleos de aproximadamente 25 cm de longitud (Lám. 5 D). Construido en un taller local, este equipo, de un peso total de solamente 40 kg, resultó extraordinariamente económico y eficiente y permitió obtener muestras en profundidades de más de 2000 m. Colocado por debajo de la estructura Rosette, se operó con el malacate hidrológico hasta que tocara fondo; esta operación de ambos equipos de manera simultánea permitió ahorrar una considerable cantidad de horas de operación en alta mar. Para la macrofauna que vive en el sedimento, se utilizó una pequeña draga de arrastre cuyo diseño fue inspirado de las dragas tipo Karling. Construida en un taller local, la draga Karling fue diseñada para recolectar el sedimento superficial hasta una profundidad de 7 cm, con una capacidad máxima de almacenaje de 80 litros de lodo (Lám. 6 A, B). Este equipo se colocó en “tren” por detrás del trineo bentónico (o red de patines) utilizado a partir del TALUD IV (véase infra) y permitió realizar un muestreo del sedimento superficial de manera simultánea con el muestreo de la fauna apoyada sobre el fondo (epiO peraciones oceanográficas en aguas profundas 69 Lam. 5. A, estructura Rosette equipada con botellas y el CTD del proyecto; B, estructura Rosette en maniobra de inmersión; C, draga geológica Smith McIntyre; D, nucleador múltiple para meiofauna siendo recuperado en la plataforma hidrológica. B A C D fauna), ahorrándose de esta manera varias horas de muestreo. La draga Karling fue utilizada de manera rutinaria en los cruceros TALUD IV-XII, con algunas excepciones debido a fallas técnicas (Cuadro 1). Se conservaron fracciones de estas mues70 Biodiversidad y comunidades del talud continental del Pacífico mexicano tras para los análisis granulométricos y del contenido de materia orgánica (por calcinación). El resto fue filtrado en una estructura de filtración diseñada para este propósito y utilizada con anterioridad en las campañas SIPCO y CORTES (Lám. 7 A). Esta estructura contó con tamices apilados con aperturas de malla de ca. 5 mm (tamiz superior) hasta 500 μm (tamiz inferior). En los últimos cruceros TALUD se sustituyó la malla más fina por una de 300 μm. A partir del TALUD X se contó con un nucleador de caja tipo Reineck (Lám. 6 C, D), de aproximadamente 80 litros de capacidad máxima. Este tipo de equipo tiene la ventaja de proporcionar muestras muy homogéneas del sedimento del fondo, las cuales permiten obtener, a su vez, submuestras directamente en el puente, casi como si se estaría muestreando in situ. De hecho, al usar este equipo, se consiguieron muestras muy precisas del sedimento superficial para el análisis de la meiofauna y de algunos parámetros ambientales del sedimento (e.g., composición del sedimento, concentración de materia orgánica por titulación, temperatura del sedimento, pH). Además, durante el crucero TALUD XII y a solicitud del Instituto Tecnológico del Mar, Mazatlán, se conservaron muestras de sedimentos para análisis químicos. Arrastres pelágicos En el TALUD I solo se realizó un muestreo de zooplancton utilizando una estructura tipo Bongo parecida a la que se usó en los cruceros SIPCO (1981-1982) y CORTES (1982-1985), con una luz de malla de 500 μm (Lám. 7 B). En el TALUD II, por primera vez se utilizó una red pelágica de tipo Isaacs-Kidd (Lám. 8 A) prestada por el grupo del Dr. V. Arenas (ICML, UNAM). Este mismo equipo se utilizó de manera más intensiva en el TALUD III y se lograron recolectar 10 muestras, las cuales fueron analizadas parcialmente en el contexto de un estudio de los camarones pelágicos del Pacífico mexicano (Hendrickx y Estrada-Navarrete 1996). En los cruceros TALUD IV a XII se usaron dos estructuras con redes de media agua para micronecton construidas en talleres locales, de aproximadamente 0.8 m2 de superficie de boca y con una malla de 1 mm de apertura (Lám. 7 C). Los muestreos se efectuaron oblicuamente, hasta una profundidad de 500 m y 1500 m, sin parada en el nivel más profundo para evitar un sobre-muestreo del estrato más profundo. En el transcurso del estudio, se le dio prioridad a las muestras a 1500 m de profundidad, pues en este caso se lograba muestrear la fauna pelágica ubicada por debajo de la ZMO. En la mayoría de los muestreos de zooplancton y de micronecton de las campañas TALUD se uso un medidor continuo de “tiempo y profundidad” Benthos O peraciones oceanográficas en aguas profundas 71 Lam. 6. A, draga de arrastre endobentónica tipo Karling en proceso de recuperación; B, misma, vista frontal; C, nucleador de caja en proceso de inmersión; D, mismo en cubierta de operaciones. A B C D precalibrado (Lám. 7 D) que registro in situ la profundidad alcanzada por el equipo y la duración del muestreo. Arrastres bentónicos En los años 80, la plataforma de operaciones del B/O “El Puma” recibió de la Universidad Autónoma de Baja California Sur (UABCS) una draga tipo Agassiz que esta institución había utilizado en algunos de sus cruceros. Este equipo, con una anchura de 2.5 m y una altura de 1.0 m, tenía la ventaja de ser simétrico, por lo que no importa de que lado toca el fondo cuando se está bajando. La draga Agassiz fue el primer equipo de arrastre profundo que se utilizó en el proyecto y se desplegó en las campañas TALUD II y III, en conjunto con una red tipo camaronera de 80’ disponible en el barco. Ambos equipos fueron usados según las circunstancias: la red de 80’ en aguas someras y la draga Agassiz en aguas más profundas (Cuadro 1). El TALUD II 72 Biodiversidad y comunidades del talud continental del Pacífico mexicano Lám. 7. A, estructura de filtración de sedimentos con tamices de diferentes aperturas; B, estructura bongo para muestreo de zooplancton; C, red para micronecton en proceso de recuperación; D, misma, al termino del muestreo; se aprecia a la izquierda el medidor de tiempo y profundidad Benthos. A C B D presentó la particularidad de ser una combinación entre muestreos para el proyecto CEEMEX en aguas de la plataforma continental (véase Hendrickx et al. 1998) y muestreos propios del proyecto TALUD en aguas más profundas, por lo que se utilizó O peraciones oceanográficas en aguas profundas 73 en varias ocasiones la red de tipo camaronera de 80’. A partir del crucero TALUD IV se descartó el uso de redes y se construyó en el astillero Constructora y Reparadora de Buques, S.A. de C.V., en Mazatlán, Sinaloa, un trineo bentónico inspirado de varios diseños disponibles en la literatura (Sorbe 1983, Guennegan y Martin 1985) (Lám. 8 B). Este trineo bentónico, con una boca de 0.9 m de altura por 2.95 m de anchura, fue equipado de una malla tipo camaronera de 5.5 cm de apertura equipada de una red interna con malla más fina (ca 2.5 cm) para asegurar la captura de organismos pequeños. Este equipo se utilizó con mucho éxito en las campañas IV-XII. En la campaña TALUD XIII, se construyó en las instalaciones del ICMyL en Mazatlán una draga tipo Agassiz de tamaño menor a aquella utilizada en los cruceros TALUD II-III (Lám. 8 C). Este equipo se uso en la cuenca del Carmen, donde las condiciones de muestreo son muy difíciles debido a la poca anchura de los pisos batimétricos. Este equipo fue bajado en posición vertical, con el buque parado, iniciándose el arrastre una vez que tocaba fondo; esta estrategia aumentó la precisión del muestreo y permitió evitar el largo recorrido necesario para el despliegue del trineo bentónico usado en las campañas IV a XII. Instituciones participantes El proyecto TALUD es fundamentalmente un proyecto del Instituto de Ciencias del Mar y Limnología de la UNAM. Sin embargo, durante su desarrollo, se incorporaron académicos de otras instituciones con diferentes especialidades. Consecuentemente, el grupo TALUD está actualmente conformado por nueve científicos (de los cuales siete son investigadores principales) perteneciendo a cuatro instituciones; además, algunos investigadores participaron de manera incidental u ocasionalmente en las campañas o bien recibieron muestras específicamente recolectadas para algún tipo de estudio (Cuadro 3). La tripulación del B/O “El Puma” tubo un papel destacado en todos los cruceros que se llevaron a cabo entre 1989 y 2009. En total, fueron 30 los tripulantes quienes se embarcaron durante estas campañas (Cuadro 4) y el equipo científico siempre pudo contar con su ayuda y con una actitud positiva y constructiva. Durante las campañas, se fomentó la participación de estudiantes, tanto a nivel de licenciatura como de posgrado, y se pudo contar con el apoyo de algunos ayudantes voluntarios con experiencia demostrada. En total, fueron 70 los miembros del personal científico perteneciendo a estas dos categorías (Cuadro 5). 74 Biodiversidad y comunidades del talud continental del Pacífico mexicano Lam. 8. A, red de media agua tipo Isaacs Kidd en proceso de recuperación; B, trineo bentónico en proceso de recuperación; C, draga tipo Agassiz. A B C Apoyos recibidos Una parte significativa de los gastos ocasionados por la realización de las campañas (con excepción de los gastos de uso del buque) fueron cubiertos por los presupuestos institucionales de los investigadores participantes. Todos los cruceros organizados recibieron el apoyo de la UNAM, ya sea a través del ICMyL o del CTIC, en lo que se refiere al gasto operativo del buque (i.e., combustibles, avituallamiento, etc .). Un apoyo recibido de Conacyt (proyecto 31805-N; véase infra) sirvió para compensar parte de los gastos ocasionados por la operación de el B/O “El Puma” durante las campañas TALUD IV-VII. En total se usaron unos 90 días de navegación de los cuales unos 22 fueron utilizados para llegar a las áreas de trabajo. O peraciones oceanográficas en aguas profundas 75 Cuadro 3. Lista del personal académico que participó en las campañas oceanográficas TALUD I-XIII entre 1989 y 2009. Se indican los temas principales de interés y de actividades. NP, no participó en las campañas. Nombre Institución Temas de interés principales Campañas TALUD Michel E. Hendrickx (1) ICML-UNAM I, III y IV-XIII Nuria Méndez Ubach Samuel Goméz Noguera David Serrano ICML-UNAM ICML-UNAM Moluscos-CrustáceosEquinodermos Poliquetos Meiofauna IV-XIII IV, VI-X, XIII Hidrología IX-XIII Peces VIII, X-XIII Peces VIII-X, XII Hugo Aguirre Juan Madrid Vera José Salgado Barragan Marcelo García Guerrero(2) Pablo Zamorano de Haro(3) Jorge Ruelas(5) A. Carolina Ruiz Fernandéz María Ana Tovar Hernández Albert van der Heiden Facultad de Ciencias del mar UAS Instituto Nacional de la Pesca Instituto Nacional de la Pesca ICML-UNAM ICML-UNAM (postdoc) RARE Conservation, BCS Instituto Tecnológico del Mar ICML-UNAM Plancton-Bentos-Winkler IV-XIII Crustáceos VII, VIII Moluscos-Registros X Agua-Sedimentos IV CTD-Winkler; peces VI ICML-UNAM (postdoc) ICML-UNAM Poliquetos XII, XIII Peces I-III CSIC Barcelona CSIC Barcelona CSIC Barcelona CSIC Barcelona CSIC Barcelona Secretaría de Marina ICML-UNAM ICML-UNAM (DF) Peces Peces Hidrología Crustáceos Cefalópodos Hidrología Esponjas Sedimentos II II II II II II IV, V III (4) Pedro Rubies Beatriz Morales Nin Mario Manriquez Francisco Sarda Pilar Sanchez Eladio García Patrón José Luis Carballo Adolfo Molina Cruz 76 Biodiversidad y comunidades del talud continental del Pacífico mexicano Cuadro 3. Continúa. Nombre Institución Temas de interés principales R. Thunell University of South Sedimentos Carolina ICML-UNAM Fitoplancton Roberto Cortés Altamirano(5) Arturo Toledano Granados(6) ICML-UNAM Arturo Nuñez Pasten(6) ICML-UNAM Moluscos-BentosPlancton Plancton-Bentos Sergio Rendón Rodríguez(6) Alfredo Galaviz Solís(6) Alberto Castro del Río(6) Humberto Bojórquez Leyva(6) ICML-UNAM ICML-UNAM ICML-UNAM ICML-UNAM Plancton-Bentos Registros Registros-Sedimentos CTD-Winkler Campañas TALUD III NP IV-VII III-VII y IX-XII XII, XIII IV-IX, XI, XIII II-V, X, XI V Responsable del proyecto y de las campañas Actualmente CIDIR Oaxaca (3) Actualmente INE México D.F. (4) Actualmente CIAD Mazatlán. Responsable del TALUD II. (5) Análisis de muestras de los cruceros (6) Apoyo técnico (1) (2) Cuadro 4. Lista de los miembros de la tripulación del B/O “El Puma” que participaron en las campañas TALUD I-XIII entre 1989 y 2009. Cap. Alt., Capitán de altura; Ing., Ingeniero; Oper. esp., Operador especialista; Ctm., Contramaestre; Tim., Timonel; Coc., Cocinero; A. coc., Ayudante de cocinero, Cam., Camarista. Cap. Alt. Marcelino González Durán (QEPD) Cap. Alt. Pascual Barajas Flores Cap. Alt. Héctor Ulises Gutiérrez Granja Cap. Alt. Ezequiel Benjamín Vázquez Ibarra Cap. Alt. Adrián Cantú Alvarado Cap. Alt. Manuel A. Martínez Díaz Cap. Alt. José Osuna Astorga Ing. Jesús Octavio Chávez Osuna Ing. Julio Alfonso Ruiz Ramírez Oper. esp. Miguel Angel Aguilar Guzmán Oper. esp. Arturo Trujillo Meza Oper. esp. Rodolfo Fernández Rodríguez Ctm. Juan Toto Fiscal Ctm. Federico Zamora Lizárraga Tim. Hernán Tirado Galindo Tim. Abel Francisco Mendia González Tim. Laurencio Triana Valles Tim. Adrián Rodríguez Castillo O peraciones oceanográficas en aguas profundas 77 Cuadro 4. Continúa. Ing. Aurelio Ovalle Martínez Ing. Luís Castañeda Segura Ing. René Abel García Torres Ing. Fernando Lavín Zatarain Ing. Manuel Suárez Sierra Ing. José de Jesús Hernández Flores Coc. Baudelio Muñóz Mota Coc. Ramón Flores Murguía Coc. Ernesto Soriano Padilla A. coc. Mauricio Rodríguez Aragón Cam. Manuel Rodríguez Aragón Cam. José Félix Flores Sandoval Cuadro 5. Lista de estudiantes y ayudantes que participaron en las campañas oceanográficas TALUD I-XIII entre 1989 y 2009. Nombre TALUD Nombre TALUD Luis Del Cerro Héctor Plascencia González Luis Miguel Valadez Manzano Sandra Guido Sánchez Saúl Rogelio Guerrero Galván Jaime Rodríguez García Felipe Silva Martínez Gustavo Colado Uribe Israel Castro Leal Yolanda Ortíz Gaona Claudia M. Agraz Hernández Manuel Alvarez Mendoza Laura Vázquez Cureño II II,III II II II II II II II II II II III VI VI VII VII VII VIII VIII-X VIII VIII VIII, X, XII, XIII VIII VIII VIII, X Dora Patricia Sánchez Vargas A. De M. Mexia Hernández G. Rodríguez Ochoa III III III Flor Delia Estrada Navarrete Sergio Mussot Pérez J.C. Milan A. José Salgado Barragán Jesús Alonso Esparza Haro Efraín Barranco Ramírez III III III III III IV, V Verónica Maldonado Sánchez Manuel Peñuelas Román Ismael Diego Núñez Riboni Pilar Pérez Pérez Enrique Ávila Torres Oscar Ricardo Guzón Zatarain Pablo Zamorano De Haro Julio César Herrera Arriaga Febe Elizabeth Vargas Arriaga Francisco Neptalí Morales Serna Ramón Vázquez Núñez Manuel Ayón Parente Manuel Leonardo Camacho Cruz José Soledad Ibarra Rivera Alondra Martínez Hernández Kissy Fabiola Rodríguez Soberanes Daniel de Jesús Moreno Flores Eva Visauta Girbau Betel Martínez Guerrero Georgina Quevedo Pacheco Juan Luis Sánchez Tellez Alba Lucia Castellanos Cendales 78 Biodiversidad y comunidades del talud continental del Pacífico mexicano IX-XII IX IX IX-XI IX, X X, XI X, XI XI XI Cuadro 5. Continúa. Nombre TALUD Nombre TALUD Alejandro Nava Aybar César P. Sánchez Cañedo Iyari Myotzi Bustos Hernández María del Carmen Espinosa Pérez Cristina Vega Juárez Alfredo Flores Reyes Benjamín Yáñez Chávez Héctor Nava Bravo Miguel Angel Díaz Flores Laura Leonor Navarro Zazueta Ernesto Sánchez Rojas Zaira L. Hernández Inda IV IV IV-VII IV-VI Lilia Catherinne Soler Jiménez Luis Sauma Castillo Dilian N. Anguas Cabrera Carlo Magno Zárate Montes XI XI XI-XIII XII, XIII IV V-VII V-VII V-VII V, VI V, VI V VI, VII XII, XIII XII XII, XIII XIII XIII XIII XIII XIII José Antonio Cruz Barraza VI Ana Cristina Quankiu Rascón Carolina Salas Singh Agustina Ferrando Ostoni Jesús Ramón Rendón Martínez Osiris Chávez Vargas Francisco Vásquez Melchor Omar Hernández Tovalin María de los Ángeles Barrón García Ricardo Colima Palacios XIII En el periodo correspondiente a 2000-2002 se consiguió el apoyo de Conacyt a través del proyecto 31805-N ($ 525,000.00 MN en tres años). En 2006, se logró conseguir un apoyo de $ 403, 600.00 MN por parte de la UNAM, a través del proyecto PAPIIT IN217306-3 (Dirección General de Apoyo al Personal Académico, UNAM), también por una duración de tres años. De manera conservadora, se estima que la participación presupuestal adicional por parte del personal académico participante (i.e., gastos menores, tanto para actividades de laboratorio como en adquisición de material y de reactivos usados en el buque; mantenimiento de equipos) fue del orden de $ 120,000.00 MN. Resultados La gran cantidad de información obtenida y de material biológico recolectado durante el proyecto TALUD han permitido alcanzar una producción científica destacada que consiste en 21 comunicaciones en reuniones científicas (Cuadro 6) y 46 publicaciones (sin contar los 13 capítulos de este libro) en diversos medios de difusión del conocimiento, tanto a nivel nacional como internacional. Estas publicaciones incluyen 38 basadas integralmente en resultados de las campañas TALUD, así como otras O peraciones oceanográficas en aguas profundas 79 Cuadro 6. Contribuciones presentadas en foros nacionales e internacionales basadas en resultados y avances obtenidos a partir de los datos oceanográficos y biológicos obtenidos durante las campañas TALUD. Lugar y tipo de evento Título de la presentación y formato Première Conférence Européenne sur les Crustacés. Paris, Francia. 31 de agosto al 5 de septiembre de 1992. 2nd European Crustacean Conference. Lieja, Bélgica. 1-6 de septiembre de 1996. Crustacés de profondeur du golfe de Californie, Mexique. M.E. Hendrickx. Oral. Seventh Benelux Congress of Zoology. Bruselas, Bélgica. 24-25 de noviembre de 2000. EDFAM Conference “Life History, Assessment and Management of Crustacean Fisheries”. La Coruña, España. 8-12 de octubre de 2001. Eighth Benelux Congress of Zoology. Nijmegen, Netherlands. 23-24 de noviembre de 2001. Eighth Benelux Congress of Zoology. Nijmegen, Netherlands. 23-24 de noviembre de 2001. The Crustacean Society Meeting. Glasgow, Escocia. 18-23 de julio de 2005. XVIII Congreso Nacional de Zoología. Monterrey, N.L., México. 4-7 de octubre de 2005. X Congreso Asociación de Investigadores del Mar de Cortés, A.C. Mazatlán, Sin., México. 25-28 de octubre de 2005. XIV Congreso Nacional de Oceanografía. Manzanillo, Colima, México. 15-19 de mayo de 2006. 80 Distribution, biology and biochemical composition of Heterocarpus vicarius Faxon (Crustacea: Decapoda: Caridea: Pandalidae) from the SE Gulf of California, Mexico. M.E. Hendrickx, F. Páez-Osuna y H.M. Zazueta-Padilla. Cartel. Exploring the SE Gulf of California continental slope: 100 years after the “Albatross”. M.E. Hendrickx. Oral. Deep water shrimps on the continental slope of the SE Gulf of California, Mexico. M.E. Hendrickx. Cartel. Estimation of body size and weight of four species of deep water shrimps in the SE Gulf of California, Mexico. M.E. Hendrickx. Cartel. Fishery potential of the Pacific lobsterette Nephropsis occidentalis in the SE Gulf of California, Mexico. M.E. Hendrickx. Cartel. Diversity and ecology of deep water decapod crustaceans in the southern Gulf of California, Mexico. M.E. Hendrickx. Cartel. El papel de la profundidad y la concentración de oxígeno sobre la comunidad de moluscos del talud continental del sureste del golfo de California. P. Zamorano, M.E. Hendrickx y A. Toledano Granados. Oral. Análisis latitudinal de la comunidad de moluscos en el mar profundo del Mar de Cortés. P. Zamorano y M.E. Hendrickx. Oral. Análisis de sensibilidad aplicado a los índices de diversidad: un ejemplo de la comunidad de moluscos de aguas profundas en el sur del golfo de California. P. Zamorano y M.E. Hendrickx. Oral. Biodiversidad y comunidades del talud continental del Pacífico mexicano Cuadro 6. Continúa. Lugar y tipo de evento Título de la presentación y formato X Reunión Nacional de Malacología y Conquiliología. Guadalajara, Jal. México. 18-22 de marzo de 2007. The Crustacean Society Meeting. Coquimbo, Chile. 14-17 de octubre de 2007. Biocenosis y distribución de los moluscos de aguas profundas en el Pacífico mexicano: una evaluación de los avances. P. Zamorano y M.E. Hendrickx. Oral. Description of the male genital structures of Hymenopenaeus doris (Faxon. 1893) based on a single specimen captured in the Gulf of California, Mexico. M.E. Hendrickx. Cartel. Efecto de la zona de mínimo de oxígeno sobre los corredores pesqueros a lo largo del Pacífico mexicano. M.E. Hendrickx y D.E. Serrano-Hernández. Oral. Pelagic shrimps collected during the TALUD IIIVII cruises, R/V “El Puma” , SE Gulf of California, Mexico. M.E. Hendrickx. Cartel. Proyecto TALUD: El mar profundo en el Pacífico mexicano. P. Zamorano, M. E. Hendrickx, N. Méndez, S. Gómez, H. Aguirre, J. Madrid y D. Serrano. Oral. Caracterización de las comunidades de anélidos poliquetos del talud continental del sureste del golfo de California. N. Méndez. Cartel. Distribución de Melinnampharete eoa (Polychaeta: Ampharetidae) en el golfo de California, México. N. Méndez. Cartel. Collection and quantification of deep-sea macrobenthos: a case study of the polychaete Melinnampharete gracilis. N. Méndez. Oral. Genetic paternity test of Cephalurus cephalus, lollipop catshark (Scyliorhinidae), by random amplified polymorphic DNA techniques. H. AguirreVillaseñor, S.A. García Gasca, J. Madrid-Vera y C. Salas-Singh. Cartel. New depth record of Coryphaenoides capito (Garman, 1899) bighead grenadier (Gadiformes: Macrouridae) from the Gulf of California, Mexico. H. Aguirre Villaseñor, D.J. Moreno-Flores, J. MadridVera y C. Salas-Singh. Cartel. Dibranchus spinosus (Garman, 1899) distribution in the Mexican central Pacific. C. Salas-Singh y H. Aguirre Villaseñor. Cartel. Congreso Nacional de Ciencia y Tecnología del Mar. Nuevo Vallarta, Nay., México. 29-31 de octubre de 2007. The Crustacean Society Meeting. Galveston, Texas, USA. 9-13 de junio de 2008. Seminario de Divulgación INE-ICML “La Frontera Final: El Océano Profundo”. México, D. F. 1 de diciembre de 2009. XIV Congreso Nacional de Ciencia y Tecnología del Mar, Nuevo Vallarta, Nay., México. 29-31 de octubre de 2007 II Simposio Latinoamericano de Polychaeta. Mar del Plata, Argentina. 9-11 de marzo de 2009. 12th Deep-Sea Biology Symposium. Reykjavík, Islandia. 7-11 de junio de 2010. 12th Deep-Sea Biology Symposium. Reykjavík, Islandia. 7-11 de junio de 2010. 12th Deep-Sea Biology Symposium. Reykjavík, Islandia. 7-11 de junio de 2010. 12th Deep-Sea Biology Symposium. Reykjavík, Islandia. 7-11 de junio de 2010. O peraciones oceanográficas en aguas profundas 81 ocho en las cuales se utilizó parte de estos resultados (Cuadro 7). Además existen, en varios rubros, trabajos concluidos que se encuentran en revisión en diversos medios de comunicación para su posible publicación. Se produjeron también seis tesis de licenciatura y de maestría (Monzalvo Santos 2003, Ibarra Rivera 2006, Zamorano de Haro 2006, Rodríguez Soberanes 2007, Moreno Flores 2009, Zarate Montes 2011) y hay una de doctorado en proceso y prácticamente concluida (Castillo Velázquez, datos no publicados). Los problemas para la clasificación de las especies, muchas de las cuales son mal conocidas y han sido citadas escasamente en la literatura, han retrasado la publicación de algunos resultados en revistas formales. Eso se complica más todavía por el hecho que, hoy en día, es prácticamente imposible conseguir el préstamo de material comparativo depositado en museos en el extranjero. Las trabas existentes a nivel de las aduanas locales y las restricciones internacionales para el manejo y el envío de muestras conservadas en líquido son obstáculos que imposibilitan, muy a menudo, completar los estudios de tipo taxonómico. Un rápido análisis de los resultados alcanzados durante el proyecto TALUD permite concluir que nunca se había conseguido tal cantidad de información acerca de la fauna de aguas profundas y de su hábitat en el Pacífico de México. De hecho, desde el punto de vista faunístico, la información obtenida por los académicos que participaron en las campañas TALUD es la mayor obtenida desde que se publicaron los resultados de las exploraciones realizadas por el buque “Albatross”. A partir de los resultados obtenidos durante las campañas TALUD y basándose en datos comparativos disponibles en la literatura, se puede resumir la situación de la siguiente manera. El número de especies en profundidades mayores a los 200 m respecto al número total de especies conocidas en el golfo de California es muy variable según el grupo faunístico: 245 de 680 para los anélidos Polychaeta, 33 de 1446 para los moluscos Gastropoda, 51 de 560 para los moluscos Bivalvia, 23 de 286 para los cangrejos Brachyura, 42 de 165 para el conjunto de los camarones y 20 de 144 para el grupo de langostas (y afines) (Hendrickx 1992a, 1996a, Hendrickx et al. 2005). En el caso de los poliquetos, tres familias contienen 44 especies casi exclusivas de fondos profundos (Ampharetidae 99 %; Maldanidae, 100 %; Sternaspidae, 66 %) (Méndez 2006, 2007). En el caso de los camarones, salvo contadas excepciones, solamente los Caridea (e.g., Pandalidae, Glyphocrangonidae, Crangonidae) tienen representantes en aguas profundas del golfo de California (Hendrickx 2003a). Los moluscos de aguas profundas alrededor de la península de Baja California y en el golfo de California ofrecen también un patrón particular de distribución (Zamorano y Hendrickx 2009, 2011). En el 82 Biodiversidad y comunidades del talud continental del Pacífico mexicano Cuadro 7. Contribuciones publicadas, aceptadas, en prensa o remitidas basadas en su totalidad o en parte en datos obtenidos durante las campañas TALUD Citas (año de publicación) Temática Información completa del proyecto TALUD (publicados) Hendrickx, M.E. (1996) Decápodos; distribución Hendrickx, M.E., F. Osuna-Páez, y H.M. Morfología; composición química Zazueta-Padilla (1998) Hendrickx, M.E. (2001) Comunidades de decápodos Hendrickx, M.E. (2002a) Camarones; nueva especie Hendrickx, M.E. (2002b) Camarones; distribución Hendrickx, M.E. (2003a) Camarones; pesquerías; abundancia Hendrickx, M.E. (2003b) Langostinos; distribución, y abundancia Hendrickx, M.E. (2003c) Langostas; distribución, y abundancia Hendrickx, M.E. (2004) Camarones; pesquerías; abundancia Hendrickx, M.E. y J. López (2006) Caracoles; distribución; abundancia Zamorano, P., M.E. Hendrickx y A. Toledano Moluscos; distribución Granados (2006) Méndez, N. (2006) Poliquetos; distribución; abundancia Méndez, N. (2007) Poliquetos; ecología Zamorano, P., M.E. Hendrickx y A. Toledano Moluscos; distribución Granados (2007) Hendrickx, M.E. y D. Serrano (2007) Hidrología; oxígeno mínimo Zamorano, P. y M.E. Hendrickx (2007) Moluscos; ecología Hendrickx, M.E. y M. García-Guerrero (2007) Camarones; larva Hendrickx, M.E. (2008b) Decápodos; distribución Ibarra Rivera, J.S. y M.E. Hendrickx (2008) Lofogastridos; taxonomía; claves; distribución Hendrickx, M.E. (2008c) Isópodos; distribución Méndez, N. (2009) Poliquetos; distribución; abundancia Zamorano, P. y M.E. Hendrickx (2009) Moluscos; distribución; zoogeografía Hendrickx, M.E. (2010) Camarones; nueva especie Hendrickx, M.E. y D. Serrano (2010) Hidrología; oxígeno mínimo; pesquerías Massin, C. y M.E. Hendrickx (2010) Holoturias; nueva especie Gómez, S., G.B. Deets, J.E. Kalman y F.N. Copépodos; parásitos; nueva especie Morales-Serna (2010) Hendrickx, M.E. y M. Ayón-Parente (2011) Langostinos; taxonomía O peraciones oceanográficas en aguas profundas 83 Cuadro 7. Continúa. Citas (año de publicación) Temática Hendrickx, M.E. y M. Ayón-Parente (2011) Langostinos; taxonomía Aguirre-Villaseñor, H. y R. Castillo-Velázquez Peces; distribución (2011) Zamorano, P. y M.E. Hendrickx (2010) Moluscos; comunidades; zoogeografía Hendrickx, M.E., C. Mah y C.M. Zárate-Montes Estrellas de mar; taxonomía; distribución (2010) Massin, C. y M.E. Hendrickx (2011) Holoturias; taxonomía; nuevas especies Serrano, D. y M.E. Hendrickx (2011) Hidrología; oxígeno mínimo; pesquerías Hendrickx, M.E., M. Ayón-Parente y D. Serrano Langostinos; distribución; zoogeografía (2011) Trabajos aceptados (A), en prensa (P) o remitidos (R) Zamorano, P., M.E. Hendrickx, N. Méndez, S. Aguas profundas de México Goméz, D. Serrano, H. Aguirre, J. Madrid y N. Morales-Serna 2012 (A) Zamorano, P. y M.E. Hendrickx (A) Moluscos; distribución; ecología Winfield, I., M. Ortiz y M.E. Hendrickx (R) Amphipoda; nueva especie Aguirre-Villaseñor, H., C. Salas-Singh, J. Martínez Peces; distribución y J. Madrid-Vera (R) Zamorano, P. y M.E. Moluscos; distribución Hendrickx (P) Información parcial del proyecto TALUD (publicados) Hendrickx, M.E. (1996b) Camarones; taxonomía; claves; distribución Hendrickx, M.E. y F.D. Estrada-Navarrete (1996) Camarones; taxonomía; claves; distribución Schiff, H. y M.E.Hendrickx (1997) Crustáceos; visión Hendrickx, M.E. (2003) Malacostraca; colección Ayón-Parente, M. y M.E. Hendrickx (2007) Isópodos, y decápodos; distribución Hendrickx, M.E. ( 2008a) Decápodos; distribución Hendrickx, M.E. y M.K. Wicksten (2011) Caridea; distribución Zamorano, P. y M.E. Hendrickx. (Aceptado) Lucinoma caso de los equinodermos, un fenómeno similar se presenta y solamente se conoce un número reducido de especies en grandes profundidades, aunque los estudios derivados de los cruceros TALUD han permitido describir ya tres especies nuevas (Massin y Hendrickx 2010, 2011). Desafortunadamente, no se cuenta con fuentes de información tan amplias para la zona SO del Pacífico mexicano y, en consecuencia, sería prematuro efectuar alguna comparación. En el caso de los peces, se 84 Biodiversidad y comunidades del talud continental del Pacífico mexicano pudo revisar el estatus taxonómico y la distribución de los Macrouridae y de algunas otras especies (Moreno Flores 2009, Aguirre-Villaseñor y Castillo-Velázquez datos no publicados, H. Aguirre-Villaseñor y J. Madrid-Vera, com. pers.). A partir de los 100-150 m, junto con una notable disminución de la temperatura del agua y de la concentración de oxígeno disuelto, se observa una franca disminución de la biodiversidad. En condiciones de oxigenación deficiente (< 1.0 ml l-1 O2), el número de especies de macro-crustáceos encontradas varía entre dos y seis. Ciertas especies (e.g., Heterocarpus vicarius, Pleuroncodes planipes Stimpson, 1860, Cancer johngarthi Carvacho, 1989, Solenocera mutator Burkenroad, 1938, Squilla biformis Bigelow, 1891) adaptadas a estas condiciones deficientes se vuelven dominantes o incluso exclusivas (Hendrickx 1985 1992b, 1995a, 1995b, 1995c, 1996a, 1996b, Hendrickx y Wicksten 1989, Hendrickx y Salgado Barragán 1991). Conforme aumenta la profundidad, las condiciones a nivel del fondo (valores epibentónicos) se mantienen muy adversas, casi anóxicas (i.e., ca 0.0 ml l-1 O2), y la macrofauna desaparece en su totalidad. En la columna de agua un fenómeno similar puede ser detectado a partir de los 100 m de profundidad (Parker 1963, Mathews et al. 1974, Alvarez-Borrego y Lara-Lara 1991, Hendrickx 1995a, 1996a, Hendrickx y Serrano 2007, 2010, Serrano y Hendrickx, 2011). Las condiciones favorables a la presencia de especies con metabolismo aeróbico reaparecen a partir de los 500-750 m (según la latitud y las condiciones oceánicas) y una fauna totalmente distinta aparece (Hendrickx 1992b, 1996a). Estas condiciones fueron comprobadas durante los cruceros TALUD (Hendrickx 2001, Zamorano et al. 2007, Ibarra-Rivera y Hendrickx 2008, Massin y Hendrickx 2011, Hendrickx et al. 2011). Los estudios realizados indican que esta fauna presenta características particulares en cuanto a su abundancia, su morfología y su fisiología (Hendrickx 1996a, 2001, 2003b, Schiff y Hendrickx 1997). Dada su gran abundancia, los poliquetos encontrados (e.g., la especie tubícola Amage scutata Moore, 1923) constituyen un componente importante de la infauna (Méndez 2006). Su importancia radica en el hecho que, en este hábitat con diversidad moderada, constituyen una parte significativa dentro de las cadenas tróficas, modifican la textura del sustrato y podrían servir de indicadores de “salud” (por su carácter sedentario) del medio ambiente profundo (Méndez 2007). Además, las campañas TALUD permitieron detectar la presencia de especies potencialmente importante para la pesca, tales como Heterocarpus affinis y Nephropsis occidentalis (Hendrickx 2003a, 2003c, 2004) y de taxones nuevos dentro del grupo de los crustáceos (Hendrickx 2002a, 2010, Roman-Contreras y Boyko 2007). El ámbito pelágico sigue un patrón semejante. En la franja de la plataforma exterO peraciones oceanográficas en aguas profundas 85 na o talud superior son pocas las especies epipelágicas (e.g., Lucifer typus H. Milne Edwards, 1837) (Hendrickx y Estrada-Navarrete 1994) y raras las especies mesopelágicas que toleran la disminución de la concentración de oxígeno disuelto (e.g., Gennadas sordidus Kemp, 1910, con una superficie branquial mayor que le permite tolerar ambientes hipóxicos) (Hendrickx y Estrada Navarrete 1989, 1996). En cambio, la fauna de Lophogastrida (géneros Gnathophausia y Neognathophausia) es abundante y se detectó la presencia de cinco especies en los muestreos realizados durante las campañas TALUD; este material, en particular, es el más abundante jamás registrado en aguas del golfo de California y del SO de México para este grupo de crustáceos (Ibarra-Rivera y Hendrickx 2008). En el caso específico de la meiofauna, se puede afirmar que las investigaciones previas en estas aguas son inexistentes; de hecho, el único grupo de especies de la meiofauna estudiado de manera sistemática en el Pacífico mexicano es aquel de los copépodos harpacticoideos (Gómez-Noguera y Hendrickx 1997). Aún en este caso, toda la información disponible se refiere a especies de aguas someras o costeras y existe un desconocimiento total de la biodiversidad, de la abundancia y de la importancia trófica de estas comunidades en fondos oceánicos del Pacífico este tropical (Gómez-Noguera y Morales-Serna 2012). El estudio paralelo de los copépodos parásitos de peces recolectados durante las campañas TALUD ha conducido a la descripción de una especie nueva (Gómez et al. 2010). En cuanto a los peces, se hicieron algunos descubrimientos importantes relacionados con la distribución de las especies y de su biología. Al igual que en el caso de los invertebrados, la fauna encontrada es totalmente distinta a la fauna de la plataforma continental y bien adaptada a los ambientes profundos (H. AguirreVillaseñor y J. Madrid-Vera, com. pers., Aguirre-Villaseñor y Moreno-Flores 2012, Aguirre-Villaseñor et al. 2012). Sobre la base del material recolectado durante los cruceros TALUD, se pudo encontrar y describir en total siete especies nuevas: una de copépodos, tres de crustáceos decápodos y tres de holoturias (Cuadro 7). Se estima, además, que quedan por describirse por lo menos otra especie de crustáceos decápodos, una estrella de mar, dos moluscos y un número indefinido (pero seguramente superior a 30) de copépodos harpacticoideos. Conclusiones El año 2010 fue considerado como el año internacional de la biodiversidad. Muchos 86 Biodiversidad y comunidades del talud continental del Pacífico mexicano países, instituciones e individuos celebraron este evento, incluyendo la UNAM, pero el dramático rezago a nivel mundial para conocer la flora y la fauna que nos rodea no ha sido entendido por las autoridades. Tal como lo señalan Feldmann y Manning (1992) y Salazar-Vallejo et al. (2007), seguimos padeciendo de una extraordinaria y muy preocupante falta de recursos en infraestructura humana, en equipos y en materiales para lograr alcanzar un ritmo adecuado en el estudio de las especies que viven en los ambientes naturales. Como lo subrayaron algunos especialistas, las especies desaparecen a un ritmo mucho mas rápido que el ritmo que hemos decidido adoptar para estudiarlas. La fauna que vive en los ambientes profundos del planeta es privilegiada, pues los efectos más peligrosos de las actividades humanas no han impactado de manera decisiva en su hábitat (Groombridge y Jenkins 2000). Pero las cosas están cambiando. Son cada vez mayores las cantidades de productos tóxicos y de desperdicios que la “civilización” está arrojando mar adentro; son cada vez más frecuentes los accidentes en las plataformas de perforaciones petroleras y la profundidad de operación de estas es cada vez mayor; aún si no llegan directamente a los grandes fondos marinos, los desechos que se dispersan en los mares y en las zonas costeras van llegando cada vez con mayor frecuencia a las grandes extensiones oceánicas, donde se degradan poco a poco, afectando los procesos biológicos y ecológicos de la zona eufótica (donde la luz sirve de motor a la vida), perturbando así las cadenas tróficas y modificando la dinámica en la transferencia de “energía” (vía las partículas que se hunden) hacia las aguas profundas. Los estudios de la biodiversidad están esencialmente basados en los estudios taxonómicos; a su vez, la taxonomía requiere de la exploración sostenida y prudente de los ambientes naturales, con el fin de poder completar la recolección o la observación de las plantas y de los animales que allí viven (Feldmann y Manning 1992). Las colecciones biológicas que resultaron de las grandes expediciones realizadas desde el siglo XIX todavía están disponibles para estudios adicionales y para propósitos comparativos. En el caso de los mares de México, la mayoría del material recolectado durante esta época se encuentra depositado en la Smithsonian Institution en Washington, en el Harvard Museum de la Universidad de Harvard, en el Museum of Natural History del condado de Los Angeles, California y en la colección de invertebrados marinos de la Scripps Institution of Oceanography, en La Jolla, California. Es a final de los años 30’s que se inició en México la formación de colecciones oficiales, acorde con el decreto presidencial que otorgó al Instituto de Biología de la UNAM la responsabilidad de organizar y cuidar grandes colecciones nacionales de la flora y la fauna O peraciones oceanográficas en aguas profundas 87 del País. Otras colecciones, hoy en día de gran importancia para el conocimiento biológico de México, fueron establecidas posteriormente (Llorente-Bousquets et al. 1999). En lo que se refiere a las especies marinas, las más importantes son probablemente aquellas resguardadas en la UNAM, tanto en su sede principal como en las sedes foráneas, en la Universidad de Nuevo León, en Monterrey y en el CIQRO, hoy Ecosur, en Chetumal. Otras colecciones interesantes están surgiendo en otros estados, y eso a pesar de la escasez de apoyos para este tipo de actividades. Las muestras recolectadas durante las campañas TALUD representaron, en muchos casos, un incremento significativo del número de especímenes conocidos para varias especies de aguas profundas del Pacifico este. El material recolectado y consignado en colecciones reconocidas a nivel nacional e internacional representa, sin lugar a dudas, el mayor conjunto de especímenes y de especies de estos ambientes disponibles en México. Considerando la extensión de las zonas oceánicas en la ZEE de México, donde la profundidad excede los 500 m, resulta apabullante el constatar que las campañas TALUD recorrieron menos del 10 % de esta superficie y que la red de estaciones fue muy poco densa. Por ejemplo, durante el proyecto TALUD se realizó en promedio un arrastre bentónico por aproximadamente 12000 km2 de extensión oceánica. Queda por explorarse la totalidad de la zona bajo la influencia de la corriente de California, todo el área del golfo de Tehuantepec, y toda la franja oceánica con profundidades superiores a 2000-2300 m en de la ZEE. El reto es enorme y seguramente rebasa la capacidad actual del País en materia de infraestructura y de apoyos financieros para la operación de embarcaciones en alta mar. Basándose en la experiencia adquirida durante el proyecto TALUD y considerando que la parte inexplorada más amplia tiene profundidades más allá de los 3000 m, un programa de exploración muy superficial de estas áreas requeriría de, por lo menos, cuatro años de muestreo continuo (unos 1200 días de actividades en alta mar) y 12 años de trabajo en los laboratorios para clasificar, estudiar y analizar las muestras y los datos obtenidos. El reto que representa el estudio de una de las “Últimas Fronteras” de México en materia de conocimiento faunístico básico está a la altura del carácter misterioso y atractivo que ofrecen las comunidades naturales que hicieron de las aguas profundas su dominio. Pero los retos pertenecen a unos de los aspectos más atractivos de la investigación científica. Sin ellos, no tendríamos tanta motivación ni tantos deseos de superarnos. El solo hecho que esta fauna está allí, intacta, esperándonos, es suficiente para convencernos que hay que salir a buscarla. 88 Biodiversidad y comunidades del talud continental del Pacífico mexicano Agradecimientos Se agradece al personal científico que participó en el proyecto TALUD y cuyo apoyo y dedicación permitieron llevar a cabo las actividades de muestreo durante las campañas. Se reconoce aquí la labor del personal técnico que participó de manera ocasional o regular en estas campañas: José Salgado Barragán, Arturo Núñez Pasten, Arturo Toledano Granados, Alfredo Galaviz Solís, Alberto Castro del Río, Sergio Rendón Rodríguez, Humberto Bojórquez. De igual manera, se agradece la participación de estudiantes y de ayudantes voluntarios de diversas instituciones durante las campañas. Se reconoce el apoyo recibido por parte de la Universidad Nacional Autónoma de México para la realización de los cruceros TALUD a bordo del B/O “El Puma”, ya sea vía el Instituto de Ciencias del Mar y Limnología (ICMyL), vía la Coordinación Técnica de la Investigación Científica (CTIC) o vía la Dirección General de Apoyo al Personal Académico (DGAPA; proyecto PAPIIT IN 217306-3). Asimismo, se agradece el apoyo recibido por parte del Conacyt, México (proyecto 31805-N). Agradecemos al Ifremer y a Danièle Lemercier por la autorización de reproducir la fotografía de la lámina 3, A. Se agradece a Mercedes Cordero Ruiz por la edición final de este manuscrito así como la preparación de las figuras y láminas. Finalmente, se agradece al Instituto Nacional de Ecología (INE), México, por invitar a los miembros del proyecto TALUD a elaborar esta obra, en particular a los editores Pablo Zamorano y Margarita Caso Chávez. Referencias Agassiz, A. 1898. Reports on the dredging operations off the west coast of Central America, Mexico and the Gulf of California by the U.S.S. “Albatross” during 1891. Preliminary report on the Echini. Bulletin of the Museum of Comparative Zoology at Harvard University 32(5): 71-86. Aguirre-Villaseñor, H. y R. Castillo-Velázquez. 2011. New depth record of Cherublemma emmelas, black brotula (Ophidiiformes: Ophidiidae) from the Gulf of California, Mexico. Revista Mexicana de Biodiversidad 82: 713-715. Aguirre-Villaseñor, H. y C. Salas-Singh. 2012. New records of the lollipop catshark Cephalurus cephalus (Scyliorhinidae) from the Gulf of California, Mexico. Revista Mexicana de Biodiversidad 83. Aguirre-Villaseñor, H., C. Salas-Singh y J. Madrid-Vera. 2012. Nuevo registro de la quimera prieta del Pacífico este, Hydrolagus melanophasma, James, Ebert, Long y Didier, O peraciones oceanográficas en aguas profundas 89 2009, en el Pacífico central mexicano. Pp. 395-404. En: P. Zamorano, M.E. Hendrickx y M. Caso (eds.). Biodiversidad y comunidades del talud continental del Pacífico mexicano. Instituto Nacional de Ecología, Secretaría del Medio Ambiente y Recursos Naturales (Semarnat). Aguirre-Villaseñor, H., C. Salas-Singh, J. Martínez y J. Madrid-Vera. New Eastern Pacific records of Hydrolagus melanophasma James, Ebert, Long and Didier with annotations of a juvenile female. Journal of Fish Biology (Aceptado). Alden, A. 2010. http://geology.about.com/od/regional_geology/a/deepseaobservs_3.htm. Alvarez-Borrego, S., y J.R. Lara-Lara. 1991. The physical environment and primary productivity of the Gulf of California. Pp. 555-567. En: J.P. Dauphin y B. Simoneit (eds.). The Gulf and Peninsular province of the Californias. American Association of Petroleum Geologist Memoir 47: 555-567. Anónimo, 2010. http://world-ocean.ru/en/history/vitiaz/past.php. Arana E.P. 2003. Experiencia chilena en faenas de pesca en aguas profundas y distantes: Evolución y Perspectivas. Pp. 57-79. En: R.E. Yánez (ed.). Actividad Pesquera y de acuicultura en Chile. 1. Aspectos globales. Ediciones Universitarias de Valparaíso. Chile. Arana, P.M. y R. Vega. 2000. Pesca exploratoria con espineles en aguas profundas en torno a la isla Robinson Crusoe (Archipiélago de Juan Fernández), Chile. Investigaciones Marinas 28: 219-230. Arciniega-Flores, J., V. Landa-Jaime y G. González-Sanson. 1998. Distribution and abundance of soft-bottom stomatopod crustaceans off the coast of Jalisco and Colima, Mexico. Ciencias Marinas 24: 169-181. Arciniega-Flores, J., J.E. Michel-Morfín y V. Landa-Jaime. 2008. Estructura poblacional de Portunus xantusii affinis (Brachyura: Portunidae) en fondos blandos de las costas de Jalisco y Colima, México. Pp. 1-16. En: M.E. Hendrickx (ed.) Contributions to the Study of East Pacific Crustaceans 5 (1). [Contribuciones al Estudio de los Crustáceos del Pacífico Este 5 (1)]. Instituto de Ciencias del Mar y Limnología, UNAM. México, D.F. Ayón-Parente, M. y M.E. Hendrickx. 2007. New records of crustaceans (Isopoda and Decapoda) along the Pacific coast of Mexico. Pp. 59-61 En: M.E. Hendrickx (ed.) Contributions to the Study of East Pacific Crustaceans 4(2) [Contribuciones al Estudio de los Crustáceos del Pacífico Este 4(2). Instituto de Ciencias del Mar y Limnología, UNAM. México, D.F. Benson, K.R. y P.F. Rehbock. 2002. Oceanographic History. The Pacific and Beyond. University of Washington Press, Seattle and London. 556 pp. Blake, J.A. 1985. Polychaeta from the vicinity of deep-sea geothermal vents in the eastern Pacific I: Euphrosinidae, Phyllodocidae, Hesionidae, Nereididae, Glyceridae, Dorvilleidae, 90 Biodiversidad y comunidades del talud continental del Pacífico mexicano Orbiniidae, and Maldanidae. Bulletin of the Biological Society of Washington 6: 67-101. Britannica. 2010. http://www.britannica.com/facts/5/925385/International-IndianOcean-Expedition-as-discussed-in-Indian-Ocean. Brusca, R.C., L.T. Findley, P.A. Hastings, M.E. Hendrickx, J. Torre Cosio y A.M. van der Heiden. 2005. Macrofaunal diversity in the Gulf of California. Pp. 179-203. En: Cartron, J.-L. E., G. Caballos y R.S. Felger (eds.). Biodiversity, Ecosystems and Conservation in Northern Mexico. Oxford University Press. Cartes, J.E. y F. Sardà. 1989. Feeding ecology of the deep-water aristeid crustacean Aristeus antennatus. Marine Ecology Progress Series 54: 229-238. Cartes, J.E., J.C. Sorbe y F. Sardà. 1994. Spatial distribution of deep-sea decapods and euphausiids near the bottom in the northwestern Mediterranean. Journal of Experimental Marine Biology and Ecology 179: 131-144. Caso, M.E. 1986. Los equinodermos del golfo de California colectados en las campañas SIPCO I-II-III a bordo del B/O “El Puma”. Anales del Instituto de Ciencias del Mar y Limnología, Universidad Nacional Autónoma de México 13 (1): 91-184. Castillo Velázquez, R. 2012. Alimentación, reproducción y edad y crecimiento de Cherublemma emmelas en el Golfo de California. Tesis de Doctorado. Universidad Nacional Autónoma de México, Posgrado en Ciencias del Mar y Limnología. Chan, T.-Y. y A. Crosnier. 1997. Crustacea Decapoda: Deep-sea shrimps of the genus Plesionika Bate, 1888 (Pandalidae) from French Polynesia, with descriptions of five new species. Pp. 187-234. En: A. Crosnier (ed.), Résultats des Campagnes Musorstom. Vol. 18. Mémoires du Museum National d’Histoire Naturelle, Paris 176. Childress J.J. y B.A. Seibel. 1998. Life at stable low oxygen levels: adaptations of animals to oceanic oxygen minimum layers. Journal of Experimental Biology 201: 1223-1232. CIAT. 2010. Comisión Interamericana del Atún Tropical. http://www.iattc.org/VesselListsSPN.htm. Clark, H.L. 1948. A report on the Echini of the warmer Eastern Pacific, based on the collections of the “Velero” III. Allan Hancock Pacific Expedition 8 (5): 225-351. Dall, W.H. 1908. Reports on the dredging operations off the west coast of Central America to the Galapagos, to the west coast of Mexico, and in the Gulf of California, in charge of Alexander Agassiz, carried on by the U.S. Fish Commission steamer “Albatross”, during 1891, Lieut. Commander Z.L. Tanner, U.S.N., commanding. XXXVII. Reports on the scientific results of the expedition to the eastern tropical Pacific, in charge of Alexander Agassiz, by the U.S. Fish Commission steamer “Albatross”, from October, 1904, to March, 1905, Lieut. Commander L.M. Garret, U.S.N., commanding. XIV. The Mollusca and Brachiopoda. Bulletin of the Museum of Comparative Zoology at O peraciones oceanográficas en aguas profundas 91 Harvard University 43 (6): 205-487. Dawson, E.Y. 1944. The marine algae of the Gulf of California. Allan Hancock Pacific Expeditions 3 (10): 189-454. Diaz, R.J. y R. Rosenberg. 1995. Marine benthic hypoxia: A review of its ecological effects and the behavioural responses of benthic macrofauna. Oceanography and Marine Biology Annual Review 33: 245-303. Escobar Briones, E. y L. A. Soto. 1993. Bentos del mar profundo en México. Pp. 106116. En: S.I. Salazar-Vallejo y N.E. González (eds.). Biodiversidad Marina y Costera de México. Comisión Nacional de Biodiversidad y CIQRO, México. Facebook. 2011. http://www.facebook.com/pages/Oceans/112038895488787. Farlex 2010. http://encyclopedia.farlex.com/Deep-sea+exploration. Faxon, W. 1893. Reports on the dredgings operations off the west coast of Central America to the Galapagos, to the west coast of Mexico, and in the Gulf of California, in charge of Alexander Agassiz, carried on by the U.S. Fish Commision Steamer “Albatross”, during 1891, Lieut. Commander Z.L. Tanner, U.S.N., commanding. VI. Preliminary descriptions of new species of Crustacea. Bulletin of the Museum of Comparative Zoology at Harvard University 24 (7): 149-220. Faxon, W. 1895. Reports on an exploration off the west coast of Mexico, Central and South America, and off the Galapagos Islands, in charge of Alexander Agassiz, carried on by the U.S. Fish Commission steamer “Albatross”, during 1891, Lieut. Commander Z.L. Tanner, U.S.N., commanding. XV. The stalk-eyed Crustacea. Memoirs of the Museum of Comparative Zoology at Harvard College, 18: 1-292. Feldmann, R.M. y R.B. Manning. 1992. Crisis in systematic biology in the “Age of Biodiversity”. Journal of Paleontology 66 (1): 157-158. Forest, J. 1985. La campagne MUSORSTOM II (1980). Compte rendu et liste des stations / The MUSORSTOM II Expedition (1980). Report and list of stations. Pp. 7-30. En: Résultats des campagnes MUSORSTOM Vol 2. Mémoires du Muséum national d’Histoire naturelle, Paris. Zoologie 133. Gage, J.D. y P.A. Tyler. 1992. Deep-sea biology: a natural history of organisms at the deep-sea floor. Cambridge University Press. Gran Bretaña. 504 pp. Galil, B. 1997. Crustacea Decapoda: A revision of the Indo-Pacific species of the genus Calappa Weber, 1795 (Calappidae). Pp. 271-335. En: A. Crosnier (ed.). Résultats des Campagnes MUSORSTOM, Vol. 18. Mémoires du Muséum national d’Histoire Naturelle, Paris. Sér. A, Zoologie 176. Garman, S. 1899. Reports on an exploration off the west coasts of Mexico, Central and South America, and off the Galapagos Islands, in charge of Alexander Agassiz, by the 92 Biodiversidad y comunidades del talud continental del Pacífico mexicano U.S. Fish Commission Steamer “Albatross,” during 1891, Lieut. Commander Z.L. Tanner, U.S.N., Commanding. XXVI. The Fishes. Memoirs of the Museum of Comparative Zoology at Harvard College 24: 1-431. Garth, J.S. 1958. Brachyura of the Pacific coast of America; Oxyrhyncha. Allan Hancock Pacific Expeditions 21 (1): 1-459. Gaxiola-Castro G., S. Álvarez-Borrego, S. Nájera-Martínez, A.R. Zirino. 2002. Efecto de las ondas internas en el fitoplancton del Golfo de California. Ciencias Marinas 28: 297-309. Godinez-Domínguez, E. y G. González-Sanson. 1998. Variation of the bathymetric distribution patterns of the macrobenthic fauna on the continental shelf off Jalisco and Colima, Mexico. Ciencias Marinas 24: 337-351. Godinez-Domínguez, E. y G. González-Sanson. 1999. Diversity of soft-bottom macroinvertebrates from the continental shelf off Jalisco and Colima, Mexico. Ciencias Marinas 25: 609-627. Gómez-Noguera, S. E. y M.E. Hendrickx. 1997. Distribution and abundance of meiofauna in a subtropical coastal lagoon in the southeastern Gulf of California Mexico. Marine Pollution Bulletin 34 (7): 582-587. Gómez, S. y F.N. Morales-Serna. 2012. Meiofauna de mar profundo del golfo de California: algunos aspectos acerca de la distribución y abundancia de Copepoda. Pp. 123-144. En: P. Zamorano, M.E. Hendrickx y M. Caso (eds.). Biodiversidad y comunidades del talud continental del Pacífico mexicano. Instituto Nacional de Ecología, Secretaría del Medio Ambiente y Recursos Naturales (Semarnat). Gómez, S., G.B. Deets, J.E. Kalman y F.N. Morales-Serna. 2010. Lophoura brevicollum n. sp. (Copepoda: Siphonostomatoida: Sphyriidae), a parasite of the smooth grenadier Nezumia liolepis (Gilbert, 1890) (Pisces: Macrouridae) from the Eastern Pacific, and a new record and new host of Lophoura unilobulata Castro R. and Gonzalez. Journal of Crustacean Biology 30 (1): 129-140. Grassle, J.F. 1989. Species diversity in deep-sea communities. Trends in Ecology and Evolution 4 (1): 12-15. Groombridge, B. y M.D. Jenkins. 2000. Global biodiversity. Earth’s living resources in the 21st century. UNEP – World Conservation Monitoring Centre. 352 pp. Groueff, S. 1973. L’homme et la mer. Larousse. Paris, Francia. 395 pp. Guennegan, Y. y V. Martin. 1985. Annexe 3. Techniques de prélevement. Pp. 571-602. En: L. Laubier y Cl. Monniot (eds.). Benthos. Peuplements profonds du golfe de Gascogne. IFREMER, Francia. . Hanley, J.R. y M. Burke. 1991. Polychaeta Polynoidae: Scaleworms of the Chesterfield Islands and Fairway Reefs, Coral Sea. Pp. 9-82. En: A. Crosnier (ed.). Résultats des O peraciones oceanográficas en aguas profundas 93 Campagnes MUSORSTOM, Vol. 8. Mémoires du Muséum national d’Histoire Naturelle Paris. Sér. A, Zoologie 151. Helly, J.J. y L.A. Levin. 2004. Global distribution of naturally occurring marine hypoxia on continental margins. Deep-Sea Research I 51: 1159-1168. Hendrickx, M.E. 1985. Diversidad de los macroinvertebrados bentónicos acompañantes del camarón en el área del Golfo de California y su importancia como recurso potencial. Cap. 3. Pp. 95-148. En: A. Yañez-Arancibia (ed.). Recursos potenciales pesqueros de México: La pesca del camarón. Programa Universitario de Alimentos, Instituto de Ciencias del Mar y Limnología, Instituto Nacional de la Pesca, Universidad Nacional Autónoma de México. México, D.F. Hendrickx, M.E. 1990. The stomatopod and decapod crustaceans collected during the GUAYTEC II Cruise in the Central Gulf of California, Mexico, with the description of a new species of Plesionika Bate (Caridea: Pandalidae). Revista de Biología Tropical 38 (1): 35-53. Hendrickx, M.E. 1992a. Crustacés de profondeur du golfe de Californie, Mexique. P. 64. En: Proceedings of the First European Crustacean Conference. Aug. 31-Sept. 5, 1992. Paris, Francia. Hendrickx, M.E. 1992b. Distribution and zoogeographic affinities of decapod crustaceans of the Gulf of California, Mexico. Proceedings of the San Diego Society of Natural History 20: 1-11. Hendrickx, M.E. 1993. Crustáceos decápodos del Pacífico Mexicano. Pp. 271-318. En: S.I. Salazar-Vallejo y N.E. González (eds.). Biodiversidad Marina y Costera de México. Comisión Nacional de Biodiversidad y CIQRO, México. Hendrickx, M.E. 1995a. CAMARONES. Pp. 417-537 En: W. Fischer, F. Krupp, W. Schneider, C. Sommer, K.E. Carpenter y V.H. Niem (eds.). Guía FAO para la identificación de especies para los fines de la pesca. Pacífico centro-oriental. Vol. I. Plantas e Invertebrados. FAO, Roma, Italia. . Hendrickx, M.E. 1995b. INTRODUCCIÓN. Pp. 1-7. En: W. Fischer, F. Krupp, W. Schneider, C. Sommer, K.E. Carpenter y V.H. Niem (eds.). Guía FAO para la identificación de especies para los fines de la pesca. Pacífico centro-oriental. Vol. I. Plantas e Invertebrados. FAO, Roma, Italia. Hendrickx, M.E. 1995c. CANGREJOS. Pp. 565-636. En: W. Fischer, F. Krupp, W. Schneider, C. Sommer, K.E. Carpenter y V.H. Niem (eds.). Guía FAO para la identificación de especies para los fines de la pesca. Pacífico centro-oriental. Vol. I. Plantas e Invertebrados. FAO, Roma, Italia. Hendrickx, M.E. 1996a. Habitats and biodiversity of decapod crustaceans in the SE Gulf of California, Mexico. Revista de Biología Tropical 44 (2A): 603-617. 94 Biodiversidad y comunidades del talud continental del Pacífico mexicano Hendrickx, M.E. 1996b. Los camarones Penaeoidea bentónicos (Crustacea: Decapoda: Dendrobranchiata) del Pacífico mexicano. Comisión Nacional para el Conocimiento y Uso de la Biodiversidad e Instituto de Ciencias del Mar y Limnolología, Universidad Nacional Autónoma de México. México, D.F. 148 pp. Hendrickx, M.E. 1996c. New records of deep-water decapod crustaceans in the southeastern Gulf of California, Mexico. Revista de Biología Tropical 44 (2B): 945-947. Hendrickx, M.E. 2001. Occurrence of a continental slope decapod crustacean community along the edge of the minimum oxygen zone in the southeastern Gulf of California, Mexico. Belgian Journal of Zoology 131 (Suppl. 2): 95-109. Hendrickx, M.E. 2002a. A new deep water species of Odontozona Holthuis (Decapoda, Stenopodidae) from the Southern Gulf of California, Mexico. Crustaceana 75 (3-4): 405-412. Hendrickx, M.E. 2002b. New bathymetric record for the genus Sicyonia in the eastern Pacific. Oceanides 17 (2): 129. Hendrickx, M.E. 2003a. Size and abundance of deep water shrimps on the continental slope of the SE Gulf of California, Mexico. Pp. 227-234. En: M.E. Hendrickx (ed.) Contributions to the Study of East Pacific Crustaceans 2. [Contribuciones al Estudio de los Crustáceos del Pacífico Este 2]. Instituto de Ciencias del Mar y Limnología, UNAM. México, D.F. Hendrickx, M.E. 2003b. Geographic and bathymetric distributions of species of Munidopsis (Crustacea: Decapoda: Galathaeidae) in the SE Gulf of California, Mexico. Pp. 21-30. En: M.E. Hendrickx (ed.) Contributions to the Study of East Pacific Crustaceans 2. [Contribuciones al Estudio de los Crustáceos del Pacífico Este 2]. Instituto de Ciencias del Mar y Limnología, UNAM. México, D.F. Hendrickx, M.E. 2003c. Distribution and size of the deep water Pacific lobsterette, Nephropsis occidentalis Faxon, 1893 (Crustacea: Decapoda: Astacidea: Nephropidae) in the SE Gulf of California, Mexico. Crustaceana 76 (2): 207-215. Hendrickx, M.E. 2004. Distribution and estimation of body size and weight of four species of deep water shrimps in the SE Gulf of California, Mexico. Crustaceana 76 (9): 1025-1036. Hendrickx, M.E. 2008a. New records and notes on decapod crustaceans in the east Pacific. Crustaceana 81 (8): 999-1262. Hendrickx, M.E. 2008b. Second capture of Odontozona foresti Hendrickx, 2002 (Stenopodidea) and Munida bapensis Hendrickx, 2000 (Galatheoidea) in western Mexico. Pp. 47-50. En: M.E. Hendrickx (ed.) Contributions to the Study of East Pacific Crustaceans 5 (1). [Contribuciones al Estudio de los Crustáceos del O peraciones oceanográficas en aguas profundas 95 Pacífico Este 5 (1)]. Instituto de Ciencias del Mar y Limnología, UNAM. México, D.F. Hendrickx, M.E. 2008c. Rediscovery of Rocinela murilloi Brusca and Iverson, 1985 (Crustacea: Isopoda: Aegidae) in the Gulf of California, Mexico, and ecological data associated with its capture. Crustaceana 81(10): 1259-1262. Hendrickx, M.E. 2011. A new species of Glyphocrangon (Decapoda: Caridea: Glyphocrangonidae) from off the coast of western Mexico. Zootaxa 2372: 358-366. Hendrickx, M. E., M. Ayón Parente and D. Serrano. 2011. Additional record of Janetogalathea californiensis (Anomura: Galatheidae) from the central Gulf of California, Mexico, with notes on its distribution. Hidrbiologica 21(1) 89-94. Hendrickx, M.E. 2012a. Los Glyphocrangonidae y Crangonidae (Crustacea: Decapoda: Caridea) recolectados durante los cruceros TALUD en el Pacífico mexicano. Pp. 319356. En: P. Zamorano, M.E. Hendrickx y M. Caso (eds.). Biodiversidad y comunidades del talud continental del Pacífico mexicano. Instituto Nacional de Ecología, Secretaría del Medio Ambiente y Recursos Naturales (Semarnat). Hendrickx, M.E. 2012b. Distribución de Stereomastis pacifica (Faxon, 1893) (Crustacea; Decapoda; Palinura; Erynoidea; Polychelidae) en el Pacífico mexicano. Pp. 357-371. En: P. Zamorano, M.E. Hendrickx y M. Caso (eds.). Biodiversidad y comunidades del talud continental del Pacífico mexicano. Instituto Nacional de Ecología, Secretaría del Medio Ambiente y Recursos Naturales (Semarnat). Hendrickx, M.E. y M. Ayón-Parente. 2011. Rediscovery of Uroptychus pubescens Faxon, 1893 (Decapoda: Anomura: Chirostylidae) in the southern Gulf of California, Pacific coast of Mexico. Crustaceana 84 (12-23): 1411-1420. Hendrickx, M.E. y F.D. Estrada Navarrete. 1989. Processa pippinae Wicksten and Méndez, 1985: a pelagic processid shrimp from the Gulf of California. Revista de Biología Tropical 37 (1): 109-112. Hendrickx, M.E. y F.D. Estrada-Navarrete. 1994. Temperature related distribution of Lucifer typus (Crustacea: Decapoda) in the Gulf of California. Revista de Biología Tropical 42 (3): 581-586. Hendrickx, M.E. y F.D. Estrada-Navarrete. 1996. Los camarones Pelágicos (Crustacea: Dendrobranchiata y Caridea) del Pacífico mexicano. Comisión Nacional para el Conocimiento y Uso de la Biodiversidad e Instituto de Ciencias del Mar y Limnolología, Universidad Nacional Autónoma de México. México, D.F. 157 pp. Hendrickx, M.E. y M. García-Guerrero. 2007. Description of the first zoea of Acanthephyra brevicarinata Hanamura, 1983 (Caridea: Oplophoridae) from deep water of the Gulf of California, Mexico. Pp. 31-37. En: M.E. Hendrickx (ed.) Contributions to the Study 96 Biodiversidad y comunidades del talud continental del Pacífico mexicano of East Pacific Crustaceans 4(2). [Contribuciones al Estudio de los Crustáceos del Pacífico Este 4(2). Instituto de Ciencias del Mar y Limnología, UNAM. México, D.F. Hendrickx, M.E. y J. López. 2006. Geographic and depth distribution of Bathybembix bairdii (Dall, 1889) (Mollusca, Gastropoda, Trochidae) in the East Pacific. Oceanides 21 (1-2): 93-99. Hendrickx, M.E. y J. Salgado Barragán. 1991. Los estomatópodos (Crustacea: Hoplocarida) del Pacífico mexicano. Publ. esp. del Instituto de Ciencias del Mar y Limnología, Universidad Nacional Autónoma de México 10: 1-200. Hendrickx, M.E. y J. Salgado Barragán. 1992. New records of two species of brachyuran crabs (Decapoda: Brachyura) from tropical coastal lagoons, Pacific coast of Mexico. Revista de Biología Tropical 40 (1): 149-150. Hendrickx, M.E. y J. Salgado Barragán. 1994. Stomatopods (Crustacea: Hoplocarida) collected off the coasts of Sinaloa, Mexico, during the BIOCAPESS Cruises IV, V and VI (August 1991, March and June 1992). Anales del Instituto de Biología, Universidad Nacional Autónoma de México 65 (2): 217-231. Hendrickx, M.E. y D. Serrano. 2007. Efecto de la zona de mínimo de oxígeno sobre los corredores pesqueros a lo largo del pacifico mexicano. Pp. 1-2. En: XIV Congreso Nacional de Ciencia y Tecnología del Mar. Memorias. Conferencia. Octubre 29 al 31 de 2007, Nuevo Vallarta, Nay. Hendrickx, M.E. y D. Serrano. 2010. Impacto de la zona de mínimo de oxígeno sobre los corredores pesqueros en el Pacífico mexicano. Interciencia 35 (1): 12-18. Hendrickx, M.E. y L.A. Vázquez-Cureño. 1998. Composition and zoogeographical affinities of the stomatopod and decapod crustaceans collected during the CEEMEX P4 cruise in the Gulf of Tehuantepec, Mexico. Bulletin de l’Institut royal des Sciences naturelles de Belgique 68: 135-144. Hendrickx, M.E. y M.K. Wicksten. 1989. Los Pandalidae (Crustacea: Caridea) del Pacífico mexicano, con una clave para su identificación. Caldasia 16 (76): 71-86. Hendrickx, M.E. y M.K. Wicksten. 2011. New distribution ranges and records of caridean shrimps (Crustacea: Decapoda: Caridea) from the west coast of Mexico. Hidrobiologica 21 (1): 26-33. Hendrickx, M.E., F. Osuna-Páez y H.M. Zazueta-Padilla. 1998. Biology and biochemical composition of the deep water shrimp Heterocarpus vicarius (Crustacea: Decapoda: Caridea: Pandalidae) from the southeastern Gulf of California, Mexico. Bulletin of Marine Science 63 (2): 265-275. Hendrickx, M.E., R.C. Brusca y L.T. Findley. 2005. A Distributional Checklist of the Macrofauna of the Gulf of California, Mexico. Part I. Invertebrates. [Listado y Distribución de la MacroO peraciones oceanográficas en aguas profundas 97 fauna del Golfo de California, México, Parte I. Invertebrados]. M.E. Hendrickx, R.C. Brusca y L.T. Findley (eds.). Arizona-Sonora Desert Museum. Tucson, Arizona. 429 pp. Hendrickx, M.E., C. Mah y C.M. Zárate Montes. 2011. Deep-water Asteroidea (Echinodermata) collected during the TALUD cruises in the Gulf of California, Mexico. Revista Mexicana de Biodiversidad 82: 798-824. Hernández-Alcántara, P. y V. Solís-Weiss. 1991. New records of errantiate polychaetous annelids from the Gulf of California. Bulletin of Marine Science 48 (2): 251-260. Hendrickx, M.E., M. Demestre, A. Esparza-Haro y J. Salgado-Barragán. 1997. Stomatopod and decapod crustaceans collected during the CEEMEX P5 and P7 cruises to the Gulf of Tehuantepec, Mexico. Oceanides 11: 1-28. Hernández-Alcántara, P. y V. Solís-Weiss. 1993a. Distribución latitudinal y batimétrica de los anélidos poliquetos del orden Terebellomorpha de la plataforma continental del Golfo de California, México. Cuadernos Mexicanos de Zoología 1 (2): 65-72. Hernández-Alcántara, P. y V. Solís-Weiss. 1993b. New records of sedentariate Polychaetous annelids from the continental shelf of the Gulf of California. Bulletin of Marine Science 53 (3): 1027-1041. Hernández-Alcántara, P. y V. Solís-Weiss. 1994. Los espiónidos (Polychaeta: Spionidae) del golfo de California y Golfo de Tehuantepec, México. Revista de Biología Tropical 42 (3): 567-577. Hernández-Alcántara, P. y V. Solís-Weiss. 1998a. Capitellids (Polychaeta: Capitellidae) from the continental shelf of the Gulf of California, Mexico, with the description of a new species, Notomastus angelicae. Proceedings of the Biological Society of Washington 111 (3): 708-719. Hernández-Alcántara, P. y V. Solís-Weiss. 1998b. Parasitism among polychaetes. A rare case illustratred by a new species: Labrorostratus zaragozensis, n. sp. (Oenonidae) found in the Gulf of California, Mexico. Journal of Parasitology 84 (5): 978-982. Herring, P.J. y M.R. Clarke. 1971. Deep Oceans. Praeger Publishers, New York. 320 pp. Ibarra Rivera, J.S. 2006. Los géneros Gnathophausia y Neognathophausia (Malacostraca: Lophogastrida) en el Pacífico mexicano. Tesis profesional. Instituto Tecnológico de Los Mochis, Sinaloa. 70 pp. Ibarra-Rivera, J.S. y M.E. Hendrickx. 2008. Los géneros Gnathophausia y Neognathophausia (Malacostraca: Lophogastrida) en el Pacífico mexicano. Pp. 55-93. En: M.E. Hendrickx (ed.) Contributions to the Study of East Pacific Crustaceans 5 (1). [Contribuciones al Estudio de los Crustáceos del Pacífico Este 5 (1)]. Instituto de Ciencias del Mar y Limnología, UNAM. México, D.F. Idronaut. 2010. http://www/gnc-inc.com/320a4/pdf. 98 Biodiversidad y comunidades del talud continental del Pacífico mexicano IFREMER, 2010. http://www.ifremer.fr/exploration/engin/cyana.htm. Kameya, A., R. Castillo, L. Escudero, E. Tello, V. Blaskovic, J. Córdova, Y. Hooker, M. Gutiérrez y S. Mayor. 1997. Localización, distribución y concentración de langostinos rojos de profundidad. Crucero BIC Humboldt 9607-08 18 de julio a 6 de agosto de 1996. Publicación Especial, Instituto del Mar de Perú. 47 pp. King, J.E. y R.T.B. Iversen. 1962. Midwater trawling for forage organisms in the Central Pacific 1951-1956. Fishery Bulletin 62 (210): 271-321. Laubier, L. 2010. http://www.universalis.fr/encyclopedie/cyana. Levin, L.A. 2003. Oxygen minimum zone benthos: adaptation and community response to hypoxia. Oceanography and Marine Biology: An Annual Review 41: 1-45. Levin, L.A. y J.D. Gage. 1998. Relationships between oxygen, organic matter and the diversity of bathyal macrofauna. Deep-Sea Research II 45: 129-163. Levin, L.A., R.J. Etter, M.A. Rex, A.J. Gooday, C.R. Smith, J. Pineda, C.T. Stuart, R.R. Hessler y D. Pawson. 2001. Environmental influences on regional deep-sea species diversity. Annual Review Ecology System 32: 51-93. Licea, S., J.L. Moreno, H. Santoyo y G. Figueroa. 1995. Dinoflagelados del golfo de California. Universidad Autónoma de Baja California Sur, SEP-FOMES, PROMARCO. México. 163 pp. Llorente-Bousquets, J., P. Koleff Osorio, H. Benítez Díaz y L. Lara Morales. 1999. Síntesis del estado de las colecciones biológicas mexicanas. Resultados de la encuesta “Inventario y diagnóstico de la actividad taxonómica en México” 1996-1998. Comisión Nacional para el Conocimiento y Uso de la Biodiversidad, México. México. 143 pp. Ludwig, H. 1894. Reports of an Exploration off the West Coast of Mexico, Central and South America, and off the Galapagos Islands, in Charge of Alexander Agassiz, by the U.S. Fish Commission Steamer “Albatross”, during 1891, Lieutenant Commander Z.L. Tanner, U.S.N., Commanding, XII: The Holothurioidea. Memoirs of the Museum of Comparative Zoology at Harvard College 17 (3): 1-183. Ludwig, H. 1905. Asteroidea. En: Reports on an Exploration off the West Coasts of Mexico, Central and South America, and off the Galapagos Islands, in Charge of Alexander Agassiz, by the U.S. Fish Commission Steamer “Albatross”, during 1891, Lieut. Commander ZL. Tanner, U.S.N., Commanding and Reports on the Scientific Results of the Expedition to the Tropical Pacific, in Charge of Alexander Agassiz, on the U.S. Fish Commission Steamer “Albatross”, from August, 1899, to March, 1900, Commander Jefferson F. Moser, U.S.N. Commanding. Memoirs of the Museum of Comparative Zoology at Harvard College 32:1-292. Luke, S.R. 1977. Catalog of the benthic invertebrate collections. I. Decapod Crustacea O peraciones oceanográficas en aguas profundas 99 and Stomatopoda. University of California. SIO Ref. Ser. 77-9. 72 p. Lütken, Chr. F. y Th. Mortensen. 1899. Reports on an exploration off the west coasts of Mexico, Central and South America, and off the Galapagos Islands, in charge of A. Agassiz, during 1891 on the “Albatross”. XXV. The Ophiuridae. Memoirs of the Museum of Comparative Zoology at Harvard College 23 (2): 93-208. Massin, C. y M.E. Hendrickx. 2010. A new species of deep-water Holothuroidea (Echinodermata) of the genus Synallactes from off western Mexico. Scientia Marina 74 (3): 599-603. Massin, C. y Hendrickx, M.E. 2011. Deep-water Holothuroidea (Echinodermata) collected during the TALUD cruises off the Pacific coast of Mexico, with the description of two new species. Revista Mexicana de Biodiversidad 82: 413-443. Mathews, C.P., J.L. Granados y J. Arvizu-Martinez. 1974. Results of the exploratory cruises of the Alejandro de Humboldt in the Gulf of California. CalCOFI Technical Report 17: 101-111. McClain, C.R. 2004. Connecting species richness, abundance and body size in deep-sea gastropods. Global Ecology and Biogeography 13 (4): 327-334. McClain, C.R. y M.A. Rex. 2001. The relationship between dissolved oxygen concentration and maximum size in deep-sea turrid gastropods: an application of quantile regression. Marine Biology 139: 681-685. McCosker, J.E. 1999. Pisces anguilliformes: Deepwater snake eels (Ophichthidae) from the New Caledonian region, Southwest Pacific Ocean. Pp. 180: 571-588. En: A. Crosnier (ed.). Résultats des Campagnes MUSORSTOM, Vol. 20. Mémoires du Muséum national d’Histoire Naturelle Paris. Sér. A, Zoologie. Méndez, N. 2006. Deep-water polychaetes (Annelida) from the southeastern Gulf of California, Mexico. Revista de Biología Tropical 54 (3): 773-785. Méndez, N. 2007. Relationships between deep-water polychaete fauna and environmental factors in the southeastern Gulf of California, Mexico. Scientia Marina 71 (3): 605-622. Méndez, N. 2009. Distribution and extraordinary abundance of the deep-sea Melinnampharete gracilis Hartman, 1969 (Polychaeta: Ampharetidae) in the Gulf of California, Mexico. Cahiers de Biologie Marine 50: 273-276. Monzalvo Santos, I.K. 2003. Determinación de mercurio en dos especies de peces bentónicos (Cherublemma emmelas y Zalietus elater) de la zona del talud del Golfo de California. Tesis de Licenciatura, Escuela de Biología, UAS. 82 pp. Moreno Flores, D.J. 2009. Distribución de la familia Macrouridae Gilbert y Hubbs 1916, en el sur del golfo de California. Tesis de Maestría, Ciencias del Mar y Limnología, UNAM. 74 pp. 100 Biodiversidad y comunidades del talud continental del Pacífico mexicano Moreno, J.L., S. Licea y H. Santoyo. 1996. Diatomeas del golfo de California. UABCS, SEP-FOMES, PROMARCO. 165 pp. Parker, R.H. 1963. Zoogeography and ecology of some macroinvertebrates, particularly mollusks, in the Gulf of California and the continental slope off Mexico. Videnskabelige Meddelelser fra Dansk Naturhistorisk Forening 126:1-178. Retamal R., M.A. 1993. Crustáceos decápodos abisales de la zona Iquique-Arica. Estudios Oceanológicos 12: 1-8. Rodríguez Soberanes, K. 2007. Variación espacial de la densidad de copépodos bentónicos y su relación con la profundidad, concentración de oxígeno disuelto, concentración de carbono orgánico y granulometría del sedimentos en el talud continental de Sinaloa. Tesis profesional. Instituto Tecnológico de Mazatlán. Mazatlán, Sinaloa. 107 pp. Rogers, A.D. 2000. The role of the oceanic oxygen minima in generating biodiversity in the deep sea. Deep-Sea Research II 47: 119-148. Román-Contreras, R. y C. Boyko. 2007. A new genus and species of Bopyrid isopod infesting the crab Munidopsis depressa (Anomura: Galatheidae) from the Gulf of California, with notes on its ecology. Journal of Crustacean Biology 27 (2): 370-379. SAGARPA. 2010. Boletín enero 2010. Salazar-Vallejo, S.I., E. Escobar-Briones, N.E. González, E. Suárez-Morales, F. Alvarez, J.A. de León-González y M.E. Hendrickx. 2007. Iniciativa Mexicana en Taxonomía: Biota Marina y Costera. Ciencia y Mar 11 (32): 3-11. Sánchez-Velasco, L., V.M. Godínez-Sandoval, B. Shirasago y M. Peguero-Icaza. 2004. Datos hidrográficos del golfo de California: Campaña oceanográfica GOLCA0308 (del 1 al 7 de agosto del 2003). Informe Técnico 16560. Comunicaciones Académicas. Serie Oceanografía Física. CICESE. 44 pp. Sardà, F. y M. Demestre. 1987. Estudio biológico de la gamba Aristeus antennatus (Risso, 1816) en el mar catalán (NE de España). Investigaciones Pesqueras 51 (Suppl. 1): 213-232. Sardà, F. y F.J. Valladares. 1990. Gastric evacuation of different foods by Nephrops norvegicus (Crustacea Decapoda) and estimation of soft tissue ingested, maximum food intake and cannibalism in captivity. Marine Biology 104: 25-30. Schiff, H. y M.E. Hendrickx. 1997. An introductory survey of ecology and sensory receptors of tropical eastern Pacific crustaceans. Italian Journal of Zoology 64: 13-30. Scripps Institution of Oceanography. 1992. The marine shrimp of the Scripps Institution of Oceanography Benthic Invertebrate collection catalogue. Mimeographed report. 106 pp. Serrano, D. 2012. La zona del mínimo oxígeno en el Pacífico mexicano. Pp. 105-119. O peraciones oceanográficas en aguas profundas 101 En: P. Zamorano, M.E. Hendrickx y M. Caso (eds.). Biodiversidad y comunidades del talud continental del Pacífico mexicano. Instituto Nacional de Ecología, Secretaría del Medio Ambiente y Recursos Naturales (Semarnat). Serrano, D. y M.E. Hendrickx. 2011. Debajo de la zona del mínimo de oxígeno. Investigación y Ciencia 417: 13-15. Smith, R.H. 1992. Planet Earth. Time-Life, EE.UU. 113 pp. Smith, C.R., L.A. Levin y S. Mullineaux. 1998. Deep-sea biodiversity: a tribute to Robert R. Hessler. Deep-Sea Research II 45: 1-11. Solís-Weiss, V. y P. Hernández-Alcántara. 1994. Amphisamytha fauchaldi: A new species of Ampharetid (Annelida: Polychaeta) from the hydrothermal vents at Guaymas Basin, Mexico. Bulletin of the Southern California Academy of Sciences 93 (3): 127-134. Solís-Weiss, V. y B. Hilbig, 1992. Redescription of Ophryotrocha platykephale Blake (Polychaeta, Dorvilleidae) from the Guaymas Basin hydrothermal vents. Bulletin of the Southern California Academy of Sciences 91 (2): 92-96. Sorbe, J.P. 1983. Description d’un traîneau destiné à l’échantillonnage quantitatif étagé de la faune suprabenthique néritique. Annales de l’Institut Océanographique, París. 59 (2): 117-126. Soule, G. 1970. The greatest depths: Probing the seas to 20000 feet (6100 m) and below. Macrae Smith. Philadelphia, EE.UU. 194 pp. Strong, A.M. y L.G. Hertlein. 1939. Marine mollusks from Panama collected by the Allan Hancock Expedition to the Galapagos Islands, 1931-1932. Allan Hancock Pacific Expeditions 2 (12): 177-245. Thomson, C.W. 1873. The Depths of the Sea. Octavio. MacMillan and Co. London. 527 pp. Vadon, C. 1991. Echinodermata: Ophiuridae profonds de Nouvelle-Calédonie. Formes paedomorphes. Pp. 335-356. En: A. Crosnier (ed.). Résultats des Campagnes MUSORSTOM, Vol. 8. Mémoires du Muséum national d’Histoire naturelle, Paris. Sér. A, Zoologie 151. Vélez, J., A. Kameya, C. Yamashiro, N. Lostaunau y O. Valiente. 1992. Investigación del recurso potencial langostino rojo de profundidad a bordo del BIC “Fridtjof Nansen” (25 de abril - 25 de mayo, 1990). Informe. Instituto del Mar del Perú, C.E.E. 104: 3-24. Wehrtmann, I.S. y V. Nielsen-Muñoz. 2009. The deepwater fishery along the Pacific Costa Rica, Central America. En: P. Arana, J.A.A. Pérez y P.R. Pezzutto (eds.). Deep-sea fisheries off Latin America. Latin American Journal of Aquatic Research 37 (3): 543-554. Wehrtmann, I.S., J. Herrera-Correal, R. Vargas y P. Hernáez. 2010. Squat lobsters (Decapoda: Anomura: Galatheidae) from deepwater Pacific Costa Rica: species diversity, 102 Biodiversidad y comunidades del talud continental del Pacífico mexicano spatial and bathymetric distribution. Nauplius 18 (1): 69-77. WHOI. 2007. http://www.whoi.edu/page.do?pid=8422. Wicksten, M.K. 1989. Ranges of offshore decapod crustaceans in the eastern Pacific Ocean. Transactions of the San Diego Society of Natural History 21 (19): 291-316. Wicksten, M.K. y M.E. Hendrickx. 1992. Checklist of Penaeoid and Caridean shrimps (Decapoda: Penaeoidea, Caridea) from the eastern tropical Pacific. Proceedings of the San Diego Society of Natural History 9: 1-11. Wicksten, M.K. y M.E. Hendrickx. 2003. An updated checklist of benthic marine and brackish water shrimps (Decapoda: Penaoidea, Stenopodidea, Caridea) from the Eastern Tropical Pacific. Pp. 49-76. En: M.E. Hendrickx (ed.) Contributions to the Study of East Pacific Crustaceans 2. [Contribuciones al Estudio de los Crustáceos del Pacífico Este 2]. Instituto de Ciencias del Mar y Limnología, UNAM. México, D.F. Wikipedia. 2010. http://es.wikipedia.org/wiki/Batisfera. Wri-Org. 2010. http://earthtrends.wri.org/text/coastal-marine/variable-62.html. Zamorano de Haro, P. 2006. Moluscos del Talud Continental del Pacífico Mexicano (Taxonomía, Biodiversidad, Ecología, Biogeografía). Tesis de Maestría. Universidad Nacional Autónoma de México, Posgrado en Ciencias del Mar y Limnología. 124 pp. Zamorano, P. y M.E. Hendrickx. 2007. Biocenosis y distribución de los moluscos de aguas profundas en el Pacífico mexicano: una evaluación de los avances. Pp. 48-49. En: E. Ríos-Jara, M.C. Esqueda-González y C.M. Galván-Villa (eds.). Estudios sobre la malacología y conquiliología en México. Universidad de Guadalajara, México. Zamorano, P. y M.E. Hendrickx. 2009. Análisis latitudinal y batimétrico de la comunidad de moluscos de mar profundo en el golfo de California, México. Brenesia 71-72: 41-54. Zamorano, P. y M.E. Hendrickx. 2011. A comparative analysis of deep-water mollusks from both sides of the Baja California Peninsula, Mexico. Cahiers de Biologie Marine 52: 13-22. Zamorano, P. y M.E. Hendrickx. (Aceptado). Distribution of Lucinoma heroica (Dall, 1901) in the minimum oxygen zone in the Gulf of California, Mexico. Marine Biodiversity Records (JMBA). Zamorano, P., M.E. Hendrickx y A. Toledano Granados. 2006. Distribution and ecology of deep water mollusks from the continental slope, southeastern Gulf of California, Mexico. Marine Biology 150 (5): 883-892. Zamorano, P., M.E. Hendrickx y A. Toledano Granados. 2007. New geographic and depth records for deep-water mollusks in the Gulf of California, Mexico. Nuevos registros geográficos y batimétricos para moluscos de mar profundo en el Golfo de California, México. Revista Mexicana de Biodiversidad 78 (2): 311-318. O peraciones oceanográficas en aguas profundas 103 Zamorano, P., M.E. Hendrickx, N. Méndez, S. Goméz, D. Serrano, H. Aguirre, J. Madrid y N. Morales-Serna. 2012. Explorando las aguas profundas del Pacífico mexicano: el proyecto TALUD. En: INE (ed.). La frontera final: el océano profundo. Instituto Nacional de Ecología, Secretaría del Medio Ambiente y Recursos Naturales (Semarnat). México, D.F. Zarate Montes, C. 2011. Taxonomía y ecología de equinodermos de aguas profundas del Pacífico mexicano. Tesis de Maestría. Universidad Nacional Autónoma de México, Posgrado en Ciencias del Mar y Limnología. 106 pp. 104 Biodiversidad y comunidades del talud continental del Pacífico mexicano La zona del mínimo de oxígeno en el Pacífico mexicano David Serrano1 INTRODUCCIÓN El oxígeno, elemento esencial para la gran mayoría de los organismos vivos, y en especial para la macrofauna, no se encuentra en igual concentración en la vertical tanto en la atmósfera como en los océanos. Es sabido por algunos de nosotros y en particular por los deportistas de alto rendimiento que en eventos competitivos que se desarrollan a una altitud considerable se requerirá, por parte de los atletas, un mayor esfuerzo, esto debido a que el oxígeno se encuentra en menor cantidad en comparación con sitios que se encuentran a menor altitud; digamos a nivel del mar. El oxígeno disminuye conforme avanzamos en la altitud y esta tendencia se mantiene a lo largo de toda la atmósfera. En algunas regiones del océano, este elemento presenta un comportamiento peculiar conforme descendemos en la profundidad; cerca de la superficie del mar se encuentran las mayores concentraciones de oxígeno disuelto (OD), aproximadamente entre 6 y 3 ml l-1, concentración suficiente para permitir el proceso de respiración de gran número de organismos marinos. La alta concentración de OD en las cercanías de la superficie del mar se debe al intercambio de gases con la atmósfera; Facultad de Ciencias del Mar, Universidad Autónoma de Sinaloa, México. Correo-e: [email protected]. 1 105 por procesos turbulentos y a la producción de oxígeno por parte del fitoplancton. Sin embargo, la concentración de OD disminuye conforme penetramos en la profundidad, alcanzando valores cercanos a cero, concentraciones que dificultarían cualquier proceso de combustión y por lo tanto de respiración. Las profundidades en las que se alcanzan valores críticos de OD (menores a 0.5 -1 ml l - valor arbitrario ya que algunos trabajos consideran 1 ó 2 ml l-1) para el proceso de respiración no es igual en todos los océanos del mundo y no en todas las regiones oceánicas se presentan estos valores críticos. Por ejemplo, frente a la costa del estado de Sinaloa, estos valores se encuentran a profundidades mayores a 70 m y hacia el sur, dentro de nuestro mar patrimonial, frente a las costas de Guerrero y Michoacán, se encuentra a profundidades mayores a 50 m (Hendrickx y Serrano 2010). Estas concentraciones de OD, cercanas a cero, se mantienen casi sin variación entre 700 y 800 m, formando una franja conocida como “la zona o capa del mínimo de oxígeno”, zona en la que la vida es escasa y en el que los seres vivos que habitan permanentemente en ella son en su mayoría bacterias anaeróbicas. Por debajo de esta franja, el OD se incrementa progresivamente alcanzando valores mayores a 0.5 ml l-1, concentraciones con la que una gran cantidad de especies marinas de los diferentes phyla logra sobrevivir. La importancia de conocer la concentración de OD en la columna de agua radica en que si es mayor al valor crítico, garantiza la existencia de organismos aeróbicos, los cuales pueden resultar potencialmente explotables, además de que los organismos que habitan a grandes profundidades resultan de interés desde el punto de vista fisiológico, ya que presentan diferentes adaptaciones para poder sobrevivir en este ambiente. En este trabajo definimos la zona del mínimo de oxígeno (ZMO) como la región oceánica en donde la concentración de oxígeno disuelto es menor a 0.5 ml l-1. Generalmente, la ZMO se presenta en áreas donde hay una alta productividad orgánica en la superficie, la cual al morir precipita y degrada, agotando el oxígeno a lo largo de la columna de agua. El consumo de oxígeno por factores biológicos y su degradación por factores bioquímicos, asociados a la escasa circulación y al largo tiempo de residencia que presentan las aguas intermedias, son la causa principal de su formación. En los océanos del mundo se tienen identificadas al menos tres importantes ZMO: el Pacífico oriental; el sureste del Atlántico (frente a la costa occidental de África); y el norte del océano Índico (mar Arábigo). Estas ZMO interceptan el margen continental en la plataforma y talud continental (i.e., profundidades batiales), creando una zona extensa del fondo marino sujeta a una hipoxia que persiste a lo largo de miles de años (Reichart et al. 1998). 106 Biodiversidad y comunidades del talud continental del Pacífico mexicano En el Pacífico oriental, la extensa ZMO se puede explicar por el hecho de que las aguas profundas intermedias son aguas con poca o escasa movilidad, las cuales no se han renovado por procesos de circulación (forzamiento externo o circulación termohalina), además de poseer una baja concentración de oxígeno en comparación con otras masas de agua que se originan cerca de la superficie del mar. El Agua Subtropical Subsuperficial, por ejemplo, donde parcialmente se encuentra la ZMO, es una masa de agua formada en el hemisferio sur, la cual lentamente fluye hacia al Pacífico oriental, a medida que por procesos de oxidación va disminuyendo su contenido de OD. La circulación en aguas intermedias y profundas se origina por los cambios de densidad del agua oceánica, como resultado de las diferencias de temperatura y salinidad. Debido a ello, las masas de agua más densas, como las generadas en las regiones polares y subpolares, tienden a hundirse hasta alcanzar su nivel de equilibrio y reemplazar a aguas menos densas, las cuales serán desplazadas lateralmente o hacia arriba, produciendo así una circulación convectiva. Las aguas intermedias forman un circuito interno, por lo que su renovación o sustitución con aguas superficiales ricas en oxígeno les lleva más tiempo. La ZMO en el Pacífico oriental comprende de los ~45º N a los ~30º S, abarcando casi en su totalidad la costa occidental de América. Esta zona cubre una superficie estimada de 15×106 km2 por lo que es considerada y por mucho la ZMO más extensa del mundo (de acuerdo a Diaz y Rosenberg 1995). Las profundidades en las que se encuentran concentraciones < 0.5 ml l-1 de oxígeno disuelto varían según la latitud: en el norte del estado de California y en el estado de Oregón comienza a profundidades entre 500-600 m; en Centroamérica la ZMO se encuentra a 10 m de profundidad. El espesor de la ZMO varía de acuerdo a la circulación y renovación que presentan las aguas intermedias. En Chile el espesor de la ZMO es < 200 m; para la costa occidental de los Estados Unidos es de ~1000 m (Helly y Levin 2004). De acuerdo a Reid y Mantyla (1978) el espesor de la ZMO es mayor hacia el Pacífico nororiental debido a que las masas de agua son “viejas” y presentan poco oxígeno en comparación con las masas de agua del Pacífico sur. Por arriba de la ZMO, el incremento de oxígeno se explica por la interacción océano-atmósfera favoreciendo el intercambio de gases y por el aporte de oxígeno de organismos fotosintéticos. Por debajo de la ZMO, el aporte de oxígeno se debe a la presencia de masas de agua con baja temperatura, las cuales se originaron superficialmente en la vecindad de los polos, llevando consigo importantes cantidades de oxígeno a grandes profundidades, debido a la circulación termohalina. La zona del mínimo de oxígeno en el Pacífico mexicano 107 En las aguas del Pacífico mexicano la ZMO cubre casi en su totalidad el litoral con excepción del alto golfo de California (Diaz y Rosenberg 1995, Helly y Levin 2004). La ZMO representa un problema ecológico y económico de magnitud mayor. Por un lado, sólo las especies que desarrollaron adaptaciones específicas para tolerar concentraciones bajas de oxígeno logran colonizar las franjas hipóxicas. Por otro lado, la extensión vertical de la ZMO (particularmente grande en el Pacífico mexicano) genera la existencia de una enorme zona prácticamente azoica (sin fauna) donde no hay cabida para la presencia de recursos pesqueros (Serrano y Hendrickx 2011). En México la ZMO es extremadamente amplia en el sur del golfo de California y a lo largo de la costa suroeste de México (Hendrickx 2001, Hendrickx y Serrano 2010). A pesar de su importancia (representa una limitante para el desarrollo de organismos aeróbicos), poco se sabe de su distribución espacial y aún se desconocen las variaciones espacio-temporal de corto, mediano y largo plazos. Entre las pocas evaluaciones de la extensión de este fenómeno en aguas mexicanas, existe un trabajo publicado en los años 60 por Parker (1963), quien utilizó la información disponible para proponer un mapa de distribución de la ZMO en el golfo de California. Desde entonces y hasta comienzos de 2010, la información publicada se refería esencialmente a datos aislados; hidrocalas, perfiles y transectos (Gaxiola-Castro et al. 2002, Sánchez-Velasco et al. 2004) y no a un estudio integral de la columna de agua a lo largo de la Zona Económica Exclusiva de México (ZEE). Por otra parte, en un contexto de mayor escala, Fiedler y Talley (2006) hacen una revisión de los trabajos hidrográficos del Pacífico oriental tropical, empleando registros del World Ocean Database 2001 (WOD01, por su sigla en Inglés), señalando secciones zonales y meridionales de temperatura, salinidad, densidad potencial, nutrientes y oxígeno disuelto. Es hasta inicios de esta década cuando Hendrickx y Serrano (2010) publican el trabajo “Impacto de la zona de mínimo de oxígeno sobre los corredores pesqueros en el Pacífico mexicano” en el que presentan el resultado de tres campañas oceanográficas TALUD, realizadas en junio de 2001 (TALUD VII) febrero de 2007 (TALUD X) y junio de 2008 (TALUD XI), cubriendo una extensión aproximada de 1500 km, abarcando desde 28º16’ N (zona central del golfo de California) hasta 16º50’ N (frente a la costa de Acapulco, Guerrero). En ese trabajo se muestra la distribución de OD a lo largo de tres secciones longitudinales construidas de acuerdo a los perfiles de OD de más de 60 estaciones oceanográficas (véase Hendrickx 2012), con profundidades que van desde los 260 m hasta 1905 m. Los datos de OD, temperatura (ºC), salinidad (UPS), conductividad (S/m), profundidad 108 Biodiversidad y comunidades del talud continental del Pacífico mexicano (m) y σθ de las campañas TALUD fueron registrados con un CTD (Conductivity Temperatura Depth, por su sigla en inglés; Conductividad Temperatura Profundidad) de la marca SEA-BIRD ELECTRONICS modelo 19 de 2 Hz con sensor de oxígeno integrado. Los datos fueron interpolados a cada metro de profundidad, por lo que para el OD y para cada una de las demás variables se contó con más de 75000 registros (sólo ascenso). Con esta importante cantidad de información se construyó con detalle los perfiles de OD para cada estación; además, se elaboraron diagramas T-S (temperatura y salinidad), lo cual permitió determinar qué masa de agua aportaba importantes cantidades de oxígeno. Entre los resultados que se destacan del trabajo de Hendrickx y Serrano (2010) y desde el punto de vista oceanográfico, cabe mencionar: el espesor de la ZMO a lo largo de la zona de estudio permanece casi constante (1167 m); la profundidad en la que se registran concentraciones de OD < 0.5 ml l-1 disminuye hacia el sur a lo largo de la ZEE, registrándose hacia el norte en la zona central del golfo de California a una profundidad de 255 m; para la costa de Sinaloa a una profundidad media de 74 m; y para las costas de los estados de Jalisco, Colima, Michoacán y Guerrero a una profundidad de 53 m. La masa de agua profunda que aporta OD ≥ 0.5 ml l-1 por debajo de los 1300 m es la masa de agua profunda del Pacífico o agua común oceánica. Por otra parte, la ZMO representa una barrera fisiológica para la migración vertical en la columna de agua; así, son pocas las especies que dentro de su distribución batimétrica cruzan la ZMO, limitando a estas especies a que habiten ya sea por encima o por debajo de esta zona. CAMPAÑA TALUD IX En esta sección se presenta con detalle la metodología y los resultados inéditos de la concentración de OD de la campaña TALUD IX, realizada entre el 11 y 15 de noviembre de 2005 frente a la costa de la península de Baja California, en la zona sur del golfo de California. Cabe destacar que las mismas metodología y técnica de análisis de los registros se realizó en la campañas TALUD VII, X y XI, discutidas en Hendrickx y Serrano (2010). Perfiles de OD La campaña TALUD IX se realizó a bordo del B/O “El Puma” de la Universidad Nacional Autónoma de México. Se realizaron 17 hidrocalas, con profundidades La zona del mínimo de oxígeno en el Pacífico mexicano 109 variables desde los 469 m (estación 4) hasta los 2257 m (estación 1), navegando un total de 508 km, entre 24º27’ y 26º27’ N y entre los 109º19’ y 110º48’ O (Fig. 1). Las hidrocalas se realizaron con el CTD-SEA BIRD -19 antes descrito, sujeto a la estructura roseta del buque, con velocidad de ascenso del cable de 1 m s-1. El CTD fue configurado para que cada segundo tomara registros de OD, temperatura, conductividad y profundidad, garantizando con ello al menos un set de parámetros cada dos metros. El total de registros de OD (sólo ascenso) fue de poco más de 23000 y se obtuvieron los perfiles de OD de 17 hidrocalas (Fig. 2). El perfil de la estación 15, segundo en profundidad, a diferencia del resto de los demás perfiles, disminuye su tasa de OD por metro a partir de los 1700 m, alcanzando un máximo 1.14 ml l-1 a 2222 m, mientras que el perfil de la estación 1 (el más profundo) alcanza la concentración de 1.66 ml l-1 a esta misma profundidad. El decremento en la tasa de OD del perfil 15 se debe a que esta estación se ubicó en la vecindad de la cuenca de Guaymas, sitio en la que la renovación del agua toma más tiempo debido a su morfología batimétrica. El resto de los perfiles presentan similar concentración de OD con la profundidad, con excepción de los primeros 100 m, en el que las variaciones de la concentración del OD por efectos de viento, procesos turbulentos y respiración en cortos periodos tienen un papel preponderante. Se estableció el perfil con los valores medios de OD de las 17 estaciones (tono de gris, Fig. 2). El valor máximo se registra a 10 m de profundidad con una concentración de 2.98 ml l-1, con variaciones menores a 0.01 ml l-1 en los primeros 18 m, por lo que podemos considerarla una capa de mezcla. Por debajo de los 18 m, el OD disminuye gradualmente a una razón media de -0.015 ml l-1 m-1, encontrándose la franja de hipoxia severa (0.1 ≤ OD < 0.5) entre los 160 y 247 m; por debajo de 247 m y hasta los 935 m, se encuentra la franja anóxica con concentraciones de OD menores a 0.1 ml l-1 y, entre los 935 m y 1340 m, de nueva cuenta se encuentra la franja de hipoxia severa. El incremento del OD a partir de valores cercanos a cero comienza aproximadamente a los 800 m, con una tasa media de 9.86×10-4 ml l-1 m-1, es decir, la concentración de OD se incrementa 0.0986 ml l-1 cada 100 m. El cambio abrupto que se observa en el perfil por debajo de los 2200 m se debe a que sólo se contó con dos perfiles mayores a esa profundidad, resultando una notable diferencia en la concentración de OD (perfiles 1 y 15). 110 Biodiversidad y comunidades del talud continental del Pacífico mexicano Figura 1. Derrotero de las campañas TALUD VII, IX, X y XI. Detalle de la ubicación de las estaciones Talud IX (recuadro). Sección longitudinal y diagramas T-S Para construir la sección longitudinal empleando los perfiles registrados en cada estación a lo largo del derrotero, fue necesario proyectar la ubicación de cada perfil a una recta. Primero se convirtió la posición de las estaciones registradas en coordenadas geográficas a coordenadas UTM (Universal Transversal de Mercator), restando a cada coordenada N y coordenada E (dadas en m) los valores mínimos de las coordenadas N y E respectivamente; esto se hizo con el fin de ubicar las estaciones en un sistema cartesiano con origen (0, 0) (Fig. 3). Segundo sobre la base de la gráfica es posible que los datos (estaciones) puedan ser ajustadas a una función polinomial que, para este caso y ya que se quiere proyectar la ubicación de los perfiles a un transecto, se trata de un polinomio de primer grado (línea recta). La zona del mínimo de oxígeno en el Pacífico mexicano 111 Figura 2. Perfiles de OD de las 17 estaciones con hidrocalas realizadas en la campaña TALUD IX. El perfil obtenido con los valores medios se señala en color gris. Los coeficientes incógnita m y b, pendiente y ordenada al origen, respectivamente, pueden calcularse por un ajuste de cuadrados mínimos, lo cual garantiza la mínima desviación cuadrática de los datos respecto al ajuste. Tercero, al ubicar las estaciones a lo largo de la línea (proyectar) se reduce al problema clásico de máximos y mínimos, el cual consiste en encontrar la distancia mínima de un punto (x0, y0) ubicado en el espacio cartesiano a una recta determinada con ecuación y = mx + b. La solución a este problema es: x= m(b - y0) - x0 - (1 + m2) y = mx + b 112 Biodiversidad y comunidades del talud continental del Pacífico mexicano Figura 3. Ubicación de las proyecciones (círculos) en el transecto (línea gruesa) y de las estaciones (triángulos) en un sistema cartesiano. Las líneas interrumpidas representan la menor distancia de las estaciones hacia el transecto. En donde (x, y) son las coordenadas que se ubican en la línea recta y que, junto con las coordenadas (x0, y0), forman un segmento ortogonal a ésta. La proyección a la línea recta (línea gruesa) de las estaciones se aprecia con círculos (Fig. 3). Las líneas interrumpidas representan los segmentos con menor distancia desde el punto (x0, y0) (estaciones, triángulos) a la línea de ajuste (transecto, línea gruesa). Cuarto, una vez ubicada las proyecciones en el transecto se determina la La zona del mínimo de oxígeno en el Pacífico mexicano 113 distancia de las proyecciones respecto al inicio de éste, que para el caso se trata de la proyección de la estación 13, la cual, y de acuerdo al ajuste, se encuentra ubicada más al norte respecto al resto de las proyecciones. Es así que, conociendo la distancia desde el origen del transecto, se ubican los perfiles para la interpolación. Por ejemplo: el perfil de la estación 13 se ubica al inicio del transecto, km 0.0; el perfil de la estación 1 se ubica a 202.0 km, que es la longitud total del transecto; el perfil de la estación 7 se ubica a 101.8 km; y así con todos los perfiles. El arreglo de norte a sur de los perfiles se determinó para mantener la consistencia con las secciones longitudinales de las campañas TALUD VII, X y XI. Además, y como ya se mencionó, se ve con mayor facilidad que la ZMO se presenta a profundidades menores hacia el sur de la ZEE. Quinto, para la construcción de la sección longitudinal se realizó una interpolación lineal. El vector a lo largo del transecto tiene una longitud de 202 km con intervalo de interpolación de 2 km, por lo que al realizar ésta se construyó una matriz de 2257 renglones (profundidad máxima de los perfiles) por 102 columnas. La distribución de OD de la sección longitudinal de la campaña TALUD IX (Fig. 4) permite observar las líneas negras que representan las oxilíneas con concentraciones de 0.5 y 0.1 ml l-1, indicando la ZMO, delimitando respectivamente la franja de hipoxia severa y la capa anóxica con espesor medio de 690 m. Para determinar que la ZMO se presenta a menor profundidad hacia el sur de la ZEE, se ajustó una línea recta a la oxilínea de 0.5 ml l-1, previa eliminación (serie filtrada) de perturbaciones ocasionada por fuertes viento, oleaje y oscilaciones en la picnoclina cuyos desplazamientos se encuentran entre 50 y 70 m y que posiblemente afectaron la distribución del OD en los primeros metros de la columna de agua. El resultado del ajuste indica que la pendiente es negativa, con valor de -4.54 ×10-4, por lo que hacia el final del transecto la oxilínea de 0.5 ml l-1 se ubicó aproximadamente 91 m por arriba respecto al inicio del transecto (Fig. 5). Hendrickx y Serrano (2010) reportan valores negativos en la pendiente para los ajustes en la oxilínea de 0.5 ml l-1 de las campañas TALUD VII, X y XI. Por último, y con el fin de determinar que masas de agua son las responsables de aportar valores significativos en las concentraciones de OD, se construyó el diagrama T-S para el TALUD IX (Fig. 6). Se identificaron cinco masas de agua (según clasificación de León-Chávez et al. 2010, Lavín et al. 2009), de las cuales el Agua Tropical Superficial (ATS), el Agua Subtropical Subsuperficial (AStSs), el Agua del golfo de California (AGC) y el Agua Profunda del Pacífico (APP) presentan concentraciones mayores a 0.5 ml l-1. La masa de agua Intermedia del Pacífico (AIP) presenta concentraciones menores a 0.5 ml l-1. Cabe destacar que el aporte 114 Biodiversidad y comunidades del talud continental del Pacífico mexicano Figura 4. Sección longitudinal de OD (ml l-1) para la campaña TALUD IX. Las oxilíneas de 0.5 ml l-1 (línea delgada) señalan el límite superior e inferior de la ZMO. Las oxilíneas de 0.1 ml l-1 (línea gruesa) indican el límite superior e inferior de la zona anóxica. Figura 5. Ajuste de línea recta para la oxilínea de 0.5 ml l-1, indicando la presencia de la ZMO a menor profundidad hacia el sur de la ZEE. de OD a profundidades mayores a 1300 m se debe a la masa de APP que, de acuerdo a Colling (2001), se forma por la mezcla del agua profunda del Atlántico norte, agua de fondo Antártica y agua Antártica intermedia. Ésta última, que se forma en la zona frontal polar Antártica, arrastra consigo importantes cantidades de OD al hundirse por procesos termohalinos. La zona del mínimo de oxígeno en el Pacífico mexicano 115 Figura 6. Diagrama T-S para la campaña TALUD IX. Los puntos rojos indican agua con OD < 0.5 ml l-1; los puntos azules indican agua con OD ≥ 0.5 ml l-1. Agua Tropical Superficial (ATS), Agua del golfo de California (AGC), Agua de la Corriente de California (ACC), Agua Subtropical Subsuperficial (AStSs), Agua Intermedia del Pacífico (AIP), Agua Profunda del Pacífico (APP). DISCUSIÓN (Campañas TALUD VII, IX, X y XI) La ZMO durante el periodo de duración del TALUD IX se ubicó a una profundidad entre 160 y 1340 m, con espesor similar a lo señalado para los TALUD VII y XI (Hendrickx y Serrano 2010). Sin embargo, resulta mayor que el espesor de la 116 Biodiversidad y comunidades del talud continental del Pacífico mexicano ZMO del TALUD X por ~200 m. El menor espesor de la ZMO para el TALUD X, en particular en su zona norte, se debe a la mezcla turbulenta que se presenta en la región de las grandes islas del golfo de California, la cual permite una redistribución de propiedades en la vertical (Figueroa-Rodríguez 2006). La tasa de recuperación de OD por debajo de la ZMO para las campañas que se realizaron exclusivamente dentro del golfo de California es menor en comparación con las campañas realizadas en el Pacífico mexicano, lo cual se atribuye a que el tiempo de residencia de las aguas que se encuentran en las diferentes cuencas dentro del golfo de California es mayor. El espesor de la ZMO para las campañas TALUD VII y XI son similares a las que se vislumbran en el trabajo de Helly y Levin (2004), entre las latitudes de 16º y 22º N; sin embargo, el espesor de la ZMO registrado en el Pacífico oriental entre 24º N y 28º N es menor respecto a la franja del mínimo de oxígeno dentro del golfo de California. De acuerdo a Hendrickx y Serrano (2010) y al diagrama T-S del TALUD IX, las aguas de la corriente de California no se registran dentro del golfo de California. Esta corriente se ubica entre 48º N y 23º N en el Pacifico oriental, con temperaturas entre 12º y 18º C, salinidades entre 32.5 y 34.5 y ricas en OD y, de acuerdo con Helly y Levin (2004) y Cepeda-Morales et al. (2009), dicha corriente produce que el límite superior de la ZMO se encuentre a mayor profundidad. A lo largo del las secciones longitudinales de OD, se puede observar que la tendencia de la ZMO es ubicarse a menor profundidad hacia el sur de la ZEE, tendencia que concuerda con los resultados de Helly y Levin (2004). El decremento en la profundidad de la zona con hipoxia severa se debe a una mayor influencia del agua superficial tropical, agua “ligera” con temperaturas altas y salinidad relativamente baja, y a la menor influencia hacia el sur del agua del golfo de California en la ZEE. De acuerdo a los diagramas T-S publicados por Hendrickx y Serrano (2010) y al diagrama T-S del Talud IX, la ZMO en su frontera superior se ubicó hacia el sur de la ZEE en planos de σθ cada vez menos densos. Kamykowski y Zentata (1990) enfatizan el espesor y el grado de hipoxia de la ZMO del Pacífico oriental, ubicándola entre la picnoclina y las aguas intermedias. De acuerdo al diagrama TS la ZMO del TALUD IX se localiza en aguas intermedias y la ZMO de los TALUD VII, X y XI no son la excepción. Por otra parte, el diagrama T-S del TALUD IX indica un cambio brusco de densidad en sus aguas por arriba de la ZMO (los diagramas T-S de las campañas TALUD VII y XI presentan un comportamiento similar), indicando una fuerte picnoclina. Fiedler y Talley (2006) atribuyen la drástica deficiencia de oxígeno en el Pacífico La zona del mínimo de oxígeno en el Pacífico mexicano 117 oriental tropical a tres factores: 1) la gran producción de fitoplancton en la superficie; 2) la lenta circulación de aguas profundas que se encuentran por debajo de la picnoclina; y 3) una fuerte picnoclina que inhibe la ventilación local. AGRADECIMIENTOS David Serrano agradece al personal del B/O El Puma por su apoyo y profesionalismo que mostraron en cada una de las campañas TALUD; a Conacyt y a la DGAPA por el apoyo a los proyectos 31805-N y PAPIIT-IN-217306-3, respectivamente. También mi agradecimiento a José Salgado Barragán, Arturo Núñez Pasten y Sergio Rendón Rodríguez, estudiantes y voluntarios que con entusiasmo ayudaron a las maniobras de lance y recuperación del CTD. REFERENCIAS Cepeda-Morales, J., E. Beier, G. Gaxiola-Castro, M. Lavín y V.M. Godinez. 2009. Effect of the oxygen minimum zone on the second chlorophyll maximum. Ciencias Marinas 35: 389-403. Colling A. 2001. Ocean Circulation. The Open University. Oxford, RU. 286 pp. Díaz, R. y Y. Rosenberg. 1995. Marine benthic hypoxia: A review of its ecological effects and the behavioural responses of benthic macrofauna. Oceanography and Marine Biology: an Annual Review 33: 245-303. Fiedler. P y L. Talley. 2006. Hydrography of the eastern tropical Pacific: A review. Progress in Oceanography 69: 143-180. Figueroa-Rodríguez, J.M. 2006. http://www.cicese.edu.mx/int/index.php?mod= proy&op=fproy&id_proy=O0C058&dep=6201. Consultado en diciembre de 2010. Gaxiola-Castro G., S. Álvarez-Borrego, S. Nájera-Martínez y A. R. Zirino. 2002. Efecto de las ondas internas en el fitoplancton del golfo de California. Ciencias Marinas 28: 297-309. Helly, J. J. y L. A. Levin. 2004. Global distribution of naturally occurring marine hypoxia on continental margins. Deep Sea Research Part I 51:1159-1168. Hendrickx, M.E. 2001. Occurrence of a continental slope decapod crustacean community along the edge of the minimum oxygen zone in the southeastern Gulf of California, Mexico. Belgian Journal of Zoology 131 (Suppl. 2): 95-109. Hendrickx, M.E. 2012. Operaciones oceanográficas en aguas profundas: los retos del pasado, del presente y del proyecto TALUD en el Pacífico mexicano (1989-2009). Pp. 118 Biodiversidad y comunidades del talud continental del Pacífico mexicano 23-104. En: P. Zamorano, M.E. Hendrickx y M. Caso (eds.). Biodiversidad y comunidades del talud continental del Pacífico mexicano. Instituto Nacional de Ecología, Secretaría de Medio Ambiente y Recursos Naturales (Semarnat). Hendrickx, M.E. y D. Serrano. 2010. Impacto de la zona de mínimo de oxígeno sobre los corredores pesqueros en el Pacifico mexicano. Interciencia 35:12-18. Kamykowski. D. y S. Zentara S. 1990. Hypoxia in the world ocean as recorded in the historical data set. Deep Sea Research 37: 1861–1874. Lavín, M.F., R. Castro, E. Beier, V.M. Godínez, A. Amador y P. Guest. 2009. SST, thermohaline structure, and circulation in the southern Gulf of California in June 2004 during the North American Monsson Experiment. 2009. Journal of Geophysical Research 114: C02025, doi:10.1029/2008JC004896. León-Chávez, C.A., L. Sánchez-Velasco, E. Beier, M.F. Lavín, V.M. Godínez y J. FärberLorda. 2010. Larval fish assemblages and circulation in the Eastern Tropical Pacific in Autumn and Winter. Journal of Plancton Research 32-4: 397-410. Parker, R.H. 1963. Zoogeography and ecology of some macro-invertebrates, particularly mollusks, in the Gulf of California and the continental slope off Mexico. Vidensk avelige fra Dansk Medd Naturhistorisk Forening 126: 1-178. Reichart, G.L., L.J. Lourens y W.J. Zachariasse. 1998. Temporal variability in the northern Arabian Sea oxygen minimum zone (OMZ) during the last 225,000 years. Paleoceanography. 13: 607–621. Reid, J.L. y A.W. Mantyla. 1978. On the mid-depth circulation of the north Pacific Ocean. Journal of Physical Oceanography. 8: 946–951. Sánchez-Velasco, L., V.M. Godínez-Sandoval, B. Shirasago, y M. Peguero-Icaza. 2004. Informe Técnico 16560. Serie Oceanografía Física. CICESE. México. A1-28. 12 pp. Serrano, D. y M.E. Hendrickx. 2011. Debajo de la zona del mínimo de oxígeno. Investigación y Ciencia 417: 13-15. La zona del mínimo de oxígeno en el Pacífico mexicano 119 Sección II Meiofauna Meiofauna de mar profundo del golfo de California: algunos aspectos acerca de la distribución y abundancia de Copepoda S. Gómez1 y F. N. Morales-Serna2 INTRODUCCIÓN Meiobentos: definición y generalidades Definición En su trabajo acerca de la cadena trófica bentónica de sustratos blandos de las costas de Plymouth, Inglaterra, Mare (1942) reconoció la presencia de una fauna detritívora y predadora que habita los fondos marinos, y sugirió la conveniencia de separarla en tres grupos (macrobentos, meiobentos y microbentos) de acuerdo a su talla o peso, factores a los cuales se asocia también el tiempo generacional (tiempo que les toma a los individuos de cada grupo animal para reproducirse, el cual varía de manera significativa entre los grupos y es importante al definir su papel en la comunidad) (Mare 1942). Sin embargo, antes de la creación de estos 1 2 Instituto de Ciencias del Mar y Limnología, Unidad Académica Mazatlán, Universidad Nacional Autónoma de México, Joel Montes Camarena s/n, Mazatlán 82040, Sinaloa, México. Correo-e: [email protected]. Departamento de Zoología, Instituto de Biología, Universidad Nacional Autónoma de México, Avenida Universidad 3000, Ciudad Universitaria, C.P. 04510, México, D.F. 123 términos ya se conocían grupos animales pertenecientes a lo que Mare (1942) definió como “meiobentos” a través de descripciones taxonómicas/morfológicas de algunos grupos (véase Coull y Giere 1988, Giere 2009). Por su parte, Giard (1904), en su estudio sobre los fondos arenosos de la costa norte de Francia, reconoció una fauna tan rica “que tomaría años estudiarla”. Mare (1942) definió como macrobentos a la macrofauna que habita el fondo incluyendo las macroalgas. Dentro del meiobentos incluyó a los animales de talla intermedia, tales como los copépodos, los cumáceos, los poliquetos de talla pequeña, los nemátodos y los foraminíferos, entre otros, y dentro del microbentos a todos los protozoarios excepto los foraminíferos, las diatomeas bentónicas y las bacterias (Mare 1942). Así mismo, reconoció que los límites exactos de las tallas del macro- meio- y microbentos pueden variar de acuerdo al hábitat y los métodos de recolección, y definió al macro- y meiobentos de acuerdo al tamaño de luz de malla que se usa para separarlos así como de acuerdo a su peso. Así se definió al macrobentos como aquellos organismos que son retenidos por un tamiz con abertura de malla de 1 mm y con un peso desde 1mg hasta 100 mg, al meiobentos como aquellos organismos retenidos por un tamiz con abertura de malla de 0.1 mm y con un peso desde 1 x 10-4 mg hasta 0.05 mg, y al microbentos como aquellos organismos retenidos por un tamiz con abertura de malla menor a 0.1 mm y con un peso desde 1x10-9 mg hasta 1x10-4 mg. Hacia la primera mitad del siglo XX ya era evidente la gran complejidad y la abundancia del meiobentos. Nichols (1935) creó el término “fauna intersticial” en su estudio acerca de los copépodos de las playas arenosas de Escocia, y Remane (1952) analizó detalladamente las adaptaciones morfológicas de la fauna de hábitats particulares (sustratos arenosos, lodosos y algales) creando el término Lebensformtypus (tipo de formas de vida) y reconoció al meiobentos como un grupo de organismos definidos ecológicamente. Actualmente, se considera a la meiofauna como aquellos organismos bentónicos de menor tamaño que la macrofauna, pero de mayor talla que la microfauna, y su intervalo de talla está definida entre 500 µm y 44 µm (Giere 2009). Más recientemente, y sobre la base de estudios del intervalo de tallas de la fauna bentónica, se ha fijado el límite inferior de la meiofauna en 31 µm para incluir hasta los individuos más pequeños de la meiofauna presentes en el mar profundo (Giere 2009). De manera similar que Mare (1942), Hakenkamp et al. (2002) definieron a la meiofauna dulceacuícola como aquellos cuya biomasa oscila entre 2 µg y 20 µg. Giere (2009) sugiere que, además de los pequeños metazoarios tradicionalmente considerados como meio124 Biodiversidad y comunidades del talud continental del Pacífico mexicano fauna, los mayores protozoarios deberían ser incluidos dentro de esta definición debido a las relaciones ecológicas entre éstos. No fue sino hasta las décadas de los años 50 y 60 cuando comenzaron a ser más numerosos los estudios acerca de los factores que regulan la distribución y la abundancia de la meiofauna (componente animal del meiobentos). Durante este periodo dominaron los estudios acerca de la ecología descriptiva del meiobentos y aquellos acerca de la taxonomía de los grupos que la conforman y que habitan ecosistemas costeros. Así mismo, se lograron avances importantes para comprender la forma en que diversos factores abióticos y bióticos regulan la distribución, la densidad y la diversidad de la meiofauna (Coull y Giere 1988), y se sugirió a la meiofauna como un buen indicador de enriquecimiento orgánico (Raffaelli y Mason 1981, Amjad y Gray 1983, Hockin 1983, Lambshead 1984, Mirto et al. 2000, Morales-Serna et al. 2006), hidrocarburos (Millward et al. 2004), metales pesados (Lee y Correa 2005) y pesticidas (Bejarano et al. 2005). Sin embargo, el estudio de la meiofauna del mar profundo no cobró importancia sino hasta finales de la segunda mitad del siglo XX con estudios llevados a cabo en los océanos Atlántico, Pacífico, Ártico, Antártico e Índico, y en el Mediterráneo, en el golfo de México y en el mar Laptev (véase Gutzmann et al. 2004, Baguley et al. 2006, 2008, Morse y Beazley 2008, Gheerardyn y Veit-Köhler 2009). Variación de la densidad de la meiofauna con la profundidad En general, se ha observado que la respiración (Baguley et al. 2008) así como la densidad total de la meiofauna tienden a disminuir con la profundidad (Herman y Dahms 1992, Tietjen 1992, Fabiano y Danovaro 1999, Danovaro et al. 2000, Gutzmann et al. 2004, Tselepides y Lampadariou 2004, Shimanaga et al. 2007). Sin embargo, no todos los taxa responden de la misma manera. Este patrón de disminución de la densidad con la profundidad ha sido observado para el caso de Nematoda y Copepoda (Herman y Dahms 1992, Tietjen 1992, Fabiano y Danovaro 1999, Gutzmann et al. 2004) al igual que para Kinorhyncha y Tardigrada (Gutzmann et al. 2004), y puede no observarse ocasionalmente para el caso de los nauplios de Copepoda y en Loricifera y Tantulocarida, mientras que la densidad de otros grupos (i.e., Gastrotricha) puede aumentar con el incremento de la profundidad (Gutzmann et al. 2004). M eiofauna de mar profundo del golfo de C alifornia 125 Por lo general, la densidad de la meiofauna del mar profundo oscila desde 2731 ind/10 cm2 a 2290 m de profundidad hasta 75 ind/10 cm2 a 3597 m de profundidad (Danovaro et al. 2000, Gutzmann et al. 2004), aunque se han observado densidades aún menores que van desde 4-40 ind/10 cm2 a 2883 m y 987 m de profundidad respectivamente, en el mar Mediterráneo (Vanhove et al. 1995: 73, Table 5, Danovaro et al. 2000, Tselepides y Lampadariou 2004). Por lo general, los grupos más frecuentes y abundantes son Nematoda (84-94 %) y Copepoda (2-8 %) (Shirayama 1984, Heip et al. 1985, Pfannkuche 1985, Tietjen et al. 1989, Vanhove et al. 1995, 2000, Danovaro et al. 2000, Gutzmann et al. 2004, Van Gaever et al. 2004), seguidos de Kinorhyncha, Loricifera, Tantulocarida, Ostracoda y Tardigrada (Gutzmann et al. 2004). Se ha sugerido que la disminución de la densidad total de la meiofauna con la profundidad se debe al decremento de materia orgánica a través de la degradación bacteriana que tiene lugar desde la zona eufótica hasta el fondo marino (Danovaro et al. 2000, Gutzmann et al. 2004, Gambi y Danovaro 2006). El efecto del aporte insuficiente de materia orgánica se ve magnificado también por otros factores como la alta presión y por los largos periodos de inanición (Thurston et al. 1994, Cook et al. 2000, Gooday et al. 2001, Cartes et al. 2002, Smith et al. 2002, Gutzmann et al. 2004, Vanhove et al. 2004). Sin embargo, algunos autores (i.e., Danovaro et al. 2002, Valdovinos et al. 2003) han encontrado muy altas biomasas en algunos sitios del mar profundo, lo que, de acuerdo con Gambi y Danovaro (2006), cuestiona el paradigma actual acerca de la disminución de la biomasa y de la abundancia de la meiofauna con el aumento de la profundidad. Evidentemente, los estudios enfocados a los patrones de la distribución de la fauna del mar profundo dependientes de la profundidad no han logrado explicar la importancia relativa de la presión, de la disponibilidad de alimento y de otras variables involucradas en los procesos bentónicos, principalmente por su naturaleza interdependiente (véase Gambi y Danovaro 2006). A este respecto, Baguley et al. (2006) y Tselepides y Lampadariou (2004) observaron que la proximidad de la desembocadura de ríos, así como las corrientes y la topografía del fondo marino, son factores importantes que pueden incrementar el flujo de materia orgánica particulada desde la superficie hasta el fondo marino, favoreciendo la presencia de sitios con densidades de meiofauna inusualmente elevadas. Por otro lado, se ha observado que, a pesar de las bajas concentraciones de oxígeno en la Zona de Mínimo Oxígeno (ZMO), la densidad de la meiofauna es por lo general elevada, la riqueza específica es baja y la dominancia es alta. Esto 126 Biodiversidad y comunidades del talud continental del Pacífico mexicano se debe probablemente a la alta tolerancia a la hipoxia que presentan algunos taxa (i.e., los nemátodos, los foraminíferos y los anélidos son más tolerantes a la hipoxia que los copépodos harpacticoides) y a la abundancia de alimento (bacterias de los géneros Thioploca, Beggiatoa, Thiomargarita) (Levin 2003). Con respecto a este último, el flujo de materia orgánica hacia el fondo parece ser mayor en sistemas con bajas concentraciones de oxígeno disuelto, lo que se atribuye a una disminución de la tasa de oxidación de la materia orgánica en la ZMO (Levin 2003) debido a la ineficiente descomposición microbiana anaeróbica (Fenchel y Finlay 1995), resultando en altas concentraciones de fitodetritos (carbono y nitrógeno orgánicos) (Levin 2003, Pfannkuche et al. 2000, Beaulieu 2002), llegando a alcanzar valores desde 3-6 % de carbono orgánico particulado (COP) hasta valores excepcionalmente altos de 15-20 % COP (Rosenberg et al. 1983, Levin y Gage 1998, Cowie et al. 1999, Neira et al. 2001). Evidentemente, esto favorecería el incremento de la densidad de la meiofauna en sitios con bajas concentraciones de oxígeno (Levin et al. 1991, Levin 2003). Por lo general, la diversidad en el mar profundo es elevada, mientras que la dominancia de especies es baja (Seifried 2004, Rose et al. 2005) y debajo de la plataforma continental (>200 m de profundidad) la diversidad de especies incrementa hasta un máximo en la zonas batiales baja y media, para luego decrecer de nuevo en la zona abisal (>4000 m de profundidad) (Gage y Tyler 1991) . Material y métodos El muestreo se realizó a bordo del B/O El Puma durante el crucero TALUD IV en agosto del 2000 y las muestras se tomaron en 19 estaciones distribuidas frente a las costas de Sinaloa. En cada estación se tomaron muestras de sedimentos con un nucleador de gravedad equipado con seis núcleos de 31.5 cm de longitud y 2.5 cm de diámetro interno. Los núcleos obtenidos se destinaron al análisis faunístico (3 núcleos), la determinación de la concentración de materia orgánica (1 núcleo) y el análisis granulométrico (1 núcleo). Una vez tomadas las muestras de sedimento, se congelaron y cada núcleo se abrió longitudinalmente para recuperar solo los 3 cm más superficiales de cada muestra. Las muestras destinadas al análisis faunístico se fijaron con una solución de formalina al 10 % y rosa de bengala. Posteriormente, se separó la macrofauna y la meiofauna de cada muestra con tamices de 500 µm y 40 µm. La meiofauna (el material retenido en el tamiz de 40 µm) se preservó M eiofauna de mar profundo del golfo de C alifornia 127 en frascos con una solución de alcohol etílico al 70 %. Posteriormente, con ayuda de un microscopio estereoscópico se extrajeron los copépodos de cada muestra. El material de cada muestra se almacenó en viales debidamente etiquetados y se preservó en una solución de alcohol etílico al 70 % hasta su posterior identificación. La determinación de la concentración de materia orgánica en las muestras de sedimento se realizó a través de la oxidación de la materia orgánica con dicromato de potasio y titulación con sulfato ferroso amoniacal (Loring y Rantala 1977). La composición granulométrica de los sedimentos se realizó de acuerdo al método propuesto por Folk (1974) y la concentración de oxígeno disuelto se determinó mediante el método Winkler a partir de muestras de agua tomadas mediante botellas Van Dorn adaptadas a la Rosette del CTD, las cuales fueron disparadas 10 m por encima del fondo. Se utilizó el análisis de varianza no paramétrico de Kruskal-Wallis para verificar la existencia de diferencias significativas de la densidad de copépodos bentónicos. El cálculo del coeficiente de correlación de Spearman para datos no paramétricos se empleó para determinar la correlación entre los factores ambientales, la densidad y la riqueza específica de copépodos. Se realizaron análisis de correspondencia canónica entre las especies dominantes y frecuentes, y las variables ambientales. La dominancia se obtuvo mediante la fórmula: Dm= (ni/N) x 100 en donde Dm es el índice de dominancia media, ni es el número de individuos de la especie i y N es el número total de individuos (Picard 1965). La frecuencia se obtuvo a partir de la fórmula: F= (mi x 100)/M en donde mi es el número de muestras en las cuales apareció la especie i, y M es el número total de muestras (Glémarec 1964). Una especie se consideró dominante y frecuente cuando Dm ≥ 1 y F ≥10. 128 Biodiversidad y comunidades del talud continental del Pacífico mexicano Resultados y discusión Meiobentos: el caso de Copepoda Variación de la densidad de los copépodos con la profundidad: el caso del golfo de California Los copépodos pueden llegar a superar a los nemátodos en sustratos biogénicos duros (Raes y Vanreusel 2005) y blandos (Tselepides y Lampadariou 2004). A pesar de la importancia de los copépodos del mar profundo, el conocimiento de sus especies y los factores que regulan su distribución es aún muy limitado (Seifried 2004, Gheerardyn y Veit-Köhler 2009). Sin embargo, la variación de la diversidad y de la densidad de los copépodos con el incremento de la profundidad puede comprenderse mejor analizando el comportamiento de la meiofauna, de la cual Copepoda es uno de los grupos dominantes. En las muestras de sedimento recolectadas en una serie de estaciones en el sur del golfo de California durante el crucero oceanográfico TALUD IV (Fig. 1) en agosto del año 2000, se registraron densidades de copépodos bentónicos desde 0 ind/10 cm2 hasta 2.37 ind/10 cm2 en profundidades desde 500 m hasta 745 m, y desde 0 ind/10 cm2 hasta valores máximos de 47.47 ind/10 cm2 a profundidades desde 800 m hasta 2120 m (Cuadro 1). Danovaro et al. (2000) registraron densidades de copépodos desde 8.3 ind/10 cm2 hasta 27.3 ind/10 cm2 a 500 m de profundidad, desde 5.7 ind/10 cm2 hasta 17.9 ind/10 cm2 a 700 m de profundidad, desde 4.5 ind/10 cm2 hasta 14.2 ind/10 cm2 a 940 m de profundidad y desde 4.2 ind/10 cm2 hasta 5.5 ind/10 cm2 a 1540 m de profundidad durante el periodo agosto de 1994–septiembre de 1995. Las densidades observadas en el golfo de California son ligeramente inferiores a las reportadas por Danovaro et al. (2000) para la costa noreste del mar Mediterráneo. Es muy probable que estas diferencias se deban a los equipos de muestreo empleados en ambos estudios. La densidad de copépodos bentónicos del golfo de California presenta una correlación positiva con la profundidad. La densidad total de estos organismos tiende a incrementarse a partir de 1050 m de profundidad (se asume que su densidad disminuiría desde la plataforma continental), punto a partir del cual permanece relativamente constante, con excepción de la estación 35 ubicada a 2020 m de profundidad en donde se registró un máximo de 47.47 ind/10 cm2 (Cuadro 1, Fig. 2A). M eiofauna de mar profundo del golfo de C alifornia 129 Figura 1. Estaciones de muestreo visitadas durante el crucero oceanográfico TALUD IV, agosto 2000. La eventual disminución de la densidad de los copépodos bentónicos desde la plataforma continental puede explicarse por la menor disposición de alimento en esta zona debido a la degradación bacteriana que tiene lugar desde la zona eufótica hasta el fondo marino (Danovaro et al. 2000, Gutzmann et al. 2004, Gambi y Danovaro 2006). Por otro lado, el incremento de la densidad de copépodos bentónicos a partir de los 1050 m de profundidad pareciera, según lo indican Gambi y Danovaro (2006), contradecir el paradigma actual acerca de la disminución de la biomasa y de la abundancia de la meiofauna con el aumento de la profundidad, de lo cual, otros factores interdependientes aún no analizados (i.e., presión, tasas de degradación, aporte de materia orgánica a través de ríos y corrientes, y topografía del fondo marino) parecen ser los responsables (Tselepides y Lampadariou 2004, Baguley et al. 2006). 130 Biodiversidad y comunidades del talud continental del Pacífico mexicano M eiofauna de mar profundo del golfo de C alifornia 131 106º23’9” 106º27’9” 106º34’6” 106º40’2” 106º47’8” 107º28’4” 107º36’44” 108º10’9” 108º17’4” 108º24’7” 108º35’1” 108º53’3” 109º05’1” 109º10’5” 109º35’2” 109º39’9” 109º42’1” 109º46’3” 101º00’0” 1 3 4 5 6 12 14 17 18 19 20 24 26 27 28 31 32 33 35 21º59’4” 21º59’6” 22º00’5” 22º01’2” 22º00’50” 23º14’8” 23º14’82” 24º14’69” 24º15’7” 24º16’0” 24º20’2” 24º58’0” 24º56’4” 25º00’0” 24º50’9” 25º46’03” 25º46’01” 25º46’3” 25º55’3” Long. Estación Lat. 500 745 1260 1540 1970 1045 2120 600 960 1240 1510 500 1235 1565 2120 635 800 1040 2020 Prof. (m) 0.33 0.19 0.84 0.60 2.44 0.23 0.73 1.26 0.18 0.76 1.32 2.20 0.79 0.25 0.51 1.68 4.62 6.70 4.22 3.90 4.51 2.65 4.46 4.05 3.82 3.97 4.33 4.19 4.09 4.40 5.20 4.18 3.81 4.24 4.22 66.67 1.53 7.98 1.57 2.34 40.87 8.25 6.83 5.98 7.72 15.97 0 - 0 32.82 0 88.58 58.59 13.14 0 31.06 17.09 50.34 42.02 0 - O2 CO % Granulometría disuelto Arena (%) Limo (%) ml l-1 33.33 65.65 92.02 9.84 39.06 45.99 91.74 62.11 76.92 41.95 42.02 100 - Arcilla (%) 0.00 1.18 2.72 11.83 11.54 0.00 0.00 2.37 0.00 4.75 0.00 0.00 10.18 3.39 6.11 0.00 0.00 1.18 47.47 Densidad media de copépodos (ind/10 cm2) 0 1 4 8 11 0 0 1 0 6 0 0 11 8 6 0 0 1 5 No. de especies Cuadro 1. Localización de las estaciones de muestreo visitadas durante el crucero oceanográfico TALUD IV en agosto de 2000 y variables abióticas y bióticas registradas. CO, Carbono orgánico.. El aumento de la densidad de copépodos bentónicos desde 1050 m hasta 2020 m de profundidad puede atribuirse, como sugiere Levin (2003), por un incremento en la disponibilidad de alimento en sitios con bajas concentraciones de oxígeno. Esta alta disponibilidad de alimento en sitios con bajas concentraciones de oxígeno puede ser favorecida por la ineficiente descomposición microbiana anaeróbica, resultando en sedimentos con altas concentraciones de carbono orgánico particulado (Rosenberg et al. 1983, Fenchel y Finlay 1995, Levin y Gage 1998, Cowie et al. 1999, Pfannkuche et al. 2000, Neira et al. 2001, Beaulieu 2002, Levin 2003). Sin embargo, la densidad total de copépodos bentónicos, así como el número de especies halladas en las muestras recolectadas en el golfo de California durante el crucero oceanográfico TALUD IV, no se correlacionan con la concentración de oxíFigura 2. Variación de la densidad de copépodos bentónicos (A) y del número de taxa (B) con respecto a la profundidad. Densidad (ind/10 cm2) A Núm. de especies, géneros y familias Profundidad B Profundidad 132 Biodiversidad y comunidades del talud continental del Pacífico mexicano geno disuelto, lo que sugiere que este factor no es determinante en la variación de la densidad y de la diversidad de este grupo de crustáceos. Como se mencionó anteriormente, la diversidad de especies tiende a ser mayor a profundidades mayores de 200 m, alcanzando valores máximos en la zona batial, y tiende a disminuir de nuevo a profundidades mayores a 4000 m (Gage y Tyler 1991). De manera similar, el número de especies de las muestras de sedimentos tomadas durante el crucero TALUD IV en el golfo de California (Cuadro 1, Fig. 2B), es relativamente baja y se mantiene más o menos constante a profundidades desde 500 m hasta 1045 m (se asume que estos valores son mayores en zonas más someras de la plataforma continental y disminuye conforme aumenta la profundidad), para luego incrementarse de manera abrupta y mantenerse relativamente constante desde los 1253 m hasta los 2120 m de profundidad. Sin embargo, no se observaron correlaciones entre la densidad total de copépodos bentónicos y la concentración de materia orgánica, ni entre la concentración de materia orgánica y la profundidad, sugiriendo que deben ser otros factores que regulan estas variaciones. Por otro lado, el número de especies de copépodos bentónicos del golfo de California se correlaciona positivamente con el contenido de limos y, por el contrario, no se observó ninguna correlación con el contenido de materia orgánica, ni la concentración de arena y arcilla en el sedimento. En sitios del mar profundo como en Porcupine Seabight, Gheerardyn et al. (2009, 2010) encontraron que las familias Ameiridae, Argestidae, Ectinosomatidae, Miraciidae y Pseudotachidiidae fueron las más abundantes. De manera similar, Rose et al. (2005) señala como las más abundantes a las familias Pseudotachidiidae, Argestidae, Ameiridae, Ectinosomatidae y Neobradyidae en la cuenca de Angola a 5400 m de profundidad, y Ahnert y Schriever (2001) citaron como las más abundantes a Ameiridae, Ectinosomatidae, Argestidae, Zosimidae y Neobradyidae en el océano Pacífico sureste, mientras que Shimanaga et al. (2004) registraron como las más abundantes a Miraciidae, Ectinosomatidae, Ameiridae, Idyanthidae y Zosimidae en la bahía Sagami, a 1430 m de profundidad. Por su parte, George y Schminke (2002) observaron que los taxa supraespecíficos más abundantes en la montaña sumergida Great Meteor, a 270 m de profundidad, pueden llegar a ser Paramesochridae, Ectinosomatidae, Diosaccidae, Miraciidae y Tisbidae, y que Argestidae puede estar representado por un número elevado de géneros y especies. En las muestras tomadas en el golfo de California se ha observado que las familias Ameiridae, Argestidae, Canthocamptidae, Cerviniidae, Cletodidae, M eiofauna de mar profundo del golfo de C alifornia 133 Pseudotachidiidae, Ectinosomatidae, Miraciidae, Neobradyidae y Tisbidae son las más abundantes y frecuentes (Cuadro 2). Cuadro 2. Número medio de individuos de cada especie encontrada en las estaciones de muestreo durante el crucero oceanográfico TALUD IV en agosto de 2000. Est., estación de muestreo. Familia Género Especie Est. (ind/10 cm2) Orden: Harpacticoida Ameiridae Monard, 1928 Limameira Soyer, 1975 sp1 sp1 27 (0.68) 4 (0.68), 27 (0.68) sp2 sp1 sp1 sp2 sp2 sp1 sp1 6 (1.36) 35 (35.64) 26 (1.36) 5 (1.18) 35 (4.73) 5 (1.18) 33 (1.18) Sicameira Klie, 1950 Mesocletodes Sars, 1909 Argestidae Por, 1986 Argestigens Willey, 1935 Parargestes Lang, 1944 Ancorabolidae Sars, 1909 Género 1 Canthocamptidae Sars, Mesochra Boeck, 1865 1906 Moraria T. Scott y A. Scott, 1893 Cerviniidae Sars, 1903 Género 1 Cletodidae T. Scott, 1905 Cletodes Brady, 1872 Bradya Boeck, 1873 Ectinosoma Boeck, 1865 Ectinosomatidae Sars, 1903 Halectinosoma Lang, 1944 Microsetella Brady y Robertson, 1873 Pseudobradya Sars, 1904 134 sp1 sp1 sp1 sp1 sp2 sp3 sp1 sp1 sp2 sp1 6 (0.68) 28 (0.68) 5 (1.18), 6 (0.68) 26 (0.68) 26 (0.68) 28 (1.36) 28 (0.68) 6 (0.68) 35 (3.55) 19 (0.68), 26 (1.36) sp2 4 (0.68) sp3 6 (0.68) sp4 6 (1.36) M. rosea 26 (0.68), 17 (Dana, (2.37) 1848) sp1 28 (2.72) sp2 26 (0.68) Biodiversidad y comunidades del talud continental del Pacífico mexicano Cuadro 2. Continúa Familia Género Especie Est. (ind/10 cm2) Bulbamphiascus Lang, 1944 Robertgurneya Lang, 1944 Amphiascoides Nicholls, 1941 Haloschizopera Lang, 1944 Delavalia Brady, 1869 sp1 sp1 sp1 sp1 sp2 sp1 sp1 sp2 sp1 Marsteinia Drzycimski, 1968 sp2 sp1 Género 1 Normanella Brady, 1880 sp1 sp1 26 (1.36) 5 (2.37) 6 (0.68), 26 (0.68) 19 (0.68) 26 (1), 5 (2.37) 27 (0.68) 27 (0.68) 6 (1.36) 19 (0.68), 26 (1.36) 19 (0.68) 28 (0.68), 5 (1.18), 4 (0.68) 35 (2.37) 5 (1.18) Parameiropsis Becker, 1974 sp1 6 (1.36) Fladenia Gee y Huys, 1990 sp1 Dactylopodopsis Sars, 1911 sp1 27 (0.68), 26 (0.68) 19 (0.68) Peresime Dinet, 1974 sp1 sp2 sp1 sp1 sp1 sp1 19 (1.36) 4 (0.68) 35 (1.18) 6 (2.72) 5 (1.18) 3 (1.18) Miraciidae Dana, 1846 Paramphiascopsis Lang, 1944 Pseudomesochra T. Scott, 1902 Neobradyidae Olofson, 1917 Normanellidae Lang, 1944 Parameiropsidae Corgosinho & Martínez Arbizu, 2010 Pseudotachidiidae Lang, 1936 Thalestridae Sars, 1905 Tisbidae Stebbing, 1910 Familia no identificada Orden: Cyclopoida Cyclopidae Dana, 1846 Tachidiella Sars, 1909 Zosime Boeck, 1873 Género 1 Halicyclops Norman, 1903 M eiofauna de mar profundo del golfo de C alifornia 135 Diversos autores (i.e., Hicks y Coull 1983, Seifried 2004, Gheerardyn et al. 2009) han observado que, en general, géneros como Bradya, Eurycletodes, Malacopsyllus, Marsteinia, Mesocletodes, Pseudomesochra y Zosime son típicos del mar profundo, y que la diversidad de especies (reflejada en la diversidad de formas del cuerpo de los diferentes taxa de harpacticoides) así como la estructura de la comunidad, puede estar regulada, por lo menos en parte, por el tipo de fondo (diferentes grados de heterogeneidad ambiental) (Jumars y Eckman 1983, Eckman y Thistle 1988, Thistle y Eckman 1990, Vincx et al. 1994, Thistle et al. 1999, Raes y Vanreusel 2006, Gambi y Danovaro 2006, Gheerardyn et al. 2009, 2010), así como por las características geoquímicas del sedimento y la epifauna presente (Van Gaever et al. 2009). En las muestras del golfo de California tomadas durante el TALUD IV, se observó que los géneros Amphiascoides, Argestigens, un género no descrito de Cerviniidae, Cletodes, Delavalia, Ectinosoma, Fladenia, Halectinosoma, Haloschizopera, Marsteinia, Microsetella, Peresime, Pseudobradya, Pseudomesochra y Sicameira son los más abundantes y frecuentes (Cuadro 2). Cabe mencionar que estas muestras no han sido identificadas a nivel especie y es posible que gran parte de ellas sean nuevas. La descripción de estas especies será el tema de contribuciones futuras y, por el momento, se ha decidido únicamente identificarlas a nivel de la unidad taxonómica operacional, esto es, identificar las especies diferentes sin asignarles un nombre y hacer referencia a ellas solamente como “sp1”, “sp2”, etc. Así, las especies más abundantes y frecuentes encontradas en el golfo de California son Amphiascoides sp1, una especie no descrita de Cerviniidae, Delavalia sp1, Fladenia sp1, Halectinosoma sp1, Haloschizopera sp2, Marsteinia sp1, Microsetella rosea y Sicameira sp1. La densidad de las especies más abundantes y frecuentes parece estar regulada por la concentración de materia orgánica y por la profundidad (Fig. 3). En este caso, la concentración de oxígeno disuelto, así como la granulometría del sedimento, juegan un papel menos importante. La densidad de Marsteinia sp1, Sicameira sp1, Amphiascoides sp1, Halectinosoma sp1 y Delavalia sp1 parece estar regulada principalmente por la concentración de materia orgánica y por la concentración de oxígeno de las estaciones 27, 20 y 19, mientras que las densidades de Haloschizopera sp2 y de la especie no descrita de Cerviniidae parecen estar regidas principalmente por la concentración de limos y por la profundidad de las estaciones 5 y 6. Microsetella rosea parece estar confinada a estaciones con una alta concentración de arenas (estación 17). Hasta la fecha se han realizado otros nueve cruceros de la serie TALUD (TALUD V-XIII). Los muestreos de los últimos cruceros se han mejorado tomando submues136 Biodiversidad y comunidades del talud continental del Pacífico mexicano Figura. 3. Análisis de correspondencias canónicas de las especies más frecuentes y abundantes (DM ≥ 1; F ≥ 10) de copépodos bentónicos encontrados en las estaciones de muestreo durante el crucero oceanográfico TALUD IV. Especies: Am1, Amphiascoides sp1; Ce1, Cerviniidae Gen1 sp1; De1, Delavalia sp1; Fl1, Fladenia sp1; Ha1, Halectinosoma sp1; Halo2, Haloschizopera sp2; Ma1, Marsteinia sp1; Mir, Microsetella rosea; Si1, Sicameira sp1. Variables ambientales: MO, concentración de materia orgánica (C%); Prof, profundidad; Are, % arenas; Li, % limos; Arc, % arcillas; Ox, oxígeno disuelto. M eiofauna de mar profundo del golfo de C alifornia 137 tras de mayor tamaño (63.6 cm2) que las tomadas en los primeros cruceros (4.9 cm2) haciendo uso de un nucleador de caja con el cual se han obtenido muestras relativamente poco perturbadas. Con toda probabilidad, el análisis de las muestras del resto de los cruceros oceanográficos de la serie TALUD revelarán datos interesantes acerca de la distribución y de la variación de la densidad de la meiofauna y en particular de los copépodos bentónicos del mar profundo del golfo de California y del SO de México. AGRADECIMIENTOS Los autores agradecen a la UNAM por le tiempo de uso del B/O El Puma otorgado al grupo de científicos durante el crucero TALUD IV. Se agradece también a la tripulación y a los estudiantes por el apoyo proporcionado durante los muestreos. Esta es una contribución al proyecto TALUD financiado en parte por el Consejo Nacional de Ciencia y Tecnología (proyecto Conacyt 31805). Referencias Amjad, S. y J.S. Gray. 1983. Use of the nematode-copepod ratio as index of organic pollution. Marine Pollution Bulletin 14: 78-181. Ahnert, A. y G. Schriever. 2001. Response of abyssal Copepoda Harpacticoida (Crustacea) and other meiobenthos to an artificial disturbance and its bearing on future mining for polymetallic nodules. Deep-Sea Research II 48: 3779-3794. Baguley, J.G., P.A. Montagna, L.J. Hyde, R.D. Kalke y G.T. Rowe. 2006. Metazoan meiofauna abundance in relation to environmental variables in the northern Gulf of Mexico deep sea. Deep-Sea Research I 53: 1344-1362. Baguley, J.G., P.A. Montagna, L.J. Hyde y G.T. Rowe. 2008. Metazoan meiofauna biomass, grazing, and weight-dependent respiration in the Northern Gulf of Mexico deep sea. Deep-Sea Research II 55: 2607-2616. Beaulieu, S.E. 2002. Accumulation and fate of phytodetritus on the sea floor. Oceanography and Marine Biology: an Annual Review 40: 171–232. Bejarano, A.C., P.L. Pennington, M.E. DeLorenzo y G.T. Chandler. 2005. Atrazine effects on meiobenthic assemblages of a modular estuarine mesocosm. Marine Pollution Bulletin 50: 1398-1404. Cartes, J.E., A. Grémare, F. Maynou, S. Villora-Moreno y A. Dinet. 2002. Bathymetric changes in the distributions of particulate organic matter and associated fauna along 138 Biodiversidad y comunidades del talud continental del Pacífico mexicano a deepsea transect down the Catalan sea slope (north-western Mediterranean). Progress in Oceanography 53: 29–56. Cook, A.A., P.J.D. Lambshead, L.E. Hawkins, N. Mitchell y L.A. Levin. 2000. Nematode abundance at the oxygen minimum zone in the Arabian Sea. Deep-Sea Research II 47: 75–85. Coull, B.C. y O. Giere. 1988. The history of meiofaunal research. Pp. 14-17. En: R.P. Higgins y H. Thiel (eds.). Introduction to the study of meiofauna. Smithsonian Institution Press, Washington, D. C. Cowie, G.L., S.E. Calvert, T.F. Pedersen, H. Schulz y U. von Rad, U. 1999. Organic content and preservational controls in surficial shelf and slope sediments from the Arabian Sea (Pakistan margin). Marine Geology 161: 23–38. Danovaro, R., A. Tselepides, A. Otegui y N. Della Croce. 2000. Dynamics of meiofaunal assemblages on the continental shelf and deep-sea sediments of the Cretan Sea (NE Mediterranean): relationships with seasonal changes in food suply. Progress in Oceanography 46: 367-400. Danovaro, R., C. Gamby, N. Della Croce. 2002. Meiofauna hotspot in the Atacama Trench (Southern Pacific Ocean). Deep-Sea Research I 49: 843–857. Eckman, J.E. y D. Thistle. 1988. Small-scale spatial pattern in meiobenthos in the San Diego Trough. Deep-Sea Research 35: 1565–1578. Fabiano, M. y R. Danovaro. 1999. Meiofauna distribution and mesoscale variability in two sites of the Ross Sea (Antarctica) with contrasting food supply. Polar Biology 22: 115-123. Fenchel, T. y B.J. Finlay. 1995. Ecology and evolution in anoxic worlds. Nueva York: Oxford University Press. 288 pp. Folk, R.L. 1974. Petrology of sedimentary rocks. Hemphills Pub. Co., Austin, Texas. 151 pp. Gage, J.D. y P.A. Tyler. 1991. Deep-sea biology:a natural history of organisms at the deepsea floor. Cambridge: Cambridge University Press. 534 pp. Gambi, C. y R. Danovaro. 2006. A multiple-scale analysis of metazoan meiofaunal distribution in the deep Mediterranean Sea. Deep-Sea Research I 53: 1117-1134. George, K.H. y H.K. Schminke. 2002. Harpacticoida (Crustacea, Copepoda) of the Great Meteor Seamount, with first conclusions as to the origin of the plateau fauna. Marine Biology 144: 887-895. Gheerardyn, H. y G. Veit-Köhler. 2009. Diversity and large-scale biogeography of Paramesochridae (Copepoda, Harpacticoida) in South Atlantic abyssal Plains and the deep Southern Ocean. Deep-Sea Research I 56: 1804-1815. Gheerardyn, H., M. De Troch, M. Vincx y A. Vanreusel. 2009. Harpacticoida (Crustacea : Copepoda) associated with cold-water coral substrates in the Porcupine Seabight (NE M eiofauna de mar profundo del golfo de C alifornia 139 Atlantic): species composition, diversity and reflections on the origin of the fauna. Scientia Marina 73:7 47-760. Gheerardyn, H., M. De Troch, M. Vincx y A. Vanreusel. 2010. Diversity and community structure of harpacticoid copepods associated with cold-water coral substrates in the Porcupine Seabight (North-East Atlantic). Helgoland Marine Research 64: 53-62. Giard, A. 1904. Sur une faunule charactéristique des sables à Diatomées d’Ambleteuse. Compte Rendu des Séances de la Société de Biologie, Paris 56: 107-165. Giere, O. 2009. Meiobenthology. The microscopic motile fauna of aquatic sediments. Springer-Verlag, Berlín. 527 pp. Glémarec, M. 1964. Bionomie benthique de la partie orientale du Golfe de Morbihan. Cahiers de Biologie Marine 5: 33-96. Gooday, A.J., J.A. Hughes y L.A. Levin. 2001. The foraminiferan macrofauna from three North Carolina (USA) slope sites with contrasting carbon flux: a comparison with the metazoan macrofauna. Deep-Sea Research I 48: 1709–1739. Gutzmann, E., P. Martínez Arbizu, A. Rose y G. Veit-Köhler. 2004. Meiofauna communities along an abyssal depth gradient in the Drake Passage. Deep-Sea Research II 51: 1617-1628. Hakenkamp, C. C., A. Morin y D. L. Strayer. 2002. The functional importance of freshwater meiofauna. Pp. 321-355. En: S.D. Rundle, A.L. Robertson y J.M. Schmid-Araya (eds.). Freshwater meiofauna: biology and ecology. Backhuys, Leiden. Heip, C., M. Vincx y G. Vranken. 1985. The ecology of marine nematodes. Oceanography and Marine Biology: an Anual Review 23: 399-489. Herman, R.L. y H.U. Dahms. 1992. Meiofauna communities along a depth transect off Halley Bay (Weddel Sea-Antarctica). Polar Biology 12: 313-320. Hicks, G.R.F. y B.C. Coull. 1983. The ecology of marine meiobenthic harpacticoid copepods. Oceanography and Marine Biology: an Annual Review 21: 67-175. Hockin, D.C. 1983. The effects of organic enrichment upon a community of meiobenthic harpacticoid copepods. Marine Environmental Research 10: 45-58. Jumars, P.A. y J.E. Eckman. 1983. Spatial structure within deep-sea benthic communities. Pp. 399-451. En: G.T. Rowe (ed.). The Sea, vol. 8. Wiley, New York. Lambshead, P.J.D. 1984. The nematode/copepod ratio : some anomalous results from the Firth of Clyde. Marine Pollution Bulletin 15: 256-259. Lee, M.R. y J.A. Correa. 2005. Effects of copper mine tailings disposal on litoral meiofaunal assemblages in the Atacama region of Northern Chile. Marine Environmental Research 59: 1-18. 140 Biodiversidad y comunidades del talud continental del Pacífico mexicano Levin, L.A. 2003. Oxygen minimum zone benthos: adaptations and community response to hypoxia. Oceanography and Marine Biology: an Annual Review 41: 1-45. Levin, L.A. y J.D. Gage. 1998. Relationships between oxygen, organic matter and the diversity of bathyal macrofauna. Deep-Sea Research 45: 129–163. Levin, L.A., C.L. Huggett y K.F. Wishner. 1991. Control of deep-sea benthic community structure by oxygen and organic-matter gradients in the eastern Pacific Ocean. Journal of Marine Research 49: 763-800. Loring, D.H. y R.T.T. Rantala. 1977. Geochemical analysis of marine sediments and suspended particulate matter. Technical Report 700: 1-58. Mare, M.F. 1942. A study of a marine benthic community with special reference to the micro-organisms. Journal of the Marine Biology Association of the United Kingdom 25: 517-554. Millward, R.N., K.R. Carman, J.W. Fleeger, R.P. Gambrell y R.Portier. 2004. Mixtures of metals and hydrocarbons elicit complex responses by a benthic invertebrate community. Journal of Experimental Marine Biology and Ecology 310: 115130. Mirto, S., T. La Rosa, R. Danovaro y A. Mazzola. 2000. Microbial and meiofaunal response to intensive mussel-farm biodeposition in coastal sediments of the Western Mediterranean. Marine Pollution Bulletin 40: 244-252. Morales-Serna, F.N., S. Gómez y I.M. Bustos Hernández. 2006. Spatial and temporal variation of taxonomic composition and species richness of benthic copepods (Cyclopoida and Harpacticoida) along a polluted coastal system from north-western Mexico during two contrasting months. Pp. 41-59. En: M.E. Hendrickx (ed.). Contributions to the study of East Pacific crustaceans 4(1). [Contribuciones al Estudio de los Crustáceos del Pacífico Este 4(1)]. Instituto de Ciencias del Mar y Limnología, UNAM, México. Morse, J.W. y M.J. Beazley. 2008. Organic matter in deepwater sediments of the Northern Gulf of Mexico and its relationship to the distribution of benthic organisms. Deep-Sea Research II 55: 2563-2571. Neira, C., J. Sellanes, L.A. Levin y W. Arntz. 2001. Meiofaunal distributions on the Peru margin: relationship to oxygen and organic matter availability. Deep-Sea Research 48: 2453–2472. Nichols, A.G. 1935. Copepods from the interstitial fauna of a sandy beach. Journal of the Marine Biological Society of the United Kingdom 20: 379-405. Pfannkuche, O. 1985. The deep-sea meiofauna of the Porcupine Seabight and abyssal plain (NE Atlantic): population structure, distribution, standing stocks. Oceanologica Acta 8: 343-353. M eiofauna de mar profundo del golfo de C alifornia 141 Pfannkuche, O., S. Sommer y A. Kahler. 2000. Coupling between phytodetritus deposition and the small-sized benthic biota in the deep Arabian Sea: analyses of biogenic sediment compounds. Deep-Sea Research II 47: 2805–2833. Picard, J. 1965. Recherches qualitatives sur les biocénoses marines des substrats meubles dragables de la region marsellaise. Recueil des Travaux de la Station Marine d’Endoume 36: 1-160. Raes, M. y A. Vanreusel. 2005. The metazoan meiofauna associated with a coldwater coral degradation zone in the Porcupine Seabight (NE Atlantic). Pp. 821-847. En: A. Freiwald y J.M. Roberts (eds.). Cold-water corals and ecosystems. Springer, Berlin Heidelberg. Raes, M. y A. Vanreusel. 2006. Microhabitat type determines the composition of nematode communities associated with sediment-clogged cold-water coral framework in the Porcupine Seabight (NE Atlantic). Deep-Sea Research I 53: 1880-1894. Raffaelli, D. y C.F. Mason. 1981. Pollution monitoring with meiofauna using the ratio of nematodes to copepods. Marine Pollution Bulletin 12: 158-163. Remane, A. 1952. Die Besiedlung des Sandbodens im Meere und die Bedeutung der Lebensformtypes für die Ökologie. Verhandlungen der Deutschen Zoologischen Gesellschaft, Wilhelmshaven 1951. Zoologischer Anzeiger Supl. 16: 327-359. Rose, A., S. Seifried, E. Willen, K.H. George, G. Veit-Köhler, K. Bröhldick, J. Drewes, G. Moura, P. Martínez Arbizu y H.K. Schminke. 2005. A method for comparing withincore alpha diversity values from repeated multicorer samplings, shown for abyssal Harpacticoida (Crustacea: Copepoda) from the Angola Basin. Organisms Diversity and Evolution 5: 3-17. Rosenberg, R., W.E. Arntz, E. Chuman de Flores, L.A. Flores, G. Carbajal, G. Finger, y J. Tarazona. 1983. Benthos biomass and oxygen deficiency in the upwelling system off Peru. Journal of Marine Research 41: 263–279. Seifried, S. 2004. The importance of a phylogenetic system for the study of deep-sea harpacticoid diversity. Zoological Studies 43: 435-445. Shimanaga, M., H. Kitazato y Y. Shirayama. 2004. Temporal patterns in diversity and species composition of deep-sea benthic copepods in bathyal Sagami Bay, central Japan. Marine Biology 144: 1097-1110. Shimanaga, M., H. Nomaki, K. Suetsugu, M. Murayama y H. Kitazato. 2007. Standing stock of deep-sea metazoan meiofauna in the Sulu Sea and adjacent areas. Deep-Sea Research II 54: 131-144. Shirayama, Y. 1984. The abundance of deep sea meiobenthos in the Western Pacific in relation to environmental factors. Oceanologica Acta 7: 113-121. 142 Biodiversidad y comunidades del talud continental del Pacífico mexicano Smith, Jr K.L., R.J. Baldwin, D.M. Karl y A. Boetius. 2002. Benthic community responses to pulses in pelagic food supply: North Pacific Subtropical Gyre. Deep-Sea Research I 49: 971–990. Thistle, D. y J.E. Eckman. 1990. The effect of a biologically produced structure on the benthic copepods of a deep-sea site. Deep-Sea Research I 37: 541-554. Thistle, D., L.A. Levin, A.J. Gooday, O. Pfannkuce y P.J.D. Lambshead. 1999. Physical reworking by near-bottom flow alters the metazoan meiofauna of Fieberling Guyot (northeast Pacific). Deep-Sea Research I 46: 2041–2052. Thurston, M.H., B.J. Bett, A.L. Rice y P.A.B. Jackson. 1994. Variations in the invertebrate abyssal megafauna in the North Atlantic Ocean. Deep-Sea Research I 41: 1321–1348. Tietjen, H.H. 1992. Abundance and biomass of metazoan meiobenthos in the deep sea. Pp. 45-62. En: G.T. Rowe y V. Pariente (eds.). Deep-sea food chains and the global carbon cycle. Kluwer Academic Publishers. Tietjen, H.H., J.W. Deming, G.T. Rowe, S. Macko y R.J. Wilke. 1989. Meiobenthos of the Hatteras Abyssal Plain and Puerto Rico Trench: abundance, biomass and associations with bacteria and particulate fluxes. Deep-Sea Research 36A: 1567-1577. Tselepides, A. y N. Lampadariou. 2004. Deep-sea meiofaunal community structure in the Eastern Mediterranean: are trenches benthic hotspots? Deep-Sea Research I 51: 833-847. Valdovinos, C., S.A. Navarrete y P.A. Marquet. 2003. Mollusk species diversity in the southern eastern Pacific: why are there more species towards the pole? Ecography 26: 139–144. Van Gaever, S., A. Vanreusel, J.A. Hughes, B.J. Bett y K. Kiriakoulakis. 2004. The macro- and micro-scale patchiness of meiobenthos associated with the Darwin Mounds (north-east Atlantic). Journal of the Marine Biological Association of the United Kingdom 84: 547-556. Van Gaever, S., K. Olu, S. Derycke y A. Vanreusel. 2009. Metazoan meiofaunal communities at cold seeps along the Norwegian margin: influence of habitat heterogeneity and evidence for connection with shallow-water habitats. Deep-Sea Research I 56: 772-785. Vanhove, S., H. Vermeeren y A. Vanreusel. 2004. Meiofauna towards the South Sandwich Trench (750–6300 m), focus on nematodes. Deep-Sea Research II 51: 1665–1687. Vanhove, S., J. Wittoeck, G. Desmet, B. Van den Berghe, R.L. Herman, R.P.M. Bak, G. Niewland, J. H. Vosjan, A. Boldrin, S. Rabitti y M. Vincx. 1995. Deep-sea meiofauna communities in Antarctica: structural analysis and relation with the environment. Marine Ecology Progress Series 127: 65-76. Vanhove, S., M. Beghyn, D. Van Gansbeke, L.W. Bullough y M. Vincx. 2000. A seasonally varying biotope at Signy Island, Antarctic: implications for meiofaunal structure. Marine Ecology Progress Series 202: 13-25. M eiofauna de mar profundo del golfo de C alifornia 143 Vincx, M., B.J. Bett, A. Dinet, T. Ferrero, A.J. Gooday, P.J.D. Lambshead, O. Pfannkuche, T. Soltwedel y A. Vanreusel. 1994. Meiobenthos of the deep Northeast Atlantic. Advances in Marine Biology 30: 1-88. Generalidades de los copépodos parásitos de peces en aguas profundas y el caso de Lophoura brevicollum (Siphonostomatoida: Sphyriidae) Francisco Neptalí Morales-Serna1 y Samuel Gómez2 INTRODUCCIÓN A nivel mundial, la exploración del océano profundo ha sido muy limitada, esencialmente por dos situaciones: 1) la dificultad en la operación de los equipos de muestreo en alta mar y 2) el alto costo para mover una embarcación de mediano o gran calado en aguas oceánicas, en particular considerando las distancias que se deben recorrer para cubrir la Zona Económica Exclusiva (Hendrickx 2012). Sin embargo, se ha reconocido que el océano profundo sostiene una gran biodiversidad y no hay duda que grandes descubrimientos irán sucediendo a medida que las investigaciones se incrementen. Hasta ahora, el conocimiento está basado principalmente en organismos de vida libre, destacando grupos como los nemátodos, los poliquetos, los moluscos, los equinodermos y los crustáceos (e.g., Brandt et al. 2007). En contraste y a pesar de la importancia del parasitismo en aguas profundas, poco se sabe al respecto. Este es un tema importante de estudio, ya que el parasitismo, que 1 2 Departamento de Zoología, Instituto de Biología, Universidad Nacional Autónoma de México, Avenida Universidad 3000, Ciudad Universitaria, C.P. 04510, México, D.F. Correo-e: [email protected]. Instituto de Ciencias del Mar y Limnología, Unidad Académica Mazatlán, Universidad Nacional Autónoma de México, Joel Montes Camarena s/n, Mazatlán 82040, Sinaloa, México. 145 es el estilo de vida más común en la Tierra (Price 1980), desempeña funciones clave en los ecosistemas, como la regulación de la abundancia o de la densidad de las poblaciones hospederas y la estabilización de la red alimentaria (Dobson et al. 2008). Además, los parásitos pueden ser un indicador útil en el entendimiento de la evolución de los animales de vida libre (Palm y Klimpel 2008) y de la salud de los ecosistemas (Marcogliese 2005). En aguas profundas, probablemente los parásitos de peces han sido los más estudiados, encontrándose que los helmintos (principalmente los nemátodos), seguido de los copépodos, son los más frecuentes y abundantes (e.g., Palm y Klimpel 2008, Klimpel et al. 2010). Recientemente, Gómez et al. (2010) dieron a conocer una especie nueva de copépodo parásito (Lophoura brevicollum) encontrada en peces del talud continental del Pacífico mexicano. Por esta razón, y debido también a que en México se tiene un conocimiento muy pobre sobre los copépodos parásitos, en el presente capítulo se brinda un acercamiento hacia este tipo de organismos. Primero se dan algunas generalidades de la subclase Copepoda, haciendo énfasis en los estilos de vida parasíticos. Posteriormente, se presentan las principales familias de copépodos parásitos de peces de aguas profundas conocidas en el mundo, finalizando con comentarios breves sobre L. brevicollum. Generalidades de la subclase Copépoda, con énfasis en los parásitos Los copépodos son crustáceos acuáticos cuya diversidad supera las 16000 especies (Walter y Boxshall 2008). Estos organismos tienen una distribución muy amplia. Se les puede encontrar en todos los regímenes de salinidad y temperatura, así como en un intervalo vertical que va desde los lagos de tierras altas hasta las trincheras oceánicas (Huys y Boxshall 1991). Además, los copépodos pueden ser encontrados tanto en la columna de agua (planctónicos) como en el sedimento (bentónicos) y en asociación con otros organismos (simbiontes). No obstante, debe considerarse que muchos copépodos no se restringen solamente a una de esas categorías durante su ciclo de vida; por ejemplo, varias especies de copépodos simbiontes tienen una fase de vida libre (Boxshall y Halsey 2004). En cuanto a su tamaño, aunque hay especies conspicuas, los copépodos son típicamente pequeños y difíciles de reconocer a simple vista. Las especies bentónicas miden entre 0.2 y 2.5 mm, las planctónicas entre 0.2 y 28 mm, y las simbiontes entre 1 y 250 mm (Huys y Boxshall 1991). 146 Biodiversidad y comunidades del talud continental del Pacífico mexicano El cuerpo básico de un copépodo se caracteriza por poseer un cefalosoma de seis somitas y un tronco postcefálico de nueve somitas más el somita anal, el cual representa el telson. El cefalosoma consiste de cinco somitas cefálicos y el primer somita torácico que lleva los maxilípedos. El tronco postcefálico comprende del segundo al sexto somita torácico (los primeros cinco somitas llevan, cada uno, un par de apéndices natatorios birrámeos), el somita genital (séptimo somita) que lleva el opérculo genital en ambos sexos, y cuatro somitas abdominales postgenitales. Los somitas postgenitales carecen de miembros y el somita anal lleva un par de ramas caudales. Los apéndices básicos de un copépodo son: anténula, antena, mandíbula, maxílula, maxila, maxilípedo, apéndices natatorias y ramas caudales. Los apéndices natatorios están armados con setas y espinas que varían en número y posición según el sexo y la especie. De acuerdo con Huys y Boxshall (1991), la tendencia evolutiva dominante en los copépodos es la fusión de los somitas corporales, la pérdida de segmentos en los apéndices y la pérdida de setas. Información más detallada e ilustrada sobre la morfología de los copépodos es proporcionada por Kabata (1979), Huys y Boxshall (1991) y Boxshall y Halsey (2004). Copépodos parásitos Hace una década se reconocían 4224 especies de copépodos viviendo en asociación simbiótica con otros animales acuáticos, los cuales pertenecen prácticamente a todos los fila, desde esponjas y moluscos hasta vertebrados, incluyendo mamíferos (Ho 2001). Hasta ahora no se tiene una actualización de esa cifra, pero seguramente se ha incrementado significativamente dados los últimos descubrimientos. Es probable que la mayoría de las asociaciones sean parasíticas, pero en muchos casos la naturaleza precisa de la relación con el hospedero necesita ser esclarecida (Boxshall 2005). La forma y el tamaño del cuerpo puede ser muy variable de una familia a otra. Si el cuerpo conserva varias características ancestrales, el copépodo parásito puede ser relativamente fácil de reconocer; por ejemplo, los copépodos de las familias Caligidae y Bomolochidae (Fig. 1A, B) que guardan cierta semejanza con los copépodos de vida libre. Por el contrario, si el cuerpo está muy modificado, es decir, sin segmentación evidente y con extremidades reducidas o carentes de ellas (e.g., familia Lernaeopodidae; Fig. 1C, D), el copépodo parásito puede pasar desapercibido. Cabe señalar que en varias familias existe un dimorfismo sexual fuerte con respecto a la forma del cuerpo y la estructura de los apéndices. Generalmente las G eneralidades de los copépodos parásitos de peces en aguas profundas 147 Figura 1. A, hembra de Lepeophtheirus simplex (Siphonostomatoida: Caligidae), vista dorsal (modificado de Ho et al. 2001); B, hembra de Acantholochus zairae (Cyclopoida: Bomolochidae), vista dorsal (modificado de Morales-Serna y Gómez 2010); C, hembra de Parabrachiella sp. (Siphonostomatoida: Lernaeopodidae), vista lateral (observ. pers.); D, la misma, vista ventral; E, extremo de las maxilas de Parabrachiella sp. en el que se señala la bulla incrustada en el tejido del hospedero. E D A B C hembras tienen apéndices de sujeción más robustos y su cuerpo es más grande y más modificado que en los machos (Fig. 2); por el contrario, los machos tienen al menos un par de extremidades (anténulas o maxilípedos) adaptadas para agarrarse al segmento genital de la hembra, donde usualmente son encontrados (Fig. 2) (Boxshall 2005). Muchas veces, en casos donde se tienen especímenes con cuerpos muy modificados, el par de sacos de huevos que llevan las hembras puede ser de utilidad en el reconocimiento de un copépodo parásito. Con el propósito de adherirse y permanecer en su hospedero, los copépodos parásitos han tenido que modificar algunos de sus apéndices, tal como las antenas, los maxilípedos e inclusive los periópodos. Por supuesto, estas modificaciones varían de una familia a otra. Las familias Caligidae y Bomolochidae, además de utilizar sus antenas y maxilípedos como elementos prensiles, han adaptado la estructura de su cefalotórax para que funcione como ventosa y poder adherirse al pez (Kabata 1992). Copépodos parásitos con cuerpos muy modificados han llegado a desarrollar estructuras de sujeción bastante especializadas; por ejemplo, en los Lernaeopodidae hay una estructura conocida como bulla (Fig. 1E), que consiste de las maxilas (tercer par de apéndices bucales) fusionadas con un aparato de an148 Biodiversidad y comunidades del talud continental del Pacífico mexicano Fig. 2. Hembra de Pseudochondracanthus diceraus. La flecha señala al macho adherido a la parte posterior (genito-abdomen) del cuerpo de la hembra (modificado de Ho 1970). claje (Kabata 1992, Benkirane et al. 1999). La bulla se inserta definitivamente en el tejido del pez haciendo que las hembras adultas sean sésiles. En general, el éxito del orden Siphonostomatoida, que agrupa a la mayoría de los copépodos parásitos de peces, se debe a dos características: la posesión de una boca en forma de sifón (tubo oral) que parece estar bien adaptada a la explotación de superficies de los peces y la posesión de un órgano de anclaje, llamado filamento frontal, en la etapa infectiva (Kabata 1992). Los copépodos parásitos dañan a sus hospederos tanto por sus mecanismos de sujeción como por sus hábitos de alimentación. Esto sucede cuando los copépoG eneralidades de los copépodos parásitos de peces en aguas profundas 149 dos clavan sus apéndices en el tejido del hospedero, produciendo lesiones locales, como necrosis y erosión de la epidermis si el ataque es en la piel, produciéndose hinchazón, hiperplasia, proliferación de fibroblastos, e infiltración celular como respuesta del tejido del hospedero (Boxshall 2005). Los ataques a los filamentos branquiales típicamente dan como resultado un aumento de la producción de mucus, la hipertrofia de las branquias y la fusión de las lamelas secundarias, con la consecuente pérdida de área superficial respiratoria (Manera y Dezfuli 2003, Boxshall 2005). Al alimentarse, la mayoría de los copépodos raspan las superficies de los hospederos usando sus mandíbulas. Algunos perforan el tejido del hospedero con su tubo oral para sacar fluidos; esto produce lesiones locales en la epidermis e, incluso, hemorragias que causan anemia cuando la infección es prolongada (Boxshall 2005). Copépodos del género Phrixocephalus Wilson, 1908 atacan el ojo del pez hospedero, destruyendo la cornea y la retina (Ohtsuka et al. 2007). De la misma forma el copépodo Ommatokoita elongata (Grant, 1827) es conocido por causar ceguera en los tiburones del género Somniosus Lesueur, 1818 (Benz et al. 2002). Ciclo de vida En Copepoda el ciclo de vida básico consiste de un máximo de seis etapas llamadas nauplios (designadas NI-NVI) y cinco etapas llamadas copepoditos (designadas CoI-CoV) antes de llegar a ser adultos. Este ciclo completo es observado en los copépodos de vida libre y también es usual en los que parasitan invertebrados. Pero en los copépodos parásitos de peces el número de etapas ha sido reducido, salvo excepciones raras (Boxshall 2005). De acuerdo con Boxshall y Halsey (2004), las familias Chondracanthidae, Ergasilidae y Lernaeidae cuentan con tres nauplios y cinco copepoditos antes de alcanzar la madurez; la familia Taeniacanthidae pasa por dos etapas de nauplios y cinco de copepodito; en los Caligidae hay dos nauplios, un copepodito (infectivo), cuatro calimus y uno o dos preadultos; en los Lernaeopodidae el desove es directamente en el primer copepodito (infectivo), después se desarrollan cuatro calimus y un preadulto, aunque a veces antes del copepodito puede haber un nauplio; y en los Lernanthropidae hay dos nauplios, un copepodito (infectivo) y cinco copepoditos. El ciclo de vida de un copépodo parásito es directo (requiere sólo un hospedero), con los nauplios siendo nadadores libres y el primer copepodito siendo la larva infectiva. La infección es generalmente en la superficie externa del hospedero (e.g., 150 Biodiversidad y comunidades del talud continental del Pacífico mexicano piel, aletas, branquias, ojos, boca y fosas nasales); por lo tanto, se les distingue como ectoparásitos. No obstante, hay casos inusuales de endoparasitismo, mesoparasitismo y ciclos de vida indirectos (requieren más de una especie hospedera). Por ejemplo, en Cardiodectes medusaeus (Wilson, 1908) (familia Pennellidae), después de dos etapas de nauplio el copepodito (infectivo) entra a la cavidad del manto de un gasterópodo (hospedero intermediario) donde se desarrolla y aparea. Posteriormente, los machos mueren y las hembras salen en busca de un pez hospedero donde sufren una metamorfosis y completan su ciclo de vida (Perkins 1983). Lernaeocera branchialis (Linnaeus, 1767) es otro copépodo penélido que requiere dos peces hospederos para completar su ciclo de vida; usualmente, los adultos se encuentran en el bacalao del atlántico Gadus morhua Linnaeus, 1758 y las etapas juveniles tanto en el pez plano Platichthys flesus (Linnaeus, 1758) como en el lompa Cyclopterus lumpus Linnaeus, 1758 (Brooker et al. 2007, Smith et al. 2007). El ciclo de vida de L. branchialis comprende dos etapas de nauplios, una etapa de copepodito infectivo y cuatro etapas de calimus con la siguiente duración de acuerdo a Brooker et al. (2007): el nauplio I muda a nauplio II aproximadamente 10 minutos después del desove; el nauplio II muda a copepodito infectivo después de 48 horas; el calimus I aparece dos días después de la infección (d.i.); el calimus II siete días d.i.; el calimus III 15 días d.i.; el calimus IV 19 días d.i., y el adulto 25 días d.i. Este adulto es capaz de nadar dentro de la cámara branquial del hospedero intermediario, en el cual se lleva a cabo el apareamiento. Mientras la hembra fertilizada sale en busca de su segundo hospedero, su cuerpo empieza a sufrir una transformación profunda en tamaño y forma, llegando a tener una segmentación poco clara. Durante la transformación, en aproximadamente cinco días, el complejo genital se enrolla y se dilata, la cutícula llega a ser más gruesa, de la cabeza emergen apéndices que penetran al hospedero y aparecen los sacos de huevos, los cuales desovan en aproximadamente 12 días. La forma final del copépodo se asemeja a un gusano. Otro ejemplo extraordinario en la biología de los copépodos parásitos se encuentra en el orden Monstrilloida, donde los juveniles son endoparásitos de invertebrados marinos (poliquetos o moluscos) y los adultos son de vida libre, planctónicos (Boxshall 2005). Probablemente, en el océano profundo estos fenómenos biológicos ocurren con más frecuencia para contrarrestar la adversidad del medio (e.g., disponibilidad baja de hospederos). G eneralidades de los copépodos parásitos de peces en aguas profundas 151 PRINCIPALES FAMILIAS DE COPÉPODOS PARÁSITOS DE PECES DE AGUAS PROFUNDAS A NIVEL MUNDIAL En general, los copépodos parásitos han sido pobremente estudiados. Hasta ahora solamente se tiene el registro de los copépodos viviendo en menos del 2 % de los invertebrados acuáticos y en menos del 20 % de los peces, valores ínfimos si se considera que cada animal acuático es un hospedero potencial para los copépodos (Ho 2001). Consecuentemente, se conoce más sobre los copépodos parásitos de peces, incluyendo los de aguas profundas. Los copépodos parásitos pertenecientes a los órdenes Siphonostomatoida y Poecilostomatoida son observados frecuentemente en peces del mar profundo (Boxshall 1998). Las familias más comúnmente encontradas son Chondracanthidae, Lernaeopodidae y Sphyriidae, aunque ocasionalmente también se pueden encontrar miembros de otras cuatro familias (Hatschekiidae, Pennellidae, Philichthyidae e Hyponeoidae). De acuerdo con Boxshall (1998), el registro de mayor profundidad es para Chondracanthodes deflexus Wilson, 1932 recolectado a 4815 m al oeste del Atlántico Norte (véase Ho 1985). La familia Chondracanthidae Los copépodos condracántidos abarcan aproximadamente 160 especies descritas distribuidas en 44 géneros, todas parasitarias de peces marinos (Boxshall y Halsey 2004). Esta familia se caracteriza por tener hembras grandes, con cuerpos modificados, las cuales típicamente llevan un macho (Fig. 2). Para esta familia, el género Chondracanthodes Wilson, 1932 es el que se ha observado más comúnmente en peces de aguas profundas (Boxshall 1998). Por ejemplo, C. deflexus es una especie encontrada en peces de la familia Macruridae tanto del Pacífico como del Atlántico (Ho 1994). Jusheyhoea Villalba y Fernández, 1985 y Chelonichondria Ho, 1994 son otros dos géneros de copépodos condracántidos también encontrados en peces macruridos (Ho 1994, Boxshall 1998). Cabe mencionar que estos peces constituyen la parte principal de la fauna de aguas profundas alrededor del mundo. La familia Lernaeopodidae En esta familia los cuerpos son altamente modificados, sin segmentación evidente (Fig. 1 C, D). Los copépodos lerneopódidos comprenden aproximadamente 268 152 Biodiversidad y comunidades del talud continental del Pacífico mexicano especies descritas, distribuidas en 48 géneros, de los cuales siete son de agua dulce y el resto son marinos; todos parasitan peces (Boxshall y Halsey 2004). En los tiburones del género Etmopterus Rafinesque, 1810 que habitan aguas profundas del océano Indico y el noroeste del océano Pacífico, es posible encontrar al lerneopódido Neoalbionella etmopteri (Yamaguti, 1939) (registrado como Albionella etmopteri) (Benz 1991). No obstante, en los peces del mar profundo aparecen con más regularidad copépodos de los géneros Clavella Oken, 1815 y Lernaeopodina Wilson, 1915 (Boxshall 1998). Hay aproximadamente 13 especies del género Clavella que parasitan macruridos, tanto del Atlántico como del Pacífico (Boxshall 1998, Castro y González 2009). Los registros más recientes son Clavella singularis Castro y González, 2009 y Clavella fortis Castro y González, 2009 en macruridos de la costa norte de Chile. Para Lernaeopodina se conocen aproximadamente cuatro especies, las cuales parasitan una amplia variedad de peces; por ejemplo, Lernaeopodina longibrachia (Brian, 1912) ocurre tanto en holocéfalos como en elasmobranquios (Boxshall 1998). La familia Sphyriidae y el caso de Lophoura brevicollum Los esfíridos son copépodos parásitos con cuerpos muy modificados. Las hembras son consideradas mesoparasíticas, ya que incrustan su cefalotórax y la parte anterior del cuello en el hospedero. Los machos son más pequeños que las hembras y se encuentran agarrados a ellas. Esta familia agrupa aproximadamente 35 especies descritas en nueve géneros (Boxshall y Halsey 2004), de los cuales Lophoura Kölliker (en Gegenbaum et al. 1853) destaca por su especialización en aguas profundas y por su alta diversidad (Boxshall 1998). Hasta ahora se reconoce que Lophoura contiene 19 taxa (Gómez et al. 2010): L. bipartita Ho y Kim, 1989, L. bouvieri (Quidor, 1912), L. brevicollum, L. caparti (Nunes-Ruivo, 1962), L. cardusa (Leigh-Sharpe, 1934), L. cornuta (Wilson, 1919), L. edwardsi Kölliker, 1853, L. elongata Kensley y Grindley, 1973, L. gracilis Wilson, 1919, L. laticervix Hewitt, 1964, L. magna Szidat, 1971, L. pentaloba Ho, 1985, L. simplex Boxshall, 2000, Lophoura sp. sensu Ho y Kim (1989), L. tetraloba Ho y Kim, 1989, L. tetraphylla Ho, 1985, L. tripartita (Wilson, 1935), L. unilobulata Castro y González, 2009 y L. ventricula Ho y Kim, 1989. Lophoura brevicollum (Fig. 3) fue descrita y nombrada por Gómez et al. (2010) a partir de algunos especímenes encontrados en el macrúrido Nezumia liolepis (Gilbert, 1890) recolectado durante la campaña oceanográfica TALUD G eneralidades de los copépodos parásitos de peces en aguas profundas 153 VI. Estos peces se capturaron a profundidades de 1270 m y 1295 m frente a las costas de Sinaloa, México (24°56’N, 109°05’O). Lophoura brevicollum puede distinguirse de la especie que más se le acerca (L. tetraloba, encontrada en el Pacífico Oeste) por la longitud del cuello (más corto en L. brevicollum), el número de depresiones dorsales y ventrales del genito-abdomen (16 en L. tetralobata, 8 en L. brevicollum), la longitud del saco de huevos (dos veces tan largo como el genito-abdomen en L tetralobata, seis veces tan largo como el genito-abdomen en L. brevicollum) y la forma general de los apéndice posteriores (Gómez et al. 2010). Los copépodos parásitos de peces de aguas profundas, además de adaptarse a la complejidad de su hospedero, han mostrado respuestas a las condiciones de profundidad. Las zonas donde se encontraron los copépodos L. brevicollum se caracterizan, Fig. 3. Hembra de Lophoura brevicollum (modificado de Gómez et al. 2010). 154 Biodiversidad y comunidades del talud continental del Pacífico mexicano entre otras cosas, por un incremento considerable en la presión en comparación con las aguas superficiales y por la presencia de la llamada Zona de Mínimo Oxígeno (aguas con menos de 0.5 ml l-1 O2). Gómez et al. (2010) consideran que los apéndices posteriores de L. brevicollum son una adaptación para la presión hidráulica alta y para las aguas pobremente oxigenadas. Esos apéndices posteriores incrementan la superficie corporal del copépodo, dando como resultado una mayor absorción de oxígeno. Estos autores también consideran que L. brevicollum y L. tetraloba divergieron a partir de un ancestro común a través de la especiación alopátrica, en la que las capas de mínimo oxígeno y la presión hidrostática posiblemente fueron los mecanismos físicos responsables del rompimiento de la cohesión genética y la consecuente especiación. CONCLUSIONES El conocimiento actual sobre la biología de los copépodos parásitos es aceptable. No obstante, es posible vislumbrar un entendimiento más claro y más preciso de estos organismos si se dirige más la atención hacia ellos, ya que, por un lado, hay una gran cantidad de especies de peces e invertebrados acuáticos que aún no han sido estudiadas para identificar sus copépodos parásitos, necesidad que puede solventarse únicamente con el trabajo multidisciplinario; por otro lado, de los taxa ya identificados, para muchos se desconocen temas como la reproducción y los ciclos de vida, las especies invasoras, las especies crípticas, los efectos en su hospedero, la biogeografía, etc. Particularmente, en México hace falta que más investigadores se interesen en el estudio de los copépodos parásitos y que, a la vez, se integren en redes de trabajo que permitan generar conclusiones sólidas. Por ejemplo, el continuar estudiando los copépodos parásitos del océano profundo servirá para responder no sólo cuestiones particulares de estos organismos, si no también cuestiones generales de este hábitat, como los concernientes a la colonización, la estructura de la comunidad, la ecología y la evolución. El descubrimiento de L. brevicollum podría indicar que en el océano profundo de México hay aún más especies de copépodos parásitos que desconocemos. Agradecimientos Se agradece a la Universidad Nacional Autónoma de México por la disponibilidad del B/O “El Puma” a nuestro grupo de investigación durante los cruceros TALUD y a la tripulación y estudiantes por su colaboración en los muestreos. El financiaG eneralidades de los copépodos parásitos de peces en aguas profundas 155 miento del TALUD VI fue otorgado por el Consejo Nacional de Ciencia y Tecnología (proyecto 31805-N). REFERENCIAS Benkirane, O., F. Coste y A. Raibaut. 1999. On the morphological variability of the attachment organ of Lernaeopodidae (Copepoda: Siphonostomatoida). Folia Parasitologica 46: 67-75. Benz, G.W. 1991. Description of some larval stages and augmented description of adult stages of Albionella etmopteri (Copepoda: Lernaeopodidae), a parasite of deep-water lanternsharks (Etmopterus: Squalidae). Journal of Parasitology 77: 666-674. Benz, G.W., J.D. Borucinska, L.F. Lowry y H.E. Whiteley. 2002. Ocular lesions associated with attachment of the copepod Ommatokoita elongate (Lernaeopodidae: Siphonostomatoida) to corneas of Pacific sleeper sharks Somniosus pacificus captured off Alaska in Prince William Sound. Journal of Parasitology 88: 474-481. Boxshall, G.A. 1998. Host specificity in copepod parasites of deep-sea fishes. Journal of Marine Systems 15: 215-223. Boxshall, G.A. 2005. Copepoda (copepods). Pp. 123-138. En: Rohde, K. (ed.). Marine parasitology. CSIRO Publishing. Melbourne, Australia. Boxshall, G.A. y S.H. Halsey. 2004. An introduction to copepod diversity. Vols. 1 y 2. The Ray Society, Londres. 970 pp. Brandt, A., C. De Broyer, I. De Mesel, K.E. Ellingsen, A.J. Gooday, B. Hilbig, K. Linse, M.R.A. Thomson y P.A. Tyler. 2007. The biodiversity of the deep Southern Ocean benthos. Philosophical Transactions of the Royal Society B 362: 39-66. Brooker, A.J., A.P. Shinn y J.E. Bron. 2007. A review of the biology of the parasitic copepod Lernaeocera branchialis (L., 1767) (Copepoda: Pennellidae). Advances in Parasitology 65: 297-341. Castro, R.R. y M.T. Gonzalez. 2009. Two new species of Clavella (Copepoda, Siphonostomatoida, Lernaeopodidae) and a new species of Lophoura (Copepoda, Siphonostomatoida, Sphyriidae): parasites on the deep-water fish, Nezumia pulchella from the northern Chilean coast. Crustaceana 82: 411-423. Dobson, A., K.D. Lafferty, A. Kuris, R.F. Hechinger y W. Jetz. 2008. Homage to Linnaeus: how many parasites? How many hosts? Proceedings of the National Academy of Sciences 105: 11482-11489. Gegenbaur, G., A. Kölliker, y H. Muller. 1853. Bericht über einige im Herbst 1852 in Messina angestellte vergleichend-anatomische Untersuchungen. Zeitschrift fur Wissenschaftliche Zoologie 4:299–370. [Lophoura Kölliker: 359]. 156 Biodiversidad y comunidades del talud continental del Pacífico mexicano Gómez, S., G.B. Deets, J.E. Kalman y F.N. Morales-Serna. 2010. Lophoura brevicollum n. sp. (Copepoda: Siphonostomatoida: Sphyriidae), a parasite of the smooth grenadier Nezumia liolepis (Gilbert, 1890) (Pisces: Macrouridae) from the eastern Pacific, and a new record and new host of Lophoura unilobulata Castro R. and Gonzalez. Journal of Crustacean Biology 30: 129-140. Hendrickx, M.E. 2012. Operaciones oceanográficas en aguas profundas: los retos del pasado, del presente y del proyecto TALUD en el Pacífico mexicano (1989-2009). Pp. 23104. En: P. Zamorano, M.E. Hendrickx y M. Caso (eds.). Biodiversidad y comunidades del talud continental del Pacífico mexicano. Instituto Nacional de Ecología, Secretaría de Medio Ambiente y Recursos Naturales (Semarnat). Ho, J.S. 1970. Revision of the genera of the Chondracanthidae, a copepod family parasitic on marine fishes. Beaufortia 229: 105-218. Ho, J.S. 1985. Copepod parasites of deep-sea benthic fishes from the western North Atlantic. Parasitology 90: 485-497. Ho, J.S. 1994. Chondracanthid copepods (Poecilostomatoida) parasitic on Japanese deep-sea fishes, with a key to the genera of the Chondracanthidae. Journal of Natural History 28: 505-517. Ho, J.S. 2001. Why do symbiotic copepods matter? Hydrobiologia 453/454: 1-7. Ho, J.S., S. Gómez y E. Fajer-Ávila. 2001. Lepeophtheirus simplex sp. n., a caligid copepod (Siphonostomatoida) parasitic on “botete” (bullseye puffer, Sphoeroides annulatus) in Sinaloa, Mexico. Folia Parasitologica 48: 240-248. Ho, J.S. y I.-H. Kim. 1989. Lophoura (Copepoda: Sphyriidae) parasitic on the rattails (Pisces: Macrouridae) in the Pacific, with note on Sphyrion lumpi from the Sea of Japan. Publications of the Seto Marine Biological Laboratory 34: 37-54. Huys, R. y G.A. Boxshall. 1991. Copepod evolution. The Ray Society, Londres. 468 pp. Kabata, Z. 1992. Copepods parasitic on fishes. The Linnean Society of London and the Estuarine and Coastal Sciences Association. Gran Bretaña. 264 pp. Klimpel, S., M.W. Busch, T. Sutton y H.W. Palm. 2010. Meso- and bathy-pelagic fish parasites at the Mid-Atlantic Ridge (MAR): Low host specificity and restricted parasite diversity. Deep-Sea Research I 57: 596-603. Manera, M. y B.S. Dezfuli. 2003. Lernanthropus kroyeri infections in farmed sea bass Dicentrarchus labrax: pathological features. Diseases of Aquatic Organisms 57: 177-180. Marcogliese, D.J. 2005. Parasites of the superorganism: Are they indicators of ecosystem health? International Journal for Parasitology 35: 705-716. Morales-Serna, F.N. y S. Gómez. 2010. A new bomolochid copepod parasitic on bullseye puffer Sphoeroides annulatus (Jenyns) from Mexico, with reassignment of some G eneralidades de los copépodos parásitos de peces en aguas profundas 157 species of Acantholochus Cressey and Hamaticolax Ho & Lin. Zootaxa 2336: 3650. Ohtsuka, S., K. Harada, K. Miyahara, K. Nagahama, K. Ogawa y T. Ohta. 2007. Prevalence and intensity of Phrixocephalus umbellatus (Copepoda: Siphonostomatoida: Pennellidae) parasitic on Paralichthys olivaceus in the western part of Sea of Japan. Fisheries Science 73: 214-216. Palm, H.W. y S. Klimpel. 2008. Metazoan fish parasites of Macrourus berglax Lacepède, 1801 and other macrourids of the North Atlantic: Invasion of the deep sea from the continental shelf. Deep-Sea Research II 55: 236-242. Perkins, P.S. 1983. The life history of Cardiodectes medusaeus (Wilson), a copepod parasite of Lanternfishes (Myctophidae). Journal of Crustacean Biology 3: 70-87. Price, P.W. 1980. Evolutionary biology of Parasites. Princeton University Press, Princeton 238 pp. Smith, J.L., R. Wootten y C. Sommerville. 2007. The pathology of the early stages of the crustacean parasites, Lernaeocera branchialis (L.), on Atlantic cod, Gadus morhua L. Journal of Fish Diseases 30: 1-11. Walter, T.C. y G.A. Boxshall. 2008. World of Copepods database. Disponible en línea en http://www.marinespecies.org/copepoda. 158 Biodiversidad y comunidades del talud continental del Pacífico mexicano Sección III Macroinvertebrados Poliquetos (Annelida, Polychaeta) del talud continental suroriental del golfo de California y su relación con algunas variables ambientales Nuria Méndez1 INTRODUCCIÓN La clase Polychaeta representa el mayor grupo de invertebrados marinos, con más de 16,000 especies conocidas y pueden llegar a conformar el mayor componente biótico de la infauna marina (alrededor del 70 % de todas las especies e individuos), tanto cerca de la costa como en las grandes profundidades (Blake 1994). Los poliquetos son gusanos con muchos segmentos a lo largo del eje anteroposterior. Su nombre indica “muchas setas” (también denominadas sedas, quetas o cerdas) que están presentes en todas las especies del grupo. Presentan un elemento anterior con un lóbulo cefálico o prostomio, un elemento posterior o pigidio y la región media de naturaleza segmentada o tronco. La morfología de los representantes de las diferentes familias depende de su forma de vida y tipo de alimentación. Presentan diversas estructuras típicas de cada familia con carácter diagnóstico para su identificación taxonómica, las cuales han sido descritas por Fauchald (1977), Blake (1994) y Harris et al. (2009). Instituto de Ciencias del Mar y Limnología, Unidad Académica Mazatlán, Universidad Nacional Autónoma de México, Joel Montes Camarena s/n, Mazatlán 82040, Sinaloa, México. Correo-e: [email protected]. 1 161 El estudio de los poliquetos puede ser muy amplio debido a la gran cantidad de ambientes que habitan y a que todos los modos de reproducción y de estrategias de alimentación descritos para los invertebrados marinos están representados en el grupo. Se encuentran en sustratos blandos (arena, lodo, grava) o duros (rocas, corales, madera, metal) y algunos son pelágicos. En cuanto a la posición que ocupan en el sustrato, existen especies excavadoras que se entierran en el sedimento (infauna o endofauna) contribuyendo a su oxigenación y a la mineralización de la materia orgánica. Algunos segregan mucus que adhiere partículas de sedimento alrededor del cuerpo formando tubos para su protección o para incubar embriones (Blake 1994). Algunas especies viven sobre el sustrato (epifauna), ya sea blando o duro y el cuerpo o el tubo pueden estar total o parcialmente expuestos. Los tubos generalmente son largos en comparación con el tamaño del animal (en proporción variable dependiendo de la especie) y frecuentemente están orientados en posición oblicua al sedimento para facilitar la alimentación de los detritos depositados en la superficie (Fauchald y Jumars 1979). Con el fin de evitar confusiones de términos, en este capítulo el conjunto de organismos recolectados en la superficie del fondo con el trineo bentónico se han denominado epifauna, mientras que los organismos recolectados con la draga Karling, dentro del sedimento, se consideran como infauna, a pesar de que con ambos métodos pueden recolectarse representantes de la comunidad que vive dentro del sedimento y sobre él (Hendrickx 2012, Méndez y Hendrickx 2012). De acuerdo con Fauchald y Jumars (1979), Gambi y Giangrande (1985) y Blake (1994), las formas de alimentación de los poliquetos están estrechamente relacionadas con su forma de vida, de manera que los de vida libre tienden a ser carnívoros, carroñeros, detritívoros u omnívoros, mientras que algunos detritívoros y filtradores tienden a ser sedentarios y forman tubos, aunque existen excepciones. Los suspensívoros o filtradores extraen el alimento de la columna de agua. Los consumidores de depósito o detritívoros extraen el alimento del sedimento. Dentro de este grupo, se distinguen los consumidores de depósito de superficie que toman las partículas alimenticias de la superficie del sedimento con sus palpos o tentáculos y los consumidores de depósito de sub-superficie o excavadores, los cuales se entierran dentro del sustrato blando para alimentarse de las capas inferiores de sedimento. Los carnívoros pueden capturar presas vivas o muertas mediante faringes musculares, a menudo con mandíbulas robustas. Algunas especies de herbívoros pueden alimentarse de algas, mientras que los omnívoros pueden consumir, además, pequeños animales y detritos. 162 Biodiversidad y comunidades del talud continental del Pacífico mexicano La mayoría de los poliquetos presenta reproducción sexual, con la producción de larvas trocóforas (generalmente libres nadadoras) y metatrocóforas que pueden o no ser nadadoras libres. ANTECEDENTES Estudios faunísticos Hasta la fecha se han realizado varios estudios faunísticos sobre poliquetos de la plataforma continental en el sur de California, entre los que destacan los de Hartman (1938, 1939a, 1939b, 1944a, 1944b, 1944c, 1951, 1955, 1961, 1966, 1968, 1969), Fauchald (1968), Kudenov (1975a, 1975b, 1980) y Williams (1987). Los trabajos sobre poliquetos de la plataforma continental dentro del golfo de California corresponden a los autores mexicanos Sarti-Martínez (1984), LezcanoBustamante (1989), Hernández-Alcántara (1992) y Hernández-Alcántara y Solís-Weiss (1999). Otros estudios en el área están incluidos en Salazar-Vallejo et al. (1989) y en Salazar-Vallejo y Londoño-Mesa (2004), que realizaron la recopilación de la literatura existente sobre poliquetos en México. Recientemente, de León-González et al. (2009) editaron una serie con tres volúmenes sobre los poliquetos de México y América tropical, la cual comprende casi todas las familias de poliquetos de aguas tanto someras como profundas. Las familias que no se incluyen en esta obra, ya sea por falta de especialistas o por la escasez de ejemplares, son Polyodontidae, Sigalionidae, Pareulepidae, Lacydonidae, Lysaretidae, Paraonidae, Questidae, Apistobranchidae, Disomidae, Poecilochaetidae, Heterospionidae, Ctenodrilidae, Poebiidae, Scalibregmidae, Opheliidae, Sternaspidae, Arenicolidae, Sabellongidae, Protodrilidae y Myzostomidae. Los estudios de poliquetos realizados en mar profundo del golfo de California y áreas adyacentes son escasos y corresponden a Hartman (1960, 1963), quien estudió los poliquetos de las cuencas profundas del sureste del golfo de California. Posteriormente, Fauchald (1972) a partir de material recolectado durante la expedición del “Albatross” por Chamberlin (1919a) y Treadwell (1923), identificó 227 especies (de las cuales, 66 eran conocidas), así como material recolectado en el oeste de México y áreas adyacentes en el océano Pacífico durante dos cruceros realizados a bordo del buque “Velero IV”, en 1967 y 1970. Hasta la fecha existen varios estudios de poliquetos de mar profundo del golfo de California y zonas aledañas. Blake (1985), Solís-Weiss y Hilbig (1992) y Solís-Weiss y HernándezPoliquetos (A nnelida , Polychaeta ) del talud continental suroriental 163 Alcántara (1994) estudiaron los poliquetos de las ventilas hidrotermales de la Cuenca de Guaymas. Otros estudios concernientes a poliquetos de aguas profundas del Pacífico norte corresponden a Fauchald y Hanckock (1981), en la zona central de Oregón, y a Blake y Hilbig (1990) en los sistemas de San Juan de Fuca y en las crestas del sistema Explorer, situados en el Pacífico nororiental. Recientemente, Blake y Hilbig (1994) y Blake et al. (1995, 1996, 2000) realizaron un atlas taxonómico de la fauna de la cuenca de Santa María y del canal occidental de Santa Bárbara, de los cuales cuatro volúmenes (volumen 4 a 7) están dedicados a los poliquetos. Recientemente, la revisión de las muestras de los cruceros TALUD VI a TALUD VII permitió realizar un listado de poliquetos de fondos blandos profundos en el golfo de California suroriental (Méndez 2006). Este estudio demostró que la fauna de poliquetos de esta zona es muy similar a la registrada previamente en zonas aledañas por Hartman (1960, 1963) y por Fauchald (1972). Algunas consideraciones de tipo morfológico o de distribución que no habían sido observadas previamente se incluyeron en este trabajo. Estudios ecológicos La relación entre las variables ambientales y la macrofauna de los fondos profundos ha sido objeto de diversos estudios realizados en diferentes áreas geográficas como el Atlántico norte, el Pacífico oriental, el océano Índico, el margen occidental de África, en un monte submarino frente a México, en el mar Arábigo, al noroeste de Omán y en los márgenes de Perú y Chile (Sanders 1969, Levin et al. 1991, 1997, 2000, 2001, 2002, Rosenberg et al. 1991, Diaz y Rosenberg 1995, Cook et al. 2000, Gooday et al. 2000, 2001, Levin 2001, 2003). En estos estudios se ha destacado la importancia de ciertas variables ambientales en la distribución, la abundancia, el número de especies y la diversidad de la macrofauna bentónica del mar profundo. Las variables más estudiadas han sido la profundidad, la temperatura, la concentración de oxígeno disuelto, la cantidad de materia orgánica en el sedimento, el tamaño de grano del sedimento, la latitud y los pigmentos contenidos en el sedimento. Sin embargo, la importancia de dichas variables está en función del grupo estudiado y de las condiciones ambientales prevalecientes en las diferentes regiones. Específicamente en el Pacífico oriental, son escasos los estudios referentes a cómo los parámetros ambientales afectan la distribución de la fauna bentónica del mar profundo. La Agencia de Protección del Medio Ambiente de Estados Unidos 164 Biodiversidad y comunidades del talud continental del Pacífico mexicano y la Armada del mismo país subsidiaron tres estudios de endofauna bentónica de la plataforma continental de las islas Farallón, cerca de San Francisco (SAIC 1991; 1992; Blake et al. 1992). Por otro lado, Levin y Gage (1998) y Levin et al. (1991) estudiaron las relaciones entre los factores medioambientales y las comunidades de macrobentos en el sur de California y frente a Acapulco (México), respectivamente. Wishner et al. (1995), por su parte, estudiaron la distribución de las faunas bentónica y pelágica en relación con el límite inferior de la zona del mínimo de oxígeno (ZMO) en una montaña submarina frente a Acapulco. Únicamente se tiene conocimiento de un estudio ecológico realizado en el golfo de California, específico para el grupo de los poliquetos (Hernández-Alcántara y Solís-Weiss 2005), quienes relacionaron algunos parámetros ambientales con los poliquetos pertenecientes a la familia Spionidae, cuyos datos corresponden a la zona sublitoral, entre los 22.2 y 120 m de profundidad. Así, hasta la fecha no existía ningún estudio sobre las relaciones entre las variables ambientales y la fauna de poliquetos de mar profundo en el golfo de California. La primera caracterización de la zona del golfo de California suroriental con poliquetos infaunales se realizó recientemente con las muestras recolectadas con la draga tipo Karling en los cruceros TALUD VI a TALUD VII, entre 732 y 2110 m de profundidad (Méndez 2007). En este capítulo, se presenta información sobre la morfología y los hábitos de vida de los poliquetos tanto de la infauna como de la epifauna, y se analiza su relación con algunas variables ambientales. MATERIAL Y MÉTODOS Muestreo y laboratorio Se recolectaron muestras de macrofauna entre 730 y 2100 m de profundidad para obtener los representantes de la infauna con la draga Karling y los de la epifauna con el trineo bentónico. Los métodos de muestreo fueron descritos en Hendrickx (2012). Hasta la fecha, se ha trabajado el material de poliquetos correspondiente a los cruceros TALUD IV a VII, los cuales comprendieron la zona suroriental del golfo de California (Fig. 1). A pesar de que el trineo bentónico y la draga Karling generalmente se utilizaron simultáneamente, el número de estaciones para recolectar macrofauna con ambos equipos no siempre coincidió, ya que hubo una fuerte dependencia del tipo de sustrato de las corrientes, el clima y las cuestiones logísticas. Durante el crucero TALUD IV (agosto de 2000) se muestrearon diez estaciones Poliquetos (A nnelida , Polychaeta ) del talud continental suroriental 165 para recolectar organismos de la infauna y siete para los de la epifauna. El crucero TALUD V se llevó a cabo en diciembre de 2000 y se obtuvo material de la infauna en nueve estaciones, mientras que para la epifauna únicamente en cuatro estaciones. Durante el TALUD VI, en marzo de 2001, se muestrearon 12 estaciones para el material de la infauna y cuatro para la epifauna. El crucero TALUD VII se desarrolló en junio de 2001 y se recolectaron muestras de sedimento para la infauna en 13 estaciones y de epifauna en siete estaciones. (Fig. 1). Los poliquetos retenidos en la red, nombrados como epifauna y recolectados con el trineo bentónico, fueron separados directamente con pinzas. En el caso de la infauna, el sedimento recolectado con la draga Karling se tamizó a bordo del B/O “El Puma” a través de un tamiz de 0.5 mm de apertura de malla utilizando agua de mar para el lavado y los poliquetos retenidos fueron separados. Los poliquetos pertenecientes tanto a la infauna como a la epifauna fueron fijados con una solución de formol al 10 %. Los especímenes que se encontraron dentro de tubos de arena gruesos fueron fijados mediante la incorporación de formol al 10 % a través Figura 1. Área de estudio mostrando las estaciones de muestreo (TALUD IV= ; TALUD V= ; TALUD VI= ; TALUD VII= ). 166 Biodiversidad y comunidades del talud continental del Pacífico mexicano de un extremo del tubo utilizando, para ello, una jeringa sin aguja para evitar dañar a los organismos. En el laboratorio, todos los especímenes fueron lavados varias veces con agua corriente y, posteriormente, fueron preservados en etanol al 70 %. Los poliquetos fueron contados e identificados, de ser posible hasta nivel de especie mediante las claves de Chamberlin (1919b), Hartman (1944a, 1957, 1960, 1968, 1969), Pettibone (1966), Fauchald (1968, 1970, 1972, 1977), Fauchald y Hancock (1981), Paxton (1986), Hernández-Alcántara (1992), Blake y Hilbig (1994), Petersen (2000) y Blake et al. (1995, 1996, 2000). Para los análisis de granulometría y del contenido de materia orgánica en el sustrato, se obtuvieron submuestras de 200 a 250 g de sedimento de cada muestra recolectada con la draga Karling, las cuales fueron congeladas a bordo. En el laboratorio, una vez descongeladas las muestras, se realizaron análisis granulométricos de acuerdo con el método propuesto por Folk (1965), el cual consiste en secar la submuestra de sedimento a 60°C y, posteriormente, tamizarla en húmedo a través de una malla de 2 mm de abertura para separar la grava de la arena y de otra malla de 0.0625 mm para separar la arena del lodo (esta última fracción fue considerada como la mezcla de limo y arcilla). Las fracciones retenidas en los tamices (grava y arena) fueron secadas en una estufa a 60°C y posteriormente fueron pesadas. La fracción de lodo fue estimada como la diferencia entre el peso seco total de la muestra y el peso seco de la suma de las fracciones arenosa y gravillenta. El tamaño de grano fue calculado por regla de tres y, por lo tanto, fue expresado como porcentajes de grava, de arena y de lodo. El contenido de materia orgánica en el sedimento fue calculado de acuerdo con el método de pérdida por ignición de Dean (1974), que consiste en secar submuestras de sedimento de unos 2 g de peso húmedo en una estufa a 60°C durante 24 horas y pesarla. Posteriormente, se coloca en una mufla a 550 °C durante una hora para obtener el peso seco libre de cenizas. El porcentaje de materia orgánica se calcula por regla de tres y corresponde al material quemado en la mufla. Análisis de datos Con fines comparativos entre los dos equipos utilizados, la abundancia fue expresada en términos de densidad, como número de individuos por metro cuadrado (ind m-2). De acuerdo con Méndez y Hendrickx (2012), la densidad fue estimada considerando las características de los diferentes aparatos para recolectar las coPoliquetos (A nnelida , Polychaeta ) del talud continental suroriental 167 munidades de poliquetos de la infauna (draga Karling) y las de la epifauna (trineo bentónico). Para cada estación se calculó el índice de diversidad de Shannon (H’log2) considerando, por separado, los datos de densidad de poliquetos de la infauna y los de la epifauna (programa Primer 5.1 para Windows; Clarke y Gorley 2006). Con el fin de observar el posible efecto de la estacionalidad y la localización de las estaciones sobre la distribución de la poliquetofauna, se realizaron gráficas de escalamiento multidimensional (MDS por sus siglas en inglés) utilizando el índice de similitud de Bray-Curtis y la raíz cuarta de las densidades para evitar el efecto de las especies raras o muy abundantes (Field et al. 1982) en cada crucero y de la totalidad de los datos obtenidos durante los cuatro cruceros (programa Primer 5.1 para Windows; Clarke y Gorley 2006; datos no mostrados). Debido a que la mayoría de las muestras estaban agregadas (estrés = 0.01), se descartó la posibilidad de alguna influencia de las estaciones del año o de las posiciones de las localidades de muestreo, indicando que otras variables abióticas son las principales responsables de los patrones de distribución de los poliquetos en el área de estudio. Para comprobarlo, se obtuvieron los índices de correlación de Pearson (programa Excel 2000) entre pares de variables bióticas y abióticas. Las variables bióticas consideradas fueron la densidad, el número de especies y la diversidad, mientras que las abióticas fueron la profundidad, la temperatura, el oxígeno disuelto, el contenido de materia orgánica en el sedimento y los porcentajes de lodo, arena y grava. Este análisis se realizó por separado para las comunidades de la infauna y de la epifauna. Las especies características de cada una de las comunidades de poliquetos estudiadas se obtuvieron mediante la dominancia y la frecuencia de aparición en las estaciones muestreadas. Las especies o taxa dominantes se determinaron de acuerdo con el índice de dominancia media propuesto por Picard (1965), cuya fórmula es: Dm= (ni/N)x100, donde Dm= índice de dominancia media para la especie i; ni= número de individuos pertenecientes a la especie i; N= número total de individuos pertenecientes a todas las especies. Las especies consideradas como dominantes son aquellas cuya dominancia media es mayor o igual a uno. La frecuencia de aparición de las especies en las estaciones fue calculada de acuerdo con el índice de Glémarec (1964), siguiendo la fórmula: 168 Biodiversidad y comunidades del talud continental del Pacífico mexicano F= (mi x 100)/M, donde mi= número de muestras en las que aparece la especie i; M= número total de muestras. Las especies consideradas como frecuentes son las que presentan un valor de F mayor o igual al 15 %. Con el fin de conocer a fondo cuales son los factores ambientales que más influyen en la distribución de los poliquetos tanto de la infauna como de la epifauna del golfo de California suroriental, se realizó un análisis de correspondencias canónicas (programa Multi Variate Statistical Package; Kovach 1998). Los valores de las variables bióticas fueron las densidades de las especies dominantes y frecuentes para cada comunidad de poliquetos durante todo el estudio y considerando todas las estaciones muestreadas. Las variables abióticas fueron la profundidad, la temperatura, el oxígeno disuelto, el contenido de materia orgánica en el sedimento y los porcentajes de lodo, de arena y de grava. Para evitar distorsión de los datos, en dichos análisis se consideraron únicamente las variables abióticas que presentaron correlación de Pearson significativa con al menos una de las variables bióticas. RESULTADOS Fauna La posición e intervalos de profundidad de las estaciones en donde se encontraron poliquetos pertenecientes a la infauna y a la epifauna se encuentran en el cuadro 1. Las estaciones que fueron muestreadas con la draga Karling y con el trineo bentónico se detallan en las secciones referentes a la infauna y a la epifauna, respectivamente. Las posiciones de las estaciones corresponden a la primera vez que cada una de ellas fue visitada. Se encontraron 106 taxa de poliquetos correspondientes a 34 familias, de los cuales 73 se identificaron a nivel de especie. Algunos especímenes adicionales de los géneros Polydora, Cirratulus, Tharyx, Notomastus, Eumida, Sthenolepis, Sigambra, Pareurythoe, Amage, Samytha y Thelepus no pudieron ser identificados a nivel de especie debido a su deterioro. Asimismo, algunos ejemplares de las familias Spionidae, Maldanidae, Opheliidae, Phyllodocidae, Nereididae, Glyceridae, Lumbrineridae, Ampharetidae, Sabellidae y Serpulidae carecían de estructuras imprescindibles para la identificación taxonómica, por lo que únicaPoliquetos (A nnelida , Polychaeta ) del talud continental suroriental 169 Cuadro 1. Posiciones e intervalos de profundidad de las estaciones donde se recolectaron poliquetos. Intervalos de profundidad (m) Estación Latitud N Longitud O TALUD IV TALUD V TALUD VI 3 22 00.2 106 28.1 732 770-780 4 22 04.6 106 34.7 11901250 5 22 00.7 106 39.9 151514701620 1530 6 22 00.0 106 48.1 19502010 11 23 15.0 106 59.0 850-870 825-855 12 23 18.6 107 26.9 11601170 13b 23 30.3 107 44.0 14 23 16.3 107 40.7 2220-2250 18 19 24 15.0 24 16.4 108 17.1 108 24.3 908-944 1196-1200 20 24 14.8 108 35.2 1500-2000 25 26 24 51.7 24 56.3 108 57.9 109 11.8 778-800 1200-1274 27 25 01.2 109 11.1 - 800-860 12801310 - 28 32b 33 33b 24 52.6 26 03.0 25 45.8 26 06.5 109 37.7 109 55.4 109 48.7 110 06.7 2024-2040 1060-1090 - - 34 25 43.8 109 54.0 1244 - 34b 26 05.5 110 10.5 - - 12401270 - 35 25 57.8 110 11.4 2000-2100 - - 170 20802140 940-990 11801200 - 890-950 11601200 12501440 830-850 11901270 15801600 - Biodiversidad y comunidades del talud continental del Pacífico mexicano TALUD VII 740-750 12001230 780-790 10401120 14001450 950-1010 11601180 780-850 11801220 15801600 850-880 12601300 15001520 - Cuadro 2. Lista de poliquetos y su presencia en la comunidad de la Infauna (I) y en la epifauna (E) recolectados con la draga Karling y el trineo bentónico, respectivamente. Especies Orbiniidae Califia calida Hartman, 1957 Leitoscoloplos elongatus (Johnson, 1901) Phylo nudus (Moore, 1911) Paraonidae Aedicira alisetosa Fauchald, 1972 Aedicira longicirrata Fauchald, 1972 Paraonis pycnobranchiata Fauchald, 1972 Spionidae Polydora sp Prionospio vermillionensis Fauchald, 1972 Spiophanes fimbriata Moore, 1923 Spionidae sp Poecilochaetidae Poecilochaetus johnsoni Hartman, 1939 Heterospionidae Heterospio catalinensis (Hartman, 1944) Chaetopteridae Phyllochaetopterus limicolus Hartman, 1960 Cirratulidae Aphelochaeta monilaris Hartman, 1960 Aphelochaeta multifilis (Moore, 1909) Chaetozone corona Berkeley y Berkeley, 1941 Chaetozone setosa Malmgren, 1867 Cirratulus sinincolens Chamberlin, 1919 Cirratulus cf sinincolens Chamberlin, 1919 Cirratulus sp Tharyx tesselata Hartman, 1960 Tharyx sp Capitellidae Neoheteromastus lineus Hartman, 1960 Notomastus sp Poliquetos (A nnelida , Polychaeta ) I X X X X X X X E X X X X X X X X X X X X X X X X X X X X X del talud continental suroriental 171 Cuadro 2. Continúa. Especies Maldanidae Asychis ramosus Levenstein, 1961 Maldane cristata Treadwell, 1923 Maldanidae sp 1 Maldanidae sp 2 Maldanidae sp 3 Maldanidae sp 4 Maldanidae sp 5 Maldanidae sp 6 Maldanidae sp 7 Maldanidae sp 8 Maldanidae indeterminados Opheliidae Ophelina acuminata (Hartman, 1960) Travisia brevis Moore, 1923 Opheliidae indeterminados Scalibregmidae Scalibregma inflatum Rathke, 1843 Phyllodocidae Eteone sp Eulalia anoculata Fauchald, 1972 Eulalia strigata Hartman, 1968 Eumida sanguinea (Oersted, 1843) Eumida sp Paranaitis polynoides (Moore, 1909) Steggoa gracilior Chamberlin, 1919 Phyllodocidae indeterminados Aphroditidae Aphrodita parva Moore, 1905 Laetmonice pellucida Moore, 1903 Polynoidae Halosydna johnsoni (Darboux, 1899) Polynoidae sp 1 172 I X X X X X X X X X X X X X X Biodiversidad y comunidades del talud continental del Pacífico mexicano E X X X X X X X X X X X X X X X X X X X X Cuadro 2. Continúa. Especies Polynoidae sp 2 Polynoidae sp 3 Sigalionidae Leanira alba Moore, 1910 Sthenolepis sp Pilargiidae Ancistrosyllis hartmanae Pettibone, 1966 Sigambra sp Syllidae Exogone lourei Berkeley & Berkeley, 1938 Nereididae Ceratocephale pacifica Hartman, 1960 Ceratonereis vermillionensis Fauchald, 1972 Nereis anoculopsis Fauchald, 1972 Nereididae indeterminados Glyceridae Glyceridae indeterminados Goniadidae Goniada brunnea Treadwell, 1906 Nephtyidae Nephtys paradoxa Malm, 1874 Amphinomidae "Pareurythoe" sp Pseudeurythoe ambigua (Monro, 1933) Onuphidae Anchinothria fissurata Fauchald, 1972 Nothria abyssalis Fauchald, 1968 Onuphis iridescens (Johnson, 1901) Onuphis profundi Fauchald, 1968 Eunicidae Eunice megabranchia Fauchald, 1970 Lumbrineridae Eranno bicirrata (Treadwell, 1929) Poliquetos (A nnelida , Polychaeta ) I X X X X X X X E X X X X X X X X X X X X X X X X X X X del talud continental suroriental 173 Cuadro 2. Continúa. Especies Lumbrineris cedroensis Fauchald, 1970 Ninoe foliosa Fauchald, 1972 Ninoe fuscoides Fauchald, 1972 Ninoe longibranchia Fauchald, 1972 Lumbrineridae indeterminados Arabellidae Drilonereis falcata Moore, 1911 Sternaspidae Sternaspis fossor Stimpson, 1854 Flabelligeridae Brada pluribranchiata (Moore, 1923) Ilyphagus ilyvestis Hartman 1960 Pherusa abyssalis Fauchald, 1972 Fauveliopsidae Fauveliopsis rugosa Fauchald, 1972 Ampharetidae Amage n. sp ? Ampharete acutifrons (Grube, 1860) Ampharete arctica Malmgren, 1866 Amphicteis scaphobranchia Moore, 1906 Egamella quadribranchiata Fauchald, 1972 Melinna exilia Fauchald, 1972 Melinnampharete gracilis Hartman, 1969 Mexamage corrugata Fauchald, 1972 Paramage scutata Moore, 1923 Samytha n sp? Samythella pala Fauchald, 1972 Schistocomus hiltoni Chamberlin, 1919 Ampharetidae indeterminados Terebellidae Thelepus hamatus Moore, 1905 Thelepus setosus (Quatrefages, 1865) Thelepus sp 174 I X X X X X X X X X X X X X X X X X X X Biodiversidad y comunidades del talud continental del Pacífico mexicano E X X X X X X X X X X X X X X X X X X X X Cuadro 2. Continúa. Especies Streblosoma crassibranchia Treadwell, 1914 Trichobranchidae Terebellides stroemi Sars, 1835 Sabellidae Chone gracilis Moore, 1906 Pseudopotamilla intermedia Moore, 1905 Sabellidae indeterminados Serpulidae Serpulidae indeterminados I X X X X X E X X X mente pudieron ser catalogados como “indeterminados”. Los anfarétidos Amage sp. y Samytha sp. presentan características que no coinciden con los especímenes de los mismos géneros registrados en el golfo de California, por lo que probablemente son especies no descritas. Se encontraron 83 taxa pertenecientes a la comunidad de poliquetos de la infauna y 52 a la de la epifauna, de los cuales únicamente 29 pertenecieron tanto a la infauna como a la epifauna (Cuadro 2). En algunos casos, los nombres de especies registrados en Méndez (2006) han sido actualizados aquí debido a cambios en la literatura reciente. La revisión y actualización de la literatura han propiciado cambios de nombres de especies (por ejemplo, Terebellides stroemi, Chaetozone setosa y Ampharete arctica, que también fueron registradas en mar profundo por Fauchald (1972) pero habían sido consideradas como cosmopolitas) o cambios en la ubicación taxonómica, como el género Travisia, que actualmente está ubicado dentro de la familia Scalibregmidae (Julio Parapar, com. pers.). Las familias mejor representadas en el área de estudio fueron Ampharetidae (13 taxa), Maldanidae (11 taxa), Cirratulidae (9 taxa) y Phyllodocidae (8 taxa). De acuerdo con su presencia en las diferentes estaciones de muestreo y en los diferentes cruceros, las especies más representativas del área de estudio fueron Melinna exilia, Melinnampharete gracilis, Thelepus hamatus, Mexamage corrugata, Terebellides stroemi, Fauveliopsis rugosa, Nothria iridiscens, Califia calida, Neoheteromastus lineus y Maldane cristata. El pilárgido Ancistrosyllis hartmanae constituye un nuevo registro de distribución en fondos blandos del golfo de California o áreas adyacentes. Asimismo, se encontraron nuevos registros de disPoliquetos (A nnelida , Polychaeta ) del talud continental suroriental 175 Cuadro 3. Descripción de los tubos o estructuras protectoras no descritas con anterioridad. ND, no hay datos; LC, lodo compacto; CH, capa hialina; DE, diámetro externo; L, longitud; P, proporción entre organismo y tubo. Eespecies LC CH Chaetopteridae Phyllochaetopterus limicolus Maldanidae Maldane cristata Onuphidae Anchinothria fissurata Eunicidae Eunice megabranchia Fauveliopsidae Fauveliopsis rugosa ND ND ND ND Si Si 0.5 ND ND 0.5 ND ND Esponjas ND ND Conchas de escafópodos (Cadulus fusiformis, Rhabdus dalli, Fissidentalium megathyris, Dentalium agassizi) y lodo petrificado Si Si ND ND Si Si Ampharetidae Ampharete acutifrons Ampharete arctica Amphicteis scaphobranchia Egamella quadribranchiata Melinna exilia Melinnampharete gracilis Mexamage corrugata Paramage scutata Schistocomus hiltoni 176 DE L (cm) (cm) P 0.5 a 20 0.6 1 Tubo hialino cubierto de fango 12 1.5 Tubo hialino duro, a veces con anémonas o tubos serpúlidos 1/7 25 Si 1/3 1/6 Si ND ND 0.3 0.2 Si Si 1 Si Si ND ND 1 Otras estructuras 30 15 Tubo arenoso con algas y foraminíferos Lodo de varios colores Lodo compacto y arena fina con foraminíferos y percebes 1/ a Lodo compacto y arena fina 1/10 1/3 a Con foraminíferos 1/2 Algunos con esponjas y foraminíferos 1/10 Biodiversidad y comunidades del talud continental del Pacífico mexicano Poliquetos (A nnelida , Polychaeta ) del talud continental suroriental 177 Orbiniidae Califia calida Phylo nudus Paraonidae Aedicira alisetosa Spionidae Spiophanes fimbriata Chaetopteridae Phyllochaetopterus limicolus Cirratulidae Aphelocheta multifilis Chaetozone setosa Cirratulus sp Tharyx sp Capitellidae Neoheteromastus lineus Notomastus sp Maldanidae Especies 5.8 Talud IV 3 18 19 2.5 0.8 20 3.3 25 0.8 1.7 1.7 0.8 26 0.8 0.8 28 0.8 33 34 35 0.8 0.8 Talud V 3 5 6 4.0 12 14 2.5 18 0.8 0.8 19 1.7 25 0.8 0.8 26 Cuadro 4. Densidad estimada (ind/m2) de poliquetos de la infauna recolectados con la draga Karling durante los cruceros TALUD IV y V. Especies Biodiversidad y comunidades del talud continental del Pacífico mexicano Asychis ramosus Maldane cristata Maldanidae sp 1 Maldanidae sp 2 Maldanidae sp 3 Maldanidae sp 4 Maldanidae sp 5 Maldanidae indeterminados Opheliidae Ophelina pallida Travisia brevis Scalibregmidae Scalibregma inflatum Phyllodocidae Eulalia strigata Polynoidae Polynoidae sp 2 Sigalionidae Sthenolepis sp Pilargiidae Cuadro 4. Continúa. 178 0.8 1.7 Talud IV 3 18 0.8 0.8 1.7 19 0.8 20 1.7 3.3 25 26 0.8 28 0.8 5.0 9.1 33 7.4 34 0.8 35 0.8 Talud V 3 5 0.8 6 0.8 12 0.8 0.8 14 0.8 18 0.8 19 0.8 25 0.8 26 Poliquetos (A nnelida , Polychaeta ) del talud continental suroriental 179 Ancistrosyllis hartmanae Nereididae Ceratonereis vermillionensis Nereis anoculopsis Nereididae indeterminados Glyceridae Glyceridae indeterminados Goniadidae Goniada brunnea Nephtyidae Nephtys paradoxa Amphinomidae (?) Pareurythoe sp. Pseudeurythoe ambigua Onuphidae Onuphis iridescens Onuphis profundi Eunicidae Eunice megabranchia Lumbrineridae Especies Cuadro 4. Continúa. Talud IV 3 18 0.8 19 0.8 0.8 20 0.8 0.8 0.8 25 0.8 1.7 26 0.8 28 0.8 0.8 1.7 0.8 33 34 35 0.8 Talud V 3 5 12 0.8 0.8 0.8 0.8 6 0.8 14 18 1.7 19 25 26 Especies Biodiversidad y comunidades del talud continental del Pacífico mexicano Lumbrineris cedroensis Lumbrineridae indeterminados Sternaspidae Sternaspis fossor Flabelligeridae Brada pluribranchiata Fauveliopsidae Fauveliopsis rugosa Ampharetidae Ampharete arctica Melinna exilia Melinnampharete gracilis Mexamage corrugata Samythella pala Schistocomus hiltoni Ampharetidae indeterminados Terebellidae Thelepus hamatus Cuadro 4. Continúa. 180 0.8 8.3 25 0.8 20 1.7 0.8 1.7 0.8 19 7.4 0.8 0.8 0.8 Talud IV 3 18 0.8 0.8 26 0.8 0.8 28 0.8 3.3 2.5 17.4 0.8 33 34 0.8 0.8 35 1.7 2.5 1.7 Talud V 3 5 0.8 0.8 6 12 14 0.8 18 19 7.4 0.8 25 0.8 1.7 0.8 26 Poliquetos (A nnelida , Polychaeta ) del talud continental suroriental 181 Thelepus setosus Streblosoma crassibranchia Trichobranchidae Terebellides stroemi Sabellidae Chone gracilis Especies Cuadro 4. Continúa. Talud IV 3 18 19 1.7 25 0.8 0.8 20 1.7 1.7 26 28 0.8 33 34 35 Talud V 3 5 6 0.8 12 0.8 14 18 19 25 26 182 Biodiversidad y comunidades del talud continental del Pacífico mexicano Polydora sp Prionospio vermillionensis Spiophanes fimbriata Poecilochaetidae Poecilochaetus johnsoni Heterospionidae Heterospio catalinensis Chaetopteridae Orbiniidae Califia calida Leitoscoloplos elongatus Paraonidae Aedicira alisetosa Aedicira longicirrata Paraonis pycnobranchiata Spionidae Especies 0.8 0.8 0.8 2.5 0.8 0.8 0.8 0.8 0.8 1.7 0.8 0.8 0.8 0.8 11 12 13b 18 19 25 26 27 3 4 26 27 34 TALUD VII 25 3 4 5 20 TALUD VI 11 12 18 19 0.8 0.8 0.8 1.7 32b 33b 34b Cuadro 5. Densidad estimada (ind/m2) de poliquetos de la infauna recolectados con la draga Karling durante los cruceros TALUD VI y VII. Poliquetos (A nnelida , Polychaeta ) del talud continental suroriental 183 3 TALUD VII 1.7 1.7 9.1 2.5 2.5 0.8 2.5 0.8 0.8 0.8 2.5 3.3 1.7 1.7 1.7 1.7 0.8 0.8 7.4 0.8 0.8 1.7 0.8 1.7 3.3 14.9 1.7 1.7 0.8 4 5 11 12 18 19 20 25 26 27 34 3 4 11 12 13b 18 19 25 26 27 0.8 0.8 0.8 1.7 0.8 3.3 0.8 0.8 1.7 TALUD VI Phyllochaetopterus limicolus Cirratulidae Aphelocheta monilaris Aphelocheta multifilis Chaetozone corona Chaetozone 0.8 setosa Tharyx tesselata Tharyx sp Capitellidae Neoheteromastus lineus Maldanidae Asychis ramosus Maldane cristata Maldanidae sp 2 Maldanidae sp 3 Maldanidae sp 5 Maldanidae sp 6 Maldanidae sp 7 Maldanidae sp 8 Especies Cuadro 5. Continúa. 4.1 2.5 0.8 0.8 0.8 8.3 15.7 32b 33b 34b 0.8 0.8 184 Biodiversidad y comunidades del talud continental del Pacífico mexicano Maldanidae indeterminados Opheliidae Ophelina pallida Travisia brevis Opheliidae indeterminados Scalibregmidae Scalibregma inflatum Phyllodocidae Eteone sp Eulalia anoculata Paranaitis polynoides Polynoidae Halosydna johnsoni Sigalionidae Leanira alba Pilargiidae Sigambra sp Syllidae Especies 0.8 0.8 0.8 3 4 5 11 12 18 19 20 25 2.5 1.7 3.3 TALUD VI Cuadro 5. Continúa. 0.8 0.8 0.8 0.8 0.8 1.7 4 TALUD VII 26 27 34 3 0.8 0.8 0.8 11 12 13b 18 19 25 1.7 0.8 26 27 2.5 2.5 0.8 1.7 32b 33b 34b 3.3 0.8 Poliquetos (A nnelida , Polychaeta ) del talud continental suroriental 185 Melinnampharete gracilis Mexamage corrugata Samythella pala Schistocomus hiltoni Ampharetidae indeterminados Terebellidae Thelepus hamatus Streblosoma crassibranchia Trichobranchidae Terebellides stroemi Sabellidae Chone gracilis Especies 0.8 3 4 0.8 0.8 0.8 0.8 0.8 0.8 0.8 0.8 0.8 0.8 0.8 0.8 0.8 0.8 26 27 32b 33b 34b 0.8 1.7 0.8 1.7 0.8 19 25 1.7 0.8 0.8 1.7 11 12 13b 18 0.8 0.8 3.3 25 26 27 34 3 4 TALUD VII 0.8 0.8 5 11 12 18 19 20 0.8 0.8 TALUD VI Cuadro 5. Continúa. 186 Biodiversidad y comunidades del talud continental del Pacífico mexicano V TALUD IV Estación 3 18 19 20 25 26 28 33 34 35 3 5 6 12 14 18 19 25 26 3.6 3.7 3.1 5.1 3.7 2.0 4.3 3.5 2.5 5.5 3.0 2.2 3.8 2.1 5.0 4.0 5.2 3.8 793 926 1198 1510 789 1237 2032 1075 1220 2050 732 1568 1980 1165 2110 965 1190 830 1295 0.19 1.03 0.73 1.26 0.29 0.76 2.20 0.51 0.79 1.68 0.12 1.15 1.88 0.54 1.98 0.15 0.38 0.13 0.53 Tempera- Oxígeno tura (°C) (ml/l) Profundidad media (m) 18.78 14.03 15.19 15.47 9.86 14.69 14.96 13.86 8.26 10.27 17.23 15.67 15.50 11.03 13.64 13.74 14.05 10.87 13.81 Materia orgánica (%) 99.4 99.2 99.5 98.1 99.1 99.4 99.2 99.9 20.6 93.5 100.0 99.9 94.9 26.5 100.0 100.0 100.0 98.1 100.0 Lodo (%) 0.6 0.8 0.5 1.9 0.9 0.6 0.8 0.1 79.4 6.5 0.0 0.1 5.1 73.5 0.0 0.0 0.0 1.5 0.0 Arena (%) 0.0 0.0 0.0 0.0 0.0 0.0 0.0 0.0 0.0 0.0 0.0 0.0 0.0 0.0 0.0 0.0 0.0 0.4 0.0 Grava (%) 0.0 11.6 8.3 11.6 27.3 10.7 5.8 43.8 7.4 3.3 1.7 7.4 4.1 3.3 3.3 3.3 5.0 10.7 5.8 Densidad (ind/m2) 0 7 7 9 10 9 7 12 1 4 1 6 5 4 4 2 5 4 6 0.0 2.3 2.7 3.0 2.7 3.1 2.9 2.7 0.0 2.0 0.0 2.4 2.3 2.0 2.0 0.8 1.9 1.4 2.5 Número de Diversidad especies (H’log2) Cuadro 6. Variables abióticas y bióticas registradas durante el muestreo de los poliquetos de la infauna con la draga Karling. Poliquetos (A nnelida , Polychaeta ) del talud continental suroriental 187 VII TALUD VI Estación 3 4 5 11 12 18 19 20 25 26 27 34 3 4 11 12 13b 18 19 Cuadro 6. Continúa 775 1220 1500 840 1105 920 1180 1345 840 1230 1590 1200 745 1215 785 1080 1425 980 1170 Profundidad media (m) 5.8 3.7 2.8 5.9 4.1 5.3 3.7 3.0 5.6 3.7 2.8 3.5 6.2 3.6 5.6 3.9 3.0 5.2 3.6 0.21 1.74 0.17 0.50 0.29 0.73 1.28 0.22 1.40 1.43 0.87 0.77 0.82 0.15 0.18 1.04 0.13 0.08 Tempera- Oxígeno tura (°C) (ml/l) 19.90 14.67 13.36 15.58 10.66 12.21 14.41 14.52 10.90 13.06 11.58 14.41 17.42 8.55 17.47 13.97 10.55 13.12 12.56 Materia orgánica (%) 98.8 91.8 92.7 98.8 93.6 99.8 99.6 99.7 97.3 99.5 97.8 99.6 60.3 93.7 100.0 99.9 88.4 100.0 100.0 Lodo (%) 1.2 8.2 7.3 1.2 6.4 0.2 0.4 0.3 2.7 0.5 2.2 0.4 1.0 4.6 0.0 0.1 10.4 0.0 0.0 Arena (%) 0.0 0.0 0.0 0.0 0.0 0.0 0.0 0.0 0.0 0.0 0.0 0.0 38.7 1.7 0.0 0.0 1.2 0.0 0.0 Grava (%) 1.7 2.5 12.4 0.8 0.0 14.9 5.0 19.8 10.7 8.3 14.9 13.2 0.8 33.9 23.1 3.3 23.1 4.1 8.3 Densidad (ind/m2) 2 3 10 1 0 7 6 13 7 6 11 11 1 13 1 3 14 4 8 1.0 1.0 3.2 0.0 0.0 2.0 2.5 3.5 2.6 2.3 3.2 3.3 0.0 2.5 0.0 1.5 3.3 1.9 2.9 Número de Diversidad especies (H’log2) 188 Biodiversidad y comunidades del talud continental del Pacífico mexicano TALUD Estación 25 26 27 32b 33b 34b Cuadro 6. Continúa 4.7 3.6 2.7 5.9 3.6 3.0 815 1200 1550 865 1270 1510 0.04 0.35 1.39 0.10 0.60 0.78 Tempera- Oxígeno tura (°C) (ml/l) Profundidad media (m) 12.21 13.42 14.76 14.74 15.87 15.36 Materia orgánica (%) 99.7 97.6 100.0 100.0 99.8 100.0 Lodo (%) 0.3 2.4 0.0 0.0 0.2 0.0 Arena (%) 0.0 0.0 0.0 0.0 0.0 0.0 Grava (%) 23.1 6.6 33.9 0.8 29.8 31.4 Densidad (ind/m2) 4 6 15 1 22 10 0.9 2.4 3.0 0.0 4.2 2.2 Número de Diversidad especies (H’log2) Poliquetos (A nnelida , Polychaeta ) del talud continental suroriental 189 TALUD VI TALUD VII 3 4 5 11 12 18 19 20 25 26 27 34 3 4 11 12 13b 18 19 25 26 27 32b Exogone lourei 0.8 0.8 0.8 Nereididae Ceratocephale 23.1 pacifica Nereididae 0.8 indeterminados Goniadidae Goniada 0.8 1.7 brunnea Amphinomidae Pseudeurythoe 1.7 ambigua Onuphidae Onuphis 0.8 0.8 19.0 1.7 1.7 0.8 0.8 iridescens Onuphis 1.7 profundi Eunicidae Eunice 0.8 megabranchia Lumbrineridae Eranno bicirrata 0.8 0.8 Ninoe foliosa 0.8 Ninoe fuscoides 0.8 Especies Cuadro 5. Continúa. 0.8 0.8 2.5 0.8 33b 34b 190 Biodiversidad y comunidades del talud continental del Pacífico mexicano Ninoe longibranchia Lumbrineridae indeterminados Arabellidae Drilonereis falcata Sternaspidae Sternaspis fossor Flabelligeridae Brada pluribranchiata Ilyphagus ilyvestis Pherusa abyssalis Fauveliopsidae Fauveliopsis rugosa Ampharetidae Ampharete arctica Melinna exilia Especies 5 0.8 0.8 3 4 TALUD VI Cuadro 5. Continúa. 1.7 0.8 2.5 2.5 0.0 0.8 1.7 1.7 2.5 2.5 0.8 0.8 0.8 26 27 34 3 4 1.7 0.8 25 1.7 11 12 18 19 20 0.8 1.7 2.5 0.8 19.0 1.7 11 12 13b 18 19 25 TALUD VII 0.8 0.8 1.7 0.8 0.8 0.8 26 27 32b 33b 34b 0.8 Cuadro 7. Índices de correlación de Pearson entre las variables abióticas y bióticas calculados con los datos de la comunidad de poliquetos del sedimento (***) p<0.001; (**) p<0.01; NS= no significativo). Variables Profundidad Temperatura Oxígeno Materia orgánica Lodo Arena Grava Densidad NS ** -0.160 NS NS NS NS NS Número de especies *** 0.297 *** -0.441 *** 0.327 ** -0.168 ** 0.219 ** -0.170 ** -0.186 Diversidad *** 0.476 *** -0.594 *** 0.472 ** -0.194 *** 0.253 ** -0.172 *** -0.256 tribución batimétrica para Eumida sanguinea (2000 a 2100 m), Steggoa gracilior (1244 m), Halosydna johnsoni (1160 a 1230 m), Ancistrosyllis hartmanae (1500 a 2040 m), Pseudeurythoe ambigua (890 a 2140 m) y Melinnampharete gracilis (700-1500 m) (Méndez 2006, 2009). Con el fin de facilitar futuros estudios taxonómicos, se describieron los tubos o estructuras de protección de Maldane cristata, Anchinothria fissurata, Eunice megabranchia, Paramage scutata, Ampharete acutifrons, Amphicteis scaphobranchiata, Egamella quadribranchiata, Melinna exilia y Mexamage corrugata, los cuales no habían sido descritos con anterioridad, así como los de Phyllochaetopterus limicolus, Fauveliopsis rugosa, Ampharete arctica, Melinnampharete gracilis y Schistocomus hiltoni, cuya descripción actual complementa la información mencionada previamente por otros autores (Cuadro 3). Estas descripciones se basan en la consistencia del tubo (generalmente consisten de una capa hialina a la cual se agregan partículas de lodo o arena), en el diámetro externo, en la longitud, a la proporción del animal con respecto a la longitud del tubo expresado en números fragmentarios (por ejemplo, el animal ocupa 1/6 parte del tubo), así como en la presencia de otras estructuras que sirven de protección al gusano, tales como esponjas o tubos hialinos muy duros (Figs. 2, 4 y 5). Los ejemplares de F. rugosa se encontraron en conchas de los escafópodos Cadulus (Gadila) fusiformis Pilsbry y Sharp, 1898 (Fig. 3a), Rhabdus dalli (Pilsbry y Sharp, 1897) (Fig. 3b), Fissidentalium megathyris (Dall, 1890) (Fig. 3c) y Dentalium agassizi Pilsbry y Sharp, 1897 (Fig. 3d), así como en foraminíferos, probablemente del género Bathysiphon (Sergio Salazar-Vallejo, com. pers.) (Fig. 3e). Poliquetos (A nnelida , Polychaeta ) del talud continental suroriental 191 Figura 2. Tubos y otras estructuras protectoras de a) Phyllochaetopterus limicolus, b) Maldane cristata, c) Anchinothria fissurata, d) Eunice megabranchia (las escalas equivalen a 0.5 cm; las flechas señalan a los gusanos; fotos b-d tomadas por Beatriz Yáñez Rivera). a b c d 192 Biodiversidad y comunidades del talud continental del Pacífico mexicano Figura 3. Conchas de los escafópodos y formainíferos en los que se encontraron especímenes de Fauveliopsis rugosa. A) Cadulus (Gadila) fusiformis, b) Rhabdus dalli, c) Fissidentalium megathyris, d) Dentalium agassizi y e) foraminíferos. Escalas 0.5 cm; las flechas señalan a los gusanos. Fotos tomadas por Beatriz Yáñez Rivera). a b d c e Poliquetos (A nnelida , Polychaeta ) del talud continental suroriental 193 Figura 4. Tubos de los anfarétidos a) Ampharete acutifrons, b) Ampharete arctica, c) Amphicteis scaphobranchia, d) Egamella quadribranchiata, e) Melinna exilia (las escalas equivalen a 0.5 cm; las flechas señalan a los gusanos; fotos tomadas por Beatriz Yáñez Rivera). a d 194 b c e Biodiversidad y comunidades del talud continental del Pacífico mexicano Figura 5. Tubos de los anfarétidos a) Melinnampharete gracilis, b) Mexamage corrugata, c) Paramage scutata, d) Schistocomus hiltoni (las escalas equivalen a 0.5 cm; las flechas señalan a los gusanos; fotos tomadas por Beatriz Yáñez Rivera). a b c d Poliquetos (A nnelida , Polychaeta ) del talud continental suroriental 195 Comunidad de poliquetos de la infauna recolectados con la draga Karling Las familias mejor representadas en la comunidad de poliquetos de la infauna, en términos de número de especies dentro del área de estudio, fueron Maldanidae (11 taxa, de los cuales nueve no pudieron ser identificados a nivel de especie), Cirratulidae (cinco especies y dos géneros), Ampharetidae (seis especies y un taxón indeterminado) y Lumbrineridae (cinco especies y un taxón indeterminado) (Cuadros 4 y 5). De acuerdo con la dominancia (Dm ≥ 1 %) y la frecuencia (F ≥ 15 %), 26 taxa resultaron ser los más representativos a lo largo del área de estudio durante los cuatro cruceros: Ampharetidae indeterminados, Ampharete arctica, Aphelochaeta multifilis, Brada pluribranchiata, Califia calida, Ceratocephale pacifica, Chaetozone setosa, Exogone lourei, Fauveliopsis rugosa, Lumbrineridae indeterminados, Maldanidae indeterminados, Maldane cristata, Mexamage corrugata, Melinna exilia, Melinnampharete gracilis, Maldanidae sp. 1, Maldanidae sp. 3, Nereididae indeterminados, Neoheteromastus lineus, Onuphis iridescens, Phyllochaetopterus limicolus, Sternaspis fossor, Thelepus hamatus, Terebellides stroemi, Tharyx sp. y Monticellina tesselata. Los valores de las variables abióticas (profundidad, temperatura, concentración de oxígeno disuelto, contenido de materia orgánica en el sedimento y porcentaje de lodo, de arena y de grava) y de las variables bióticas (densidad, número de especies y diversidad) registrados en las estaciones de muestreo donde se recolectaron poliquetos de la infauna se presentan en el cuadro 6. Los valores del índice de correlación de Pearson indicaron que la profundidad, la temperatura y el oxígeno disuelto fueron las principales variables abióticas responsables del número de especies y de los valores de diversidad de la comunidad de poliquetos de la infauna, mientras que la densidad sólo estuvo significativamente relacionada (negativamente) con la temperatura. El contenido de materia orgánica en el sedimento presentó también una correlación significativa, pero menor que las otras variables, con el número de especies y la diversidad. Los porcentajes de lodo y grava, en términos generales, presentaron una mayor correlación con la diversidad (Cuadro 7). La distribución de las 26 especies dominantes y frecuentes pertenecientes a la comunidad de la infauna, de acuerdo con las variables bióticas obtenidas en el análisis de correspondencias canónicas, indicaron que 34.6 % de la varianza está explicado por el primer eje canónico y 22.1 % por el segundo. La representación espacial de estas especies en relación con las variables abióticas (esquema no mostrado aquí) indicaron que la profundidad fue la variable que más influye en la distribución de los 196 Biodiversidad y comunidades del talud continental del Pacífico mexicano poliquetos; sin embargo, esta distribución estuvo también fuertemente influenciada por el oxígeno disuelto y la temperatura. En cambio, la materia orgánica y la composición granulométrica del sedimento fueron menos importantes (Méndez 2007). Este esquema, sin embargo, sugiere que las especies no dependen exclusivamente de una de las variables abióticas, ya que se localizan un tanto conglomeradas en el gráfico, lo que sugiere que su distribución en el golfo de California suroriental está dada por la combinación de la profundidad, el oxígeno y la temperatura, principalmente. Comunidad de poliquetos de la epifauna recolectados con el trineo bentónico Las familias mejor representadas en la superficie del sustrato, en términos de número de taxa dentro del área de estudio fueron Ampharetidae (10 taxa, de los cuales se identificaron ocho especies y dos géneros), Maldanidae (seis taxa, de los cuales únicamente se pudo identificar una especie) y Phyllodocidae (cinco taxa con tres especies, un género y un taxón indeterminado) (Cuadros 8 y 9) El cuadro 10 incluye los resultados del análisis de las variables bióticas (densidad, número de especies, diversidad) y de las variables abióticas (profundidad, temperatura, concentración de oxígeno disuelto, contenido de materia orgánica en el sedimento y porcentaje de lodo, de arena y de grava), registrados en las estaciones de muestreo donde se recolectaron poliquetos de la epifauna. En el caso de las estaciones 13 y 14 (TALUD IV) y 11 (TALUD V), no se registraron los valores de las variables abióticas debido a problemas de tipo logístico. El anfarétido Melinnampharete gracilis presentó una abundancia extrema (alrededor de 16,000 individuos en un solo arrastre con el trineo bentónico, equivalente a 4.16 ind m-2; Fig. 5a) en la estación 25 del TALUD IV (Méndez 2009), lo que ocasionó un sesgo considerable en los valores de dominancia de las demás especies, ya que se vieron tan reducidos que únicamente resultaban dos especies dominantes. Por este motivo, en el caso de la comunidad que vive en la superficie del sustrato, esta especie fue eliminada de los análisis de dominancia, frecuencia y análisis de correspondencias canónicas. Asimismo, el límite inferior de la frecuencia fue considerado como mayor o igual a 10 %, debido a que utilizando el 15 %, como recomienda Glémarec (1964), únicamente resultaban siete taxa dominantes y frecuentes, con los cuales la interpretación de los resultados del análisis de correspondencias canónicas habría sido dudosa. Así, los 11 taxa más representativos Poliquetos (A nnelida , Polychaeta ) del talud continental suroriental 197 198 Biodiversidad y comunidades del talud continental del Pacífico mexicano 0.0076 0.0022 25 0.0003 33 0.0046 34 Polynoidae Aphrodita parva Aphroditidae 0.0003 0.0005 0.0011 20 0.0003 14 Eumida sp 13 Talud IV Steggoa gracilior Eumida sanguinea Phyllodocidae Maldanidae indeterminados Maldanidae sp 4 Maldanidae sp 1 Maldane cristata Maldanidae Neoheteromastus lineus Capitellidae Cirratulus cf sinincolens Cirratulidae Spionidae sp Spionidae Especies 0.0003 35 11 0.0005 18 0.0003 25 0.0008 0.0005 0.0003 0.0081 0.0035 3 TALUD V Cuadro 8. Densidad estimada (ind/m2) de poliquetos de la epifauna recolectados con el trineo bentónico durante los cruceros TALUD IV y V. Poliquetos (A nnelida , Polychaeta ) del talud continental suroriental 199 Fauveliopsidae Brada pluribranchiata Flabelligeridae Sternaspis fossor Sternaspidae Lumbrineridae indeterminados Ninoe fuscoides Lumbrineridae Eunice megabranchia Eunicidae Nothria abyssalis Anchinothria fissurata Onuphidae "Pareurythoe" sp Amphinomidae Nereis anoculopsis Nereididae Polynoidae sp 3 Polynoidae sp 1 Especies Cuadro 8. Continúa. 13 Talud IV 0.0027 14 20 25 0.0003 0.0005 0.0008 0.0003 0.0003 33 34 0.0003 0.0062 0.0003 35 0.0124 0.0003 3 TALUD V 11 0.0003 0.0003 18 25 200 Biodiversidad y comunidades del talud continental del Pacífico mexicano 25 33 34 35 Serpulidae indeterminados Serpulidae Sabellidae indeterminados Sabellidae Thelepus setosus Thelepus hamatus Terebellidae Schistocomus hiltoni Samytha n sp? Melinnampharete gracilis Melinna exilia 0.0003 0.0097 0.0003 0.0095 Ampharete arctica Egamella quadribranchiata 4.1684 0.0057 Ampharete acutifrons Ampharetidae 0.0805 3 20 13 14 TALUD V Talud IV Fauveliopsis rugosa ESPECIES Cuadro 8. Continúa. 11 0.0008 0.0005 0.0038 0.0259 0.0003 0.0003 0.0005 18 0.0011 25 Poliquetos (A nnelida , Polychaeta ) del talud continental suroriental 201 Orbiniidae Califia calida Chaetopteridae Phyllochaetopterus limicolus Cirratulidae Aphelocheta multifilis Cirratulus sinincolens Maldanidae Maldane cristata Maldanidae sp 5 Maldanidae sp 8 Maldanidae indeterminados Phyllodocidae Paranaitis polynoides Phyllodocidae indeterminados Aphroditidae Aphrodita parva Especies 0.0005 3 TALUD VI 0.0005 18 0.0003 11 13b 18 0.0003 0.0003 0.0297 0.0003 0.0019 0.0003 0.0003 4 0.0008 0.0005 3 0.0008 0.0005 34 0.0070 25 TALUD VII 25 0.0003 0.0019 32b Cuadro 9. Densidad estimada (ind/m2) de poliquetos de la epifauna recolectados con el trineo bentónico durante los cruceros TALUD VI y VII. 202 Biodiversidad y comunidades del talud continental del Pacífico mexicano Laetmonice pellucida Amphinomidae Pseudeurythoe ambigua Onuphidae Nothria abyssalis Eunicidae Eunice megabranchia Lumbrineridae Lumbrineridae indeterminados Arabellidae Drilonereis falcata Flabelligeridae Brada pluribranchiata Fauveliopsidae Fauveliopsis rugosa Ampharetidae Amage sp ? Amphicteis scaphobranchia Melinna exilia Especies Cuadro 9. Continúa. 3 TALUD VI 18 0.0108 0.0014 0.0005 0.0003 0.0003 25 0.0005 0.0141 0.0003 34 0.0011 3 4 TALUD VII 0.0003 11 13b 0.0003 0.0003 0.0003 0.0011 0.0003 18 0.0035 25 32b Poliquetos (A nnelida , Polychaeta ) del talud continental suroriental 203 Melinnampharete gracilis Paramage scutata Schistocomus hiltoni Terebellidae Thelepus hamatus Thelepus setosus Thelepus sp Streblosoma crassibranchia Sabellidae Chone gracilis Pseudopotamilla intermedia Especies Cuadro 9. Continúa. TALUD VI 3 18 0.0003 25 0.0003 0.0003 0.0057 34 3 4 TALUD VII 0.0003 0.0003 11 13b 0.0003 0.0030 18 0.0003 0.0003 0.0003 25 0.1508 32b 204 Biodiversidad y comunidades del talud continental del Pacífico mexicano VII VI V IV TALUD Estación 13 14 20 25 33 34 35 3 11 18 25 3 18 25 34 3 4 11 13b 18 Profundidad media (m) 1510 789 1075 1220 2050 732 965 830 775 920 840 1200 745 1215 785 1425 980 Temperatura (°C) 3.1 5.1 4.3 3.5 2.5 5.5 5.0 5.2 5.8 5.3 5.6 3.5 6.2 3.6 5.6 3.0 5.2 Oxígeno (ml/l) 1.26 0.29 0.51 0.79 1.68 0.12 0.15 0.13 0.21 0.29 0.22 0.87 0.77 0.82 0.15 1.04 0.13 Materia orgánica (%) 15.47 9.86 13.86 8.26 10.27 17.23 13.74 10.87 19.90 12.21 10.90 14.41 17.42 8.55 17.47 10.55 13.12 Lodo (%) 98.1 99.1 99.9 20.6 93.5 100.0 100.0 98.1 98.8 99.8 97.3 99.6 60.3 93.7 100.0 88.4 100.0 Arena (%) 1.9 0.9 0.1 79.4 6.5 0.0 0.0 1.5 1.2 0.2 2.7 0.4 1.0 4.6 0.0 10.4 0.0 Grava (%) 0.0 0.0 0.0 0.0 0.0 0.0 0.0 0.4 0.0 0.0 0.0 0.0 38.7 1.7 0.0 1.2 0.0 Densidad (ind/m2) 0.0000 0.0027 0.0016 4.2662 0.0005 0.0054 0.0262 0.0211 0.0357 0.0024 0.0016 0.0005 0.0005 0.0519 0.0216 0.0016 0.0000 0.0011 0.0003 0.0086 Número de especies 0 1 2 9 2 4 6 4 7 6 3 1 1 12 7 2 0 4 1 11 Diversidad (H’log2) 0.0 0.0 0.9 0.2 1.0 0.8 1.8 1.1 1.4 2.5 1.3 0.0 0.0 1.9 1.4 0.9 0.0 2.0 0.0 2.8 Cuadro 10. Variables abióticas y bióticas registradas durante el muestreo de los poliquetos de la epifauna con el trineo bentónico. Poliquetos (A nnelida , Polychaeta ) del talud continental suroriental 205 TALUD Profundidad Estación media (m) 25 815 32b 865 Temperatura (°C) 4.7 5.9 Oxígeno (ml/l) 0.04 0.10 Materia orgánica (%) 12.21 14.74 Lodo (%) 99.7 100.0 Arena (%) 0.3 0.0 Grava (%) 0.0 0.0 Densidad (ind/m2) 0.1549 0.0022 Número de especies 4 2 Diversidad (H’log2) 0.2 0.5 Tabla 10. Variables abióticas y bióticas registradas durante el muestreo de los poliquetos de la epifauna con el trineo bentónico. Cuadro 11. Índices de correlación de Pearson entre las variables abióticas y bióticas calculados en la comunidad de poliquetos de superficie (***) p<0.001; (**) p<0.01; NS= no significativo). Variables Profundidad Temperatura Oxígeno Materia orgánica Lodo Arena Grava Densidad ** -0.203 *** 0.246 *** -0.258 ** -0.149 NS NS NS Número de especies *** - 0.290 *** 0.443 *** - 0.347 *** -0.257 NS NS NS Diversidad *** - 0.261 *** 0.427 *** 0.333 NS NS NS NS a lo largo del área de estudio durante los cuatro cruceros fueron: Ampharetidae indeterminados, Ampharete arctica, Aphrodita parva, Brada pluribranchiata, Califia calida, Cirratulus sinincolens, Cirratulus cf. sinincolens Fauveliopsis rugosa, Maldane cristata, Melinna exilia, Nothria abyssalis y Schistocomus hiltoni. Los análisis de correlación de Pearson indicaron que la densidad, el número de especies y la diversidad presentaron una correlación significativa negativa con la profundidad y positiva con la temperatura. El oxígeno disuelto y la materia orgánica se correlacionaron significativamente con la densidad y el número de especies de manera inversa y únicamente el oxígeno se correlacionó positivamente con la diversidad (Cuadro 11). Las correlaciones de los diferentes porcentajes de tamaño de grano con las variables bióticas resultaron no significativas. En el caso de las especies de la epifauna, los resultados del análisis de correspondencias canónicas indicaron que el primer factor extrajo 22 % de la varianza, mientras que el segundo 19.7 %. La distribución espacial de las 11 especies dominantes y frecuentes de acuerdo con las variables abióticas indicó que las variables más importantes que influyen sobre la distribución de los poliquetos epibentónicos son el oxígeno disuelto, la temperatura y la profundidad, mientras que la materia orgánica es menos importante. La representación espacial de estas especies en relación con las variables abióticas (esquema no mostrado aquí) sugiere asociaciones de ciertas especies con algunas de las variables ambientales, tales como C. calida con valores altos de temperatura, A. arctica y N. abyssalis con valores máximos de oxígeno, y B. pluribranchiata y C. cf. sinnincolens con valores altos de materia orgánica (Méndez, datos no publicados). 206 Biodiversidad y comunidades del talud continental del Pacífico mexicano DISCUSIÓN Fauna Todas las especies recolectadas en el golfo de California suroriental habían sido registradas previamente en aguas profundas con excepción de dos: Halosydna johnsoni (Hartman 1939a, 1968, Berkeley y Berkeley 1939, 1941, Rioja 1962, Kudenov 1975a), y Ancistrosyllis hartmanae (Pettibone 1966; Fiege y Bögemann 1999), las cuales habían sido encontradas únicamente en aguas someras. Además, se consiguió el primer registro para las aguas del golfo de California y áreas adyacentes (Méndez 2006). La familia Ampharetidae fue la mejor representada en términos de número de taxa en las dos comunidades de poliquetos estudiadas. Desde hace tiempo, se sabe que la densidad de los anfarétidos aumenta con la profundidad y que la familia es dominante en sedimentos abisales (Day 1967, Fauchald y Jumars 1979, Hernández-Alcántara y Solís-Weiss 1993). Por su parte, Fauchald y Jumars (1979) demostraron que algunos poliquetos de mar profundo construyen tubos de ventilación para soportar las condiciones hipóxicas y que los anfarétidos construyen tubos continuamente, lo que puede representar una forma eficiente de locomoción. Muchos de los tubos de anfarétidos recolectados eran largos (más de 30 cm de longitud), anchos (más de 1 cm de diámetro) y robustos (Cuadro 3; Figs. 4 y 5), lo que explica el éxito de esta familia en el área de estudio. Además, los miembros de esta familia son consumidores de depósito, lo que favorece su presencia sobre o dentro del sedimento de este ambiente con altos contenidos de materia orgánica (Fauchald y Jumars 1979). Los maldánidos también estuvieron bien representados en términos de número de taxa, tanto de la epifauna como de la infauna. De acuerdo con Fauchald y Jumars (1979) y Gambi y Giangrande (1985), muchos maldánidos son tubícolas y están generalmente representados por consumidores de depósito de sub-superficie. Los altos contenidos de materia orgánica en el sedimento, así como la dominancia de lodo compacto explican el éxito de los miembros de la familia en este ambiente. La familia Cirratulidae estuvo mejor representada en la comunidad de poliquetos de la infauna. Los miembros de esta familia están catalogados como consumidores de depósito y generalmente son considerados como gusanos no selectivos (Fauchald y Jumars 1979, Gambi y Giangrande 1985). Los cirratúlidos (Levin et al. 2000) y en especial muchas especies del género Tharyx (Jumars 1975), están Poliquetos (A nnelida , Polychaeta ) del talud continental suroriental 207 considerados como uno de los taxa de la macrofauna más abundantes en el mar profundo y este estudio no fue la excepción. La familia Phyllodocidae, cuyas especies son consideradas, en su mayoría, como carnívoras que cazan las presas con la faringe muscular (Fauchald y Jumars 1979) estuvo mejor representada en la epifauna. Gambi y Giangrande (1985) clasificaron esta familia dentro del grupo de los carnívoros, móviles, con faringe sin mandíbulas o estructuras duras, lo que explica su mayor éxito en la superficie del sedimento. Sin embargo, algunos géneros como Eteone pueden ser, además, detritívoros, lo que explica la presencia de Eteone sp. únicamente en la infauna. El hábito de alimentación de depósito tanto de superficie como de sub-superficie parece ser muy importante para las especies habitantes de las zonas batiales y abisales (Fauchald y Jumars 1979). Este es el caso de las especies dominantes y frecuentes pertenecientes a las familias tubícolas Chaetopteridae, Capitellidae y Terebellidae y las no tubícolas Orbiniidae, Flabelligeridae, Syllidae y Sternaspidae. Pocas especies pertenecientes a las familias predominantemente carnívoras (Lumbrineridae) y omnívoras (Nereididae y Onuphidae) fueron también dominantes y frecuentes; éstas probablemente no compiten por alimento con los detritívoros, permitiendo el equilibrio en los fondos marinos profundos. Las especies que resultaron dominantes y frecuentes, tanto en las muestras de la epifauna como en la infauna, pueden ser consideradas como las más representativas de la zona de estudio. Estas fueron el orbínido Califia calida, el maldánido Maldane cristata, el flabeligérido Brada pluribranchiata, el fauveliópsido Fauveliopsis rugosa y los anfarétidos Ampharete arctica, Melinna exilia y Melinnampharete gracilis. El orbínido Califia calida (Fig. 6a) vive en la plataforma continental hasta profundidades abisales, cerca de la isla de San Pedro en Baja California (Fauchald 1972). Hartman (1957) la registró, por primera vez, en la cuenca de San Pedro, en el sur de California, entre 480 y 764.4 m de profundidad, en lodo verdoso. Posteriormente, Hartman, (1969) la encontró en la cuenca de San Pedro y en alta mar, en la plataforma continental profunda y en profundidades abisales, asociada con limo y esponjas silíceas. El maldánido Maldane cristata (Figs. 2b, 6b) ha sido encontrado en lodo en el sur de California y oeste de México, desde la plataforma continental, hasta cañones submarinos (Hartman 1969). Fauchald (1972) lo registró en aguas profundas del sur de California y de Baja California, y también ha sido recolectado en aguas profundas frente a Panamá, en la trinchera de Centroamérica. 208 Biodiversidad y comunidades del talud continental del Pacífico mexicano El flabeligérido Brada pluribranchiata (Fig. 6c) se distribuye en el sur de California, en plataformas y cañones profundos, de 123 a 1400 m, en arenas negras y lodo (Hartman 1969). El fauveliópsido Fauveliopsis rugosa (Fig. 6d) se ha registrado en la isla de Cedros y en cabo Falso, Baja California y frente a las islas Tres Marías (Fauchald 1972). Los ejemplares recolectados en este estudio fueron encontrados dentro de conchas de escafópodos (Figs 3a-d) y en foraminíferos (Fig. 3e). El anfarétido Ampharete arctica (Figs. 4b y 6e) vive en sedimentos mixtos desde la plataforma continental hasta profundidades abisales y se ha considerado como una especie cosmopolita (Hartman 1969, Fauchald 1972). El anfafrétido Melinna exilia (Figs. 4e, 6f) había sido registrado únicamente en una localidad de la cuenca de Guaymas, en el golfo de California (Fauchald 1972). El anfarétido Melinnampharete gracilis (Figs. 5a y 6g) se ha registrado en la cuenca de Santa Cruz a 1846 m, en lodo (Hartman 1969), y en aguas profundas a ambos lados de la península de Baja California (Fauchald 1972). De acuerdo con Salazar-Vallejo y Londoño-Mesa (2004), M. gracilis es la única especie del género Melinnampharete conocida en el Pacífico oriental tropical. Comunidades de poliquetos de la infauna y de la epifauna Los valores de densidad de organismos registrados en la epifauna difirieron, considerablemente, de los obtenidos para la infauna. El trineo bentónico está diseñado para recolectar organismos de la epifauna y algunos poliquetos, especialmente los tubícolas, pueden ser atrapados por este aparato debido a que cuando se encuentran en posición vertical dentro del sustrato, una porción del tubo de unos 2 cm sobresale del sedimento. La naturaleza lodosa del sustrato en la mayoría de las estaciones muestreadas provocó que el trineo se hundiera un poco en el sedimento, favoreciendo la captura únicamente de los tubos que sobresalían. Este hecho, aunado a que la malla interna de la red mide 2.5 cm, tuvo como consecuencia que el trineo haya recolectado menor número de especies que la draga Karling, ya que únicamente fueron atrapados los ejemplares de mayor tamaño o los gusanos pequeños que estaban asociados a otros organismos o sustratos capturados durante el arrastre. Además, no hay que descartar la posibilidad de que varios especímenes se pudieron perder durante el ascenso del trineo en la columna de agua. Estos son los motivos principales de que las densidades registradas en el trineo hayan resultado considerablemente menores que las de la draga Karling. Sin embargo, el Poliquetos (A nnelida , Polychaeta ) del talud continental suroriental 209 número de individuos registrados en cada lance fue considerablemente mayor en el trineo que en la draga debido, principalmente, a que el área barrida por el trineo es muchísimo mayor que la de la draga Karling, además de que esta última, una vez llena, no recolecta más sedimento (ver Hendrickx 2012). Relación con el ambiente Los resultados obtenidos en este estudio demostraron que las comunidades de poliquetos de la epifauna y de la infauna del golfo de California suroriental dependen, fuertemente, de la combinación del efecto de la profundidad, la concentración de oxígeno disuelto y la temperatura. Estudios previos realizados en el mar profundo con diferentes grupos de la macrofauna bentónica han demostrado que la profundidad, el oxígeno y la materia orgánica influyen fuertemente sobre la diversidad Figura 6. Especies más representativas de la zona de estudio por su dominancia y frecuencia. a) Califia calida, b) Maldane cristata, c) Brada pluribranchiata, d) Fauveliopsis rugosa, e) Ampharete arctica, f) Melinna exilia, g) Melinnampharete gracilis (a, según Taylor 1984; b según Hartman 1969; d-g, según Fauchald 1972; a, b, e, f, g, región anterior; c, d, animal completo). A C B F E 210 G Biodiversidad y comunidades del talud continental del Pacífico mexicano D del macrobentos (Levin y Gage 1998), siendo la profundidad uno de los factores que más afectan la distribución de la macrofauna (Jumars 1976, Grassle 1989), como se demostró en los análisis de correlación y de correspondencias canónicas de las dos comunidades estudiadas. Sin embargo, la diversidad de la macrofauna bentónica de mar profundo en función de la profundidad aparentemente es más evidente en otros grupos pertenecientes a la macrofauna bentónica (moluscos y crustáceos) como lo han demostrado Levin et al. (2000) en el noroeste del mar Arábigo y Levin et al. (2001) en el Atlántico norte. Estos autores encontraron que diversos grupos pertenecientes a la macrofauna bentónica, como los poliquetos, oligoquetos, moluscos y algunos foraminíferos grandes, dependen de la posición batimétrica de la zona del mínimo de oxígeno. Asimismo, Hendrickx (2003a, b) indicó la fuerte dependencia de las comunidades de camarones pandálidos y de la cigala del Pacífico Nephropsis occidentalis en ambientes con hipoxia, localizados entre los 1000 y 1500 m de profundidad en esta misma zona de estudio. Hendrickx (2001) propuso que las estaciones de muestreo con concentración de oxígeno superiores a 2.0 ml l-1 (en profundidades mayores a 2000 m) estaban habitadas por muy pocas especies de decápodos que fueron recolectados con el trineo bentónico. Lo mismo ocurrió con los poliquetos de la epifauna, donde se observó una correlación negativa entre el número de especies y el oxígeno. Asimismo, Levin (2003) observó un decremento fuerte en la densidad de la macrofauna en el estrato de menor concentración de oxígeno. Lo mismo ocurrió con la densidad de poliquetos de la epifauna, la cual presentó una correlación negativa con el oxígeno. En cambio, en el caso de los poliquetos de la infauna, se encontró un mayor número de especies y mayor diversidad debido, probablemente, a que en esta comunidad se encontraron especies pertenecientes a familias con todos los hábitos alimenticios registrados para el grupo de poliquetos (Fauchald y Jumars 1979, Gambi y Giangrande 1985). Este patrón también fue observado en otras regiones del mundo como el margen occidental de África (Sanders 1969), el Pacífico oriental en México (Levin et al. 1991), el noroeste del mar Arábigo (Levin et al. 1997, 2000) y en los márgenes de Perú y Chile (Levin et al. 2002). Los poliquetos constituyen el taxón más tolerante a concentraciones bajas de oxígeno disuelto (Diaz y Rosenberg 1995) y, por lo tanto, son dominantes en las zonas del mínimo de oxígeno (Levin 2001, 2003). Sin embargo, la distribución observada de los poliquetos en relación con el oxígeno en la zona de estudio indica que es difícil distinguir la importancia del estrés producido por el mínimo de oxígeno en la determinación de los cambios de densidad, riqueza específica y diversidad. Poliquetos (A nnelida , Polychaeta ) del talud continental suroriental 211 La ausencia de patrones claros de la densidad, riqueza específica y diversidad de los poliquetos en función de las diferentes concentraciones de oxígeno fue también observada en las comunidades de moluscos de la misma zona de estudio por Zamorano et al. (2007). Por otro lado, Narayanaswamy et al. (2003, 2005) mencionaron la importancia de la temperatura en la distribución de los poliquetos de mar profundo del Atlántico nororiental. Esto concuerda con los resultados de este estudio, ya que se observó una fuerte dependencia de las especies de poliquetos en relación con la temperatura. Sin embargo, el patrón observado entre la comunidad de la epifauna y la de la infauna es inverso. En el caso de esta última comunidad, se observó una correlación negativa y, tras un análisis minucioso, se llegó a la conclusión de que el intervalo preferido para los poliquetos de la infauna es de 2.5 a 4°C (Méndez 2007). Por el contrario, se observó una correlación significativa de la temperatura con la comunidad de la epifauna, pero positiva. Esta discrepancia en ambas comunidades apoya la idea de que la distribución de los poliquetos en esta área no está afectada directamente por una variable ambiental, sino por la combinación de la profundidad, la concentración de oxígeno y la temperatura, las cuales están fuertemente correlacionadas entre sí, como lo han sugerido Wishner et al. (1995) para comunidades pelágicas y bentónicas en una montaña submarina frente a Acapulco. El contenido de materia orgánica en el sedimento ha sido considerado como otro factor importante en la distribución de los poliquetos de mar profundo. Cook et al. (2000) y Gooday et al. (2000, 2001) concluyeron que los poliquetos frecuentemente han demostrado tendencias paralelas a lo largo de gradientes de oxígeno y la materia orgánica. Esto coincide con los valores de densidad y con el número de especies de la comunidad de la epifauna en relación con la materia orgánica (Cuadro 11); sin embargo, en el caso de la comunidad de la infauana, la correlación entre estas dos variables resultó no significativa (Cuadro 7) debido, probablemente, a que el contenido de materia orgánica fue siempre alto y homogéneo en toda el área de estudio. Esto sugiere que en el golfo de California suroriental, para ambas comunidades de poliquetos de aguas profundas, la materia orgánica no es un factor limitante en comparación con las demás variables. La importancia de la materia orgánica ha sido también establecida para la riqueza específica y la diversidad, como fue observado por Levin y Gage (1998) en el Atlántico norte, el Pacífico oriental y el océano Índico, donde el carbono orgánico resultó influir fuertemente en la diversidad de poliquetos. Levin et al. (1994) observaron una reducción de la diversidad en los sitios más enriquecidos de fondos 212 Biodiversidad y comunidades del talud continental del Pacífico mexicano batiales de Carolina del norte y en una montaña submarina frente a Acapulco, como ocurre aquí en ambas comunidades de poliquetos, en las que la diversidad y la materia orgánica mostraron una correlación inversa. En relación con el número de especies, de acuerdo con Levin y Gage (1998) los niveles elevados de materia orgánica pueden conducir a la reducción del número de especies y, por lo tanto, incrementar la dominancia, lo que explica la correlación negativa entre la riqueza específica y la materia orgánica en las dos comunidades estudiadas. De acuerdo con Jumars (1976), los organismos detritívoros de gran talla se ven favorecidos en el mar profundo donde el contenido de materia orgánica es alto. Muchas de las especies dominantes y frecuentes de ambas comunidades estudiadas pertenecen a la categoría de consumidores de depósito (Fauchald y Jumars 1979; Gambi y Giangrande 1985). Así, las cantidades elevadas de materia orgánica registradas en el golfo de California suroriental demuestran que los poliquetos no estaban limitados en cuanto al alimento, al menos durante el período de estudio. El contenido de materia orgánica está inversamente relacionado con el tamaño de grano del sedimento (Milliman 1994). Los análisis de granulometría y de materia orgánica mostraron que las características del sedimento fueron relativamente homogéneas en el golfo de California suroriental, ya que hubo una gran dominancia de lodo en la mayoría de las estaciones y la materia orgánica fue siempre elevada (de 8.26 a 18.78 %) (Cuadros 6 y 10). Por lo tanto, ambas variables, especialmente la composición granulométrica del sedimento, fueron menos importantes que las mencionadas anteriormente en lo que se refiere a patrones de distribución de los poliquetos. A diferencia de los poliquetos de aguas someras, la la composición granulométrica del sedimento no resultó ser un factor limitante en la distribución de ambas comunidades de poliquetos, especialmente los de la epifauna, cuyas correlaciones con las variables bióticas resultaron no significativas (Cuadros 7 y 11). La falta de importancia del tamaño de grano observada en este estudio está apoyada por resultados similares en el Atlántico norte, el Pacífico oriental y el océano Índico, donde los porcentajes de arena y grava fueron considerados como factores no significativos en la distribución de la macrofauna de mar profundo (Levin y Gage 1998). Por el contrario, las correlaciones significativas entre las variables bióticas de la comunidad de la infauna con las características del sedimento se explica por la fuerte asociación de algunos poliquetos con el fondo blando debida a la formación de tubos y por el hábito excavador (tamaño de grano) y por la alimentación de detritos (materia orgánica) de algunas familias (Wieser 1959, Rhoads 1974, Gray 1981). Poliquetos (A nnelida , Polychaeta ) del talud continental suroriental 213 Los resultados de este estudio indican que las comunidades de poliquetos, tanto de la infauna como de la epifauna habitantes del mar profundo del golfo de California suroriental, no se distribuyen siguiendo algún gradiente de temperatura, profundidad, oxígeno, contenido de materia orgánica o tamaño de grano de los sedimentos (Méndez 2007, Méndez, datos no publicados). Las especies no fueron encontradas en intervalos específicos de estas variables dificultando, por lo tanto, el establecimiento de patrones de distribución basados en los análisis de la fauna de poliquetos. Varios estudios de mar profundo realizados en diferentes regiones del mundo (Rosenberg et al. 1991, Etter y Grassle 1992, Diaz y Rosenberg 1995, Wishner et al. 1995, Levin y Gage 1998, Levin et al. 2000, 2001, Rex et al. 2000, Levin 2001, Hendrickx 2003a, Narayanaswamy et al. 2003, 2005) han revelado que la densidad de la macrofauna batial, la riqueza de especies y la diversidad están fuertemente influenciadas por la concentración de oxígeno disuelto y la profundidad. Sin embargo, estos estudios también indican que hay otros factores tales como la temperatura, la materia orgánica en sedimentos, el tamaño de grano, la latitud y los pigmentos del sedimento que son parámetros importantes en la distribución de la macrofauna. En conclusión, los estudios realizados dentro del proyecto TALUD han demostrado que la distribución de los poliquetos de la infauna y la epifauna de aguas profundas del golfo de California suroriental está controlada por la combinación de diversas variables ambientales, siendo la profundidad, la concentración de oxígeno disuelto y la temperatura las más sobresalientes. AGRADECIMIENTOS Este estudio fue financiado por los proyectos 31805-N de Conacyt y IN217306-3 de PAPIIT. Se agradece al Consejo Técnico de la Investigación Científica de la UNAM por otorgar el tiempo de uso del buque oceanográfico “El Puma”. Agradezco al Dr. Eduardo Peters, Director General de Ordenamiento Ecológico y Conservación de los Ecosistemas, a la Dra. Margarita Caso, Directora de Conservación de Ecosistemas y al M. en C. Pablo Zamorano, Jefe del Departamento de Ecología de Comunidades del Instituto Nacional de Ecología por la invitación a participar en la elaboración de este capítulo. La recolección de las muestras de sedimento se realizó gracias a la ayuda de la tripulación del B/O “El Puma”, así como de estudiantes y personal técnico (Arturo Toledano, José Salgado y Arturo Núñez) de la Unidad Académica Mazatlán 214 Biodiversidad y comunidades del talud continental del Pacífico mexicano del Instituto de Ciencias del Mar y Limnología, UNAM. Agradezco a Leslie Harris, Kristian Fauchald, Sergio Salazar y Luis Carrera por su ayuda en la identificación de algunos ejemplares dudosos. Arturo Toledano identificó los moluscos escafópodos. Beatriz Yáñez colaboró en la elaboración de las figuras. REFERENCIAS Berkeley, E. y C. Berkeley. 1939. On a collection of Polychaeta, chiefly from the West Coast of Mexico. The Annals and Magazine of Natural History 11(3): 321-346. Berkeley, E. y C. Berkeley. 1941. On a collection of Polychaeta from Southern California. Bulletin of the Southern California Academy of Sciences 40: 16-59. Blake, J.A. 1985. Polychaeta from the vicinity of deep-sea geothermal vents in the Eastern Pacific I: Euphrosinidae, Phyllodocidae, Hesionidae, Nereidae, Glyceridae, Dorvilleidae, Orbiniidae, and Maldanidae. Bulletin of the Biological Society of Washington 6: 67-101. Blake, J.A. 1994. Introduction to the Polychaeta. Pp 37-108. En: J.A. Blake y B. Hilbig (eds.). Taxonomic Atlas of the Santa Maria Basin and Western Santa Barbara Channel. Vol. 4. Annelida Part 1. Oligochaeta and Polychaeta (Phyllodocidae to Paralacydoniidae). Santa Barbara Museum of Natural History. Blake, J.A. y B. Hilbig. 1990. Polychaeta from the vicinity of deep-sea hydrothermal vents in the Eastern Pacific II. New species and records from the Juan de Fuca and Explorer ridge systems. Pacific Science 44: 219-253. Blake, J.A. y B. Hilbig. 1994. Taxonomic Atlas of the Santa Maria Basin and Western Santa Barbara Channel. Vol. 4. Annelida Part 1. Oligochaeta and Polychaeta (Phyllodocidae to Paralacydoniidae). Santa Barbara Museum of Natural History. 369 pp. Blake, J.A., B. Hilbig y P.H. Scott. 1995. Taxonomic Atlas of the Santa Maria Basin and Western Santa Barbara Channel. Vol. 5. Annelida Part 2. Polychaeta (Phyllodocida, Amphinomida and Eunicida). Santa Barbara Museum of Natural History. 378 pp. Blake, J.A., B. Hilbig y P.H. Scott. 1996. Taxonomic Atlas of the Santa Maria Basin and Western Santa Barbara Channel. Vol. 6. Annelida Part 3. Polychaeta (Orbiniidae to Cossuridae). Santa Barbara Museum of Natural History. 418 pp. Blake, J.A., B. Hilbig y P.H. Scott. 2000. Taxonomic Atlas of the Santa Maria Basin and Western Santa Barbara Channel. Vol. 7. Annelida Part 4. Polychaeta (Flabelligeridae to Ampharetidae). Santa Barbara Museum of Natural History. 348 pp. Blake, J.A., J.A. Muramoto, B. Hilbig y I.P. Williams. 1992. Biological and sedimentological investigations of the sea floor at the proposed U.S. Navy Ocean disposal site. July 1991 surPoliquetos (A nnelida , Polychaeta ) del talud continental suroriental 215 vey (R/V Wecoma). Benthic biology and sediment characterization. Final Report submitted to PRC Environmental Management, Inc., Honolulu, Hawai, 130 pp., apéndice A-D. Chamberlin, R.V. 1919a. The Annelida Polychaeta. Memories of the Museum of Comparative Zoology Harvard 48: 1-514. Chamberlin, R.V. 1919b. New polychaetous annelids from Laguna Beach, California. Journal of Entomology and Zoology 11: 1-23. Clarke, K.R. y R.N. Gorley. 2006. PRIMER v6: User Manual/Tutorial. PRIMER-E, Plymouth. Cook, A.A., P.J.D. Lambshead, L.E. Hawkins, N. Mitchell y L.A. Levin. 2000. Nematode abundance at the oxygen minimum zone in the Arabian Sea. Deep-Sea Research, Part II 47: 75-85. Day, J.H. 1967. A Monograph on the Polychaeta of Southern Africa. Part I: Errantia. Part II: Sedentaria. British Museum of Natural History 656: 1-878. Dean, W.E., Jr. 1974. Determination of carbonate and organic matter in calcareous sediments and sedimentary rocks by loss of ignition: comparison with other methods. Journal of Sedimentary Petrology 44: 242-248. De León-González, J.A., J.R Bastida-Zavala, L.F. Carrera-Parra, M.E. García-Garza, A. PeñaRivera, S.I. Salazar-Vallejo, V. Solís-Weiss (comps.). 2009. Poliquetos (Annelida: Polychaeta) de México y América Tropical. Tomos I-III. Universidad Autónoma de Nuevo León, Nuevo León. 737 pp. Diaz, R.J. y R. Rosenberg. 1995. Marine benthic hypoxia: a review of its ecological effects and the behavioural responses of benthic macrofauna. Oceanography and Marine Biology: an Annual Review 33: 245-303. Etter, R.J. y J.F. Grassle. 1992. Patterns of species diversity in the deep sea as a function of sediment particle size diversity. Nature 360: 576-578. Fauchald, K. 1968. Onuphidae (Polychaeta) from Western Mexico. Allan Hancock Monographs in Marine Biology 3: 1-82. Fauchald, K. 1970. Polychaetous annelids of the families Eunicidae, Lumbrineridae, Iphitimidae, Arabellidae, Lysaretidae and Dorvilleidae from western Mexico. Allan Hancock Monographs in Marine Biology 5: 1-335. Fauchald, K. 1972. Benthic polychaetous annelids from deep water off western Mexico and adjacent areas in the Eastern Pacific Ocean. Allan Hancock Monographs in Marine Biology 7: 1-575. Fauchald, K. 1977. The polychaete worms. Definitions and keys to the orders, families and genera. Natural History Museum of Los Angeles County, and Allan Hancock Foundation. Univeristy of Southern California Science Series 8: 1-188. 216 Biodiversidad y comunidades del talud continental del Pacífico mexicano Fauchald, K. y D.R. Hancock. 1981. Deep-water polychaetes from a transect off central Oregon. Allan Hancock Monographs in Marine Biology 11: 1-73. Fauchald, K. y P.A. Jumars. 1979. The diet of worms: a study of polychaete feeding guilds. Oceanography and Marine Biology: an Annual Review 17: 193-284. Fiege, D. y M. Boggemann. 1999. Ancistrosyllis fioronii, a new species of Pilargidae from the North Sea, with a key and synoptic table of characters for all species of the genus Ancistrosyllis McIntosh 1879 (Annelida, Polychaeta, Pilargidae). Senckenbergiana Biologica 78:135-140. Field, J.G., K.R. Clarke y R.M. Warwick. 1982. A practical strategy for analysing multispecies distribution patterns. Marine Ecology Progress Series 8: 37-52. Folk, R.L. 1965. Petrology of Sedimentary Rocks. Hemphills Publications Company, Austin. 170 pp. Gambi, M.C. y A. Giangrande. 1985. Caratterizzazione e distribuzione delle catagorie trofiche dei policheti nei fondi mobili del golfo di Salerno. Oebalia 11: 223-240. Glémarec, M. 1964. Bionomie benthique de la partie orientale du golfe du Morbihan. Cahiers de Biologie Marine 5: 33-96. Grassle, J.F. 1989. Species diversity in deep-sea communities. Trends in Ecology and Evolution 4: 12-15. Gray, J.S. 1981. The Ecology of Marine Sediments. An introduction to the Structure and Function of Benthic Communities. Cambridge University Press. Cambridge. 185 pp. Gooday, A.J., J.A. Hughes y L.A. Levin. 2001. The foraminiferal macrofauna from three North Carolina (U.S.A.) slope sites with contrasting carbon flux: a comparison with the metazoan macrofauna. Deep-Sea Research, Part II 48: 1709-1739. Gooday, A.J., J.M. Bernhard, L.A. Levin y S. Suhr. 2000. Foraminifera in the Arabian Sea OMZ and other oxygen deficient settings: taxonomic composition, diversity and relation to metazoan faunas. Deep-Sea Research, Part II 47: 54-73. Harris, L.H., J.A. de León-González y S.I. Salazar-Vallejo. 2009. Morfología, métodos, clave para familias y clasificación. Pp 3-32. En: de León-González, J.A., J.R BastidaZavala, L.F. Carrera-Parra, M.E. García-Garza, A. Peña-Rivera, S.I. Salazar-Vallejo y V. Solís-Weiss (comps.). Poliquetos (Annelida:Polychaeta) de México y América Tropical. Tomo I. Universidad Autónoma de Nuevo León. Nuevo León. Hartman, 0. 1938. Descriptions of new species and new generic records of Polychaetous annelids from California of the families Glyceridae, Eunicidae, Stauronereidae, and Opheliidae. University of California. Publications in Zoology 43: 93-1 1 1. Hartman, O. 1939a. Polychaetous annelids. Part I. Aphroditidae to Pisionidae. Allan Hancock Pacific Expeditions 7: 1-156. Poliquetos (A nnelida , Polychaeta ) del talud continental suroriental 217 Hartman, O. 1939b. New species of polychaetous annelids from Southern California. Allan Hancock Pacific Expeditions 7: 157-172. Hartman, O. 1944a. Polychaetous annelids. Part V. Eunicea. Allan Hancock Pacific Expeditions 10: 1-237. Hartman, O. 1944b. Polychaetous annelids from California, including the descriptions of two new genera and nine new species. Allan Hancock Pacific Expeditions 10: 239-307. Hartman, O. 1944c. Polychaetous annelids. Part. VI. Paraonidae, Magelonidae, Longosomidae, Ctenodrilidae, and Sabellariidae. Allan Hancock Pacific Expeditions 10: 311-389. Hartman, O. 1951. Literature of the polychaetous annelids. Edwards Brothers Inc. Ann Arbor, Michigan. 290 pp. Hartman, 0. 1955. Quantitative survey of the benthos of San Pedro Basin, southern California. Part. l. Preliminary Results. Allan Hancock Pacific Expeditions 19: 1-185. Hartman, O. 1957. Orbiniidae, Apistobranchidae, Paraonidae and Longosomidae. Allan Hancock Pacific Expeditions 15: 207-393. Hartman, 0. 1960. Systematic account of some marine invertebrate animals from the deep basins off southern California. Allan Hancock Pacific Expeditions 22: 69-215. Hartman, O. 1961. Polychaetous annelids from California. Allan Hancock Pacific Expeditions 25: 1-226. Hartman, O. 1963. Submarine canyons of southern California Polychaetous annelids. Allan Hancock Pacific Expeditions 27: 1-93. Hartman, O. 1966. Quantitative survey of the benthos of San Pedro Basin, Southern California. Part II. Final results and conclusions. Allan Hancock Pacific Expeditions 19: 187-456. Hartman, O. 1968. Atlas of errantiate polychaetous annelids from California. Allan Hancock Foundation. University of Southern California, Los Angeles. 828 pp. Hartman, O. 1969. Atlas of sedentariate polychaetous annelids from California. Allan Hancock Foundation. University of Southern California, Los Angeles. 812 p. Hendrickx, M.E. 2001. Occurrence of a continental slope decapod crustacean community along the edge of the minimum oxygen zone in the south eastern Gulf of California, México. Belgian Journal of Zoology 131: 95- 110. Hendrickx, M.E. 2003a. Size and abundance of deep water shrimps on the continental slope of the SE Gulf of California, México. Pp. 227- 234. En: M.E. Hendrickx (ed.), Contributions to the Study of East Pacific Crustaceans. Vol. 2. Instituto de Ciencias del Mar y Limnología, UNAM. Hendrickx, M.E. 2003b. Distribution and size of the Pacific deep water lobsterette Nephropsis occidentalis Faxon, 1893 (Decapoda, Astacidea, Nephropidae) in the Gulf of California, México. Crustaceana 76: 207-216. 218 Biodiversidad y comunidades del talud continental del Pacífico mexicano Hendrickx, M.E. 2012. Operaciones oceanográficas en aguas profundas: los retos del pasado, del presente y del proyecto TALUD en el Pacífico mexicano (1989-2009). Pp. 19-99. En: En: P. Zamorano, M.E. Hendrickx y M. Caso (eds.). Biodiversidad y comunidades del talud continental del Pacífico mexicano. Instituto Nacional de Ecología, Secretaría del Medio Ambiente y Recursos Naturales (Semarnat). Hernández-Alcántara, P. 1992. Los poliquetos (Annelida: Polychaeta) de la plataforma continental del Golfo de California, México. Taxonomía, Abundancia numérica y distribución geográfica. Tesis de Maestría, Instituto de Ciencias del Mar y Limnología, Universidad Nacional Autónoma de México, México D.F. 427 pp. Hernández-Alcántara, P. y V. Solís-Weiss. 1993. Distribución latitudinal y batimétrica de los anélidos poliquetos del Orden Terebellomorpha de la plataforma continental del Golfo de California, México. Cuaderno Mexicano de Zoología 1: 65-72. Hernández-Alcántara, P. y V. Solís-Weiss. 1999. Systematics and distribution of the polychaetes (Annelida: Polychaeta) from the sublittoral zone in the Gulf of California. Oceánides 13 (2), 14 (1): 25-38. Hernández-Alcántara. P. y V. Solís-Weiss. 2005. Seasonal variations of the Spionida (Palpata: Canalipalpata) in the sublittoral zone of the Gulf of California. Marine Ecology 26: 273-285. Jumars, P.A. 1975. Target species for deep-sea studies in ecology, genetics, and physiology. Zoological Journal of the Linnean Society 57: 341-348. Jumars, P.A. 1976. Deep-sea species diversity: does it have a characteristic scale? Journal of Marine Research 34: 217-246. Kovach WL. 1998. MVSP -a Multivariate Statistical Package for Windows, ver. 3.0. Kovach Computing Services: Pentraeth, Wales. Kudenov, J.D. 1975a. Errant polychaetes from the Gulf of California, Mexico. Journal of Natural History. London 9: 65-91 Kudenov, J.D. 1975b. Sedentary polychaetes from the Gulf of California, Mexico. Journal of Natural History. London 9: 205-231. Kudenov, J.D. 1980. Annelida: Polychaeta (Bristleworms). Pp. 77-123. En: R. Brusca (ed.). Common intertidal invertebrates of the Gulf of California. University of Arizona. Tucson. 513 pp. Levin, L.A. 2001. Oxygen minimum zone influence on the community structure of deepsea benthos. En: ASLO Meeting. Aquatic Sciences Meeting. Albuquerque, NM. 12-16 de febrero de 2001. Abstracts. Levin, L.A. 2003. Oxygen minimum zone benthos: adaptation and community response to hypoxia. Oceanography and Marine Biology. An Annual Review 41: 1-45. Poliquetos (A nnelida , Polychaeta ) del talud continental suroriental 219 Levin, L.A. y J.D. Gage. 1998. Relationship between oxygen, organic matter and diversity of bathyal macrofauna. Deep-Sea Research, Part II 45: 129-163. Levin, L.A., C.L. Huggett y K.F. Wishner. 1991. Control of deep-sea benthic community structure by oxygen and organic-matter gradients in the eastern Pacific Ocean. Journal of Marine Research 49: 763-800. Levin, L.A., G.R. Plaia y C.L. Huggett. 1994. The influence of natural organic enhancement on life histories and community structure of bathyal polychaetes. Pp. 261-283. En: C.M. Young y K.J. Eckelbarger (eds.). Reproduction, Larval Biology, and Recruitment of the Deep-Sea Benthos. Columbia University Press, New York. Levin, L.A., J.D. Gage, C. Martin y P.A. Lamont. 2000. Macrobenthic community structure within and beneath the oxygen minimum zone, NW Arabian Sea. Deep-Sea Research, Part II., 47: 189-226. Levin, L.A., J. Gage, P. Lamont, L. Cammidge, C. Martin, A. Patience y J. Crooks. 1997. Infaunal community structure in a low-oxygen, organic rich habitat on the Oman Continental slope, NW Arabian Sea. Pp. 223-230 En: L.E. Hawkins y S. Hutchinson (eds.). Responses of Marine Organisms to their Environments. Proceedings of the 30th European Marine Biology Symposium, 18-22 de agosto de 1995. University of Southampton, Southampton. Levin, L.A., A.E. Rathburn, C. Neira, J. Sellanes, P. Muñoz, V. Gallardo y M. Salamanca. 2002. Benthic processes on the Peru margin: A transect across the oxygen minimum zone during the 1997-1998 El Niño. Progress in Oceanography 53: 1-27. Levin, L.A., J.E. Etter, M.A. Rex, A.J. Gooday, C.R. Smith, J. Pineda, C.T. Stuart, R.R. Hessler y D. Pawson. 2001. Environmental influences on regional deep-sea species diversity. Annual Review of Ecology and Systematics 32: 51-93. Lezcano-Bustamante, B.G. 1989. Estudio prospectivo de la distribución, diversidad y abundancia de las poblaciones de anélidos poliquetos en la porción sur del golfo de California. Tesis de Biólogo. Facultad de Ciencias, Universidad Nacional Autónoma de México, México D.F. 98 pp. Méndez, N. 2006. Deep-water polychaetes (Annelida) from the southeastern Gulf of California, Mexico. Revista de Biología Tropical 54: 773-785. Méndez, N. 2007. Relationships between deep-water polychaete fauna and environmental factors in the southeastern Gulf of California, Mexico. Scientia Marina 71(3): 605-622. Méndez, N. 2009. Distribution and extraordinary abundance of the deep-sea Melinnampharete gracilis Hartman, 1969 (Polychaeta: Ampharetidae) in the Gulf of California, México. Cahiers de Biologie Marine 50:273-276 220 Biodiversidad y comunidades del talud continental del Pacífico mexicano Méndez, N. y M.E. Hendrickx. 2012. Recolección y cuantificación de macrofauna de mar profundo: el caso de estudio del poliqueto Melinnampharete gracilis Hartman, 1969 (Ampharetidae). Pp. 229-246. En: P. Zamorano, M.E. Hendrickx y M. Caso (eds.). Biodiversidad y comunidades del talud continental del Pacífico mexicano. Instituto Nacional de Ecología, Secretaría del Medio Ambiente y Recursos Naturales (Semarnat). Milliman, J.D. 1994. Organic matter content in U.S. Atlantic continental slope sediments: decoupling the grain-size factor. Deep-Sea Research, Part II 41: 797-808. Narayanaswamy, B.E., T.D. Nickell y J.D. Gage. 2003. Appropriate levels of taxonomic discrimination in deep-sea studies: species vs family. Marine Ecology Progress Series 257: 59-68. Narayanaswamy, B.E., B.J. Bett y J.D. Gage. 2005. Ecology of bathyal polychaete fauna at an Arctic-Atlantic boundary (Faroe-Shetland Channel, North-east Atlantic). Marine Biology Research 1: 20-32. Paxton, H. 1986. Generic revision and relationships of the family Onuphidae (Annelida: Polychaeta). Records of the Australian Museum 38(1-2): 1-74. Petersen, M.E. 2000. A new genus of Fauveliopsidae (Annelida: Polychaeta), with a review of its species and redescription of some described taxa. Bulletin of Marine Science 67: 491-515. Pettibone, M.H. 1966. Revision of the Pilargidae (Annelida: Polychaeta) including descriptions of new species, and redescription of the pelagic Podarmus ploa Chamberlin (Polynoidae). Proceedings of the United States Natural Museum 118: 155-208. Picard, J. 1965. Recherches qualitatives sur les biocénoses marines des substrats meubles dragables de la région marsellaise. Recueil des Travaux de la Station Marine d’Endoume 36: 1-60. Rex, M.A., C.T. Stuart y G. Coyne. 2000. Latitudinal gradients of species richness in the deep-sea benthos of the North Atlantic. Proceedings of the National Academy of Sciences of the United States of America 97: 4082-4085. Rhoads, C.D. 1974. Organism-sediment relations on the muddy sea floor. Oceanography and Marine Biology: an Annual Review 12: 263-300. Rioja, E. 1962. Estudios anelidológicos. XXVI. Algunos anélidos poliquetos de las Costas del Pacífico de México. Anales del Instituto de Biología, México 33: 131-229. Rosenberg, R., B. Hellman y B. Johansson. 1991. Hypoxic tolerance on marine benthic fauna. Marine Ecology Progress Series 79: 127-131. SAIC (Science Applications International Corporation). 1991. Biological and sedimentological investigations of the sea floor at the proposed U.S. Navy 103 Ocean Disposal Poliquetos (A nnelida , Polychaeta ) del talud continental suroriental 221 Sit. Report submitted to PRC Environmental Management, Inc., San Francisco. 95 pp, Appendices A-C. SAIC (Science Applications International Corporation). 1992. Benthic ecology and sediment characterization. Ocean studies report for detailed physical and biological oceanographic studies for an ocean site designation effort under the Marine Protection, Research and Sanctuaries Act of 1972 (MPRSA). Report prepared for U.S. Environmental Protection Agency, Region IX, San Francisco, CA. Salazar-Vallejo S.I. y Londoño-Mesa M.H. 2004. Lista de especies y bibliografía de poliquetos (Polychaeta) del Pacífico Oriental Tropical. Anales del Instituto de Biología. Universidad Nacional Autónoma de México. Serie Zoología 75: 9-97. Salazar-Vallejo, S.I., J.A. de León-González y H. Salaices-Polanco. 1989. Poliquetos (Annelida: Polychaeta) de México. Libros Universitarios, Universidad Autónoma de Baja California Sur. La Paz. 212 pp. Sanders, H.L. 1969. Benthic marine diversity and the stability-time hypothesis. Brookhaven Symposia on Biology 22: 71-81. Sarti-Martínez, A.L. 1984. Estudio prospectivo de la distribución, abundancia y diversidad de los anélidos poliquetos de la zona norte del golfo de California. Tesis de Biólogo. Facultad de Ciencias, Universidad Nacional Autónoma de México, México D.F. 53 pp. Solís-Weiss, V. y B. Hilbig. 1992. Redescription of Ophryotrocha platykephale Blake (Polychaeta, Dorvilleidae) from the Guaymas Basin hydrothermal vents. Bulletin of the Southern California Academy of Sciences 91: 92-96. Solís-Weiss, V. y P. Hernández-Alcántara. 1994. Amphisamytha fauchaldi: a new species of Ampharetid (Annelida: Polychaeta) from the hydrothermal vents at Guaymas Basin, Mexico. Bulletin of the Southern California Academy of Sciences 93: 127134. Taylor, J.L. 1984. Orbiniidae. Pp 1-38. En: J.M. Uebelacker y P.G. Johnson (eds.). Taxonomic Guide to the Polychaetes of the Northern Gulf of Mexico. Mobile, Barry A. Vittor & Associates Inc. Louisiana. Treadwell, A.L. 1923. Polychaetous annelids from lower California with descriptions of new species. American Museum Novitates 74: 1-11. Williams, S.J. 1987. Taxonomic notes on some Ampharetidae (Polychaeta) from Southern California. Bulletin of the Biological Society of Washington 7: 251258. Wieser, W. 1959. The effect of grain size on the distribution of small invertebrates inhabiting the beaches of Puget Sound. Limnology and Oceanography 4: 181-194. 222 Biodiversidad y comunidades del talud continental del Pacífico mexicano Wishner, K.F., C.J. Ashjian, C. Gelfman, M.M. Gowing, L. Kann, L.A. Levin, L.S. Mulineaux y J. Saltzman. 1995. Pelagic and benthic ecology of the lower interface of the Eastern Tropical Pacific oxygen minimum zone. Deep-Sea Research, Part I 42: 93-115. Zamorano, P., M.E. Hendrickx y A. Toledano-Granados. 2007. Distribution and ecology of deep-water mollusks from the continental slope, southeastern Gulf of California, Mexico. Marine Biology 150(5): 883-892. Poliquetos (A nnelida , Polychaeta ) del talud continental suroriental 223 Recolección y cuantificación de macrofauna de mar profundo: el caso de estudio del poliqueto Melinnampharete gracilis Hartman, 1969 (Ampharetidae) Nuria Méndez1 y Michel E. Hendrickx2 INTRODUCCIÓN El proceso de recolectar muestras de macrobentos de aguas profundas es difícil, ya que se requiere el uso de buques equipados con aparatos adecuados que permitan la exploración de los perfiles del fondo y del sustrato, así como para la toma de las muestras. En aguas profundas (más de 1000 m de profundidad), para las operaciones de muestreo utilizando el equipo adecuado se invierte mucho tiempo, además de que se necesitan malacates grandes que soporten cables largos y resistentes (por ejemplo, se necesitan unos 4000 m de cable para operar una red de arrastre a una profundidad de 2000 m). Además, los equipos deben ser sólidos y pesados para asegurar que lleguen al fondo y, por lo tanto, deben ser manejados por personal calificado. Esto aumenta considerablemente el costo de la infraestruc- Laboratorio de Invertebrados Bentónicos, Unidad Académica Mazatlán, Instituto de Ciencias del Mar y Limnología, Universidad Nacional Autónoma de México. P.O. Box 811 Mazatlán, Sinaloa, México. Correo-e: [email protected]. 2 Laboratorio de Invertebrados Bentónicos, Unidad Académica Mazatlán, Instituto de Ciencias del Mar y Limnología, Universidad Nacional Autónoma de México. P.O. Box 811 Mazatlán, Sinaloa, México. Correo-e: [email protected]. 1 225 tura en equipamiento y de los cruceros oceanográficos (Zamorano et al. 2010, Hendrickx 2012). El conocimiento preliminar de la estructura del fondo y de los perfiles batimétricos es esencial para diseñar una metodología de muestreo adecuada, debido a que la presencia de sustratos duros, montes o fallas pueden dañar los aparatos, o incluso causar su pérdida. Por otra parte, la selección de los aparatos de muestreo de la macrofauna de aguas profundas es complicada ya que depende, en gran medida, de la naturaleza del sustrato y de si se requieren muestras cuantitativas o no. Durante la interpretación de los resultados obtenidos con muestras de sedimentos blandos, es importante considerar que las comunidades del mar profundo se caracterizan por formar agregaciones o parches (“patches”) de individuos. Estos parches dificultan la estimación de la densidad, pues los equipos que se usan durante las recolecciones pueden encontrar una agregación de individuos (en cuyo caso la muestra resulta abundante) o muestrear a un lado de estas agregaciones (resultando en muestras muy pobres o sin organismos). Las agregaciones pueden ser causadas por algunas características particulares del medio ambiente (e.g., tipo de sedimento, efectos de las corrientes, pendiente del fondo), por la disponibilidad de alimento, o por comportamiento de las especies (e.g., reproducción, migración) (Gage y Tyler, 1992). Los poliquetos pertenecientes a la familia Ampharetidae son comunes en los fondos marinos profundos (véase Méndez 2012). Recientemente, se han registrado 62 especies incluidas en 30 géneros en aguas mexicanas, de las cuales 38 han sido encontradas en el golfo de California (Hernández-Alcántara y Solís-Weiss 2009). Todos los anfarétidos construyen tubos mucosos cubiertos de partículas de sedimento. La mayoría de las especies forman tubos muy largos en comparación con la longitud de los organismos (Fauchald y Jumars 1979). Los tubos de Melinnampharete gracilis Hartman, 1969 presentan paredes relativamente delgadas, tienen revestimientos interiores formados de mucus cubierto con una capa delgada de lodo de grano fino y, por lo general, son de color gris oscuro o negro (Fauchald 1972). Los especímenes de M. gracilis recolectados en el sur del golfo de California son pequeños (máximo, unos 15 mm de largo) y los tubos miden alrededor de 30 cm de largo y 0.2 cm de diámetro externo. Los animales ocupan de una quinta parte a una décima parte de la longitud del tubo y cada tubo está habitado por un solo individuo (Méndez 2006). Algunos anfarétidos como Melinna cristata (Sars, 1851) construyen tubos de turba orientados verticalmente en los sedimentos blandos (Fauchald y Jumars 1979). 226 Biodiversidad y comunidades del talud continental del Pacífico mexicano De acuerdo con Fauchald y Jumars (1979) y Gambi y Giangrande (1985) la mayoría de los anfarétidos son sésiles y consumidores de depósitos de superficie, es decir, se alimentan de detritos localizados sobre el sedimento. Presentan tentáculos retráctiles y ciliados que les permiten recoger las partículas de alimento y llevarlas a la boca. Durante la alimentación, el tubo de muchas especies de esta familia se proyecta oblicuamente por encima del sustrato, por lo que queda distalmente curvado hacia el lodo. La parte anterior del gusano se sale del tubo y se estira extendiendo los tentáculos sobre el sustrato y mantiene las branquias en contacto con el agua (figura 1) (Fauchald y Jumars 1979). La posición y la orientación de los tubos dentro del sedimento, con una parte que sobresale, permite la captura de estos organismos utilizando aparatos ya sea de arrastre o de penetración. La distribución geográfica y batimétrica de M. gracilis está muy extendida en aguas profundas del océano Pacífico, en ambos lados de la península de Baja California, incluyendo las porciones medias del golfo de California (Fauchald 1972), en profundidades que van desde los 700 m hasta los 1500 m (Méndez 2009). Los estudios de poliquetos realizados dentro del proyecto TALUD (Méndez 2006, 2007, citado como M. eoa Annenkova, 1937) indican que M. gracialis es una de las especies dominantes en fondos blandos del mar profundo en el sur del golfo de California. En un estudio reciente con muestras recolectadas con tres apaFigura 1. Anfarétido transportando detritos a lo largo de los tentáculos durante la alimentación (x 10) (Según Fauchald y Jumars 1979). R ecolección y cuantificación de macrofauna de mar profundo 227 ratos diferentes, Méndez (2009) encontró que la dominancia media de la especie fue del 98.4 % en muestras recolectadas con un trineo bentónico, del 13.2 % en las muestras recolectadas con una draga tipo Karling modificada y de un 75.0 % en las de un nucleador de caja tipo Reineck. Se calculó, además, una frecuencia total del 16.5 %, ya que la especie fue encontrada en 13 muestras de un total de 79 estaciones muestreadas. Por estos motivos y tomando en cuenta la posición de los tubos dentro del sedimento, se consideró que M. gracilis es un buen ejemplo para comparar los diferentes métodos de muestreo utilizados para recolectar la macrofauna de fondos blandos en el mar profundo y tener opciones para obtener cantidades grandes de organismos si así lo requiere el proyecto. Por lo tanto, el propósito de este capítulo fue analizar la eficacia de estos tres aparatos basándonos en la densidad obtenida por superficie muestreada (área) y en la frecuencia de M. gracilis recolectada durante siete campañas oceanográficas a bordo del B/O “El Puma”. MATERIALES Y MÉTODOS Se recolectaron organismos bentónicos asociados a fondos blandos entre 360 y 2309 m de profundidad a bordo del B/O “El Puma” de la Universidad Nacional Autónoma de México durante siete cruceros: TALUD IV en agosto de 2000 (11 estaciones), TALUD V en diciembre de 2000 (10 estaciones), TALUD VI en marzo de 2001 (12 estaciones), TALUD VII en junio de 2001 (13 estaciones), TALUD VIII en abril de 2005 (11 estaciones), TALUD IX en noviembre de 2005 (10 estaciones), y TALUD X en febrero de 2007 (22 estaciones). Se utilizaron tres aparatos en diferentes estaciones (véase Hendrickx 2012), con los cuales se obtuvo una muestra por estación. a) Un trineo bentónico (2.35 m de ancho por 0.95 m de alto) equipado con una red de 5.5 cm (2 ¼”) de apertura de malla, la cual estaba forrada, internamente, con otra red de 2 cm (¾”) de apertura de malla a todo lo largo de la boca. En promedio, el tiempo de arrastre en todas las estaciones fue de 30 minutos. b) Una draga tipo Karling modificada (110 cm x 40 cm x 14 cm) diseñada para recoger los sedimentos superficiales a una profundidad de 7 cm, con una capacidad máxima de 85 l de sedimento dispuesta en tren en la parte posterior del trineo bentónico (en general 30 minutos de arrastre). c) Un nucleador de caja tipo Reineck (42.0 cm x 41.0 cm x 59.5 cm de altura) con una capacidad máxima de 102 l de sedimento. Los especímenes de M. gracilis retenidos en el trineo bentónico se recolectaron directamente con pinzas. Por otro lado, se midió el volumen (litros) de sedimento 228 Biodiversidad y comunidades del talud continental del Pacífico mexicano recolectado con la draga Karling y con el nucleador de caja Reineck. En ambos casos, la totalidad de sedimento recolectado se tamizó a través de una malla de 0.5 mm de apertura con el fin de recolectar la macrofauna (Holme y McIntyre 1984). Los organismos retenidos en el tamiz fueron separados del sedimento, clasificados por grupos y se fijaron a bordo con una solución de formol al 10 %. En el laboratorio, todas las muestras, incluidas las de M. gracilis, fueron lavadas repetidamente con agua dulce y, posteriormente, fueron preservadas en etanol al 70 %. La identificación taxonómica de la especie se llevó a cabo utilizando la clave de Fauchald (1972). Los métodos de medición de las variables ambientales (profundidad y oxígeno disuelto) donde se recolectó la especie se describen en Hendrickx (2012). La granulometría y el contenido de materia orgánica en el sedimento, se calcularon de acuerdo con los métodos descritos en Méndez (2012). Debido a la presencia de tubos vacíos en las muestras, la abundancia se calculó considerando únicamente los tubos que contenían un gusano. Se utilizaron tres criterios para la estimación de la abundancia: 1) en las muestras que contenían menos de 100 tubos, todos ellos se abrieron y se examinaron para confirmar la presencia del organismo. Se contaron únicamente los tubos que contenían un organismo; 2) en las muestras con más de 100 tubos, se tomaron submuestras de 50 a 60 tubos, los cuales fueron examinados y la abundancia se estimó contando los tubos que contenían un gusano; 3) en el caso de las capturas con más de 1000 tubos, inicialmente se determinó el peso húmedo de toda la muestra a bordo y se obtuvo una submuestra de 60 tubos, registrando su peso húmedo. En el laboratorio, se abrieron todos los tubos de la submuestra y se contaron los tubos conteniendo el organismo. Así, la abundancia se estimó considerando las proporciones entre el peso de la muestra y la submuestra, y la de los tubos llenos y vacíos (véase Méndez 2009). Con el fin de analizar y comparar la eficiencia de los tres aparatos utilizados, se estimaron los valores de densidad (expresada como el número de individuos ind/m-2), a través de los valores de abundancia y considerando las diferentes características de cada equipo. Para el nucleador de caja Reineck, se consideró el área de la caja (0.42 m x 0.41 m = 0.1722 m2), y el valor de densidad se estimó por regla de tres, considerando este valor y el número de individuos. Para el trineo bentónico, el área barrida fue estimada considerando una velocidad media de 1.75 nudos (1 nudo = 1 milla náutica por hora), el tiempo de arrastre (30 minutos = 0.5 horas) y el ancho de la boca del trineo (2.35 m). R ecolección y cuantificación de macrofauna de mar profundo 229 El área muestreada fue obtenida mediante la siguiente operación: velocidad de arrastre x tiempo de arrastre x anchura de la boca del trineo. En el caso de un arrastre de 30 min, el área barrida correspondió a 3700 m². El valor aproximado de densidad se estimó por regla de tres, considerando el área muestreada y el número de individuos recolectados. Para la draga Karling, el área muestreada se calculó considerando la relación: superficie (en cm2) = volumen de sedimento recolectado (en cm3) dividido por la profundidad teórica (7 cm) del muestreo. El valor de densidad se estimó por regla de tres, considerando la superficie muestreada y el número de individuos recolectados. Debido a que este aparato recoge una cantidad limitada de sedimento (85 litros), la distancia recorrida, el tiempo de arrastre y la velocidad de arrastre no fueron considerados para la estimación de la densidad. La frecuencia de M. gracilis se calculó para cada crucero y cada aparato según la fórmula: F = (mi x 100) / M Donde: mi = número de muestras en las que fue encontrada la especie i; M = número total de muestras. Según Glémarec (1964), los valores de frecuencia significativos son los iguales o superiores a 15 %. Con fines comparativos, se calculó el índice de correlación de Pearson (programa Excel 2000) entre la densidad estimada de M. gracilis y las variables ambientales utilizando los datos obtenidos en todas las estaciones muestreadas con el trineo bentónico y la draga Karling, independientemente de la aparición o no de la especie. Asimismo, se calculó dicho índice considerando los dos equipos, utilizando las medias de las densidades obtenidas con ambos aparatos, con el fin de observar si existen diferencias entre los dos métodos que pudieran influir en la interpretación de los datos a nivel ecológico. Las variables ambientales incluidas en estos análisis fueron la profundidad, la temperatura, el oxígeno disuelto, la materia orgánica y los porcentajes de lodo, de arena y de grava. Los resultados del nucleador de caja Reineck no fueron incluidos, debido a que las muestras de sedimento no han sido analizadas en su totalidad. 230 Biodiversidad y comunidades del talud continental del Pacífico mexicano RESULTADOS Para estimar la abundancia, se utilizó el primer criterio (se abrieron todos los tubos y se contaron los especímenes) en la mayoría de las muestras recolectadas con los tres aparatos. El segundo criterio (se abrieron submuestras de 50 a 60 tubos y se contaron los organismos) se aplicó únicamente a muestras recolectadas con el trineo bentónico: estación 25 del crucero TALUD VII (558 individuos), estación 16 del TALUD VIII (376 individuos) y estación 25 del TALUD X (202 individuos). El tercer criterio para estimar la abundancia se aplicó únicamente a la muestra recolectada con el trineo bentónico en la estación 25 durante el crucero TALUD IV, ya que la red apareció completamente cubierta de tubos de M. gracilis. En este caso, el peso húmedo total de tubos separados de la red fue 6.679 kg. En el laboratorio, 60 de estos tubos se pesaron (0.013 kg) y se abrieron para comprobar la presencia de gusanos. La relación entre los tubos vacíos y los llenos fue de 1:1. En consecuencia, estimamos que esta muestra contenía un total de 30826 tubos, de los cuales, 15413 contenía un gusano (Méndez 2009). Los valores de abundancia variaron entre 1 y 15413 individuos en el trineo bentónico, de 1 a 9 individuos en la draga Karling y 9 individuos en el nucleador de caja Reineck (Cuadro 1). Los valores aproximados de densidad para cada aparato indicaron que los menores valores estimados correspondieron al trineo bentónico (0.0003 a 4.05 ind m-2; media: 0.49±1.34 ind m-2), la mayor densidad se obtuvo con el nucleador de caja Reineck (52.3 ind m-2), mientras que los valores intermedios (0.1 a 7.5 ind m-2; media: 1.70±2.91 ind m-2) correspondieron a la draga Karling (Cuadro 1; Méndez 2009). La frecuencia de M. gracilis, calculada para cada crucero, varió de 0 %, en los casos en que no se recolectó la especie, hasta 23.1 % en el Talud VII . La frecuencia total calculada para cada crucero y aparato mostró los valores más altos durante el TALUD VI (draga Karling = 15.4 %), TALUD VII (trineo bentónico = 15.4 %; draga Karling = 23.1 %) y TALUD VIII (trineo bentónico = 20.0 %). Considerando todas las muestras recogidas con cada aparato, la frecuencia más alta correspondió al trineo bentónico, con 10.2 % (M. gracilis apareció en 9 de 88 muestras), en segundo lugar la draga Karling, con 7.8 % (6 de 77 muestras) y, por último, el nucleador de caja Reineck, con el 6.2 % (1 de 16 muestras) (Cuadro 2). Las estaciones donde se encontró M. gracilis se localizan entre los 22° 01’-26° 39’N y 106° ‘40-111º 18 ‘O (Fig. 2), en profundidades que oscilan entre 700 y 1500 m. Los valores de temperatura del agua y de oxígeno disuelto en estas R ecolección y cuantificación de macrofauna de mar profundo 231 Cuadro 1. Número de individuos (Abund.) y densidad (den.; individuos m-2) de elinnampharete gracilis recolectado con los diferentes aparatos de muestreo. Cruceros Talud IV Talud V Talud VI Talud VI Talud VI Talud VII Talud VII Talud VII Talud VII Talud VIII Talud VIII Talud IX Talud X Trineo bentónico Draga Karling Abund. 15413 96 Abund. 9 Den. 7.50 1 1 0.11 0.23 2 1 2 1.75 0.10 0.52 Estación 25 11 5 11 25 18 25 26 33B 16 17B 16 25 Den. 4.0500 0.0300 1 1 558 0.0003 0.0003 0.1500 376 4 18 202 0.1000 0.0010 0.0050 0.0500 Nucleador de caja Reineck Abund. Den. 9 52.30 Cuadro 2. Frecuencia de Melinnampharete gracilis calculada para cada aparato de muestreo durante los siete cruceros. Crucero Trineo bentónico Talud IV Talud V Talud VI Talud VII Talud VIII Talud IX Talud X Total Draga Karling Talud IV 232 Número de estaciones muestreadas Estaciones con M. gracilis Frecuencia (%) 12 11 13 13 10 10 19 88 1 1 1 2 2 1 1 9 8.33 9.09 7.69 15.38 20.00 10.00 5.26 10.23 10 1 10.00 Biodiversidad y comunidades del talud continental del Pacífico mexicano Cuadro 2. Continúa. Crucero Número de estaciones muestreadas Talud V 11 Talud VI 13 Talud VII 13 Talud VIII 11 Talud IX 2 Talud X 17 Total 77 Nucleador de caja Reineck Talud X 16 Total 16 Estaciones con M. gracilis Frecuencia (%) 0 2 3 0 0 0 6 0.00 15.38 23.08 0.00 0.00 0.00 7.79 1 1 6.25 6.25 Figura 2. Localización de las estaciones de muestreo donde fue recolectado el anfarétido Melinnampharete gracilis. Talud 4 Talud 5 Talud 6 Talud 7 Talud 8 Talud 9 Talud 10 R ecolección y cuantificación de macrofauna de mar profundo 233 234 Biodiversidad y comunidades del talud continental del Pacífico mexicano Estaciones 25 11 5 11 25 18 25 26 33B 16 17B 16 25 Cruceros Talud IV Talud V Talud VI Talud VI Talud VI Talud VII Talud VII Talud VII Talud VII Talud VIII Talud VIII Talud IX Talud X 24°53' 23°15' 22°01' 23°15' 24°52' 24°15' 24°52' 24°25' 26°07' 25°24' 25°24' 25°24' 26°39' Latitud (N) 108°59' 106°59' 106°40' 106°59' 108°58' 108°16' 108°58' 109°05' 110°07' 110°37' 110°48' 110°33' 111°18' Longitud (O) 789 860 1500 840 840 980 815 1200 1280 1030 700 1011 818 Profundidad media (m) 5.1 5.4 2.8 5.9 5.6 5.2 4.7 3.6 3.6 5.0 6.0 4.6 5.0 0.29 0.07 1.74 0.17 0.22 0.13 0.04 0.35 0.60 0.20 0.13 0.15 0.17 Temperatura Oxígeno (ºC) (ml l-1) Materia orgánica (%) 9.86 13.36 15.58 10.90 13.12 12.21 13.42 15.87 18.50 15.79 99.1 92.7 98.8 97.3 100.0 99.7 97.6 99.8 98.7 99.21 Lodo (%) Cuadro 3. Localización y variables abióticas donde se recolectaron especímenes de Melinnampharete gracilis. 0.9 7.3 1.2 2.7 0.0 0.3 2.4 0.2 1.3 0.79 Arena (%) 0.0 0.0 0.0 0.0 0.0 0.0 0.0 0.0 0.0 0.0 Grava (%) estaciones oscilaron entre 2.8 y 6.0° C y 0.04 y 1.74 ml l-1, respectivamente. En cuanto al tipo de sedimento, M. gracilis se encontró en sedimentos lodosos y lodo-arenosos (92.7 a 100 % de lodo, de 0 a 7.3 % de arena y 0 % de grava), con contenidos de materia orgánica entre 9.86 y 18.5 % (Cuadro 3). Los valores del índice de correlación de Pearson entre las variables abióticas y la densidad de M. gracilis con los datos del trineo bentónico y de la draga Karling por separado y con la combinación de ambos métodos (media de las densidades de cada aparato) se muestran en el Cuadro 4. Los resultados obtenidos con los dos aparatos por separado muestran tendencias similares ya que, en ambos, la densidad de M. gracilis presentó correlaciones significativas con la profundidad, la temperatura, el oxígeno disuelto (p<0.001 y p<0.01) y, con menor nivel de significancia (p<0.02 y p<0.05), con la materia orgánica y la proporción de lodo en sedimento. La combinación de los datos obtenidos con los dos aparatos presentó las mismas tendencias que por separado y la única diferencia fue que se incrementaron, ligeramente, los valores del índice de correlación. Cuadro 4. Valores del índice de correlación de Pearson (R2) entre la densidad de Melinnampharete gracilis y las variables ambientales registradas en las estaciones muestreadas con el trineo bentónico, con la draga Karling y con ambos aparatos (valores de significancia: **** p<0.001; *** p<0.01; ** p<0.02; * p<0.05; NS= no significativo). Crucero Estación Talud IV Talud V Talud VI Talud VI Talud VI Talud VII Talud VII Talud VII Talud VII Talud VIII Talud VIII Talud IX Talud X 25 11 5 11 25 18 25 26 33B 16 17B 16 25 Trineo bentónico Draga Karling Abund. 15413 96 Abund. 9 Den. 7.50 1 1 0.11 0.23 2 1 2 1.75 0.10 0.52 Den. 4.0500 0.0300 1 1 558 0.0003 0.0003 0.1500 376 4 18 202 0.1000 0.0010 0.0050 0.0500 R ecolección Nucleador de caja Reineck Abund. Den. 9 52.30 y cuantificación de macrofauna de mar profundo 235 DISCUSIÓN De manera general, el muestreo en aguas profundas representa un reto debido al costo de las campañas y a la duración de las operaciones en cada estación. Por lo anterior, es importante buscar el mejor rendimiento posible al momento de planear el muestreo. En el caso de los poliquetos tubícolas cuyo habitáculo se encuentra en parte dentro del sedimento y en parte fuera de éste, se recomienda utilizar diferentes aparatos de muestreo diseñados para recolectar la epifauna o la endofauna. Hasta el momento, no existe información relacionada con la orientación de los tubos de M. gracilis dentro del sedimento in situ; sin embargo, se sabe que la mayoría de los tubos de anfarétidos están orientados verticalmente y que durante la alimentación algunas especies exponen parte del tubo en posición oblicua (Fauchald y Jumars 1979). La mayoría de los tubos de M. gracilis recolectados en la estación 25 durante el crucero TALUD X tenían dos o tres bandas transversales en un extremo, cuya coloración era más pálida que la del resto del tubo. Estas bandas podrían reflejar la estratificación superior del fondo lodoso, indicando, por lo tanto, la porción del tubo que sobresalía. Por otra parte, la observación detallada del sedimento recolectado con el nucleador de caja Reineck en la misma estación indicó la presencia de tubos delgados que sobresalían unos 2 cm del sedimento, los cuales correspondían a la misma especie. Esto sugiere que los tubos de M. gracilis están orientados verticalmente y que sobresalen del sedimento, lo que facilita su captura con el trineo bentónico. Además, los sedimentos donde se recogió esta especie consistían de lodo poco compacto (Cuadro 3) causando, probablemente, un ligero hundimiento del trineo en el fondo, lo que favoreció a que los tubos se enredaran en la red. Por el contrario, la capacidad de la draga Karling está limitada a 85 l de sedimento, por lo que pierde la eficiencia de muestreo una vez llena, lo que produjo que se recolectara un número menor de especímenes con este aparato. La manipulación y apertura de los tubos de M. gracilis en el laboratorio es difícil, tediosa y consume mucho tiempo debido a que los tubos son muy delgados. Por este motivo, sugerimos utilizar métodos indirectos para estimar la abundancia total en las muestras grandes, lo que posteriormente permitió hacer estimaciones de densidad para proceder con las comparaciones. En los casos del trineo bentónico y la draga Karling, los valores aproximados de densidad permitieron comparar la eficiencia de los tres aparatos utilizados en los muestreos. Es importante resaltar el hecho de que, a pesar de que el mayor número de individuos se recolectó con el trineo bentónico, la mayor densidad fue registrada con el nucleador de caja Reineck 236 Biodiversidad y comunidades del talud continental del Pacífico mexicano (Cuadro 1). El trineo bentónico obviamente no está diseñado para capturar la infauna bentónica, pero cubre una superficie mucho mayor que los otros aparatos, lo que produce que una cantidad considerable de tubos se enreden en la red o sean capturados mezclados con otros organismos bentónicos u objetos durante el arrastre. Sin embargo, probablemente varios organismos pueden pasar a través de la red o se pueden perder durante la operación de recuperación del trineo. Entonces, los resultados de este estudio indican que el trineo bentónico no es el equipo más adecuado para estimar la densidad de poliquetos bentónicos, como lo demuestra el reducido número de especímenes recolectados por metro cuadrado utilizando este aparato (ver Cuadro 1). Por su parte, la densidad obtenida por la draga Karling sugiere que tampoco este método de muestreo es el mejor para recolectar poliquetos, ya que la irregularidad de la superficie del fondo y la reducida profundidad de penetración de esta draga dentro del sedimento (7 cm) influyen en la eficacia de este último aparato. Por lo tanto, y de acuerdo con los valores de densidad estimada, tratándose de instrumentos de penetración, el nucleador de caja resulta ser el mejor aparato. La mayor frecuencia de M. gracilis se obtuvo en las muestras recolectadas con el trineo bentónico, debido a la mayor superficie barrida. Por los motivos ya expuestos (i.e., variación en el número de muestras obtenidas), la frecuencia de aparición de M. gracilis disminuyó en las muestras recogidas con la draga Karling y, aún más, con el nucleador de caja Reineck (una de diez muestras que contenían sedimentos en el TALUD X). Los valores significativos de frecuencia observados en los cruceros TALUD VII y VIII con el trineo bentónico y TALUD VI y VII con la draga Karling confirmaron el hecho de que M. gracilis es una de las especies más representativas de poliquetos del área de estudio, aunque la distribución en parches podría desempeñar un papel importante, siendo así un buen ejemplo para analizar la eficacia de los aparatos de muestreo utilizados en este estudio. La draga Karling y el nucleador de caja Reineck presentan la ventaja de que parte de los sedimentos recogidos puede ser utilizado para los análisis de granulometría y materia orgánica, los cuales son descriptores importantes en estudios tanto taxonómicos como ecológicos. Por otra parte, estos dos aparatos permiten la recolección de organismos grandes y pequeños, lo que permite realizar estudios de dinámica poblacional detallados, siempre y cuando se utilice una luz de malla adecuada durante el tamizado de los sedimentos. Así, a diferencia del trineo bentónico, estos dos aparatos proveen una buena representación de las especies R ecolección y cuantificación de macrofauna de mar profundo 237 pertenecientes a la endofauna. Recientemente, los nucleadores de caja han sido utilizados rutinariamente para recolectar endofauna y han sustituido, progresivamente, a las dragas de tipo van Veen o Smith-McIntyre para la toma de muestras en aguas profundas (Ziegelmeier 1972, Guennegan y Martin 1985). El trineo bentónico generalmente captura organismos de tallas grandes que viven en la superficie del sustrato, por lo que es ampliamente utilizado para recolectar epifauna de aguas profundas, aunque su alcance es meramente cualitativo. Las dragas utilizadas en aguas profundas, tales como la draga de arrastre tipo “ancla”, un aparato similar en su estructura a la draga Karling, son consideradas como métodos semi-cuantitativos para la captura de organismos bentónicos (Gage y Tyler 1991); tal es el caso de la draga Karling que se usó durante los cruceros TALUD IV a VII. Tanto la draga Karling como el nucleador de caja Reineck permiten una estimación razonable de la abundancia y de la densidad de organismos de acuerdo con el volumen de sedimento recolectado. Para fines ecológicos, el nucleador de caja Reineck es más eficaz que la draga Karling, ya que penetra más profundamente en el sedimento, asegurando la captura de organismos por lo menos en los primeros 15 cm, donde vive la mayoría de especies de la endofauna (Holme 1964). En relación con la habilidad de recoger muestras en fondos muy compactos o accidentados, la experiencia adquirida durante los 13 cruceros que conforman el proyecto TALUD ha confirmado la mayor efectividad del trineo bentónico, debido a que, al ser un aparato muy pesado, siempre llegó al fondo, asegurando así la recolección de organismos durante el arrastre. En cambio, en algunas ocasiones, la draga Karling y el nucleador de caja Reineck llegaron a cubierta totalmente vacíos indicando que no tocaron fondo o que las muestras de sedimento recolectadas se perdieron por lavado durante la recuperación de los aparatos en la columna de agua. Debido a que los cruceros oceanográficos en buques grandes son extremadamente caros, es recomendable reducir al máximo los tiempos de muestreo y de procesamiento de las muestras a bordo. En este sentido, el nucleador de caja Reineck presenta la ventaja de que el tiempo necesario para lanzarlo y recuperarlo es mucho más corto que cuando se utilizan el trineo bentónico y la draga Karling. Si bien el arrastre propiamente dicho tarda solamente 30 minutos, los tiempos de maniobras (hundimiento y recuperación de los aparatos) son extremadamente largos. En relación con el procesado de las muestras a bordo, en el caso del trineo bentónico el tiempo necesario para separar los organismos, una vez que se encuentra en cubierta, es corto, porque los organismos se pueden tomar directamente con pinzas o con la mano. Por el contrario, los procedimientos de tamizado y separa238 Biodiversidad y comunidades del talud continental del Pacífico mexicano ción de organismos requeridos por la draga Karling y el nucleador de caja Reineck puede durar horas, dependiendo del tamaño de grano, la consistencia y la cantidad de sedimento recolectado. Los resultados obtenidos utilizando como ejemplo los datos de M. gracilis confirmaron la necesidad de elegir el equipo adecuado para los muestreos de organismos bentónicos para poder alcanzar diferentes metas de investigación. En los casos en que es necesario contar con un gran número de individuos, se ha demostrado que el trineo bentónico es muy útil para estudios taxonómicos y de distribución, así como para estudios de biología de poblaciones de las especies abundantes (por ejemplo, el tamaño del cuerpo, el peso corporal, los hábitos alimenticios, la reproducción). Por otro lado, los aparatos cuantitativos como la draga Karling y el nucleador de caja Reineck son esenciales para estudios ecológicos en los que la densidad de organismos y las características sedimentarias (como contenido de materia orgánica y granulometría) son necesarios para evaluar la estructura de la comunidad. Nuestra experiencia durante el proyecto TALUD indicó que, considerando que el muestreo de aguas profundas es caro y toma mucho tiempo, lo ideal sería utilizar varios tipos de aparatos de forma simultánea o secuencial con el fin de optimizar la toma de muestras. Las relaciones entre los poliquetos de mar profundo y las características del entorno han sido discutidas por Méndez (2007, 2012) y no son objeto de este capítulo. Aquí únicamente se pretendió verificar la eficiencia de cada aparato para estudios de distribución y a nivel ecológico, a través de los resultados de correlación entre la densidad de la macrofauna con las variables ambientales, utilizando a M. gracilis como ejemplo. Se comprobó que, una vez que los datos de abundancia fueron transformados a densidad, las tendencias observadas en relación con las variables ambientales son similares utilizando tanto el equipo diseñado para recolectar la macrofauna que vive en la superficie del sedimento blando (trineo bentónico), como la que vive dentro del sedimento (draga Karling). La combinación de ambos métodos a través de la inclusión de los valores medios de densidad obtenidos con ambos aparatos incrementó la significancia de los valores de correlación, lo que corrobora nuestra recomendación de utilizar varios equipos simultáneamente. CONCLUSIONES La experiencia adquirida durante el proyecto TALUD nos permitió reconocer las ventajas y desventajas de los tres aparatos utilizados, basándonos en la densidad R ecolección y cuantificación de macrofauna de mar profundo 239 y la frecuencia de aparición del poliqueto M. gracilis. Se sugiere entonces que el trineo bentónico presenta las ventajas de que los valores de abundancia y frecuencia son mayores, el área barrida es mucho mayor, el tiempo de procesado de muestras a bordo es significativamente menor y generalmente llega al fondo, asegurando el muestreo de la macrofauna bentónica. Sin embargo, presenta las desventajas de que es un método cualitativo en el que la densidad estimada es menor que en los otros dos aparatos, no permite recolectar muestras de sedimentos para otros análisis, generalmente recoge organismos grandes u organismos fijados a otras estructuras duras pero la representación de la endofauna es mínima o nula. La draga Karling y el nucleador de caja Reineck presentan las ventajas de ser métodos cuantitativos (referidos al volumen de sedimento y área del muestreo, respectivamente), recogen organismos grandes y pequeños, permiten tener una buena representación de la endofauna, la densidad estimada es mayor que la del trineo bentónico (principalmente en el nucleador de caja Reineck) y pueden recolectar sedimentos para análisis granulométricos y de materia orgánica. Sin embargo, ambos aparatos presentan las desventajas de que los valores de abundancia, frecuencia y el área muestreada son menores (especialmente en el nucleador de caja Reineck) y, en ocasiones, llegan vacíos a la superficie y el procesado de las muestras a bordo es mucho más largo que con el trineo bentónico, debido al tamizado y la separación de los organismos. En este sentido, el nucleador de caja Reineck se encuentra en desventaja, ya que el material procesado puede alcanzar los 105 l de sedimento, mientras que la draga Karling puede contener, como máximo, 85 l. Por el contrario, el tiempo requerido para la toma de muestras es significativamente menor en el nucleador de caja Reineck, ya que es un muestreo puntual y, además, la capacidad de penetración en el sedimento de este aparato es considerablemente mayor que la de la draga Karling, la cual únicamente puede recoger los 7 cm superficiales de sedimento. AGRADECIMIENTOS Este estudio forma parte de los proyectos Conacyt número 31.805-N y PAPIITIN-217306 3. La recogida de muestras se llevó a cabo gracias a los miembros de la tripulación del B/O “El Puma”, los estudiantes y el personal técnico de la Unidad Académica Mazatlán (Instituto de Ciencias del Mar y Limnología, UNAM). En especial agradecemos a Arturo Toledano, José Salgado y Arturo Núñez por su apoyo en los muestreos y a David Serrano por la elaboración de 240 Biodiversidad y comunidades del talud continental del Pacífico mexicano la figura 2. Agradecemos también al Dr. Eduardo Peters, Director General de Ordenamiento Ecológico y Conservación de los Ecosistemas, a la Dra. Margarita Caso, Directora de Conservación de Ecosistemas y al M. en C. Pablo Zamorano del Instituto Nacional de Ecología por la invitación a participar en la elaboración de este capítulo. REFERENCIAS Fauchald, K. 1972. Benthic polychaetous annelids from deep water off western Mexico and adjacent areas in the Eastern Pacific Ocean. Allan Hancock Monographs in Marine Biology 7: 1-575. Fauchald, K. y P. A. Jumars. 1979. The diet of worms: a study of polychaete feeding guilds. Oceanography and Marine Biology. An Annual Review 17: 193-284. Gage, D. J. y P. A. Tyler. 1991. Deep-sea biology: natural history of organisms at the deepsea floor. Cambridge University Press, Gran Bretaña. 504 pp. Gambi, M. C. y A. Giangrande. 1985. Caratterizzazione e distribuzione delle catagorie trofiche dei policheti nei fondi mobili del golfo di Salerno. Oebalia 11: 223-240. Glémarec, M. 1964. Bionomie benthique de la partie orientale du golfe du Morbihan. Cahiers de Biologie Marine 5: 33-96. Guennegan, Y. y V. Martin. 1985. Annexe 3. Techniques de prélevements. Pp. 571-602. En: L. Laubier, L., C:L. Monniot (eds.). Peuplements profonds du golfe de Gascogne. IFREMER. Hendrickx, M.E. 2012. Operaciones oceanográficas en aguas profundas: los retos del pasado, del presente y del proyecto TALUD en el Pacífico mexicano (1989-2009). Pp. 23-104. En: P. Zamorano, M.E. Hendrickx y M. Caso (eds.). Biodiversidad y comunidades del talud continental del Pacífico mexicano. Instituto Nacional de Ecología, Secretaría del Medio Ambiente y Recursos Naturales (Semarnat). Hernández-Alcántara, P. y V. Solís-Weiss, 2009. Ampharetidae Malmgren, 1866. Pp 57-75 En: de León-González, J.A., J.R Bastida-Zavala, L.F. Carrera-Parra, M.E. García-Garza, A. Peña-Rivera, S.I. Salazar-Vallejo y V. Solís-Weiss (eds.). Poliquetos (Annelida:Polychaeta) de México y América Tropical. Tomo I. Universidad Autónoma de Nuevo León. Nuevo León. Holme, N. A. 1964. Methods of sampling the benthos. Advances in Marine Biology 2: 171-260. Holme, N. A. y A. D. McIntyre. 1984. Methods for the Study of Marine Benthos. Blackwell Scientific Publications. Oxford. 399 pp. R ecolección y cuantificación de macrofauna de mar profundo 241 Méndez, N. 2006. Deep-water polychaetes (Annelida) from the southeastern Gulf of California, Mexico. Revista de Biología Tropical 54 (3): 773-785. Méndez, N. 2007. Relationships between deep-water polychaete fauna and environmental factors in the southeastern Gulf of California, Mexico. Scientia Marina 71(3): 605622. Méndez, N. 2009. Distribution and extraordinary abundance of the deep-sea Melinnampharete gracilis Hartman, 1969 (Polychaeta: Ampharetidae) in the Gulf of California, México. Cahiers de Biologie Marine 50: 273-276. Méndez, N. 2012. Poliquetos (Annelida, Polychaeta) del talud continental suroriental del golfo de California y su relación con algunas variables ambientales. Pp. 161-222. En: En: P. Zamorano, M.E. Hendrickx y M. Caso (eds.). Biodiversidad y comunidades del talud continental del Pacífico mexicano. Instituto Nacional de Ecología, Secretaría del Medio Ambiente y Recursos Naturales (Semarnat). Zamorano, P., M. E. Hendrickx, N. Méndez, S. Gómez, D. Serrano, H. Aguirre, J. Madrid y N. Morales-Serna. 2012. Explorando las aguas profundas del Pacifico mexicano: el proyecto TALUD. En: INE (ed.). La frontera final: el oceáno profundo. Instituto Nacional de Ecología, Secretaría del Medio Ambiente y Recursos Naturales (Semarnat). (En prensa). Ziegelmeier, E. 1972. Bottom-living animals. Pp. 104-116. En: Research Methods in Marine Biology. Sidgwick and Jackson Biology Series, London. 242 Biodiversidad y comunidades del talud continental del Pacífico mexicano Moluscos de aguas profundas del sur del golfo de California Pablo Zamorano1 y Michel E. Hendrickx2 INTRODUCCIÓN Los moluscos (Mollusca) forman uno de los grandes filo del reino animal. A la fecha se han descrito alrededor de 100000 especies de moluscos vivientes y más de 35000 especies extintas (Brusca y Brusca 2002). Los moluscos colonizan prácticamente todos los ambientes, desde las grandes alturas a más de 3000 m sobre el nivel del mar hasta profundidades de más de 5000 m y se distribuyen tanto en aguas polares como tropicales, aunque suelen ser más comunes en los litorales de todo el mundo (Brusca y Brusca 2002). Los moluscos son los invertebrados más numerosos después de los artrópodos. Presentan una morfología muy heterogénea, desde las típicas formas de las almejas, ostras y caracoles, calamares, pulpos, babosas, quitones, lapas, etc. Esta enorme diversidad de formas ha resultado en una clasificación taxonómica amplia que incluye siete clases: Aplacophora (320 especies), Monoplacophora (20 especies), Poliplacophora (600 especies), Escaphopoda (350 especies), Bivalvia (13000 Instituto Nacional de Ecología, SEMARNAT. Periférico 5000, Col. Insurgentes Cuicuilco, Del. Coyoacán, México, D.F. 04530. Correo-e: [email protected] 2 Laboratorio de Invertebrados Bentónicos, Instituto de Ciencias del Mar y Limnología, Unidad Académica Mazatlán, Universidad Nacional Autónoma de México, Joel Montes Camarena s/n, Mazatlán 82040, Sinaloa, México. Correo-e: [email protected]. 1 243 especies), Cephalopoda (800 especies) y Gastropoda (75000 especies) (Brusca y Brusca 2002). Recientemente, se ha considerado a la clase Aplacophora como parafilética y se ha propuesto dividirla en dos clases: Caudophoveata (70 especies) y Solenogastra (250 especies) (Brusca y Brusca 2002). Los primeros registros de moluscos de aguas profundas en el Pacífico mexicano fueron obtenidos por el buque de vapor “Albatross”, de la Comisión de Pesca de los Estados Unidos (Dall 1895). Posteriormente, la Academia de Ciencias de California realizó una serie de expediciones al golfo de California en 1921 y los resultados relacionados con los moluscos fueron publicados por Baker (1926) y Baker et al. (1928, 1930, 1938a, 1938b). Para 1932, la misma academia extendió su expedición hasta Acapulco (“The Templeton Crocker Expedition”) y continuó recopilando datos para este grupo (véase Strong et al. 1933). Durante los años 40, la Sociedad Zoológica de Nueva York realizó una serie de trabajos sobre los moluscos de la costa oeste de México y de América Central (véase Hertlein y Strong 1940). A finales de los 50, Emerson y Puffer (1957) trabajaron las muestras obtenidas por el crucero realizado por el buque “E.W. Scripps” en 1940, en el golfo de California. Para la década de los 60, Emerson (1960a, 1960b, 1964) y Emerson y Old (1962, 1963a, 1963b) publicaron los resultados de las muestras del “Puritan-American Museum of Natural History” obtenidas durante una expedición al oeste de México. En un trabajo reciente, Hendrickx y Brusca (2005) recopilaron la información sobre las especies de moluscos que hasta esa fecha se habían registrado en el golfo de California, registrando más de 2250 especies distribuidas principalmente en las lagunas costeras, los esteros, la zona intermareal, la plataforma continental y, muy brevemente, se menciona lo referente al talud continental y el plano abisal. Estos últimos dos estratos han sido tratados con más detalle recientemente gracias a la implementación del proyecto TALUD que se desarrolla en las aguas profundas del Pacífico mexicano (véase Zamorano y Hendrickx 2011). Aunque los moluscos bentónicos han sido recolectados en el talud continental del Pacífico mexicano por más de un siglo, no se tienen registros previos a los productos desprendidos del proyecto TALUD de alguna evaluación cuantitativa de este grupo de invertebrados (Zamorano 2006, Zamorano et al. 2007 a, b, Zamorano y Hendrickx 2007, 2009, 2011). Con lo que respecta a trabajos de ecología de moluscos realizados en el talud continental del Pacífico mexicano, son extremadamente escasos y los pocos que hay están restringidos al golfo de California. Por ejemplo, Parker (1964) realizó un estudio sobre la zoogeografía y la ecología de los macroinvertebrados. Dentro de los 11 ambientes que evaluó, 244 Biodiversidad y comunidades del talud continental del Pacífico mexicano tres se distribuyen en las distintas zonas del talud continental (superior, medio e inferior); sus datos corresponden a siete cruceros oceanográficos realizados por la “Scripps Institution of Oceanography” (1958-1961). Parker (1964) concluyó que la distribución de las especies resulta de la interdependencia de factores físicos, químicos y biológicos. Después de analizar los antecedentes, en el presente trabajo se busca presentar un listado comentado de las especies de moluscos de aguas profundas que se han recolectado durante los trabajos del proyecto TALUD en el Pacífico mexicano, mencionando la distribución geográfica y la batimétrica conocida de las especies identificadas, los valores de las variables ambientales relacionadas a cada una de las muestras y las sinonimias, entre otros aspectos, mismos que servirán para que los científicos interesados en la malacofauna de la región conozca parte de la diversidad que albergan las aguas profundas y los impactos de barreras físicas como lo es la zona del mínimo oxígeno (ZMO) presente a lo largo del Pacífico mexicano. MATERIAL Y MÉTODOS Descripción del área de estudio El golfo de California es una cuenca alargada (aproximadamente 1000 km) y estrecha (200 km en promedio) que constituye un mar marginal del océano Pacífico (Fernández-Barajas et al. 1994). La topografía corresponde a una cuenca compleja, donde se registran desde abanicos sedimentarios de pendientes suaves en el norte, mismos que se interrumpen bruscamente por una serie de escarpes accidentados hasta llegar a formar paredes casi verticales en el canal de Ballenas, hasta los cañones submarinos, localizados, principalmente, en el extremo sur de la península de Baja California, así como frente a Sinaloa (De la Lanza-Espino 1991). En el golfo se conoce una serie de diez cuencas alineadas de norte a sur hasta las islas Marías y cuya profundidad se incrementa en el mismo sentido. El canal de Ballenas presenta una profundidad mayor a los 1500 m y divide al golfo de California en dos regiones: 1) la región norte, con profundidad máxima de 450 m, a excepción de la cuenca Delfín y 2) la región sur, donde el golfo mantiene una comunicación abierta con el océano Pacífico, con profundidades de hasta más de 3000 m en la boca (Álvarez-Borrego y Schwartzlose 1979, Castro et al. 2000). Otra característica del golfo es la extensión de la plataforma continental en su margen oriental y una fuerte reducción, hasta su casi ausencia, en el lado opuesto (Amador-Buenrostro et M oluscos de aguas profundas del sur del golfo de C alifornia 245 al. 2003). Finalmente, existen alrededor de 102 islas, la mayoría de ellas de origen volcánico (De la Lanza-Espino 1991). Muestreo El área de estudio en la que se desarrollaron los cruceros oceanográficos del proyecto TALUD incluye el sureste (TALUD IV-VII) y el suroeste del golfo de California (TALUD VIII y IX). Durante estos cruceros se efectuaron 80 muestreos en un número igual de estaciones (véase Hendrickx 2012). Los TALUD IV y V se desarrollaron respectivamente del 23 al 27 de agosto y del 13 al 18 de diciembre del 2000; los TALUD VI y VII se llevaron a cabo del 13 al 17 de marzo y del 5 al 9 de junio de 2001, respectivamente; mientras que el TALUD VIII y el TALUD IX se realizaron en el 2005, el primero del 15 al 20 de abril y el segundo del 10 al 16 de noviembre. El material biológico se obtuvo mediante una draga tipo Karling modificada de 110 cm de longitud x 40 cm de anchura x 19.4 cm de altura y con una capacidad de 85 l, y con un trineo bentónico de boca rectangular de 240 cm x 90 cm, equipado de una red de aproximadamente 5.5 cm de luz de malla interna de aproximadamente 3.5 cm. Los sedimentos obtenidos por la draga fueron lavados con agua de mar abundante para facilitar la recolección de los organismos y filtrado a través de un tamiz de 0.5 mm de luz de malla. Los organismos retenidos se separaron de acuerdo al grupo taxonómico al que pertenecen, se fijaron con formol al 5-8 % y se almacenaron en frascos etiquetados con los datos de la estación. Una vez en el laboratorio, las muestras se lavaron con agua corriente y se transfirieron a etanol al 70 % para su preservación. Con ayuda de un microscopio estereoscópico, se procedió a la identificación y clasificación de los moluscos de acuerdo a material bibliográfico especializado (Keen 1971, Keen y Coan 1975, Skoglund 1989, 1991a, 1991b, 1992, Scott et al, 1996, Scott y Blake 1998). La temperatura y la salinidad se midieron con un CTD (“Conductivity-Temperature-Density”) a partir de un perfil vertical de registros, cuyas características se describen en otros capítulos de este libro (Hendrickx 2012, Serrano 2012). La profundidad fue medida con un ecosonda analógico Edo Western y el oxígeno disuelto epibentónico se determinó por medio del método Winkler (Strickland y Parson 1972). Además, se conservaron muestras de sedimento que se analizaron en el Laboratorio de Invertebrados Bentónicos del ICML, UNAM-Mazatlán, con el fin de obtener el porcentaje de materia orgánica (pérdida por ignición; Dean 1974) así como de los tipos de sustrato (porcentaje de lodo, arena y grava por el método de Folk 1965). 246 Biodiversidad y comunidades del talud continental del Pacífico mexicano Análisis de información Para determinar la presencia de especies de moluscos en aguas profundas del Pacífico mexicano, se tomó en cuenta la base de datos del Laboratorio de Invertebrados Bentónicos del ICML, UNAM, Unidad Académica Mazatlán, la cual cuenta con series de registros de especies en profundidades mayores a 200 m en el golfo de California. También, se contó con una base de datos filtrada (sólo los registros >200 m) procedente de Scripps Institution of Ogeanography. Además, se realizó una revisión bibliográfica exhaustiva en la que se identificaran registros de especies de moluscos en el Pacífico mexicano, con una distribución batimétrica >200 m de profundidad, cuyas fuentes se refieren en el apartado de resultados y discusión conforme se avanza en la lectura. Los resultados faunísticos se presentan según el esquema general siguiente: especies encontradas, abundancia, distribución en los cruceros, condiciones ambientales asociadas con cada especie (profundidad, temperatura, salinidad, concentración de oxígeno disuelto, materia orgánica, tipo de sedimento), registros anteriores y comentarios generales. Abreviaciones utilizados en esta contribución: CA, California; AK, Alaska; OR, Oregon; WA, Washington; ZMO, Zona del Mínimo de Oxígeno; SIO, Scripps Institution of Oceanography, La Jolla, CA. RESULTADOS Y DISCUSIÓN La muestra total obtenida durante las campañas oceanográficas TALUD IV-IX consistió en 2711 especímenes de moluscos bentónicos y está compuesta por 48 especies (32 bivalvos, 9 gastrópodos, 5 escafópodos y 2 aplacóforos), de las cuales 16 quedaron identificadas a nivel de género. Un gasterópodo no pudo ser identificado y, en el caso de los dos aplacóforos, solo fue posible identificarlos a nivel de familia. De estas, y según opinión de especialistas como E. Coan y P. V. Scott, existen al menos seis especies nuevas (cinco bivalvos y un gasterópodo), cuyas descripciones están pendientes. En el caso de la endofauna recolectada con la draga Karling, se identificaron 23 especies de moluscos (15 bivalvos, 5 gastrópodos y 3 escafópodos). Por su parte, en la epifauna recolectada con el trineo bentónico se identificaron 43 especies de moluscos (30 bivalvos, 6 gasterópodos, 5 escafópodos y 2 aplacóforos). M oluscos de aguas profundas del sur del golfo de C alifornia 247 Únicamente 18 especies se registraron tanto en la endofauna como en la epifauna (13 bivalvos, 2 gasterópodos y 3 escafópodos). El registro de cinco especies se restringió a la endofauna (3 bivalvos y 2 gasterópodos), mientras que un total de 25 especies se restringió a la epifauna (17 bivalvos, 4 gasterópodos, 2 escafópodos y 2 aplacóforos). Estos datos se pueden apreciar en la Cuadro 1. El listado taxonómico obtenido a partir de las muestras de moluscos recolectadas durante los cruceros TALUD IV-IX muestra una composición de 4 clases, 16 órdenes, 30 familias, 38 géneros y 48 especies (Fig. 1). Figura 1. Número de especies de moluscos recolectados durante las campañas TALUD IV-IX en el sur del golfo de California. 35 30 25 20 15 10 5 0 Orden Bivalvos Familia Gasterópodos Género Escafópodos Especie Aplacóforos A continuación se enlistan las especies identificadas durante las campañas TALUD IV-IX y se presenta una breve reseña informativa sobre los intervalos la- titudinales y batimétricos de cada especie y, en su caso, se discuten los nuevos registros. Clase Aplacophora Orden Neomeniida Familia Neomeniidae Durante el TALUD VIII se recolectaron dos organismos a una profundidad de 1100 m en el suroeste del golfo de California bajo condiciones de 3°C, 34.7 ppm, 0.39 ml l-1 O2, 7.25 % de materia orgánica en un sedimento lodoso-arenoso. Estos organismos solo fueron identificarlos a nivel de familia y por sus características se presume que corresponden a dos especies diferentes; sin embargo, hace falta un 248 Biodiversidad y comunidades del talud continental del Pacífico mexicano análisis más detallado de las muestras para determinar si esto es correcto o si, realmente, ambas muestras corresponden a Alexandromenia agassizi Health, 1911 que, según Keen (1971), es la única especie de Aplacophora de la cual se tiene registro en aguas profundas del Pacífico mexicano y que, en efecto, pertenece a la familia Neomeniidae. Este registro de A. agassizi corresponde a una captura a una profundidad de 841 m frente a las islas de Revillagigedo (localidad tipo). Cuadro 1. Presencia de las especies de moluscos por campaña oceanográfica y hábitat en el sur del golfo de California. X, indica presencia; T, TALUD; Ep, Epifauna; En, Endofauna. Crucero TIV Especies Ep TV En Ep TVI En Ep TVII En Ep TVIII En Ep TIX En Ep En Aplacophora Neomeniidae 1 X Neomeniidae 2 X Bivalva Acharax johsoni X X X X Cardiomya planetica X Conchocele excavata Cuspidaria sp. X X Cyclopecten pernomus Cyclopecten sp. X X Cymatioa sp. Dacrydium pacificum X X X Ennucula cardara X X Ennucula colombiana X Ennucula tenuis X X X X X X X X X Limatula saturna X Limatula similaris X Limopsis dalli Lucinoma heroica X X X X X M oluscos X X X X X X de aguas profundas del sur del golfo de X C alifornia 249 Cuadro 1. Continúa Crucero TIV Especies Ep Lyonsiella quylei X TV En Ep TVI En Ep X Malletia alata X X Myonera sp. X X Neilonella ritteri X Nucula carlottensis X X TVII En Ep TVIII En Ep X X X X X Nuculana pontonia X Nuculana sp. X X X Periploma sp. X Policordia sp. X X Solemya agassizi X Teredo sp. X Thracia sp. X X Vesicomya sp. X X Yoldia sp. X Gastropoda X Architectonica sp. X Astyris permodesta X X Buccinum sp. X Microglyphis sp. Philine sp. X X X X X X X X Gasterópodo indet. X 250 X X Solariella nuda X X X Bathybembix bairdii Ep X X Dermatomya mactroides Acteon sp. En X Nuculana pernula Periploma carpenteri TIX X X X X Biodiversidad y comunidades del talud continental del Pacífico mexicano X En Cuadro 1. Continúa Crucero TIV Especies Ep TV En Ep TVI En Ep TVII En Ep TVIII En Ep TIX En Ep En Scaphopoda Cadulus californicus X Gadila fusiformis X X Dentalium agassizi Fissidentalium megathyris Rhabdus dalli X X X X X X X X X X X X Clase Bivalvia Orden Solemyoida Familia Acharacidae Acharax johnsoni (Dall, 1891). Esta especie fue recurrente en los muestreos realizados en el sur del golfo de California durante los cruceros TALUD y únicamente no apareció en la campaña TALUD IX. Se registró tanto en la endofauna (draga Karling) como en el epifauna (trineo bentónico), en un intervalo de profundidad de 778 a 1150 m dentro de la ZMO, observándose concentraciones de 0.10 a 0.30 ml l-1 O2. Sin embargo, la literatura señala que su distribución batimétrica va desde los 110 m hasta los 3270 m (Keen 1971). Geográficamente, se conoce desde Perú hasta Puget Sound, Washington, siendo la localidad tipo las costas de Baja California, México (Parker 1964, Keen 1971). Solemya agassizi Dall, 1908. Se recolectaron 30 organismos en la muestra de epifauna de la estación 16 del TALUD VIII (25° 24’ N, 110° 37’ O) a una profundidad de 1030 m (5°C, 34.5 ppm, 0.2 ml l-1). Se tiene registro de que esta especie sólo se distribuye en el Pacífico mexicano, desde Cabo San Lucas, BCS, hasta el golfo de Tehuantepec. También fue documentada en el trabajo de Parker (1964) a una profundidad media de 1376 m y su intervalo de distribución batimétrica conocido va de 1006 a 3642 m. De las tres especies del mismo género que se conocen para las aguas profundas del Pacífico mexicano, S. agassizi es la que tiene los intervalos de distribuciones geográfica y batimétrico más restringidos. Comparativamente, S. panamensis Dall, 1908 se conoce desde la isla Vancouver, Canadá, hasta Panamá, en un intervalo M oluscos de aguas profundas del sur del golfo de C alifornia 251 de profundidad de 54-1720 m (Emerson y Puffer 1957, Keen 1971). Por su parte, S. valvulus Carpenter, 1964 se conoce desde Monterey, CA., hasta Cabo San Lucas en aguas más someras (2-627 m), lo que sugiere una especie con afinidad de ambientes templados y aguas poco profundas (Parker 1964, Hendrickx y Toledano-Granados, 1994), mientras que S. agassizi se puede considerar con afinidad de aguas profundas. Orden Pholodomyoida Familia Cuspidariidae Cardiomya planetica (Dall, 1908). Esta especie únicamente se registró en la epifauna recolectada durante la campaña TALUD VIII, a una profundidad de 920 m. El registro consistió en nueve organismos bajo condiciones de hipoxia (0.2 ml l-1 O2) y en sedimento de tipo lodo-arenoso, con 6.03 % de materia orgánica. La presencia de la especie en el sur del golfo de California representó un nuevo registro para el área (Zamorano et al. 2007a). En aguas profundas del Pacífico mexicano hay registro de otras tres especies del mismo género: C. californica (Dall, 1896), C. lanieri (Strong y Hertlein, 1937) y C. pectinata (Carpenter, 1864); sin embargo, estas especies presentan un límite máximo de distribución batimétrica de 640 m, mientras que C. planetica se extiende hasta los 2,400 m (Keen 1971). Myonera n. sp. La nueva especie de Myonera registrada durante los cruceros TALUD fue recolectada en dos de ellos (12 organismos de la epifauna del TALUD IV y un ejemplar de la endofauna del TALUD V), a profundidades de 789 m y 830 m, respectivamente. Se observó bajo condiciones de hipoxia moderada (0.13-0.29 ml l-1 O2) en un sedimento predominantemente lodoso (98-99 %) y con condiciones de materia orgánica alto en relación al resto de las estaciones muestreadas durante los cruceros (9.9-10.9 %). En aguas profundas del Pacífico tropical mexicano se cuenta con un sólo registro para el género Myonera. Se trata de M. garretti (Dall, 1908), recolectado a profundidades de entre 3481m y 3557 m y cuya distribución actual documentada se extiende desde el sur de Baja California Sur hasta el golfo de Tehuantepec, sin que se haya documentado su presencia en el golfo de California hasta la fecha. Esta especie ha sido citada en los trabajos de Parker (1964), Keen (1971) y Keen y Coan (1975); es el sinónimo más antiguo de Myonera mexicana Knudsen, 1970 por lo que en la descripción de la nueva especie se debe de considerar dicho informe. 252 Biodiversidad y comunidades del talud continental del Pacífico mexicano Cuspidaria n. sp. Para esta nueva especie sólo se cuenta con un organismo recolectado en la epifauna del TALUD IV. La estación en la que se muestreó coincide con los 12 registros de Myonera n. sp. antes señalados, por lo que cabría la duda si se trata de diferentes especies o bien el grado de deterioro de la concha no permitió un adecuado análisis. Los valores de las variables ambientales presentes en la estación de captura son: 789 m, 5.1°C, 0.29 ml l-1 O2, 9.86 % de materia orgánica y sedimentos con 99.1 % de lodo y 0.9 % de arena. Otros registros del género en las aguas profundas del Pacífico mexicano disponibles en la literatura indican la presencia de cuatro especies: C. berigensis Leche, 1883, distribuida desde el mar de Bering, AK (localidad tipo), hasta la costa occidental de Baja California, México, sin registros en el golfo de California, con un intervalo batimétrico de 1880 m a 1936 m; C. panamensis Dall, 1908, distribuida desde Baja California hasta Panamá, sin registro en el golfo de California y con un intervalo batimétrico amplio (915-2817 m); C. parapodema Bernard, 1969, distribuida desde Punta San Luis, CA, hasta bahía Elena, Costa Rica, y presente en el sur del golfo de California, especie típicamente de aguas someras (43-410 m de profundidad). La última especie del género registrada en el Pacífico mexicano es C. parkeri Knudsen, 1970, una especie de aguas profundas (2770-2817 m) registrada únicamente en el sur del golfo de California. Familia Periplomatidae Periploma carpenteri Dall, 1896. Una especie conspicua en aguas profundas del sur del golfo de California, recolectada tanto en la epifauna como en la endofauna durante los cruceros TALUD IV, VI, VIII y IX. Las muestras obtenidas confirmaron la presencia de esta especie en el sur del golfo de California y permitieron extender su intervalo de distribución batimétrica hasta los 1030 m (Zamorano et al. 2007a). Un total de 81 organismos fueron recolectados durante el proyecto TALUD y los valores de las variables ambientales asociados se documentan en la cita anterior. Es la única especie del género que se ha encontrado en el Pacífico mexicano y sus límites de distribución geográfica corresponden, en el norte, a la bahía de San Carlos, Sonora y, en el sur a su localidad tipo, en Panamá. El registro más somero conocido es de 100 m. Periploma sp. Las características conquiliológicas sobre las que se basó la identificación sugiere que podría tratarse de P. rosewateri Bernard, 1989; sin embargo, no se observó la totalidad de las características diagnósticas que caracterizan esta especie, por lo que se decidió dejarlo a nivel género esperando corroborar a detalle M oluscos de aguas profundas del sur del golfo de C alifornia 253 el registro. Esta especie normalmente se encuentra desde NewPort, OR, hasta las islas Farallón (SCAMIT 2010), por lo que en dado caso de que se trate de P. rosewateri se estaría correspondiendo un nuevo registro geográfico. Un ejemplar de Periploma sp. se recolectó en la estación 25 del TALUD IV con el trineo bentónico a una profundidad de 789 m, 5.1°C, 0.29 ml l-1 de O2, 9.86 % de materia orgánica, en sedimentos con 99.1 de lodo y 0.9 % de arena. Familia Poromyidae Dermatomya mactroides (Dall, 1889). Previamente se tenían registros de esta especie a 637-915 m de profundidad. Con los datos del proyecto TALUD, se demostró que puede encontrarse en aguas mucho más someras, hasta 182 m (Zamorano et al. 2007a). Durante el proyecto TALUD la especie se recolectó únicamente en el suroeste del golfo de California (TALUD VIII y IX). En la primera campaña se recolectó en la epifauna un organismo a 920 m, 5°C, 34.5 ppm, 0.2 ml l-1 O2, 6.03 % de materia orgánica y en sedimento compuesto por 71.07 % de lodo, 27.76 % de arena y 1.17 % de grava. Para el TALUD IX también se recolectó un organismo en la epifauna a una profundidad de 1097 m, a 3.6°C, 34.6 ppm y 0.11 ml l-1 O2 (sin datos de materia orgánica y de composición de los sedimentos). D. aequatorialis, (Dall, 1908), la segunda especie del género citada para el Pacífico este tropical, es considerada un sinónimo más reciente de D. mactroides, por lo que esta última es el único representante del género en esta región (Skoglund, 2001). Familia Thraciidae Thracia sp. Se cuenta con 10 registros de esta especie en la epifauna del TALUD IV, todos correspondientes a la estación 25 (800 m, 5.1°C, en condiciones de hipoxía 0.29 ml l-1 O2, dominancia de lodo en el sedimento). Por su parte, el único registro identificado en el TALUD V formó parte de la muestra de 85 l de sedimento obtenida con la draga Karling a 830 m, 5.2°C, con hipoxia (0.13 ml l-1 O2) dentro de la ZMO. El porcentaje de materia orgánica fue de 10.87 % y el sedimento compuesto en su mayoría por lodo (98.10 %) y pequeñas porciones de arenas (1.50 %) y de grava (0.40 %). En aguas profundas del Pacífico mexicano, únicamente se cuenta con el registro de Thracia trapezoides Conrad, 1849, para la costa occidental de la península de Baja California. Su localidad tipo, en Astoria, OR, y su distribución geográfica (Cook Inlet, AK hasta la isla Cedros, BCS) sugieren que esta sea una especie de ambientes tem254 Biodiversidad y comunidades del talud continental del Pacífico mexicano plados (Scott y Blake 1998). Esta especie es un sinónimo más reciente de Thracia kanakoffi Hertlein y Grant, 1972 y se le ha encontrado habitando el límite inferior de la plataforma continental (200 m). Según los datos de la literatura, el registro del género en el golfo de California basado en las muestras del proyecto TALUD, puede considerarse como un extensión tanto geográfica como batimétrica. Familia Verticordiidae Policordia n. sp. Según comentarios y revisión del material por E. Coan, esta especie de Policordia corresponde a una nueva especie. El único organismo fue recolectada en la epifauna del sureste del golfo de California durante los muestreos del TALUD IV en el año 2000 (24° 52’ N y 108° 59’ O). Las condiciones ambientales de recolección son las mismas que las señaladas para Periploma sp. Posteriormente, en el año 2005, seis organismos adicionales fueron recolectados en el suroeste del golfo de California en la estación 11 del TALUD VIII (24° 54’ N y 110° 25’ O). Nuevamente la especie apareció únicamente en la epifauna recolectada con e trineo bentónico y, en esta ocasión, las condiciones ambientales registradas fueron las siguientes: 920 m, 5°C, 34.5 ppm, 0.2 ml l-1 O2, 6.03 % de materia orgánica y sedimento lodo-arenoso (71.07 de lodo, 27.76 % de arena), con escasa presencia de grava (1.17 %). Según datos de Keen (1971) y Keen y Coan (1975), en aguas profundas del Pacífico de México se conoce la presencia de Policordia alaskana (Dall, 1895); sin embargo, en los trabajos citados, únicamente se indica como su límite de distribución sureño “West Mexico”. También se considera que Lyonsella alaskana Bernard, 1974 es un sinónimo de esta especie, lo que sugiere confusiones taxonómicas a nivel genérico. De igual forma, el registro de P. alaskana en México corresponde a una localidad mucho más profunda (3570 m) que las muestreadas en el proyecto TALUD (789-920 m). Lyonsiella quylei Bernard, 1969 (Lámina 1A). El hallazgo de esta especie en el sur del golfo de California por los cruceros TALUD resultó ser un nuevo registro para el área (Zamorano et al. 2007a); previamente se conocía de la isla de Vancouver, Columbia Britanica, Canadá, hasta la isla Santa Catalina (localidad tipo), CA. (Bernard 1976). Los 50 organismos analizados proceden todos de la epifauna muestreada en la estación 25 del TALUD IV, bajo condiciones ambientales antes descritas para otras especies en esta misma estación. Los registros previos de la especie indicaban un intervalo de distribución batimétrica de 664 m a 800 m y los registros obtenidos en el proyecto TALUD (789 m) coinciden con el límite inferior antes señalado. M oluscos de aguas profundas del sur del golfo de C alifornia 255 Lyonsiella magnifica Dall, 1913 es la otra especie del género que se ha registrado en aguas mexicanas, concretamente en el golfo de California (localidad tipo, Mazatlán, Sin.), donde ha sido señalada como una especie de “aguas profundas”, sin más detalles (Dall 1913). Orden Veneroida Familia Thyasiridae Conchocele excavata (Dall, 1901). Con un total de tres ejemplares, esta especie se registró en dos muestras de la endofauna obtenidas durante el crucero TALUD VI, entre 1170 m y 1500 m, 2.8 y 3.5 °C, bajo condiciones de oxigenación altas en relación al resto de las estaciones (0.87-1.74 ml l-1 O2) y con un contenido de materia orgánica de entre 13.36 y 14.41 %, en sedimentos altamente lodosos (>99 %). La presencia de esta especie en el golfo de California ha sido citada por diversos autores, entre ellos Dall (1901; entre 120 m y 1829 m) y Skoglund (1991; entre 800 m y 2050 m). En la base de datos proporcionada por Lawrence Lovell de la Colección de Invertebrados de SIO, la especie es registrada entre 1684 y 1723 m. Estos datos sugieren que su distribución batimétrica se restringe a la parte inferior del talud continental donde la concentración de oxígeno vuelve a aumentar mientras que su distribución geográfica está restringida al centro y sur del golfo de California (Guaymas, Son., a Los Cabos, BCS). Se reconocen dos sinónimos más recientes: Thyasira excavata (Dall, 1901) y Thyasira tricarinata Dall, 1916. Además, existen registros para el Pacífico mexicano de Thyasira flexuosa (Montagu, 1803), una especie con una distribución mundial en aguas templadas y cuya localidad tipo esta en el Devonshire, Reino Unido. Ha sido citada, bajo muchos nombres diferentes en diversas regiones zoogeográficas y también se ha observado desde los 20 m hasta los 3000 m de profundidad (Scott y Blake 1998). Por su parte, otra especie ha sido señalada desde la Columbia Británica, Canadá, hasta isla Cedros en BC: Thyasira gouldi (Philippi, 1845). Sus registros la señalan como habitante de la parte superior del talud continental (311-329 m). Familia Lucinacae Lucinoma heroica (Dall, 1901). Durante el proyecto TALUD, esta especie se ha presentado tanto en la endofauna como en la epifauna durante casi todos los cruceros oceanográficos para los cuales ya se ha hecho la revisión del material (TALUD IV-X). Nuestros datos y los análisis estadísticos efectuados han señalado que es 256 Biodiversidad y comunidades del talud continental del Pacífico mexicano un habitante frecuente y dominante en la zona mínima de oxígeno (Zamorano et al. 2007b), donde se distribuye bajo condiciones de hipoxia severa (por debajo de 0.1ml l-1O2) y moderada (0.1-0.5ml l-1O2). La mayor abundancia de la especie se documenta entre los 730 y 990 m de profundidad y, a la fecha, se tienen identificados 291 organismos (Zamorano y Hendrickx, 2012). Pese a que la especie es recurrente en los muestreos realizados en el sur del golfo de California, con los datos obtenidos durante los cruceros TALUD se identificó un nuevo registro de distribución batimétrica en su límite superior en alrededor de los 700 m (Zamorano et al. 2007a). La localidad tipo de la especie es Santa Rosalía, BCS, y su distribución geográfica se restringía al centro y sur del golfo de California (Dall 1901, Keen 1971, Scott et al. 1990, Scott y Blake 1998, SIO 2005), aunque recientemente se reportó para Perú (Skoglund 2001). El límite inferior de distribución batimétrica es cercano a los 1,850 m. En algunos trabajos se nombra a la especie como Phacoides heroica. Otras dos especies de Lucinoma han sido registradas en aguas profundas del Pacífico mexicano. La primera es L. annulatum (Reeve, 1850), presente desde AK hasta el norte del golfo de California, a profundidades de entre 25 m y 750 m (Scott y Blake 1998), también conocida (sinónimos) como Lucina annulata Reeve, 1850, Lucinoma densilineata Dall, 1916 y Lucinoma annulata densilineata Dall, 1916. La segunda especie registrada es L. aequizonata (Stearns, 1891), distribuida desde Santa Barbara, CA, hasta Chile a profundidades de 500 m (Skoglund 1991a). Familia Vesicomyidae Vesicomya n.sp. Esta nueva especie esta en proceso de descripción y se recolectaron ocho organismos en la epifauna del TALUD IV y un organismo en la endofauna del TALUD V. Las variables ambientales asociadas al registro de la especie en el TALUD IV son: 789 m, 5.1°C, 0.20 ml l-1 O2, 9.86 % de materia orgánica, sedimento lodoso (99.1 %) con presencia marginal de arenas (0.9 %). Para el registro en el TALUD V se tiene los siguientes datos: 2110 m, 2.1°C, una concentración de oxígeno alta (1.98 ml l-1), 13.64 % de materia orgánica y sedimentos lodosos (100 %). La supuesta nueva especie fue corroborada por E. Coan. El género al que corresponde está ampliamente distribuido en el Pacífico mexicano y actualmente se conocen cuatro especies: V. angulata Dall, 1908 conocida únicamente en aguas profundas adyacentes a La Paz, BCS (L. Lovell, com. pers., 2005) y cuya distribución batimétrica se ha observado entre 1810 m y 1908 m de profundidad; V. lepta (Dall, M oluscos de aguas profundas del sur del golfo de C alifornia 257 1896), que cuenta con el mayor número de registros en México (Dall 1895, Parker 1964, Keen 1971, Scott et al. 1990 y SIO) y que presenta una distribución desde bahía Coos, OR, y el centro-sur del golfo de California (localidad tipo, bahía Concepción, BCS) hasta el golfo de Tehuantepec. Esta especie ha sido registrado únicamente a profundidades de entre 1000 m y 2000 m; V. ovalis (Dall, 1896), cuya distribución se restringe al centro-sur del golfo de California, en bahía Concepción y en La Paz, BCS. Los registros batimétricos indican que se trata de una especie distribuida de los 1321 m hasta 1875 m (SIO). Por último, se conoce a V. suavis (Dall, 1913) como endémica de la zona de isla Tiburón, Son. De esta especie sólo se cuenta con el registro original, una muestra recolectada a 1345 m de profundidad (Dall 1913). Familia Lasaeidae Cymatioa sp. No se cuenta con registros del género en aguas profundas del Pacífico mexicano. Para la familia a la que pertenece, sólo se conocen dos especies del género Rochefortia, ambas restringidas a aguas menores a 600 m de profundidad (Scott y Blake 1998). Los seis organismos recolectados se encontraron en la epifauna recolectada durante el TALUD VIII (25°24’ N y 110°37’ O), a 1,030 m, 5°C y 34.5 ppm. La concentración de oxígeno epibéntico de la estación de captura comprende a condiciones de hipoxia moderada (0.2 ml l-1 O2); no se cuenta con datos de materia orgánica o de la composición del sedimento. Orden Ostreoida Familia Pectinidae Cyclopecten pernomus (Hertlein, 1935) y Cyclopecten n. sp. Un total de 35 organismos de C. pernomus fueron recolectados con el trineo bentónico a 1,100 m de profundidad en el suroeste del golfo de California durante el TALUD VIII con los siguientes datos ambientales: ca 3 °C, 34.7 ppm, 0.39 ml l-1 O2, 7.25 % de materia orgánica y sedimento predominantemente lodoso (88.63 %) pero con importante presencia de arenas (11.37 %). Por otra parte, se recolectaron también 55 organismos de Cyclopecten n. sp. con el trineo bentónico a 789 m de profundidad en el sureste del golfo de California durante el TALUD IV; en este caso, los datos ambientales fueron: >5°C, 0.29 ml l-1 O2, 9.86 % de materia orgánica y un sedimento lodoso (99.1 %) con presencia marginal de arenas (0.9 %). Como se observa, las diferencias ambientales entre ambas especies son tangibles. Por ejemplo, C. pernomus se recolectó fuera de la ZMO en un sustrato lodo-arenoso, mientras que la nueva especie se registró dentro de la ZMO, en un sustrato meramente 258 Biodiversidad y comunidades del talud continental del Pacífico mexicano lodoso. Para C. pernomus se cuenta con suficientes registros para poder determinar una distribución geográfica amplia, desde isla Cedros, BC, y bahía San Carlos, Son., hasta isla La Plata, Ecuador, con la localidad tipo en la bahía de Panamá. Su distribución batimétrica es también muy amplia, desde la zona circalitoral (2 m) hasta 1720 m (Emerson y Puffer 1957, Keen 1971). En la literatura se cita también como Pecten pernomus y Propeamussium pernomus. Para el Pacífico mexicano se cuenta con el registro de otras cuatro especies de Cyclopecten, la mayoría de ellas con una amplia distribución, tanto geográfica como batimétrica. Cyclopecten exquisitus Grau, 1959 está asociado con la plataforma continental y su registro más profundo es a 274 m; su localidad tipo esta en las islas Galápagos y se distribuye desde Ángel de la Guardia, BC, hasta Callao, Perú. Cyclopecten incongruus (Dall, 1916) se conoce únicamente a 1,250 m en las cercanías de isla Cedros, BC Cyclopecten polyleptus (Dall, 1908), distribuido desde bahía San Carlos, Son., hasta las islas Galápagos, su localidad tipo, tiene registros desde la plataforma continental hasta 650 m (Skoglund 1991a) y es conocido también como Pecten polyleptus o Delectopecten polyleptus. Orden Mytiloida Familia Mytilidae Dacrydium pacificum Dall, 1916. La presencia de esta especie en los cruceros TALUD representó el primer registro en mares mexicanos, tema que se discute en Zamorano et al. (2007a) junto con los datos ambientales asociados con su captura. Se registró tanto en la endofauna (TALUD V y VII) como en la epifauna (TALUD IV), y previamente se conocía desde el mar de Alaska, a profundidades de entre 502-1,310 m, hasta los 55°N, a 2564 m de profundidad (Bernard 1983). Previamente, en aguas profundas del Pacífico mexicano, se conocía a D. elegantulum Soot-Ryen, 1955 también citada como Quendreda elegantulum, y cuya distribución batimétrica señalada se restringe a la plataforma continental (25-200 m de profundidad), con una amplia distribución geográfica desde California hasta las islas Galápagos (Keen y Coan 1975, Skoglund 1991a). Por otra parte, el género también ha sido encontrado alrededor de los 3500 m de profundidad, con D. panamensis Knudsen, 1970, cuyo registro en aguas mexicanas corresponde a Acapulco, Gro., siendo éste su límite norteño de distribución geográfica (Keen y Coan 1975, Skoglund 1991a). Así, la presencia de D. pacificum en las aguas mexicanas determina una distribución batimétrica intermedia para el género (5021310 m). M oluscos de aguas profundas del sur del golfo de C alifornia 259 Orden Nuculoida Familia Malletiidae Malletia alata Bernard, 1989 (Lámina 1B). Es una especie recurrente en los muestreos realizados en el sur del golfo de California durante el proyecto TALUD, encontrada tanto en la endofauna como en la epifauna y en prácticamente todos los cruceros (TALUD IV-VIII). La presencia de la especie en el golfo de California representó un nuevo registro geográfico, ya que previamente sólo se conocía en su localidad tipo en San Diego, CA a 1200 m de profundidad (véase Zamorano et al. 2007a). Otros representantes del género en aguas profundas del Pacífico mexicano son M. arciformis Dall, 1908 y M. benthima Dall, 1908, ambas registradas únicamente en Acapulco, Gro., a una profundidad de 900 m. Una tercer especie es M. faba Dall, 1897, la cual ha sido registrada en la costa occidental de la península de Baja California, entre 415 m y 1936 m de profundidad (Parker 1964), ámbito de distribución geográfica que comparte con M. truncata Dall, 1908, aunque esta última habita también aguas mucho más profundas (hasta 2700-2763 m) (Parker 1964). Familia Neilonellidae Neilonella ritteri (Dall, 1916). Esta especie ha sido registrada tanto en la endofauna como en la epifauna durante los cruceros TALUD IV y V. Se señaló su presencia en el golfo de California como nuevo registro (Zamorano et al. 2007a) ya que previamente se conocía únicamente frente a La Jolla (localidad tipo) y Santa Barbara, CA, a 527 m de profundidad (Dall 1916). El intervalo de profundidad en el que se recolectaron los más de 450 ejemplares en el sureste del golfo de California fue de entre 789 m y 926 m, lo que coincide con el registro histórico que sugiere una distribución batimétrica de entre 366 m y 944 m (Scott y Blake 1998). Las condiciones de oxigenación epibentónico bajo las cuales se registró la especie en los cruceros TALUD (0.13-1.03 ml l-1) indica una especie con umbrales altos de resistencia a las condiciones de oxigenación, mientras que el tipo de sedimento del fondo indica preferencia con sustrato predominantemente lodoso con concentraciones de materia orgánica mayores al 10 %. Previamente, en el Pacífico mexicano profundo se contaba con el registro de Neilonella lucasana (Strong y Hertlein, 1937) cuya localidad tipo es San José del Cabo, BCS, y en su momento se confundió el material citado como Nuculana lucasana. Esta especie cuenta con un intervalo de distribución batimétrica más corto que N. ritteri, propio de la plataforma continental y de la parte superior del talud continental, 260 Biodiversidad y comunidades del talud continental del Pacífico mexicano entre 36 y 400 m de profundidad. Su distribución geográfica conocida es a lo largo del golfo de California, desde la bahía de San Carlos, Son., hasta Teacapán, Sin., al este y San José del Cabo, BCS, al oeste (Hertlein y Strong 1940, Keen 1971). Familia Nuculanidae Nuculana pontonia (Dall, 1890). La presencia de dos organismos de esta especie en la epifauna del TALUD VIII, a 1100 m de profundidad y en sustrato lodoso, representa un nuevo registro geográfico en el golfo de California (Zamorano et al. 2007a). Previamente se conocía desde Santa Barbara, CA, hasta Panamá y Perú, pero no existían registros dentro del golfo de California (Keen 1971, Bernard 1976, 1983, Scott y Blake 1998). La localidad tipo esta frente a las islas Galápagos, entre 1141 y 1461 m (Dall 1889). Previamente, se conocía desde 1485 a 3050 m de profundidad (Keen 1971) y desde 1150 m (Scott y Blake 1998). En los muestreo del TALUD se recolectaron dos organismos a 1,100 m, lo que significó un ligero incremento de su registro batimétrico inferior (Zamorano et al. 2007a), en las siguientes condiciones ambientales: 3°C 34.7 ppm, 0.39 ml l-1 O2, 7.25 % de materia orgánica y sedimento lodosos con arena (88.63 %-11.37 %). Nuculana pernula (Müeller, 1771). Al igual que N. pontonia, esta especie sólo se registró en la epifauna del TALUD VIII aunque en otra estación. Solo se recolectó un organismo a 1030 m, 5°C, 34.5 ppm, y en condiciones de hipoxia moderada (0.2 ml l-1). No se cuenta con datos de materia orgánica o de la composición del sedimento. Nuculana sp. De las tres especies de Nuculana que se han identificado entre el material recolectado durante el proyecto TALUD, esta última es la más frecuente. Se recolectó en la endofauna y en la epifauna en tres campañas oceanográficas (TALUD V-VII). La muestra total incluye cuatro organismos cuyas conchas no están en buen estado, lo que ha dificultado su precisa identificación. Las condiciones ambientales de captura muestran un intervalo batimétrico de 815-1295 m, desde condiciones de anoxia (0.04 ml l-1, Est. 25, TALUD VII) hasta moderadamente hipóxicas (0.22 ml l-1, Est. 25, TALUD VI y 0.53 ml l-1, Est. 26, TALUD V), entre 3.8 y 5.6°C, y con unas concentraciones de materia orgánica de 10.9 a 13.81 % y el sedimento principalmente lodoso (97.3-100 %). Otras especies representantes del género Nuculana en aguas profundas del Pacífico mexicano son: • Nuculana agapea (Dall, 1908). Citada por Hertlein y Strong (1940) y Parker (1964) en aguas con profundidades cercanas a 3000 m. Tiene su localiM oluscos de aguas profundas del sur del golfo de C alifornia 261 • • • • • dad tipo en el golfo de Panamá y se distribuye desde Nayarit, México, hasta Ecuador. Citada también como Leda agapea. Nuculana grasslei Allen, 1993. Citada únicamente en su localidad tipo, en la cuenca de Guaymas, Son, en el centro-norte del golfo de California (Allen 1993) y registrada entre 1997 y 2022 m de profundidad. Nuculana hamata (Carpenter, 1864). Especie con amplio intervalo de distribución batimétrico (30 a 1490 m). De igual forma, su intervalo de distribución geográfica se extiende desde isla Forrester, AK, hasta Panamá con la localidad tipo en Santa Barbara e isla Catalina, CA (Scott y Blake 1998). Cuenta con registros para el centro del golfo de California y es también conocida como Leda hamata y Leda hamata limata Dall, 1916. Nuculana lobula (Dall, 1908). Conocida únicamente en su localidad tipo, en la plataforma continental de Acapulco, Gro, entre 59 y 260 m de profundidad (Hertlein y Strong 1940, Keen 1971). Nuculana rhytida (Dall, 1908). Registrada únicamente en Acapulco (localidad tipo) a 257 m de profundidad (Hertlein y Strong 1940). Descrita originalmente como Leda rhytida. Nuculana taphria (Dall, 1897). Citada por Parker (1964), y su distribución geográfica es desde isla Cedros, BC, hasta La Paz, BCS, con incursión en el centro del golfo de California. Es una especie propia de la plataforma continental (164-298 m de profundidad) y se desconoce su localidad tipo. Familia Nuculidae Ennucula cardara (Dall, 1916). Un solo ejemplar de esta especie fue recolectado en la endofauna del TALUD V, en el sureste del golfo de California, y otro en la epifauna del TALUD IX, en el suroeste del golfo de California. Su registro representó un nuevo dato de distribución (Zamorano et al. 2007a), ya que previamente se conocía desde Cabo Flattery, WA, hasta Cabo San Lucas, BCS (Bernard 1976, Scott y Blake 1998). Su localidad tipo San Diego, CA a 1962 m de profundidad (Dall 1916). En el presente proyecto, los organismos se recolectaron entre 836 y 1170 m de profundidad, con una concentración de oxígeno disuelto de 0.03 a 0.54 ml l-1, una temperatura media de 4.7°C, en sedimentos con 11.03 % de materia orgánica y predominatemente arenosos (73.50 %), con una porción importante de lodo (26.5 %). Los registros previos indican que la especie se distribuye de 590 m a 2600 m de profundidad (Scott y Blake 1998), intervalo dentro del cual se registró el material del proyecto TALUD. 262 Biodiversidad y comunidades del talud continental del Pacífico mexicano Ennucula colombiana Dall, 1908 (Lámina 1). Ampliamente distribuida en aguas profundas del Pacífico americano, los registros indican que se extiende desde San Felipe, BC, hasta Chile, incluido todo el golfo de California; su distribución batimétrica es desde 11 m hasta 2140 m. En el proyecto TALUD se registró tanto en la endofauna como en la epifauna y fue catalogada como frecuente (TALUD IV-VIII) a profundidades de entre 731 y 2110 m. Se distribuye en un amplio intervalo/espectro de concentración de oxígeno (0.12 a 1.98 ml l-1), así como también de materia orgánica (4.84 a 18.78 %), en sedimento predominantemente lodoso. El número total de organismos con el que se cuenta es de 14, todos en buen estado de conservación. Ennucula tenuis (Montagu, 1808). Especie circumboreal que, en el Pacífico Este, se conoce desde la isla Nunivak, AK, hasta San Diego, CA (Bernard 1976, 1983), este último como el registro más sureño (Scott y Blake 1998) junto con isla Cedros, BC, México (Hertlein y Strong 1940). Su localidad tipo corresponde a Dumbar, Inglaterra y, de acuerdo con Dall (1889), esta especie se distribuye entre 315 y 810 m de profundidad. Ha sido señalada por Scott y Blake (1998) desde 10 hasta 927 m. El presente registro incrementa su intervalo de profundidad conocido hasta 1250 y 1440 m (Zamorano et al. 2007a). Se recolectaron 52 organismos en la epifauna del TALUD IV en un sustrato lodoso, en condiciones hipóxicas (0.29 ml l-1 O2) y en sedimentos con 9.8 % de materia orgánica. Además, se recolectó un organismo en la endofauna del TALUD VI, también en sustrato lodoso (1.28 ml l-1 O2; 14.52 % de materia orgánica). A la fecha no se cuenta con información acerca de otras especies del género Ennucula en aguas profundas del Pacífico mexicano. Nucula carlottensis Dall, 1897. Registrada en la epifauna de tres cruceros oceanográficos (TALUD IV, VII y VIII). Esta especie fue muy abundante durante el TALUD IV, obteniéndose 149 ejemplares, mientras que en los otras dos campañas la muestra fue mínima. El intervalo de profundidad de las capturas es de 785 m a 1,030 m, con temperatura constante de alrededor de los 5°C, en condiciones de hipoxia severa (0.150.29 ml l-1) y con porcentajes de materia orgánica entre 9.86 % y 17.47 %, en un sustrato lodoso. Nucula darella Dall, 1916, un sinónimo más reciente de esta especie, tiene su localidad tipo en la isla Queen Charlotte, Canadá, y su distribución geográfica va desde la Columbia Britanica, Canada, hasta Acapulco, Gro., con presencia de la especie en el sur del golfo de California. Nucula carlottensis ha sido recolectada entre 104 m y 2600 m de profundidad (Skoglund 1991a , Scott y Blake 1998). En aguas profundas del Pacífico mexicano el género Nucula es ampliamente distribuido y consta de otras cuatro especies: M oluscos de aguas profundas del sur del golfo de C alifornia 263 • Nucula chrysocome Dall, 1908. Distribuida desde el oeste de México hasta su localidad tipo en Perú, con registros en un intervalo de profundidad amplio (733-4060 m) (Keen 1971). • Nucula exigua Sowerby, 1833. La localidad tipo esta en Caracas, Venezuela, y su distribución es amplia a lo largo del Pacífico americano, contando con registros desde la bahía de Los Ángeles, BC, hasta Zorritos, Perú, incluido todo el golfo de California (Emerson y Puffer 1957, Keen 1971), desde aguas someras (11 m) hasta la zona intermedia del talud continental (1900 m). Nucula suprastriata Carpenter, 1903 es un sinónimo más reciente de esta especie. • Nucula panamina Dall, 1908. También conocida como Ennucula panamica, se distribuye desde Baja California hasta el golfo de Panamá (localidad tipo), incluido el sur del golfo de California (Hertlein y Strong 1940, Parker 1964), entre 1150 y 3009 m de profundidad. • Nucula taeniolata Dall, 1908. Únicamente conocida en su localidad tipo, Acapulco, Gro., a 900 m de profundidad (Hertlein y Strong 1940, Keen 1971). Familia Sereptidae Yoldia sp. Se cuenta con un solo organismo recolectado con el trineo bentónico en la estación 17 del TALUD VIII (25° 24’ N y 110° 37’ O), en el suroeste del golfo de California, a una profundidad de 1,031 m, a 6°C , 34.4 ppm, 0.13 ml l-1 O2, 18.5 % de materia orgánica y un sustrato lodoso (98.72 %) con muy poca arena (1.28 %). A más de 200 m de profundidad en el Pacífico mexicano se han registrado otras dos especies de este género La primera, Y. ensifera plana Dall, 1908, esta citada por Parker (1964) en la costa occidental de la península de Baja California, entre 231 y 318 m de profundidad, con una distribución que se restringe a la zona de influencia de la corriente de California (véase Zamorano y Hendrickx 2011). La otra especie, Y. martyria Dall, 1897, presenta una distribución más amplia, desde bahía Kasaan, AK, hasta el golfo de California, y tiene su hábitat en la plataforma continental, entre 35 y 250 m de profundidad (Keen 1971). Orden Limoida Familia Limidae Limatula similaris (Dall, 1908). Esta especie se describió originalmente como Lima similaris. En el presente proyecto se registró un organismo en la endofauna del 264 Biodiversidad y comunidades del talud continental del Pacífico mexicano TALUD V, a 1567 m de profundidad, a concentraciones de oxígeno disuelto y de ma- teria orgánica altas con relación al resto de las estaciones (1.15 ml l-1 O2 y 15.67 %), en un sustrato lodoso (99.90 %) y con una temperatura epibéntica de 3 °C. Los registros previos indican una distribución geográfica desde Baja California hasta Panamá, incluido el sur del golfo de California, y se contempla como una especie que habita tanto la plataforma como el talud continentales (55-1620 m de profundidad). Limatula saturna Bernard, 1978 (Lámina 1). Se cuenta con siete organismos de esta especie recolectados en dos estaciones del TALUD VIII en el suroeste del golfo de California. Bernard (1983) señala esta especie entre 45 y 49° N en el Pacífico este. Posteriormente, Scott y Blake (1998) la citan para la isla Kodiak (56.5°N), AK, hasta Cabo San Lucas (22.9° N), BCS. El material del proyecto TALUD permitió extender su distribución hasta isla del Carmen, BCS, dentro del golfo de California (Zamorano et al. 2007a). Previamente se conocía desde los 30 hasta los 675 m de profundidad (Scott y Blake 1998). Con las muestras del TALUD VIII, este intervalo se incrementó hasta 1150 m (Zamorano et al. 2007a). Limatula saturna presenta una estructura morfológica muy heterogénea, lo cual ha propiciado su descripción bajo diferentes nombres tales como Limatula californica Bernard, 1988, y Limatula macleani Bernard, 1988. No se cuenta con registros para las aguas profundas del Pacífico mexicano de otras especies de la familia Limidae y por ende del género Limatula. Orden Arcoida Familia Limopsidae Limopsis dalli Lamy, 1912. Un solo ejemplar de esta especie fue recolectado con el trineo bentónico durante el TALUD VIII en el suroeste del golfo de California (24° 58’ N y 110° 17’ O). Ha sido recurrentemente señalada en los trabajos que tratan la fauna de aguas profundas del Pacífico mexicano, incluido el golfo de California. Las recolecciones previas indican que se encuentra a una profundidad máxima de 4191 m y se distribuye desde Baja California hasta el golfo de Panamá, con incursión en aguas profundas del sur del golfo de California (Parker 1964, Keen 1971, L. Lovell com. pers.). En estos estudios se menciona que L. dalli es un habitante de profundidades mayores a 2000 m; sin embargo, la muestra del TALUD VIII fue obtenida a 1500 m, lo que resulta ser un nuevo registro del límite inferior de distribución batimétrica. Esta especie también ha sido descrita como Limopsis compressus Dall, 1896, actualmente reconocido como un sinónimo más reciente. M oluscos de aguas profundas del sur del golfo de C alifornia 265 Otras especies del mismo género que se han registrado en las aguas profundas del Pacífico mexicano son: Limopsis diazi Dall, 1908, recolectada a 1207 m de profundidad frente a Acapulco, Gro. (Keen 1971), de la cual no se tienen registros en otro sitio; L. juarezi Dall, 1908 es la otra especie presente en México y su distribución es desde Acapulco, Gro., hasta el golfo de Tehuantepec y el golfo de Panamá, entre 1207 y 1960 m de profundidad (Keen 1971). Orden Myoida Familia Teredinidae Teredo sp. Únicamente se cuenta con un registro de esta especie obtenido en el suroeste del golfo de California durante el TALUD VIII. El ejemplar fue recolectado a 920 m, 5°C y 34.5 ppm, en un ambiente epibéntonico hipóxico (0.20 ml l-1 O2) y condiciones de baja concentración de materia orgánica (6.03 %) en un sedimento heterogéneo, pero dominado por lodo (71.03 %), seguido de arena (27.76 %) y una porción de gravas (1.17 %). No se cuenta con registros previos de la familia Teredinidae en aguas con profundidades mayores a 200 m dentro del Pacífico mexicano. Clase Gastropoda Orden Cephalaspidea Familia Acteonidae Acteon sp. Recolectada en la epifauna durante el TALUD IV con un sólo ejemplar a una profundidad de 789 m, en condiciones de hipoxia moderada (0.29 ml l-1 O2), 9.86 % de materia orgánica y un sustrato predominantemente lodoso (99.1 %). El muestreo se realizó en el sureste del golfo de California (24° 51.7’ N y 108° 57.9’ O), en la localidad donde se encontraron las mayores riquezas de especies de moluscos y abundancia de todas las estaciones muestreadas durante los cruceros TALUD IV-IX. En el norte del golfo de California, previamente se conocía a Acteon panamensis Dall, 1908, cuyos registros indican una distribución desde la bahía de los Ángeles, BC, hasta Panamá. Poco se sabe acerca de su intervalo batimétrico, ya que sólo se menciona que se ha capturado a 2320 m de profundidad. Microglyphis sp. Registrada en la endofauna de la estación 25 del TALUD V, se cuenta con un sólo ejemplar recolectado a 830 m de profundidad, bajo condiciones de hipoxia severa (0.13 ml l-1), a una temperatura de 5.2 °C. Los análisis de sedimentos en esta estación indicaron una concentración de materia orgánica 266 Biodiversidad y comunidades del talud continental del Pacífico mexicano cercana al 11 % y un sustrato lodoso con arena, con una mínima presencia de gravas (0.40 %). En el golfo de California, específicamente frente a Mazatlán, Sin., se cuenta con el registro de Microglyphis mazatlanicus (Dall, 1908), originalmente nombrada como Acteon mazatlanicus. Los datos del muestreo de esta última especie en el área de Mazatlán indican una profundidad de captura de 1,820 m. El conocimiento sobre la distribución de la especie está restringido a su localidad tipo, en el sureste del golfo de California (Keen 1971). Familia Philinidae Philine sp. Es la tercera especie de gasterópodo perteneciente al orden Cephalaspidea e identificado durante los cruceros TALUD. Al igual que las dos anteriores, sólo se cuenta con un ejemplar, mismo que se recolectó en la estación 25 del TALUD V con la draga Karling. Las condiciones ambientales relacionadas con su captura son las mismas que se mencionaron para Microglyphis sp. En las aguas profundas del Pacífico mexicano, se ha señalado la presencia de Philine hemphilli Dall, 1919, recolectada en la costa occidental de la península de Baja California, en Cabo San Quintín, en el área de incidencia de la corriente de California, a 653 m de profundidad (Dall 1919). No se conoce otro registro, por lo que su distribución geográfica, según lo que se sabe actualmente, se restringe a Baja California. Orden Heterostropha Familia Architectonicidae Architectonica sp. Un ejemplar de esta especie fue recolectado en la endofauna con la draga Karling, a 1500 m de profundidad durante el TALUD VI en el sureste del golfo de California, en un ambiente con 2.8° C y con una franca recuperación del oxígeno (1.74 ml l-1), con 13.36 % de materia orgánica y un sedimento constituido por 92.7 % de lodo y 7.3 % de arena. No se cuenta con registros previos ni del género, ni de la familia en aguas profundas del Pacífico mexicano. Orden Neotaenioglossa Familia Columbellidae Astyris permodesta (Dall, 1890). Recolectada en la epifauna del TALUD VIII, se cuenta con una muestra de 77 organismos encontrados a 700 m de profundidad en el suroeste del golfo de California, con los siguientes datos ambientales: 6°C, 34.4 ppm, 0.13 ml l-1 de O2, 18.5 % de materia orgánica y un sedimenM oluscos de aguas profundas del sur del golfo de C alifornia 267 to compuesto por 98.72 % de lodo y 1.28 % de arena. La localidad tipo es en Santa Barbara, CA, y según datos encontrados en la literatura se distribuye desde Monterey, CA, hasta el suroeste del golfo de California, a profundidas de entre 300 y 1000 m (McLean 1996). Esta especie también ha sido citada como Columbella permodesta y Mitrella permodesta y se ha registrado tanto en la costa occidental de la península de Baja California como en el golfo de California. Otra especie conocida en el Pacífico mexicano profundo es Astyris gausapata (Gould, 1850), cuya localidad tipo es Puget Sound, WA. En México ha sido señalado para el área de influencia de la corriente de California, entre los 30 y los 200 m (McLean 1996). Su distribución geográfica conocida va de bahía Bechevin, AK, hasta Punta San Pablo, B.C.S. La especie ha sido citada como Columbella gausapata y tiene varios sinónimos. Entre ellos: Nitinella gouldii Carpenter, 1857; N. lutulenta Dall, 1919; Mitrella gouldii Grant y Gale, 1931; Columbella dalli Smith, 1880; Alia casciana Dall, 1919. Esto indica una alta variabilidad morfológica intra-específica. Familia Buccinidae Buccinum n. sp. Esta nueva especie se recolectó en gran cantidad en la epifauna del TALUD IV (68 ejemplares) y un organismo más con el trineo bentónico en el TALUD VII. Las condiciones ambientales registradas muestran un intervalo de distribución batimétrica de 789 a 815 m de profundidad, con concentraciones de oxígeno entre 0.04 y 0.29 ml l-1, temperaturas cercanas a 5°C y un intervalo de concentración de materia orgánica que va de 9.86 % a 12.21 %, sobre un sustrato principalmente lodoso (>99 %). Ha sido recolectada en el sureste del golfo de California y previamente no se contaba con registro del género en aguas profundas del Pacífico mexicano, aunque miembros de la familia Buccinidae han sido ampliamente documentados en esta región, con presencia de ocho géneros y 20 especies, la mayoría de ellas restringidas a la porción menos profunda del talud continental (<650 m) (Dall 1917, 1919, Strong y Hertlein 1937, Demond 1952, Parker 1964, Keen 1971, Poorman 1981). Solamente Neptunea amiantus (Dall, 1890) ha sido registrada a más de 1500 m de profundidad en isla Cedros, BC. (L. Lovell, com. pers.). Orden Patellogastropoda Familia Trochidae Bathybembix bairdii (Dall, 1889) (Lámina 1). Esta especie de gasterópodo es una de las más recurrentes en los cruceros TALUD. Se ha registrado su presencia 268 Biodiversidad y comunidades del talud continental del Pacífico mexicano en todo el sur del golfo de California, en un amplio intervalo batimétrico que va desde 778 hasta 2140 m de profundidad (Zamorano et al. 2007b). Los datos ambientales asociados a cada una de las muestras son ampliamente descritos en Zamorano et al. (2007a), trabajo en el cual se discutió un nuevo registro batimétrico superior, siendo el anterior hasta 1400 m (McLean 1996). Previamente, su distribución se reconocía desde Columbia Británica hasta el golfo de Tehuantepec (Keen 1971, McLean 1996), pero no existían registros para el golfo de California. Recientemente, Hendrickx y López (2006) señalaron que el intervalo de distribución de Bathybembix bairdii se extendió hasta El Salvador. La localidad tipo es la isla San Clemente, CA, a 745 m de profundidad (Dall 1889). En la descripción original es nombraba Turcicula bairdii. Solariella oxybasis Dall, 1890 es considerado sinónimo de esta especie. Otros registros de esta especie en aguas profundas del Pacífico mexicano son para Acapulco y en el golfo de Tehuantepec, desde 350 a 1,400 m de profundidad (McLean 1996). En el catálogo del SIO (2005) se señala en el golfo de California, entre 931 y 952 m de profundidad. Sin embargo, la mayor cantidad de localidades de captura y de ejemplares recolectados en esta área corresponde a los cruceros TALUD III al VIII, con un total de 266 organismos. En aguas más profundas (>1500 m) se ha registrado la presencia de B. ceratophora (Dall, 1895), originalmente conocida como Solariella ceratophora. Según datos de la literatura, esta especie se distribuye desde San Diego, CA, hasta El Salvador, entre los 1460 y los 2740 m (Dall 1895, Keen 1971) con la localidad B tipo en La Paz, B.C.S. Una tercera especie del género, B. aquatorialis (Dall, 1896), presenta un intervalo de distribución batimétrico más restringido (1830-2190 m), aunque su distribución geográfica es más amplia, desde San Diego, CA, hasta Panamá (Keen 1971), pero sin registro en el golfo de California. Solariella nuda Dall, 1896 (Lámina 1). La distribución geográfica señalada para esta especie es desde Columbia Britanica, Canadá, hasta la localidad tipo en las islas Revillagigedo, México, con una distribución batimétrica de 536 a 819 m (Dall 1896, Parker 1964, Keen 1971, McLean 1996). Anterior a los proyectos TALUD, no se contaba con registros en el golfo de California ni ha profundidades mayores a 820 m (Zamorano et al. 2007a). Llamo la atención que una muestra mayor a 1000 individuos fue recolectada con el trineo bentónico en la estación 25 del TALUD IV (24°52’ N y 108°58’ O), a 789 m de profundidad, bajo condiciones de hipoxia moderada (0.29 ml l-1 O2) y 9.86 % de materia orgánica en sustrato predominantemente lodoso (99.1 %) con escasa presencia de arena (0.9 %). La riqueza de especies (S = 25), la diversidad (H’ M oluscos de aguas profundas del sur del golfo de C alifornia 269 = 2.42 bits ind-1) y la abundancia (N = 1949) estimadas para los moluscos en esta estación durante el TALUD IV fueron E D las más altas registradas durante los cruceros TALUD IV-IX (Zamorano 2006), debido posiblemente a un aporte de materia orgánica que permitió la colonización del área por especies oportunistas (Zamorano et al. 2007b). En esta misma estación, también se pudo observar una extraordinaria abundancia del poliqueto Milinnampharete gracilis Hartman, 1969 (Méndez 2009). Solariella nuda se registró también en la epifauna en otros tres cruceros: en el TALUD VI con un solo ejemplar a 840 m de profundidad, 0.17 ml l-1 O2, 15.58 % de materia orgánica y sustrato lodoso con poca arena (98.2 % y 1.2 % ); en el F TALUD VII, con tres ejemplares recolectados a 865 m de profundidad, 5.9°C, G0.1 -1 ml l O2, 14.74 % de materia orgánica y un sustrato lodoso (100 %); en el TALUD VIII, con un organismo a 1100 m de profundidad, con lo que se incrementó el limite máximo de profundidad en 281 m (Zamorano et al. 2007a), en un ambiente con 3°C, 34.7 ppm, 0.39 ml l-1 O2, 7.25 % de materia orgánica en lodo con arena (88.63 % y 11.37 %). Otras especies del género Solariella registradas en aguas profundas del Pacífico mexicano son: S. ecuatorialis Dall, 1908, distribuida en aguas más profundas que S. nuda (máximo de 2086 m) (Parker 1964) y con una distribución geográfica restringida a la zona de incidencia de la corriente de California (véase Zamorano y Hendrickx 2011); S. peramabilis Carpenter, 1864, sinónimo más antiguo de S. rhyssa Dall, 1919, cuya localidad tipo es Santa Catalina, CA, y cuya distribución conocida señala a la isla Forrester, AK, como su límite norte y a las islas Revillagigedo como su límite sur, con presencia en el centro y sur del golfo de California, pero a profundidades que corresponden a la plataforma continental (50-350 m) (McLean 1996). Clase Scaphopoda Orden Dentaliida Familia Dentallidae Dentalium agassizi Pilsbry y Sharp, 1897 (Lamina 3A). De las cinco especies de escafópodos registradas en los cruceros TALUD, D. agassizi fue la más frecuente. Apareció tanto en la epifauna recolectada con el trineo bentónico como en la endofauna obtenida con la draga Karling. Las muestras recolectadas en el golfo de California fueron consideradas como un nuevo registro (Zamorano et al. 2007a), ya que previamente se conocía desde Santa Barbara, CA, hasta Panamá y las Galápagos, pero sin muestras provenientes del golfo de California (Parker 270 Biodiversidad y comunidades del talud continental del Pacífico mexicano 1964, Keen 1971). Los datos ambientales asociados a los sitios de muestreo donde apareció Dentalium agassizi se señalan y discuten en Zamorano et al. (2007a). Llama la atención su presencia en un amplio intervalo de profundidad (865-2110 m), con dominancia en la parte inferior del talud continental, a más de 1,000 m de profundidad. De igual forma, la especie se registró en un amplio intervalo de concentración de oxígeno, desde zonas cercanas a la anoxia (0.10 ml l-1) hasta 1.98 ml l-1, con una mayor concentración alrededor de los 0.50 ml l-1. En lo que se refiere a la materia orgánica, D. agassizi fue capturado en sedimento con contenido de 8.55 % y 14.74 %, tanto en lodo con arena como en arena lodosa. Durante el proyecto TALUD se recolectaron 40 ejemplares de esta especie. Otras cuatro especies de Dentalium han sido registradas en aguas profundas del Pacífico mexicano. Dentalium neohexagonum Sharp y Pilsbry, 1897, también conocida como D. pseudohexagonum Arnold, 1903, se distribuye desde Monterey, CA, hasta la isla Tiburón, Son., en el golfo de California y Guacomayo en Centroamérica; no se cuenta con información que mencione su localidad tipo. Los registros disponibles sugieren una distribución en la plataforma continental hasta los 256 m de profundidad (Keen 1971). La segunda especie es Antalis (antes Dentalium) pretiosum berryi Smith y Gordon, 1948 (Keen y Coan 1975), conocida desde Monterey, CA, hasta la isla San Esteban, Son, en el norte del golfo de California, y distribuido entre los 37 m y los 298 m de profundidad (Keen 1971). La tercera especie es D. spendidum Sowerby, 1832, conocida únicamente en su localidad tipo en el norte del golfo de California, específicamente cerca de la isla Tiburón, Son., y con una distribución batimétrica limitada a la parte superior del talud continental, entre 292 m y 320 m de profundidad (Parker 1964). La cuarta y última especie, D. vallicolens Raymond, 1904, es la que se ha registrado con mayor frecuencia en el Pacífico mexicano. Su localidad tipo es la bahía de Santa Mónica, CA, aunque su distribución geográfica va desde el estrecho de San Juan de Fuca, WA, hasta isla San Esteban, Son., en la porción norte del golfo de California. Esta especie presenta un intervalo de distribución batimétrico más amplio que las anteriores tres, desde aguas tan someras como 5 m hasta 477 m de profundidad (Parker 1964, Keen 1971, Shimek 1998). Fissidentalium megathyris (Dall, 1890). Registrada únicamente en la epifauna de una estación (23°13’ N y 107°41’ O) durante el TALUD IV, con un total de tres ejemplares. Desafortunadamente, en esta estación no fue posible obtener datos de las variables ambientales, salvo la profundidad de captura que fue de 2235 m. El nombre original de esta especie era Dentalium megathyris y su localidad tipo esta M oluscos de aguas profundas del sur del golfo de C alifornia 271 cerca de las islas Galápagos. Actualmente se conoce desde la costa de California, EE.UU., hasta Chiloé, Chile (Parker 1964, Keen 1971), por lo que se podría pensar en una distribución continua en este amplio intervalo geográfico. Sin embargo, no se cuenta con registros en el Pacífico mexicano. Su distribución batimétrica es desde los 931 m y hasta los 3001 m de profundidad, y no se conoce otra especie del mismo género para las aguas profundas mexicanas. Familia Rhabdidae Rhabdus dalli (Pilsbry y Sharp, 1897). Esta es otra especie de escafópodo abundante y frecuente en los muestreos realizados durante las campañas oceanográficas TALUD y se recolectó tanto en la endofauna como en la epifauna en el sur del golfo de California (Zamorano et al. 2007b). Para el TALUD IV se recolectó en dos estaciones con la draga Karling, con un total de cuatro ejemplares bajo condiciones de hipoxia moderada (0.51-0.79 ml l-1 O2), en un intervalo de profundidad de 1075 a 1255 m, 8.26 - 13.86 % de materia orgánica y en dos tipos de sustrato, tanto lodo con arena (99.9-0.10 %) como arena con lodo (79.4-20.6 %). Para el TALUD VI se recolectó en ambos ambientes, en cuatro estaciones con un total de cinco organismos entre 840 m y 1590 m de profundidad, 2.8°C a 5.6°C, 0.22 a 1.43 ml l-1 O2, materia orgánica desde 10.9 a 14.52 % y en sustrato predominantemente lodoso (97.3 - 99.7 %). En el TALUD VII se recolectaron dos ejemplares en la endofauna en dos estaciones, entre 1170 m y 1510 m, 3.0 a 3.6°C, 0.08 a 0.78 ml l-1 O2, materia orgánica entre 12.56 y 15.36 %; para ambas estaciones la composición del sedimento fue 100 % de lodos. Por último, en el TALUD VIII, en el suroeste del golfo de California, la especie se recolectó en la epifauna de tres estaciones, con una muestra de 31 ejemplares, registrándose los siguientes valores ambientales: 1110 a 1220 m, 3.0 a 4.0°C, 0.30 a 1.02 ml l-1 O2, con valores bajos en materia orgánica (4.66 a 7.25 %) y una composición del sustrato que va desde 88.93 a 99.26 % de lodos y de 0.72 a 11.37 % de arenas. Incluso, en una estación, el sustrato contenía una pequeña proporción de grava (1.41 %). Originalmente, la especie se nombró Fustiaria dalli con la localidad tipo desconocida. Actualmente, ha sido señalada desde el mar de Bering, AK, hasta Punta Aguja, Perú, a profundidades que cubren parte de la plataforma continental superior y una gran parte del talud continental (139-1900 m). Al igual que en los muestreos del TALUD, esta especie también ha sido ampliamente recolectada por la SIO en los cruceros que han realizado en la costa occidental de la península de Baja California y en el golfo de California (L. Lovell, com. pers.). 272 Biodiversidad y comunidades del talud continental del Pacífico mexicano En aguas profundas del Pacífico mexicano se cuenta también con un sólo registro de otra especie del mismo género, conocida como Rhabdus rectius (Carpenter, 1864) (originalmente, Dentalium rectius) y que tiene dos sinónimos: D. dalli Pilsbry y Sharp, 1897 y D. watsoni Pilsbry y Sharp, 1897. Rhabdus rectius tiene como localidad tipo Puget Sound, WA y se distribuye desde Alaska hasta Perú, sin registro en el golfo de California, desde los 35 m y hasta los 350 m de profundidad (Shimek 1998). Orden Gadilida Familia Gadilidae Cadulus californicus Pilsbry y Sharp, 1898. La distribución conocida de esta especie va desde el estrecho de Clarence, AK, hasta Manta, en Ecuador, incluyendo el sur del golfo de California. Al igual que su distribución geográfica, su distribución batimétrica es amplia y va desde los 48 y hasta los 2320 m (Parker 1964, Keen 1971). Esta especie se registró en tres estaciones dentro de la epifauna del TALUD VIII y constituye una muestra total de 13 organismos, en las aguas de la parte intermedia del talud continental (920-1220 m de profundidad), en temperaturas de 3.0 a 5.0°C, 0.20 a 1.20 ml l-1 O2, con concentraciones bajas de materia orgánica (4.66 a 7.25 %), con dominancia de lodo (71.07 a 97.87 %), presencia de arenas (0.72 a 27.76 %) y poca grava (0 a 1.41 %). Además de C. californicus, otras cuatro especies de Cadulus se encuentran en las aguas profundas del Pacífico mexicano. La menos rara, con cuatro registros, es C. austinclarki Emerson, 1951, en aguas relativamente someras (2-405 m) en todo el golfo de California (localidad tipo, bahía Santa Inés, BCS). Sus límites de distribución son, al norte, la bahía de Santa María, BCS y la isla Smith, BC., y al sur Guayaquil, Ecuador. Con dos registros en el Pacífico mexicano, C. striatus Pilsbry y Sharp, 1898 se distribuye desde Acapulco, Gro., hasta Panamá a profundidades de entre 589 y 1210 m (Keen 1971). Finalmente, con un solo registro se sabe de la presencia de C. albicomatus Dall, 1890 y de C. tolmiei Dall, 1897, la primera desde California hasta Manta, Ecuador, entre 733 y 3050 m de profundidad (Keen 1971) y la segunda desde el mar de Bering hasta el norte de Baja California, con la localidad tipo en la isla Vancouver y registrada de los 50 a los 400 m de profundidad (Shimek 1998). Gadila fusiformis (Pilsbry y Sharp, 1898). Un total de 114 ejemplares se recolectaron en la epifauna del TALUD IV. Las condiciones de captura asociadas a la estación de muestreo son los mismos abordados cuando se describe la extraordinaria abundancia de Solariella nuda párrafos arriba. Gadila fusiformis se recolectó M oluscos de aguas profundas del sur del golfo de C alifornia 273 Lámina 1. Especies representativas de moluscos de aguas profundas del Pacífico mexicano Malletia alata Bernard, 1989 Ennucula colombiana Dall, 1908 C Limatula saturna Bernanrd, 1978 Lyosiella quylei Bernanrd, 1969 Bathybembix bairdii (Dall, 1889) 274 Solariella nuda Dall, 1895 Dentalium agassizi Pilsbry y Sharp, 1897 Biodiversidad y comunidades del talud continental del Pacífico mexicano también en tres estaciones dentro de la endofauna del TALUD VII, pero con una abundancia mucho menor, de tan sólo cuatro organismos, distribuidos entre los 1,080 y 1,270 m de profundidad. En esta estación, las variables ambientales fueron como sigue: 3.7 °C en promedio; 0.18 a 0.82 ml l-1 O2; materia orgánica de 8.55 a 15.87 %; sedimentos con una dominancia de lodos (93.70 - 99.90 %), con poca arenas (0.10 - 4.6 %) y gravas. A la especie también se le conoce como Cadulus fusiformis y C. nitentior Arnold, 1903 es un sinónimo más reciente. Se distribuye en las aguas profundas del Pacífico mexicano en la costa occidental de la península de Baja California y en el norte, centro y sur del golfo de California (Parker 1964, Keen 1971), donde tiene su límite sureño de distribución geográfica. Su límite norte está en Monterey, CA. Presenta un amplio intervalo de distribución batimétrica, que va de 7 a 1936 m de profundidad. Una segunda especie del mismo género, Gadila perpusillus (Sowerby, 1832), es conocida a lo largo del Pacífico mexicano incluyendo el golfo de California. Ha sido citada como Dentalium perpusilla y Cadulus perpusillus, y C. panamensis Sharp y Pilsbry, 1898, es un sinónimo más reciente de esta especie. Se distribuye hasta los 4096 m de profundidad (SIO) pero se encuentra también en aguas someras, en la plataforma y el talud continentales y en el plano abisal (Emerson y Puffer 1957). Geográficamente su intervalo de distribución también es amplio, y se puede encontrar desde Monterey, CA., hasta Guayaquil, Ecuador, incluidos las porciones norte, centro y sur del golfo de California (Emerson y Puffer 1957). AGRADECIMIENTOS Se agradece a los miembros del equipo científico y a la tripulación del B/O “El Puma” por el apoyo proporcionado durante las campañas TALUD. El proyecto TALUD recibió el apoyo de Conacyt (proyecto 31805-N) y de la Dirección General de Apoyo al Personal Académico (DGAPA; proyecto PAPIIT IN 2173063). Se agradece el tiempo de uso de buque otorgado por la Coordinación Técnica de la Investigación Científica, UNAM. Agradecemos a E. Coan y P. V. Scott por su asistencia para identificar especies difíciles; igualmente, agradecemos a Lawrence Lovell, Colección de Invertebrados, SCRIPPS Institution of Oceanography, La Jolla, California, por haber proporcionado la base de datos para moluscos de aguas profundas y a Mercedes Cordero, ICML-Mazatlán, por facilitar información sobre la distribución de moluscos en el golfo de California. M oluscos de aguas profundas del sur del golfo de C alifornia 275 Nuestros agradecimientos a la oficina editorial de la Revista Mexicana de Biodiversidad, Instituto de Biología, UNAM, por permitirnos la reproducción de las figuras 2B, 2F, 3B y 4 de un artículo publicado por Zamorano y Hendrickx (2007a). Pablo Zamorano recibió el apoyo del Programa de Becas de Posgrado de Conacyt (clave 190220). REFERENCIAS Abbot, R. T. 1974. American Seashells. The marine Mollusca of the Atlantic and Pacific coast of North America. Van Nostrand Reinhold Co., Nueva York, 2a ed., 666 pp. Allen, J. A. 1993. A new deep-water hydrothermal species of Nuculana (Bivalvia: Protobranchia) from the Guaymas basin. Malacologia 35(1): 141-15. Álvarez-Borrego, S. y R.A. Schwartzlose. 1979. Water masses of the Gulf of California. Ciencias Marinas 6(1-2): 43-63. Amador-Buenrostro, A., A. Trasviña-Castro, A. Muhlia-Melo y M.L. Argote-Espinoza. 2003. Influence of EBES seamount and Farallon basin on coastal circulation in the Gulf of California, Mexico. Geofísica Internacional 42(3): 407-418. Baker, F. 1926. VI Expedition of the California Academy of Sciences to the Gulf of California in 1921. Mollusca of the family Triphoridae. Proceedings of the California Academy of Sciences. 4a ser. 15(6): 223-239. Baker, F., G. D. Hanna y A.M. Strong. 1928. Some Pyramidellidae from the Gulf of California. Proceedings of the California Academy of Sciences. 4a ser. 17(7): 205-246. Baker, F., G. D. Hanna y A.M. Strong. 1930. Some Mollusca of the family Epitoniidae from the Gulf of California. Proceedings of the California Academy of Sciences. 4a ser. 19(5): 41-56. Baker, F., G. D. Hanna y A.M. Strong. 1938a. Some Mollusca of the families Cerithiopsidae, Cerithiidae and Cyclostrematidae from the Gulf of California and adjacent waters. Proceedings of the California Academy of Sciences. 4a ser. 23(15): 217-244. Baker, F., G. D. Hanna y A.M. Strong. 1938b. Columbellidae from Western Mexico. Proceedings of the California Academy of Sciences. 4a ser. 23(16): 245-254. Bernard, F.R. 1976. List of bivalve mollusks from California. Unpublished manuscript, obtain from Don Cadien, 1977: 1-37. Bernard, F.R. 1983. Catalogue of the living Bivalvia of the Eastern Pacific Ocean: Bering Strait to Cape Horn. Canadian Special Publication of Fisheriesand Aquatic Sciences 61: 1-102. Brusca, R.C. y G.J. Brusca. 2002. Invertebrates. 2da ed. Sinauer Associates, Inc., E.U.A. 895 pp. 276 Biodiversidad y comunidades del talud continental del Pacífico mexicano Castro, R., A.S. Mascarenhas, R. Durazo y C.A. Collins. 2000. Seasonal variation of the temperature and salinity at the entrance to the Gulf of California, Mexico. Ciencias Marinas 26(4): 561-583. Dall, W.H., 1889 Report on the results of dredging by the U. S. Coast survey steamer “Blake”. XXIX. Report on the Mollusca, part II: Gastropoda and Scaphopoda. Bulletin of the Museum of Comparative Zoology at Harvad University 18: 1-491. Dall, W.H. 1895. Scientific results of explorations by the U.S. Fish Commission Steamer Albatross. No. XXXIV. Report on Mollusca and Brachiopoda dredged in deep water, chiefly near the Hawaiian Island, with illustrations of hitherto unfigured species from northwest America. Proceedings of the United States National Museum 17 (1032): 675-733. Dall, W.H. 1896. Diagnoses of new species of mollusks from the West Coast of America. Proceedings of the United States National Museum 18: 6-20. Dall, W.H. 1901. Synopsis of the Lucinacea and of the American species. Proceedings of the United States National Museum 23(1237): 779-833. Dall, W.H. 1913. Diagnoses of new shells from the Pacific Ocean. Proceedings of the United States National Museum 45(2002): 587-597. Dall, W.H. 1916. Diagnoses of new species of marine bivalve mollusks from the Northwest Coast of America in the collection of the United States National Museum. Proceedings of the United States National Museum 52: 393-417. Dall, W. H. 1917. Notes on the shells of the genus Epitonium and its allies of the Pacific coast of America. Proceedings of the United States National Museum 53(2217): 471-488. Dall, W.H. 1919. Descriptions of new species of mollusca from the north Pacific ocean in the collection of the United States National Museum. Proceedings of the United States National Museum 56(2295): 293-371. Dean Jr. W.E. 1974. Determination of carbonate and organic matter in calcareous sediments and sedimentary rocks by loss of ignition: comparison with other methods. Journal of Sediment and Petrology 44: 242-248. De la Lanza-Espino, G.E. 1991. Oceanografía de Mares Mexicanos. AGT ed., México. 580 pp. Demond, J. 1952. The Nassaridae of the west coast of north America between Cape San Lucas, Lower California and Cape Flattery, Washington. Pacific Science 6(4): 300317. Emerson, W.K. 1960a. Results of the Puritan-American Museum of Natural History Expedition to Western Mexico. 11. Pleistocene invertebrates from Cerralvo Island. American Museum Novitates 1995: 1-6. M oluscos de aguas profundas del sur del golfo de C alifornia 277 Emerson, W.K. 1960b. Results of the Puritan-American Museum of Natural History Expedition to Western Mexico. 12. Shell middens of San José Island. American Museum Novitates 2013: 1-9. Emerson, W.K. 1964. Results of the Puritan-American Museum of Natural History Expedition to Western Mexico. 20. The recent Mollusks: Gastropoda: Harpidae, Vasidae and Volutidae. American Museum Novitates 2202: 1-23. Emerson, W.K. y W.E. Old. 1962. Results of the Puritan-American Museum of Natural History Expedition to Western Mexico. 16. The recent mollusks: Gastropoda, Conidae. American Museum Novitates 2112: 1-44. Emerson, W.K. y W.E. Old. 1963a. Results of the Puritan-American Museum of Natural History Expedition to Western Mexico. 17. The recent mollusks: Gastropoda, Cypraeacea. American Museum Novitates 2136: 1-32. Emerson, W. K. y E. L. Puffer. 1957. Recent mollusks of the 1940 “E. W. Scripps” cruise to the Gulf of California. American Museum Novitates 1825: 1-57. Fernández-Barajas, M.A., M.A. Monreal-Gómez y A. Molina-Cruz. 1994. Thermohaline structure and geostrophic flow in the Gulf of California, during 1992. Ciencias Marinas 20(2): 267-286. Folk, R.L. 1965. Petrology of Sedimentary Rocks. Hemphills Publications Company, Austin. 184 pp. Hendrickx, M.E. Operaciones oceanográficas en aguas profundas: los retos del pasado, del presente y del proyecto TALUD en el Pacífico mexicano (1989-2009). Pp. 19-99. En: P. Zamorano, M.E. Hendrickx y M. Caso (eds.). Biodiversidad y comunidades del talud continental del Pacífico mexicano. Instituto Nacional de Ecología, Secretaría del Medio Ambiente y Recursos Naturales (Semarnat). Hendrickx, M.E. y R.C. Brusca. 2005. Cap. 15. MOLLUSCA. pp. 195-310. En: M.E. Hendrickx, y R.C. Brusca (eds.). Listado y distribución de la macrofauna del golfo de California, México. Hendrickx, M.E. y J. López. 2006. Geographic and depth distribution of Bathybembyx (Bathybembyx) bairdii (Dall, 1889) (Mollusca, Gastropoda, Trochidae) in the East Pacific. Oceánides 21(1, 2): 93-99. Hendrickx, M. E. y A. Toledano-Granados. 1994. Catálogo de moluscos Pelecypodos, Gastropodos y Poliplacóforos. Colección de referencia, Estación Mazatlán. ICML, UNAM. Comisión Nacional para el Conocimiento y Uso de la Biodiversidad e Instituto de Ciencias del Mar y Limnología, UNAM, México. 71 pp. Hertlein, L. G. y A. M. Strong. 1940. Eastern Pacific expeditions of the New York Zoological Society. Mollusks from the west coast of Mexico and central America. Zoologica, (NY) 25: 369-430. 278 Biodiversidad y comunidades del talud continental del Pacífico mexicano Keen, A.M. 1971. Sea shells of Tropical West America: Marine mollusk from Baja California to Peru. 2a edición. Stanford University Press, California. 1064 pp. Keen, M. A. y E. Coan. 1975. Sea Shell of Tropical West America: Additions and Corrections to 1975. The Western Society of Malacologists. Occasional Paper 1-66. McLean, J. H. 1996. The prosobranchia. En: Taxonomic atlas of the benthic fauna of the Santa Maria Basin and western Santa Barbara Channel. Vol. 9. The mollusca Part 2: The Gastropoda. Santa Barbara Museum of Natural History. Santa Barbara, California. Méndez, N. 2009. Distribution and extraordinary abundance of the deep-sea Melinnampharete gracilis Hartman, 1969 (Polychaeta: Ampharetidae) in the Gulf of California, Mexico. Cahiers de Biologie Marine 50: 273-276. Parker, R. H. 1964. Zoogeography and ecology of some macro-invertebrates, particularly mollusks, in the Gulf of California and the continental slope off Mexico. Videnskabelige Meddeleiser, Dansk Naturhistorisk Forening Copenhagen 126 : 1-178. Poorman, L. H. 1981. New species of Fusinus (Gastropoda: Fasciolariidae) from the Tropical Eastern Pacific. The Veliger 23(4): 339-344. SCAMITx. 2010. Mollusca, CSD. SCAMIT Newslatter 28(5, 6): 5-6. http://www.scamit.org/newsletter. Scott, P. V. y J. A. Blake (eds.). 1998. The Aplacophora, Polyplacophora, Scapghopoda and Cephalopoda. Pp. 3-47. En: Scott, P.V. y J.A. Blake (eds.). Taxonomic Atlas of the Benthic Fauna of the Santa Maria Basin and Western Santa Barbara Channel. Vol. 8, Part 1. Santa Barbara Museum of Natural History. Santa Barbara, California. 250 pp. Scott, P. H., G. Hochberg y B. Roth. 1990. Catalog of recent and fossil molluscan types in the Santa Barbara Museum of Natural History. I. Caudofoveata, Polyplacophora, Bivalvia, Scaphopoda, and Cephalopoda. The Veliger 33(1): 1-27. Scott, P. H., J. M. Blake y A. L. Lissner. 1996. Taxonomic Atlas of the Benthic Fauna of the Santa Maria Basin and Western Santa Barbara Channel. Vol. 9, Part 2. The Gastropoda. Santa Barbara Museum of Natural History. Santa Barbara, California. 228 pp. Serrano, D. 2012. La zona del mínimo oxígeno en el Pacífico mexicano. Pp. 101-115. En: P. Zamorano, M.E. Hendrickx y M. Caso (eds.). Biodiversidad y comunidades del talud continental del Pacífico mexicano. Instituto Nacional de Ecología, Secretaría del Medio Ambiente y Recursos Naturales (Semarnat). Shimek, R.L. 1998. Class Scaphopoda. En: Taxonomic atlas of the benthic fauna of the Santa Maria Basin and western Santa Barbara Channel. Vol. 8. The mollusca Part 1. The Aplacophora, Polyplacophora, Scaphopoda, Bivalvia and Cephalopoda. Scott, P. V. y J. A. Blake (eds.). Santa Barbara Museum of Natural History. Santa Barbara, California. 250 p. M oluscos de aguas profundas del sur del golfo de C alifornia 279 Skoglund, C. 1989. Additions to the Panamic province Chiton (Polyplacophora) literature-1971 trough 1988. The Festivus 21(9): 78-89. Skoglund, C. 1991a. Additions to the Panamic province Bivalve (Mollusca) literature 1971 to 1990. The Festivus 22(2): 1-63. Skoglund, C. 1991b. Small boat dredging with resulting Panamic Province mollucan range extensions. Annual Report of the Western Society of Malacologists 23: 1-21. Skoglund, C. 1992. Additions to the Panamic province Gastropod (Mollusca) literature 1971 to 1992. The Festivus 24(2): 1-169. Strickland, J.H. y T.R. Parson. 1972. The Nassaridae of the west coast of north America between Cape San Lucas, lower California and Cape Flattery, Washington. Pacific Science 6(4): 300-317. Strong, A. M. y L. G. Hertlein. 1937. The Templeton Crocker expedition of the California Academy of Sciences, 1932. No. 35. New species of recent mollusks from the coast of western north America. Proceedings of the California Academy of Science 22(6): 159-178. Strong, A.M., G.D. Hanna y L.G. Hertlein. 1933. The Templeton Crocker Expedition of the California Academy of Sciences, 1932. No. 10. Marine Mollusca from Acapulco, Mexico with notes on other species. Proceedings of the California Academy of Sciences 21(10): 117-130. Zamorano, P. 2006. Biocenosis y distribución de los moluscos asociados al talud continental del Pacífico mexicano. Tesis de maestría. Instituto de Ciencias del Mar y Limnología, UNAM. 124 pp. Zamorano, P. y M.E. Hendrickx. 2007. Biocenosis y distribución de los moluscos de aguas profundas en el Pacífico mexicano: Una evaluación de los avances. Pp 48-49. En: Estudios sobre la Malacología y Conquiliología en México. Universidad de Guadalajara, México. Zamorano, P. y M.E. Hendrickx. 2009. Análisis latitudinal y batimétrico de la comunidad de moluscos de mar profundo en el Golfo de California, México. Brenesia 71-72: 41-54. Zamorano, P. y M.E. Hendrickx. 2011. State of knowledge about the community of mollusks on both sides of the Baja California Peninsula, Mexico: A comparative analysis. Cahiers de Biologie Marine 52: 13-22. Zamorano, P. y M.E. Hendrickx. 2012. Distribution of Lucinoma heroica (Mollusca: Pelecypoda: Lucinidae) in the minimum oxygen zone in the Gulf of California, Mexico. Marine Biodiversity Records (Aceptado). Zamorano, P. , M.E. Hendrickx y A. Toledano-Granados. 2007a. New geographic and depth records for deep-water mollusks in the Gulf of California, Mexico. Revista Mexicana de Biodiversidad 78: 311-318. 280 Biodiversidad y comunidades del talud continental del Pacífico mexicano Zamorano, P., M.E. Hendrickx y A. Toledano-Granados. 2007b. Distribution and ecology of deep water mollusks from the continental slope, southeastern Gulf of California, Mexico. Marine Biology 150(5): 883-892. M oluscos de aguas profundas del sur del golfo de C alifornia 281 Crustáceos decápodos (Arthropoda: Crustacea: Decapoda) de aguas profundas del Pacífico mexicano: lista de especies y material recolectado durante el proyecto TALUD Michel E. Hendrickx1 Introducción Los crustáceos decápodos son organismos omnipresentes en los mares y océanos de la Tierra y han sido encontrados desde la zona intermareal hasta las profundidades abisales. Contienen los muy conocidos cangrejos, los camarones, los langostinos y las langostas. Algunas especies son particularmente llamativas por su forma y sus colores. El grupo de los crustáceos decápodos corresponde a una orden dentro del filo de los Arthropoda (Subfilo Crustacea: Orden Decapoda). Se caracteriza por tener un caparazón generalmente bien calcificado y (salvo algunas excepciones) 10 pares de “patas” (o pereiópodos) que sirven como apéndices prensiles o para desplazarse. Contiene unas 18000 especies y está formado por dos subórdenes y 10 infraordenes. El primer suborden, los Dendrobranchiata, corresponde, entre otras especies, a los camarones clásicos (e.g., los Penaeidae que se pescan en las costas de México). Los Pleocyemata, el segundo suborden de decápodos, contiene todas las demás especies de camarones, langostinos, langostas y cangrejos repartidas entre 10 infraordenes (Stenopodidea, Caridea, Astacidea, Glypheidea, Axiidea, Laboratorio de Invertebrados Bentónicos, Instituto de Ciencias del Mar y Limnología, Unidad Académica Mazatlán, Universidad Nacional Autónoma de México, Joel Montes Camarena s/n, Mazatlán 82040, Sinaloa, México. Correo-e: [email protected]. 1 283 Gebiidea, Achelata, Polychelida, Anomura y Brachyura) (De Grave et al. 2009). De estos, ocho tienen representantes en aguas profundas (Martin y Davis 2001, Brusca y Brusca 2002). Los Glypheidae, con solamente dos especies vivas, no tienen representantes en aguas profundas. Los Gebiidea, que incluyen solamente algunas especies en el Pacifico este (e.g., Naushonia panamensis Martin y Abele, 1982), tampoco han sido encontradas en profundidades mayores. Al igual que en el caso de la mayoría de los grupos de invertebrados, los primeros crustáceos decápodos de aguas profundas recolectados en el Pacífico americano fueron obtenidos por los buques de investigación “Challenger” y “Albatross” en el siglo XIX. Las contribuciones más significativas al respecto fueron los trabajos de Faxon (1893, 1895, 1896) (véase Hendrickx, 2012a). Hasta recientemente no ha existido un estudio sistemático de la fauna de crustáceos decápodos de aguas profundas en el Pacífico mexicano, y las capturas de especímenes han sido incidentales en muestreos muy dispersos en la región (Hendrickx 2001, Hendrickx 2012a). Sin embargo, algunas contribuciones relativamente recientes son de interés para el área ya que proporcionan datos acerca de la presencia de crustáceos decápodos en aguas profundas del Pacífico mexicano. Newman (1985), por ejemplo, presenta una lista de invertebrados (incluyendo crustáceos decápodos) asociados con las fuentes hidrotermales del Pacífico este y Wicksten (1989) elaboró una lista de 185 especies de crustáceos decápodos conocidas en aguas con profundidades mayores a los 50 m en el Pacífico este, desde Alaska hasta Chile. Por su parte, Escobar-Brionés y Soto (1993) revisaron la información relacionada con la fauna de crustáceos decápodos de aguas profundas del Pacifico mexicano y citan solamente cinco especies. Hendrickx (1993) presentó un listado de todas las especies de crustáceos decápodos conocidos para el Pacífico de México, con 720 especies, incluyendo aquellas de aguas profundas. Entre las especies de crustáceos decápodos de aguas profundas se encuentran aquellas asociadas con las ventilas hidrotermales y las filtraciones frías (“cold seeps”; salinas o de hidrocarburos). Martin y Haney (2005) revisaron todos los registros de esta fauna a nivel mundial, incluyéndolos en un listado de unas 115 especies distintas de las cuales solamente nueve tienen registros en las aguas del Pacífico mexicano. Otras contribuciones importantes para determinar la presencia de especies de crustáceos decápodos en aguas mexicanas son las listas de Galatheoidea elaboradas a nivel mundial (Baba et al. 2008) o regional (Baba 2005, Navas et al. 2003), de Brachyura (Ng et al. 2008) y de Caridea (De Grave y Fransen 2011) a nivel mundial, y algunos listados de la fauna de crustáceos decápodos del Pacífico 284 Biodiversidad y comunidades del talud continental del Pacífico mexicano mexicano publicadas entre 1995 y 2003 (Hendrickx 1995a, 1995b, Hendrickx y Harvey 1999, Wicksten y Hendrickx 2003). En México, los avances recientes en el estudio de la fauna de aguas profundas han sido particularmente significativos en el golfo de California basándose en el material recolectado durante el proyecto TALUD, entre 1989 y 2009. Hasta la fecha, como parte de los resultados de este proyecto, se han descrito dos especies nuevas de crustáceos decápodos (Hendrickx 2002a, 2010) y otras de diferentes grupos de invertebrados (véase Hendrickx 2012a). En esta contribución se presenta una breve síntesis de lo que se conoce acerca de las especies de crustáceos decápodos de aguas profundas (≥ 350 m) del Pacífico mexicano y una lista actualizada de las mismas, basados en los muestreos del proyecto TALUD y en la literatura disponible, general y particular, para cada grupo específico. Material y métodos Sobre la base de una revisión exhaustiva de la literatura existente y de las muestras obtenidas durante el proyecto TALUD, se elaboró la lista de especies de crustáceos decápodos de aguas profundas (≥ 350 m) conocidas para el Pacífico de México. El material nuevo fue obtenido en el golfo de California y frente a la costa SO del Pacífico de México. Todos los especímenes fueron recolectados por el B/O “El Puma” de la Universidad Nacional Autónoma de México, con un trineo bentónico con boca de 0.9 m de anchura por 2.95 m de altura equipado de una malla tipo camaronera de 5.5 cm de apertura doblada de una red interna con malla más fina (ca 2.5 cm), salvo en el TALUD III donde se utilizó una draga de arrastre tipo “Agassiz” de 1.0 m de altura por 2.5 m de anchura, con una malla similar (véase Hendrickx, 2012a). Los especímenes recolectados fueron conservados en formaldehído al 10 % (transferidos posteriormente a etanol) o directamente en etanol al 70 %. El material recolectado durante este proyecto ha sido depositado en la Colección Regional de Invertebrados Marinos (EMU) del Laboratorio de Invertebrados Bentónicos de la Unidad Académica Mazatlán, ICML, UNAM. C rustáceos decápodos (A rthropoda : C rustacea : D ecapoda ) de aguas profundas 285 Resultados Riqueza en especies en el Pacífico de México Según los registros encontrados en la literatura y el material obtenido durante las campañas TALUD, hay 85 especies de crustáceos decápodos de aguas profundas (≥ 350 m) registradas en el Pacífico mexicano (Anexo 1). Estas especies pertenecen a los dos subórdenes de Decapoda de acuerdo a lo siguiente: Dendobranchiata, cuatro especies (4.7 %); Pleocyemata, 81 especies (94.3 %). Los Pleocyemata se reparten, a su vez, entre siete infraórdenes: los Stenopodidea (una especie; 1.2 %), los Caridea (31 especies; 36.5 %), los Axiidea (dos especies; 2.4 %), los Polychelida (dos especies; 2.4 %), los Astacidea (una especie; 1.2 %), los Anomura (33 especies; 38.8 %) y los Brachyura (11 especies; 12.9 %) (Fig. 1). Suborden Dendrobranchiata Contiene unas 533 especies descritas (De Grave y Fransen 2011). Los camarones que pertenecen a esta orden de crustáceos decápodos contienen, entre otras especies, los conocidos Penaeidae que forman el bulto de la producción pesquera en México y que son también sujetos a cultivo (e.g., Farfantepenaeus califorFigura 1. Representación en porcientos entre las categorías superiores (subordenes e infraordenes) de las 85 especies de crustáceos decápodos de aguas profundas (≥ 350 m) registradas en el Pacífico mexicano. 286 Biodiversidad y comunidades del talud continental del Pacífico mexicano niensis (Holmes, 1900) (Hendrickx 1996a). En las aguas profundas del Pacífico mexicano solo se han registrado cuatro especies asociadas con el bentos (Anexo 1). El registro de Sicyonia disedwardsi (Burkenroad, 1934) (Fig. 2 A) en aguas muy profundas (ca 850-880 m) (Hendrickx 2002b) es una aparente anomalía comparado con su distribución general en la región (entre 10 y 229 m) y en el Pacífico mexicano (hasta 127 m) (Hendrickx 1996a). El género Benthesicymus (Fig. 2 B) está representado en el Pacífico este tropical por dos especies, las mismas que han sido registradas en el Pacífico mexicano (Hendrickx 1996a; Wicksten y Hendrickx 2003). De éstas, solo una ha sido recolectada durante las campañas TALUD (Anexo 1). Por su parte, Hymenopenaeus (Fig. 2 C) también cuenta con dos especies con afinidad bentónica en el Pacífico este tropical (Wicksten y Hendrickx 2003); sin embargo, solo una tiene registros en México y ha sido recolectada durante el proyecto TALUD (Anexo 1). Suborden Pleocyemata Infraorden Stenopodidea Los estenopodídeos son un pequeño grupo de crustáceos decápodos (58 especies conocidas; De Grave y Fransen 2011) afines a los camarones. Cuenta con dos familias y solamente nueve géneros (Hendrickx 2002a). Algunas especies son asociadas a los bancos de corales y presentan colores muy llamativos. La familia Stenopodidae cuenta con tres representantes en el Pacífico americano y solo dos en el Pacífico mexicano, ambas del género Odontozona: O. rubra Wicksten, 1982 (de aguas someras) y O. foresti Hendrickx, 2002 (Fig. 2 D) (Anexo 1), una de las dos nuevas especies de crustáceos decápodos encontradas durante el proyecto TALUD, recolectada entre 1058 y 1088 m de profundidad. Infraorden Caridea Uno de los grupos mejor representados en aguas profundas del Pacífico mexicano, los camarones carideos (3428 especies conocidas; De Grave y Fransen 2011) se diferencian de los camarones Dendrobranchiata esencialmente por presentar la porción lateral del segundo segmento (o somito) abdominal que se encima tanto sobre la porción posterior del primero como sobre la porción anterior del tercero. Además, las hembras cargan los huevecillos hasta su eclosión, mientras en el caso C rustáceos decápodos (A rthropoda : C rustacea : D ecapoda ) de aguas profundas 287 Fidura 2. A. Sicyonia disedwardsi (Burkenroad, 1934); B. Benthesicymus tanneri Faxon, 1893; C. Hymenopenaeus doris (Faxon, 1893); D. Odontozona foresti Hendrickx, 2002; E. Acanthephyra brevicarinata Hanamura, 1983; F. Pasiphaea magna Faxon, 1893; G. Nematocarcinus agassizii Faxon, 1893; H. Bathystylodactylus echinus Wicksten y Martin, 2004. A, tomado de Hendrickx (1996a); B, C, G, tomados de Hendrickx (1995d); D, tomado de Hendrickx (2002a); E, F, tomados de Hendrickx y Estrada-Navarrete (1996); H, tomado de Wicksten y Martin (2004). 288 A B C D E F G H Biodiversidad y comunidades del talud continental del Pacífico mexicano de los camarones Dendrobranchiata los huevos son liberados directamente en el ambiente pelágico (Hendrickx 1996a). Los carideos de aguas profundas incluyen tanto especies bentónicas como especies pelágicas y batipelágicas (es decir que viven cerca del fondo pero pueden alejarse de éste nadando de manera vigorosa). En las aguas profundas del Pacífico mexicano, los Caridea representan más del 36 % de las especies de crustáceos decápodos conocidos (Anexo 1). De allí su notable importancia como componente en las comunidades de invertebrados y en las cadenas tróficas de los ecosistemas profundos. El género Acanthephyra (Oplophoridae) (Fig. 2 E) está representado en el Pacífico mexicano por cinco especies (Hendrickx y Estrada-Navarrete 1996), de las cuales dos pueden ser consideradas como bentopelágicas; ambas fueron capturadas durante el proyecto TALUD. En el caso de los Pasiphaeidae, cuatro especies parecen tener un comportamiento más bien ligado con el bentos; son especies grandes y relativamente pesadas (caparazón bien calcificado), características que no favorecen la vida en la columna de agua. El género Pasiphaea (Fig. 2 F), por su parte, contiene seis especies que han sido registradas en el Pacífico mexicano. Pasiphaea magna Faxon, 1893 es una especie muy grande (hasta 19 cm de longitud total) y robusta, que no parece ser apta para el nado sostenido en la columna de agua. La otra especie, P. emarginata Rathbun, 1902, podría tener un comportamiento batipelágico pero se tiene poca información al respecto. Ambas fueron recolectadas durante las campañas TALUD (Anexo 1). Los Nematocarcinidae solo contienen un género, Nematocarcinus (Fig. 2 G), con 48 especies distribuidas en todos los océanos del mundo (Burukovsky 2003, De Grave y Fransen 2011). Especímenes de este género han sido recolectados abundantemente en los muestreos de aguas profundas realizados con equipos de arrastre bentónicos frente a las costas de México durante el proyecto TALUD. En cambio, no han sido encontrados frecuentemente en redes pelágicas (véase Hendrickx y Estrada-Navarrete 1996). Sobre la base de la revisión de Burukovsky (2003), existen tres especies con distribución en el Pacífico mexicano, de las cuales solo una (Anexo 1) ha sido reconocida hasta la fecha en las muestras revisadas. Para la familia Stylodactylidae, solo se cuenta con el registro de Bathystylodactylus echinus Wicksten y Martin, 2004 (Fig. 2 H; Anexo 1) en el Pacífico este; esta especie fue descrita hace apenas unos años y fue encontrada frente a bahía Magdalena, en la costa oeste de Baja California, a más de 3500 m de profundidad (Wicksten y Martin 2004). No ha sido encontrada nuevamente desde su descripción. C rustáceos decápodos (A rthropoda : C rustacea : D ecapoda ) de aguas profundas 289 La familia Hippolytidae es sumamente diversificada. Contiene en su mayoría especies asociadas con las pozas de mareas, los arrecifes y, en general, las aguas someras. Sin embargo, el género Lebbeus (Fig. 3 A) está particularmente bien representado en aguas profundas y contiene 53 especies (De Grave y Fransen 2011). Tres especies han sido registradas para el Pacífico mexicano, pero solo una ha sido recolectada durante el proyecto TALUD (Anexo 1) y este hallazgo representó un primer registro de esta especie para México (Hendrickx 1996b). Hay 33 especies reconocidas del género Heptacarpus (Fig. 3 B), muchas previamente incluidas en los géneros Hippolyte o Spirontocaris (De Grave y Fransen 2011). De las seis especies con registros en México (Hendrickx 1993) (Nota: Hippolyte picta Stimpson, 1871, es ahora reconocida como un sinónimo de Hippolyte sitchensis Brandt, 1851; ambas han sido transferidas al género Heptacarpus; véase De Grave y Fransen 2011), solo una (H. yaldwyni Wicksten, 1984) ha sido encontrada en aguas con profundidades ≥350 m (Anexo 1). Hasta la fecha, se conocen 21 especies de Spirontocaris (Fig. 3 C) (De Grave y Fransen 2011) y cuatro de éstas han sido encontrada en el Pacífico mexicano (Hendrickx 1993), con sola una (S. sica Rathbun, 1902) conocida en aguas profundas (Anexo 1). Con una importancia comercial considerable a nivel mundial, los Pandalidae contienen especies que pueden alcanzar una talla considerable, hasta más de 25 cm de longitud total en el caso de Pandalus platyceros Brandt, 1851 (Holthuis 1980). Los géneros Pandalus (20 especies conocidas) (Fig. 3 D) y Heterocarpus (29 especies conocidas) (Fig. 3 E) (De Grave y Fransen 2011) son particularmente importantes para las pesquerías debido a su abundancia y alto valor en el mercado (Hendrickx y Wicksten 1989). Incluso en México representan un potencial pesquero importante (Hendrickx 2003a, Flores et al. 2004). En total, ocho especies de Pandalidae bentónicos o bentopelágicos han sido registradas en las aguas del Pacífico mexicano (Anexo 1). Las dos especies de Heterocarpus así como la única especie de Pandalopsis (Fig. 3 F) registradas en la región han sido recolectadas durante el proyecto TALUD. Pantomus affinis (Chace, 1937) (Fig. 3 G) ha sido encontrada en otros cruceros pero no en las campañas TALUD. De igual manera, las cuatro especies de Plesionika (Fig. 3 H) con registros en profundidades ≥350 m, han sido recolectadas en otras campañas por el Laboratorio de Invertebrados Bentónicos (Hendrickx y Wicksten 1989) (Anexo 1). Los Crangonidae incluyen en su mayoría especies asociadas con la plataforma continental. Esta familia está particularmente bien representada en la zona de influencia de la corriente de California (Wicksten 1980) y en latitudes más altas en 290 Biodiversidad y comunidades del talud continental del Pacífico mexicano Figura 3. A. Lebbeus scrippsi Wicksten y Méndez, 1982; B. Heptacarpus yaldwynae Wicksten, 1984; C. Spirontocaris spinus (Sowerby, 1805); D. Pandalus platyceros Brandt, 1851; E. Heterocarpus vicarius Faxon, 1893; F. Pandalopsis ampla Spencer Bate, 1888; G. Pantomus affinis Chace, 1937; H. Plesionika mexicana Chace, 1937. A, tomado de Wicksten y Méndez (1982); B, tomado de Wicksten (1984); C, tomado de Holthuis (1993); E-H, tomado de Hendrickx (1995d). A B C D E F G C rustáceos H decápodos (A rthropoda : C rustacea : D ecapoda ) de aguas profundas 291 el Pacífico noreste (Austin 1985). En el Pacífico mexicano se encuentran cinco especies asociadas con profundidades ≥350 m y de éstas se recolectaron cuatro (Anexo 1). El género Argis (Fig. 4 A) contiene 10 especies a nivel mundial (De Grave y Fransen 2011), la mayoría en aguas someras. En cambio, los géneros Metacrangon (Fig. 4 B) (28 especies conocidas), Paracrangon (Fig. 4 C; siete especies conocidas), Parapontophilus (Fig. 4 D; 18 especies conocidas) y Sclerocrangon (Fig. 4 E) (ocho especies conocidas) (De Grave y Fransen 2011) son típicamente asociadas con aguas profundas. En el Pacífico de México solo se ha registrado una especie para cada uno de estos últimos cuatro géneros y todas han sido capturadas durante las campañas TALUD (Anexo 1). Información adicional sobre este grupo y su distribución en las aguas del Pacífico mexicano está incluida en otro capítulo de esta obra (véase Hendrickx 2012b). La familia Glyphocrangonidae, afín a los Crangonidae pero con un aspecto general muy distinto, contiene un solo género, Glyphocrangon (Fig. 4 F), con un total de 87 especies conocidas (De Grave y Fransen 2011). A nivel mundial, el género está asociado típicamente con aguas profundas (Komai 2006). En el Pacífico mexicano solo se conoce la presencia de cuatro especies de las cuales tres han sido recolectadas en las campañas TALUD (Anexo 1). Una de estas fue descubierta durante estas campañas y fue descrita recientemente por Hendrickx (2010). Información adicional sobre este grupo y su distribución en las aguas del Pacífico mexicano está incluida en otro capitulo de esta obra (véase Hendrickx 2012b). Infraorden Axiidea El grupo de los “Thalassinidea” (sensu Martin y Davis 2001) ha sido suprimido y sustituido por dos infraordenes: Axiidea y Gebiidea (De Grave et al. 2009) (ca 660-670 especies descritas; Gary Poore y Peter Dworschak, com. pers., marzo 2011). De acuerdo con los comentarios de Darryl Felder (com. pers., marzo 2011), lo que previamente se consideraban como sinapomorfías morfológicas que unían los “Thalassinidea” en un solo grupo, son ahora consideradas como convergencias causadas por adaptaciones a un mismo hábitat: las madrigueras. La división en dos infraordenes, los Gebiidea y los Axiidea, está fuertemente apoyada por consideraciones morfológicas (tanto en adultos como en larvas) y por análisis genéticos. Conocidos como los camarones fantasmas o las langostas de fango, los Gebiidea y los Axiidea son típicamente asociados con los sustratos blandos donde excavan 292 Biodiversidad y comunidades del talud continental del Pacífico mexicano Figura 4. A. Argis californiensis (Rathbun, 1902); B. Metacrangon procax (Faxon, 1893); C. Paracrangon areolata Faxon, 1893; D. Parapontophilus occidentalis (Faxon, 1893); E. Sclerocrangon atrox Faxon, 1893; F. Glyphocrangon taludensis Hendrickx, 2010; G. Calocarides quinqueseriatus (Rathbun, 1902); H. Callianopsis goniophthalma (Rathbun, 1902). A, tomado de Word y Charwart (1974); B, C, E, tomado de Hendrickx (1995d); D, tomado de Faxon (1895); F, tomado de Hendrickx (2010); G, tomado de Hendrickx (1995e); H, tomado de Schmitt (1921). A B C D E F G H C rustáceos decápodos (A rthropoda : C rustacea : D ecapoda ) de aguas profundas 293 madrigueras a veces muy profundas y ramificadas. Algunas especies se encuentran también en fondos mixtos. La taxonomía del grupo es muy compleja y sujeta a controversias (Robles et al. 2009). Debido al hecho de que viven enterradas en el lodo, son difíciles de recolectar y, por lo general, escapan a los arrastres tradicionales. Basándose en la riqueza en especies registrada para este grupo en otras áreas del mundo, es casi seguro que existen muchas más especies por descubrir en el Pacífico mexicano. Se sabe que su distribución batimétrica se extiende hasta >2000 m (Robles et al. 2009), pero no hay mucha información acerca de la presencia de especies de este grupo en aguas más allá del talud continental. En el Pacífico mexicano, hasta la fecha solo se tiene un registro confirmado en el caso de dos especies (Anexo 1), cada una perteneciendo a un género y una familia diferentes. Dentro de la familia Axiidea, se cuenta con una sola especie de aguas profundas registrada para el Pacífico de México, Calocarides quinqueseriatus (Rathbun, 1902) (Fig. 4 G), y esta especie ha sido recolectada en cuatro ocasiones durante las campañas TALUD (Hendrickx 1996b, 2008a). La otra familia con registro en el Pacífico mexicano, Callianopsidae, a la fecha solo contiene una especie de aguas profundas conocida en nuestra región, Callianopsis goniophthalma (Rathbun, 1902) (Fig. 4 H), cuyo tamaño es relativamente grande (más de 9 cm de longitud total); es una especie ciega (los ojos están desprovistos de pigmentos), con muy pocos registros conocidos en el mundo. El material recolectado durante el proyecto TALUD representó el primer registro de esta especie para México (Hendrickx 1996b). Infraorden Polychelida El infraoden de los “Palinura” (sensu Martin y Davis 2001) ha sido suprimido y sustituido por dos infraordenes (De Grave et al. 2009; Chan 2010). Con 38 especies descritas (Chan 2010), los Polychelida contienen las poco conocidas langostas de profundidad. Contrariamente a las langostas espinosas (Infraorden Achelata), un grupo de crustáceos decápodos que posee una importancia comercial considerable en México por su alto precio en el mercado, las “langostas” de profundidad no son explotadas. Difieren notablemente en su morfología de las langostas espinosas. Por lo general, carecen de los llamativos colores de estas últimas, son más pequeñas, poseen un cuerpo deprimido dorsoventralmente y menos calcificado, y las pinzas son muy delgadas. Las langostas de profundidad pertenecen a la familia Polychelidae (la única familia en los Polychelida), la cual fue revisada integralmente por Galil (2000), 294 Biodiversidad y comunidades del talud continental del Pacífico mexicano En unos trabajos recientes, Ahyong (2009) y Chan (2010) proporcionan información adicional acerca de la filogenia del grupo. Según este último autor, los Polychelidae cuentan con 38 especies validas; para el Pacífico mexicano, solo se cuenta con registros de dos especies (véase Hendrickx 2012c), uno del género Stereomastis (Fig. 5 A) y otro del género Willemoesia (Fig. 5 B) (Anexo 1). Solo la primera fue recolectada durante las campañas TALUD. Infraorden Astacidea Los Astacidea contienen en su mayoría especies de aguas dulces (ríos y lagos), conocidas como “crayfish” o acociles. Dentro del grupo de los Astacidea, una familia (Nephropidae) se caracteriza por su hábitat marino. A nivel mundial se cuenta con unas 50 especies de Nephropidae de importancia comercial real o potencial, incluyendo los famosos bogavantes del género Homarus y la cigala, Nephrops norvegicus (Linnaeus, 1758), que sostiene una importante pesquería en las aguas del Atlántico noreste y en el mar Mediterráneo (Holthuis 1991). Una sola especie de esta familia, Nephropsis occidentalis Faxon, 1893 (Fig. 5 C), ha sido registrada para el Pacífico este tropical. En las muestras recolectadas durante el proyecto TALUD apareció en muchas ocasiones, por lo que es considerada ocasionalmente abundante frente a las costas de México (Hendrickx 2003b). Infraorden Anomura Los Anomura (ca 2540 especies descritas) (Baba et al. 2008; Boyko y McLaughlin 2010, McLaughlin et al. 2010a, 2010b, Osawa y McLaughlin 2010) contienen especies con una morfología muy distinta, desde los conocidos cangrejos ermitaños que se refugian en un habitáculo (generalmente la concha vacía de un gasterópodo o caracol) hasta las pequeñas langostas de río de la familia Aeglidae, los únicos anomuros exclusivamente encontrados en agua dulce (Schmitt 1942). Los Anomura es también el grupo a los cuales pertenecen los Lithodidae, una familia muy común en aguas profundas de la región circuntropical y en aguas de la plataforma continental en latitudes más elevadas. Los Lithodidae incluyen, por ejemplo, los conocidos “king crabs” de Alaska, un recurso pesquero muy importante en el Pacífico noreste (Otto y Jamieson 2003), y las “centollas” de Chile (Retamal 1981). En las aguas profundas del Pacífico mexicano, los Anomura representan casi 39 % de las especies de crustáceos decápodos conocidos (Anexo 1). De allí su C rustáceos decápodos (A rthropoda : C rustacea : D ecapoda ) de aguas profundas 295 Figura 5. A. Stereomastis pacifica (Faxon, 1893); B. Willemoesia inornata Faxon, 1893; C. Nephropsis occidentalis Faxon, 1893; D. Glyptolithodes cristatipes (Faxon, 1893); E. Lithodes murrayi Henderson, 1888; F. Neolithodes agassizii (Smith, 1882); G. Paralithodes rathbuni (Benedict, 1894); H. Paralomis papillata (Benedict, 1895). A, B, tomados de Faxon (1895); C, tomado de Hendrickx (1995e). D, tomado de Haig (1974); E, tomado de Retamal (1981); F, tomado de MacPherson (1988); G, tomado de Schmitt (1921); H, tomado de Haig (1974). 296 A B C D E F G H Biodiversidad y comunidades del talud continental del Pacífico mexicano notable importancia como componente en las comunidades y en las cadenas tróficas. Como grupo, los Lithodidae contienen 129 especies a nivel mundial (Mclaughlin et al. 2010b), mientras que en aguas profundas mexicanas se conocen siete especies, repartidas entre cinco géneros (Fig. 5 D-H) y cuyos registros corresponden, en su mayoría, a la zona de influencia de la corriente de California donde especies típicas de las aguas de California y de Oregon extienden su distribución (Hendrickx 1993). De estas siete especies, solo una, Neolithodes diomedeae (Benedict, 1894), ha sido recolectada durante las campañas TALUD. El grupo de los Galatheoidea s.l. es muy complejo y ha sido sujeto de varios análisis filogenéticos en los últimos años (véase Ahyong et al. 2010). Hasta recientemente, esta superfamilia estaba compuesta de cuatro familias (Martin y Davis 2001), pero en la actualidad los “Galatheoidea” s.l. han sido divididos y se consideran tres superfamilias validas (i.e., Galatheoidea, Chirostyloidea y Kiwaoidea; Ahyong et al. 2010) cuyas relaciones con los demás grupos de Anomura son todavía tema de controversias (véase Baba et al. 2008). Según Baba et al. (2008), los Chyrostylidae incluyen 192 especies a nivel mundial, pero de acuerdo con De Grave et al. (2009) ya son 204 especies, exclusivamente recolectadas en aguas profundas. En el Pacífico mexicano solo se conoce la presencia de dos especies: Gastroptychus iaspis Baba y Haig, 1990 (Fig. 6 A) es conocida del área del monte submarino Jasper, frente a la costa oeste de Baja California (Baba et al. 2008), mientras que Uroptychus pubescens Faxon, 1893 (Fig. 6 B) fue señalada recientemente por primera vez en aguas mexicanas sobre la base de material recolectado durante el proyecto TALUD (Hendrickx y Ayón-Parente 2011) (Anexo 1). Los Galatheidae (sensu Ahyong et al. 2010) contienen un total de 11 géneros y 87 especies a nivel mundial (Baba et al. 2008; MacPherson y Cleva 2010). Solamente una especie, Janetogalathea californiensis (Benedict, 1902) (Fig. 6 C), la única conocida dentro de este género, posee registros en el Pacífico mexicano y ha sido escasamente recolectada en el golfo de California. Parece ser más característica de la región que se encuentra bajo la influencia de la corriente de California (Hendrickx et al. 2011), aunque un mayor esfuerzo de captura en la zona del golfo de California donde se encuentra registrada podría demostrar que también es abundante allí. De acuerdo con la reclasificación de Ahyong et al. (2010), la familia Munididae posee 356 especies a nivel mundial (Baba et al. 2008) y es una de las más ricas en C rustáceos decápodos (A rthropoda : C rustacea : D ecapoda ) de aguas profundas 297 Figura 6. A. Gastroptychus iaspis Baba y Haig, 1990; B, Uropthychus pubescens Faxon, 1893; C. Janetogalathea californiensis (Benedict, 1902); D, Munida quadrispina Benedict, 1902; E. Munidopsis verrillii Benedict, 1902; F. Galacantha diomedeae (Faxon, 1895); G. Parapagurus foraminosus Lemaitre, 1999; H. Moloha faxoni (Schmitt, 1921). A, tomado de Baba y Haig (1990); B, F tomado de Faxon (1895); C-E, tomados de Schmitt (1921); G, tomado de Lemaitre (1999); H, tomado de Hendrickx (1997). 298 A B C D E F G H Biodiversidad y comunidades del talud continental del Pacífico mexicano especies dentro de los Anomura. De estas 356 especies, el género Munida corresponde a casi el 68 %. Cuatro especies han sido registradas en el Pacífico mexicano por debajo de los 350 m de profundidad, todas del género Munida (Anexo 1). El género Munida (Fig. 6 D) tiende a estar presente en aguas mucho más someras que Munidopsis. Debido a la presencia de una amplia área bajo la influencia de la Zona del Mínimo de Oxígeno (ZMO) frente a las costas de México, las especies de Munida poseen por lo general una distribución batimétrica más somera que en otras partes de la región del Pacífico americano. Frente a México, las especies de este género generalmente han sido encontradas en la plataforma continental (Hendrickx 2000, 2003c). En el caso de Munida bapensis Hendrickx, 2000, una especie considerada hasta la fecha endémica al golfo de California, ha sido encontrada en profundidades de entre 587 y 633 m (Hendrickx 2008b). Un caso particular es aquel de Munida perlata Benedict, 1902, citada para el sur del golfo de California entre 1920 y 3292 m por Luke (1977) sobre la base de especímenes capturados en una red de media agua tipo Isaac Kidds. Sin embargo, esta especie no ha aparecido en ninguno de los arrastres bentónicos del proyecto TALUD y este registro se considera dudoso. La familia de los Munidopsidae (234 especies conocidas, Ahyong et al. 2010) contiene solamente tres géneros, de los cuales Munidopsis es el más diversificado con 224 especies (ca 96 %). Hay 17 especies de esta familia registradas en aguas profundas del Pacífico mexicano (Anexo 1), 15 del género Munidopsis (Fig. 6 E) y dos del género Galacantha (Fig. 6 F). Sin lugar a dudas, las especies de Munidopsis corresponden a uno de los grupo de crustáceos decápodos de aguas profundas más característicos a nivel mundial. A menudo, se ha observado que estas especies dominan las comunidades del talud continental (Hendrickx 2003d). De las 17 especies registradas, se recolectaron ocho durante las campañas TALUD (Anexo 1). Los Parapaguridae contienen los cangrejos ermitaños asociados con las grandes profundidades. Lemaitre (1999) revisó el género Parapagurus de manera exhaustiva y consideró un total de 14 especies válidas, de las cuales siete eran nuevas. Según McLaughlin et al. (2010b), en la actualidad se reconocen 17 especies de Parapagurus y dos de estas se encuentran en aguas del Pacífico mexicano, incluyendo Parapagurus foraminosus Lemaitre, 1999 (Fig. 6 G) que fue recolectada durante el proyecto TALUD (Anexo 1) (Hendrickx y Ayón-Parente 2009). C rustáceos decápodos (A rthropoda : C rustacea : D ecapoda ) de aguas profundas 299 Infraorden Brachyura Este grupo (conocido como los cangrejos verdaderos) contiene unas 6800 especies (Ng et al. 2008). A pesar de pertenecer a cinco familias distintas, son pocas las especies de Brachyura conocidas en las aguas profundas del Pacífico mexicano y se tiene el registro de solamente ocho, la mitad de las cuales pertenecen a la familia Ethusidae (Anexo 1). Entre los Homolidae solo se conoce una especie en el área, perteneciente al género Moloha (Fig. 6 H), con una distribución limitada a la zona de influencia de la corriente de California. En México, el Calappidae Platymera gaudichaudii H. Milne Edwards, 1937 (Fig. 7 A) ha sido encontrado esencialmente en la plataforma continental, pero es una especie que alcanza profundidades de hasta 400 m en la porción más sureña de su intervalo de distribución (Hendrickx 1995c). La familia Atelecyclidae tiene solo dos representantes conocidas en el Pacífico mexicano y uno de éstos, Trichopeltarion corallinum (Faxon, 1893) (Fig. 7 B) es típico de las aguas profundas y ha sido recolectado durante las campañas TALUD (Anexo 1). Hay muchas especies del genero Cancer (Fig. 7 C) distribuidas a lo largo de las costas del Pacífico americano (Wicksten 1980, Austin 1985, Hendrickx 1995c), pero la enorme mayoría de éstas presentan una afinidad con aguas templadas y generalmente menos profundas. Por ejemplo, frente a California, se registran ocho especies en aguas de la plataforma continental (Wicksten 1980), raramente en aguas muy profundas. De igual manera, se conoce la presencia de ocho especies de Cancer frente a las costas del Pacífico mexicano (Hendrickx 1993), pero solamente una especie, C. johngarthi Carvacho, 1989, ha sido encontrada en profundidades ≥ 350 m y apareció ocasionalmente en muestras de varias campañas del proyecto TALUD (Hendrickx 2001, Hendrickx datos no publicados). Al igual que la familia Alvinocarididae (camarones Caridea), la familia Bythograeidae es típica de las ventilas hidrotermales. De las seis especies conocidas dentro del género Bythograea (Fig. 7 D), todas endémicas del Pacífico este (Martin y Haney 2005), tres especies poseen un registro en aguas del Pacífico mexicano (Anexo 1). Debido al hecho que el proyecto TALUD fue enfocado al estudio de las comunidades bentónicas típicas de los fondos blandos, no se recolectó ninguna especie asociada con las ventilas hidrotermales. Finalmente, con cuatro especies, la familia Ethusidae es la que cuenta con la mayor riqueza específica en aguas profundas del Pacífico mexicano. Una de éstas, 300 Biodiversidad y comunidades del talud continental del Pacífico mexicano Figura 7. A. Platymera gaudichaudii H. Milne Edwards, 1837; B. Trichopeltarion corallinum (Faxon, 1893); C. Cancer johngarthi Carvacho, 1989; D. Bythograea microps de Saint Laurent, 1984; E. Ethusa ciliatifrons Faxon, 1893; F. Ethusina faxonii Rathbun, 1933. A, tomado de Hendrickx (1995c); B, tomado de Faxon (1895); C, tomado de Carvacho (1989); D, tomado de Guinot y Segonzac (1997); E, F. tomados de Hendrickx (1997). A B C D E F Ethusa ciliatifrons Faxon, 1893 (Fig. 7 E), ha sido encontrada solamente en la plataforma continental de México, pero tiene registros en aguas mucho más profundas en otras regiones del Pacífico este (hasta ca 400 m). En cambio, el género C rustáceos decápodos (A rthropoda : C rustacea : D ecapoda ) de aguas profundas 301 Ethusina (Fig. 7 F) es típico de aguas muy profundas y esta representado en el área por tres especies (Anexo 1), de las cuales dos fueron recolectadas durante las campañas TALUD. Discusión Previamente a la elaboración de este trabajo, solo se contaba con listas incompletas de la fauna de aguas profundas del Pacífico mexicano. La presente contribución permite señalar que la fauna de crustáceos decápodos bentónicos y bentopelágicos de aguas profundas (≥350 m) del Pacífico mexicano cuenta con un total de 85 especies registradas y 40 de estas (47 %) fueron recolectadas durante el proyecto TALUD. Comparativamente, se estima en aproximadamente 800 el total de especies de este grupo presente en la región, tanto en la zona costera como en la plataforma continental y en aguas profundas (Hendrickx 1993, Hendrickx datos no publicados). Sin embargo, es de subrayar que quedan por explorar de manera más sistemática e intensiva varias porciones del territorio marino nacional. En particular, prácticamente no se sabe nada acerca de la fauna que se localiza por debajo de los 200 m de profundidad en la parte de la corriente de California en territorio mexicano (véase por ejemplo Flores et al. 2004). Por razones de afinidades zoogeográficas, es evidente que la mayoría de las especies encontradas en el sur de California penetran en las aguas mexicanas, pues estas aguas forman parte de la Provincia Californiana que se extiende al sur hasta bahía Magdalena (Espinosa-Pérez y Hendrickx 2006); sin embargo, hace falta efectuar un censo de esta fauna. La porción SO del Pacífico mexicano fue muestreada, en parte, durante el proyecto TALUD (entre Jalisco y Guerrero, véase Hendrickx 2012a); sin embargo, y a pesar de lo interesante que resultaron estos muestreos, la pequeña serie de arrastres efectuados en esta ocasión resultó ser netamente insuficiente considerando la vasta extensión de los fondos con profundidades ≥ 350 m en esta área. La tercera zona que todavía queda pobremente explorada es aquella frente los estados de Oaxaca y Chiapas, en la zona de aguas profundas que corresponde esencialmente al golfo de Tehuantepec. Según Hendrickx et al. (1997) y Hendrickx y VázquezCureño (1998), esta área es de mucho interés faunístico pero, hasta la fecha, no se han realizados arrastres exploratorios sistemáticos por debajo de los 350 m o por debajo de la ZMO. Adicionalmente, no se cuenta con ninguna información reciente acerca de la fauna que se encuentra en las zonas batiales inferiores 302 Biodiversidad y comunidades del talud continental del Pacífico mexicano y abisales (> 2000 m) de la Zona Económica Exclusiva (ZEE) de México. Estas enormes extensiones oceánicas, que corresponden a casi 2000000 de km2 (más del 81 % de la superficie marina de esta ZEE) (Hendrickx 1993), están prácticamente inexploradas. La composición de la fauna de crustáceos decápodos del Pacífico mexicano indica una fuerte proporción de especies de Caridea y de Anomura (más del 75 % en conjunto), con una fuerte dominancia de los Pandalidae (nueve especies) y de los Munidopsidae (18 especies). Los demás grupos tienen una representación mucho más baja, siendo los Stenopodidae y los Astacidea los menos numerosos (una sola especie en ambos casos) (Fig. 1). En cuanto a su distribución a lo largo de las costas del Pacífco mexicano, los crustáceos decápodos de aguas profundas han sido recolectados con mayor éxito en el golfo de California y en la porción SO del Pacífico mexicano. De un total de 85 especies, 36 han sido encontradas en localidades ubicadas en la porción mexicana de la corriente de California, mientras que 51 han sido registradas en el golfo de California y 44 en la porción SO de México (Anexo 1). Sin duda, estas diferencias se deben en gran parte a la diferencia en el esfuerzo de captura entre estas tres áreas. De las 85 especies presentes en aguas profundas del Pacífico mexicano, 13 han sido recolectadas en las tres áreas consideradas (corriente de California, golfo de California y SO de México) y 23 en dos de estas áreas (siete en la corriente y en el golfo; 16 en el golfo y el SO de México; ninguna en la corriente y el SO de México). Entre las especies de aguas profundas del Pacífico mexicano, varias han sido registradas o descritas para las fuentes hidrotermales. Munidopsis alvisca fue descrita por Williams (1988), en parte con material de la cuenca de Guaymas. Una segunda especie de este mismo género, M. lentigo fue descrita por Williams y van Dover (1983) a partir de una muestra obtenida a 2600 m de profundidad en la dorsal del Pacífico este (20°49’N, 109°06’O). En el grupo de los carideos se cuenta con siete familias, 12 géneros y 31 especies de aguas profundas en el Pacífico mexicano; sin embargo, hasta la fecha, no hay registros de representantes de la familia Alvinocarididae. Esta familia incluye dos especies del género Mirocaris Vereschchaka, 1997 (anteriormente considerados como parte de la familia Mirocarididae, pero actualmente incluida dentro de los Alvinocarididae) y nueve especies de Alvinocaris Williams y Chace, 1982 (véase Komai y Segonzac 2003, Komai et al. 2005), todas encontradas en fuentes hidrotermales y afloramientos fríos. A pesar de que miembros de esta familia hayan sido descritas para aguas profundas cerca de las islas Galápagos y en el golfo de México (Martin y C rustáceos decápodos (A rthropoda : C rustacea : D ecapoda ) de aguas profundas 303 Haney 2005), no ha sido encontrada en el Pacífico mexicano. En cambio, en lo que se refiere al género Bythograea, hay tres especies con registros en el Pacífico mexicano, todas en fuentes hidrotermales. Comparativamente con el área del Pacífico mexicano, en el golfo de México se ha registrado la presencia de 100 especies de crustáceos decápodos de aguas profundas y en el Caribe mexicano solamente 54 (en ambos casos > 200 m, EscobarBriones y Soto 1993). Seguramente, en la actualidad se cuentan con registros adicionales de especies para ambas zonas, pero no parece haber datos publicados al respecto. Es de subrayar que en estas regiones no se presenta la ZMO típica del Pacífico este, lo que permite a muchas especies de la plataforma continental extenderse en profundidades mayores, lo que aumenta considerablemente la diversidad faunística en las franjas batimétricas >200 m. Para poder entender las relaciones ecológicas y tróficas que rigen los ecosistemas profundos del Pacífico mexicano, es indispensable aumentar de manera significativa nuestros conocimientos acerca de la fauna de crustáceos decápodos que allí se encuentra, ya que son un componente fundamental dentro de las comunidades naturales que allí prevalecen y llegan, incluso, a ser dominantes en algunas áreas. Solamente a través de un esfuerzo coordinado y sostenido a corto y mediano plazos, podremos lograr conocer con mayor detalle la fauna de camarones, langostinos, langostas y cangrejos que puebla las profundidades de los mares de México. Agradecimientos Se agradece a los miembros del equipo científico y a la tripulación del B/O “El Puma” por el apoyo proporcionado durante las campañas TALUD. El proyecto TALUD recibió el apoyo de Conacyt (proyecto 31805-N) y de la Dirección General de Apoyo al Personal Académico (DGAPA; proyecto PAPIIT IN 217306-3). La edición final así como la preparación de las figuras de este manuscrito fue realizada por Mercedes Cordero Ruiz. El autor agradece a Sammy De Grave por proporcionar información relacionada con los Caridea y a Gary Poore, Peter Dworschak y Dannyl Felder por aclarar algunas dudas acerca de los Axiidea y Gebiidea. Bibliografía Ahyong, S.T. 2009. The polychelidan lobsters: Phylogeny and systematics (Polychelida: Polychelidae). Pp. 369-396. En: J.W. Martin, K.A. Crandall y D.L. Felder (eds.). De304 Biodiversidad y comunidades del talud continental del Pacífico mexicano capod Crustacean Phylogenetics. CRC Press. Taylor y Francis Group. Boca Ratón, Fla. EUA. Ahyong, S.T., K. Baba, E. MacPherson y G.C.B. Poore. 2010. A new classification of the Galatheoidea (Crustacea: Decapoda: Anomura). Zootaxa 2676: 57-68. Austin, W.C. 1985. An annotated checklist of marine invertebrates in the cold temperate northeast Pacific. Khoyatan Marine Laboratory, British Columbia. Vol. 3: 445-682. Baba, K. 2005. Deep-sea Chirostylid and Galatheid Crustaceans (Decapoda: Anomura) from the Indo-Pacific, with a list of species. Scientific Results of the Danish Deep-Sea Expedition Round the World 1950-52. Galathea Reports 20: 1-317. Baba, K. y J. Haig. 1990. A new species of chirostylid crustacean (Decapoda: Anomura) from off the West coast of North America. Proceedings of the Biological Society of Washington 104 (4): 854–860. Baba, K., E. MacPherson, G.C.B. Poore, S.T. Ahyong, A. Bermudez, P. Cabezas, C.-W. Lin, M. Nizinski, C. Rodríguez, y K.E. Schnabel. 2008. Catalogue of squat lobsters of the World (Crustacea: Decapoda: Anomura- families Chirostylidae, Galatheidae and Kiwaidae. Zootaxa 1905: 1-220. Boyko, C.B. y P.A. McLaughlin. 2010. Annotated checklist of anomuran decapod crustaceans of the world (exclusive of the Kiwaoidea and families Chirostylidae and Galatheidae of the Galatheoidea). Part IV – Hippoidea. En: M.E.Y. Low y S.H. Tan (eds.). Checklists of anomuran decapod crustaceans of the world (exclusive of the Kiwaoidea and families Chirostylidae and Galatheidae of the Galatheoidea) and marine lobsters of the World. The Raffles Bulletin of Zoology Supplement 23: 139-151. Brusca, R.C. y G.J. Brusca. 2002. Invertebrates. 2nd. Ed. Sinauer Associates. USA. 936 pp. Burukovsky, R.N. 2003. Shrimps of the family Nematocarcinidae [in Russian]. Kaliningrad Izdatelistovo KGGU, Malingrad. 250 pp. Carvacho, A. 1989. Cancer johngarthi, n. sp. & Cancer porteri (Bell) (Crustacea, decapoda): comparisons and hypothesis. Proceedings of the Biological Society of Washington 102(3): 613-619. Chan, T.-Y. 2010. Annotated checklist of the world’s marine lobsters (Crustacea: Decapoda: Astacidea, Glypheidea, Achelata, Polychelida). En: M.E.Y. Low y S.H. Tan (eds.). Checklists of anomuran decapod crustaceans of the world (exclusive of the Kiwaoidea and families Chirostylidae and Galatheidae of the Galatheoidea) and marine lobsters of the World. The Raffles Bulletin of Zoology Supplement 23: 153-181. De Grave, S. y C.H.J.M. Fransen. 2011. Carideorum catalogus: the recent species of the dendrobranchiate, stenopodidean, procarididean and caridean shrimps. Zoologische Mededelingen, Leiden 85: 195-588. C rustáceos decápodos (A rthropoda : C rustacea : D ecapoda ) de aguas profundas 305 De Grave, S., N.D. Pentcheff, S.T. Ahyong, T.-Y. Chan, K.A. Crandall, P.C. Dworschak, D.L. Felder, R.M. Feldmann, C.H.J.M. Fransen, L.Y.D. Goulding, R. Lemaitre, M.E.Y. Low, J.W. Martin, P.K.L. Ng, C.E. Schweitzer, S.H. Tan, D. Tshudy, y R. Wetzer. 2009. A classification of living and fosil genera of decapod crustaceans. The Raffles Bulletin of Zoology Supplement 21: 1-109. Escobar Briones, E. y L. A. Soto. 1993. Bentos del mar profundo en México. Pp. 106-116. En: S.I. Salazar-Vallejo y N.E. González (eds.). Biodiversidad Marina y Costera de México. Comisión Nacional de Biodiversidad y CIQRO, México. Espinosa-Pérez, M.C. y M.E. Hendrickx. 2006. A comparative analysis of biodiversity and distribution of shallow water marine isopods (Crustacea: Isopoda) from polar and temperate waters in the East Pacific. Belgian Journal of Zoology 136 (2): 219-247. Faxon, W. 1893. Reports on the dredgings operations off the west coast of Central America to the Galapagos, to the west coast of Mexico, and in the Gulf of California VI. Preliminary descriptions of new species of Crustacea. Bulletin of the Museum of Comparative Zoology at Harvard University 24 (7): 149-220. Faxon, W. 1895. Reports on an exploration off the west coast of Mexico, Central and South America, and off the Galapagos Islands, in charge of Alexander Agassiz, carried on by the U.S. Fish Commission steamer “Albatross”, during 1891, lieut. Commander Z.L. Tanner, U.S.N., commanding. XV. The stalk-eyed Crustacea. Memoirs of the Museum of Comparative Zoology at Harvard College 18: 1-292. Faxon, W. 1896. Reports on the results of dredging, under the supervision of Alexander Agassiz, in the Gulf of Mexico and the Caribbean Sea, and on the east coast of United States, 1877 to 1880, by the U.S. coast survey steamer “Blake”, lieut. Commander C.D. Sigsbee, U.S.N., and commander J.R. Bartlett, U.S.N., commanding. XXXVII. Supplementary notes on the Crustacea. Bulletin of the Museum of Comparative Zoology at Harvard College 30 (3): 153–168. Flores, J., M.E. Hendrickx y H. Chapa-Saldaña. 2004. Capturas del camarón mancha blanca, Pandalus platyceros Brandt, 1851 (Caridea: Pandalidae), en la costa oeste de Baja California, México, con una breve revisión de su biología y su pesca. Pp. 199-211. En: M.E. Hendrickx (ed.). Contributions to the Study of East Pacific Crustaceans 3. [Contribuciones al Estudio de los Crustáceos del Pacífico Este 3] Instituto de Ciencias del Mar y Limnología, UNAM. 245 pp. Galil, B.S. 2000. Crustacea Decapoda: review of the genera and species of the family Polychelidae Wood-Mason, 1874. En: A. Crosnier (ed.). Résultats des Campagnes Musorstom. Vol. 21. Mémoires du Museum national d’Histoire naturelle, Paris 184: 285-387. 306 Biodiversidad y comunidades del talud continental del Pacífico mexicano Guinot, D. y M. Segonzac. 1997. Description d’un crabe hydrothermal nouveau du genre Bythograea (Crustacea, Decapoda, Brachyura) et remarques sur les Bythograeidae de la dorsale du Pacifique oriental. Zoosystema 19 (1): 121-149. Haig, J. 1974. Observations on the lithodid crabs of Peru, with description of two new species. Bulletin of the Southern California Academy of Sciences 73 (3): 152-164. Hendrickx, M.E. 1993. Crustáceos decápodos del Pacífico Mexicano. Pp. 271-318. En: S.I. Salazar-Vallejo y N.E. González (eds.). Biodiversidad Marina y Costera de México. Comisión Nacional de Biodiversidad y CIQRO, México. Hendrickx, M.E. 1995a. Checklist of lobsters-like decapod crustaceans (Crustacea: Decapoda: Thalassinidea, Astacidea and Palinuridea) from the Eastern Tropical Pacific. Anales del Instituto de Biología, Universidad Nacional Autónoma de México 66 (2): 153-165. Hendrickx, M.E. 1995b. Checklist of brachyuran crabs (Crustacea: Decapoda) from the Eastern Tropical Pacific. Bulletin de l’Institut royal des Sciences naturelles de Belgique 65: 125-150. Hendrickx, M.E. 1995c. CANGREJOS. Pp. 565-636. En: W. Fischer, F. Krupp, W. Schneider, C. Sommer, K.E. Carpenter y V.H. Niem (eds.). Guía FAO para la identificación de especies para los fines de la pesca. Pacífico centro-oriental. Vol. I. Plantas e Invertebrados. FAO, Roma, Italia. Hendrickx, M.E. 1995d. CAMARONES. Pp. 417-537. En: W. Fischer, F. Krupp, W. Schneider, C. Sommer, K.E. Carpenter y V.H. Niem (eds.). Guía FAO para la identificación de especies para los fines de la pesca. Pacífico centro-oriental. Vol. I. Plantas e Invertebrados. FAO, Roma, Italia. Hendrickx, M.E. 1995e. LANGOSTAS. En: W. Fischer, F. Krupp, W. Schneider, C. Sommer, K.E. Carpenter y V.H. Niem (eds.). Guía FAO para la identificación de especies para los fines de la pesca. Pacífico centro-oriental. Vol. I. Plantas e Invertebrados. FAO, Roma, Italia. Pp. 383-416. Hendrickx, M.E. 1996a. Los camarones Penaeoidea bentónicos (Crustacea: Decapoda: Dendrobranchiata) del Pacífico mexicano. Comisión Nacional para el Conocimiento y Uso de la Biodiversidad e Instituto de Ciencias del Mar y Limnolología, Universidad Nacional Autónoma de México. México, D.F. 148 pp. Hendrickx, M.E. 1996b. New records of deep-water decapod crustaceans in the southeastern Gulf of California, Mexico. Revista de Biología Tropical 44 (2B): 945-947. Hendrickx, M.E. 1997. Los cangrejos braquiuros (Crustacea: Brachyura: Dromiidae, hasta Leucosiidae) del Pacífico mexicano. Comisión Nacional para el Conocimiento y Uso de la Biodiversidad e Instituto de Ciencias del Mar y Limnología, Universidad Nacional Autónoma de México. México, D.F. 178 pp. C rustáceos decápodos (A rthropoda : C rustacea : D ecapoda ) de aguas profundas 307 Hendrickx, M.E. 2000. The genus Munida Leach (Crustacea, Decapoda, Galatheidae) in the eastern tropical Pacific, with description of two new species. Bulletin de l’Institut royal des Sciences naturelles de Belgique 70: 163-192. Hendrickx, M.E. 2001. Occurrence of a continental slope decapod crustacean community along the edge of the minimum oxygen zone in the southeastern Gulf of California, Mexico. Belgian Journal of Zoology 131 (Suppl. 2): 95-109. Hendrickx, M.E. 2002a. A new deep water species of Odontozona Holthuis (Decapoda, Stenopodidae) from the Southern Gulf of California, Mexico. Crustaceana 75 (3-4): 405-412. Hendrickx, M.E. 2002b. New bathymetric record for the genus Sicyonia in the eastern Pacific. Oceanides 17 (2): 129. Hendrickx, M.E. 2003a. Size and abundance of deep water shrimps on the continental slope of the SE Gulf of California, Mexico. Pp: 227-234. En: M.E. Hendrickx (ed.) Contributions to the Study of East Pacific Crustaceans 2 [Contribuciones al Estudio de los Crustáceos del Pacífico Este 2]. Instituto de Ciencias del Mar y Limnología, UNAM. México, D.F. Hendrickx, M.E. 2003b. Distribution and size of the Pacific deep-water lobsterette, Nephropsis occidentalis Faxon, 1893 (Decapoda: Astacidea: Nephropidae) in the S.E. Gulf of California, Mexico. Crustaceana 76 (2): 207-216. Hendrickx, M.E. 2003c. The temperate species of the genus Munida Leach (Crustacea, Decapoda, Galatheidae) in the east Pacific, with the description of a new species and additional records for tropical-subtropical species. Bulletin de l’Institut royal des Sciences naturelles de Belgique 73: 117-138. Hendrickx, M.E. 2003d. Geographic and bathymetric distributions of species of Munidopsis (Crustacea: Decapoda: Galathaeidae) in the SE Gulf of California, Mexico. Pp. 2130. En: M.E. Hendrickx (ed.). Contributions to the Study of East Pacific Crustaceans 2 [Contribuciones al Estudio de los Crustáceos del Pacífico Este 2]. Instituto de Ciencias del Mar y Limnología, UNAM. México, D.F. Hendrickx, M.E. 2008a. New records of and notes on decapod crustaceans in the east Pacific. Crustaceana 81 (8): 999-1262. Hendrickx, M.E. 2008b. Second capture of Odontozona foresti Hendrickx, 2002 (Stenopodidea) and Munida bapensis Hendrickx, 2000 (Galatheoidea) in western Mexico. Pp. 47-50. En: M.E. Hendrickx (ed.). Contributions to the Study of East Pacific Crustaceans 5 (1). [Contribuciones al Estudio de los Crustáceos del Pacífico Este 5 (1)]. Instituto de Ciencias del Mar y Limnología, UNAM. México, D.F. Hendrickx, M.E. 2010. A new species of Glyphocrangon (Decapoda: Caridea: Glyphocrangonidae) from off the coast of western Mexico. Zootaxa 2372: 358-366. 308 Biodiversidad y comunidades del talud continental del Pacífico mexicano Hendrickx, M.E. 2012a. Operaciones oceanográficas en aguas profundas: los retos del pasado, del presente y del proyecto TALUD en el Pacífico mexicano (1989-2009). Pp. 23-104. En: P. Zamorano, M.E. Hendrickx y M. Caso (eds.). Biodiversidad y comunidades del talud continental del Pacífico mexicano. Instituto Nacional de Ecología, Secretaría del Medio Ambiente y Recursos Naturales (Semarnat). Hendrickx, M.E. 2012b. Los Glyphocrangonidae y Crangonidae (Crustacea: Decapoda: Caridea) recolectados durante los cruceros TALUD en el Pacífico mexicano. Pp. 317354. En: P. Zamorano, M.E. Hendrickx y M. Caso (eds.). Biodiversidad y comunidades del talud continental del Pacífico mexicano. Instituto Nacional de Ecología, Secretaría del Medio Ambiente y Recursos Naturales (Semarnat). Hendrickx, M.E. 2012c. Distribución de Stereomastis pacifica (Faxon, 1893) (Crustacea; Decapoda; Palinura; Erynoidea; Polychelidae) en el Pacífico mexicano. Pp. 355-369. En: P. Zamorano, M.E. Hendrickx y M. Caso (eds.). Biodiversidad y comunidades del talud continental del Pacífico mexicano. Instituto Nacional de Ecología, Secretaría del Medio Ambiente y Recursos Naturales (Semarnat). Hendrickx, M.E. y M. Ayon-Parente. 2009. Notes on distribution and ecology of Parapagurus foraminosus Lemaitre, 1999 (Crustacea: Decapoda: Parapaguridae) in the eastern Pacific. Crustaceana 82 (10): 1339-1344. Hendrickx, M.E. y M. Ayón-Parente. 2011. Rediscovery of Uroptychus pubescens Faxon, 1893 (Decapoda: Anomura: Chirostylidae) in the southern Gulf of California, Pacific coast of Mexico. Crustaceana 84 (12-13): 1411-1420. Hendrickx, M.E. y F.D. Estrada Navarrete. 1996. Los camarones pelágicos (Crustacea: Dendrobranchiata y Caridea) del Pacífico mexicano. Comisión Nacional para el Conocimiento y Uso de la Biodiversidad e Instituto de Ciencias del Mar y Limnolología, Universidad Nacional Autónoma de México. México, D.F. 157 pp. Hendrickx, M.E. y A.W. Harvey. 1999. Checklist of anomuran crabs (Crustacea: Decapoda) from the Eastern Tropical Pacific. Belgian Journal of Zoology 129 (2): 327-352. Hendrickx, M.E. y L.A. Vázquez-Cureño. 1998. Composition and zoogeographical affinities of the stomatopod and decapod crustaceans collected during the CEEMEX P4 cruise in the Gulf of Tehuantepec, Mexico. Bulletin de l’Institut royal des Sciences naturelles de Belgique 68: 135-144. Hendrickx, M.E. y M.K. Wicksten. 1989. Los Pandalidae (Crustacea: Caridea) del Pacífico mexicano, con una clave para su identificación. Caldasia (Colombia) 16 (76): 71-86. Hendrickx, M.E., M. Demestre, A. Esparza-Haro y J. Salgado-Barragán. 1997. Stomatopod and decapod crustaceans collected during the CEEMEX P5 and P7 cruises to the Gulf of Tehuantepec, Mexico. Oceanides 11: 1-28. C rustáceos decápodos (A rthropoda : C rustacea : D ecapoda ) de aguas profundas 309 Hendrickx, M.E., M. Ayón-Parente, y D. Serrano. 2011. Additional record of Janetogalathea californiensis (Benedict, 1901) (Anomura: Galatheidae) from the central Gulf of California, Mexico with notes on its distribution. Hidrobiologica 21 (1): 89-94. Holthuis, L.B. 1980. FAO species catalogue. Vol. I. Shrimps and prawns of the world. An annotated and illustrated catalogue of species of interest to fisheries. FAO Fisheries Synopsis 125 (1): 1-271. Holthuis, L.B. 1991. FAO species catalogue. Vol. 13. Marine lobsters of the world. An annotated and illustrated catalogue of species of interest to fisheries known to date. FAO Fisheries Synopsis 125 (13): 1-292. Holthuis, L.B. 1993. The recent genera of the caridean and stenopodidean shrimps (Crustacea, Decapoda) with and appendix on the order Amphionidacea. National Natuurhistorisch Museum, Leiden. 328 pp. Komai, T. 2006. Revision of the Glyphocrangon caeca species group (Crustacea, Decapoda, Glyphocrangonidae). Pp. 243-264. En: B. Richer de Forges y J.-L. Justine (eds.). Tropical Deep-Sea Benthos, Vol. 24. Mémoires du Muséum national d’Histoire Naturelle, Paris. Zoologie 193 Komai, T., y M. Segonzac. 2003. Review of the hydrothermal vent shrimp genus Mirocaris, redescription of M. fortunata and reassessment of the taxonomic status of the family Alvinocarididae (Crustacea: Decapoda: Caridea). Cahiers de Biologie Marine 44: 199-215. Komai, T., T.M. Shank y C.L. van Dover. 2005. A new species of Alvinocaris (Crustacea: Decapoda: Caridea: Alvinocarididae) and a new record of A. muricola from methane seeps on the Blake Ridge Diapir, northwestern Atlantic. Zootaxa 1019: 27-42. Lemaitre, R. 1999. Crustacea Decapoda: A review of the species of the genus Parapagurus Smith, 1879 (Parapaguridae) from the Pacific and Indian Oceans. Pp. 303-378. En: A. Crosnier (ed.). Résultats des Campagnes MUSORSTOM. Vol. 20. Mémoires du Muséum national d’Histoire naturelle, Paris. Zoologie 180. Luke, S.R. 1977. Catalog of the benthic invertebrate collections. I. Decapod Crustacea and Stomatopoda. University of California. SIO Ref. Ser. 77-9: 72 p. MacPherson, E. 1988. Revision of the Family Lithodidae Samouelle, 1819 (Crustacea, Decapoda, Anomura) in the Atlantic Ocean. Monografías de Zoología Marina 2: 9-153. MacPherson, E. y R. Cleva. 2010. Shallow-water squat lobsters (Crustacea, Decapoda, Galatheidae) from Mayotte (Comoros Island), La Reunión and Madagascar, with the description of a new genus and two new species. Zootaxa 2612: 57-68. Martin, J.W. y G.E. Davis. 2001. An updated classification of the recent Crustacea. Contributions in Science of the Natural History Museum of Los Angeles County 39: 1-124. 310 Biodiversidad y comunidades del talud continental del Pacífico mexicano Martin, J.W. y T.A. Haney. 2005. Decapod crustaceans from hydrothermal vents and cold seeps: a review through 2005. Zoological Journal of the Linnean Society 145: 445-522. McLaughlin, P.A., R. Lemaitre y K.A. Crandall. 2010a. Annotated checklist of anomuran decapod crustaceans of the world (exclusive of the Kiwaoidea and families Chirostylidae and Galatheidae of the Galatheoidea). Part III – Aegloidea. Pp. 131-137. En: M.E.Y. Low y S.H. Tan (eds.), Checklists of anomuran decapod crustaceans of the world (exclusive of the Kiwaoidea and families Chirostylidae and Galatheidae of the Galatheoidea) and marine lobsters of the World. The Raffles Bulletin of Zoology Supplement 23. McLaughlin, P.A., T. Komai, R. Lemaitre y D.L. Rahayu. 2010b. Annotated checklist of anomuran decapod crustaceans of the world (exclusive of the Kiwaoidea and families Chirostylidae and Galatheidae of the Galatheoidea). Part I – Lithodoidea, Lomisoidea and Paguroidea. Pp. 5-107. En: M.E.Y. Low y S.H. Tan (eds.). Checklists of anomuran decapod crustaceans of the world (exclusive of the Kiwaoidea and families Chirostylidae and Galatheidae of the Galatheoidea) and marine lobsters of the World. The Raffles Bulletin of Zoology Supplement 23. Navas, G.R., A. Bermúdez, N. Cruz y N.H. Campos. 2003. Galatéidos (Decapoda, Anomura, Galatheidae) del Caribe colombiano, incluyendo doce primeros registros. Boletín de Investigaciones Marinas y Costeras 32: 183-218. Newman, W.A. 1985. The abyssal hydrothermal vent invertebrate fauna: A glimpse of antiquity? Bulletin of the Biological Society of Washington 6: 231-242. Ng, P.K.L., D. Guinot y P.J. Davie. 2008. Systema Brachyurorum: Part I. An annotated checklist of extant brachyuran crabs of the world. The Raffles Bulletin of Zoology 17: 1-286. Osawa, M. y P.A. McLaughlin. 2010. Annotated checklist of anomuran decapod crustaceans of the world (exclusive of the Kiwaoidea and families Chirostylidae and Galatheidae of the Galatheoidea). Part II – Porcellanidae. Pp. 109-129. En: M.E.Y. Low y S.H. Tan (eds.). Checklists of anomuran decapod crustaceans of the world (exclusive of the Kiwaoidea and families Chirostylidae and Galatheidae of the Galatheoidea) and marine lobsters of the World. The Raffles Bulletin of Zoology Supplement 23. Otto, R.S. y G.S. Jamieson. 2003. Commercially Important Crabs, Shrimps and Lobsters of the North Pacific Ocean. Pp. 235-303. En M.E. Hendrickx (ed.). Contributions to the Study of East Pacific Crustaceans 2 [Contribuciones al Estudio de los Crustáceos del Pacífico Este 2]. Instituto de Ciencias del Mar y Limnología, UNAM. México, D.F. Retamal, M.A. 1981. Catálogo ilustrado de los crustáceos decápodos de Chile. Gayana, Zoología 44: 1-110. C rustáceos decápodos (A rthropoda : C rustacea : D ecapoda ) de aguas profundas 311 Robles, R., C.C. Tudge, P.C. Dworschak, G.C.B. Poore y D.L. Felder. 2009. Molecular phylogeny of the Thalassinidea based on nuclear and mitochondrial genes. Pp. 309-326. En: J.W. Martin, K.A. Crandall y D.L. Felder (eds.). Decapod crustacean phylogenetics. CRC Press Taylor & Francis Group Fla. USA. Román-Contreras, R. y C. Boyko. 2007. A new genus and species of Bopyrid isopod infesting the crab Munidopsis depressa (Anomura: Galatheidae) from the Gulf of California, with notes on its ecology. Journal of Crustacean Biology 27 (2): 370-379. Schmitt, W.L. 1921. The Marine Decapod Crustacea of California with special reference to the decapod Crustacea collected by the United States Bureau of Fisheries steamer “Albatross” in connection with the biological survey of San Francisco Bay during the years 1912-1913. University of California Publications in Zoology 23: 1-470. Schmitt, WL. 1942. The species of Aegla, endemic South America freshwater crustaceans. Proceedings of the United States National Museum 91: 431-520. Wicksten, M.K. 1980. Crustacea and Pycnogonida. Pp. 196-223. En: D. Straughan, y R.W. Klink (comp.). A taxonomic listing of common marine invertebrate species from Southern California. Allan Hancock Foundation Technical Report 3. Wicksten, M.K. 1984. New records and a new species of Hippolytid shrimp from the northeastern Pacific (Decapoda, Caridea). Crustaceana 46 (3): 241-248. Wicksten, M.K. 1989. Ranges of offshore decapod crustaceans in the eastern Pacific Ocean. Transactions of the San Diego Society of Natural History 21 (19): 291-316. Wicksten M.K. y J.L. Martin. 2004. A new species of caridean shrimp of the family Stylodactylidae from the eastern Pacific Ocean. Proceedings of the Biological Society of Washington 117 (3): 377-384. Wicksten, M.K. y M.E. Hendrickx. 2003. An updated checklist of benthic marine and brackish water shrimps (Decapoda: Penaoidea, Stenopodidea, Caridea) from the Eastern Tropical Pacific. Pp. 49-76. En: M.E. Hendrickx (ed.). Contributions to the Study of East Pacific Crustaceans 2. [Contribuciones al Estudio de los Crustáceos del Pacífico Este 2]. Instituto de Ciencias del Mar y Limnología, UNAM. México. Wicksten, M.K. y M. Méndez. 1982. New records and new species of the genus Lebbeus (Caridea: Hippolytidae) in the Eastern Pacific Ocean. Bulletin of the Southern California Academy of Sciences 81: 106-120. Williams, A.B. 1988. New marine decapod crustaceans from waters influenced by hydrothermal discharge, brine, and hydrocarbon seepage. Fishery Bulletin 86 (2): 263287. 312 Biodiversidad y comunidades del talud continental del Pacífico mexicano Williams, A.B. y C.L. van Dover. 1983. A new species of Munidopsis from submarine thermal vents of the east Pacific rise at 21º N (Anomura: Galatheidae). Proceedings of the Biological Society of Washington 96 (3): 481-488. Word, J. y D. Charwart. 1974. Key to shrimp common in southern California trawl catches. Southern California Coastal Water Research. 41 pp. C rustáceos decápodos (A rthropoda : C rustacea : D ecapoda ) de aguas profundas 313 Anexo Lista de especies de crustáceos decápodos bentónicas o bentopelágicas registradas en el Pacífico de México en profundidades ≥350 m. Las especies en negritas fueron recolectadas durante las campañas TALUD. Se indica la presencia de cada especie en tres áreas del Pacífico mexicano: CC, corriente de California; GC, golfo de California; SOM, suroeste de México, al sur de bahía Banderas. Dendrobranchiata Stenopodidea Caridea 314 Especies Benthesicymidae Benthesicymus altus Spence Bate, 1881 (1) Benthesicymus tanneri Faxon, 1893 Sicyoniidae Sicyonia disedwardsi (Burkenroad, 1934) (4) Solenoceridae Hymenopenaeus doris (Faxon, 1893) (2) Stenopodidae Odontozona foresti Hendrickx, 2002 Pasiphaeidae Acanthephyra brevicarinata Hanamura, 1983 Acanthephyra brevirostris Smith, 1885 (2) Pasiphaea emarginata Rathbun, 1902 (2) Pasiphaea magna Faxon, 1893 Nematocarcinidae Nematocarcinus agassizii Faxon, 1893 (2) Nematocarcinus ensifer (Smith, 1882) (2) Nematocarcinus faxoni Burukovsky, 2001 (2) Stylodactylidae Bathystylodactylus echinus Wicksten y Martin, 2004 Hippolytidae Heptacarpus yaldwynae Wicksten, 1984 Lebbeus scrippsi Wicksten y Méndez, 1982 Lebbeus washingtonianus (Rathbun, 1902) Spirontocaris sica Rathbun, 1902 Distribución CC, GC CC, GC CC, GC, SOM GC, SOM GC, SOM GC, SOM GC CC, GC, SOM CC, GC, SOM SOM SOM GC, SOM CC CC GC CC CC Biodiversidad y comunidades del talud continental del Pacífico mexicano Cuadro 1. Continúa. Axiidea Achelata Astacidea Anomura C rustáceos Especies Pandalidae Heterocarpus affinis Faxon, 1893 Heterocarpus vicarius Faxon, 1893 Pandalopsis ampla Spence Bate, 1888 Pandalus platyceros Brandt, 1851 (5) Pantomus affinis Chace, 1937 (5) Plesionika beebei Chace, 1937 (2) (5) Plesionika carinirostris Hendrickx, 1990 (5) Plesionika mexicana Chace, 1937 (2) (5) Plesionika trispinus Squires y Barragán, 1976 (5) Crangonidae Argis californiensis (Rathbun, 1902) Metacrangon procax (Faxon, 1893) Paracrangon areolata Faxon, 1893 Parapontophilus occidentalis (Faxon, 1893) Sclerocrangon atrox Faxon, 1893 Glyphocrangonidae Glyphocrangon alata Faxon, 1893 Glyphocrangon vicaria Faxon, 1896 Glyphocrangon spinulosa Faxon, 1893 Glyphocrangon taludensis Hendrickx, 2010 Axiidae Calocarides quinqueseriatus (Rathbun, 1902) Callianopsidae Callianopsis goniophthalma (Rathbun, 1902) Polychelidae Stereomastis pacifica (Faxon, 1893) Willemoesia inornata Faxon, 1893 Nephropidae Nephropsis occidentalis Faxon, 1893 Lithodidae Glyptolithodes cristatipes (Faxon, 1893) (5) decápodos (A rthropoda : C rustacea : D ecapoda ) Distribución GC, SOM GC, SOM CC. GC. SOM CC. GC. SOM GC, SOM CC, GC, SOM GC, SOM CC, GC, SOM GC, SOM CC GC, SOM GC, SOM CC, SOM GC, SOM SOM SOM? GC, SOM GC, SOM CC, GC GC GC, SOM CC CC, GC, SOM CC, GC de aguas profundas 315 Cuadro 1. Continúa. Especies Lithodes couesi Benedict, 1895 Neolithodes diomedeae (Benedict, 1894) Paralithodes rathbuni (Benedict, 1894) Paralomis multispina (Benedict, 1894) Paralomis papillata (Benedict, 1895) Paralomis verrilli (Benedict, 1894) Chyrostylidae Gastroptychus iaspis Baba y Haig, 1990 Uropthychus pubescens Faxon, 1893 Munididae Munida bapensis Hendrickx, 2000 Munida hispida Benedict, 1902 Munida perlata Benedict, 1902 Munida quadrispina Benedict, 1902 Galatheidae Janetogalathea californiensis (Benedict, 1902) (5) Munidopsidae Galacantha diomedeae (Faxon, 1893) Galacantha rostrata A. Milne Edwards, 1880 Munidopsis alvisca Williams, 1988 Munidopsis antonii (Filhol, 1884) Munidopsis aspera (Henderson, 1885) Munidopsis bairdii (Smith, 1884) Munidopsis depressa Faxon, 1893 Munidopsis hamata Faxon, 1893 Munidopsis hendersoniana Faxon, 1893 Munidopsis hystrix Faxon, 1893 Munidopsis latirostris (Henderson, 1895) Munidopsis lentigo Williams y Van Dover 1983 Munidopsis nitida (A. Milne-Edwards, 1880) Munidopsis palmatus Khodkina, 1973 Munidopsis quadrata Faxon, 1893 316 Biodiversidad y comunidades del talud continental del Pacífico mexicano Distribución CC GC CC CC, GC CC CC, GC CC GC GC SOM GC CC CC, GC CC, GC, SOM SOM GC CC CC CC, GC GC CC SOM CC, GC, SOM CC (?) SOM GC GC GC Cuadro 1. Continúa. Brachyura Especies Munidopsis scabra Faxon, 1893 Munidopsis subsquamosa Henderson, 1885 Munidopsis verrillii Benedict, 1902 Munidospis verrucosus Khodkina, 1973 Parapaguridae Parapagurus benedicti de Saint Laurent, 1972 Parapagurus foraminosus Lemaitre, 1999 Homolidae Moloha faxoni (Schmitt, 1921) Calappidae Platymera gaudichaudii H. Milne Edwards, 1837 (3) (5) Atelecyclidae Trichopeltarion corallinum (Faxon, 1893) Cancridae Cancer johngarthi Carvacho, 1989 Bythograeidae Bythograea thermydron Williams, 1980 Bythograea laubieri Guinot y Segonsac, 1997 Bythograea microps de Saint Laurent, 1984 Ethusidae Ethusa ciliatifrons Faxon, 1893 (5) Ethusina faxonii Rathbun, 1933 Ethusina robusta (Miers, 1886) Ethusina smithsiana Faxon, 1893 Distribución GC SOM CC CC CC CC, GC, SOM CC, GC CC, GC, SOM GC, SOM CC, GC, SOM SOM SOM SOM GC CC, GC GC, SOM SOM (1) California del Sur. (2) Bentopelágico. (3) Probablemente solo en aguas más someras en México. (4) Registro confirmado pero muy aislado. (5) Recolectado en otros cruceros por el Laboratorio de Invertebrados Bentónicos. C rustáceos decápodos (A rthropoda : C rustacea : D ecapoda ) de aguas profundas 317 Los Glyphocrangonidae y Crangonidae (Crustacea: Decapoda: Caridea) recolectados durante los cruceros TALUD en el Pacífico mexicano Michel E. Hendrickx1 Introducción Los camarones Caridea del Pacífico este tropical cuentan con 319 especies, de las cuales 70 son pelágicas y 249 bentónicas (Hendrickx y Estrada Navarrete 1989, Wicksten y Hendrickx 2003, Li y Poupin 2009, Hendrickx, datos no publicados). Las familias con mayor riqueza específica en el ambiente pelágico corresponden a los Pasiphaeidae y los Oplophoridae. Ambas familias contienen especies de tamaño relativamente grande (de 2 a 10 cm de longitud) que forman parte del micronecton, con una capacidad natatoria suficiente para permitirles desplazarse en contra de las corrientes oceánicas. Pese a este conocimiento, se puede considerar que en general las especies pelágicas de aguas profundas (> 500 m) están pobremente documentadas debido a la dificultad de realizar muestreos discretos en los pisos batimétricos profundos con equipos (redes pelágicas) suficientemente grandes que permiten su captura. Además, por su alta movilidad pueden detectar la presencia de las artes de pesca y alejarse de la trayectoria de la red de pesca, lo que dificulta aún más su captura. Por otra parte, en el ambiente bentónico se distribuye el ma- Laboratorio de Invertebrados Bentónicos, Instituto de Ciencias del Mar y Limnología, Unidad Académica Mazatlán, Universidad Nacional Autónoma de México, Joel Montes Camarena s/n, Mazatlán 82040, Sinaloa, México. Correo-e: [email protected]. 1 319 yor número de especies entre los Hippolytidae, los Palaemonidae y los Alpheidae, familias esencialmente de aguas someras. La familia Crangonidae contiene en su mayoría especies de aguas someras que incluye, entre otros, el camarón gris del mar del Norte, Crangon crangon (Linneaus, 1758) y varias especies sujetas a la pesca artesanal o industrial en diversas partes del mundo (e.g., Crangon nigromaculata Lockington, 1877, en California; Crangon affinis De Haan, 1849, en Japón). Según Holthuis (1980), se capturan para consumo humano 13 especies de Crangonidae, pero ninguna de Glyphocrangonidae. En lo que se refiere a las especies de Crangonidae y Glyphocrangonidae de aguas profundas del Pacífico americano, las descripciones originales se deben en su mayoría al trabajo de Walter Faxon, quien basó sus estudios en material recolectado por el “Albatross” (Faxon 1893, 1895, 1896). La poca información adicional disponible en la región acerca de estas, se encuentra en los trabajos de Schmitt (1921), Wicksten (1977, 1979, 1989), Retamal (1981), Méndez (1981), Hendrickx (2001, 2004) y Wicksten y Hendrickx (2003). Adicionalmente, existe una serie de trabajos relacionados con Glyphocrangon publicados por Komai que tienen implicaciones sobre la taxonomía de este género en todas las regiones del mundo (e.g., Komai 2004a, 2006). Esta contribución presenta la síntesis del conocimiento actual acerca de esta fauna en el Pacífico este e información del material nuevo que fue recolectado en las operaciones de arrastre realizadas durante el proyecto TALUD. Material y métodos El material examinado fue recolectado durante las campañas TALUD III-XII a bordo del B/O “El Puma” de la Universidad Nacional Autónoma de México (UNAM) y representa una de las colecciones más importantes de Crangonidae y de Glyphocrangonidae del Pacífico este. El número de especímenes obtenido rebasó en muchos casos el material capturado originalmente por el buque “Albatross” (campañas de 1891 y 1892 entre Ecuador y México). El material recolectado está depositado en la Colección Regional de Invertebrados Marinos (EMU) del Laboratorio de Invertebrados Bentónicos, ICML, UNAM, en Mazatlán, Sinaloa, México. Una pequeña parte del material se encuentra depositado en el Oxford University Museum of Natural History (OUMNH), en Gran Bretaña. 320 Biodiversidad y comunidades del talud continental del Pacífico mexicano Los especímenes capturados con la red montada en un trineo bentónico fueron separados a bordo, fijados con formaldehído (salvo un número limitado de especímenes conservados directamente en etanol al 96 %) y posteriormente transferidos a una solución de etanol al 70 % después de haber sido abundantemente enjuagados con agua dulce. Los principales trabajos taxonómicos de referencia utilizados durante este estudio son aquellos de Faxon (1893, 1895, 1896), Rathbun (1902), Schmitt (1921), Wicksten (1977, 1979, 1989), Holthuis (1980, 1993), Chace (1984) y Hendrickx (1995) . La información completa relacionada con los muestreos realizados durante las campañas TALUD se encuentra en Hendrickx (2012a). Los resultados presentados en la sección taxonómica incluyen, en cada especie tratada, la sinonímia (limitada a las citas para la región y las contribuciones significativas), la lista del material examinado, la distribución de cada especie, los registros previos en México y –en caso de haberlos– los registros nuevos. Se incluyen algunos comentarios, así como una ilustración de cada especie registrada en aguas de México. Las abreviaciones utilizadas en este trabajo son: H, hembra; M, macho; HH, hembra ovada; NS, no sexado; Est., estación de captura; LC, longitud de caparazón (medido desde el margen interno de la órbita hasta el margen posterior del caparazón). Resultados Los Crangonidae y los Glyphocrangonidae pertenecen a la superfamilia Crangonoidea. Se caracterizan por tener el primer par de pereiópodos terminado en una seudopinza (Crangonidae) o en un apéndice prensil (Glyphocrangonidae) (Fig. 1). Los Crangonidae son generalmente de aguas someras y los Glyphocrangonidae sólo se encuentran en aguas profundas. Crangonidae Según Holthuis (1993), la familia Crangonidae contiene 20 géneros, a los cuales se incluyeron posteriormente los géneros Syncrangon J.N. Kim & Hayashi, 2003, Pseudoponthophilus Komai, 2004b y Placopsicrangon Komai y Chan, 2009 (De Grave et al. 2009, De Grave y Fransen 2011). Sin embargo, el estatuto de varios de estos géneros ha permanecido incierto. L os G lyphocrangonidae y C rangonidae (C rustacea : D ecapoda : C aridea ) 321 Figura 1. A, seudopinza de tipo “prensil” de los Glyphocrangonidae; B, seudopinza de tipo “subquelado” de los Crangonidae. La familia Crangonidae incluye tanto especies de aguas someras –algunas de interés para la pesca– como especies de aguas profundas. En total, hay 57 especies conocidas en ambas costas de América, con una fuerte predominancia en el Pacífico (37 especies) comparativamente con el Atlántico (20 especies) (Rathbun 1904, Pequegnat 1970, Boschi 2000, Retamal y Jara 2002, Wicksten y Hendrickx 2003, Campos et al. 2005, S. De Grave y Fransen 2011). El género Crangon, limitado en su distribución al hemisferio norte, es particularmente importante para la pesca (Holthuis 1980, 1993). Algunos trabajos importantes que tratan este grupo son la revisión de las especies de Crangonidae de la expedición del “Albatross” en las Filipinas (1907-1910) (Chace 1984), así como las claves a nivel de géneros de Burukovsky (1985) y de Holthuis (1993). En el Pacífico americano, ocho especies de Crangonidae han sido recolectadas en aguas con una profundidad mayor a los 200 m. De éstas, dos [Argis ovifer (Rathbun, 1902) y Crangon abyssorum Rathbun, 1902] no tienen registros en aguas mexicanas, aunque la segunda tiene su distribución más sureña en California del Sur (Wicksten 1989), por lo que podría ser encontrada en el futuro frente a la costa de la península de Baja California. Crago lomae (Schmitt, 1921), con registros en 830-1182 m en California (Wicksten 1989), es un sinónimo “junior” de Sclerocrangon procax Faxon, 1893 (Komai 1997a: 672). En total, se cuenta con 12 especies de Crangonidae registradas para el Pacífico mexicano, cinco de estas en aguas profundas (Cuadro 1). Como se señaló anteriormente, la mayoría de las especies de Crangonidae de aguas profundas del Pacífico americano fueron descritas por Faxon (1893, 1895) e información adicional disponible acerca de estas especies en la región se en322 Biodiversidad y comunidades del talud continental del Pacífico mexicano Cuadro 1. Especies de Crangonidae distribuidas en aguas del Pacífico de México. Fuentes: Abele y Kim (1986), Wicksten (1989), Hendrickx (1993), Wicksten y Hendrickx (2003). Las especies en negritas han sido encontradas en profundidades > 200 m. Argis californiensis (Rathbun, 1902) Crangon handi (Kuris y Carlton, 1977) C. holmesi Rathbun, 1902 C. nigromaculata Lockington, 1877 Mesocrangon munitella (Walker, 1898) Metacrangon procax (Faxon, 1893) M. spinossisimus (Rathbun, 1907) Neocrangon resima (Rathbun, 1902) N. zacae (Chace, 1937) Paracrangon areolata Faxon, 1893 Parapontophilus occidentalis (Faxon, 1893) Sclerocrangon atrox Faxon, 1893 cuentra en los trabajos de Wicksten (1977, 1989), Hendrickx (1995, 2001) y Wicksten y Hendrickx (2003). Además de los trabajos citados anteriormente, Burukovsky (1990) describió una especie nueva (Pontophilus nikiforovi) ahora incluida en el género Philocheras (S. De Grave y Framsen 2011) y señaló la presencia de otras dos [Pontocaris rathbuni (de Man, 1918) y Pontophilus gracilis juncaeus Spence Bate, 1888, ahora considerada como Parapontophilus juncaeus] (De Grave et al. 2009), todas en la cordillera de Sala-y-Gómez, frente a Chile. Sin embargo, por ser muy alejadas de la costa de Chile, se considera que las localidades de captura de estas especies se encuentran fuera del contexto del presente trabajo. Clave de las especies de Crangonidae de aguas profundas (> 200 m) del Pacífico americano. Las especies presentes en México están representadas en negritas. 1. Segundo par de pereiópodos ausentes (Paracrangon) Paracrangon areolata Segundo par de pereiópodos presentes ..................................................................2 2. Dáctilo de los pereiópodos 4 y 5 aplanado, ancho (Argis) .................................3 Dáctilo de los pereiópodos 4 y 5 normal, no aplanado ni ensanchado (pereiópodo 2 de longitud semejante a los demás pereiópodos).................................. 4 L os G lyphocrangonidae y C rangonidae (C rustacea : D ecapoda : C aridea ) 323 Figura 2. Esquema del caparazón de un Crangonidae en vistas lateral y dorsal, con la ubicación y la nomenclatura de las carinas, espinas y lobulo (según Word y Charwat 1976). R, rostro. ESPINAS Y LOBULO. esppm, espina posterior mediana; espam, espina anterior mediana; esph, espina hepática; espph, espina post-hepática; espbr, espina branquiostega; esppt, espina pterigostomiana; espant, espina antenal; lo, lóbulo orbital. CARINAS. cb1, primer carina branquial y espina terminal; cb2, segunda carina branquial y espina terminal. 3. Una carina dorsal en todos los somitos (segmentos abdominales)................................................................................................Argis californiensis Sin carina dorsal en los somitos 1 y 2 .................................................. Argis ovifer 4. Pereiópodo 2 mucho más corto que los otros pereiópodos ....................................... .................................................................................. Parapontophilus occidentalis Todos los pereiópodos de longitud similar ............................................................ 5 5. Caparazón sin espina submediana entre la línea mediodorsal y la espina hepática.........................................................................................................................6 Caparazón con 1 o 2 espinas submedianas entre la línea mediodorsal y la espina hepática...................................................................................Metacrangon procax 6. Tegumento grueso y duro; abdomen con esculturas muy evidentes; espina branquiostegal muy fuerte.............................................................Sclerocrangon atrox Tegumento blando; abdomen sin esculturas muy evidentes; espina branquiostegal no muy fuerte (Crangon)..................................................Crangon abyssorum 324 Biodiversidad y comunidades del talud continental del Pacífico mexicano Figura 3. Argis californiensis (Rathbun, 1902). A, vista lateral; B, caparazon, vista lateral; C, mismo, vista dorsal. Metacrangon procax (Faxon, 1893). D, vista lateral; E, vista dorsal. Paracrangon areolata Faxon, 1893. F, vista lateral; G, vista dorsal. (A, según Wicksten 1979; B, C, según Word y Charwat 1976; D-G, según Faxon 1895). A B D C E F G L os G lyphocrangonidae y C rangonidae (C rustacea : D ecapoda : C aridea ) 325 Argis Krøyer, 1842 Argis californiensis (Rathbun, 1902) (Fig. 3 A, B, C) Nectocrangon californiensis Rathbun, 1902: 892; 1904: 136 (clave), 140, fig. 80.- Schmitt 1921: 102, fig. 71. Argis californiensis.- Word y Charwat 1976: 67 (clave), 71 (figuras).Wicksten 1977: 964, fig. 1.- Komai 1997b: 158 (clave). Material examinado- Ninguno. Distribución.- Desde puerto Hueneme (34°04’N, 119°17’O), California, EE.UU., hasta Baja California (31°07’N, 116°33’O) (Wicksten 1977). Al norte de bahía Morro, California (35°12’N, 121°02’O) (SIO, 1992). Entre 20 y 286 m (Wicksten 1989). Registros previos en México.- Frente a Punta Banda (31°07’N, 116°33’O), 194-222 m (Wicksten 1977). Metacrangon Zarenkov, 1965 Metacrangon procax (Faxon, 1893) (Fig. 3 D, E) Sclerocrangon procax Faxon 1893: 199; 1895: 135, lám. XXXVI.- Méndez 1981: 122, lám. XLVII, figs. 357-358.- Chirichigno et al. 1982: 380. Crago lomae Schmitt 1921: 100, lám. 12, figs. 3, 4. Metacrangon procax.- Yaldwin 1960: 38.- Zarenkov 1965: 1764.- Hendrickx 1995: 440 (clave, fig. 6), 443 (texto).- Wicksten y Hendrickx 1992, 6 (lista); 2003: 69 (list).- Komai 1997a: 653 (clave), 672, figs. 1G, 10. Metacrangon lomae.- Zarenkov,1965: 1764. Crangon lomae.- Wicksten 1989: 303 (cuadro), 313 (lista). Material examinado- TALUD X, Est. 22, 13/feb/2007, 1575-1586 m: 1 NS (LC 13.4 mm) (EMU-8102); 1 NS (LC 11.3 mm) (EMU-8103). TALUD XII, Est. 23, 2/abr/2008, 3 M (LC 10.1 – 12.3 mm), 1058-1088 m (EMU-8799). 326 Biodiversidad y comunidades del talud continental del Pacífico mexicano Figura 4. Distribución de Metacrangon procax (Faxon, 1893) y de Paracrangon areolata Faxon, 1893, frente a las costas de México. Los triángulos corresponden a los registros previos (véase texto). TALUD XII, Est. 29, 2/abr/2008, 1609-1643 m: 5 M (LC 14.4 – 8.0 mm), 2 H (LC 14.4 mm) y 1 HH (LC 14.5 mm) (EMU-8798). Distribución.- California del sur, USA; desde el Golfo de California, frente a Sonora (27°34’N, 110°53’40”O), al sur hasta Atico, Perú (Wicksten y Hendrickx 2003). Entre 830 y 1658 m (Wicksten 1989; limite inferior de Crangon lomae). Registros previos en México.- “Albatross” Est. 3418 (frente a Acapulco; 16°33’N, 99°53’W) y dos estaciones en el golfo de California: 3435 (26°48’N, 110°45’20”O; a la altura de Punta Arboleda) y 3436 (27°34’N, 110°53’40”O; al sur de Guaymas) (Faxon 1895). A estos registros se agregan tres localidades correspondiendo a los cruceros TALUD (Fig. 4). L os G lyphocrangonidae y C rangonidae (C rustacea : D ecapoda : C aridea ) 327 Paracrangon Dana, 1852 Paracrangon areolata Faxon, 1893 (Fig. 3 F. G) Paracrangon areolata Faxon, 1893: 200; 1895: 139, lám. XXXIV.- Méndez 1981: 118 (clave), lám. XLVI, figs. 349-350.- Wicksten 1989: 303, 304 (cuadro 1), 313 (lista).- Hendrickx 1995: 439 (clave, fig. 1), 441 (texto); 1996: 945; 2001: 104 (cuadro 4); 2005: 169.- Wicksten y Hendrickx 1992: 6 (lista); 2003: 69 (lista). Material examinado.- TALUD III, Est. 14A, 19/ago/1991, 1018 m: 3 H (LC 13.1-15.4 mm) (EMU-4037-A); 2 H (LC 15.1 y 18.8 mm) (EMU-4037-B). TALUD VIII, Est. 9, 17/abr/2005, 2 M (LC 15.4 y 10.9 mm) y 3 H (LC 10.1-12.2 mm), 1650 m (EMU-8227). TALUD VIII, Est. 11, 17/abr/2005, 1 NS (LC 9.6 mm), 920 m (EMU8150). TALUD XII, Est. 23, 1/abr/2008, 1058-1088 m: 15 M (LC 18.2 – 13.5 mm), 1 H (LC 18.0 mm), 1 HH (LC 20.2 mm) y 2 juv. (LC 7.2 – 7.6 mm) (EMU-8806); 1 M y 1 H, no medidos (OUMNH.ZC.2010-08-0007). Distribución.- Desde bahía Santa María, Sinaloa, hasta el banco de Mancora, Perú; cerca de las islas Tres Marías y Galápagos (Wicksten y Hendrickx 2003). Entre 1016 y 1246 m (Hendrickx 1996). Se extiende la distribución batimétrica de esta especie entre 920 y 1650 m (material del TALUD). Registros previos en México.- Faxon (1895): “Albatross” 3424 (Tres Marías; 21°15’N, 106°23’O), 3425 (21°19’N, 106°24’O). El material del TALUD III, frente a la costa sureste del golfo de California, fue citado previamente por Hendrickx (1996, 2001) (Fig. 4). Nuevos registros.- Los registros del material del TALUD VIII (frente a la costa este de la península de Baja California) y del TALUD XII (ca 65 km al SE de Manzanillo), son nuevos para esta especie en aguas mexicanas. El material del TALUD XII es también el primer registro de P. areolata entre el sur del golfo de California y Perú desde su descripción en 1893 (Fig. 4). 328 Biodiversidad y comunidades del talud continental del Pacífico mexicano Parapontophilus Christoffersen, 1988 Parapontophilus occidentalis (Faxon, 1893) (Fig. 5 A) Pontophilus occidentalis Faxon, 1893: 200; 1895: 131, Lám. D, fig. 2-2d.Wicksten 1977: 963.- Méndez 1981: 121, lám. XLVII, figs. 351-353.- Hendrickx 1995: 439 (clave, fig. 2).- Retamal y Jara 2002, 204 (lista). Pontophilus gracilis occidentalis.- Wicksten 1989: 303, 304 (cuadro 1), 313 (lista).- Wicksten y Hendrickx 1992: 6 (lista); 2003: 69 (lista). Parapontophilus occidentalis.- Komai 2008: 287, figs. 8, 20D. Material examinado.- TALUD VII, Est. 34B, 9/jun/2001, 1500-1520 m: 1 NS (LC 6.0 mm) (EMU-8210-A); 1 H (LC 8.2 mm) (EMU-8210-C). TALUD VIII, Est. 3, 16/abr/2005, 1100 m: 1 HH (LC 11.9 mm) y 3 NS (LC 9.3 – 12.3 mm) (EMU-8151); 1 H (LC 11.4 mm) (EMU-8210-B). TALUD X, Est. 22, 13/feb/2007, 1575-1586 m: 2 HH (LC 14.6 mm) (EMU-8098); 7 NS (LC 8.6 – 12.8 mm) (EMU-8153). Figura 5. Parapontophilus occidentalis (Faxon, 1893). A, vista dorsal. Sclerocrangon atrox Faxon, 1893. B, vista lateral; C, vista dorsal. (A, según Méndez 1981; B, C, según Faxon 1895). B A C L os G lyphocrangonidae y C rangonidae (C rustacea : D ecapoda : C aridea ) 329 Figura 6. Distribución de Parapontophilus occidentalis (Faxon, 1893) y de Sclerocrangon atrox Faxon, 1893 frente a las costas de México. Los triángulos corresponden a los registros previos (véase texto). TALUD X, Est. 25, 14/feb/2007, 1 M (LC 12.1 mm), 837-840 m (EMU8210-D). Distribución.- Desde California del sur hasta el norte de Chile (Wicksten y Hendrickx 2003). Entre 1789 y 4082 m (Wicksten 1989). Se extiende el valor mínimo del intervalo batimétrico superior de esta especie hasta 939 m (material del TALUD). Registros previos en México.- A pesar de incluir México en su intervalo general de distribución, no hay registros previos de P. occidentalis en aguas mexicanas. Nuevos registros.- Golfo de California central, sureste y suroeste (Fig. 6). Comentario.- Komai (2008) revisó el género Parapontophilus a nivel mundial, validando un total de 18 especies. De Grave y Fransen (2011) consideran el mismo número de especies. De éstas, P. occidentalis es la única presente en el Pacífico este (De Grave y Fransen 2011). 330 Biodiversidad y comunidades del talud continental del Pacífico mexicano Sclerocrangon G.O. Sars, 1883 Sclerocrangon atrox Faxon, 1893 (Fig. 5 B, C) Sclerocrangon atrox Faxon 1893: 199; 1895: 132, lám. XXXV.- Méndez 1981: 121, lám. XLVII, figs. 355, 356.- Wicksten 1989: 303, 304 (cuadro 1), 313 (lista).- Hendrickx 1995: 439 (clave, fig. 3), 442 (texto); 2001: 97, 103 (cuadro); 2005: 169.- Wicksten y Hendrickx 1992: 6 (lista); 2003: 69 (lista).Retamal y Jara: 2002, 204 (lista). Material examinado.- TALUD IV, Est. 13, 29/ago/2000, 1 M (LC 28.0 mm), 860 m (EMU-5982-A). TALUD IV, Est. 19, 25/ago/2000, 1 M (LC 24.8 mm), 1245 m (EMU5982-B). TALUD VI, Est. 12, 14/mar/2001, 1 M (LC 24.8 mm), 1050-1160 m (EMU-5983). TALUD VI, Est. 34, 17/mar/2001, 1 M (LC 23.9 mm) y 4 H (LC 11.5-19.8 mm), 1240-1270 m (EMU-6001). TALUD VII, Est. 19, 7/jun/2001, 3 H (LC 10.3 mm), 1160-1180 m (EMU8804). TALUD XII, Est. 27, 2/abr/2008, 1040-1095 m: 4 H (LC 7.8 – 14.8 mm) y 1 juv (LC 5.5 mm) (EMU-8801); 8 H (LC 13.0 – 21.7 mm) (EMU-8803). TALUD XII, Est. 28, 2/abr/2008, 1 H (LC 9.2 mm) y 1 juv (LC 5.6 mm), 1101-1106 m (EMU-8802). Distribución.- Frente a Sinaloa (24°15’18”N, 108°24’06”O) y hasta Mollendo, Perú; islas Tres Marías (Wicksten y Hendrickx 2003). Entre 800 y 1250 m (Hendrickx 1995). Se extiende la distribución batimétrica de esta especie hasta 1575-1586 m (material del TALUD). Registros previos en México.- “Albatross”, Ests. 3418 (frente a Acapulco; 16°33’N, 99°53’O) y 3424 (frente a las islas Tres Marías; 21°15’N, 106°23’O) (Faxon 1895). Frente a Cabo San Lucas (sin coordenadas) y al este de isla Carmen (25°56’N, 110°35’O) (SCRIPPS, 1992). El material del TALUD IV, frente a la costa sureste del golfo de California, fue citado previamente por Hendrickx (2001) (Fig. 6). Nuevos registros. El material del TALUD VI, Est. 34, representa un ligero incremento del limite norte de esta especie (de 24°15’18”N a 25°43’48”N). El maL os G lyphocrangonidae y C rangonidae (C rustacea : D ecapoda : C aridea ) 331 terial recolectado durante el TALUD XII (18°40’28”N y 18°50’19”N) confirma la presencia de S. atrox entre Acapulco y el sur del golfo de California (Fig. 6). Glyphocrangonidae Dentro de la familia Glyphocrangonidae se encuentran los camarones Caridea e incluyen solamente especies bentónicas de aguas profundas (> 200m) o muy profundas (> 1000m). Son especies generalmente de tamaño mediano a grande, con un caparazón fuerte y armado con carinas longitudinales y series variables de espinas o tubérculos. Esta familia contiene un solo género, Glyphocrangon A. Milne Edwards, 1881. Hasta 1984 este género de camarones contenía solamente 38 especies (Chace 1984), pero el incremento de las actividades de muestreo en aguas profundas en la década de los 90 y a principio del siglo XXI ha tenido como resultado un aumento espectacular del número de especies conocidas a la fecha: 88, más del doble en un poco más de 20 años (Komai 2004c, Hendrickx 2010, De Grave y Fransen 2011). Las especies de Glyphocrangon del Pacífico este son mal conocidas, en particular en lo que se refiere a su biología, ecología, abundancia y distribución. Históricamente, las mayores capturas en esta región fueron aquellas realizadas por el barco “Albatross” en fecha. Al estudiar el material recolectado durante estas campañas, Faxon (1893, 1895, 1896) reconoció cinco especies nuevas (G. alata Faxon, 1893; G. sicaria Faxon, 1893; G. spinulosa Faxon, 1893; G. loricata Faxon, 1895 y G. vicaria Faxon, 1896). Otra especie, G. rimapes Spence Bate, 1888, descrita para el Atlántico oeste, ha sido encontrada en el Pacífico este, en las cercanías de las islas Juan Fernández (Wicksten 1989). De acuerdo con Komai (2004a: 378), una especie adicional de Glyphocrangon, incluida de forma errónea en la serie tipo de G. rimapes recolectada por el “Challenger”, cerca de Juan Fernández, Chile, pertenece a otra especie pendiente de ser descrita. Finalmente, Hendrickx (2010) describió una especie adicional dentro de este género, G. taludensis Hendrickx, 2010, capturada durante el proyecto TALUD. Además de las descripciones originales y la información proporcionada por Komai (2004a, 2004b), los datos adicionales disponibles acerca de la distribución de las especies de Glyphocrangon en el Pacífico este han sido proporcionados por Wicksten (1979), Retamal (1981), Méndez (1981) y Hendrickx (2001) (nuevos registros, aspectos taxonómicos y distribución), y por Hendrickx (2004), quien aporta más información acerca de G. spinulosa. 332 Biodiversidad y comunidades del talud continental del Pacífico mexicano Cuadro 2. Especies de Glyphocrangonidae (género Glyphocrangon) distribuidas en aguas profundas de América (A. M-E., A. Milne-Edwards). Fuentes: Pequegnat (1970); Abele y Kim (1986); Ramos-Porto y Alves Coelho (1998); y Wicksten y Hendrickx (2003). Lado del Pacífico G. alata Faxon, 1893 G. loricata Faxon, 1895 G. rimapes Spence Bate, 1888 G. sicaria Faxon, 1893 G. spinulosa Faxon, 1893 G. vicaria Faxon, 1896 G. taludensis Hendrickx, 2010 G. wagini Burukovsky, 1990 Área México-Chile Lado del Atlántico G. aculeata A. M-E., 1881 México-Perú G. alispina Chace, 1939 Chile* G. atlantica Chace, 1939 México-Panamá G. rimapes Spence Bate, 1888 California-Panamá G. longirostris (S.I. Smith, 1882) California; Galápagos G. nobilis A. M-E., 1881 México G. spinicauda A. M-E., 1881 Chile (Placa de G. sculptus (S.I. Gómez-y-Sala) (**) Smith, 1882) G. longleyi Schmitt, 1931 G. haematonotus Holthuis, 1971 G. aurantiaca Holthuis, 1971 G. neglecta Faxon, 1896 Área Delaware-Brasil (G. de México) G. de México y Caribe Argentina* Georgia-G. de México G. de México-W. Indies USA-Brasil Groenlandia-G. de México USA-Colombia (G. de México) USA-Colombia NE Sur-América Panamá hasta Surinam; Jamaica * También citada en Japón. ** Muy alejada de la costa de Chile. Sobre la base de lo anterior, en el Pacífico americano se registran siete especies de Glyphocrangon encontradas, en su mayoría, entre los trópicos (México hasta el norte de Perú). Comparativamente, en el Atlántico americano, se conocen 12 especies (Cuadro 2). Una de éstas, G. rimapes, es común a ambas costas en el hemisferio sur. Sin embargo, de acuerdo con Holthuis (1971) el estatuto de esta especie es incierto y, desde su descripción original (basada en sólo cuatro espeL os G lyphocrangonidae y C rangonidae (C rustacea : D ecapoda : C aridea ) 333 Figura 7. Esquema del caparazón de Glyphocrangon en vista lateral, con la ubicación y la nomenclatura de las carinas y espinas (según Chace 1984). CARINAS. 1 ant, 1 post: carinas submedianas anterior y posterior; 2 ant, 2 post: mismas, intermedias; 3 ant, 3 post: mismas, antenales; 4 ant, 4 post: mismas, laterales; 5 ant, 5 post: mismas, sublaterales; 6, carina submarginal; 7, carina marginal. ANGULO, DIENTE Y ESPINAS. plAng, ángulo posterolateral; antlSp, espina antenal; brSp, espina branquiostegal; latT, diente rostral lateral. SURCOS. antrGr, surco anterior; cvGr, surco cervical; latGr, surco lateral; lmGr, surco lateromarginal; pmGr, surco posteromarginal. címenes capturados en Japón, en las islas Juan Fernández y en Atlántico sur, éste último siendo el holotipo, no se ha señalado material nuevo. Glyphocrangon A. Milne Edwards, 1881 La taxonomía del género Glyphocrangon ha sido relativamente estable a lo largo de los años. De hecho, todas las especies salvo dos fueron descritas originalmente en el género Glyphocrangon al final del siglo XIX (1881-1893) o a principio del siglo XX y, hasta la fecha, no se han reconocido caracteres morfológicos suficientes para subdividir este género. Las dos especies descritas por Smith (1882) fueron incluidas originalmente en el género Rhachocaris S.I. Smith, 1882, un sinónimo “junior” de Glyphocrangon por estar establecida sobre la base de una especie, Rhachocaris agassizi S.I. Smith, 1882, que resultó ser un sinónimo de Glyphocrangon aculeatum A. Milne-Edwards, 1881. En su revisión de las especies de Glyphocrangonidae y Crangonidae de la expedición del “Albatross” en las Filipinas (1907-1910), Chace (1984) presenta 334 Biodiversidad y comunidades del talud continental del Pacífico mexicano una clave de todas las especies de Glyphocrangon conocidas en esta época (38 en total) y una figura en la cual se puede apreciar la ubicación y la nomenclatura de las carinas y espinas en este género (véase Fig. 7), caracteres considerados diagnósticos. De hecho, esta figura es adaptada de un trabajo anterior de Holthuis (1971) en el cual este eminente carcinólogo definió la posición y la nomenclatura de estas carinas y espinas. Este sistema sigue vigente hasta el día de hoy. La mayor contribución reciente al estudio de las especies de Glyphocrangon se debe a T. Komai y sus colaboradores. Junto con algunos otros autores quienes describieron una amplia serie de nuevas especies después de 1994 (véase Komai y Takeuchi 1994, Takeda y Hanamura 1994, Brand y Takeda 1996, Burukovsky 2004, Komai 2004a, 2004c, 2005, 2006, 2007, Komai y Chan 2008), T. Komai emprendió la revisión del grupo (2004a), incluyendo una nueva descripción de varias especies que estaban mal conocidas. Es de notar que, a pesar de este notable aumento en el número de especies de Glyphocrangon, después de 1994, ninguna especie nueva fue descrita para el Pacífico este hasta muy recientemente, con el descubrimiento de G. taludensis en aguas mexicanas. Anteriormente a esta fecha, solo una especie había sido agregada a la fauna del Pacífico americano en el siglo XX, G. waginii Burukovsky, 1990, recolectada en la cordillera de Sala-y-Gómez, frente a Chile (Hendrickx 2010). La descripción de esta especie (Burukovsky 1990) es en ruso y las ilustraciones proFigura 8. Glyphocrangon sicaria Faxon, 1893. A, vista lateral; B, vista dorsal. Glyphocrangon alata Faxon, 1893. C, vista lateral; D, vista dorsal. (Según Faxon 1895). A C B D L os G lyphocrangonidae y C rangonidae (C rustacea : D ecapoda : C aridea ) 335 puestas son muy semejantes a G. loricata, conocida del área de las Galápagos, por lo que se considera que ambas especies podrían ser sinónimos. Clave de las especies de Glyphocrangon del Pacífico americano (modificada de Chace 1984). Las especies mexicanas están representadas en negritas. 1.Rostro con tres o más de tres pares de dientes laterales adelante del surco anterior del caparazón........................................................................................................2 Rostro con dos o menos de dos pares de dientes laterales adelante del surco anterior del caparazón................................................................................................5 2.Parte anterior de la cuarta carina (lateral) expandida y formando una amplia lámina aguda, comprimida verticalmente, dirigida anterolateralmente y rebasando el nivel del margen posterior de la órbita.....................................................3 Parte anterior de la cuarta carina (lateral) no expandida en una amplia lámina anterolateral que rebasa el nivel del margen posterior de la órbita..........................4 3. Rostro con 4 a 6 pares de dientes laterales; cuarta carina anterior (lateral) con dientes posteriores, cerca del surco lateral; carina más grande del caparazón aserrada, en parte oscurecida por numerosas líneas de tubérculos en el espacio entre las carinas..............................................................................................G. alata Rostro con 3 pares de dientes laterales; cuarta carina anterior (lateral) sin dientes posteriores; carina más grande del caparazón completa o algo irregular, nunca aserrada, y no oscurecida por tubérculos en el espacio entre las carinas........... ................................................................................................................G. loricata (1) 4. Rostro con 6-7 pares de dientes laterales; parte posterolateral de la espina antenal espinulosa..........................................................................................G. spinulosa Rostro con 3 pares de dientes laterales; parte posterolateral de la espina antenal sin espínulas.........................................................G. rimapes (Atlántico y Pacífico) 5. Sin tubérculos entre las carinas laterales posteriores del caparazón; ojos grandes; dos dientes laterales bien desarrollados en el rostro................G. taludensis Tubérculos presentes entre las carinas laterales posteriores del caparazón; ojos pequeños; dientes laterales del rostro obsoletos o ausentes................................6 6. Parte anterior de la segunda carina (intermedia) compuesta de tubérculos romos; espina antenal subparalelas entre sí, muy poco o nada divergentes con respecto a las espinas branquiostegales....................................................G. sicaria Parte anterior de la segunda carina (intermedia) compuesta de espinas y tubérculos; espina antenal proyectándose, mucho más divergente que las espinas branquiostegales..........................................................................................G. vicaria 336 Biodiversidad y comunidades del talud continental del Pacífico mexicano (1) Glyphocrangon wagini Burukovsky, 1990, es considerada aquí como un posible sinónimo “junior” de G. loricata Faxon, 1895. Figura 9. Distribución de Glyphocrangon alata Faxon, 1893, G. sicaria Faxon, 1893, y G. taludensis Hendrickx, 2010, frente a las costas de México. El triángulo corresponde a un registro previo (véase texto). Glyphocrangon alata Faxon, 1893 (Fig. 8 C, B) Glyphocrangon alata Faxon 1893: 201; 1895: 137, lám. XXXVII.- Wicksten 1979: 218, fig. 1A-C, 224 (clave); 1989: 303, 304 (cuadro 1), 313 (lista).Méndez 1981: 116 (clave), lám. XLVI, figs. 343-345.- Retamal 1981: 15.Chirichigno et al. 1982: 380.- Wicksten y Hendrickx 1992: 6 (lista); 2003: 69 (lista).- Hendrickx 1995: 445 (clave), 446 (texto).- Retamal y Jara 2002: 205 (lista). Material examinado.- TALUD XII, Est. 10, 29/mar/2008, 1180-1299 m 14 M (14.5 – 23.3 mm), 13 H (LC 15.9 – 25.4 mm) y 3 HH (LC 26.1 – 30.6 mm), (EMU-8797). L os G lyphocrangonidae y C rangonidae (C rustacea : D ecapoda : C aridea ) 337 TALUD XII, Est. 27, 2/abr/2008, 1 H (LC 17.0 mm), 1 HH (LC 33.6 mm), 1040-1095 m (EMU-8796). Distribución.- Desde Acapulco, México, hasta Valparaíso, Chile (Wicksten y Hendrickx 2003). Entre 600 y 1325 m (Wicksten 1989; Hendrickx 1995). Hasta 18º 40’ 28’’ N (material del TALUD). Registros previos en México.- Faxon (1895) señala material de esta especie capturado en la Est. 3418 del “Albatross”, frente a Acapulco (16°33’N, 99°53’O) (Fig. 9). Nuevos registros- El material del TALUD XII corresponde a dos estaciones ubicadas frente al norte del estado de Michoacán (ca 18°40’N; nuevo limite norte de distribución) y al norte de Acapulco (Fig. 9). Glyphocrangon sicaria Faxon, 1893 (Fig. 8 A, B) Glyphocrangon sicaria Faxon 1893: 202; 1895: 144, lám. XXXIX.- Wicksten 1979: 218, fig. 2A-B, 224 (clave); 1989: 303 (cuadro 1), 314 (lista).- Wicksten y Hendrickx 1992: 6 (lista); 2003: 69 (lista).- Hendrickx 1995: 445 (clave), 448 (texto); 2001: 99, 103 (cuadro 3) (en parte; véase en G. taludensis). Figura 10. Glyphocrangon taludensis Hendrickx, 2010. A, vista dorsal; B, vista lateral. Glyphocrangon spinulosa Faxon, 1893. C, vista lateral; D, vista dorsal. (A, B, según Hendrickx 2010; C, D, según Faxon 1895). A C B D 338 Biodiversidad y comunidades del talud continental del Pacífico mexicano Material examinado.- TALUD IV, Est. 14, 24/ago/2000, 1 juv., 2150-2160 m (EMU-5975). Distribución.- Frente a Sinaloa (24°56’24”N, 109°05’24”O)y hasta el golfo de Panamá (Wicksten y Hendrickx 2003). Entre 1454 y 3310 m (Wicksten 1989). Registros previos en México.- Hasta la fecha, el registro del TALUD IV frente a Sinaloa (un juvenil) (Fig. 9) es el único disponible para México y su identificación es dudosa. Por lo tanto, no se puede confirmar la presencia de G. sicaria en aguas mexicanas hasta encontrar algunos especímenes adultos que correspondan, sin lugar a dudas, a la descripción original de Faxon (1893). Glyphocrangon spinulosa Faxon, 1893 (Fig. 10 C, D) Glyphocrangon spinulosa Faxon 1893: 202; 1895: 138, lám. XXXVIII.Wicksten 1979: 220, fig. 3A-B, 224 (clave); 1989: 303 (cuadro 1), 314 (lista); Wicksten y Hendrickx 1992: 6 (lista); 2003: 70 (lista).- Hendrickx 1995: 445 (clave), 447 (texto); 1996: 945; 2001: 102 (cuadro 3), 104 (cuadro 4); 2004: 1025-1034 (passim); 2005: 170. Material examinado.- TALUD III, Est. 10A, 18/ago/1991, 1 H (LC 22.1 mm) y 1 HH (LC 29.7 mm), 968 m (EMU-4045). TALUD III, Est. 14B, 19/ago/1991, 1 H (LC 16.9 mm), 1188-1208 m (EMU-4430). TALUD III, Est. 24A, 24/ago/1991, 2 HH (LC 26.9 y 29.4 mm) y 2 H (LC 26.8 y 27.9 mm), 1027-1060 m (EMU-4046). TALUD IV, Est. 19, 25/ago/2000, 2 H (LC 22.8 y 23.0 mm), 1245 m (EMU5974-A). TALUD IV, Est. 26, 26/ago/2000, 3 H (LC 16.8-19.1 mm) y 1 HH (LC 27.1 mm), 1200-1274 m (EMU-5533). TALUD V, Est. 19, 15/dic/2000, 1 M (LC 15.1 mm) y 7 H (17.8-26.4 mm), 1180-1200 m (EMU-5974-B). TALUD V, Est. 26, 16/dic/2000, 1 M (LC 19.4 mm), 6 H (LC 20.5-25.3 mm) y 2 HH (LC 26.4 y 27.7 mm), 1280-1310 m (EMU-5973). TALUD VI, Est. 12, 14/mar/2001, 1 M (LC 20.2 mm), 1050-1160 m (EMU-5965-A). TALUD VI, Est. 19, 15/mar/2001, 1 H (LC 20.7 mm), 1160-1200 m (EMU5965-B). L os G lyphocrangonidae y C rangonidae (C rustacea : D ecapoda : C aridea ) 339 TALUD VI, Est. 34, 17/mar/2001, 3 M (LC 19.9-22.8 mm), 6 H (LC 13.530.4 mm) y 2 HH (LC 29.3 y 31.7 mm), 1240-1270 m (EMU-5964). TALUD VII, Est. 12, 6/jun/2001, 1 HH (LC 31.1 mm), 1040-1120 m (EMU-5962-A). TALUD VII, Est. 19, 7/jun/2001, 1 M (LC 22.5 mm), 1160-1180 m (EMU- 5962-B). TALUD VII, Est. 26, 8/jun/2001, 1 M (LC 21.7 mm) y 1 H (LC 25.0 mm), 1180-1220 m (EMU-5962-C). TALUD VII, Est. 33B, 9/jun/2001, 2 M (LC 22.1 y 23.4 mm) y 4 H (LC 17.6-29.5 mm), 1260-1300 m (EMU-5963). TALUD VIII, Est. 10, 17/abr/2005, 1 M (LC 22.3 mm), 2 H (LC 20.0 – 21.0 mm), 1422-1623 m (EMU-8207). TALUD IX, Est. 10, 12/nov/2005, 3 H (LC 27.8 – 32.4 mm) y 2 HH (LC 27.0 mm), 966-997 m (EMU-8239). TALUD IX, Est. 20B, 14/nov/2005, 1 H (LC 29.5 mm), 1229-1343 m (EMU-8230). TALUD IX, Est. 21B, 14/nov/2005, 1 M (LC 23.4 mm), 1349-1361 m (EMU-8247). Figura 11. Distribución de Glyphocrangon spinulosa Faxon, 1893, frente a las costas de México. Los triángulos corresponden a los registros previos (véase texto). 340 Biodiversidad y comunidades del talud continental del Pacífico mexicano TALUD X, Est. 4, 9/feb/2007, 2 M (LC 18.1 – 19.4 mm), 1 H (LC 23.0 mm), 587-633 m (EMU-8117). TALUD X, Est. 18, 12/feb/2007, 1526 m: 1 M (LC 18.7 mm) y 2 HH (LC 31.6 – 32.4 mm) (EMU-8105); 1 M (LC 18.6 mm) y 2 H (LC 17.2 – 19.8 mm) (EMU-8208). TALUD X, Est. 22, 13/feb/2007, 1575-1586 m: 2 NS (LC 22.0 – 26.1 mm) (EMU-8096), 3 juvs. (LC 6.8-10.7 mm) (EMU-8100) y 2 juvs. (LC 8.410.7 mm) (EMU-8101). TALUD XII, Est. 10, 29/mar/2008, 5 M (20.9 – 27.6 mm), 2 H (LC 20.6 – 27.0 mm) y 3 HH (LC 30.8 – 35.2 mm), 1180-1299 m (EMU-8792). TALUD XII, Est. 27, 2/abr/2008, 1040-1095 m: 5 H (LC 24.0 – 32.3 mm) y 7 HH (LC 27.4 – 34.3 mm) (EMU-8795); 1 M (LC 10.2 mm), 7 H (LC 8.6 – 15.4 mm) y 22 juvs. (LC 6.0 – 8.3 mm) (EMU-8800); 4 H (LC 10.3 – 19.4 mm) (EMU-8805); 1 M y 1 H, no medidos (OUMNH.ZC.2010-08-0001). TALUD XII, Est. 28, 2/abr/2008, 1575-1586 m: 3 M (LC 18.0 – 24.7 mm), 22 H (LC 17.8 – 35.4 mm) y 11 HH (LC 26.0 – 35.5 mm) (EMU-8791); 5 M (LC 18.8 – 23.1 mm) y 6 H (LC 20.3 – 27.6 mm) (EMU-8793); 4M (LC 13.8 – 17.4 mm), 14 H (LC 10.9 – 20.5 mm) y 2 NS (LC 11.6 – 14.7 mm) (EMU8794). Distribución.- Desde la cuenca de Cortez, California, USA, hasta Panamá, incluyendo el SE del golfo de California (hasta frente a Ahome). Entre 956 y 1586 m (Hendrickx 1996). Golfo de California central (material del TALUD). Registros previos en México.- Faxon (1895) cita registros de G. spinulosa en las estaciones “Albatross” 3418, 3419 (frente a Acapulco; 16°33’N, 99°53’O y 16°34’N, 100°03’O), 3424, 3425 (cerca de las islas Tres Marías; 21°15’N, 106°23’O y 21°19’N, 106°24’O) y 3435 (en el golfo de California; 26°48’N, 110°45’O). Wicksten (1979) señala la presencia de esta especie frente a Cabo San Lucas (sin proporcionar coordenadas) y cita material adicional de la colección de SCRIPPS. Estos registros adicionales corresponden a localidades frente a isla Tortuga (27°26.2’N, 111°48.5’O), a isla Lobos (27°15’N, 111°27’O) y a punta Chivato (27°17’N, 111°25’O) (SCRIPPS 1992). A estos registros se agregan 24 localidades correspondiendo a los cruceros TALUD (Fig. 11). L os G lyphocrangonidae y C rangonidae (C rustacea : D ecapoda : C aridea ) 341 Figura 12. Glyphocrangon rimapes Bate, 1888. A, vista lateral. Glyphocrangon vicaria Faxon, 1896. B, vista lateral; C, vista dorsal. (A, según Retamal 1981; B, C, según Faxon 1895). A B C Glyphocrangon taludensis Hendrickx, 2010 (Fig. 10 A, B) Glyphocrangon taludensis Hendrickx 2010: 359, figs. 1-3. Material examinado.- TALUD VII, St. 13B, 6/jun/2001, 1400-1450 m: 1 M (LC 21.2 mm) (EMU-8596), 1 H (LC 27.5 mm) (EMU-8601) y 2 HH (LC 28.1 – 28.4 mm) (EMU-8604). TALUD VII, St. 25, 8/jun/2001, 1 HH (LC 28.3 mm), 780-850 m (EMU8602). TALUD XII, St. 25, 1/abr/2008, 1858-1879 m: 1 HH (LC 34.3 mm) (EMU8595), 2 HH (LC 32.4-35.1 mm) (EMU-8597) y 1 HH (LC 39.3 mm) (EMU8598). TALUD XII, St. 29, 2/abr/2008, 1609-1643 m: 1 M (LC 19.0 mm) (EMU8600) y 3 HH (LC 26.5 – 29.4 mm) (EMU-8599, 8603). Distribución.- Entre 780 y 1879 m. El material utilizado en la descripción original fue recolectado frente a Sinaloa y al sur de Manzanillo, Colima (Hendrickx 2010) (Fig. 9). Registros previos en México.- Aquellos citados por Hendrickx (2010). Comentarios.- El material citado por Hendrickx (2001: 99, 103, cuadro 3) 342 Biodiversidad y comunidades del talud continental del Pacífico mexicano Cuadro 3. Especies de Crangonidae y Glyphocrangonidae recolectadas en los cruceros TALUD por estaciones. Se indican las profundidades y concentraciones de oxígeno disuelto (O2) registradas en cada estación. Crucero TALUD III TALUD III TALUD III TALUD III TALUD IV TALUD IV TALUD IV Est. 10A 14A 14B 24A 13 14 19 TALUD IV 26 TALUD V TALUD V TALUD VI 19 26 12 TALUD VI TALUD VI 19 34 TALUD VII TALUD VII TALUD VII 12 13B 19 TALUD VII TALUD VII TALUD VII TALUD VII TALUD VIII TALUD VIII TALUD VIII TALUD VIII TALUD IX TALUD IX 25 26 33B 34B 3 9 10 11 10 20B Especies Glyphocrangon spinulosa Paracrangon areolata Glyphocrangon spinulosa Glyphocrangon spinulosa Sclerocrangon atrox Glyphocrangon sicaria Sclerocrangon atrox Glyphocrangon spinulosa Glyphocrangon sicaria Glyphocrangon spinulosa Glyphocrangon spinulosa Glyphocrangon spinulosa Sclerocrangon atrox Glyphocrangon spinulosa Glyphocrangon spinulosa Sclerocrangon atrox Glyphocrangon spinulosa Glyphocrangon spinulosa Glyphocrangon taludensis Sclerocrangon atrox Glyphocrangon spinulosa Glyphocrangon taludensis Glyphocrangon spinulosa Glyphocrangon spinulosa Pontophilus occidentalis Pontophilus occidentalis Paracrangon areolata Glyphocrangon spinulosa Paracrangon areolata Glyphocrangon spinulosa Glyphocrangon spinulosa Prof. (m) 968 1010 1198 1043 860 2220-2250 1245 O2 (ml/l-1) ND 0.4 0.4 ND ND 2.44 0.73 1200-1274 0.76 1180-1200 1280-1310 1050-1160 0.38 0.53 0.50 1160-1200 1240-1270 0.73 0.80 1040-1120 1400-1450 1160-1180 0.27 1.04 0.10 780-850 1180-1220 1260-1300 1500-1520 1100 1650 1500 920 966-997 1229-1343 0.05 0.35 0.60 0.73 0.39 0.84 ND 0.20 0.11 0.57 L os G lyphocrangonidae y C rangonidae (C rustacea : D ecapoda : C aridea ) 343 Cuadro 3. Continúa. Crucero TALUD IX TALUD X TALUD X TALUD X Est. 21B 4 18 22 TALUD X TALUD XII Especies Prof. (m) 1349-1361 587-633 1526 1575-1586 O2 (ml/l-1) 0.57 0.38 0.59 0.85 25 10 837-840 1180-1299 0.18 0.68 TALUD XII 23 1058-1088 0.22 TALUD XII TALUD XII 25 27 1858-1879 1040-1095 1.38 0.26 TALUD XII TALUD XII 28 29 1101-1106 1609-1643 0.36 1.38 como Glyphocrangon sicaria (espécimen pequeño y dañado de la Est. 26 del TALUD IV) pertenece muy probablemente a G. taludensis. Glyphocrangon vicaria Faxon, 1896 (Fig. 12 B, C) Glyphocrangon vicaria Faxon 1896: 159.- Wicksten 1979: 221, fig. 4 A, B.Hendrickx 1995: 448 (figuras). Material examinado.- Ninguno. Distribución previa.- Desde la isla San Clemente, California, EE.UU., hasta las islas Galápagos (Wicksten y Hendrickx 2003). Entre 938 y 3800 m (Wicksten 1979). Entre 1374 y 2441 m (Wicksten 1989). Registros previos en México.- Frente a Baja California (31°24’N, 120°12’O) (Wicksten 1979). Frente a Baja California (30°49’N, 116°51’O; 31°04’N, 344 Biodiversidad y comunidades del talud continental del Pacífico mexicano 118°O; 31°18’N, 117°25’O; 31°18’N, 117°37’O; 31°25’N, 117°45’O), frente a isla Cedros (28°49’N, 115°44’O) y frente a Cabo San Lucas (22 41.8N, 110 15’O) (SCRIPPS 1992). Comentarios.- El único registro conocido entre las islas Galápagos y Baja California, México parece ser aquel de Costa Rica (“Velero IV”, Est. 18932) (Wicksten 1979). Además de las especies recolectadas durante las campañas TALUD, el género Glyphocrangon está representado en el Pacífico este por otras dos especies: G. rimapes y G. loricata (Cuadro 2). Por su distribución muy sureña, es poco probable que la primera (Fig. 12 A) se encuentre en aguas mexicanas. En cambio, la segunda (Fig. 13 A, B) es conocida desde México (frente a Acapulco) hasta Perú pero no apareció en los muestreos del TALUD. Glyphocrangon waginii solo se conoce de la placa de Gómez-y-Salas (Cuadro 2) (Fig. 13 C, D). Frecuencia de aparición de las especies Considerando un total de 49 muestras de Crangonidae y Glyphocrangonidae recolectados a lo largo de las campañas de muestreo del proyecto TALUD, la especie con mayor frecuencia de aparición fue Glyphocrangon spinulosa (24 de 49 muestras o 49 %), seguida de Sclerocrangon atrox (14 %) (Cuadro 3). Las demás especies tuvieron una frecuencia de aparición baja y se encontraron en 4, 3, 2 o solamente 1 muestra de las 49 obtenidas. Asociación de especies Durante los cruceros TALUD se recolectaron especímenes de Crangonidae o de Glyphocrangonidae en 37 estaciones de muestreo (Cuadro 3). Sin embargo, en la mayoría de los casos (27 de 37) solamente apareció una especie en la muestra. En los demás casos (10), se recolectaron dos (8 casos) o tres (2 casos) especies. Glyphocrangon spinulosa fue la especie que se encontró más frecuentemente asociada con por lo menos otra especie más (8 de 10 casos), seguida de Sclerocrangon atrox (5 de 10 casos). De hecho, estas dos especies aparecieron juntas en cinco muestras de un total de diez que contaron con dos o tres especies (Cuadro 3). Metacrangon procax apareció solamente tres veces en las muestras del TALUD, pero en todos los casos fue en asociación con una o dos especies. L os G lyphocrangonidae y C rangonidae (C rustacea : D ecapoda : C aridea ) 345 Figura 13. Glyphocrangon loricata Faxon, 1895. A, vista dorsal; B, vista lateral. G. wagini Burukovski, 1985. C, vista dorsal; D, vista lateral. (A, B, según Faxon 1895; C, D, según Burukovski 1985). A B A C D 346 Biodiversidad y comunidades del talud continental del Pacífico mexicano Figura 14. Intervalo de distribución batimétrica de las especies de Crangonidae y Glyphocrangonidae recolectadas durante los cruceros TALUD. Metacrangon procax Paracrangon areolata Parapontophilus occidentalis Sclerocrangon atrox Glyphocrangon alata Glyphocrangon sicaria Glyphocrangon spinulosa Glyphocrangon taludensis 0 500 1000 1500 2000 2500 Distribución geográfica Exceptuando la zona de influencia de la corriente de California, frente a la costa oeste de la península de Baja California, que no fue muestreada durante este estudio, el material recolectado durante las campañas TALUD cubre una sección muy amplia de las aguas profundas frente a las costas de México. La especie que presentó la mayor cubertura latitudinal fue Glyphocrangon spinulosa, que apareció desde la zona norte del área cubierta por el crucero TALUD X (Est. 4), justo al sur de isla Tiburón, hasta frente a Guerrero (TALUD XII, Est. 10) (Fig. 11). Solo se conocía cinco localidades de captura de esta especie en el Pacífico mexicano, por lo que se incrementó de manera significativa (hasta 29) el número de registros de la misma. Esta especie apareció en los arrastres de todas las campañas, con excepción de la campaña TALUD XI, pero en esta solo se efectuó un arrastre con el trineo bentónico (véase Hendrickx 2012). La distribución de las estaciones donde aparecieron las demás especies es mucho menos homogénea. Por ejemplo, G. taludensis no apareció en las muestras frente a la costa de Baja California (TALUD VIII y IX) y en el golfo de California central (TALUD X) (Fig. 9). En el caso de Paracrangon areolata, esta especie no apareció en el golfo de California central (TALUD X) (Fig. 4) y Parapontophilus occidentalis no apareció en las muestras del crucero TALUD L os G lyphocrangonidae y C rangonidae (C rustacea : D ecapoda : C aridea ) 347 Figura 15. Intervalo de tolerancia a las concentraciones de oxígeno disuelto (ml l-1) observado para las especies de Crangonidae y Glyphocrangonidae recolectadas durante los cruceros TALUD. Metacrangon procax Paracrangon areolata Parapontophilus occidentalis Sclerocrangon atrox Glyphocrangon alata Glyphocrangon sicaria Glyphocrangon spinulosa Glyphocrangon taludensis 0.00 0.50 1.00 1.50 2.00 2.50 XII, en la porción SO de México (Fig. 6). Salvo en el caso de Metacrangon procax donde se igualó el número de capturas previamente registradas para México, en todos los demás casos las especies encontradas en los arrastres de los cruceros TALUD aparecieron en un número mayor de localidades que aquello conocido anteriormente. Distribución batimétrica A pesar de que el intervalo general de muestreo contemplado durante los cruceros TALUD fue de 377 a 2250 m, solo se recolectaron especies de Crangonidae entre 860 y 1650 m de profundidad y especies de Glyphocrangonidae entre 610 y 1879 m de profundidad (Cuadro 3; Fig. 14). Considerando solamente estos muestreos, las especies con el mayor intervalo de profundidad fueron Glyphocrangon taludensis (ca 1100 m de diferencia) y G. spinulosa (970 m de diferencia); la especie con el menor intervalo fue G. alata, con 232 m. Comparativamente con los límites de distribución batimétrica conocidos para estas especies, en el caso de dos de éstas las muestras recolectadas fueron relativamente someras, pues G. sicaria es conocida hasta 3310 m y Parapontophilus occidentalis hasta 4082 m de profundidad (Cuadro 3). También G. sicaria ha sido encontrada en profundidades menores, 348 Biodiversidad y comunidades del talud continental del Pacífico mexicano hasta 1454 m, pero no apareció en las muestras de los cruceros TALUD obtenidas a profundidades inferiores a 2150-2160 m (Cuadro 3; Fig. 14). Tolerancia a ambientes hipóxicos Salvo G. sicaria (una sola medida de oxígeno disponible), todas las especies de Crangonidae y Glyphocrangonidae recolectadas aparecieron en concentraciones de oxígeno disuelto muy variables (Cuadro 3; Fig. 15). Los mayores intervalos corresponden a Glyphocrangon taludensis (1.20 ml l-1) y Sclerocrangon atrox (1.20 ml l-1) y el menor a Glyphocrangon alata (0.26 ml l-1). Salvo el caso de G. sicaria, todas las especies mostraron una fuerte tolerancia a condiciones de hipoxia severas (<0.5 ml l-1). Considerando que el intervalo de concentraciones epibentónicas de oxígeno observado en las localidades donde se realizaron arrastres durante este estudio fue de cerca de 0 hasta 2.66 ml l-1, resulta sorpresivo que 29 de 33 muestras de Crangonidae y Glyphocrangonidae fueron encontradas en valores < 1.0 ml l-1 y 16 de 33 en valores inferiores o iguales a 0. 5 ml l-1 (Cuadro 3; Fig. 15). Discusión A pesar de que la fauna de aguas profundas del golfo de California y frente a la costa SO de México había sido muy poco estudiada antes del inicio de los cruceros TALUD, sorprende el hecho que, salvo en un caso, todas las especies de Crangonidae y Glyphocrangonidae recolectadas ya habían sido descubiertas y descritas en el siglo XIX por Walter Faxon o por Charles Spence Bate. Resalta también el muy bajo número de especies encontradas por estación y, en general, el hecho que no se encontraron congregaciones de especímenes. Dos especies, Glyphocrangon spinulosa (presente en 49 % de las muestras) y Sclerocrangon atrox (14 %) son más características del hábitat profundo (aproximadamente entre 600 y 1900 m) y muestran cierta afinidad para el mismo hábitat, pues salieron a menudo juntas en los arrastres. Glyphocrangon spinulosa es también la especie que presentó la mayor cubertura latitudinal. Durante este proyecto se recolectaron muestras bentónicas con el trineo bentónico entre 377 y 2356 m de profundidad. Aún así, se recolectaron especies de Crangonidae solamente entre 860 y 1650 m y especies de Glyphocrangonidae entre 610 y 1879 m. El límite inferior parece ser congruente con lo que se sabe L os G lyphocrangonidae y C rangonidae (C rustacea : D ecapoda : C aridea ) 349 de estas especies, pero es probable que un incremento en la frecuencia de muestreo permitiría obtener registros en aguas más profundas. Considerando solamente estos muestreos, las especies con el mayor intervalo de profundidad fueron Glyphocrangon taludensis y G. spinulosa. Salvo el caso de G. sicaria, todas las especies mostraron una fuerte tolerancia a condiciones de hipoxia severa. Durante este estudio, ha sido común encontrar otras especies de crustáceos decápodos, de moluscos o de equinodermos con una sorpresiva tolerancia a concentraciones de oxígeno muy bajas (Hendrickx 2001, 2003, Zamorano et al. 2007, Massin y Hendrickx 2011, Hendrickx et al. 2011). En el caso de los Crangonidae y Glyphocrangonidae del Pacífico mexicano, eso indica claramente una fuerte afinidad de estas dos familias de carideos de aguas profundas para condiciones de hipoxia leve a severas. De hecho, junto con las especies de Munidopsis (Munidopsidae) y de Pandalidae (en particular Heterocarpus affinis Faxon, 1893), son el grupo de especies de macrocrustáceos más característicos de las comunidades bentónicas de la parte del TALUD continental ubicada por debajo de la zona del mínimo de oxígeno en las aguas del Pacífico mexicano. Agradecimientos Se agradece la invitación del Instituto Nacional de Ecología, Semarnat, para la elaboración, junto con los colegas que participaron en el proyecto TALUD, de esta obra. El autor agradece a los científicos, estudiantes y miembros de la tripulación que participaron en las Campañas TALUD a bordo del B/O “El Puma”. Este proyecto fue parcialmente apoyado por Conacyt, México (proyecto 31805-N) y DGAPA (proyecto IN-217306-3), UNAM, México. Se agradece el tiempo de uso de buque otorgado por la Coordinación Técnica de la Investigación Científica, UNAM y a los revisores del capítulo por sus comentarios. La edición de esta contribución estuvo a cargo de Mercedes Cordero Ruiz. Referencias Boschi, E.E. 2000. Species of decapod crustaceans and their distribution in the American marine zoogeographic provinces. Revista de Investigación y Desarrollo Pesquero 13: 1-136. Brand, T. y M. Takeda. 1996. Glyphocrangon shrimps from the western Pacific collected by the R/V Hakuho-maru during the KH-72-1 cruise. Bullletin of the National Science Museum, Tokyo, Series A, 22(4): 263-281. 350 Biodiversidad y comunidades del talud continental del Pacífico mexicano Burukovsky, R.N. 1985. Key to shrimps and lobsters. Russian translation series, Vol. 5. A.A. Balkema, Rotterdam. The Netherlands. 174 pp. Burukovsky, R.N. 1990. Shrimps from the Sala-y-Gomez and Nazka Ridges. Trudy Instituta Okeanologii 124: 187-215. Burukovsky, R.N. 2004. The Glyphocrangonidae (Crustacea, Decapoda) from Aden Gulf. Pp. 70-87. En: Nekotorie Problemi Gidrobiologii I Mikrobiologii. Kaliningradskii Goschdarstvennii Tekhicheskii Universitet (en ruso con resumen en inglés). Campos, C., N.H., G.R. Navas S., A. Bermúdez T. y N. Cruz C. 2005. Monografías de Fauna de Colombia. 2. Los Crustáceos decápodos de la franja superior del talud continental (300-500 m) del mar Caribe Colombiano. Universidad Nacional de Colombia, Facultad de Ciencias. Instituto de Ciencias Naturales. Bogotá, Colombia. 272 pp. Chace, Jr. F.A. 1984. The caridean shrimps (Crustacea: Decapoda) of the “Albatross” Philippine Expedition, 1907-1910, Part 2: Families Glyphocrangonidae and Crangonidae. Smithsonian Contributions to Zoology 397: 1-63. Chirichigno, N., W. Fisher y C.E. Nauen. 1982. INFOPESCA. Catálogo de especies marinas de interés económico actual o potencial para América Latina. II. Pacífico Central y Suroriental. SIC/82/2. FAO/PNUD, Roma, Italia. 588 pp. De Grave, S. y C.H.J.M. Fransen. 2011. Carideorum Catalogus: The Recent Species of the Dendrobranchiate, Stenopodidean, Procarididean and Caridean Shrimps. Zoologische Mededelingen 85(9): 195-589. Faxon, W. 1893. Reports on the dredging off the west coast of Central America to the Galapagos, to the West coast of México, and in the Gulf of California, in charge of Alexander Agassiz, carried on by the U.S. Fish Commission steamer “Albatross”, during 1891, lieut. Commander Z.L. Tanner, U.S.N., commanding. VI. Preliminary descriptions of new species of Crustacea. Bulletin of the Museum of Comparative Zoology Harvard University 24 (7): 149-220. Faxon, W. 1895. Reports on an explorations off the west coasts of Mexico, Central and South America, and off the Galapagos Islands to the Gulf of California in charge of Alexander Agassiz, carried on by the U.S. Fish Commission Steamer “Albatross” during 1891. XV. The stalk-eye Crustacea. Memoirs Museum of Comparative Zoology. Harvard 18: 1-292. Faxon, W. 1896. Reports on the results of dredging, under the supervision of Alexander Agassiz, in the Gulf of Mexico and the Caribbean Sea, and on the east coast of the United States, 1877 to 1880, by the U.S. coast survey steamer “Blake”, lieut. Commander C.D. Sigsbee, U.S.N., and commander J.R. Bartlett, U.S.N., commanding. XXXVII. SupplemenL os G lyphocrangonidae y C rangonidae (C rustacea : D ecapoda : C aridea ) 351 tary notes on the Crustacea. Bulletin of the Museum of Comparative Zoology at Harvard College 30 (3): 153-168. Hendrickx, M.E. 1995. Camarones. Pp. 417-537. En: W. Fischer, F. Krupp, W. Schneider, C. Sommer, K.E. Carpenter y V.H. Niem. (Eds.). Guía FAO para la identificación de especies para los fines de la pesca. Pacífico centro-oriental. Vol. I. Plantas e Invertebrados. FAO, Roma, Italia. Hendrickx, M.E. 1996. New records of deep-water decapod crustaceans in the southeastern Gulf of California, Mexico. Revista de Biología Tropical 44 (2B): 945-947. Hendrickx, M.E. 2001. Occurrence of a continental slope decapod crustacean community along the edge of the minimum oxygen zone in the southeastern Gulf of California, Mexico. Belgian Journal of Zoology 131 (Suppl. 2): 95-109. Hendrickx, M.E. 2003. Geographic and bathymetric distributions of species of Munidopsis (Crustacea: Decapoda: Galathaeidae) in the SE Gulf of California, Mexico. Pp. 21-30. En: M.E. Hendrickx (ed.). Contributions to the Study of East Pacific Crustaceans 2. [Contribuciones al Estudio de los Crustáceos del Pacífico Este 2]. Instituto de Ciencias del Mar y Limnología, UNAM. México. Hendrickx, M.E. 2004. Distribution and estimation of body size and weight of four species of deep water shrimps in the SE Gulf of California, Mexico. Crustaceana 76 (9): 1025-1036. Hendrickx, M.E. 2005. Cap. 14. Crustacea 6. Decapoda: Dendrobranchiata, Caridea, Palinura, Anomura y Brachyura. Pp. 159-194. En: Hendrickx, M. E., R. C. Brusca y L. T. Findley (eds.). A Distributional Checklist of the Macrofauna of the Gulf of California, Mexico. Part I. Invertebrates. [Listado y Distribución de la Macrofauna del Golfo de California, México, Parte I. Invertebrados]. Arizona-Sonora Desert Museum. Tucson, Az. USA. Hendrickx, M.E. 2010. A new species of Glyphocrangon (Decapoda: Caridea: Glyphocrangonidae) from off the coast of western Mexico. Zootaxa 2372: 358-366. Hendrickx, M.E. 2012. Operaciones oceanográficas en aguas profundas: los retos del pasado, del presente y del proyecto TALUD en el Pacífico mexicano (1989-2009). Pp. 23104. En: P. Zamorano, M.E. Hendrickx y M. Caso (eds.). Biodiversidad y comunidades del talud continental del Pacífico mexicano. Instituto Nacional de Ecología, Secretaría de Medio Ambiente y Recursos Naturales (Semarnat). Hendrickx, M.E. y F.D. Estrada Navarrete. 1989. A checklist of the species of pelagic shrimps (Penaeoidea and Caridea) from the eastern Pacific with notes on their geographic and depth distribution. CalCofi Reports 30: 104-121. 352 Biodiversidad y comunidades del talud continental del Pacífico mexicano Hendrickx, M.E., C. Mah y C.M. Zárate Montes. 2011. Deep-water Asteroidea (Echinodermata) collected during the TALUD cruises in the Gulf of California, Mexico. Revista Mexicana de Biodiversidad 82: 798-824. Holthuis, L.B. 1971. The Atlantic shrimps of the deep-sea genus Glyphocrangon A. Milne Edwards, 1881. Bulletin of Marine Science 21 (1): 267-373. Holthuis, L.B. 1980. FAO species catalogue. 13. Marine lobsters of the world. An annotated and illustrated catalogue of species of interest to fisheries known to date. FAO Fisheries Synopsis 125: 1-292. Holthuis, L.B. 1993. The recent genera of the caridean and stenopodidean shrimps (Crustacea, Decapoda) with and appendix on the order Amphinidacea. C.H.J.M. Fransen y C. van Achterberg, (eds.). Leiden: Nationaal Natuurhistorisch Museum, The Netherlands. 328 pp. Komai, T. 1997a. A review of the Metacrangon jacqueti group, with descriptions of two new species (Decapoda, Caridea, Crangonidae). Zoosystema 19(4): 651-681. Komai, T. 1997b. Revision of Argis dentata and related species (Decapoda: Caridea: Crangonidae), with description of a new species from the Okhotsk Sea. Journal of Crustacean Biology 17 (1): 135-161. Komai, T. 2004a. A review of the Indo-West Pacific species of the genus Glyphocrangon A. Milne Edwards, 1881 (excluding the G. caeca species group) (Crustacea: Decapoda: Caridea: Glyphocrangonidae). Mémoires du Muséum national d’Histoire naturelle 191: 375-610. Komai, T. 2004 b. A new genus and new species of Crangonidae (Crustacea, Decapoda, Caridea) from the southwestern Pacific. Zoosystema 26(1): 73-85. Komai, T. 2004c. Deep-sea shrimps of the genus Glyphocrangon A. Milne-Edwards (Crustacea, Decapoda, Caridea, Glyphocrangonidae) from off southeastern coast of Brazil collected during the Revizee program. Arquivos do Museu Nacional, Rio de Janeiro 62(1): 31-44. Komai, T. 2005. A distinctive new species of the deep-water shrimp genus Glyphocrangon A. Milne-Edwards (Crustacea: Decapoda: Caridea: Glyphocrangonidae) from southern Australia. Records of the Western Australian Museum 22: 253-258. Komai, T. 2006. Revision of the Glyphocrangon caeca species group (Crustacea, Decapoda, Glyphocrangonidae). Pp. 243-264. En: Richer de Forges, B., y J.-L. Justine (eds.). Tropical Deep-Sea Benthos volume 24. Mémoires du Muséum national d’Histoire naturelle, 193. Komai, T. 2007. A new species of Glyphocrangon (Crustacea, Decapoda, Caridea, Glyphocrangonidae) from the Austral Islands, French Polynesia. Zoosystema 29: 565-573. L os G lyphocrangonidae y C rangonidae (C rustacea : D ecapoda : C aridea ) 353 Komai, T. 2008. A world-wide revision of species of the deep-water crangonid genus Parapontophilus Christoffersen, 1988 (Crustacea, Decapoda, Caridea), with descriptions of ten new species. Zoosystema 30: 261-332. Komai, T. y T.-Y. Chan. 2008. Further records of deep-sea shrimps of the genus Glyphocrangon A. Milne Edwards, 1881 (Crustacea: Decapoda: Caridea) from the Philippines, with descriptions of three new species. The Raffles Bulletin of Zoology 19: 3962. Komai, T. y Takeuchi, I. 1994. Glyphocrangon fimbriata, a new species of caridean shrimp (Crustacea: Decapoda: Glyphocrangonidae) from Sio Guyot, mid-Pacific mountains. Proceedings of the Biological Society of Washington 107 (3): 458-464. Li, X. y J. Poupin. 2009. Report on some species of Palaemonidae (Decapoda: Caridea) from Clipperton Island. Journal of Crustacean Biology 29 (4): 579-594. Massin, C. y ME. Hendrickx. 2011. Deep-water Holothuroidea (Echinodermata) collected during the TALUD cruises off the Pacific coast of Mexico, with the description of two new species. Revista Mexicana de Biodiversidad 82: 19-49. Méndez, M. 1981. Claves de identificación y distribución de los langostinos y camarones (Crustacea: Decapoda) del mar y ríos de la costa del Perú. Boletín del Instituto del Mar de Perú 5: 1-170. Pequegnat, L.H. 1970. Caridean shrimps with description of six new species. Pp. 59-123. En: W.E. Pequegnat y F.A. Chace (eds.). Contributions to the Biology of the Gulf of Mexico. Texas A. & M. University Oceanographic Studies. Houston, Texas. Rathbun, M.J. 1902. Descriptions of new decapod crustaceans from the west coast of North America. Proceedings of the United States National Museum 24 (1272): 885905. Rathbun, M.J. 1904. Decapod crustaceans of the northwest coast of North America. Harriman Alaska Expedition Washington 10: 1-190. Retamal, M.A. 1981. Catálogo ilustrado de los crustáceos decápodos de Chile. Gayana, Zoología 44: 1-110. Retamal, M.A. y C. Jara. 2002. La Carcinología en Chile. Pp. 195-208. En: M.E. Hendrickx (ed.). Contributions to the Study of East Pacific Crustaceans 1 [Contribuciones al Estudio de los Crustáceos del Pacífico Este 1]. Instituto de Ciencias del Mar y Limnología, UNAM, México. Schmitt, W.L. 1921. The marine decapod Crustacea of California with special reference to the decapod Crustacea collected by the United States Bureau of Fisheries Steamer “Albatross” in connection with the biological survey of San Francisco Bay during the years 1913-1913. University of California Publications in Zoology 23: 1-359. 354 Biodiversidad y comunidades del talud continental del Pacífico mexicano Smith, S.I. 1882. Reports on the results of dredging, under the supervision of Alexander Agassiz, on the East coast of the United States, during the summer of 1880, by the U.S. Coast Survey Steamer “Blake”, commander J.R. Bartlett, U.S.N., commanding, I: Report on the Crustacea. Bulletin of the Museum of Comparative Zoology at Harvard College 10(1):1-108. SCRIPPS, 1992. The Marine Shrimp of the Scripps Institution of Oceanography Benthic Invertebrate Collection. Catalogue. 106 pp. Takeda, M. y Y. Hanamura. 1994. Deep-sea shrimps and lobsters from the Flores Sea collected by the R.V. “Hakuho-maru” during KH-85-1 cruise. Bulletin of the National Science Museum, Serie A (Zoology) 20(1): 1-37. Wicksten, M.K. 1977. Range extensions of four species of crangonid shrimps from California and Baja California, with a key to the genera (Natantia: Crangonidae). Proceedings of the Biological Society of Washington 90 (4): 963-967. Wicksten, M.K. 1979. New records of the species of Glyphocrangon in the northeastern Pacific Ocean (Caridea: Glyphocrangonidae). Proceedings of the Biological Society of Washington 92: 217-224. Wicksten, M.K. 1989. Ranges of offshore decapod crustaceans in the eastern Pacific Ocean. Transactions of the San Diego Society of Natural History 21 (19): 291-316. Wicksten, M.K. y M.E. Hendrickx. 1992. Checklist of Penaeoid and Caridean shrimps (Decapoda: Penaeoidea, Caridea) from the eastern tropical Pacific. Proceedings of the San Diego Society of Natural History 9: 1-11. Wicksten, M.K. y M.E. Hendrickx. 2003. An updated checklist of benthic marine and brackish water shrimps (Decapoda: Penaoidea, Stenopodidea, Caridea) from the Eastern Tropical Pacific. Pp. 49-76. En: M.E. Hendrickx (ed.). Contributions to the Study of East Pacific Crustaceans 2. [Contribuciones al Estudio de los Crustáceos del Pacífico Este 2]. Instituto de Ciencias del Mar y Limnología, UNAM. México. Word, J.Q. y D.K. Charwat. 1976. Invertebrates of southern California coastal waters. II. Natantia. Southern California Coastal Water Research Project. 238 pp. Yaldwin, J.C. 1960. Biological results of the Chatham Islands 1954 Expedition, I: Crustacea Decapoda Natantia from the Chatham Rise; a deep water bottom fauna from New Zealand. New Zealand Department of Scientific and Industrial Research Bulletin 139: 13-53. Zamorano, P., M.E. Hendrickx y A. Toledano Granados. 2007. Distribution and ecology of deep water mollusks from the continental slope, southeastern Gulf of California, Mexico. Marine Biology 150 (5): 883-892. L os G lyphocrangonidae y C rangonidae (C rustacea : D ecapoda : C aridea ) 355 Zarenkov, N.A. 1965. Reviziya rodov Crangon Fabricius i Sclerocrangon G.O. Sars (Decapoda, Crustacea) [Revision of genera Crangon Fabricius and Sclerocrangon G.O. Sars (Decapoda, Crustacea)]. Zoological Zhurnal 44 (12): 1761-1775. 356 Biodiversidad y comunidades del talud continental del Pacífico mexicano Distribución de Stereomastis pacifica (Faxon, 1893) (Crustacea; Decapoda; Polychelida; Polychelidae) y notas sobre la distribución de Willemoesia inornata Faxon, 1893 en el Pacífico mexicano Michel E. Hendrickx1 Introducción Los Polychelidae pertenecen a un grupo de langostas con una morfología muy particular y difieren notablemente en su apariencia de las langostas espinosas que, en México, tienen una importancia comercial considerable (Hendrickx 1995, Pérez-González et al. 2002). Por lo general, los Polychelidae carecen de los llamativos colores de éstas, son más pequeños, poseen un cuerpo deprimido dorsoventralmente y menos calcificado, y las pinzas son muy delgadas, además que las especies de esta familia son exclusivamente de aguas profundas (Hendrickx 2012a). Un estudio a nivel mundial de los Polychelidae fue propuesta por Galil (2000) quien efectuó una revisión exhaustiva de la literatura y del material recolectado en todas las regiones zoogeográficas del mundo. En este trabajo, de carácter monográfico, Galil (2000) considera cinco géneros actuales como válidos (dos de estos nuevos); propone la inclusión de Stereomastis Spence Bate, 1888 en la sinonimia de Polycheles Heller, 1862. Sin embargo, esta sinonimia fue refutada posteriormen- Laboratorio de Invertebrados Bentónicos, Instituto de Ciencias del Mar y Limnología, Unidad Académica Mazatlán, Universidad Nacional Autónoma de México, Joel Montes Camarena s/n, Mazatlán 82040, Sinaloa, México. Correo-e: [email protected]. 1 357 te por Ahyong (2009), quien basa sus conclusiones sobre un estudio filogenético de la familia Polychelidae en el cual considera 71 caracteres morfológicos. Ahyong (2009) propone el reconocimiento de seis géneros dentro de la familia: Cardus Galil, 2000; Homeryon Galil, 2000; Pentacheles Spence Bate, 1878; Polycheles Heller, 1872; Stereomastis Spence Bate, 1888; y Willemoesia Grote, 1873. Dentro de los Polychelidae, Galil (2000) incluye 32 especies, de las cuales seis eran nuevas. Ahyong (2009) incluye 37 especies en su trabajo (nota: Pentacheles obscurus Spence Bate, 1878, aparece en las claves de este último trabajo pero no en el listado de especies), pues dos especies de Polycheles [P. kermadecensis (Sund, 1920) y P. amemiyai Yokoya, 1933] fueron restablecidas por Ahyong y Brown (2002), mientras que Ahyong y Chan (2004) y Ahyong y Galil (2006) describieron tres especies nuevas. Recientemente Chan (2010) propuso una lista completa de las especies válidas de langostas de aguas dulces y marinas a nivel mundial. Dentro de los Polychelidae (la única familia dentro del Infraorden Polychelida), este autor considera 38 especies, incluyendo las 37 especies citadas por Ahyong (2009) y Stereomastis panglao Ahyong y Chan, 2008. De las 38 especies reconocidas actualmente, solamente seis fueron descritas sobre la base de material originalmente recolectado en el Pacífico este (Chan 2010): Polycheles tanneri Faxon, 1893 (islas Galápagos), Stereomastis evexa (Galil, 2000) (Chile), S. pacifica (Faxon, 1893) (golfo de Panamá), S. suhmi (Spance Bate, 1878) (Chile), Willemoesia inornata Faxon, 1893 (al sur de Panamá) y W. pacifica Sund, 1920 (Chile). Además, tres especies, descritas originalmente en otras regiones del mundo, fueron encontradas posteriormente en el Pacífico americano: Pentacheles laevis Spence Bate, 1878 (descrita para Indonesia; citada para las Galápagos); P. validus A. Milne-Edwards, 1880 (descrita para el Atlántico oeste; citada para Chile); Stereomastis sculpta (Smith, 1880) (descrita para Canadá, Atlántico oeste; citada para Chile) (Galil 2000). Así, en total son nueve las especies de Polychelidae citadas por lo menos una vez en la región del Pacífico este (Cuadro 1). Según Galil (2000), en las aguas del Pacífico mexicano se han registrado solamente dos especies de Polychelidae: Stereomastis evexa (véase infra) y S. pacifica. Los registros de S. evexa para el Pacífico este corresponden en su mayoría a registros erróneos de Pentachelus nanus Smith, 1884. Revisando el material citado como S. nana procedente del Pacífico este, Galil (2000) se dió cuenta que se trataba de una especie nueva, distinta a S. nana descrita por S. Smith para el Atlántico. Por lo anterior, todos los registros anteriores de esta última especie por Faxon (1895; 358 Biodiversidad y comunidades del talud continental del Pacífico mexicano Cuadro 1. Especies de Polychelidae registradas en el Pacífico este (fuentes: Wicksten 1989; Galil 2000; Chan 2010). Especie Polycheles tanneri Faxon, 1893 Pentacheles laevis Spence Bate, 1878 Pentacheles validus A. Milne-Edwards, 1880 Stereomastis evexa (Galil, 2000) (1) Stereomastis pacifica (Faxon, 1893) Stereomastis sculpta (Smith, 1880) Stereomastis suhmi (Spence Bate, 1878) Willemoesia inornata Faxon, 1893 Willemoesia pacifica Sund, 1920 (Chile) Registros en el Pacífico este Perú; islas Galápagos; Ecuador; Panamá; Colombia; golfo de Panamá Islas Galápagos Sur de Chile Chile; Perú; México Chile; Perú; Ecuador; Panamá; México; California Chile Sur de Chile Chile; Ecuador; islas Galápagos; Colombia; Panamá; Costa Rica; Sur de Chile (1) La mayoría de los registros corresponden a S. nana (Smith, 1884). Véase texto. citada como Polycheles nanus), Wicksten (1989) y Hendrickx (1995) (citado en ambos casos como Stereomastis nana) corresponden a S. evexa. Una tercera especie, Willemoesia inornata Faxon, 1893, citada por Galil (2000) desde Panamá hasta Chile, ha sido recolectada frente a bahía Magdalena, en la costa oeste de la península de Baja California, entre 3427 y 3621 m de profundidad (Scriffs 1992). En el Pacífico mexicano, la distribución de la fauna de aguas profundas está fuertemente influenciada por la presencia de una amplia franja batimétrica donde las concentraciones de oxígeno disuelto bajan de manera dramática. En el golfo de California y en la porción suroeste de México esta franja, conocida como la Zona del Mínimo de Oxígeno (ZMO), se extiende desde profundidades muy someras (50-150 m) hasta 700-800 m (Hendrickx y Serrano 2010). Entre las especies recolectadas durante el proyecto TALUD, se encontró una sola especie de Polychelidae, Stereomastis pacifica. Hasta la fecha no hay ningún trabajo publicado en el cual se presente una relación detallada de los Polychelidae en el Pacífico mexicano. Por lo tanto, la información obtenida durante los cruceros TALUD permitió, por primera vez, relacionar la presencia de S. pacifica con valores de concentración de oxígeno medidos in D istribución de S tereomastis pacifica 359 situ. Por lo anterior, esta contribución presenta la información relacionada con esta especie y con Willemoesia inornata, la segunda especie conocida en el Pacífico mexicano. Además, se presenta una clave de identificación en español para las especies de la región. Material y métodos El material estudiado fue obtenido durante el proyecto TALUD, en el golfo de California y frente a las costas SO del Pacífico de México. Este proyecto inició en 1989 y el último crucero considerado en esta contribución se efectuó en 2009. El objetivo principal era recolectar material en aguas con profundidades mayores a 350 m y determinar en que condiciones de profundidad y nivel de oxigenación se encontraban (véase Hendrickx 2001, Hendrickx 2012b). Todos los especímenes fueron recolectados por el B/O “El Puma” de la Universidad Nacional Autónoma de México, con un trineo bentónico o draga de patín con boca de 0.9 m de altura por 2.95 m de anchura equipado con una malla tipo camaronera de 5.5 cm de apertura y una red interna con malla más fina (ca 2.5 cm), salvo en el TALUD III donde se utilizó una draga de arrastre tipo “Agassiz” de 1.0 m de altura por 2.5 m de anchura, con una malla similar. Las profundidades fueron medidas con las ecosondas del buque y las concentraciones de oxígeno disuelto obtenidas a partir de muestras de agua recolectadas cerca del fondo y analizadas con el método Winkler (véase Hendrickx 2012b). Los especímenes fueron conservados en formaldehído al 10 % (transferidos posteriormente a etanol) o directamente en etanol al 70 %. Para la identificación de los mismos su usaron las claves proporcionadas por Galil (2000). Además, se revisaron las descripciones originales de las especies por Faxon (1893) y la información morfológica adicional proporcionada por este mismo autor (Faxon 1895). Se incluye la lista del material examinado, la sinonímia de las especies en su estado adulto (véase comentarios) limitada a la descripción original, las recombinaciones y las citas que incluyen registros para el Pacífico este, los datos de distribución y algunos comentarios acerca de la ecología de la especie. El material recolectado durante este proyecto ha sido depositado en la Colección Regional de Invertebrados Marinos del Laboratorio de Invertebrados Bentónicos de la Unidad Académica Mazatlán, ICML, UNAM (EMU, siglas de la colección de la “Estación Mazatlán UNAM”). Información adicional acerca de las especies que se encuentran en aguas mexicanas fue obtenida de las colecciones de Scripps Institution of Oceanography y de la colección de crustáceos del Museum of Natural History of 360 Biodiversidad y comunidades del talud continental del Pacífico mexicano Los Angeles County (LACM). Se usaron las siguientes abreviaciones: H, hembra; M, macho; HH, hembra ovada; LC, longitud de caparazón; Est., estación de muestreo; Prof., profundidad; Id., identificó; AHF, Allan Hancock Foundation. Resultados Familia Polychelidae Stereomastis pacifica (Faxon, 1893) Fig. 1A Figura 1. A. Stereomastis pacifica (Faxon, 1893), vista dorsal; B, Willemoesia inornata Faxon, 1893, vista dorsal. Según Faxon (1895). A B D istribución de S tereomastis pacifica 361 Polycheles sculptus pacificus Faxon 1893: 196 (localidad tipo, golfo de Panamá); 1895: 122, lám. C, figs. 1, 1 a. Polycheles sculptus.- Del Solar 1972: 11. Stereomastis sculpta pacifica.- Firth y Pequegnat 1971: 71.- Wicksten 1980: 914, fig. 1; 1989: 311 (lista).- Wicksten y Méndez 1982: 110.- Hendrickx 1995: 391 (lista).- Scriffs, 1992: 101-102. Polycheles pacificus.- Galil 2000: 332, fig. 20 (sinonímia completa). Stereomastis pacifica.- Retamal 1981: 16.- Quintana y Retamal 1984: 133.Retamal y Jara 2002: 205 (lista). Polycheles nana.- Hendrickx 2001: 104 (cuadro). Stereomastis pacificus.- Hendrickx 2001:193 (cuadro).- Ahyong 2009:385 (clave), 387 (lista).- Chan 2010:163 (lista). Material examinado.- TALUD III, Est. 14A, frente a bahía Santa María, Sin, 19/ ago/1991, 1198 m, 1 M (LC 35.0 mm), draga Agassiz (EMU-2556). TALUD IV, Est. 19, frente a la ensenada del Pabellón, Sin, 25/ago/2000, 1245 m, 3 H (CL 42.4-46.2 mm) y 1 HH (LC 51.3 mm), trineo bentónico (EMU-5980). TALUD V, Est. 19, frente a la ensenada del Pabellón, Sin, 15/dic/2000, 11801200 m, 1 HH (LC 44.2 mm), trineo bentónico (EMU-5981). TALUD VI, Est. 20, frente a la ensenada del Pabellón, Sin, 15/mar/2001, 1250-1440 m, 1 H (LC 33.0 mm), trineo bentónico (EMU-6708). TALUD VI, Est. 34, frente a isla Lechuguilla, Sin, 17/mar/2001, 1240-1270 m, 2 M (LC 31.2 y 31.3 mm), trineo bentónico (EMU-6709). TALUD VII, Est. 4, sureste del golfo de California, 5/jun/2001, 1190 m, 1 hembra (LC 37.5 mm), draga de patín (EMU-6710). TALUD VII, Est. 19, frente a ensenada del Pabellón, Sin, 7/jun/2001, 11601180 m, 1 H (LC 38.0 mm), trineo bentónico (EMU-6711). TALUD XII, Est. 23, frente a Michoacán, 1/abr/2008, 1058-1088 m, 1 M (LC 32.5 mm) y 1 H (LC 36.7 mm), trineo bentónico (EMU-8868). Frente a las islas Los Coronados, R/V “Calafia”, 16/mar/1979, 1,190 m (650 fm), 1 H (LC 48.0 mm), trampa para peces (LACM ex-AHF-1677-1) (Id. M.K. Wicksten). HH ovífera (LC 46.2 mm; aprox. 800 huevos), trampa para peces (LACM exAHF 1396-1) (Id. M.K. Wicksten). Frente a isla San Juantito, R/V “Velero III”, Est. 13770, 21/ene/1970, 11441555 m (625-850 fm), 1 H (LC 40.8 mm) (LACM ex-AHF, sin número) (Id. M.K. Wicksten). 362 Biodiversidad y comunidades del talud continental del Pacífico mexicano Material adicional.- Una larva, muy probablemente perteneciendo a S. pacifica, fue capturada durante el crucero TALUD IV; Est. 4, sur del golfo de California, 23/ ago/2000, 1200-1290 m, trineo bentónico (EMU-5987). Distribución en el Pacífico este.- Según Galil (2000), S. pacifica es conocida en Chile, Perú, Ecuador, Panamá, México y California, EE.UU. Los limites de distribución son desde Noyo Canyon, al norte de San Francisco, California (ca 39°25’N, 124°30’O) (Mary K. Wicksten, com. pers., marzo 2011), hasta Valparaíso (30°46’S, 81°31’O). Además, hay registros para Costa Rica (Wicksten 1980), los cuales corresponden muy probablemente a los dos lotes contenidos en las colecciones de SIO y del LACM (Cuadro 2). Los datos de distribución proporcionados por Firth y Pequegnat (1971) para “Stereomastis sculpta pacifica” (Mediterráneo e Indo-Pacífico) corresponden en parte a la distribución de S. sculpta Smith, 1880 (véase Galil 2000). Cuadro 2. Localidades de capturas de Stereomastis pacifica (Faxon, 1893) en México y Costa Rica registradas en las colecciones de SIO y del LACM. Todos los especímenes del LACM identificados por M.K. Wicksten (como S. sculptus pacificus). Material de SIO citado en Scriffs (1992) como S. sculpta pacifica. ND, no hay datos. (1) En el caso del “Albatross” se indica el número de la estación. Localidad/ Colección Cerca de las islas Coronados/ LACM Frente a Ensenada/ LACM Cerca de isla San Juanito/ LACM Cuenca de Guaymas/SIO Cerca de punta Guiones/LACM Cerca de punta Guiones/SIO Coordenadas Prof. (m) Fecha ND 1006 16/mar/1979 Embarcación (1) R/V “Calafia” 31°59.6’N, 118°47.4’O 1100 9/nov/1978 R/V “Calafia” ND 1144-1556 21/ene/1970 R/V “Velero III” 27°17’N, 111°26’O ND 1792-1875 15/ene/1968 1866 09°34'N, 85°41'O 1157-1454 12-13/ may/1973 20/abr/1973 R/V “T. Washington” R/V “Velero IV” R/V”Agassiz” D istribución de S tereomastis pacifica 363 Cuadro 2. Continúa. Localidad/ Colección Al sur de Acapulco Al sur de Acapulco Al suroeste de las islas Marías Coordenadas Prof. (m) Fecha 16°33N, 99°52'30”O 16°34'30”N, 100°03'O 21°15'N, 106°23'O 1208 11/abr/1891 1413 11/abr/1891 1237 18/abr/1891 Embarcación (1) “Albatross” 3418 “Albatross” 3419 “Albatross” 3424 Distribución en el Pacífico mexicano.- El material recolectado por el “Albatross” incluye seis lotes, de los cuales tres provienen de aguas mexicanas (“Albatross” Est. 3418, 3419 y 3424) (Cuadro 1). La colección de SIO contiene 11 lotes de S. pacifica, de los cuales sólo uno fue recolectado en México, en la cuenca de Guaymas, golfo de California central, a una profundidad de 1792-1875 m. La colección del LACM contiene 13 lotes, de los cuales tres corresponden a localidades en el Pacífico de México (Cuadro 1) (Fig. 2). Junto con los ocho lotes obtenidos durante el proyecto TALUD, se tiene entonces un total de 15 registros de S. pacifica para el Pacífico de México (Fig. 2). Distribución batimétrica y ecología.- Según Galil (2000), S. pacifica se distribuye entre 450-500 (“Anton Bruun”, frente a Ecuador) y 3380 m de profundidad (3382 m, dato retomado de Wicksten, 1980 y correspondiendo a la estación 3383 del “Albatross”). El material recolectado durante los cruceros TALUD se recogió entre 1058 y 1440 m. Las concentraciones de oxígeno disuelto registrados a nivel del fondo fueron de 0.08 a 1.27 ml l-1, con una mayoría de registros (6 de 8) entre 0.38 y 0.86 ml l-1, lo que indica una buena tolerancia a ambientes hipóxicos. Comentarios.- El material recolectado durante las campañas TALUD III y IV, citado por Hendrickx (2001), se identificó antes de poder contar con el trabajo monográfico de Galil (2000). Una revisión posterior de este material permitió rectificar la identificación del espécimen del TALUD IV que corresponde en realidad a Stereomastis pacifica, y no a “S. nana” como se creía anteriormente. Por lo tanto, este registro de S. evexa (la especie que corresponde a los registros de “S. nana” para el Pacífico este) para el Pacífico de México queda descartado. Por otra parte, el material citado por Faxon (1895) es sólo para Perú y Chile. El material visto e ilustrado por Faxon (1895: Pl. XXXIII, Fig. 1) proveniente de Panamá y que identificó como Polycheles nanus es también citado por Galil (2000) 364 Biodiversidad y comunidades del talud continental del Pacífico mexicano en la sinonimia de S. evexa. Sin embargo, no hay evidencias que Galil haya vuelto a examinar este material de Panamá. En todo caso, y de acuerdo con comentarios recibidos de Shane Ahyong (com. pers., enero 2011), no hay registros de la presencia de S. evexa (como tal o identificado de manera errónea como “Polycheles nanus”) al norte de Panamá y los registros presentados por Wicksten (1989; Alaska hasta Chile) podrían corresponder a una sobre-estimación del intervalo de distribución de esta especie basado en especímenes mal identificados y cuyo origen no es claro (i.e., no hay rastros de este material en las colecciones que fueron revisadas por Galil). Esta opinión es compartida por el autor. Por todo lo anterior, la presencia de S. evexa quedaría confirmada solamente para el área de Perú-Chile. Willemoesia inornata Faxon, 1893 Fig. 1B Willemoesia inornata Faxon 1893: 195; 1895: 125, lám. 32, fig. 2, lám 33, fig. 3.- Firth y Pequegnat 1971: 77.- Galil 2000:362, fig. 32 (sinonímia completa).- Ahyong 2009: 386 (clave), 388 (lista).-Chan 2010: 163. Willemoesia challengeri Sund 1920: 223.- Holthuis 1952: 79.- Bahamonde 1963: 4.- Retamal 1981: 16.- Wicksten 1989: 304.- Retamal y Jara 2002: 205 (lista). Willemoesia inorata.- Scriffs 1992: 102 (lista). Material examinado.- Cuenca frente a bahía Magdalena (24°35’N, 113°25’O), 24/jun/1965, 3563-3621 m, 1 especímen, red Sigsbee de 6’, R/V “Horizon” (col. C. Hubbs) (SIO-C 1637). Distribución en el Pacífico este.- Según Galil (2000), W. inornata es conocida en el Pacífico este desde el golfo de Panamá hasta Chile. Sin embargo, tal como lo nota M.K. Wicksten (com. pers., enero 2011), la colección de SIO contiene dos lotes de esta especie capturados frente a bahía Magdalena, en la costa oeste de Baja California Sur (véase material examinado). Por lo tanto, los límites de distribución de esta especie son desde 24°35’N, 113°25’O hasta las islas Juan Fernández (34°07’N, 73°56’O), Chile, a 4005 m, incluyendo registros en Costa Rica, Panamá, Ecuador, Colombia y Chile (Galil 2000). Distribución en el Pacífico mexicano.- Solamente conocida de las dos estaciones frente a bahía Magdalena, Baja California Sur (Fig. 2). Comentarios.- Firth y Pequegnat (1971) citan a W. chalengeri Sund, 1920, como una especie válida. Sin embargo, Galil (2000: 362) la coloca en la siD istribución de S tereomastis pacifica 365 nonímia de W. inornata. Esta opinión fue adoptada posteriormente por Chan (2010). Discusión Por las grandes profundidades en las que habitan, las especies de Polychelidae no son comúnmente capturadas. De hecho, considerando las dos especies citadas para el Pacífico de México, se tenía para este área solamente siete registros para Stereomastis pacifica y dos para Willemoesia inornata. Con el material del TALUD se agregaron ocho registros adicionales para la primera de estas dos especie, obviamente la más común de la familia Polychelidae en esta área. No se recolectaron otras especies de esta familia durante las operaciones del proyecto TALUD. La ausencia de especímenes de W. inornata en los arrastres se debe probablemente al hecho que no se alcanzó el nivel de residencia de esta especie durante los arrastres. Según Mary K, Wicksten (com. pers., marzo 2011), en el golfo de México Stereomastis sculpta, es uno de los crustáceos decápodos más abundante, y las Figura 2. Mapa de distribución de Stereomastis pacifica (Faxon, 1893) y de Willemoesia inornata Faxon, 1893 en el Pacífico mexicano. 366 Biodiversidad y comunidades del talud continental del Pacífico mexicano colecciones de la Texas A&M University contienen cientos de especímenes de esta especie, recolectados entre 1200 y 2500 m. En el caso de S. pacifica, los registros son aún escasos en el Pacífico mexicano. Sin embargo, Wicksten (1980) menciona la presencia de abundantes larvas de esta especie en arrastres de media agua realizados durante los cruceros Velero III y IV, lo que indicaría que S. pacifica es probablemente más abundante de lo que dejan suponer las muestras disponibles. Stereomastis pacifica forma parte de un amplio grupo de especies macrobentónicas con capacidad para tolerar concentraciones de oxígeno muy bajas, lo cual permite su presencia en la zona batimétrica que se extiende desde la franja inferior de la ZMO hasta profundidades mayores (véase Hendrickx 2001, 2003, Zamorano et al. 2007). En el caso de W. inornata, no se cuenta en la literatura con valores de oxigeno disuelto asociadas a sus capturas. Sin embargo, considerando el intervalo batimétrico general de esta especie (2380-4005 m) (Galil 2000), se encuentra distribuida en una zona donde el oxígeno ya se ha recuperado considerablemente comparado con la franja hipóxica, zona donde se alcanzan valores superiores a los 2.0 ml l-1 (véase Hendrickx 2001, Hendrickx y Serrano 2010). Clave de las especies de Polychelidae del Pacífico este. Las especies con registros en México aparecen en negritas (Adaptado de Galil 2000 y Ahyong 2009) 1. Órbitas formando una hendidura poco profunda. Margen interno del pollex de la pinza mayor con una espina (Willemoesia).......................................................... 2 Órbitas formando una hendidura profunda, en forma de U o de V. Margen interno del pollex de la pinza mayor sin espina...................................................................3 2. Crestas dorsales de los somitos abdominales IV-V sin un fuerte diente anterior; somito seis liso, sin esculturas dorsales.....Willemoesia inornata (México-Chile) Crestas dorsales de los somitos abdominales IV-V formando un fuerte diente anterior; somito seis con esculturas dorsales muy aparentes..................................................................................Willemoesia pacifica (Chile) 3. Hendidura orbital en forma de U. Pereiópodos 1-5 con un epípodo reducido, más corto que la anchura de la coxa correspondiente (Stereomastis)..............4 Hendidura orbital en forma de V. Pereiópodos 1-5 con un epípodo bien desarrollado, claramente más largo que la anchura de la coxa correspondiente............7 4. Carinas dorsales de los somitos abdominales II-V (por lo menos la del 5to) con un fuerte diente dirigido anteriormente y otro, mucho más pequeño, inmediatamente posterior al diente anterior ........................ Stereomastis suhmi (Chile) D istribución de S tereomastis pacifica 367 5 6 7 8 Carinas dorsales de los somitos abdominales II-V sin diente adicional posterior al diente principal ...................................................................................................... 5 Surco branquial sin espinas......................................................... S. sculptus (Chile) Surco branquial con una o varias espinas .............................................................. 6 Carina dorsal del somito V con un diente anterior muy fuerte, parecido al diente del somito 4 ....................................................... Stereomastis evexa (Perú, Chile) Carina dorsal del somito V sin diente anterior............Stereomastis pacificus (California-Chile) Margen anterolateral del segmento basal de la anténula redondeado, con 1-2 pequeñas espinas. Epipodito del tercer par de maxilípedos muy reducido......... . ........................................................................................................ Polycheles tanneri Margen anterolateral del segmento basal de la anténula de forma cuadrada. Epipodito del tercer par de maxilípedo bien desarrollado (Pentacheles)...........8 Somitos abdominales I-III con un fuerte diente dorsal dirigido anteriormente ..................................................................Pentacheles laevis (Panamá-Galápagos) Somitos abdominales I-III sin diente dorsal bien desarrollado, cuando mucho con una prominencia redonda....................................Pentacheles validus (Chile) Agradecimientos Se agradece a los miembros del equipo científico y a la tripulación del B/O “El Puma” por el apoyo proporcionado durante las campañas TALUD. El proyecto TALUD recibió el apoyo de CONACYT (proyecto 31805-N) y de la Dirección General de Apoyo al Personal Académico (DGAPA; proyecto PAPIIT IN 2173063). Se agradece a Joel W. Martin y a Adam Wall, del Museo de Los Ángeles, por la información proporcionada acerca de las muestras de Stereomastis pacificus en la colección y a Shane Ahyong por los comentarios relacionados con la distribución de S. evexa en el Pacífico este. Se agradece también a Harim Cha, Scripps Institution of Oceanography, por facilitarme la revisión de material de la colección de invertebrados. Se agradece a los revisores por proporcionar información acerca de los Polychelidae en el golfo de México. La edición final así como la preparación de las figuras de este manuscrito fue realizada por Mercedes Cordero Ruiz. 368 Biodiversidad y comunidades del talud continental del Pacífico mexicano Referencias Ahyong, S. T. 2009. The polychelidan lobsters: Phylogeny and systematics (Polychelida: Polychelidae). Pp. 369-396. En: J.W. Martin, K.A. Crandall y D.L. Felder (eds.). Decapod Crustacean Phylogenetics. CRC Press. Taylor y Francis Group. Boca Ratón, Fla. EUA. Ahyong, S. T. y D. E. Brown. 2002. New species and new records of Polychelidae from Australia (Decapoda: Crustacea). The Raffles Bulletin of Zoology 50: 53-79. Ahyong, S. T. y T. Y. Chan. 2004. Polychelid lobsters of Taiwan (Decapoda: Polychelidae). The Raffles Bulletin of Zoology 52: 171-182. Ahyong, S. T. y B. S. Galil. 2006. Polychelidae from the southern and western Pacific (Decapoda, Polychelida). Zoosystema 28: 757-767. Bahamonde, N. N. 1963. Decápodos en la fauna preabismal de Chile. Noticiario Mensual del Museo Nacional de Historia Natural, Santiago de Chile 7(81): 1-10. Chan, T.-Y. 2010. Annotated checklist of the world’s marine lobsters (Crustacea: Decapoda: Astacidea, Glypheidea, Achelata, Polychelida). The Raffles Bulletin of Zoology 23: 153-181. Del Solar, E. 1972. Addenda al catálogo de crustáceos del Perú. Informe Instituto del Mar del Perú 38: 1-21. Faxon, W. 1893. Reports on the dredgings operations off the west coast of Central America to the Galapagos, to the west coast of Mexico, and in the Gulf of California VI. Preliminary descriptions of new species of Crustacea. Bulletin of the Museum of Comparative Zoology at Harvard University 24(7): 149-220. Faxon, W. 1895. Reports on an exploration off the west coast of Mexico, Central and South America, and off the Galapagos Islands, in charge of Alexander Agassiz, carried on by the U.S. Fish Commission steamer “Albatross”, during 1891, Lieut. Commander Z.L. Tanner, U.S.N., commanding. XV. The stalk-eyed Crustacea. Memoirs of the Museum of Comparative Zoology at Harvard College 18: 1-292. Firth, R. W. y W. E. Pequegnat. 1971. Deep sea lobsters of the families Polychelidae and Nephropidae (Crustacea, Decapoda) in the Gulf of Mexico and Caribbean Sea. Texas A. & M. University, Texas. 106 pp. Galil, B. S. 2000. Crustacea Decapoda: review of the genera and species of the family Polychelidae Wood-Mason, 1874. En: A. Crosnier (ed.). Résultats des Campagnes Musorstom. Vol. 21. Mémoires du Museum National d’Histoire Naturelle, Paris 184: 285-387. Hendrickx, M. E. 1995. Langostas. Pp. 383-416. En: W. Fischer, F. Krupp, W. Schneider, C. Sommer, K.E. Carpenter y V.H. Niem (eds.). Guía FAO para la identificación D istribución de S tereomastis pacifica 369 de especies para los fines de la pesca. Pacífico centro-oriental. Vol. I. Plantas e Invertebrados. FAO, Roma, Italia. Hendrickx, M. E. 2001. Occurrence of a continental slope decapod crustacean community along the edge of the minimum oxygen zone in the southeastern Gulf of California, Mexico. Belgian Journal of Zoology 131 (2): 95-109. Hendrickx, M. E. 2003. Geographic and bathymetric distributions of species of Munidopsis (Crustacea: Decapoda: Galathaeidae) in the SE Gulf of California, Mexico. Pp. 21-30. En M.E. Hendrickx (ed.) Contributions to the Study of East Pacific Crustaceans. [Contribuciones al Estudio de los Crustáceos del Pacífico Este 2]. Instituto de Ciencias del Mar y Limnología, UNAM. México, D.F. Hendrickx, M. E. 2012a.Crustáceos decápodos (Arthropoda: Crustacea: Decapoda) de aguas profundas del Pacífico mexicano: Lista de especies y material recolectado durante el proyecto TALUD. Pp. 281-315. En: P. Zamorano, M.E. Hendrickx y M. Caso (eds.). Biodiversidad y comunidades del talud continental del Pacífico mexicano. Instituto Nacional de Ecología, Secretaría del Medio Ambiente y Recursos Naturales (Semarnat). Hendrickx, M. E. 2012b. Operaciones oceanográficas realizadas durante el proyecto TALUD en el Pacífico mexicano (1989-2009). Pp. 23-104. En: P. Zamorano, M.E. Hendrickx y M. Caso (eds.). Biodiversidad y comunidades del talud continental del Pacífico mexicano. Instituto Nacional de Ecología, Secretaría del Medio Ambiente y Recursos Naturales (Semarnat). Hendrickx, M. E. y D. Serrano. 2010. Impacto de la zona de mínimo de oxígeno sobre los corredores pesqueros en el Pacífico mexicano. Interciencia 35(1): 12-18. Holthuis, L. B. 1952. Reports of the Lund University Chile Expedition 1948-1949. The Crustacea Decapoda Macrura of Chile. Acta Universitatis Lundensis, Lund, nueva serie 47(10): 1-110. Pérez González, R., I. Muñoz.L. M. Valadez y M. I. Borrego. 2002. The current status of the fishery for spiny lobsters Panulirus inflatus and P. gracilis (Decapoda: Palinuridae) along the Mexican Pacific coast. Pp. 327-347 En: M.E. Hendrickx (ed). Contributions to the Study of East Pacific Crustaceans 1 [Contribuciones al Estudio de los Crustáceos del Pacífico Este 1]. Instituto de Ciencias del Mar y Limnología, UNAM. México. Quintana, R. y M. A. Retamal. 1984. Two pelagic stages of Stereomastis pacifica (Faxon) collected in the Chile-Peru Trench (Polychelidae: Macrura). Researches on Crustacea 13-14: 133-142. 370 Biodiversidad y comunidades del talud continental del Pacífico mexicano Retamal, M. A. 1981. Catálogo ilustrado de los crustáceos decápodos de Chile. Gayana, Serie Zoología 44: 7-110. Retamal, M. A. y C. Jara. 2002. La Carcinología en Chile. Pp: 195-208. En: M.E. Hendrickx (ed.) Contributions to the Study of East Pacific Crustaceans 1. [Contribuciones al Estudio de los Crustáceos del Pacífico Este 1]. Instituto de Ciencias del Mar y Limnología, UNAM. México. Sciffs (Scripps Institution of Oceanography). 1992. The marine shrimp of the Scripps Institution of Oceanography Benthic Invertebrate collection catalogue. Mimeographed report. 106 pp. Sund, O. 1920. The “Challenger” Eryonidea (Crustacea). Annals and Magazine of Natural History, serie 9. 6: 220-226. Wicksten, M. K. 1980. New records of Stereomastis sculpta pacifica (Faxon) (Decapoda: Polychelidae) in the eastern Pacific Ocean. Proceedings of the Biological Society of Washington 93(4): 914-919. Wicksten, M. K. 1989. Ranges of offshore decapod crustaceans in the eastern Pacific Ocean. Transactions of the San Diego Society of Natural History 21(19): 291-316. Wicksten, M. K. y M. Méndez. 1982. New records and new species of the genus Lebbeus (Caridea: Hippolytidae) in the Eastern Pacific Ocean. Bulletin of the Southern California Academy of Sciences 81: 106-120. Zamorano, P., M. E. Hendrickx y A. Toledano Granados. 2007. Distribution and ecology of deep-water mollusks from the continental slope, southeastern Gulf of California, Mexico. Marine Biology 150 (5):883-892. D istribución de S tereomastis pacifica 371 Listado sistemático de los equinodermos de aguas profundas del Pacífico mexicano Michel E. Hendrickx* Introducción Los equinodermos son organismos omnipresentes en los mares y océanos de la Tierra y han sido encontrados desde la zona intermareal hasta las profundidades abisales. Son particularmente llamativos por su forma y sus colores. El grupo de los equinodermos (Echinodermata) contiene unas 7000 especies y está formado por cinco clases: los Crinoidea (estrellas plumosas; lirios de mar y comatúlas), los Asteroidea (estrellas de mar), los Ophiuroidea (estrellas quebradizas), los Echinoidea (erizos de mar) y los Holothuroidea (pepinos de mar) (Brusca y Brusca 2002). Los primeros equinodermos de aguas profundas recolectados en el Pacífico americano fueron obtenidos por los buques de investigación “Challenger” y “Albatross” en el siglo XIX. Sin embargo, se tuvo que esperar hasta la primera mitad del siglo XX para que surgiera un interés específico sobre este grupo de organismos en México. Sin lugar a dudas, la Dra. María Elena Caso Muñóz fue la fundadora de la escuela de “biología y taxonomía” de los equinodermos de México. A través de numerosas * Laboratorio de Invertebrados Bentónicos, Instituto de Ciencias del Mar y Limnología, Unidad Académica Mazatlán, Universidad Nacional Autónoma de México, Joel Montes Camarena s/n, Mazatlán 82040, Sinaloa, México. Correo-e: [email protected]. 373 publicaciones y monografías (e.g., Caso 1954, 1976, 1978, 1980, 1983, 1986, 1992), sentó las bases del conocimiento acerca de este grupo en México y montó la colección de equinodermos más importante del País ubicada en el Instituto de Ciencias del Mar y Limnología de la UNAM, en la Ciudad de México. Una revisión exhaustiva de la fauna de equinodermos del Pacífico este tropical (desde el sur de California, EE.UU., y el golfo de California hasta Perú) fue presentada por L.Y. Maluf en 1988. En esta compilación, Maluf (1988) incluye una lista completa de las especies conocidas para esta subregión en aquella época, junto con datos acerca de las distribuciones geográfica y batimétrica, las sinonimias y una lista de todas las referencias bibliográficas consultadas por esta autora hasta 1988. A 22 años de su publicación, esta obra representa todavía una referencia obligada para el grupo de los Echinodermata para la totalidad del Pacífico este. Basándose en esta obra, por ejemplo, se puede apreciar fácilmente cuales fueron las contribuciones más significativas acerca del conocimiento de los equinodermos del Pacífico americano. Además de los trabajos de M.E. Caso, que cubren el periodo entre 1941 y 1983, se puede apreciar las importantes contribuciones de A. Agassiz (e.g., 1881, 1892, 1898, 1904), de Ludwig (e.g., 1894, 1905), de H. L. Clark (e.g., 1901, 1913, 1920a, 1920b, 1923), de Fisher (e.g., 1911, 1928, 1930), de Ziesenhenne (1937) y de Deichman (e.g., 1937, 1941, 1958). Posterior a 1988, en la región se siguió con el estudio de los equinodermos y entre las contribuciones más destacadas y más útiles, tanto para la fauna de aguas someras como para aquella de aguas profundas, podemos citar los trabajos de Maluf (1991), Solís-Marín et al. (1997, 2005, 2009), Nybakken et al. (1998), Lambert (2000), Solís-Marín (2003), Maluf y Brusca (2005), Tilot (2006), Mah (2007) y Honey-Escandón et al. (2008) . Otros trabajos de importancia para el Pacífico americano tropical fueron publicados en dos volúmenes de la Revista de Biología Tropical dedicados a los estudios de los equinodermos en América Latina (Alvarado y Cortés 2005, 2008). Los avances recientes han sido particularmente significativos en el golfo de California. En el caso de las especies de aguas profundas, se han reconocido tres especies nuevas de holoturias procedentes de los muestreos de los cruceros TALUD (Massin y Hendrickx 2010, 2011) y se ha conseguido una serie importante de datos novedosos acerca de las estrellas (Hendrickx et al. 2011) y de los erizos de mar (datos no publicados). En esta contribución se presenta una breve síntesis de lo que se conoce acerca de las especies de equinodermos de aguas profundas del Pacífico mexicano basada 374 Biodiversidad y comunidades del talud continental del Pacífico mexicano en los muestreos del proyecto TALUD. Además, se presenta una lista provisional de las especies de equinodermos de aguas profundas (≥ 350 m) de esta región, basada esencialmente en los trabajos citados en los párrafos anteriores. Material y métodos Basándose en la literatura existente y en las muestras obtenidas durante el proyecto TALUD, se elaboró una lista de las especies de equinodermos de aguas profundas (≥ 350 m) del Pacífico de México. El material nuevo fue obtenido en el golfo de California y frente a las costas SO del Pacífico de México. Todos los especímenes fueron recolectados por el B/O “El Puma” de la Universidad Nacional Autónoma de México, con un trineo bentónico con boca de 0.9 m de altura por 2.95 m de anchura equipado de una malla tipo camaronera de 5.5 cm de apertura y de una red interna con malla más fina (ca 2.5 cm), salvo en el TALUD III donde se utilizó una draga de arrastre tipo “Agassiz” de 1.0 m de altura por 2.5 m de anchura, con una malla similar. Una lista completa de las estaciones de muestreo y datos relacionados con las áreas visitadas se encuentran en el primer capítulo de esta obra (véase Hendrickx 2012). La enorme mayoría de los arrastres se efectuaron por debajo de la Zona del Mínimo de Oxígeno (ZMO) ya que es la fauna que menos se conoce en el Pacífico mexicano (Hendrickx 2001, Hendrickx y Serrano 2010). Los especímenes fueron conservados en formaldehído al 10 % (transferidos posteriormente a etanol) o directamente en etanol al 70 %. La información relacionada con la identificación de las especies recolectadas está incluida en los trabajos de Massin y Hendrickx (2010, 2011) de Hendrickx et al. (2012) y en un manuscrito en preparación. En el caso de los Ophiuroidea, las especies citadas como parte de las campañas TALUD fueron identificadas por Gordon Hendler (Natural History Museum of Los Angeles County, California). El material recolectado durante este proyecto ha sido depositado en la Colección Regional de Invertebrados Marinos (EMU) del Laboratorio de Invertebrados Bentónicos de la Unidad Académica Mazatlán, ICML, UNAM. Para la elaboración de la lista de especies, se tomó en cuenta la clasificación propuesta por Maluf (1988) y las adecuaciones o cambios posteriores a 1988 disponibles en la base de WoRMS (2011). En el listado no se consideraron los subgéneros o subfamilias. L istado sistemático de los equinodermos de aguas profundas 375 Resultados Riqueza de especies de equinodermos en el Pacífico de México Según los registros de la literatura y el material obtenido durante las campañas TALUD, hay 165 especies de equinodermos de aguas profundas (≥ 350 m) en el Pacífico mexicano (Anexo 1). Estas especies pertenecen a las cinco clases de equinodermos vivientes reconocidas actualmente. Todas las clases de Echinodermata tienen una representación muy importante y bien diversificada en las comunidades de aguas someras, en particular en la zona intermareal, en los arrecifes y en la plataforma continental (véase por ejemplo: Benítez-Villalobos 2001, Cintra-Buenrostro 2001, Zamorano y Leyte-Morales 2005, 2009), y existe un número significativo de especies en cada una de estas cinco clases que han sido registradas en aguas profundas (Maluf 1988). Crinoidea (Fig. 1 A). Lirios de mar y las comátulas. Este grupo de equinodermos –en particular los lirios de mar o crinoideos pedunculados– tiene un registro fósil muy amplio. En total los crinoideos suman unas 625 especies vivientes (Brusca y Brusca 2002). De éstas, hay unas 80 especies actuales de lirios y éstas se limitan en general a aguas profundas, mientras que las comátulas (de vida libre) se encuentran tanto en aguas someras como profundas. Solamente hay tres registros seguros de especies de Crinoidea en el Pacífico mexicano, dos que corresponden a comátulas (Maluf 1988) y uno a un Crinoidea pedunculado (Roux 2004) (Anexo 1). Las dos especies de comátulas han sido recolectadas entre 9 y 1,969 m de profundidad, una en la zona de la corriente de California y la otra en el sur del golfo de California (Maluf 1988). Sin embargo, no aparecieron en las muestras del proyecto TALUD. La tercera especie, Hyocrinus foelli Roux y Pawson, 1999, citada por Roux (2004) para México a 3030 m de profundidad, más allá del alcance de los cruceros TALUD, fue citada nuevamente por Honey-Escandón et al. (2008). Esta especie está registrada para la costa SO de México y, según los datos proporcionados por Maluf (1988), es posible que se encuentran también en aguas de México especies de otro género de crinoideos, por ejemplo del género Ptilocrinus Clark, 1907. Durante las campañas TALUD se recolectaron cinco especímenes de comátulas en tres estaciones, entre 969 y 1225 m de profundidad, pero este material todavía no ha sido identificado. Asteroidea (Fig. 1 B-D). Estrellas de mar. Este grupo cuenta con unas 1500 especies vivientes (Brusca y Brusca 2002). En el Pacífico mexicano esta clase 376 Biodiversidad y comunidades del talud continental del Pacífico mexicano Fig. 1. A. Crinoidea. B, C. Asteroidea. Dipsacaster laetmophilus Fisher, 1910, vistas aboral y oral. D. Asteroidea. Soleaster sp., vista aboral. A, cortesía de K. Sheng. B-D, material de los cruceros TALUD. A B C D comprende 67 especies de aguas profundas repartidas en 38 géneros (Maluf 1988, Hendrickx et al. 2011a). De éstas, se recolectaron 15 plenamente identificadas, dos identificadas a nivel genérico y una más que corresponde a una especie no descrita del género Radiaster Perrier, 1881 (Anexo 1). Este material se obtuvo en muestras recolectadas entre 587 y 1525 m de profundidad (Hendrickx et al. 2011a). Considerando la distribución conocida actualmente para estas 67 especies, 41 de éstas han sido registradas en la zona de la corriente de California, 44 en aguas del golfo de California y 11 en el Pacífico SO (Hendrickx et al. 2011a). Ophiuroidea (Fig. 2 A). Estrellas quebradizas, estrellas serpientes o estrellas canastas. Contiene unas 2000 especies vivientes (Brusca y Brusca 2002). Según Maluf (1988), hay 63 especies de esta clase que han sido registradas en aguas del Pacífico mexicano (Anexo 1). Estas especies pertenecen a 25 géneros. Durante los cruceros TALUD, se recolectaron por lo menos 15 especies de Ophiuroidea, de las L istado sistemático de los equinodermos de aguas profundas 377 cuales solamente ocho han sido identificadas hasta el momento (Anexo 1). Eso se debe a las dificultades inherentes a la taxonomía de este grupo de equinodermos y al hecho de que el material tipo de la mayoría de las especies recolectadas en aguas profundas del Pacífico este se encuentra en colecciones en el extranjero. El material identificado proviene de un amplio intervalo de profundidad (820-2309 m) y el material pendiente de ser reconocido a nivel de especie cubre un intervalo todavía más amplio: 377-2309 m. De acuerdo con los datos disponibles en la literatura y tomando en cuenta lo poco que ya se conoce acerca del material recolectado durante las campañas TALUD, de las 63 especies capturadas en aguas profundas del Pacífico mexicano 46 tienen registros en la zona de la corriente de California, 45 en el golfo de California y solamente 20 en el SO de México. El caso particular del género Dougaloplus A.M. Clark, 1970 merece algunas aclaraciones debido al hecho que el estatuto de las especies citadas para la cosFig. 2. A. Ophiuroidea. Asteronyx loveni Müller y Troschel, 1842, vista aboral. B, Brisaster townsendi (A. Agassiz, 1898) (izquierda) y Brissopsis pacifica (A. Agassiz, 1898) (derecha), vista aboral; C, Tromikosoma sp., vista aboral. Material de los cruceros TALUD; D, Holothuroidea. Synallactes virgulosolida Massin y Hendrickx, 2010, a: vista lateral, b: vista dorsal. A C B D a b 378 Biodiversidad y comunidades del talud continental del Pacífico mexicano ta del Pacífico de México permanece incierto. De acuerdo con Gordon Hendler (com. pers., marzo 2011), “Matsumoto (1917) transferred Amphiura gastracantha and Amphiura notacantha to a new genus, Amphiacantha. Ailsa Clark (A.M. Clark, 1970) noted that the name Amphiacantha was preoccupied. She provided Dougaloplus as a replacement name and treated notacanthus and gastracanthus as Dougaloplus species. Aside from the citations in a few systematic and faunal works, both species have been disregarded since the publication of their original descriptions, which were based on a few specimens collected off Mexico (Lütken and Mortensen, 1899). Dougaloplus amphacanthus, an abundant species on the continental shelf of California, has also been reported from Mexico and Japan. However, collection records for the two latter localities are considered doubtful (Hendler 1996).” Por lo anterior, los registros de D. notacanthus (Lütken and Mortensen, 1899) y D. gastracanthus (Lütken and Mortensen, 1899) deben considerarse con reservas. Echinoidea (Fig. 2 B, C). Erizos de mar. Cuentan con un total de aproximadamente 650 especies vivientes (Brusca y Brusca 2002). Esta clase de equinodermos tiene solamente 21 especies registradas en aguas profundas del Pacífico de México (Hendrickx, De Ridda y David, datos no publicados) (Anexo 1). De éstas, solamente se logró recolectar cuatro (Anexo 1), en un intervalo de profundidad de 920 a 2125 m. Entre estas especies, destacan por su extraordinaria abundancia Brisaster townsendi (A. Agassiz, 1898) (Fig. 2) y Brissopsis pacifica (A. Agassiz, 1898) (Fig. 2), de las cuales se obtuvieron 527 y 1866 especímenes, respectivamente. De las 21 especies registradas en aguas del Pacífico mexicano, 10 han sido recolectadas en las aguas de la corriente de California, 17 en el golfo de California y 11 en el SO de México. Holothuroidea (Fig. 2 D). Los llamados pepinos de mar. Esta clase cuenta con unas 1100 especies vivientes (Brusca y Brusca 2002). Según Massin y Hendrickx (2011), incluyendo tres especies nuevas y algunos registros nuevos, hay 31 especies (distribuidas entre 21 géneros) de Holothuroidea conocidas con seguridad de las aguas profundas del Pacífico mexicano. De estas 31, se encontraron 18 especies (Anexo 1) en muestras recolectadas entre 377 y 2200 m de profundidad durante el proyecto TALUD. De las 31 especies conocidas de las aguas del Pacífico de México, 13 han sido encontradas en la zona de la corriente de California, 20 en el golfo de California y 14 (o quizás 15) en el SO de México. L istado sistemático de los equinodermos de aguas profundas 379 Distribución batimétrica Los Equinodermos que han sido registrados en las aguas profundas del Pacífico mexicano poseen registros batimétricos muy amplios, desde 9 hasta 4880 m (profundidad máxima para Hyocrinus foelli Roux y Pawson, 1999) en el caso de los Crinoidea, entre 0 y 5780 m en el caso de los Asteroidea [especie más profunda: Eremicaster pacificus (Ludwig, 1905)], de 0 a 5969 m en el caso de las Ophiuroidea [profundidad máxima registrada tanto para Amphioplus daleus (Lyman, 1879) como para Ophiura irrorata (Lyman, 1860)], de 0 a 4950 m [esta última profundidad para Kamptosoma asterias (A. Agassiz, 1881)] en el caso de los Echinoidea y de 0 a 7250 m en el caso de las Holothuroidea (profundidad máxima alcanzada por Benthodytes sanguinolenta Théel, 1882) (Maluf 1988). Sin embargo, es de resaltar que muchos límites batimétricos individuales (i.e., por cada especie) corresponden ocasionalmente a registros aislados o en otras regiones del mundo o en latitudes más altas en el Pacífico este (e.g, desde California hasta Alaska), donde las temperaturas del agua son mucho más bajas en relación con la profundidad. Por este motivo, algunas especies típicamente boreales logran extender su distribución hasta zonas templadas, o incluso tropicales, invadiendo aguas más profundas (y más frías). Este fenómeno, conocido como “sumersión tropical”, existe también en otros grupos faunísticos (Briggs 1987, Dean 2004). Abundancia y composición en especies de las muestras de los cruceros TALUD La abundancia absoluta (número total de especímenes recolectados) fue muy variable según el grupo de equinodermos. En el caso de los Asteroidea se recolectaron 335 especímenes. Debido a la extraordinaria abundancia de dos especies, se pudo contar con un total de 2393 especímenes de Echinoidea. Comparativamente, solo se contó con 74 ejemplares de Holothuroidea. En el caso de los Ophiuroidea, el número aproximado de especímenes recolectados es de 1700 pero no se han revisado con atención la totalidad de las muestras. Además, se obtuvieron cuatro especímenes de Crinoidea. En total fueron ca 4500 especímenes de equinodermos recolectados. De manera global, el nivel de representación de la fauna de equinodermos de aguas profundas en las muestras del TALUD fue bajo. De un total de 44 especies potencialmente accesibles para la zona de muestreo (i.e., solamente con registros 380 Biodiversidad y comunidades del talud continental del Pacífico mexicano en el golfo de California, en el SO de México o en ambos, ya que durante el proyecto TALUD no se efectuaron muestreos en la zona de la corriente de California), se recolectaron solamente 49 (30 %). A nivel de clases, el número de especies recolectadas (y los porcentajes correspondientes) son como sigue: una de dos especies en el caso de los Crinoidea, aunque no queda claro si la especie recolectada pertenece a una de las especies ya conocidas para la región o si se trata de un primer registro o de una especie nueva; 18 de 46 especies (39 %) en el caso de los Asteroidea; 8 de 50 especies (16 %) en el caso de las Ophiuroidea; 4 de 18 especies (22 %) en el caso de los Echinoidea; y 18 de 26 especies (69 %) en el caso de las Holothuroidea. Es de recordar que en el caso de las ofiuras quedan por identificarse por lo menos unas siete especies adicionales. Discusión Considerando el material recolectado durante las campañas TALUD y a pesar de las enormes limitaciones en cuanto al número de estaciones visitadas (en total se efectuaron 179 arrastres, algunos de los cuales salieron sin especímenes) en comparación con la extensión de la zona de trabajo (casi 12 grados de latitud), se obtuvo una buena representación de los equinodermos en las muestras: 56 especies con un total de aproximadamente 4500 especímenes. Uno de los aspectos más importantes de este estudio es el haber podido definir con cierta precisión la composición de las comunidades de equinodermos que se encuentran cerca del límite inferior de la ZMO y más allá, hasta profundidades del orden de 2000 m. Obviamente, se requiere de una amplia serie de muestreos adicionales en la misma zona y en las zonas adyacentes del Pacífico mexicano (i.e., la corriente de California y el área al sur de Acapulco, incluyendo el golfo de Tehuantepec) para poder completar nuestros conocimientos acerca de esta fauna muy particular. La presencia de una amplia ZMO en el Pacífico mexicano es determinante para la pesca en aguas someras (50-200 m) y en la porción superior del talud continental, donde la macrofauna es prácticamente inexistente. Por otro lado, esta ZMO juega un papel trascendental para la distribución de las especies e impide, de acuerdo con lo que se observó durante las campañas, contactos e intercambios entre la fauna de la plataforma continental y la fauna que se encuentra por debajo de la ZMO (Hendrickx 2001, 2003, Zamorano et al. 2007, Hendrickx y Serrano 2010). Esta barrera tiene consecuencias en los patrones de distribución geográfica y batimétrica de las especies en el área. Sin embargo, el impacto real de la ZMO L istado sistemático de los equinodermos de aguas profundas 381 sobre las comunidades naturales del Pacífico mexicano no podrá ser entendido plenamente hasta que se pueda contar con bases de datos biológicos y ambientales más completos. Para ello, es imprescindible aumentar de manera muy significativa la cantidad de estudios acerca de estos ambientes. Agradecimientos Se agradece a los miembros del equipo científico y a la tripulación del B/O “El Puma” por el apoyo proporcionado durante las campañas TALUD. El proyecto TALUD recibió el apoyo de Conacyt (proyecto 31805-N) y de la Dirección General de Apoyo al Personal Académico (DGAPA; proyecto PAPIIT IN 217306-3). La edición final así como la preparación de las figuras de este manuscrito fue realizada por Mercedes Cordero Ruiz. Algunas de las fotos fueron tomadas por Carlomagno Zárate y se agradece a K. Sheng por la figura 1, A (www.Flickr.com). Se agradece a Gordon Hendler, Natural History Museum of Los Angeles County, por la identificación de las ofiuras recolectadas en los cruceros TALUD y citadas en este trabajo y sus comentarios acerca del género Dougaloplus. Referencias Agassiz, A. 1881. Report on the Echinoidea dredged by H.M.S. Challenger during the years 1873-1876. Report of the Scientific Results of the Voyage of H.M.S. “Challenger” 1873-76 3(9): 1-321. Agassiz, A. 1892. Reports on an exploration off the west coasts of Mexico, Central and South America, and off the Galapagos Islands, in charge of Alexander Agassiz, by the U.S. Fish Commission steamer “Albatross”, during 1891, Lieut. Commander Z.L. Tanner, U.S.N., commanding. l. Calamocrinus diomedeae, a new stalked crinoid, with notes on the apical system and the homologies of echinoderms. Memoirs of the Museum of Comparative Zoology at Harvard College 17(2): 1-95. Agassiz, A. 1898. Reports on the dredging operations off the west coast of Central America, Mexico and the Gulf of California by the U.S.S. “Albatross” during 1891. Preliminary report on the Echini. Bulletin of the Museum of Comparative Zoology at Harvard University 32(5):71-86. Agassiz, A. 1904. The Panamic Deep Sea Echini. Report XXXII on an exploration off the west coasts of Mexico, Central and South America, and off the Galapagos Islands. Memoirs of the Museum of Comparative Zoology at Harvard College 31:1-243. 382 Biodiversidad y comunidades del talud continental del Pacífico mexicano Alvarado, J.J. y J. Cortés 2005 (eds.). Estudios Latinoamericanos en Equinodermos. Revista de Biología Tropical 53 (Supl. 3): 1-382. Alvarado, J.J. y J. Cortés 2008 (eds.). Estudios Latinoamericanos en Equinodermos II. Revista de Biología Tropical 56 (Supl. 3): 1-360. Benítez-Villalobos, F. 2001. Comparación de la comunidad de equinodermos, asociados a arrecifes, en dos localidades de las Bahías de Huatulco, Oaxaca, México. Ciencia y Mar 5 (13): 19-24. Briggs, J.C. 1987. Antitropical distribution and evolution in the Indo-West Pacific Ocean. Systematic Zoology 36(3): 237-247. Brusca, R.C. y G.J. Brusca. 2002. Invertebrates. Segunda edición. Sinauer Associates, Inc., EE.UU. 895 pp. Caso, ME., 1954. Contribución al conocimiento de los Holoturoideos de México: Algunas especies de Holoturoideos litorales y descripción de una nueva especie, Holothuria portovallartensis. Anales del Instituto de Biología, Universidad Nacional Autónoma de México 25: 417-442. Caso M.E. 1976. El estado actual del estudio de los equinodermos de México. Anales del Centro de Ciencias del Mar y Limnología, Universidad Nacional Autónoma de México 3(1): 1-56. Caso M.E. 1978. Los Equinoideos del Pacifico de Mexico. Parte primera. Ordenes Cidaroida y Aulodonta. Parte segunda. Ordenes Stiridonta y Camarodonta. Anales del Instituto de Ciencias del Mar y Limnología, Universidad Nacional Autónoma de México 1: 1-244. Caso M.E. 1980. Los Equinoideos del Pacifico de Mexico. Parte tercera. Orden Clypeasteroida. Anales del Centro de Ciencias del Mar y Limnología, Universidad Nacional Autónoma de México Publ. esp. 4: 1-252. Caso M.E. 1983. Los Equinoideos del Pacifico de Mexico. Parte cuarta. Ordenes Cassiduloida y Spatangoida. Anales del Centro de Ciencias del Mar y Limnología, Universidad Nacional Autónoma de México 6 :1-200. Caso, ME., 1986. Los equinodermos del Golfo de California colectados en las campañas Sipco I-II-III, a bordo del B/O EL PUMA. Anales del Instituto de Ciencias del Mar y Limnología, Universidad Nacional Autónoma de México 13 (1): 91-184. Caso M.E. 1992. Los equinodermos Acteroideos, ofiuroideos y equinoideos de la Bahía de Mazatlán, Sinaloa. Anales del Centro de Ciencias del Mar y Limnología, Universidad Nacional Autónoma de México 11: 1-214. Cintra-Buenrostro, C.E. 2001. Los asteroideos (Echinodermata: Asteroidea) de aguas someras del Golfo de California, México. Oceánides 16 (1): 49-90. L istado sistemático de los equinodermos de aguas profundas 383 Clark, A. M. 1970. Notes on the Family Amphiuridae (Ophiuroidea). Bulletin of the British Museum (Natural History) Zoology 19:1-81. Clark, H.L. 1901. The Holothurians of the Pacific Coast of north America. Zoologischer Anzeiger 24: 162-171. Clark, H.L. 1913. Echinoderms from Lower California, with Descriptions of New Species. Bulletin of the American Museum of Natural History 32 (8): 185-236. Clark, H.L. 1920a. Reports on the Scientific Results of the Expedition to the Eastern Tropical Pacific, in Charge of Alexander Agassiz, by the U.S. Fish Commission Steamer “Albatross”, from October, 1904, to March, 1905, Lieut. Commander L.M. Garrett, U.S.N., Commanding, XXXII: Asteroidea. Memoirs of the Museum of Comparative Zoology at Harvard College 39 (3): 75-113. Clark, H.L. 1920b. Reports on the scientific results of the expedition of the “Albatross” to the tropical Pacific, 1899-1900 and 1904-1905. XXXIII: Holothuroidea. Memoirs of the Museum of Comparative Zoology at Harvard College 39(4):121-154. Clark, H.L. 1923. Echinoderms from Lower California, with descriptions of new species: supplementary report. Bulletin of the American Museum of Natural History 48 (6): 147-163. Dean, H.K. 2004. Marine biodiversity of Costa Rica: Class Polychaeta (Annelida). Revista de Biología Tropical 52 (supl. 2): 131-181. Deichmann, E. 1937. The Templeton Crocker Expedition. IX. Holothurians from the Gulf of California, the West Coast of Lower California, and Clarion Island. Zoologica. (NY) 22: 161-176. Deichmann, E. 1941. The Holothurioidea collected by the VELERO III during the years 1932– 1938. Part I. Dendrochirotida. Allan Hancock Pacific Expeditions 8 (3): 61–195. Deichmann, E. 1958. The Holothuroidea collected by the VELERO III and IV during the years 1932 to 1954. Part II. Apsidochirota. Allan Hancock Pacific Expeditions 11(2): 239-349. Fisher, W.K. 1911. Asteroidea of the North Pacific and adjacent waters. Part l. Phanerozonia and Spinulosa. Bulletin of the United States National Museum 76: 1-419. Fisher, W.K. 1928. Asteroidea of the North Pacific and adjacent waters. Part 2. Forcipulata. Bulletin of the United States National Museum 76 (2): 1-245. Fisher, W.K. 1930. Asteroidea of the North Pacific and adjacent waters. Part 3. Forcipulata. Bulletin of the United States National Museum 76 (3) 1-356. Hendler, G. 1996. Ophiuroidea. Pp. 1-66. En: J.A. Blake y A. Lissner (eds.). Taxonomic Atlas of the Benthic Fauna of the Santa Maria Basin and Western Santa Barbara Channel. Santa Barbara Museum of Natural History. 384 Biodiversidad y comunidades del talud continental del Pacífico mexicano Hendrickx, M.E. 2001. Occurrence of a continental slope decapod crustacean community along the edge of the minimum oxygen zone in the south eastern Gulf of California, Mexico. Belgian Journal of Zoology 131 (2): 95-109. Hendrickx, M.E. 2003. Geographic and bathymetric distributions of species of Munidopsis (Crustacea: Decapoda: Galathaeidae) in the SE Gulf of California, Mexico. Pp. 21-30. En: M.E. Hendrickx (ed.). Contributions to the Study of East Pacific Crustaceans 2. [Contribuciones al Estudio de los Crustáceos del Pacífico Este 2]. Instituto de Ciencias del Mar y Limnología, UNAM. México, D.F. Hendrickx, M.E. 2011. Operaciones oceanográficas en aguas profundas: los retos del pasado, del presente y del proyecto TALUD en el Pacífico mexicano (1989-2009). Pp23-104. En: P. Zamorano, M.E. Hendrickx y M. Caso (eds.). Biodiversidad y comunidades del talud continental del Pacífico mexicano. Instituto Nacional de Ecología, Secretaría del Medio Ambiente y Recursos Naturales (Semarnat). Hendrickx, M.E., y D. Serrano. 2010. Impacto de la zona de mínimo de oxígeno sobre los corredores pesqueros en el Pacífico mexicano. Interciencia 35 (1): 12-18. Hendrickx, M.E., C. Mah y C.M. Zárate Montes. 2011. Deep-water Asteroidea (Echinodermata) collected during the TALUD cruises in the Gulf of California, Mexico. Revista Mexicana de Biodiversidad 82: 798-824. Honey-Escandón, M., F.A. Solís-Marín y A. Laguarda-Figueras. 2008. Equinodermos (Echinodermata) del Pacífico Mexicano. Revista de Biología Tropical 56 (3): 57-73. Lambert, P. 2000. Sea Stars of British Columbia, Southeast Alaska, and Puget Sound. Royal British Columbia Museum Handbook. UBC Press, Vancouver, BC. 186 pp. Ludwig, H.L. 1894. Report on an Exploration off the west coasts of Mexico, Central and South America, and off the Galapagos Islands, in charge of Alexander Agassiz, by the U.S. Fish Commission Steamer “Albatross” during 1891, Lt. Z.L. Tanner U.S.N., Commanding. XII. The Holothurioidea. Memoirs of the Museum of Comparative Zoology at Harvard College 17(3): 1-183. Ludwig, H.L. 1905. Reports on an Exploration off the West Coasts of Mexico, Central and South America, and off the Galapagos Islands, in Charge of Alexander Agassiz, by the U.S. Fish Commission Steamer “Albatross”, during 1891, Lieut. Commander Z.L. Tanner, U.S.N., Commanding and Reports on the Scientific Results of the Expedition to the Tropical Pacific, in Charge of Alexander Agassiz, on the U.S. Fish Commission Steamer “Albatross”, from August, 1899, to March, 1900, Commander Jefferson F. Moser, U.S.N. Commanding. VII. Asteroidea. Memoirs of the Museum of Comparative Zoology at Harvard College 32: 1-292. L istado sistemático de los equinodermos de aguas profundas 385 Lütken, C.F. y T. Mortensen. 1899. Reports on an exploration off the west coasts of Mexico, Central and South America, and off the Galapagos Islands, in charge of Alexander Agassiz, by the U.S. Fish Commission Steamer “Albatross”, during 1891, Lieut. Commander Z.L. Tanner, U.S.N., Commanding. XXV. The Ophiuridae. Memoirs of the Museum of Comparative Zoology at Harvard College 23: 1-97. Mah, C. 2007. Phylogeny of the Zoroasteridae (Zorocallina; Forcipulatida): evolutionary events in deep-sea Asteroidea displaying Palaeozoic features. Zoological Journal of the Linnean Society 150: 177-210. Maluf, L.Y. 1988. Composition and distribution of the Central Eastern Pacific Echinoderms. Technical Report, Natural History Museum of Los Angeles County 2: 1-242. Maluf, L.Y. 1991. Echinoderm Fauna of the Galapagos Islands. Chapter 16. Pp. 345-367. En: M.J. James (ed.). Galapagos Marine Invertebrates: Taxonomy, Biogeography and Evolution in Darwin’s Islands. Plenum Press. Nueva York, EE.UU. Maluf, L.I. y R.C. Brusca. 2005. Echinodermata. Chapter 18. Pp. 327-343. En: M. E. Hendrickx, R. C. Brusca y L.T. Findley (eds.). A Distributional checklist of the macrofauna of the Gulf of California, Mexico. Part I. Invertebrates. [Listado y distribución de la macrofauna del golfo de California, México, Parte I. Invertebrados]. Arizona-Sonora Desert Museum, Tucson, Az. EE.UU. Massin, C. y M.E. Hendrickx. 2010. A new species of deep-water Holothuroidea (Echinodermata) of the genus Synallactes from off western Mexico. Scientia Marina 74 (3): 599-603. Massin, C. y Hendrickx, M.E. 2011. Deep-water Holothuroidea (Echinodermata) collected during the TALUD cruises off the Pacific coast of Mexico, with the description of two new species. Revista Mexicana de Biodiversidad 82: 413-443. Matsumoto, H. 1917. A monograph of Japanese Ophiuroidea arranged according to a new classification. Journal of the College of Science, Imperial University of Tokyo 38(2): 1-408. Nybakken, J., S. Craig, L. Smith-Beasley, G. Moreno, A. Summers y L. Weetman. 1998. Distribution density and relative abundance of benthic invertebrate megafauna from three sites at the base of the continental slope off central California as determined by camera sled and beam trawl. Deep-Sea Research II 45: 1753-1780. Roux, M. 2004. New hycrinid crinoids (Echinodermata) from submersible investigations in the Pacific Ocean. Pacific Science 58: 597-613. Solís-Marín, F.A. 2003. Systematics and phylogeny of the holothurian family Synallactidae. Ph.D. thesis, University of Southampton, Gran Bretaña. 356 pp. 386 Biodiversidad y comunidades del talud continental del Pacífico mexicano Solís-Marín, F.A., H. Reyes-Bonilla, M.D. Herrero-Pérezrul, O. Arizpe-Covarrubias y A. Laguarda-Figueras. 1997. Sistemática y distribución de los equinodermos de la bahía de La Paz. Ciencias Marinas 23 (2): 249-263. Solís-Marín, F.A., A. Laguarda-Figueras, A. Durán-González, C. Gust Ahearn y J. Torres Vega. 2005. Echinoderms (Echinodermata) from the Gulf of California, México. Revista de Biología Tropical 53 (3): 123-137. Solís-Marín, F.A., J.A. Arriaga-Ochoa, A. Laguarda-Figueras, S.C. Frontana-Uribe y A. Durán-González. 2009. Holoturoideos (Echinodermata: Holothuroidea) del Golfo de California. Comisión Nacional par el Conocimiento y Uso de la Biodiversidad e Instituto de Ciencias del Mar y Limnología, UNAM, México, D.F. 177 pp. Tilot, V. 2006. Biodiversité et distribution de la mégafaune. Vol. 2. Atlas photographique annoté des échinodermes de la zone de fractures de Clarion et de Clipperton. Paris, UNESCO/IOC. IOC Technical Series 69:1-62. WoRMS. 2011. World Register of Marine Species. http://www.marinespecies.org (marzo 2011). Zamorano, P. y G. E. Leyte-Morales. 2005. Cambios en la diversidad de equinodermos asociados al arrecife coralino de La Entrega, Oaxaca, México. Ciencia y Mar 9(27): 19-27. Zamorano, P. y G. E. Leyte-Morales. 2009. Equinodermos asociados a formaciones arrecifales en Zihuatanejo y Acapulco, Guerrero, México. Boletín de Investigaciones Marinas y Costeras 38 (2): 7-28. Zamorano, P., M.E. Hendrickx y A. Toledano Granados. 2007. New geographic and depth records for deep-water mollusks in the Gulf of California, Mexico. Nuevos registros geográficos y batimétricos para moluscos de mar profundo en el Golfo de California, México. Revista Mexicana de Biodiversidad 78 (2): 311-318. Ziesenhenne, F.C. 1937. Echinoderms from the west coast of Lower California, the Gulf of California and CIarion Island. Zoologica (N.Y.) 22 (15): 209-239. L istado sistemático de los equinodermos de aguas profundas 387 Anexo 1. Anexo 1. Lista de especies de Echinodermata de aguas profundas (≥ 350 m) registradas en el Pacífico mexicano. Las especies recolectadas durante las campañas TALUD aparecen en negritas. Fuentes principales: Maluf (1988); Solis et al. (2005); HoneyEscandón et al. (2008); Massin y Hendrickx (2011); Hendrickx et al. (2011a). Crinoidea Comatulida Antedonidae Florometra serratissima (A.H. Clark, 1907) Florometra tanneri (Hartlub, 1895) Hyocrinida Hyocrinidae Hyocrinus foelli Roux y Pawson, 1999 Asteroidea Paxillosida Luidiidae Luidia asthenosoma Fisher, 1906 Luidia foliolata Grube, 1865 Astropectinidae Astropecten ornatissimus Fisher, 1906 Astropecten verrilli de Loriol, 1899 Dipsacaster letmophylus Fisher, 1910 Dytaster gilberti Fisher, 1905 Leptychaster inermis (Ludwig, 1905) Psilaster armatus Ludwig, 1905 Psilaster pectinatus (Fisher, 1905) Trissacanthias penicillatus (Fisher, 1905) Porcellanasteridae Eremicaster crassus gracilis (Salden, 1883) (2) Eremicaster pacificus (Ludwig, 1905) Hyphalaster inermis Sladen, 1883 (3) Ctenodiscidae Ctenodiscus crispatus (Retzius, 1805) Notomyoida Benthopectinidae Benthopecten acanthonotus Fisher, 1905 Benthopecten pectinifer (Ludwig, 1905) Nearchaster aciculosus (Fisher, 1910) 388 Biodiversidad y comunidades del talud continental del Pacífico mexicano Anexo 1. Continúa Pectinaster agassizii (Ludwig, 1905) (4) Radiasteridae Radiaster sp. nov. Valvatida Goniasteridae Ceramaster leptoceramus (Fisher, 1905) Ceramaster grenadensis patagonicus Sladen, 1889 Cryptopeltaster lepidonotus Fisher, 1905 Mediaster aequalis Stimposn, 1857 Mediaster tenellus Fisher, 1905 Mediaster transfuga Ludwig, 1905 (5) Nymphaster diomedeae Ludwig, 1905 Odontasteridae Odontaster crassus Fisher, 1905 Pseudoarchasteridae Pseudarchaster pectinifer Ludwig, 1905 Pseudarchaster pulcher Ludwig, 1905 Pseudarchaster pusillus Fisher, 1905 Oreasteridae Anthenea mexicana A.H. Clark, 1916 (6) Poraniidae Poraniopsis inflatus Fisher, 1906 Velatida Solasteridae Lophaster furcilliger Fisher, 1905 (7) Lophaster validus (Ludwig, 1905) (7) Korethrasteridae Peribolaster biserialis Fisher, 1905 Myxasteridae Pythonaster pacificus Downey, 1979 Pterasteridae Hymenaster pellucidus W. Thomson, 1873 Hymenaster quadrispinosus Fisher, 1905 Hymenaster violaceus Ludwig, 1905 Pteraster jordani Fisher, 1905 Spinulosida Echinasteridae Henricia aspera Fisher, 1906 Henricia asthenactis Fisher, 1905 Henricia clarki Fisher, 1910 L istado sistemático de los equinodermos de aguas profundas 389 Anexo 1. Continúa Henricia gracilis (Ludwig, 1905) Henricia leviuscula (Stimpson, 1857) Henricia polyacantha Fisher, 1906 Henricia seminuda (A.H. Clark, 1906) Henricia sp. 1 ? Henricia sp. 2 Forcipulatida Zoroasteridae Cnemidaster nudus (Ludwig, 1905) Myxoderma platyacanthum (H.L. Clark, 1913) Myxoderma sacculatum (Fisher, 1905) Myxoderma longispinum (Ludwig, 1905) (8) Myxoderma qawashqari (Moyana y Larrain Prat, 1976) Sagenaster evermanni (Fisher, 1905) (9) Zoroaster actinocles Fisher, 1919 Zoroaster hirsutus Ludwig, 1905 Zoroaster ophiurus Fisher, 1905 Asteriidae Pisaster giganteus (Stimpson, 1857) Sclerasterias heteropaes Fisher, 1924 Pedicellasteridae Ampheraster chiroplus Fisher, 1928 Ampheraster hyperoncus (H.L. Clark, 1913) Ampheraster marianus (Ludwig, 1905) Anteliaster coscinactis Fisher, 1923 Pycnopodiidae Pycnopodia helianthoides (Brandt, 1835) Labidiasteridae Rathbunaster californicus Fisher, 1906 Brisingida Brisingidae Astrolirus panamensis (Ludwig, 1905) Ophiuroidea Asteronychidae Asteronyx loveni Müller y Troschel, 1842 Asternonyx excavata Lütken y Mortensen, 1899 Asteroschematidae Asteroschema sublaeve Lütken y Mortensen, 1899 390 Biodiversidad y comunidades del talud continental del Pacífico mexicano Anexo 1. Continúa Ophiacanthidae Ophiacanthinae Ophiacantha adiaphora H.L. Clark, 1911 Ophiacantha costata Lütken y Mortensen, 1899 Ophiacantha diplasia H.L. Clark, 1911 Ophiacantha eurypoma H.L. Clark, 1911 Ophiacantha hirta Lütken y Mortensen, 1899 Ophiacantha moniliformis Lütken y Mortensen, 1899 Ophiacantha pacifica Lütken y Mortensen, 1899 Ophiacantha normani Lyman, 1879 Ophiacantha phragma Ziesenhenne, 1940 Ophiacantha quadrispina H.L. Clark, 1917 Ophiacantha rhachophora H.L. Clark, 1911 Ophiacantha sentosa Lyman, 1878 Ophiotominae Ophiolimna bairdi (Lyman, 1883) Ophioplinthacinae Ophiomitra granifera ( Lütken y Mortensen, 1899) Ophiomitra partita ( Lütken y Mortensen, 1899) Amphilepidae Amphilepis patens Lyman, 1879 Amphiuridae Amphiodia assimilis ( Lütken y Mortensen, 1899) Amphiodia occidentalis (Lyman, 1860) Amphiodia periercta H.L. Clark, 1911 Amphiodia urtica (Lyman, 1860) Amphioplus daleus (Lyman, 1879) Amphioplus strongyloplax (H.L. Clark, 1911) Amphipholis pugetana (Lyman, 1860) Amphipholis squamata (Delle Chiaje, 1828) Amphiura arcystata H.L. Clark, 1911 Amphiura carchara H.L. Clark, 1911 Amphiura diomedeae Lütken y Mortensen, 1899 Amphiura seminuda Lütken y Mortensen, 1899 Amphiura serpentina Lütken y Mortensen, 1899 Dougaloplus amphacanthus (McClendon, 1909) Dougaloplus gastracanthus ( Lütken y Mortensen, 1899) Dougaloplus notacanthus ( Lütken y Mortensen, 1899) Microphiopholis puntarenae ( Lütken, 1856) Ophiocnida californica Ziesenhenne, 1940 L istado sistemático de los equinodermos de aguas profundas 391 Anexo 1. Continúa Ophiactidae Histampica duplicata (Lyman, 1875) Ophiactis simplex (Le Conte, 1851) Ophiopholis kennerlyi (Lyman, 1860) Ophiopholis bakeri McClendon, 1909 Ophiopholis longispina H.L. Clark, 1911 Ophiotrichidae Ophiothrix galapagensis Lütken y Mortensen, 1899 Ophiothrix spiculata Le Conte, 1851 Ophiochitonidae Ophiochiton carinatus Lütken y Mortensen, 1899 Ophionereidae Ophionereis eurybrachiplax H.L. Clark, 1911 Ophiuridae Ophiurinae Amphiophiura oligopora (H.L. Clark, 1913) Amphiophiura cf. ponderosa (Lyman 1878) Amphiophiura superba ( Lütken y Mortensen, 1899) Gymnophiura mollis Lütken y Mortensen, 1899 Ophiocten hastatum Lyman, 1878 Ophiura bathybia H.L. Clark, 1911 Ophiura flagellata (Lyman, 1878) Ophiura irrorata (Lyman, 1860) Ophiura luetkeni (Lyman, 1860) Ophiura sarsii Lütken, 1855 Ophiura scutellata ( Lütken y Mortensen, 1899) Ophioleucinae Ophiernus adspersus annectens Lütken y Mortensen, 1899 Ophiernus seminudus Lütken y Mortensen, 1899 Ophiolepididae Ophiosphalma glabrum (Lütken y Mortensen, 1899) Ophiosphalma jolliensis (McClendon, 1909) Ophiomusium lymani Wyville Thomson, 1873 Ophiomusium variabile Lütken, 1899 Echinoidea Cidaroida Cidaridae Hesperocidaris perplexa (H.L. Clark, 1907) Ctenocidaridae 392 Biodiversidad y comunidades del talud continental del Pacífico mexicano Anexo 1. Continúa Aporocidaris milleri (A. Agassiz, 1898) Echinothurioida Echinothuriidae Sperosomatinae Tromikosoma hispidum (A. Agassiz, 1898) Tromikosoma panamense (A. Agassiz, 1898) Tromikosoma sp. Kamptosomatidae Kamptosoma asterias (A. Agassiz, 1881) Camarodonta Strongylocentrotidae Allocentrotus fragilis (Jackson, 1912) Holasteroida Pourtalesiidae Cystocrepis setigera (A. Agassiz, 1898) Pourtalesia tanneri A. Agassiz, 1898 Plexechinidae Plexechinus cinctus A. Agassiz, 1898 Urechinidae Urechinus giganteus A. Agassiz, 1898 Urechinus loveni (A. Agassiz, 1898) Urechinus reticulatus H.L. Clark, 1913 Spatangoida Brissidae Brissopsinae Brissopsis columbaris A. Agassiz, 1898 Brissopsis pacifica (A. Agassiz, 1898) Spatangidae Spatangus californicus H.L. Clark, 1917 Maretiidae Homolampas fulva A. Agassiz, 1879 Nacospatangus depressus H.L. Clark, 1917 Schizasteridae Brisaster latifrons (A. Agassiz, 1898) Brisaster towsendi (A. Agassiz, 1898) Clypeasteroida Clypeasteridae Arachnoidinae Clypeaster europacificus H.L. Clark, 1914 L istado sistemático de los equinodermos de aguas profundas 393 Anexo 1. Continúa Holothuroidea Dendrochirotida Psolidae Psolidium gracile Ludwig, 1894 Psolus cf. squamatus (O.F. Müller, 1776) Cucumariidae Abyssocucumis abyssorum (Théel, 1886) (1) Abyssocucumis albatrossi (Cherbonnier, 1941) (2) Dactylochirotida Vaneyellidae Mitsukuriella unusordo Massin y Hendrickx, 2011 Ypsilothuriidae Ypsilocucumis californiae Massin y Hendrickx, 2011 Ypsilothuria bitentaculata (Ludwig, 1893) (3) Aspidochirotida Synallactidae Bathyplotes sp. Paelopatides confundens Théel, 1886 Pseudostichopus mollis Théel, 1886 Synallactes sagamiensis Augustin, 1908 (4) Synallactes alexandri Ludwig, 1894 Synallactes virgulasolida Massin y Hendrickx, 2010 Elasipodida Deimatidae Oneirophanta mutabilis mutabilis Théel, 1879 Laetmogonidae Laetmogone scotoeides (H.L. Clark, 1913) Laetmogone wyvillethomsoni Théel, 1879 Pannychia moseleyi Théel, 1882 Psychropotidae Psychronaetes hanseni Pawson, 1983 Benthodytes sanguinolenta Théel, 1882 (5) Psychropotes longicauda Théel, 1882 (6) Elpidiidae Peniagone intermedia Ludwig, 1894 Peniagone papillata Hansen, 1975 Peniagone sp. Scotoplanes clarki Hansen, 1975 Scotoplanes globosa (Théel, 1879) Apodida Anexo 1. Continúa Synaptidae Leptosynapta albicans (Selenka, 1867) Molpadiida Molpadiidae Molpadia granulata (Ludwig, 1894) (7) Molpadia intermedia (Ludwig, 1894) Molpadia musculus Risso, 1826 Hedingia californica (Ludwig, 1894) (8) Paracaudina chilensis (J. Müller, 1850) L istado sistemático de los equinodermos de aguas profundas 395 Sección IV Vertebrados Nuevo registro de la quimera prieta del Pacífico este, Hydrolagus melanophasma James, Ebert, Long y Didier, 2009 (Halocephali, Chimaeiformes, Chimaeridae), en el Pacífico central mexicano Hugo Aguirre-Villaseñor1, Carolina Salas-Singh2 y Juan Madrid Vera1 Introducción Hydrolagus melanophasma James, Ebert, Long y Didier, 2009, pertenece al orden Chimaeriformes, familia Chimaeridae (denominados quimeras o tiburones fantasma). Los Chimaeriformes son el único orden superviviente de la subclase Holocephali, perteneciente a la clase Chondrichthyes. Contiene 49 especies incluidas en tres familias: Callorhinchidae (un género y tres especies), Chimaeridae (dos géneros y 38 especies) y Rhinochimaeridae (tres géneros y ocho especies) (Eschmeyer y Fong 2010). Las quimeras se distribuyen en los océanos Atlántico, Índico y Pacífico en aguas templadas y tropicales, generalmente por debajo de los 200 m de profundidad. Su extraño aspecto, en el que se aprecia una cabeza protuberante, una boca que se asemeja a la de un conejo y una larga cola que recuerda a la de una rata, les ha valido el nombre de quimeras, que toman del monstruo de la mitología griega formado por partes de diversos animales. Se distinguen por su corto y redondeado hocico, la primera aleta dorsal eréctil con una fuerte espina y Instituto Nacional de Pesca, Centro Regional de Investigación Pesquera-Mazatlán, Calzada Sábalo-Cerritos s/n, AP 1177, Sinaloa, México. Correo-e: [email protected]. 2 Posgrado en Ciencias del Mar y Limnología. Instituto de Ciencias del Mar y Limnología, Unidad Académica Mazatlán, Universidad Nacional Autónoma de México, Joel Montes Camarena s/n, Mazatlán 82040, Sinaloa, México. 1 399 la segunda aleta dorsal larga y baja. La aleta caudal es dificerca, con forma simétrica y puntiaguda. Su estructura interna es también simétrica, siendo la columna vertebral su eje de simetría dificerca. La aleta anal confluye con la aleta caudal en Hydrolagus Gill, 1862 y se separa en Chimaera Linnaeus, 1758. Se alimentan de pequeños peces e invertebrados. Los machos presentan un clasper cefálico (pequeño apéndice en la zona anterior de la cabeza). Son especies ovovivíparas que depositan sus huevos envueltos en una fina y larga cápsula sobre el fondo. Una espina venenosa situada delante de la aleta dorsal les permite inyectar veneno a cualquier animal que los ataque (Nelson 1994). Hydrolagus melanophasma fue descrita recientemente (James et al. 2009); sin embargo, su presencia ya había sido reconocida para las aguas del oeste del océano Pacífico Este (Hubbs et al. 1979, Eschmeyer et al. 1983, Ebert 2003). Esta nueva especie fue reconocida por primera vez en 1965 por Carl L. Hubbs (Scripps Institute of Oceanography) quien recolectó dos especímenes en la costa pacífica de Baja California, México. Subsecuentemente, otros especímenes han sido grabados en video, por vehículos operados a control remoto (ROV), al sur y dentro del golfo de California, México (Fig. 1). Recientemente se reportaron dos hembras adultas y un macho adulto en las costas de Chile (Bustamante et al. 2012) y un macho adulto en las costas de Ecuador (Aguirre et al. en prensa). Hydrolagus melanophasma habita sobre fondos suaves o parches empedrados con un mínimo relieve vertical. Se distingue de las otras quimeras reportadas para el océano Pacífico Este por las siguientes características: una coloración negra uniforme a lo largo del cuerpo, espina de la primera aleta dorsal curvada ligeramente mayor a la altura de la primera aleta dorsal, segunda aleta dorsal larga y de altura uniforme, aletas pectorales grandes que se extienden más allá de la inserción de las aletas pélvicas; en los machos se presenta un clasper ventral trífido que se bifurca aproximadamente un cuarto de la longitud total del mismo (James et al. 2009). En la ontogenia de las quimeras son comunes los cambios morfométricos, pero han sido poco citados (Barnett et al. 2009, Didier 2004, Møller et al. 2004). La descripción de H. melanophasma se basó en machos adultos cercanos a 1000 mm de longitud total (LT) (Holotipo 923 mm LT). Aguirre-Villaseñor et al. (en prensa) compararon las características merísticas y morfométricas de una hembra juvenil con la descripción original, encontraron que el cuerpo de la hembra es más largo y alto; sin embargo, las medidas morfométricas respecto a la longitud de la cabeza se mantienen similares. Al parecer, la naturaleza conservativa de la longitud de las líneas laterales de la cabeza y el crecimiento de la longitud de la cabeza mantienen 400 Biodiversidad y comunidades del talud continental del Pacífico mexicano Fig 1. Mapa de distribución de Hydrolagus melanophasma. La estrella negra marca la localización del holotipo, la estrella blanca la de los paratipos, el triángulo negro la localización de los especímenes no tipo, el círculo negro la localización de la filmación con el ROV (Remote Operated Vehicle) (James et al. 2009) y el cuadro negro la hembra juvenil del presente reporte. la configuración precisa del sistema de líneas laterales mecanoreceptoras a lo largo de la ontogenia. El género Hydrolagus agrupa 26 especies validas conocidas (Eschmeyer y Fong 2010). Seis de ellas habitan el este del océano Pacífico: Hydrolagus alphus Quaranta, Didier, Long y Ebert, 2006, ha sido señalado alrededor de las islas Galápagos, Ecuador (Quaranta et al. 2006); H. colliei (Lay y Bennett, 1839) se distribuye del sureste de Alaska, EE.UU., hasta la punta de la península de Baja California, México y dentro de la parte norte del golfo de California, México (Barnett et al. 2009); H. macrophthalmus De Buen, 1959, desde Manzanillo, Colima, México hasta Valparaiso, Chile (González-Acosta et al. 2010); H. mccoskeri Barnet, Didier, Long y Ebert, 2006, alrededor de las islas Galápagos, Ecuador (Barnet et al. 2006); H. melanophasma James, Ebert, Long y Didier, 2009, desde el sureste de California, EE.UU., hasta la punta de la península de Baja California, México y dentro del golfo de California, México (James et al. 2009); y H. pallidus Hardy y Stehmann, 1990, alrededor del archipiélago de Juan Fernández, Chile (Andrade y Pequeño 2006). N uevo registro de la quimera prieta del P acífico este 401 Este nuevo registro confirma la presencia de Hydrolagus melanophasma dentro del intervalo de distribución conocido en el Pacífico Este, desde el sur de California, EE.UU., hasta Valdivia, Chile. Hasta el momento ningún juvenil de esta especie había sido reportado, el presente trabajo constituye el primer reporte de una hembra juvenil para esta especie. Adicionalmente se incluye una clave taxonómica para el reconocimiento de los holocéfalos del Pacífico mexicano y el golfo de California. Materiales y método El 29 de marzo de 2008, en la estación 9 del crucero TALUD XII, se recolectó una quimera prieta con un trineo bentónico. El arrastre se realizó en un intervalo batimétrico de 1392–1420 m a bordo de el B/O “El Puma” de la Universidad Nacional Autónoma de México a 1.7 nudos de velocidad y con una duración de 30 min. El organismo se fijó en una solución de formol al 10 % neutralizado con borato de sodio a pH 7 y, posteriormente, se conservó en alcohol al 70 %. En el laboratorio, la determinación del espécimen se realizó comparando las características merísticas y morfométricas indicadas por James et al. (2009); en el caso de las estructuras pareadas, las medidas se tomaron en el lado izquierdo. Las medidas y la abreviaciones utilizadas se definen en el apéndice 1. Resultados Se recolectó una hembra juvenil de H. melanophasma de 373 mm de LT y de 178 mm de LC (Fig. 2), en un intervalo batimétrico de 1392–1420 m, en la estación 9 del crucero TALUD XII, frente a las costas de Guerrero, México (17°10’16”N y 101°37’2”O). Este nuevo registro extiende el intervalo sureño de distribución de H. melanophasma ca 737 km ya que los datos previos planteaban una posición extrema de distribución de la especie hacia el sur en 23°48’N, tomándose como el intervalo actual de distribución desde los 23°48’ N hasta los 17°10’ N (Fig. 1). El organismo se depositó en la colección de referencia ictiológica del Instituto de Ciencias del Mar y Limnología, Unidad Académica Mazatlán (número de catálogo: EMU-PI: 20001) y está disponible para su consulta. Sobre la base de los trabajos de Compagno (1999), James et al. (2009) y Aguirre-Villaseñor et al. (2012), se elaboró la clave de las familias, géneros y especies de holocéfalos presentes en el Pacífico mexicano y golfo de California. 402 Biodiversidad y comunidades del talud continental del Pacífico mexicano Figura 2. Vista lateral del flanco izquierdo de Hydrolagus melanophasma (EMU-PI: 20001), hembra juvenil. A, organismo en fresco; B, organismo preservado. Escala, 50 mm. A B Clave de familias, géneros y especies del orden Chimaeriformes del Pacífico mexicano y del golfo de California. * No se cuenta con registro de ninguna especies de este género para la zona 1a. Hocico alargado y puntiagudo, aleta caudal dificerca (aleta caudal con forma simétrica y puntiaguda. Su estructura interna es también simétrica, siendo la columna vertebral su eje de simetría) aunque parece heterocerca (Aleta caudal cuyos lóbulos son diferentes, siendo el superior mayor que el inferior. Además, la columna vertebral se prolonga hacia el lóbulo superior, haciendo que sea éste de mayor tamaño). Familia: Rhinochimaeridae 1b Hocico corto y redondeado, el eje de la aleta caudal es horizontal, las aletas son prácticamente simétricas (dificerca), los lóbulos epaxial (por encima del eje) e hipaxial (por debajo del eje) de igual tamaño. Familia: Chimaeridae 2 Aleta caudal sin tubérculos en el margen dorsal, cabeza con perfil dorsal convexo, ojos por encima de la boca, placas dentarias anchas con bordes lisos, coloración café oscuro o negra. Harriotta raleighana Goode y Bean, 1895 N uevo registro de la quimera prieta del P acífico este 2 3 403 3a Aleta anal presente. Género Chimaera 3b Aleta anal ausente: Género Hydrolagus 4a Cuerpo café oscuro, negro o rojizo con lunares o marcas claras en cabeza, tronco o aletas. Hydrolagus colliei (Lay y Bennett, 1839) 4b. Cuerpo café oscuro o negro sin lunares o marcas claras. 5a. Cuerpo café oscuro o negro sin lunares o marcas claras en cabeza, tronco o aletas, la altura de la segunda aleta dorsal es constante a lo largo de esta, cabeza moderada (25–29.5% LBD), margen anterior de las aletas pectorales largo (38.5–40.9% LBD), espina dorsal corta (19 -19.5% LBD). En juveniles la cabeza (34.3% LBD) y el margen anterior de las aletas pectorales son más largos (43.3% LBD) y la espina dorsal más corta (15.2% LBD) que en adultos. Hydrolagus melanophasma, James, Ebert, Long y Didier, 2009 5b Cuerpo café oscuro sin marcas blancas, aletas azuladas, la altura de la segunda aleta dorsal es mayor en su porción anterior y posterior y presenta una depresión en su porción media, cabeza corta (18.6–22.2% LBD), margen anterior de las aletas pectorales corto (31.9–35.3% LBD), espina dorsal larga (26.3–31.1% LBD). Hydrolagus macrophthalmus De Buen, 1959 4 5 Longitud del cuerpo (LBD). Discusión La primera especie de halocéfalo conocida en el Pacífico mexicano fue la quimera narizona Harriotta raleighana Goode y Bean, 1895, la cual fue registrada como una nueva especie denominada H. curtissjamesi Townsend y Nichols, 1925 en la expedición “Albatross” (Est. 5685) en la costa occidental de la península de Baja California, a una latitud de 26° N (Townsend y Nichols 1925) y cuya distribución más sureña validada es frente a las costas de Manzanillo, Colima (Castro-Aguirre et al. 2007), la cual, sin embargo, fue mal citada como Harriota raleighana, con una sola t en el género en lugar de dos, y recientemente ha sido reportado frente a las costas de Ecuador (Aguirre-Villaseñor et al. en prensa) y Chile (Bustamante et al. 2012). Hydrolagus colliei fue registrada por primera vez en el alto golfo de California por Baldwin (1961), entre Guaymas e isla Tiburón (Mathews 1975), y frente a 404 Biodiversidad y comunidades del talud continental del Pacífico mexicano la bahía de la Paz (Balart et al. 1995), la cual fue mal citada como H. collei. En la costa occidental de la península de Baja California ha sido señalada frente a Punta Prieta, Baja California (González-Acosta et al. 1999) y bahía de Sebastián Vizcaíno (Ruiz et al. 2010). Hydrolagus melanophasma fue recolectada por primera vez en 1965 en la costa occidental de la península de Baja California, al oeste de Ensenada, México (paratipo) y dentro del golfo de California en 1977, en Punta Pescadera, Baja California, México (holotipo), en 1968 cercano a la isla Ángel de la Guarda, Baja California, México, y en el 2003 filmado (James et al. 2009), en el Pacífico Central mexicano frente a las costas de Guerrero, México (presente reporte). Agradecimientos Los autores agradecen a la UNAM por el tiempo de uso del B/O “El Puma” otorgado al grupo de científicos durante el crucero TALUD. Se agradece también a la tripulación y a los estudiantes por el apoyo proporcionado durante los muestreos. También a C. Ramírez por facilitarnos las referencias bibliográficas y G. Ramírez por su ayuda en la edición de las figuras. Referencias Aguirre-Villaseñor, H., C. Salas-Singh, J. Madrid-Vera, J. Martínez-Ortiz, D. A. Didier y D. A. Ebert (en prensa). New Eastern Pacific records of Hydrolagus melanophasma James, Ebert, Long, & Didier, with annotations of a juvenile female. Journal of fish Biology. Andrade, I. y G. Pequeño. 2006. Primer registro de Hydrolagus pallidus Hardy and Stehmann 1990 (Chondrichthyes: Chimaeridae) en el Océano Pacífico, con comentarios sobre los holocéfalos de Chile. Revista de Biologia Marina y Oceanografia 41: 111-115. Balart, E.F., J.L. Castro–Aguirre, D. Aurioles, F. García–Rodríguez y C. Villavicencio–Garayzar. 1995. Adiciones a la ictiofauna de Bahía de La Paz, Baja California Sur, México. Hidrobiológica 5: 79–85. Baldwin, W. J. 1961. First records of three northern fishes from the upper Gulf of California. Copeia 1961: 475-476. Barnett, L.K., D.A. Didier, D.J. Long y D.A. Ebert. 2006. Hydrolagus mccoskeri sp. nov., a new species of chimaeroid fish from the Galapagos Islands (Holocephali: Chimaeriformes: Chimaeridae). Zootaxa, 1328: 27–38. N uevo registro de la quimera prieta del P acífico este 405 Barnett, L. A. K., R.L. Earley, D.A. Ebert y G.M. Cailliet. 2009. Maturity, fecundity, and reproductive cycle of the spotted ratfish, Hydrolagus colliei. Marine Biology (Berlin) 156: 301–316. Bustamante, C., H. Flores, Y. Concha-Pérez, C. Vargas-Caro, J. Lamilla, y M. Bennett. 2012. First record of Hydrolagus melanophasma James, Ebert, Long & Didier, 2009 (Chondrichthyes, Chimaeriformes, Holocephali) from the southeastern Pacific Ocean. Latin American Journal of Aquatic Research 40: 236-242. Castro-Aguirre, J.L., H. Santana-Hernández, E. Espino-Barr y M.C. Jiménez-Quiroz. 2007. Primer registro de Harriota raleighiana (Chondrichthyes: Holocephali: Rhinochimaeridae) en la costa del Pacífico central de México. Revista Mexicana de Biodiversidad 78: 489- 492. Compagno, L.J.V. 1999. Chimaeras. Pp. 1531-1537. En: K.E. Carpenter y V.H. Niem (eds.). FAO species identification guide for fishery purposes. The living marine resources of the Western Central Pacific. Volume 3. Batoid fishes, chimaeras and bony fishes Part 1 (Elopidae to Linophrynidae). Rome, FAO. Didier, D. A. 2004. Phylogeny and classification of extant Holocephali. Pp. 115–135. En: J.C. Carrier, J.A. Musick y M.R. Heithaus (eds.). Biology of sharks and their relatives CRC Press, Boca Raton. Ebert, D.A. 2003. Sharks, Rays, and Chimaeras of California. University of California Press, Berkeley, California. 284 pp. Eschmeyer, W.N., E.S. Herald y H. Hammann. 1983. A Field Guide to Pacific Coast Fishes of North America. Houghton Mifflin Company, Boston, USA. Eschmeyer, W.N. y J.D. Fong. 2010. Species of Fishes by family/subfamily. http://research.calacademy.org/research/ichthyology/catalog/SpeciesByFamily.asp. (Consultado 01/12/2010). González–Acosta, A.F., J. De La Cruz–Agüero y V.M. Cota–Gómez. 1999. Extension of geographical distribution and first occurrence of fishes in the northwest of Mexico. Hidrobiológica 9: 39–44. González-Acosta, A.F., J.L. Castro-Aguirre, D.A. Didier, R. Vélez-Marín y L.A. Burnes-Romo, L.A. 2010. Presencia de Hydrolagus macrophthalmus (Chondrichthyes: Holocephali: Chimaeridae) en el Pacífico nororiental. Revista Mexicana de Biodiversidad 81: 197-201. Hubbs, C.L., W.I. Follett y L.J. Dempster. 1979. List of the Fishes of California. Occasional Papers of the California Academy of Sciences 133: 1-55. James, K.C., D.A. Ebert, D. A., D.J. Long y D.A. Didier. 2009. A new species of chimaera, Hydrolagus melanophasma sp. nov. (Chondrichthyes: Chimaeriformes: Chimaeridae), from the eastern north Pacific. Zootaxa 2218: 59-68. 406 Biodiversidad y comunidades del talud continental del Pacífico mexicano Mathews, C.P. 1975. Note on the ecology of the ratfish, Hydrolagus collei, in the Gulf of California. California Fish and Game 61: 47-53. Møller, P. R., T. Kullberg y O.A. Jørgensen. 2004. New records of Chimaeroid fishes from Greenland waters (North Atlantic), with Description of juvenile Chimaera monstrosa and Hydrolagus affinis (Holocephali, Chimaeridae). Cybium 28: 55-60. Nelson, J.S. 1994 Fishes of the world. 3a. ed. John Wiley & Sons, Inc., Nueva York. 600 pp. Quaranta, K.L., D.A. Didier, D.J. Long y D.A. Ebert. 2006. A new species of chimaeroid, Hydrolagus alphus sp. nov. (Chimaeriformes: Chimaeridae) from the Galapagos Islands. Zootaxa, 1377, 33–45. Ruiz-Campos, G., J.L. Castro-Aguirre, E.F. Balart, L. Campos-Dávila y R. Vélez-Marín. 2010. New specimens and records of chondrichthyan fishes (Vertebrata: Chondrichthyes) off the Mexican Pacific coast. Revista Mexicana de Biodiversidad 81: 363- 371. Townsend, C. H. y J.T. Nichols. J. T. 1925. Deep sea fishes of the “Albatross” Lower California expedition. Bulletin of the American Museum of Natural History 52: 1-20. N uevo registro de la quimera prieta del P acífico este 407 Apéndice 1. A-C. Términos (según James et al. 2009) y siglas utilizadas en el presente trabajo y en Aguirre-Villaseñor et al. (datos no publicados). No se presentan las medidas relacionadas con los claspers. Longitud total (LT), longitud pre-caudal (LPC), Longitud del cuerpo (LBD), longitud del hocico al orificio nasal (LSV), longitud del tronco (LTR), longitud de la cabeza (LHD), longitud pre-oral (LPOR), longitud pre-narinal (LPRN), longitud pre-orbital (LPOB), longitud del ojo (LEY), altura del ojo (HEY), longitud pre-segunda aleta dorsal (LPD2), longitud pre-primera aleta dorsal (LPD1), longitud de la base de la primera aleta dorsal (LD1B), altura de la espina dorsal (LDSA), altura máxima de la primera aleta dorsal (HD1), longitud de la base de la segunda aleta dorsal (LD2B), altura máxima de la segunda aleta dorsal (HD2), espacio inter-dorsal (LIDS), longitud del margen del lóbulo dorsal de la aleta caudal (LCDM), altura máxima del lóbulo dorsal de la aleta caudal (HCD), longitud total de la aleta caudal (LCT), longitud del margen del lóbulo ventral de la aleta caudal (LCVM), altura máxima del lóbulo ventral de la aleta caudal (HCV), altura del pedúnculo caudal (HCP), longitud del margen anterior de la aleta pectoral (LP1A), longitud del margen anterior de la aleta pélvica (LP2A), longitud del margen posterior de la aleta pectoral al margen anterior de la base de la aleta pélvica (LP2P), espacio entre las aletas pélvicas y caudal (LPCA), espacio entre el origen de la primera aleta dorsal al origen de la aleta pectoral (LD1P1), espacio entre el origen de la primera aleta dorsal al origen de la aleta pélvica (LD1P2), espacio entre el origen de la segunda aleta dorsal al origen de la aleta pectoral (LD2P1), espacio entre el origen de la segunda aleta dorsal al origen de la aleta pélvica (LD2P2). D-F. Medidas realizadas en las lineas laterales (según James et al. 2009) y siglas utilizadas en el presente trabajo y en Aguirre-Villaseñor et al. (datos no publicados). Las medidas se muestran entre paralelos para hacer más sencilla la ilustración: a) Vista lateral se muestran los canales preopercular (POP), oral e infraorbital (IO); b) Vista ventral de la cabeza; c) Vista dorsal de la cabeza. Longitud del pliegue anterior oronasal al centro del canal nasal (LONC), longitud del canal rostral (LRC), longitud del canal nasal (LNC), longitud entre el canal infraorbital y el angular (LIOA), longitud entre el canal preopercular y el canal principal del cuerpo (LOTM), longitud entre el canal principal del cuerpo y el supratemporal (LOC), longitud del canal supratemporal (LST), espacio entre el origen de la base de la espina dorsal y el centro del canal supratemporal (LSPS). 408 Biodiversidad y comunidades del talud continental del Pacífico mexicano N uevo registro de la quimera prieta del P acífico este 409 Distribución geográfica de cuatro especies de la familia Macrouridae (Teleostei; Gadiformes) en el centro-sur del golfo de California Hugo Aguirre-Villaseñor1 y Daniel de Jesús Moreno-Flores2 Introducción Dentro de los diferentes grupos de peces de profundidad recolectados en el proyecto TALUD, las especies de la familia Macrouridae son de las más abundantes. La familia Macrouridae (del griego makros = grande y oura = cola) se distingue por tener una cabeza grande, el hocico proyectado y el cuerpo esbelto, el cual se va afilando hasta terminar en una cola en forma de látigo. Generalmente presenta dos aletas dorsales, la primera alta, la segunda baja, ocupando la mayor parte del dorso. La aleta anal es larga, usualmente con más de 80 radios. Esta y la segunda aleta dorsal confluyen con la caudal, misma que no está definida. La primera aleta dorsal no presenta espinas, sino que posee dos radios espinosos que morfológicamente son radios blandos endurecidos; sin embargo, para la descripción de las especies estas estructuras suelen designarse como espinas (Iwamoto 1970). De éstas, la primera espina es rudimentaria y la segunda puede presentar dientes en la superficie del borde anterior. Generalmente presentan una barbilla en el mentón. Algunas Instituto Nacional de Pesca, Centro Regional de Investigación Pesquera-Mazatlán, Calzada Sábalo-Cerritos s/n, AP 1177, Sinaloa, México. Coreeo-e: [email protected]. 2 Posgrado en Ciencias del Mar y Limnología. Instituto de Ciencias del Mar y Limnología, Unidad Académica Mazatlán, Universidad Nacional Autónoma de México, Joel Montes Camarena s/n, Mazatlán 82040, Sinaloa, México. 1 411 especies presentan un órgano luminiscente subcutáneo localizado a lo largo de la línea media del abdomen, con una fosa justo por delante del ano. Presenta de 5 a 8 radios branquióstegos (Cohen et al. 1990). La posición taxonómica de la familia Macrouridae según Nelson (1994) es la siguiente: Reino: Animalia Filo: Chordata Subfilo: Vertebrata (Craniata) Superclase: Gnasthostomata Clase: Osteichthyes Subclase: Actinopterygii Infraclase: Neopterygii División: Halecostomi Subdivisión: Teleostei Infradivisión: Euteleostei Superorden: Paracanthopterygii Orden: Gadiformes Familia: Macrouridae Las 300 especies de esta familia están presentes en todos los océanos, desde las regiones árticas a las antárticas (Hubbs e Iwamoto 1977). Son especies bentopelágicas en su vida adulta y habitan el talud continental entre los 200 y los 6000 m de profundidad (Cohen et al. 1990). Los géneros mejor representados son Coelorhynchus (Girona, 1810), con más de 76 especies, Coryphaenoides (Grunnerus, 1765), con 61 especies y Nezumia (Jordan, 1904), con 46 especies. Estos tres géneros contienen la mitad de las especies registradas (Cohen et al. 1990). En el Pacífico mexicano se han registrado 13 especies de macrúridos: Albatrossia pectoralis (Gilbert, 1892), Coelorinchus scaphopsis (Gilbert, 1890), Coryphaenoides acrolepisis (Bean, 1884), C. anguliceps (Garman, 1899), C. armatus (Hector, 1875), C. capito (Garman, 1899), C. oreinos (Iwamoto y Sazonov, 1988), C. rudis (Günther, 1878), Malacocephalus laevis (Lowe, 1843), Mesobius berryi Hubbs e Iwamoto, 1977, Nezumia convergens (Garman, 1899), N. liolepis (Gilbert, 1890) y N. stelgidolepis (Gilbert, 1890). Ocho especies se encuentran en el golfo de California: Conyphaemoides scaphopsis, C. anguliceps, C. armatus, C. capito, Mesobeus berryi, Nezumia convergens, N. liolepis y N. stel412 Biodiversidad y comunidades del talud continental del Pacífico mexicano gidolepis (Gilbert 1890, Garman 1899, Cohen et al. 1990, Castro-Aguirre et al. 2007). En el presente trabajo se determinó taxonómicamente la composición de los especímenes de la familia Macrouridae y su distribución geográfica, a partir de los muestreos realizados en el centro-sur del golfo de California. Adicionalmente, se incluye una clave taxonómica para el reconocimiento de los macrúridos del Pacífico mexicano y del golfo de California. La presencia de N. kensmithi Wilson, 2001, ha sido confirmada únicamente en el Guyot Fieberinling, localizado a unos 900 km OSO de San Diego, EE.UU. La composición específica de las especies ícticas a lo largo de la cadena montañosa Fieberinling-Guadalupe es muy similar, por lo que la presencia de N. kensmithi en aguas del Pacífico mexicano es muy probable (Wilson 2001). Materiales y métodos Las muestras fueron recolectadas durante los cruceros de investigación III-IX del proyecto TALUD (Fig. 1). Las muestras de peces se capturaron con un trineo bentónico en un intervalo batimétrico de 600 a 2250 m, a 3 km/h de velocidad y con una duración del arrastre de 30 min. Los organismos se fijaron en una solución de formol al 10 % neutralizado con borato de sodio a pH 7 y se conservaron en alcohol al 70 %. En el laboratorio, la determinación de los especímenes se realizó comparando la características merísticas y morfométricas indicadas por Cohen et al. (1990), Fischer et al. (1995) e Iwamoto y Williams (1999). En el caso de las estructuras pareadas, las medidas se tomaron en el lado izquierdo (Apéndice 1). El nombre científico y sus sinonimias se corroboraron en la versión en línea del catálogo de peces de Eschmeyer y Fong (2011). La lista de abreviaciones citadas en el texto y sus definiciones se encuentran en el apéndice 1. Resultados En las siete campañas analizadas se realizaron 78 lances. En 62 se capturaron peces (79 % del total de lances) y de estos, en 24 (30 % del total de lances) se capturaron organismos de la familia Macrouridae (Cuadro 1). El total de macrúridos analizados (148) pertenecen a dos géneros y cuatro especies. La especie más abundante fue Nezumia liolepis con 99 organismos, seguida por Coryphaenoides capito con 40 organismos, C. anguliceps con siete organismos y N. convergens con solamente dos organismos. D istribución geográfica de cuatro especies de la familia M acrouridae 413 Figura 1. Área de muestreo de los cruceros TALUD III-IX en el centro-sur del golfo de California. estaciones de muestreo; estaciones con especimenes de la familia Macrouridae. Cuadro 1. Número de lances en los crucero TALUD con peces y con macrúridos realizados en el sureste del golfo de California. Crucero TALUD III TALUD IV TALUD V TALUD VI TALUD VII TALUD VIII TALUD IX 414 Fecha Agosto de 1991 Agosto de 2000 Diciembre de 2000 Marzo de 2001 Junio de 2001 Abril de 2005 Noviembre de 2005 Lances 11 8 8 7 14 13 17 Con peces 10 7 6 6 14 10 9 Con macrúridos 1 3 4 4 5 3 4 Biodiversidad y comunidades del talud continental del Pacífico mexicano Coryphaenoides anguliceps (Garman, 1899). Macrurus anguliceps Garman, 1899: 212, láms. G, fig. 1, 50, 83, fig. 2. Macrurus latinasutus Garman, 1899: 214. Macrurus liraticeps Garman, 1899: 196, lám. 45, figs. 1-1b. Coryphaenoides anguliceps.- Gilbert y Hubbs 1916: 144 (lista).- Iwamoto y Sazonov 1988:45.- Iwamoto en Cohen et al. 1990: 203.- Iwamoto y Schneider en Fischer et al. 1995: 1258.- McMillan 1999: 488.- Iwamoto y McCosker 2001: 27.- McCosker y Rosenblatt 2010: 189. Coryphaenoides liraticeps.- Gilbert y Hubbs 1916: 144 (lista). Coryphaenoides latinasutus.- Gilbert y Hubbs 1916: 144 (lista). Lionurus latinasutus.- Marshall, 1973: 596 (lista). Material examinado.- 7 organismos. Conteos.- Radios branquióstegos 6; branquiespinas 8-9; ciegos pilóricos 9-14. Cabeza y cuerpo bajos; LC 4.5 a 5.0 veces, altura del cuerpo más de 7 veces en LT. Hocico puntiagudo, moderadamente prominente, 2.8 a 3.3, órbita 3.3 a 5.0, interorbital 4.3 a 5.8, mandíbula superior 2.8 a 3.7, barbillón 14.3 a 33.3 en LC. Tubérculos espinosos en extremo y ángulos del hocico; crestas de la cabeza débilmente escamadas. Escamas del cuerpo delgadas, caedizas y con pocas o ninguna espínula. Hocico y suborbital mayormente desnudos. Extremo posterior de la maxila debajo del 1/4 anterior de la órbita. Dientes de mandíbula pequeños dispuestos en bandas. Altura de la lera dorsal casi 65 % de LC; 2da espina débilmente aserrada (Fig. 2). Figura 2. Vista lateral de un ejemplar de Coryphaenoides anguliceps (Garman, 1899). Lt 250 mm. Barra de escala = 50 mm. D istribución geográfica de cuatro especies de la familia M acrouridae 415 Coryphaenoides capito (Garman, 1899). Fig. 3 Macrurus capito Garman, 1899: 200-201. Macrurus leucophaeus Garman, 1899: 201-202. Macrurus vagrans Garman, 1899: 201. Coryphaenoides capito.- Gilbert y Hubbs 1916: 144 (lista).- Iwamoto y Sazonov, 1988: 60. Iwamoto y Schneider en Fischer et al. 1995: 1258.- Chirichigno y Vélez 1998: 236.- Castellanos-Galindo et al. 2006: 196. Material examinado.- 40 organismos. Conteos.- Radios branquióstegos 6; branquiespinas 7-14; ciegos pilóricos 6-8. Cabeza baja, cuerpo alto, mayor altura casi igual a LC. Hocico se prolonga escasamente más allá de la boca, su longitud 4.2, órbita, 3.6, interorbital 5.3, mandíbula superior 3, barbillón 14.3 en LC. Pequeño tubérculo en extremo y ángulos del hocico, crestas en la cabeza débilmente escamada. Escamas del cuerpo delgadas, caedizas, espínulas débiles y cortas. Lado inferior de la cabeza mayormente desnuda. Extrema posterior de la maxila bajo la mitad anterior de la órbita. Dientes en las mandíbulas finos, pequeños y en bandas moderadas. Altura de 1ra dorsal casi 1.5 de LC; 2da espina finamente aserrada (Fig. 3). Figura 3. Vista lateral de un ejemplar de Coryphaenoides capito (Garman, 1899). Lt 203 mm. Barra de escala = 50 mm. Nezumia convergens (Garman, 1899). Fig. 4 Macrurus convergens Garman, 1899: 210, lám., figs. 1-1b. Macrurus cuspidatus Garman, 1899: 209-210. Macrurus trichiurus Garman, 1899: 215. Lionurus convergens.- Gilbert y Hubbs, 1916: 146. Lionurus trichiurus.- Gilbert y Hubbs, 1916:146 Nezumia convergens.- Makushok, 1967: 218 (cuadro).- Iwamoto 1979: 171.- Iwamoto en Cohen et al. 1990: 270.- Iwamoto y Schneider en Fischer 416 Biodiversidad y comunidades del talud continental del Pacífico mexicano et al. 1995: 1264.- Pequeño 1997: 82.- Chirichigno y Vélez 1998: 237-238.Iwamoto y McCosker 2001: 27.- Wilson 2001: 32.- Castellanos-Galindo et al. 2006: 196.- McCosker y Rosenblatt 2010: 189. Nezumia cuspidata.- Makushok, 1967: 218 (cuadro). Nezumia trichiura.- Makushok, 1967: 218 (cuadro ). Sphagemacrurus trichiurus .- Marshall, 1973: 623 (lista). Material examinado.- 2 organismos. Conteos.- Radios branquióstegos 7; branquiespinas 7-9; ciegos pilóricos 31. Cuerpo esbelto, su altura 7.5-8 en LT, menos de 1.3 en LC. Hocico 3.2-3.6, órbita 3-3.2, interorbital 5.3-6.3, mandíbula superior 3.2-3.6, barbillón 5.9-7.7 en LC. Extremo y ángulos laterales del hocico con tubérculos espinosos. Fuerte cresta espinosa bajo la órbita; boca inferior. Escamas del cuerpo cubiertas con espínulas cónicas a lanceoladas en filas convergentes. Superficie ventral del hocico desnuda. Ano entre pélvicas y anal; fosa de órgano luminoso no visible externamente. Dientes de mandíbulas chicos, en bandas; poco más alargados en la fila externa de la mandíbula superior. Altura de la 1ra dorsal más corta que LC, 2da espina aserrada (Fig. 4). Figura 4. Vista lateral de un ejemplar de Nezumia convergens (Garman, 1899). Lt 230 mm. Barra de escala = 50 mm. Nezumia liolepis (Gilbert, 1890) Macrurus liolepis Gilbert, 1890: 117. Macrurus barbiger Garman, 1899: 197, lám. 45. Lionurus liolepis.- Good y Bean 1896: 409 (lista). Nezumia liolepis.- Fitch y Lavenberg 1968: 142.- Iwamoto y Stein 1974: 46.- Iwamoto 1979: 157.- Iwamoto en Cohen et al. 1990: 274.- Iwamoto y Schneider en Fischer et al. 1995: 1265.- Hoff 1999: 115. Ventrifossa barbiger.- Marshall 1973: 654 (lista). D istribución geográfica de cuatro especies de la familia M acrouridae 417 Conteos.- Radios branquióstegos 7; branquiespinas 9-12; ciegos pilóricos 2537. Cuerpo esbelto, su altura 5.6-7.9 en LT, entre 1.2-1.7 en LC. Hocico 3.6-4.2, órbita 3.2-4, interorbital 3.7-4.8, mandíbula superior 2.5-3.2, barbillón 5-10 en LC. Extremo y ángulos laterales del hocico con tubérculos espinosos pequeños. Cresta espinosa bajo la órbita poco desarrollada; boca inferior. Escamas del cuerpo caedizas, desnudas o cubiertas con pocas espínulas. Hocico desnudo, sin escamas. Ano separado del origen de la aleta anal. Una hilera de dientes en las mandíbulas superior, dos hileras en la mandíbula inferior. Altura de la 1ra dorsal más corta que LC, 2da espina aserrada. Longitud del radio más largo de las aletas pélvicas se extiende a la base de la aleta anal (Fig. 5). Figura 5. Vista lateral de un ejemplar de Nezumia liolepis (Gilbert, 1890). Lt 245 mm. Barra de escala = 50 mm. Distribución geográfica Coryphaenoides anguliceps se presentó en la boca del golfo de California en cuatro estaciones (intervalo batimétrico: 1000 a 1800 m). Dos de ellas se localizan en la costa oriental y dos en la costa occidental del golfo, con el mayor número de organismos (3) presentándose frente a la bahía de La Paz (Fig. 6). Coryphaenoides capito se presentó en 12 estaciones (intervalo batimétrico: 759 a 800 m), desde la boca hasta el centro del golfo de California. Ocho de las estaciones se localizan en la costa oriental y una en la costa occidental del golfo, con el mayor número de organismos (5) presentándose frente a la bahía de La Paz, Topolobampo y San Blas (Fig. 6). Nezumia convergens se presentó en la boca del golfo de California en dos estaciones (intervalo batimétrico: 1350 a 1600 m). Ambas se localizan en la costa oriental del golfo, frente a la bahía de Altata y San Blas, capturándose en cada una de ellas un ejemplar (Fig. 6). 418 Biodiversidad y comunidades del talud continental del Pacífico mexicano Figura 6. Mapa de distribución de macrúridos capturados en el Pacifico central mexicano y el sur del golfo de California. El círculo señala las estaciones donde se capturaron organismos de Coryphaenoides anguliceps, la cruz donde se capturaron organismos de C. capito, el triángulo donde se capturaron organismos de Nezumia convergens y la equis donde se capturaron organismos de N. liolepis. Nezumia liolepis se presentó en 18 estaciones (intervalo batimétrico: 759 a 1400 m), desde la boca hasta el centro del golfo de California, nueve de las cuales se localizan en la costa oriental y seis en la costa occidental del golfo. El mayor número de organismos (10) se presentó en el centro del golfo de California (Fig. 6). Sobre la base del trabajo de Cohen et al. (1990) se elaboró la clave de los géneros y especies de la familia Macrouridae presentes en el Pacífico mexicano y golfo de California. D istribución geográfica de cuatro especies de la familia M acrouridae 419 Clave de géneros y especies de Macrouridae del Pacífico mexicano y del golfo de California 1 Con 6 radios branquióstegos ............................................................................... 2 Con 7 u 8 radios branquióstegos ............................................................................ 9 2 Branquiespinas ausentes en la cara externa del primer arco branquial. Hocico puntiagudo, armado con escamas espinosas que forman una gran cresta continua, que se extiende desde la punta del hocico hasta el ángulo del preopérculo ................ .................................................................... Coelorinchus scaphopsis (Gilbert, 1890) Branquiespinas presentes en la cara externa del primer arco branquial. Hocico redondeado o moderadamente puntiagudo, no presenta escamas espinosas burdas que formen una gran cresta continua .......................................................................... 3 3 Vejiga natatoria pequeña con dos retia mirabilia, radios de la primera aleta dorsal 9-11, radios de las aletas pélvicas 6-8 ............ Albatrossia pectoralis (Gilbert, 1892) Vejiga natatoria grande con más de dos retia mirabilia, radios de la primera aleta dorsal 10-16, radios de las aletas pélvicas 7-14 ..................................................... 4 4 Mandíbula superior se extiende más allá del tercio posterior de la órbita [género Coryphaenoides (Grunnerus, 1765)] .................................................................5 Mandíbula superior corta, no alcanza el tercio posterior de la órbita ................ 7 5 Dos hileras de dientes o más en la mandíbula inferior. Radios de las aletas pélvicas 8 (raramente 9). Caecas pilóricas 11 a 14 .......... C. acrolepis (Bean, 1884) Una hilera de dientes en la mandíbula inferior ..................................................... 6 6 Cara ventral del hocico cubierto densamente por escamas ................................. .................................................................................................. C. rudis (Günther, 1878) Cara ventral del hocico sin escamas ........................ C. armatus (Hector, 1875) 7 Hocico chato y respingado, sin escama tubercular en su punta. Mandíbula superior se extiende hasta la mitad de la órbita. Radios de las aletas pélvicas 9 o 10. Branquiespinas en el primer arco branquial 9 a 11 ......................................................... ......................................................................... C. oreinos (Iwamoto y Sazonov, 1988) Hocico puntiagudo con escama tubercular en su punta ......................................8 420 Biodiversidad y comunidades del talud continental del Pacífico mexicano 8 Hocico corto, su longitud 22 a 31 % de la longitud de la cabeza. Branquiespinas en el primer arco branquial 11 a 14. Caecas pilóricas cortas de 6 a 8 .......................... ................................................................................................ C. capito (Garman, 1899) Hocico largo, su longitud 28 a 35 % de la longitud de la cabeza. Branquiespinas en el primer arco branquial 7 a 10. Caecas pilóricas largas de 9 a 14 .......................... ........................................................................................ C. anguliceps (Garman, 1899) 9 Barbillón ausente ............................ Mesobius berryi Hubbs e Iwamoto, 1977 Barbillón presente ................................................................................................... 10 10 Una hilera de dientes grandes en la mandíbula inferior. Malacocephalus laevis (Lowe, 1843) Dientes pequeños o moderados formando una o varias hileras de dientes [género Nezumia (Jordan, 1904)] .................................................................................. 11 11 Hocico corto, su superficie dorsal y ventral desnudas ........................................ ................................................................................................. N. liolepis (Gilbert, 1890) Hocico corto o largo, su superficie dorsal con escamas y la ventral desnuda o con escamas. Radios de las aletas pélvicas 8 a 10 .................................................. 12 12 Escamas del cuerpo con espínulas lanceoladas en forma de aguja. Branquiespinas en el primer arco branquial 7 a 9. Radios de las aletas pélvicas 10 a 11 (ocasionalmente 9). Caecas pilóricas 21 a 32 ........ N. convergens (Garman, 1899) Escamas del cuerpo con espínulas lanceoladas, triangulares o en forma de escudo. Branquiespinas en el primer arco branquial 10 a 11. Radios de las aletas pélvicas 9 a 10. Caecas pilóricas 24 a 58 ..................... N. stelgidolepis (Gilbert, 1890) Discusión Del total de organismos analizados (148) se determinaron cuatro especies pertenecientes a dos géneros. El género Coryphaenoides presentó dos especies C. capito y C. anguliceps y el género Nezumia presentó N. liolepis y N. convergens. Además de las aquí señaladas y dentro de los límites geográficos del área de estudio, se ha registrado la presencia de otras cuatro especies de la familia Macrouridae: C. armatus, C. oreinos, N. stelgidolepis y C. scaphopsis (Cohen et D istribución geográfica de cuatro especies de la familia M acrouridae 421 al. 1990, Castro-Aguirre et al. 2007). Para confirmar la determinación de las especies encontradas en el presente estudio y evitar una identificación incorrecta, se compararon los datos provenientes de las diagnosis de las otras especies reportadas para el golfo de California. En el caso de C. armatus las proporciones de LE, LH, LIO respecto a LC son menores que las reportadas en C. capito y C. anguliceps. La HB respecto a LC es de 1:1 en C. armatus y de 0.9:1 en C. oreinos, mientras que en C. capito y C. anguliceps la razón es menor a 0.75:1 (Cohen et al. 1990). En el caso de N. stelgidolepis la proporción de LH, LIO, LMS, LB respecto a LC es mayor que en N. convergens. Por otro lado, en N. stelgidolepis, el borde anterior del segundo radio espinoso de la primera aleta dorsal es liso, mientras que en N. liolepis es aserrado (Iwamoto 1979, Iwamoto y Sazonov 1988, Cohen et al. 1990, Fischer et al. 1995). El género Caelorinchus presenta un hocico puntiagudo, armado con escamas espinosas que forman una gran cresta continua, que se extiende desde la punta del hocico hasta el ángulo del preopérculo, característica que lo distingue de los demás géneros, por lo que no hay riesgo de una mala determinación. En el caso de C. scaphopsis, el hocico es relativamente corto pero puntiagudo, y su borde antero-lateral (no osificado completamente) presenta una órbita muy desarrollada (LE 31- 37 % respecto a la LC) generalmente algo mayor a la LH. Presenta crestas de la cabeza con escamas fuertes pero no muy espinosas, mismas que se encuentran fuertemente adheridas con espínulas presentes con pocas hileras sub-paralelas (3-9) (Cohen et al. 1990). Las cuatro especies citadas en el presente trabajo se encuentran dentro del intervalo de distribución latitudinal citado en la literatura. El intervalo de N. liolepis va de los 43°N a 17º 24´ N (Cohen et al. 1990, Hoff et al. 2000). El intervalo de N. convergens va de los 27º 34´ N a los 34º 53´ S (Cohen et al. 1990). El intervalo de C. anguliceps va de los 26º 48´ N a los 4º 10´ S y de 110º 45´ O a 80º 15´ O (Cohen et al. 1990, Iwamoto y Sazonov 1988). El intervalo de C. capito va de los 27º 40´ N a 5º 40´ S (Iwamoto y Sazonov 1988). Con estos resultados se confirma que el golfo de California junto con la Provincia Mexicana representa el límite de distribución norte de C. anguliceps, C. capito y N. convergens. Mientras que para N. liolepis el intervalo se extiende hasta el noreste del Pacífico. De las ocho especies registradas en el golfo de California, cuatro no se capturaron durante los siete cruceros TALUD realizados. C. scaphopsis ha sido reportado en aguas someras (95-296 m) en el norte del golfo de California (39°N) (Cohen et al. 1990, California Academy of Sciences/Research/Ichthyology/Collection Database), mientras que en el caso de C. armatus su intervalo de distribución 422 Biodiversidad y comunidades del talud continental del Pacífico mexicano batimétrica va de 2000 a 4700 m (Cohen et al. 1990). La ausencia de registro de estas especies en el presente trabajo probablemente se debe a que ambas han sido capturadas en intervalos batimétricos muy distintos a los muestreados en este estudio, además de que C. scaphopsis ha sido capturado en latitudes mayores a las de este estudio. Esto puede estar asociado a las diferencias ictiofaunísticas en la composición y abundancia entre el norte y centro-sur del golfo de California, y que a su vez ha sido explicado sobre la base de las diferencias en las condiciones topográficas e hidrográficas entre ambas cuencas. El norte del golfo de California es más somero y sus aguas son menos frías y más saladas que en la parte centro y sur, que son más profundas (Álvarez-Borrego y Schwartzlose 1979). Dentro del golfo de California la ictiofauna somera (<600 m) presenta cuatro ensambles distintivos. La fauna del sur del golfo de California, en la costa continental de Guaymas, hacia el sur. La parte alta del golfo de California, al norte de la línea de bahía San Francisquito al punto más al sur de la isla Tiburón, se caracteriza por una fauna empobrecida, con una gran cantidad de especies endémicas de profundidades moderadas y un gran número de componentes faunísticos de especies de áreas más norteñas de la costa oeste del Pacífico americano. El centro del golfo de California incluye las costas entre bahía Kino a Guaymas en la costa Este y entre bahía San Francisquito y La Paz en la costa Oeste, la fauna de esta área muestra las características propias del golfo, con una gran cantidad de especies endémicas de aguas someras. El área de Cabo San Lucas se extiende hacia el norte desde el cabo hasta la zona aledaña de La Paz; su fauna se caracteriza por la presencia de especies del Pacífico Oeste encontradas en islas oceánicas, ausencia de especies norteñas, mucho endemismo y un gran grupo de especies que solo se encuentra en esta área y en la parte continental desde Mazatlán hacia el sur (Walker 1960). Por otro lado, N. stelgidolepis presenta una distribución geográfica muy amplia desde la Columbia Británica hasta el sureste del Perú, con un intervalo batimétrico de 277 a 909 m (Cohen et al. 1990); mientras que C. oreinos se distribuye en el Pacífico central mexicano, en un intervalo batimétrico de 990 a 1626 m (CastroAguirre et al. 2007, Cohen et al. 1990, Iwamoto y Sazonov 1988). No obstante que las distribuciones latitudinal y batimétrica de N. stelgidolepis y C. oreinos se encuentran dentro del espacio muestreado, estas no se capturaron. Esto puede estar asociado a la heterogeneidad del hábitat y a la poca capacidad de los macrúridos para realizar grandes migraciones, lo que favorece que las especies se distribuyan en parches discretos. Se ha observado segregación batimétrica entre N. liolepis (581 a 1247 m) y N. stelgidolepis (285 a 555 m) a lo largo de la costa pacífica de Norte D istribución geográfica de cuatro especies de la familia M acrouridae 423 América. Hoff et al. (2000) atribuyen esta segregación a la distribución en parches, debida a las preferencias en el sustrato. Sin embargo, muchas de las especies de macrúridos son conocidas por su amplia distribución. A lo largo de las costas del Pacífico americano, la distribución discreta observada en estas especies, puede estar ligada a un artefacto del muestreo, como son los pocos estudios realizados a profundidades > 600 m en el golfo de California, la inaccesibilidad del arte a zonas rocosas o con pendientes muy abruptas, la velocidad de arrastre que no permite capturar organismos con mayor movilidad, el bajo o nulo valor comercial o la existencia de informes locales con difusión limitada, como sucede con otras especies de peces del Pacífico Mexicano (Aguirre et al. 2002, Ruiz-Campos et al. 2010, Aguirre-Villaseñor y Castillo-Velazquez 2011, Aguirre-Villaseñor y Salas-Singh 2012). Castro-Aguirre y Balart (1996) concluyen que no existe una clara diferencia entre los conjuntos ícticos del golfo de California y los del resto del Pacífico oriental, dado que la mayoría de las especies son compartidas, es decir no hay endemismo, al menos en las especies conocidas (Castro-Aguirre et al. 2007). AGRADECIMIENTOS Los autores agradecen a C. Ramírez por facilitarnos las referencias bibliográficas, a G Ramírez y P. Valdez por su ayuda en la edición de las figuras. A los participantes en los cruceros TALUD, la tripulación del buque y a la UNAM por el apoyo proporcionado durante las campañas oceanográficas a bordo del B/O El Puma. Referencias Aguirre-Villaseñor, H., J. Madrid y J.A. Virgen. 2002. Presence of Echinorhinus cookei Pietschmann, 1928 (Pisces: Squalidae, Echinorhinidae) off central Pacific Mexico. Journal of Fish Biology 61: 1403-1409. Aguirre-Villaseñor, H. y R. Castillo-Velazquez. 2011. New depth record of Cherublemma emmelas (Gilbert, 1890), black brotula (Ophidiiformes: Ophidiidae) from the Gulf of California, Mexico. Revista Mexicana de Biodiversidad 82: 713-715. Aguirre-Villaseñor, H. y C. Salas-Singh. 2012. New records of the lollipop catshark Cephalurus cephalus (Scyliorhinidae) from the Gulf of California, Mexico. Revista Mexicana de Biodiversidad 83(1): 298-300. Álvarez-Borrego, S. y R.A. Schwartzlose. 1979. Masas de agua del golfo de California. Ciencias Marinas. 6(1-2): 43-63. 424 Biodiversidad y comunidades del talud continental del Pacífico mexicano Castellanos-Galindo, G.A., E.A. Rubio-Rincón, B.S. Beltrán-Léon y C.C. Baldwin. 2006. Check list of stomiiform, aulopiform and myctophiform fishes from Colombian waters of the tropical eastern Pacific. Biota Colombiana 7(2): 245-262. Castro-Aguirre, J.L. y E.F. Balart. 1996. Contribución al conocimiento del origen y relaciones de la ictiofauna de aguas de profundidad del golfo de California, México. Hidrobiológica 6: 67-76. Castro-Aguirre, J.L., A.F. González-Acosta y N. Álvarez-Pliego. 2007. Nuevo registro de Coryphaenoides oreinos (Teleostei: Gadiformes: Macrouridae) en el Pacífico central mexicano. Hidrobiológica 17(2): 189-192. Chirichigno, F. y J. Vélez. 1998. Clave para identificar los peces marinos del Perú (Segunda edición, revisada y actualizada). Instituto del Mar del Perú, Publicación especial. Lima, Perú. 496 pp. Cohen, D.M., T. Inada, T. Iwamoto y N. Scialabba. 1990. Gadiform fishes of the world (Order Gadiformes). An annotated and illustrated catalogue of cods. hakes. grenadiers and other gadiform fishes known to date. FAO Fisheries Synopsis 125 (10). Roma. 442 pp. Eschmeyer, W.N. y J. Fong. D. 2011. Species of Fishes by family/subfamily. http:// research.calacademy.org/research/ichthyology/catalog/SpeciesByFamily.asp. 21/07/2011. Fischer, W., F. Krupp, W. Schneider, C. Sommer, K.E. Carpenter y V.H. Niem. 1995. Guía FAO para la identificación de especies para los fines de la pesca. Pacífico centro-oriental. Roma FAO. 2: 647-1200. Fitch, J.E. y R.J. Lavenberg. 1968. Deep-water teleostean fishes of California. University of California Press. Berkeley 155 pp. Garman, S. 1899. Reports of an exploration of west coast of Mexico, Central and South America and the Galapagos Island, in charge of Alexander Agassiz, by the U.S. Fish Commission Steamer “Albatross”, during 1891, Lieut. Cmdr. Z. L. Tanner, U.S.N. commanding. XXVI: The fishes. Memorian of the Museum Comparative Zoological. Harvard University 24: 1-431. Gilbert, C.H. 1890. A preliminary report on the fishes collected by the steamer “Albatross“ on the Pacific coast of North America during the year 1889, with descriptions of twelve new genera and ninety-two new species. Proceedings of the United States National Museum. 13: 49-126. Gilbert, C.H. y C.L. Hubbs. 1916. Report on the Japanese macruroid fishes collected by the United States Fisheries steamer “Albatross” in 1906, with a synopsis of the genera. Proceedings of the United States National Museum 51(2149): 135-214. D istribución geográfica de cuatro especies de la familia M acrouridae 425 Goode, G.B. y T.H. Bean. 1896. Oceanic ichthyology, a treatise on the deep–sea and pelagic fishes of the world, based chiefly upon the collections made by the steamers “Blake”, “Albatross2, and “Fish Hawk” in the northwestern Atlantic, with an atlas containing 417 figures. Memoirs of the Museum of Comparative Zoology, Harvard 22: 1-553. Hoff, G.R. 1999. Range extensions of 3 species of macrourids from the west coast of North America. California Fish and Game 85(3): 113-117. Hoff, G.R., T.W. Buckley, J.C. Drazen y K.M. Duncan. 2000. Biology and ecology of Nezumia liolepis and N. stelgidolepis from the west coast of North America. Journal of Fish Biology 57(3):662-680. Hubbs, C.L. y T. Iwamoto. 1977. A new genus (Mesobius) and three new bathypelagic species of Macrouridae (Pisces. Gadiformes) from the Pacific Ocean. Bulletin of the California Academy of Sciences 41(7): 233-251. Iwamoto, T. 1970. The R/V Pillsbury deep-sea biological expedition to the gulf of Guinea. 1964-65. Macrourid fishes the Gulf of Guinea. Studies in Tropical Oceanography. 4 (2): 316-431. Iwamoto, T. 1979. Eastern Pacific Macrourine Grenadiers with seven Branchiostegal rays (Pisces: Macrouridae). Bulletin of the California Academy of Sciences. 42(5): 135-179. Iwamoto, T. y J.E. McCosker. 2001. Notes on Galápagos grenadiers (Pisces, Gadiformes, Macrouridae), with the description of a new species of Coryphaenoides. Revista de Biologia Tropical 49(Sup. 1): 21-27. Iwamoto, T. y Y.I. Sazonov. 1988. A review of the Sotheastern Pacific Coryphaenoides (sensu lato) (Pisces, Gadiformes, Macrouridae). Proceedings of the California Academy of Sciences (Ser. 4). 45(3): 35-82. Iwamoto, T. y A. Williams. 1999. Grenadiers (Pisces. Gadiformes) from the Continental Slope of Western and Northwestern Australia. California Academy of Sciences 51(3): 105-243. McCosker, J.E. y R.H. Rosenblatt. 2010. The fishes of the Galápagos Archipelago: an update. Proceedings of the California Academy of Sciences (Ser. 4) 61 (supl. II. 11): 167-195. Makushok. M. 1967. Whiptails (family Macrouridae or Coryphaenoididae Auct). Chapter IV. Pp. 200-227. En: V.G. Kort (ed.). Biology of the Pacific Ocean, Book III, Fishes of the open waters. Moscú. (Traducido del ruso) U.S. Naval Oceanographic Office, Transl. 528, Wash., D.C. Marshall, N.B. 1973. Family Macrouridae. Pp. 496-665. En: D.M. Cohen (ed.). Fishes of the western North Atlantic. Parte 1 (6). Memoir, Sears Foundation for Marine Research. 426 Biodiversidad y comunidades del talud continental del Pacífico mexicano Nelson, J.S. 1994. Fishes of the world. John Wiley and Sons, Inc. Nueva York. 3a ed. 600 pp. Ruiz-Campos, G., J.L. Castro-Aguirre, E.F. Balart, L. Campos-Dávila y R. Vélez-Marín. 2010. New specimens and records of chondrichthyan fishes (Vertebrata: Chondrichthyes) off the Mexican Pacific coast. Revista Mexicana de Biodiversidad 81: 363- 371. Walker, B. W. 1960. The Distribution and Affinities of the Marine Fish Fauna of the Gulf of California. Systematic Zoology 9(3/4): 123-133. Wilson, R.R., Jr. 2001. A new species of Nezumia (Gadiformes: Macrouridae) from Fieberling Guyot, eastern North Pacific Ocean. Revista de Biologia Tropical 49(Supl. 1): 29-37. D istribución geográfica de cuatro especies de la familia M acrouridae 427 Apéndice 1. Siglas y definición de las morfometrías y conteos merísticos utilizados, basado en los trabajos de Iwamoto (1970) e Iwamoto y Williams (1999). Sigla LT Medida Longitud total LC LH LIO LE LMS LB HB 1D-2D H1D 428 Descripción De la punta del hocico hasta el extremo de la aleta caudal. Longitud cefálica De la punta del hocico al ángulo posterior superior del opérculo. Longitud del hocico De la punta del hocico al margen anterior de la órbita. Espacio interorbital Distancia media entre las órbitas. Longitud orbital Diámetro de la órbita en el plano longitudinal. Longitud de la mandíbula Del extremo anterior del premaxilar al extremo superior posterior del maxilar. Longitud barbilla De la inserción posterior de la barbilla al extremo distante. Altura del cuerpo Medido en el origen de la 1ª aleta dorsal. Espacio interdorsal Espacio entre el límite posterior de la 1ª aleta dorsal y el origen de la 2ª aleta dorsal. Altura de la primera aleta De la base al extremo distal de la 2ª espina. dorsal Biodiversidad y comunidades del talud continental del Pacífico mexicano Discusión Michel E. Hendrickx, M.E.,1 Nuria Méndez-Ubach, 1 David Serrano,2 Pablo Zamorano,3 Francisco Neptali Morales-Serna4 y Samuel Gómez1 En el contexto regional del Pacífico este, el Pacífico mexicano se caracteriza por presentar una biodiversidad muy elevada debido a la presencia de una mezcla de fauna templada y subtropical, y de una rica fauna subtropical y tropical que habita las aguas del golfo de California y la porción suroeste de México (desde bahía Banderas hasta la frontera con Guatemala). En el Pacífico mexicano todos los ambientes marinos están representados, desde las lagunas costeras, los sistemas estuarinos y las largas playas rocosas y arenosas, hasta las profundas cuencas y fosas oceánicas. Por su accesibilidad fueron los ecosistemas de aguas someros los primeros en ser explorados y estudiados de manera sistemática. Por el contrario, las investigaciones sostenidas en la plataforma continental y en las aguas oceánicas de esta región iniciaron muy recientemente, en particular debido a la llegada de algu- 1 2 3 4 Unidad Académica Mazatlán, Instituto de Ciencias del Mar y Limnología, Universidad Nacional Autónoma de México, Apdo. Postal 811, Mazatlán, Sinaloa, 82000, México. Email: [email protected] Facultad de Ciencias del Mar, Universidad Autónoma de Sinaloa, Avenida del Mar, Mazatlán, Sinaloa, México. Instituto Nacional de Ecología, SEMARNAT. Periférico 5000, Col. Insurgentes Cuicuilco, Del. Coyoacán, México D.F. 04530. Departamento de Zoología, Instituto de Biología, Universidad Nacional Autónoma de México, Avenida Universidad 3000, Ciudad Universitaria México D.F. 04510. 429 nas embarcaciones mayores que facilitaron la obtención de muestras y mediciones en alta mar. Una de las características más sobresalientes del Pacífico mexicano es su incorporación en la región oceánica donde la zona de aguas profundas desprovista de oxígeno (zona a la cual nos hemos referido en esta obra como la Zona del Mínimo de Oxígeno o ZMO) es la mayor a nivel mundial (Diaz y Rosenberg 1995, Serrano 2012). Este fenómeno natural, resultado de un exceso en la producción primaria subsuperficial en una escala de tiempo muy amplia y de la consecuente abundancia de material orgánico en descomposición en la columna de agua, es sin lugar a dudas un factor determinante para la abundancia y la distribución de las especies pelágicas y bentónicas en una parte significativa de la plataforma continental y en la porción superior del talud. Sobrevivir en las franjas batimétricas donde el oxígeno no supera valores de 0.5 ml l-1O2 o, incluso de 0.1 ml l-1O2, es un verdadero reto fisiológico que solamente algunas especies han logrado superar, desarrollando para ello mecanismos adaptativos que les proporcionan una enorme ventaja para ocupar hábitats decididamente hostiles para la mayoría de las especies (Rosenberg et al. 1991, Rogers 2000, Levin 2002). En el Pacífico mexicano, la presencia de una franja profunda donde los valores de oxígeno no son suficientes para la permanencia de especies no adaptadas tiene otras consecuencias. Por un lado, se ha podido constatar que la macrofauna que vive en las aguas someras, hasta el límite superior de la ZMO (entre 50 y 150 m de profundidad en la mayor parte de la zona estudiada durante el proyecto TALUD), es radicalmente distinta a la fauna que habita las aguas profundas que se extienden desde el margen inferior de la ZMO (entre unos 700 y 1000 m, salvo en el centronorte del golfo de California), a tal grado que los muestreos efectuados hasta la fecha, tanto en el golfo de California como frente a la costa suroeste de México, no han permitido encontrar una sola especie común entre estos dos conjuntos faunísticos. Por otro lado, la barrera fisiológica que representa la ZMO y la presencia de una amplia franja de “no vida” más allá de los 50-150 m de profundidad, reduce de manera drástica el área potencialmente disponible para las actividades pesqueras. Solo dentro un angosto corredor costero hay presencia de macro y megafauna bentónica potencialmente interesante para la explotación comercial (e.g., camarones, langostas, lenguados). Más allá de este corredor paralelo a la costa, el dramático descenso de las concentraciones de oxígeno hasta valores anóxicos se contrapone a la presencia de organismos aeróbicos y allí solo encontramos un “desierto pesquero” (Hendrickx y Serrano 2010, Serrano 2012). A pesar de ello, 430 Biodiversidad y comunidades del talud continental del Pacífico mexicano existen comunidades abundantes pero con una baja riqueza en especies que pueden establecerse en ambientes francamente hipóxicos, con concentraciones de oxígeno disuelto que no rebasan 0.16 ml l-1O2 (Levin et al. 1991). Según Levin y Gage (1998), el efecto de las condiciones “hipóxicas” sobre las comunidades puede ser relativamente limitado hasta llegar a valores criticas del orden 0.45 ml l-1O2. De hehco, los resultados obtenidos durante las campañas TALUD confirman esta observación, ya que fueron muchas las especies que fueron encontradas en ambientes con valores de oxígeno disuelto comprendidas entre 1.0 y 0.5 ml l-1O2. Sobre la base de estudios realizados en otras regiones del mundo, se sabe también que algunas especies (por ejemplo del grupo de los poliquetos) tienen la capacidad de adoptar un metabolismo anaeróbico cuando las condiciones ambientales se vuelven anóxicas; sin embargo, esta opción es pasajera y no permite sobrevivir por periodos alargadas en estas condiciones (Rogers 2000). De acuerdo con los registros de oxígeno disuelto de las campañas TALUD se ha determinado la presencia de la ZMO en gran parte del Pacífico mexicano. Esta zona, cuyo espesor y ubicación cambian con la profundidad de acuerdo a la latitud, representa una nueva área de conocimiento para los estudiosos del océano. Por ejemplo, la variación en la ubicación y el espesor de la ZMO a corto y largo plazos se desconocen y la relación con el cambio climático de estas variaciones de profundidad y espesor también es desconocida. Recordemos que la columna de agua (grandes profundidades) sirve como filtro a forzamientos externos de alta frecuencia, por lo que pequeñas variaciones a grandes profundidades de parámetros químicos, como el oxígeno disuelto, o físicos, como la temperatura, que pueden atribuirse a forzamientos de bajas frecuencias, pueden servir como indicadores de cambio en el clima terrestre. La ZMO representa retos y oportunidades para el sector pesquero. Por una parte, la franja en donde se ubican los organismos con potencial pesquero es limitada; así mismo, y con una visión positiva, el esfuerzo pesquero se concentra dependiendo de la latitud a unos pocos metros de profundidad. La mortandad de un número importante de organismos y sus consecuencias pesqueras, biológicas y ambientales se atribuyen al arribo hacia la superficie de agua anóxica o con escasa concentración de oxigeno disuelto (agua subsuperficial), arribo que se puede atribuir a afloramientos u ondas internas. Registros sistemáticos del oxígeno disuelto y su posterior análisis a lo largo de varios años en puntos estratégicos en la ZEE de México podrían brindarnos información valiosa de la evolución de la ZMO en tiempo y espacio, de la distribución geográfica de algunas especies y de su relación con el cambio climático. D iscusión 431 Un análisis preliminar de los valores de oxígeno obtenidos cerca del fondo durante los cruceros en el golfo de California (Hendrickx y Serrano, datos no publicados) permite observar que la franja dentro de la cual los valores son iguales o inferiores a 0.5 ml l-1O2 es parecido a lo presentado por Parker (1963). Al extender este análisis a valores de 0.05 ml l-1O2, esta franja permanece relativamente amplia, con valores cercanos a la anoxia, y no cabe duda que esta franja tiene un impacto determinante sobre la distribución de las especies de la plataforma y del talud continentales. La meiofauna, aquellos organismos bentónicos que viven sobre el sedimento o en los espacios intersticiales del mismo, y que por sus tallas atraviesan un tamiz de 500 μm de luz de malla, pero son retenidos en un tamiz de 44 μm de luz de malla (este criterio varía de investigador a investigador y de acuerdo al medio ambiente en el que se esté trabajando; comúnmente se emplean tamices con luces de malla de hasta 31 μm como límite inferior para separar a la meiofauna de la macrofauna en muestras del mar profundo) (véase Giere 2009), ha sido reconocida como un componente ecológicamente importante del bentos. A pesar de la importancia de la meiofauna en sistemas bentónicos costeros y del mar profundo, estas comunidades así como los taxa que la componen son unos de los menos conocidas en México, así como en África, América del Sur, Asia y Australia (Giere 2009). Debido a la facilidad para muestrear en ambientes someros (zona costera, lagunas, esteros, etc.), actualmente se conocen mejor los factores que regulan la distribución y abundancia de la meiofauna de estos sistemas, así como aquellas variables ambientales que regulan, de una u otra forma, la diversidad de los diferentes taxa que la componen. De manera similar, se conocen mejor las especies que habitan zonas someras que aquellas que habitan el mar profundo. Lo anterior debido, en gran parte a que las investigaciones acerca de la meiofauna de mar profundo está fuertemente limitada por el equipamiento necesario para tomar muestras de sedimento a grandes profundidades. El estudio de la meiofauna y de algunos de sus taxa han recibido la atención de investigadores de países con cierto grado de desarrollo científico y tecnológico, así como con “cierta tradición” en el estudio de la meiofauna. Países como Alemania, Estados Unidos y Bélgica han desarrollado, gracias también a la disponibilidad de el equipo adecuado para realizar muestreos a grandes profundidades, estudios en los océanos Atlántico, Pacífico e Indico, el Mediterráneo, el golfo de México, los océano Ártico y Antártico, y el mar Laptev (e.g., Gutzmann et al. 2004; Baguley et al. 2006, 2008; Morse y Beazley 2008; Gheerardyn y Veit-Köhler 2009). 432 Biodiversidad y comunidades del talud continental del Pacífico mexicano El mar profundo es un hábitat típicamente estable en comparación con los sistemas someros. En el futuro será interesante evaluar la relación entre la fisiografía del fondo y las corrientes profundas que, de alguna manera, al resuspender los sedimentos finos, provocan la presencia de parches arenosos en planicies lodosas. Lo anterior tiene un efecto importante en la composición y abundancia de la meiofauna. Los nemátodos pueden ser más numerosos en sustratos lodosos, mientras que los copépodos harpacticoides pueden ser dominantes en sustratos arenosos. Tal vez el rasgo más importante a evaluar en el futuro sea, según Gooday (2002) y Giere (2009), la estacionalidad de los procesos del mar profundo. Las condiciones ambientales de este último están íntimamente ligadas a los procesos que ocurren en la zona fótica. Tal es el caso de los florecimientos masivos de fitoplancton, que al depositarse y oxidarse en el fondo, puede llegar a provocar descensos estacionales muy marcados en la concentración de oxígeno disuelto, dando lugar a zonas mínimas de oxígeno, que en algunos casos pueden llegar a cubrir áreas muy extensas durante periodos prolongados de tiempo. Por el contrario, la ausencia de tales florecimientos puede favorecer concentraciones de oxígeno favorables para la meiofauna en el mar profundo. Estos análisis serán importantes en el futuro. Sin embargo, no es posible disociar este tipo de análisis ecológicos y el conocimiento taxonómico necesario para identificar, a nivel de género o especie, los diferentes componentes de la meiofauna. Actualmente se ha prestado más atención al conocimiento taxonómico de los dos taxa mas comúnes y abundantes de la meiofauna, los nemátodos y los copépodos harpacticoides. El análisis de estas poblaciones a nivel de género o especie dará resultados mas precisos acerca de los factores ambientales que regulan su distribución, abundancia y diversidad. Sin embargo, y a pesar de que actualmente nos encontramos en la era molecular y de la biodiversidad, la taxonomía todavía sigue sufriendo los efectos, por un lado, de las formas de evaluar el trabajo de los taxónomos, y por otro lado de la escasez cada vez más aguda de recursos para realizar investigaciones de carácter puramente taxonómico. Las instancias y autoridades en materia de ciencia y tecnología, así como los diferentes niveles del gobierno deberán, en un futuro no muy lejano, comprometerse aún más con la labor de los taxónomos de comunidades megadiversas y poco conocidas como la meiofauna. Como una consecuencia lógica de nuestros conocimientos muy limitados acerca de la composición y la abundancia de las comunidades de aguas profundas del Pacífico mexicano, poco se sabe acerca de los organismos parásitos en estas aguas. Si bien la diversificación de los crustáceos es amplia, sus formas parasíticas o simD iscusión 433 biontes tanto en peces como en invertebrados, particularmente en aguas profundas, han sido pobremente estudiadas en general. La búsqueda de asociaciones entre animales no ha sido uno de los objetivos principales del proyecto TALUD. Sin embargo, el descubrimiento durante las campañas TALUD IV y V de un nuevo género y una nueva especie de isópodos parásitos (Bopyridae) en la cavidad branquial de una especie de langostinos (galateidos o “squat lobsters”) recolectada a 835-870 m de profundidad (Román-Contreras y Boyko 2007), es un buen ejemplo de lo poco que conocemos sobre este tipo de relaciones. Por otro lado, el hallazgo de una especie nueva de copépodo parásito de peces indica el éxito de estos organismos para lograr sobrevivir aún en condiciones de mínimo de oxígeno. También indica que debe ser puesta más atención en los diferentes grupos de parásitos, tanto de hospederos vertebrados como de invertebrados. Los poliquetos son un grupo de invertebrados importantes en los ambientes marinos por la amplia gama de ambientes que habitan, por las múltiples formas de alimentación y reproducción que presentan, así como por su gran abundancia y diversidad. En la actualidad existen pocos estudios de poliquetos habitantes de mar profundo en el golfo de California que han sido realizados por investigadores mexicanos (e.g., Solís-Weiss y Hilbig 1992, Solís-Weiss y Hernández-Alcántara 1994, Méndez 2006, 2007). En esta obra se presentan resultados de los poliquetos recolectados en los cruceros TALUD IV-VII, entre 732 y 2110 m de profundidad, haciendo la distinción entre los pertenecientes a la infauna que viven dentro del sedimento y los de la epifauna que viven en la superficie del sedimento . En total se encontraron 106 taxa de poliquetos correspondientes a 34 familias, se identificaron 73 especies (83 taxa pertenecen a la infauna y 52 a la epifauna, de los cuales únicamente 29 se encontraron tanto en la superficie como dentro del sedimento). Las familias mejor representadas en el sureste del golfo de California, de acuerdo con el mayor número de taxa, fueron Ampharetidae, Maldanidae (infauna y epifauna), Cirratulidae, Lumbrineridae (infauna) y Phyllodocidae (epifauna). Se encontraron 10 especies representativas del área de estudio de acuerdo con su presencia en las diferentes estaciones de muestreo y en los diferentes cruceros. Ancistrosyllis hartmanae constituye un nuevo registro de distribución en fondos blandos del golfo de California o áreas adyacentes. Asimismo, se obtuvieron nuevos registros de distribución batimétrica de seis especies. Con el fin de facilitar futuros estudios taxonómicos, se presentó la descripción de los tubos o estructuras protectoras de 13 especies que no habían sido descritos 434 Biodiversidad y comunidades del talud continental del Pacífico mexicano previamente o que habían sido descritos y para los cuales se incluyó información complementaria. El análisis de las relaciones de los poliquetos de la infauna y de la epifauna con las variables ambientales medidas durante los cuatro cruceros (profundidad, oxígeno disuelto, temperatura del agua, granulometría del sedimento y contenido de materia orgánica en el sedimento) permitió interpretar la presencia de las especies en relación con los hábitos alimenticios o de locomoción de las diferentes familias de poliquetos encontradas. Este tipo de análisis es extremadamente escaso para los ecosistemas de aguas profundas del Pacífico mexicano, tanto en el caso de los poliquetos como de otros grupos de invertebrados. Se concluyó que los poliquetos tanto de la infauna como de la epifauna del mar profundo del sureste del golfo de California no siguen gradientes de las variables ambientales estudiadas y su distribución está controlada por la combinación de varias de estas , entre las que destacan la profundidad, la concentración de oxígeno disuelto y la temperatura del agua. Actualmente, las recopilaciones contenidas en los trabajos de Salazar-Vallejo y Londoño-Mesa (2004) y de De León-González et al. (2009) incluyen gran parte de la literatura existente sobre los poliquetos en México, de áreas tanto someras como profundas. Estas obras han contribuido enormemente al conocimiento de este grupo en nuestro país; sin embargo y a pesar de tratarse de uno de los grupos de invertebrados dominantes en los fondos marinos y con un fuerte impacto sobre la dinámica de los ecosistemas, el estudio de los poliquetos marinos está aún restringido a un reducido número de grupos de investigación nacionales. El estudio de la taxonomía del grupo es complicado debido, principalmente, a que en muchas ocasiones, los organismos, al tener el cuerpo blando, aparecen dañados en las muestras, lo que imposibilita su identificación a nivel de especie e incluso de género o familia. En el caso de mar profundo, este problema se incrementa aún más, debido a la escasez de claves de identificación de poliquetos que viven en este ambiente. A esto se suma el problema del alto costo de la realización de campañas a bordo de buques oceanográficos provistos del equipo necesario para recolectar muestras de sedimento a grandes profundidades. A nivel global, los moluscos de aguas profundas son el tercer grupo de invertebrados por orden de dominancia y se encuentran en todos los niveles batimétricos, hasta las fosas más profundas. La diversidad alcanzada por este grupo en las grandes profundidades es muy elevada y consiste esencialmente de especies que se alimentan de depósitos orgánicos (Gage y Tyler 1992). En diversas localidades D iscusión 435 de los océanos se han registrado diversidades muy altas en el caso de los bivalvos y los gasterópodos. El uso de artes específicamente diseñados para muestrear cuantitativamente los sedimentos blandos (i.e., los nucleadores de caja), añadido al hecho de que los moluscos de la endofauna (casi en su totalidad bivalvos) son relativamente poco móviles, ha ciertamente favorecido su captura y su estudio, motivo por el cual existe una gran cantidad de información acerca de este grupo de organismos en aguas profundas. En el caso de los gasterópodos, han aparecido con frecuencia en las muestras de sedimentos y en las redes o trineos de arrastre, como fue el caso durante las campañas TALUD. Un tercer grupo de moluscos, los Polyplacophora o quitones, son mucho menos diversificados en aguas profundas y presentan una distribución particular ya que requieren de un soporte relativamente duro para establecerse. En el caso de los Aplacophora, un grupo esencialmente fósil, solo se conoce unas cuantas especies actuales (Gage y Tyler 1992). Los cefalópodos (pulpos y calamares) son extremadamente móviles y consecuentemente no hay muchos registros para ellos en aguas profundas. A lo largo de las campañas TALUD IV-IX se recolectó un total de aproximadamente 2700 especímenes, lo que representa seguramente el conjunto de moluscos de aguas profundas más importante obtenido por parte de una institución nacional desde el inicio de la exploración de los mares de México. El estudio de este material permitió obtener una serie importante de información acerca de la composición de las comunidades de bivalvos, gasterópodos y escafópodos del golfo de California y acerca de su ecología. Dentro del material recolectado, quedan por estudiarse algunos moluscos pelágicos como calamares, pulpos y algunos gasterópodos que todavía no han sido revisado con atención; sin embargo, entre este material, ya se ha podido detectar la presencia de varias especies nuevas y otras tantas de interés especial para la ciencia. Al igual que en el caso de otros grupos faunisticos, el potencial comercial de los moluscos de aguas profundas del Pacífico mexicano es difícil de evaluar. Ciertamente, la profundidad de residencia de las especies es un factor decisivo ya que complica mucho las maniobras de captura. Por ejemplo, en el caso de Bathybembix bairdii (Dall, 1889), una especie relativamente grande y abundante de Gastropoda que ha representado capturas de hasta 769 kg en un solo arrastre frente a las costas de El Salvador entre 824 y 921 m de profundidad . Es una especie definitivamente apta para el consumo humano (Hendrickx y Lopéz 2006). De acuerdo con los resultados compilados por Mullins et al. (1985), hay un número relativamente alto de especies de moluscos que toleran concentraciones 436 Biodiversidad y comunidades del talud continental del Pacífico mexicano de oxígeno bajas (del orden de 0.5 ml l-1 O2), aunque no al mismo nivel que algunas especies de poliquetos que soportan concentraciones todavía más bajas (del orden de 0.3 ml l-1 O2 o que incluso pueden sobrevivir por lapsos cortos de tiempo en condiciones anóxicas). Evidentemente, en el caso de los moluscos bivalvos (la mayoría asociados con el sedimento) y de los gasterópodos, el poseer una capacidad de movilidad nula o muy reducida representa una desventaja en caso de que se incremente el nivel de hipoxía, ya que no pueden adoptar un comportamiento de “escape” que les permite huir de las zonas críticas. En el caso de los moluscos de aguas profundas del Pacífico mexicano, nuestro conocimiento es todavía embrionario. Zamorano y Hendrickx (2009) compilaron una lista de todas las especies de moluscos citadas para el golfo de California entre 200 y 3800 m de profundidad, tomando en cuenta los resultados de los cruceros TALUD IV-IX, así como la información disponible en la literatura y en algunas colecciones; la lista contiene 225 especies con solamente 614 registros (o sea una media de 2.7 registro por especie). El mismo análisis realizado para el área correspondiendo a la corriente de California (parte mexicana) para las especies conocidas entre 200 y 4200 m de profundidad arrojó un total de 177 registros (118 species), todos tomados de la literatura o de registros de colecciones (Zamorano y Hendrickx 2011), lo que corresponde a una media de 1.5 registros por especie. En otros términos, se contó con solamente unos 791 registros de moluscos de aguas profundas para el área correspondiente al la totalidad del golfo de California y las aguas profundas de la parte oeste de la península de Baja California, lo cual es muy poco. De manera general, el interés para los moluscos es mucho más elevado que para el resto de los invertebrados marinos, esencialmente debido a la existencia de numerosos malacólogos aficionados y de un amplio mercado para especies raras o de particular belleza. Sin embargo, en el caso de las aguas profundas, las comunidades son prácticamente inaccesibles. Esta desventaja dificulta el estudio de estos organismos, pero a la vez los protege de posibles recolecciones excesivas o de saqueos sistemáticos con fines de lucro. Entre los crustáceos, los grupos mejor representados en aguas profundas del talud continental o, incluso, más abajo, son los Peracarida (en particular los anfípodos), los cangrejos anomuros (en particular los Galatheoidea) y sobre todo en la zona batial los camarones Dendrobranchiata y Caridea (Gage y Tyler 1992). Las langostas de aguas profundas son también un elemento importante de las comunidades profundas, en particular por debajo de los 2000 m de profundidad (Galil D iscusión 437 2000). Como grupo, los peracáridos aparecen como los más abundantes dentro de los crustáceos y pueden llegar a representar entre 32 y 51% de las especies del macrobentos (Hessler y Wilson 1983) y su alimentación es esencialmente de tipo detritívoro. Por su parte, los Galatheoidea (que incluye los “squat lobsters” o langostinos del género Munidopsis) caracterizan las aguas profundas en todas las regiones del mundo, donde más de 224 especies habían sido reconocidas en 2008 (Baba et al. 2008). Y nuevas especies están siendo descritas prácticamente cada mes. Entre los camarones carídeos, el grupo quizás más característico es el de los Glyphocrangonidae, una familia monotípica (solo contiene el género Glyphocrangon) que caracteriza las aguas profundas a nivel global con unas 85 especies descritas (Hendrickx 2010). Otros camarones, incluyendo algunos Dendrobranchiata (i.e., grupo al cual pertenecen los peneideos de aguas someras), forman parte de la fauna que nada cerca del fondo y se alimentan generalmente de restos en proceso de degradación, por lo que son atraídas por y fácilmente capturados en trampas con carnadas (Gooding 1984). Dentro de la fauna profunda, los cangrejos Brachyura no representa un grupo dominante, sino todo lo contrario, y solo una pequeña porción de este muy diverso grupo de crustáceos ha colonizado las grandes profundidades. En particular, contamos con las especies de Geryon y de Chaceon, las cuales suelen ser muy abundantes en algunas regiones del mundo donde extienden su distribución batimétrica desde la plataforma hasta el talud continentales y son, incluso, sujetos a una pesquería comercial (Griffin y Tranter 1986, Gage y Tyler 1992). Según el grupo de organismos, nuestros conocimiento acerca de la fauna de crustáceos de aguas profundas del Pacífico mexicano varía enormemente en calidad y cantidad. En el caso de los Stomatopoda (las esquilas o galeras), la enorme mayoría de las especies son de aguas someras o intermedias, y hay pocos registros de este grupo en aguas con profundidades mayores a los 500 m (Hendrickx y Salgado-Barragán 1991). Sin que haya una explicación lógica para ello, no se cuenta con representantes del género Bathysquilla, encontrado hasta unos 900 m de profundidad en otras regiones del mundo (Manning 1969), en el Pacífico este. En el Pacífico mexicano, la especie que alcanza la mayor profundidad de residencia es Squilla biformis Bigelow, 1891 (hasta 518 m), pero en aguas mexicanas ésta se encuentra al límite inferior de la plataforma continental (hasta 117 m de profundidad), donde la ZMO inicia, y no hay registros de su presencia por debajo de esta zona (Hendrickx y Salgado-Barragán 1991). Poco se sabe acerca de la taxonomía, la distribución y la ecología de los Peracarida (e.g., isópodos, anfípo438 Biodiversidad y comunidades del talud continental del Pacífico mexicano dos, tanaidáceos, cumáceos) de aguas profundas del Pacífico este en general y del Pacífico mexicano en particular, y eso a pesar que representan una componente muy importante en los ecosistemas profundos (véase Gage y Tyler 1992). Se debe en parte a la complejidad de su taxonomía, pero también a la falta de muestreos adecuados y al reducido número de expertos en este campo a nivel nacional. A pesar de ello, se logró describir una nueva especie de Bopyridae (Roman-Contreras y Boyko 2007) y otra especie profunda del género Epimeria está siendo descrita (Winfield et al. 2012). En cambio, el poco diversificado pero ocasionalmente muy abundante grupo de los Lophogastrida fue estudiado de manera muy completa en aguas del Pacífico de México, y se cuenta con una buena base de información acerca de la composición del grupo y de su distribución (Ibarra-Rivera y Hendrickx 2008). Segundo en importancia en aguas profundas, el grupo de los crustáceos decápodos (i.e., camarones, langostas, langostinos y cangrejos) es mejor conocido (véase Hendrickx 2012a). Si bien hace falta la obtención de una mayor cantidad de datos acerca de su abundancia y de su biología en la región, existe mucha información de base sobre esta fauna, en gran parte debido al material recolectado durante las campañas TALUD. A pesar del alto número de muestreos realizados durante el proyecto, hasta la fecha se han encontrado solamente tres especies nuevas (dos de las cuales ya fueron formalmente descritas) (Hendrickx 2002, Hendrickx y Ayón-Parente 2012), lo cual podría parecer algo sorpresivo considerando lo poco que se tenía como antecedentes acerca del grupo en la región (véase Hendrickx 2012b). Las peculiares comunidades de invertebrados (en particular los crustáceos) presentes en las ventilas hidrotermales del Pacífico mexicano no fueron estudiados durante el proyecto TALUD, pues el objetivo era enfocarse sobre los fondos blandos. Hay una buena serie de datos sobre estos ecosistemas y sus habitantes (Williams 1985, Gage y Tyler 1992), aunque evidentemente se requiere una mayor intensidad de los programas de investigación en la región y, de ser posible, lo ideal sería poder contar con un grupo de trabajo nacional independiente que cuente con la infraestructura adecuada (i.e., equipos de filmación y de recolección autónomo tipo ROV con capacidad de inmersión de hasta por lo menos 3000 m). Al igual que los demás grupos de invertebrados bentónicos, los equinodermos de aguas profundas han sido estudiados de manera superficial, dándole mayor énfasis a aspectos taxonómicos y de distibución geográfica (véase Maluf 1988). Sin lugar a duda, las capturas realizadas durante las campañas TALUD (unos 4500 especímenes perteneciendo a las estrellas de mar, las ofiuras o estrellas quebradizas, D iscusión 439 los erizos y las holoturias) son de las mayores registradas para el Pacífico mexicano hasta la fecha. Si bien se pudo reconocer entre las muestras hasta la fecha un número limitado de especies (55 especies de las 165 registradas en la región en profundidades mayores a 350 m), este material reviste una importancia considerable para nuestros conocimientos acerca de la composición de las comunidades que se encuentran por debajo de la ZMO. Los equinodermos, en general, son organismos frágiles, cuyo esqueleto externo, formado por placas calcáreas, se rompe fácilmente durante las operaciones de arrastre o durante la recuperación de las muestras dentro de las redes. Incluso la conservación de especímenes en colecciones es un reto debido a su fragilidad, pero también debido al hecho que suelen perder partes importantes de su estructura (e.g., las espinas) que son necesarias para realizar una identificación correcta. En una muestra obtenida mediante un “arrastre”, es muy común contar con especímenes de erizos totalmente aplastados o destrozados y de estrellas “quebradizas” con todos o gran parte de los brazos mutilados. Aún así, existen casos en los cuales se han recolectado decenas o centenas de especímenes de una sola especie en una misma localidad, con un porcentaje alto de individuos en buenas condiciones. La suerte también sonríe a veces al investigador, como en el caso de un crucero CORTES en el golfo de California donde una muestra obtenida con una draga Van Veen permitió recolectar un individuo grande de un erizo irregular poco común, perfectamente conservado e intacto, justo en medio del lodo recuperado, lo cual provoco en aquel entonces el beneplácito de la Dra. María Elena Caso Muñóz (QEPD). Otro de los problemas fundamentales en el estudio de los equinodermos de aguas profundas es que, en el caso de muchas especies, antes del inicio del proyecto TALUD, las colecciones nacionales carecían de material representativo, pues la enorme mayoría de los especímenes recolectados en el pasado a estas profundidades se encuentra en museos de los EE. UU. Dada la imperiosa necesidad de comparar el material de los cruceros TALUD con el material tipo depositado en estos museos, los procesos de identificación son largos y tediosos, pues hay que contar con la colaboración de expertos que tienen acceso a dicho material. Sobre la base del material recolectado durante las campañas TALUD, se pudo aumentar de manera muy significativa el número de especies y de especímenes disponibles en México para su estudio. Los porcentajes de representatividad en cada uno de los grupos de equinodermos, considerando el número de especies recolectadas durante el proyecto vs. el número de especies cuya presencia ha sido 440 Biodiversidad y comunidades del talud continental del Pacífico mexicano señalada en aguas mexicanas del Pacífico varía considerablemente: 30% en el caso de las estrellas de mar; 14% en el caso de las estrellas quebradizas; 22% en el caso de los erizos de mar; y 69% en el caso de los pepinos (Hendrickx 2012c). Como se señaló en esta obra, en el caso de las estrellas quebradizas (Ophiuroidea), el porcentaje aumentará seguramente una vez que se cuente con la identificación de todo el material recolectado. El aprovechamiento de los recursos marinos en las aguas del Pacífico mexicano ha tenido una influencia limitada, pero cierta, sobre los equinodermos de la región (Hendrickx 1995, Reyes-Bonilla et al. 2008). Las principales especies afectadas por la pesca pertenecen a los grupos de los pepinos de mar (Holothuroidea) y a los erizos (Echinoidea). En el primer caso, se desarrolló una pesca intensiva de Isostichopus fuscus (Ludwig, 1875) en el golfo de California en los años 19881994, con una fuerte sobreexplotación que llegó a tal grado que el gobierno decidió colocarla en el grupo de especies en riesgo, por lo que actualmente esta en veda permanente (Solís-Marín et al. 2009) y su aprovechamiento requiere de un permiso especial otorgado no por la SAGARPA sino por la Semarnat. Recientemente la especie ha sido registrada en la costa oeste de Baja California (Turrubiates-Morales 2009). En el caso de los erizos, existe una pesquería artesanal de Echinometra vanbrunti A. Agassiz, 1863, cuyas gónadas son consumidas y el esqueleto se vende como recuerdo en tiendas de curiosidades (Hendrickx 1995). También se está explotando Strongylocentrotus franciscanus (A. Agassiz, 1863) (la mayoría de las capturas) y S. purpuratus (Stimpson, 1857) en las costas de Baja California, con una producción anual del orden de 2000 toneladas (Palleiro Nayar et al. 2003), y se comercializan las gónadas (Vázquez-Solórzano y Salgado-Rogel 2003). Por ser de difícil acceso, los equinodermos que se ubican por debajo de la ZMO no han sido explotados ni estudiados desde un punto de vista alimenticio o farmacéutico. Sin embargo, no es de descartar que en pocos años se pudiera organizar programas de explotación de las especies que allí se encuentran, con los posibles daños que una explotación descontrolada, y sin poder contar con antecedentes serios sobre la dinámica de las comunidades naturales. En el caso de los pepinos de mar de aguas someras, por ejemplo, se han hecho recomendaciones para que estén considerados dentro de la lista de especies protegidas y que se busque evaluar el estado de las poblaciones, y no solamente su abundancia y su densidad, antes de considerarlos como recursos explotables (Herrero-Perézrul y Reyes-Bonilla 2003). Obviamente, un mecanismo similar sería necesario antes de considerar una posible explotación de recursos del mar profundo. El material recolectado durante las campañas D iscusión 441 TALUD I-XII no dejó entrever opciones viables de explotación de equinodermos, pues las abundancias fueron muy limitadas. Sin embargo, es de resaltar que los artes de pesca utilizadas no fueron diseñadas para “capturas masivas”. También es de señalar que durante la más reciente campaña TALUD XIV, en el golfo de California norte, se recolectaron del orden de 125 kg ha-1 de Spatangus californicus H.L. Clark, 1917 (datos no publicados), una densidad muy apreciable, aunque quedaría por averiguar si esta especie es de interés para el consumo humano. Independientemente del hecho de que algunas de las especies de equinodermos que se encuentran por debajo de la ZMO podrían, en su momento, presentar algún tipo de importancia para la pesca, resulta de suma importancia seguir con la exploración de las aguas profundas de la Zona Económica Exclusiva de México con el fin de poder detectar la eventual presencia de especies que podrían contener agentes químicos de interés para la investigación en ciencias bioquímicas o farmacéuticas. En el caso de los peces y sobre la base de la información obtenida durante los cruceros TALUD, parece evidente que se requiere de un mayor esfuerzo para completar los análisis del material obtenido, a la vez que es indispensable multiplicar los arrastres exploratorios para poder contar con muestras más representativas de esta fauna extremadamente móvil. Hasta la fecha, los resultados más completos fueron obtenidos con los Macrouridae, pues el estudio de unos 148 especímenes permitió detectar la presencia de cuatro especies dentro del golfo de California (Moreno-Flores 2009). La posible explotación de especies de peces de aguas profundas se enfrenta, al igual que en el caso de los invertebrados, a serios problemas de protección del hábitat natural. Por lo anterior, se debería plantear una política responsable de exploración de los recursos potenciales, con especial atención a los ecosistemas naturales e intactos que todavía existen en las grandes profundidades. La tasa de recuperación de las poblaciones que habitan las aguas profundas es muy mal conocida; depende de los procesos de reclutamiento y de crecimiento que, en la mayoría de los casos, no han sido estudiados. En el mar Mediterráneo, donde los crustáceos decápodos constituyen uno de los grupos dominantes de la megafauna bentónica en aguas profundas, se han explotado recursos en aguas de hasta 800 m de manera rutinaria (Carbonell et al. 1999, Cau et al. 2002) y existe también una pesca importante (de hasta 44500 toneladas año-1) para especies de merluzas en la misma región (género Merluccius) (Orsi-Relini et al. 2002). De hecho, en los últimos 20 años, se han incrementado los programas de estudio sobre estos recursos de aguas profundas, hasta 1000-2000 m (véase Cartes et al. 1993) y hasta 4000 m de profundidad 442 Biodiversidad y comunidades del talud continental del Pacífico mexicano (véase Company et al. 2004). En cambio, en el Pacífico mexicano, los intentos de evaluación de los recursos pesqueros de profundidades son extremadamente escasos. El caso aislado de la pesca de Cancer johngarthi Carvacho, 1989, frente a las costas de Baja California, es algo excepcional. Los informes acerca de esta pesca indican que se esta efectuando mediante trampas entre 80 y 530 m de profundidad. El recurso ha sido ampliamente estudiado desde varios puntos de vista (e.g., Cervantes-Díaz et al. 2006, López-Rocha et al. 2006). El mismo recurso ha sido detectado en aguas del golfo de California, en particular en la porción norte (Hendrickx, datos no publicados), pero la información disponible es muy escasa. En todos casos, una posible explotación debería efectuarse mediante trampas, un tipo de arte de pesca mucho menos invasivo que las redes tradicionales, y tendría que ser precedido de un amplio estudio de dinámica de población y de sustentabilidad. La pesca mediante trampas en el golfo de California podría tener otro objetivo, pues muestras preliminares obtenidas durante el crucero PANDAL a bordo del B/O “El Puma” en 2002 indican que los camarones Pandalidae (e.g., Heterocarpus affinis y Pandalus amplus) son relativamente fáciles de capturar con este tipo de arte (Hendrickx, datos no publicados), el cual presenta la enorme ventaja de no ser muy dañino para el medio ambiente, además de ser de uso sencillo y económico. Existen numerosos ejemplos de éxito comercial a pequeña escala con la pesca de camarones pandálidos (Gooding 1984). Durante los mismos muestreos, se pudo detectar la presencia de peces de la familia Myxinidae en las mismas trampas, con una especie, Myxine circifrons Garman, 1899, que podría representar otra opción de pesca con trampas en aguas profundas (Hendrickx y Hastings 2007). Al igual que en cualquier tipo de investigación, el uso de la infraestructura y de los equipos adecuados es fundamental para garantizar el éxito. Considerando el alto costo de las campañas oceanográficas (pago de tripulaciones, gasto de combustibles, mantenimiento y avituallamiento) un crucero mal organizado o que no cuente con el equipamiento indispensable y confiable para recolectar los datos y los organismos por estudiarse, representa una mala inversión de recursos. En el caso de las campañas TALUD, la mayoría de los equipos que se usaron para el muestreo de la fauna (e.g., trineos bentónicos, dragas Agassiz y Karling, redes de media agua, nucleadores múltiples) fueron de fabricación local, adaptando o modificando diseños clásicos para este tipo de actividad. En consecuencia, el costo de operación de cada campaña resultó muy bajo y el costo global del proyecto (exceptuando el gasto de operación del B/O “El Puma”, cubierto por la UNAM) fue muy pequeño D iscusión 443 considerando la amplia serie de resultados obtenidos. Sin embargo, las limitaciones presupuestales fueron ocasionalmente críticas y limitaron ciertas actividades o afectaron la calidad de algunas operaciones. Este tipo de problemas contrasta con el alcance del reto que representa el estudiar adecuadamente los ecosistemas profundos que se encuentran bajo la jurisdicción económica nacional (entiéndase, la Zona Económica Exclusiva, o ZEE, de México) en el Pacífico: unos 2400000 km2 (Hendrickx 1993). Entre las limitaciones con las cuales se cuentan para realizar operaciones más eficientes y más seguras en aguas profundas, destacan las dificultades de ubicar con precisión los equipos con respecto al nivel del fondo (i.e., altura con respecto al fondo), la problemática de evaluar la duración efectiva de los arrastres (i.e., cuanto tiempo el equipo está realmente en el fondo), la necesidad de evitar la contaminación de las muestras durante el descenso y (sobre todo) el ascenso de los equipos de arrastre, la dificultad debido a los altos costos de poder desplegar sistemas de trampas grandes autónomas, y la posibilidad de poder obtener muestras discretas del micronecton (e.g., camarones pelágicos, calamares) en la columna de agua. Por supuesto, todos estos problemas tienen soluciones de ingeniería o de tecnología clásicas o avanzadas (e.g., Huberdeau y Brunel 1982, Sorbe 1983, Guennegan y Martin 1985). Por ejemplo, la disponibilidad de “pingers” (pequeños transmisores amarrados a los equipos y que proporcionan información constante sobre la posición de éstos con respecto al fondo y a la superficie) daría una mayor seguridad en todas las operaciones de inmersión de equipos y permitirían evaluar con una buena precisión el momento en el cual los equipos de arrastre tocan fondo (inicio de la operación de arrastre) o se elevan sobre el mismo (fin de la operación). La instalación de cortinas retráctiles (sistema de respuesta mecánica o eléctrica con impulso desde la superficie) en la boca de los equipos de arrastre rígidos (e.g., trineos bentónicos) permitiría evitar la captura de organismos pelágicos durante el traslado del arte en la columna de agua. El uso de trampas autónomas (i.e., con inmersión controlada, liberación automática desde el fondo después de un tiempo determinado) de gran tamaño y equipadas con sistemas de video/fotográfico y de ubicación, sería un gran avance en la evaluación de la densidad y diversidad de la fauna atraída por carnadas. En el ámbito pelágico, el uso de grandes equipos de muestreo tipo redes “Isaac Kidds” con redes múltiples de despliegue automático (i.e., 3-4 bolsas que se abren y se cierran a distintos niveles batimétricos) (Roe y Shale 1979) y con “Pingers” de posición vertical ya está solucionado desde el punto de vista tecnológico, pero los costos de adquisición y de mantenimiento son 444 Biodiversidad y comunidades del talud continental del Pacífico mexicano altos. Como se puede apreciar, sí existen alternativas de ingeniería o tecnológicas que permiten -en muchos casos- conseguir una cantidad de información mucho mayor y/o de mejor calidad. Sin embargo, los científicos que estudian las comunidades bentónicas o pelágicas en aguas profundas por lo general no son ingenieros o técnicos especializados en diseños de equipos y no cuentan con la capacidad (ni con el tiempo) para confrontarse con este tipo de retos. Claramente, en estos casos se requeriría de una estrecha colaboración entre biólogos, oceanólogos y técnicos especializados. Por otro lado, Méndez y Hendrickx (2012) presentaron algunas de las dificultades de muestreo e interpretación de resultados con las cuales se puede enfrentar el investigador al utilizar los diferentes equipos para recolectar la macrofauna en el mar profundo. Como ejemplo, se analizaron las ventajas y las desventajas de la draga Karling, del trineo bentónico y del nucleador de caja para el muestreo del poliqueto Melinnampharete gracilis Hartman, 1969, recolectado durante los cruceros TALUD IV-X. Se seleccionó esta especie debido a la abundancia extrema registrada en una de las estaciones del crucero TALUD IV (alrededor de 16000 individuos en un solo arrastre con el trineo bentónico, equivalente a 4.16 individuos m-2) (Méndez 2009). Este ejercicio demostró que, aún en el caso de usar un equipo de muestreo que no permite obtener valores de densidades confiables, esto puede ser ventajoso ya que se obtiene una cantidad muy elevada de individuos para realizar estudios de tipo biológicos o bioquímicos, por ejemplo. Según los datos recopilados por Gage y Tyler (1992), virtualmente todas las “regiones oceánicas” del mundo han sido exploradas con el propósito de investigar la fauna de aguas profundas; sin embargo, la intensidad de las exploraciones ha sido muy variable y globalmente, solo una pequeña porción de los fondos marinos ha sido “muestreada” comparativamente con las inmensas extensiones batiales, abisales y hadales. Además, la cantidad de muestras obtenidas mediante el uso de nucleador de caja rebasa y por mucho, las muestras obtenidas por medio de redes o trineos de arrastre de gran tamaño, lo que representa una enorme desventaja al momento de querer identificar y cuantificar las comunidades de macro y megafauna que ocupan estos ambientes profundos (Gage y Tyler 1992). Si bien la situación ha mejorado notablemente en los últimos años en algunas regiones del globo (e.g., el Pacífico oeste, el Atlántico norte), regiones enteras carecen todavía de información suficiente sobre estas biocenosis. Considerando la pequeña porción de la ZEE que ha sido sujeta a algún tipo de investigación en aguas profundas, el reto del futuro parece no tener solución inmeD iscusión 445 diata. Basta recordar que casi el 90% de la extensión marina de la ZEE de México en el Pacífico tiene profundidades mayores a los 500 m y un poco más del 83% alcanza profundidades iguales o mayores a los 2000 m (Hendrickx 1993). En el caso del proyecto TALUD se pudo muestrear de manera satisfactoria en el sureste (cuatro campañas consecutivas) y el suroeste (dos campañas consecutivas) del golfo de California. En cambio, la porción centro-norte solo fue visitada una vez. En el caso del suroeste de México, se efectuaron dos campañas entre las costas de Jalisco y de Guerrero, pero en una de éstas (TALUD XI) la pérdida de dos equipos debido a una falla en la maniobra de inicio de arrastre redujo de manera muy significativa los logros obtenidos. Independientemente de la necesidad de efectuar muestreos adicionales en el centro-norte del golfo de California y en la costa suroeste de México, queda por explorarse toda el área del golfo de Tehuantepec, la zona que se encuentra frente a la costa oeste de la península de Baja California y las vastas extensiones oceánicas de la ZEE donde las profundidades rebasan los 2500 m, límite de profundidad actual permitida con la infraestructura del B/O “El Puma” que cuenta con solo unos 5.5 km de cable para arrastres profundos. En términos conservadores, y tomando como referencia el ritmo actual de exploración de las grandes profundidades, se requeriría de un mínimo de 30 campañas oceanográficas, con una duración media de 15 días por campaña, para poder cubrir de manera preliminar el área de la ZEE que no ha sido explorada. Paralelamente, y considerando que la cantidad de material y de datos acumulada rebasaría –y por mucho- la capacidad actual de investigación en el País, sería pertinente duplicar la infraestructura humana dedicada a este tipo de proyectos. Referencias Baba, K., E. MacPherson, G.C.B. Poore, S.T. Ahyong, A. Bermudez, P. Cabezas, C.W. Lin, M. Nizinski, C. Rodríguez y K.E. Schnabel. 2008. Catalogue of squat lobsters of the World (Crustacea: Decapoda: Anomura- families Chirostylidae, Galatheidae and Kiwaidae. Zootaxa 1905: 1-220. Baguley, J.G., P.A. Montagna, L.J. Hyde, R.D. Kalke y G.T. Rowe. 2006. Metazoan meiofauna abundance in relation to environmental variables in the northern Gulf of Mexico deep sea. Deep-Sea Research I 53: 1344-1362. Baguley, J.G., P.A. Montagna, L.J. Hyde y G.T. Rowe. 2008. Metazoan meiofauna biomass, grazing, and weight-dependent respiration in the Northern Gulf of Mexico deep sea. Deep-Sea Research II 55: 2607-2616. 446 Biodiversidad y comunidades del talud continental del Pacífico mexicano Carbonell, A., M. Carbonell, M. Demestre, A. Grau y S. Montserrat. 1999. The red shrimp Aristeus antennatus (Risso, 1816) fishery and biology in the Balearic islands, western Mediterranean. Fishery Research 44: 1-13. Cartes, J., F. Sardá y P. Abelló. 1993. Decapod crustaceans collected by deep water trawls (between 1000 and 2000 m) in the Catalan area (north-western Mediterranean). Bios (Thessaloniki) 1: 207-213. Cau, A., A. Carbonell, M.C. Follesa, A. Mannini, G. Norrito, L. Orsi-Relini, C.Y. Politou, S. Ragonese y P. Rinelli. 2002. MEDITS-based information on the deep-water red shrimps Aristeaomorpha foliacea and Aristeus antennatus (Crustacea: Decapoda: Aristeidae. Pp. 103-124. En: P. Abello, J.A. Bertrand, L.Gil de Sola, C. Papacomnstantinou, G. Relini y S. Souplet (eds.). Mediterranean marine demersal resources: The medits International Trawl Survey (1994-1999). Scientia Marina 66 (supl. 2). Cervantes-Diaz, J.L., M. Ramírez-Rodriguez, F. Arreguín-Sánchez y J. Fiol-Ortiz. 2006. Selectivity of traps for the deep-water crab, Cancer johngarthi Carvacho, 1989 in the northern Mexican Pacific. Crustaceana 79(2): 217-225. Company, J.B., P. Maiorano, A. Tselepides, C.Y. Politou, W. Plaity, G. Rotllant y F. Sardá. 2004. Deep-sea decapod crustaceans in the western and central Mediterranean sea: preliminary aspects of species distribution, biomass and polulation structure. Scientia Marina 68 (supl. 3): 73-86. De León-González, J.A., J.R Bastida-Zavala, L.F. Carrera-Parra, M.E. García-Garza, A. PeñaRivera, S.I. Salazar-Vallejo y V. Solís-Weiss. 2009. Poliquetos (Annelida: Polychaeta) de México y América Tropical. Tomos I-III. Universidad Autónoma de Nuevo León, Nuevo León. 737 pp. Diaz, R.J. y R. Rosenberg. 1995. Marine benthic hypoxia: A review of its ecological effects and the behavioral responses of benthic macrofauna. Oceanography and Marine Biology Annual Review 33: 245-303. Gage, J.D. y P.A. Tyler. 1992. Deep-sea biology: a natural history of organisms at the deep-sea floor. Cambridge University Press. United Kingdom. 504 pp. Galil, B.S. 2000. Crustacea Decapoda: review of the genera and species of the family Polychelidae Wood-Mason, 1874. Pp. 285-387. En: A. Crosnier (ed.), Résultats des Campagnes Musorstom. Vol. 21. Mémoires du Museum National d’Histoire Naturelle, Paris 184. Gheerardyn, H. y G. Veit-Köhler. 2009. Diversity and large-scale biogeography of Paramesochridae (Copepoda, Harpacticoida) in South Atlantic abyssal plains and the deep southern Ocean. Deep-Sea Research I 56: 1804-1815. Giere, O. 2009. Meiobenthology. The microscopic motile fauna of aquatic sediments. Second edition. Springer-Verlag, Berlin. 527 pp. D iscusión 447 Gooday, A.J. 2002. Biological responses to seasonally varying fluxes of organic matter to the ocean floor: a review. Journal of Oceanography 58: 305-332. Gooding, R.M. 1984. Trapping surveys for the deep-water caridean shrimp Heterocarpus laevigatus and H. ensifer, in the north western Hawaiian Islands. Marine and Fishery Review 46(2): 51-85. Griffin, D.J.G., y H.A. Tranter 1986. Some majid spider crabs from the deep Indo-Pacific. Records of the Australian Museum 38: 351-371. Guennegan, Y. y V. Martin 1985. Techniques de prélevement. Annexe 3. Pp. 571-602. En: L. Laubier y Cl. Monniot (eds.). Peuplements profonds du golfe de Gascogne. IFREMER. Gutzmann, E., P. Martinez-Arbizu, A. Rose y G. Veit-Kohler. 2004. Meiofauna communities along an abyssal depth gradient in the Drake Passage. Deep-Sea Research II 51: 1617-1628. Hendrickx, M.E. 1993. Crustáceos decápodos del Pacífico Mexicano. Pp. 271-318. En: S.I. Salazar-Vallejo y N.E. González (eds.). Biodiversidad Marina y Costera de México. Comisión Nacional de Biodiversidad y CIQRO, México. Hendrickx, M.E. 1995. Equinodermos. Pp. 637-646. En: W. Fischer, F. Krupp, W. Schneider, C. Sommer, K.E. Carpenter y V.H. Niem (eds.). Guía FAO para la identificación de especies para los fines de la pesca. Pacífico centro-oriental. Vol. I. Plantas e Invertebrados. FAO, Roma, Italia. Hendrickx, M.E. 2002. A new deep water species of Odontozona Holthuis (Decapoda, Stenopodidae) from the Southern Gulf of California, Mexico. Crustaceana 75(3-4): 405-412. Hendrickx, M.E. 2010. A new species of Glyphocrangon (Decapoda: Caridea: Glyphocrangonidae) from off the coast of western Mexico. Zootaxa 2372: 358-366. Hendrickx, M.E. 2012a. Crustáceos decápodos (Arthropoda: Crustacea: Decapoda) de aguas profundas del Pacífico mexicano: Lista de especies y material recolectado durante el proyecto TALUD. En prensa. En: P. Zamorano, M.E. Hendrickx y M. Caso (eds.). Biodiversidad y comunidades del talud continental del Pacífico mexicano. Secretaría del Medio Ambiente y Recursos Naturales (Semarnat), Instituto Nacional de Ecología (INE). Hendrickx, M.E. 2012b. Operaciones oceanográficas en aguas profundas: los retos del pasado, del presente y del proyecto TALUD en el Pacífico mexicano (1989-2009). En prensa. En: P. Zamorano, M.E. Hendrickx y M. Caso (eds.). Biodiversidad y comunidades del talud continental del Pacífico mexicano. Secretaría del Medio Ambiente y Recursos Naturales (Semarnat), Instituto Nacional de Ecología (INE). 448 Biodiversidad y comunidades del talud continental del Pacífico mexicano Hendrickx, M.E. 2012c. Listado sistemático de los equinodermos de aguas profundas del Pacífico mexicano. En prensa. En: P. Zamorano, M.E. Hendrickx y M. Caso (eds.). Biodiversidad y comunidades del talud continental del Pacífico mexicano. Secretaría del Medio Ambiente y Recursos Naturales (Semarnat), Instituto Nacional de Ecología (INE), Hendrickx, M.E. y M. Ayón-Parente. 2012. First record of Prionocrangon Wood Mason & Alcock, 1981 (Crustacea: Decapoda: Caridea: Crangonidae) in the East Pacific and description of a new deep-water species from western Mexico. Zootaxa 3205: 63-68. Hendrickx, M.E. y J. López. 2006. Geographic and depth distribution of Bathybembix bairdii (Dall, 1889) (Mollusca, Gastropoda, Trochidae) in the East Pacific. Oceanides 21(1-2): 93-99. Hendrickx, M.E. y P.A. Hastings. 2007. Additional records and ecological data for Myxine circifrons Garman, 1899 (Myxiniformes: Myxinidae) in the Gulf of California, Mexico. Hidrobiológica 17(3): 81-84. Hendrickx, M.E. y J. Salgado-Barragán 1991. Los estomatópodos (Crustacea: Hoplocarida) del Pacífico mexicano. Publicación Especial Instituto de Ciencias del Mar y Limnología, UNAM 10: 1-200. Hendrickx, M.E. y D. Serrano. 2010. Impacto de la zona de mínimo de oxígeno sobre los corredores pesqueros en el Pacífico mexicano. Interciencia 35(1): 12-18. Herrero-Pérezrul, M.D. y H. Reyes-Bonilla. 2003. Análisis de los métodos de evaluación del recurso pepino de mar en el golfo de California. P. 42. En: Memorias del I Foro de Intercambios sobre Recursos Bentónicos de México, 1-3 de sept. 2003, INP–CRIP La Paz, BCS. Hessler, R.R. y G.D.F. Wilson. 1983. The origin and biogeography of the malacostracan crustaceans in the deep sea. Pp. 227-254. En: R.W. Smith, J.H. Price y P.E.S. Whalley (eds.). Evolution, Time and Space: the Emergence of the Biosphere. New York, N.Y., Academic Press. Huberdeau, L. y P. Brunel 1982. Efficacité et sélectivité faunistique comparée de quatre appareils de prélévements endo-, épi- et suprabenthiques sur deux types de fonds. Marine Biology 69: 331-343. Ibarra-Rivera, J.S. y M.E. Hendrickx. 2008. Los géneros Gnathophausia y Neognathophausia (Malacostraca: Lophogastrida) en el Pacífico mexicano.Contribuciones al Estudio de los Crustáceos del Pacífico Este [Contributions to the Study of East Pacific Crustaceans] Instituto de Ciencias del Mar y Limnología, UNAM 5(1): 55-93. Levin, L.A. 2002. Deep-ocean life where oxygen is scarce. American Scientist 90: 436444. D iscusión 449 Levin, L.A. y J.D. Gage. 1998. Relationships between oxygen, organic matter and the diversity of bathyal macrofauna. Deep-Sea Research II 45: 129-163. Levin, L.A., R.J. Etter, M.A. Rex, A.J. Gooday, C.R. Smith, J. Pineda, C.T. Stuart, R.R. Hessler y D. Pawson. 2001. Environmental influences on regional deep-sea species diversity. Annual Review Ecology System 32: 51-93. López-Rocha, J.A., F. Arreguín-Sánchez y M. Ramírez-Rodríguez. 2006. Stock size estimation of the Mexican crab Cancer johngarthi Carvacho, 1989 on the southwestern Peninsula of Baja California, Mexico. Crustaceana 79(9): 1033-1047. Maluf, L.Y. 1988. Composition and distribution of the Central Eastern Pacific Echinoderms. Technical Report, Natural History Museum of Los Angeles County 2: 1-242. Manning, R.B. 1969. Stomatopod Crustacea of the Western Atlantic. Studies in Tropical Oceanography, Institute of Marine Sciences, University of Miami 8: 1-380. Méndez, N. 2006. Deep-water polychaetes (Annelida) from the southeastern Gulf of California, Mexico. Revista de Biología Tropical 54: 773-785. Méndez, N. 2007. Relationships between deep-water polychaete fauna and environmental factors in the southeastern Gulf of California, Mexico. Scientia Marina 71(3): 605-622. Méndez, N. 2009. Distribution and extraordinary abundance of the deep-sea Melinnampharete gracilis Hartman, 1969 (Polychaeta: Ampharetidae) in the Gulf of California, Mexico. Cahiers de Biologie Marine 50: 273-276. Méndez, N. y M.E. Hendrickx. 2012. Recolección y cuantificación de macrofauna de mar profundo: el caso de estudio del poliqueto Melinnampharete gracilis Hartman, 1969 (Ampharetidae). En prensa. En: P. Zamorano, M.E. Hendrickx & M. Caso (eds.). Biodiversidad y comunidades del talud continental del Pacífico mexicano. Secretaría del Medio Ambiente y Recursos Naturales (Semarnat), Instituto Nacional de Ecología (INE) Moreno-Flores, D.J. 2009. Distribución de la familia Macrouridae Gilbert y Hubbs 1916, en el sur del golfo de California. Tesis de Maestría, Maestría en Ciencias del Mar, ICML, UNAM. 74 pp. Morse, J.W. y M.J. Beazley. 2008. Organic matter in deepwater sediments of the Northern Gulf of Mexico and its relationship to the distribution of benthic organisms. Deep-Sea Research II 55: 2563-2571. Mullins, H.T., J.B. Thompson, K. McDougall y T.L. Vercoutere. 1985. Oxygen-minimum zone edge effects: evidence from the central California coastal upwelling system. Geology 13: 491-494. Orsi-Relini, L., C. Papaconstantinou, S. Jukic-Peladic, A. Souplet, L.G. de Sola, C. Piccinetti. S. Kavadas y M. Rossi. 2002. Distribution of the Mediterranean hake populations 450 Biodiversidad y comunidades del talud continental del Pacífico mexicano (Merluccius merluccius smiridus Rafinesque, 1810) (Osteichthyes: Gadiformes) based on six years monitoring by trawl-surveys: some implications for management. Pp. 21-38. En: P. Abelló, J.A. Bertrand, L.Gil de Sola, C. Papacomnstantinou, G. Relini y S. Souplet (eds.). Mediterranean marine demersal resources: The medits International Trawl Survey (1994-1999). Scientia Marina 66 (supl. 2). Palleiro-Nayar, J.S., M. L. Salgado-Rogel, M. Romero-Martínez y D. Aguilar-Montero. 2003. La pesquería del erizo rojo y erizo morado Strongylocentrotus franciscanus y Strongylocentrotus purpuratus en Baja California, México. P. 27. En: Memorias del I Foro de Intercambios sobre Recursos Bentónicos de México, 1-3 de sept. 2003, INP– CRIP La Paz, BCS. Parker, R.H. 1963. Zoogeography and ecology of some macroinvertebrates, particularly mollusks, in the Gulf of California and the continental slope off Mexico. Videnskabelige Meddelelser fra Dansk Naturhistorisk Forening 126: 1-178. Reyes-Bonilla, H., M.D. Herreo-Pérezrul, S. González-Romero, A. González-Peralta y Y. Ramírez-Hernández. 2008. Abundance of the brown sea cucumber Isosticopus fuscus at the National Park Bahia de Loreto, Mexico. Revista de Biología Tropical 56 (supl. 3): 265-271. Roe, H.S.J. y D.M. Shale. 1979. A new multiple rectangular midwater trawl (RMT 1+8M) and some modifications to the Institute of Oceanographic Sciences’ RMT 1+8. Marine Biology 50: 283-288. Rogers, A.D. 2000. The role of the oceanic oxygen minima in generating biodiversity in the deep sea. Deep-Sea Research II 47: 119-148. Román-Contreras, R. y C.B. Boyko 2007. A new genus and species of bopyrid isopod infesting the crab Munidopsis depressa (Anomura: Galatheidae) from the Gulf of California, with notes on its ecology. Journal of Crustacean Biology 27(2): 370-379. Rosenberg R., B. Hellman y B. Johansson. 1991. Hypoxic tolerance of marine benthic fauna. Marine Ecology Progress Series 79: 127-131. Salazar-Vallejo S.I. y M.H. Londoño-Mesa. 2004. Lista de especies y bibliografía de poliquetos (Polychaeta) del Pacífico Oriental Tropical. Anales del Instituto de Biología. Universidad Nacional Autónoma de México. Serie Zoología 75: 9-97. Serrano, D. 2012. La zona del mínimo de oxígeno en el Pacífico mexicano. En prensa. En: P. Zamorano, M.E. Hendrickx y M. Caso (eds.). Biodiversidad y comunidades del talud continental del Pacífico mexicano. Secretaría del Medio Ambiente y Recursos Naturales (Semarnat), Instituto Nacional de Ecología (INE). Solís-Marín, F.A., J.A. Arriaga-Ochoa, A. Laguarda-Figueras, S.C. Frontana-Uribe y A. Durán-González. 2009. Holoturoideos (Echinodermata: Holothuroidea) del Golfo D iscusión 451 de California. Comisión Nacional para el Conocimiento y Uso de la Biodiversidad e Instituto de Ciencias del Mar y Limnología, UNAM, México, D.F. 177 pp. Solís-Weiss, V. y P. Hernández-Alcántara. 1994. Amphisamytha fauchaldi: a new species of Ampharetid (Annelida: Polychaeta) from the hydrothermal vents at Guaymas Basin, Mexico. Bulletin of the Southern California Academy of Sciences 93: 127-134. Solís-Weiss, V. y B. Hilbig. 1992. Redescription of Ophryotrocha platykephale Blake (Polychaeta, Dorvilleidae) from the Guaymas Basin hydrothermal vents. Bulletin of the Southern California Academy of Sciences 91: 92-96. Sorbe J.C. 1983. Description d’un traîneau destiné à l’échantillonnage quantitatif étagé de la faune suprabenthique néritique. Annales de l´Institut océanographique, Paris 59(2): 117-126. Turrubiates-Morales, J. 2009. Registro geográfico del pepino de mar Isostichopus fuscus en Baja California Sur, México. Ciencia Pesquera 17(1): 81-82. Vázquez-Solórzano, E. y M. L. Salgado-Rogel. 2003. Industrialización de la gónada de erizo de mar en Baja California. P. 24. En: Memorias del I Foro de Intercambios sobre Recursos Bentónicos de México, 1-3 de sept. 2003, INP–CRIP La Paz, BCS. Williams, A.B. 1985. Summary comments. Bulletin of the Biological Society of Washington 6: 489-493. Winfield, I., M. Ortiz y M.E. Hendrickx. A New Deep-water Species of Epimeria (Amphipoda: Gammaridea: Epimeriidae) from the Continental Slope of Western Mexico. Journal of the Biological Association of the United Kingdom (En prensa). Zamorano, P. y M.E. Hendrickx. 2009. Análisis latitudinal y batimétrico de la comunidad de moluscos de mar profundo en el golfo de California, México. Brenesia 71-72: 4154. Zamorano, P. y M.E. Hendrickx. 2011. A comparative analysis of deep-water mollusks from both sides of the Baja California Peninsula, Mexico. Cahiers de Biologie Marine 52: 13-22. 452 Biodiversidad y comunidades del talud continental del Pacífico mexicano Síntesis curricular de los autores Dr. Hugo Aguirre Villaseñor Investigador Titular B del Instituto Nacional de la Pesca (Inapesca) en el Centro Regional de Investigación Pesquera, Mazatlán. Me gradué en la Universidad Nacional Autónoma de México, Facultad de Ciencias en 1991. Doctorado por en la Universidad Politécnica de Cataluña en el 2000. Su trabajo de tesis lo realizó en el Institut de Ciències del Mar (CSIC) en Barcelona, España. Desde 2000 ha trabajado en el Inapesca, enfocado al análisis de la dinámica de poblaciones y comunidades marinas, la determinación de indicadores de las pesquerías, con énfasis en el manejo sustentable desde un punto de vista de ecosistema, análisis estadístico multivariado, técnicas de re muestreo y la estimación de parámetros a partir de métodos no paramétricos. Otras de sus líneas de investigación se enfocan a los estudios fáusticos, de biodiversidad y la taxonomía de peces marinos de profundidad. A nivel licenciatura ha impartido cursos en la carrera de Biología en la Facultad de Ciencias, UNAM y en la Facultad de Ciencias del Mar, de la Universidad Autónoma de Sinaloa. Como profesor de posgrado ha impartido curso en Centro de Investigación en Alimentación y Desarrollo A.C., Mazatlán, en el Instituto de Ciencias del Mar y Limnología de la UNAM y Facultad de CienciasUnidad Académica Sisal, UNAM. Desde 2000 es miembro del Sistema Nacional de Investigadores, Nivel I. Ha participado como revisor de revistas indexadas y como evaluador de proyectos CONACYT. Distinciones: Sobresaliente Cum Laude otorgado por la Universidad Politécnica de Cataluña en el examen de grado de doctor 453 (6 de abril de 2000). Premio Dr. José Álvarez del Villar, otorgado por la Sociedad Ictiológica Mexicana A.C. en el VII Congreso Nacional de Ictiología, a la mejor tesis de posgrado (23 de noviembre de 2000). Dr. Samuel Enrique Gomez Noguera Realizó sus estudios profesionales (Biología) en la Facultad de Ciencias (UNAM) en el periodo de 1986 a 1989, obteniendo el grado de Biólogo en 1991. En el periodo de 1991 a 1993 realizó sus estudios de maestría en la Facultad de Ciencias (UNAM), obteniendo, en 1993 el grado de Maestro en Ciencias (Biología Animal), y durante el periodo de 1995 a 1998 cursó sus estudios de doctorado en el Limburgs Universitair Centrum (Diepenbeek, Bélgica), obteniendo el grado de Doctor de Ciencias en 1998. Desde 1998 es investigador del Instituto de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México (ICML-UNAM) en la Unidad Académica Mazatlán, y actualmente tiene la categoría de Investigador Titular “B” en la misma dependencia, y es miembro del Sistema Nacional de Investigadores (SNI-Conacyt) (Nivel II). Actualmente forma parte de padrón de tutores del Posgrado en Ciencias del Mar y Limnología del Instituto de Ciencias del Mar y Limnología de la UNAM. Sus áreas de investigación son la taxonomía, sistemática, biogeografía y ecología de copépodos harpacticoides (Crustacea: Copepoda: Harpacticoida) de sistemas marinos y salobres, taxonomía, sistemática y biogeografía de copépodos parásitos de peces e invertebrados marinos (Crustacea: Copepoda: Siphonostomatoida, Cyclopoida) y ecología de la meiofauna bentónica de sistemas marinos y salobres. Es autor o coautor de más de 50 obras científicas (artículos, memorias en extenso y capítulos de libros) publicados en revistas de circulación nacional e internacional, ha participado en 60 exposiciones en congresos tanto a nivel nacional como internacional en el área de su especialidad, y ha fungido como revisor de cerca de 60 artículos científicos publicados en revistas de circulación e impacto internacional. Actualmente forma parte de comité ejecutivo de la World Association of Copepodologist y es miembro activo de la International Association of Meiobenthologists. Dr. Michel E. Hendrickx Egresado de la Université Libre de Bruxelles, Bélgica, y de nacionalidad Belga, el Doctor M.E. Hendrickx estudio durante un poco más de dos años (1974-76) las comunidades planctónicas en el Phuket Marine Biological Center, en el sur de Tailandia. En 1977, se incorporó en el Centro de Ciencias del Mar y Limnología de 454 Biodiversidad y comunidades del talud continental del Pacífico mexicano la UNAM, en Mazatlán, México, en calidad de experto asociado de la UNESCO, a través de un proyecto UNAM/PNUD. En 1981, optó por permanecer en México e ingreso como investigador en la Estación Mazatlán del ICML donde ha permanecido desde entonces. Actualmente, es Investigador Titular “C y profesor de posgrado en la Universidad Nacional Autónoma de México, y es miembro del SNI con el nivel III. Es fundador y responsable de la Colección Regional de Invertebrados Marinos que cuenta con un acervo de 12,400 lotes con 1,860 especies. Fue Jefe de la Unidad Académica Mazatlán entre 1995 y 2000 y es editor de la serie periódica “Contribuciones al Estudio de los Crustáceos del Pacífico Este”. Además, ha participado en labores editoriales en diversas revistas nacionales e internacionales. Sus campos de especialidades incluyen la ecología, la taxonomía y la biogeografía de invertebrados marinos del Pacífico americano, en particular los crustáceos, pero también los moluscos y los equinodermos. Es autor de unas 221 contribuciones científicas en revistas y en libros y ha presentado 114 contribuciones en reuniones científicas. En total, ha descrito (solo o en colaboración) 40 especies y dos géneros nuevos. Organizó 21 cruceros oceanográficos a bordo del B/O “El Puma” de la UNAM, 20 como Jefe Científico a bordo. Fue Gobernador de The Crustacean Society (TCS) para America Latina (2004-2009), es actualmente Presidente de la Asociación Latino Americana de Carcinología (ALCARCINUS) y Oficial de Enlace entre estas dos organizaciones. Dra. María Nuria Méndez Ubach Obtuvo el título de Bióloga (1977-81), de Maestra en Ciencias (1982-86; Medalla “Gabino Barreda”) y de pasante de Doctora en Ciencias (1986-89) en la Facultad de Ciencias de la UNAM. Posteriormente, obtuvo el grado de Doctora en Biología (1990-94) en el Departamento de Ecología de la Facultad de Biología en la Universidad de Barcelona (España) con calificación de Apto Cum laude. Realizó una estancia postdoctoral (1998- 1999) en el Institute of Aquaculture de la Universidad de Stirling (Escocia) y en el Department of Life Sciences and Chemistry de la Universidad de Roskilde (Dinamarca). Sus líneas de especialidad son la sistemática de anélidos poliquetos, la ecología marina (especialmente aspectos relacionados con contaminación), la ecotoxicología con poliquetos y el cultivo y reproducción de algunas especies de poliquetos. Se incorporó al Instituto de Ciencias del Mar y Limnología de la UNAM en México D.F. como Técnica Académica (1983-1989) y, posteriormente, como Investigadora Asociada “C” (1996-2005) y Titular (20005 a la fecha) en la A utores 455 Unidad Académica Mazatlán del mismo instituto. Actualmente, es Investigadora Titular “B”, es tutora del Posgrado de Ciencias del Mar de la UNAM y es miembro del SNI nivel II.. Los principales logros son: trabajos científicos publicados (48) presentación de trabajos en congresos nacionales (26) e internacionales (46), participación en comités revisores de revistas científicas nacionales (6 trabajos) e internacionales (23 trabajos), evaluación de proyectos de investigación (8), responsable de proyectos de investigación (3), participación en otros proyectos de investigación (26), participación en campañas oceanográficas (18) y miembro del Consejo Académico de la Unidad Académica Mazatlán del Instituto de Ciencias del Mar y Limnología, UNAM (2000-01). Francisco Neptalí Morales-Serna En el año 2004 obtuvo el título de Licenciado en Biología por el Instituto Tecnológico Agropecuario de Oaxaca No. 23. Realizó sus estudios de Maestría y Doctorado en el Posgrado en Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México, U. N. A. M. En ambos casos fue becado por el Conacyt (Consejo Nacional de Ciencia y Tecnología). En la Maestría, estudió la relación entre la diversidad de copépodos bentónicos y la contaminación orgánica de un sistema lagunar, obteniendo el grado con mención honorífica en 2006. En el Doctorado, estudió la ocurrencia de copépodos parásitos en una especie de pez marino, obteniendo el grado en 2010. Desde ese mismo año y hasta la fecha, becado por la Dirección General de Asuntos del Personal Académico de la UNAM, realiza una estancia posdoctoral en el Instituto de Biología de la misma casa de estudios. Su línea de investigación se centra en la ecología y taxonomía de copépodos parásitos de peces marinos. A la fecha, entre otros trabajos, cuenta con cinco artículos científicos publicados en revistas indizadas y de circulación internacional. Su publicación más reciente es sobre la estacionalidad de los copépodos parásitos del pez botete (Sphoeroides annulatus). En otras dos publicaciones recientes se describen dos especies nuevas de copépodos parásitos. Ha participado como instructor en el curso-taller “Técnicas para la identificación de ectoparásitos de peces y evaluación de medicamentos para su control” impartido en el Centro de Investigación en Alimentación y Desarrollo, A.C. Hasta ahora, ha participado en tres congresos nacionales y cinco internacionales. 456 Biodiversidad y comunidades del talud continental del Pacífico mexicano Lic. en Biología Carolina Salas Singh Licenciada en biología por la Escuela de Biología de la Universidad Autónoma de Sinaloa con la especialidad de ecología. Actualmente cursa los estudios de Maestría en Biología Marina en el posgrado del Instituto de Ciencias del Mar y Limnología Unidad Académica Mazatlán, UNAM. Su interés se enfoca a estudios fáusticos, de biodiversidad y la taxonomía. Actualmente desarrolla la tesis sobre Taxonomía integrada, combinando estudios de taxonomía morfológica con Biología molecular, específicamente la generación de códigos de barras de ADN de esponjas marinas. Ha participado en campañas oceanográficas como el TALUD XII. Ha colaborado en la elaboración de dos manuscritos de peces marinos de profundidad, uno aceptado y el otro sometido en revistas indexadas. Ha realizado estudios de fecundidad de peces marinos, estimando tamaño y número de huevos a partir de análisis de imágenes. Dr. David Ernesto Serrano Hernández Es Licenciado en Oceanografía (1990) por la Facultad de Ciencias Marinas de la Universidad Autónoma de Baja California (FACM-UABC). Maestro en Ciencias (1994) en Oceanografía Física por el Centro de Investigación Científica y Educación Superior de Ensenada (CICESE) y cuneta con Doctorado en Ciencias (2004) por el Instituto de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México (ICML-UNAM). Actualmente se desempeña como Investigador Titular “C” y Profesor de Tiempo Completo en la Facultad de Ciencias del Mar de la Universidad Autónoma de Sinaloa (FACIMAR-UAS). Sus principales líneas de investigación son la modelación hidrodinámica costera, los análisis de datos oceanográficos y ha incursionado en la oceanografía física de aguas profundas del Pacífico mexicano con especial énfasis en la zona de mínimo oxígeno. Cuenta con 12 contribuciones en revistas científicas nacionales e internacionales y 11 participaciones en congresos. Es candidato al Sistema Nacional de Investigadores. M. en C. Pablo Zamorano de Haro Licenciado en Biología Marina por la Universidad del Mar (UMAR), y maestro en Ciencias del Mar y Limnología titulado con mención honorífica por el Instituto de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México, Unidad Académica Mazatlán (ICML-UNAM). Cuenta con tres especialidades: una en manejo integral de zona costera por el Centro de Estudios Universitarios de la Costa Sur de Jalisco, Universidad de Guadalajara (CUCSUR-U de G), la segunda en A utores 457 derecho y gestión ambiental por el Centro de Estudios Jurídicos Ambientales (CEJA, A.C.) y la tercera en peritaje y criminalística ambiental y los recursos naturales por el Instituto de Formación Académica del Centro y Sureste S.C. (INFA). Realizó estancias profesionales en PEMEX-Refinación, en la Universidad Autónoma de Baja California y en el Acuario de Veracruz. Ha sido guardaparque en el Parque Nacional Isla Contoy; profesor en la Universidad Autónoma de Baja California Sur y diversos diplomados en conservación de ecosistemas y vida silvestre; asesor pesquero en Loreto, B.C.S. para la organización no gubernamental estadounidense RARE Conservation; asesor independiente para la Comisión Nacional de Áreas Naturales Protegidas (Conanp-Semarnat); coordinador de investigación y monitoreo en la Reserva de la Biosfera Sian Ka’an, Reserva de la Biosfera Arrecifes de Sian Ka’an y Área de Protección de Flora y Fauna Uaymil de la CONANP. Actualmente es Jefe del Departamento de Ecología de Comunidades en el Instituto Nacional de Ecología (INE-Semarnat). Sus campos de especialidades incluyen ecología, taxonomía y biogeografía de invertebrados marinos, en particular moluscos y equinodermos además de aves y pesquerías. Gusta del buceo científico y el trabajo con comunidades humanas para lo cual ha tomado diversos cursos. Trabaja conservación y manejo sustentable de recursos naturales, ecosistemas y comunidades, tanto marinas como acuáticas y terrestres. Es autor de unas 20 contribuciones científicas en revistas y en libros y ha presentado cerca de 20 contribuciones en reuniones académicas y foros de difusión. Ha participado como revisor y evaluador de proyectos CONACYT y Vida Silvestre sin Fronteras del USFWS. Cuenta con mención honorífica a la tesis de licenciatura en la IX Reunión de Malacología y Conquiliología y mejor tesis de posgrado en la X Reunión de Malacología y Conquiliología, ambas distinciones otorgadas por la Sociedad Mexicana de Malacología, A.C. 458 Biodiversidad y comunidades del talud continental del Pacífico mexicano Índice analítico A abisales 24 abundancia 229, 231, 236, 238, 239, 240, 379, 380 Acharacidae 251 Achelata 284, 294 Acteonidae 266 adaptaciones 37 Agassiz 36 Agassiz, Alexander 26 Agassiz, draga 65, 72, 74 Albatross 26, 35, 82, 244 alimentación de depósito 208 alimento 126, 127, 130, 132 Alvin 30, 31, 36 Alvinocarididae 300, 303 Amage 169, 175, 191 Ameiridae 133 Ampharetidae 169, 175, 196, 197, 206, 207, 226 Amphiuridae 391 anélidos 127 anfarétidos 226, 227, 236 Anomura 284, 286, 295, 297, 299, 303 anóxica 37, 40, 85 Antedonidae 388 Anton Bruun 364 Aplacophora 243, 248 Apodida 394 Arachnoidinae 393 Architectonicidae 267 arenas 136 Argestidae 133 arrastre 24, 26, 39, 41, 63, 64, 65, 69, 71, 74, 88, 225, 227, 228, 229, 230, 237, 238 Aspidochirotida 394 Astacidea 283, 286, 295, 303 Asteriidae 390 Asteroidea 373, 376, 380, 381 459 Asteronychidae 390 Asteroschematidae 390 Astropectinidae 388 Atelecyclidae 300 Atlántico, océano 125 AUV (Autonomous Underwater Vehicle) 32 Axiidea 283, 286, 292, 294, 304 B Baja California 26, 27, 36, 63, 72, 82 barrera fisiológica 37 barrera (geográfica) 381 barreras físicas 245 batiales 24, 40 batiscafo 28 Ben Franklin 30, 31 Benthopectinidae 388 bentónica, comunidades 42 bentónica, fauna 38, 40, 44, 65, 68 bentopelágico 290, 302 BIOCAPESS 42 biomasa 124, 126, 130 Bivalvia 243, 251 Bomolochidae 147, 148 boreal 380 Brachyura 284, 286, 300 Brissidae 393 Brissopsinae 393 Buccinidae 268 460 C cabestrantes 41 cadenas tróficas 85, 87, 123, 289, 297 Calappidae 300 California 285, 290, 297, 299, 300, 302, 303 Caligidae 147, 148, 150 Callianopsidae 294 Calypso 30 camarones 36, 39, 71, 82, 283, 286, 287, 289, 292, 300, 304 camarones fantasmas 292 cangrejos 36, 82, 283, 295, 299, 300, 304 Canthocamptidae 133 caparazón 283, 289 Capitellidae 208 carbono orgánico 127, 132 Caridea 283, 284, 286, 287, 289, 300, 303, 304 carideos 287, 289, 303 CEEMEX 42, 73 centollas 295 Cephalaspidea 266 Cephalopoda 244 Cerviniidae 133, 136 Chaetopteridae 208 Chile 35, 37 Chimaeridae 399 Chimaeriformes 399 Chondracanthidae 150, 152 Chondrichthyes 399 Ciclo de vida 150 Cidaridae 392 circulación termohalina 107 Biodiversidad y comunidades del talud continental del Pacífico mexicano Cirratulidae 175, 196, 207 clasper cefálico 400 clave de identificación 322, 323, 334, 336 cletodes 136 Cletodidae 133 Clypeasteridae 393 colecciones 87, 88, 285 Columbellidae 267 columna de agua 24, 32, 38, 39, 40, 44, 68, 85 comátulas 376 comunidades 24, 27, 33, 38, 39, 40, 42, 64, 86, 88, 207, 209, 210, 211, 212 concentración 68, 71, 85, 86 consumidores de depósito 162, 207, 213 copépodos 40, 124, 127, 128, 129, 130, 132, 133, 138 copépodos parásitos 145, 147 correlación 168, 169, 196, 206, 211, 212, 213, 230, 235, 239 correspondencia canónica 128 corriente de California 290, 297, 300, 302, 303, 376, 377, 378, 379, 381 CORTES 42, 71 Coryphaenoides capito 416 costa SO de México 37, 65 Crangonidae 290, 292, 320, 321, 322, 323, 334, 345, 348, 349 Crinoidea 373, 376, 380, 381 crustáceos 36, 40, 85, 86 crustáceos decápodos 283, 284, 285, 286, 287, 289, 294, 295, 299, 302, 303, 304 CTD (Conductivity-Temperature-Density) 39, 246 Ctenocidaridae 392 Ctenodiscidae 388 Cucumariidae 394 cuenca 26, 64, 74 Cuspidariidae 252 Cyana 30, 31 D Dactylochirotida 394 degradación bacteriana 130 Deimatidae 394 Dendrobranchiata 283, 286, 287, 289 Dendrochirotida 394 Denise 30 densidad 107, 108, 117, 125, 126, 127, 128, 129, 130, 133, 136, 138, 167, 168, 196, 214, 226, 228, 229, 230, 231, 235, 236, 237, 238, 239, 240 Dentaliida 270 Dentallidae 270 detritívora 123, 162, 208, 213 diagrama T-S 114, 117 Diosaccidae 133 distribución 211, 212, 213, 214 distribución batimétrica 68, 380 diversidad 125, 127, 129, 133, 136, 164, 168, 196, 197, 206, 210, 211, 212, 214, 245 diversidad de formas 136 doctorado 82 Í ndice analítico 461 dominancia 126, 127, 128, 168, 196, 197, 207, 213, 228 draga 25, 34, 36, 41, 63, 65, 68, 69, 70, 72, 74 dragados 41 draga tipo Karling. Véase Karling, draga estrellas de mar 36, 373, 376 estrellas quebradizas 373, 377 estudiante 74, 89 Ethusidae 300 eufótica, zona 126, 130 expediciones 24, 26, 27, 31, 35, 36, 87 E F Echinasteridae 389 Echinodermata 373, 374, 376 Echinoidea 373, 379, 380, 381 Echinothuriidae 393 Echinothurioida 393 ecología de moluscos 244 ecosistema 125 ecosonda 65 Ectinosomatidae 133 eficiencia 229, 236, 239 Elpidiidae 394 El Puma 27, 40, 42, 43, 68, 72, 74, 75, 89 El Salvador 37 endémicas 300 endofauna 247 epifauna 63, 69, 136, 197, 206, 207, 208, 209, 210, 211, 212, 214, 247 equinodermos 40, 84, 373, 374, 375, 376, 378, 379, 380, 381 equipo 25, 26, 29, 30, 32, 34, 41, 44, 63, 65, 68, 69, 71, 72, 74, 79, 87 Ergasilidae 150 erizos de mar 36, 373, 374, 379 ermitaños, cangrejos 295, 299 Escaphopoda 243 familia 197, 207, 208, 211, 213 fauna profunda 26, 35, 63 filogenia 295 filtradores 162 fitodetritos 127 Flabelligeridae 208 fondos blandos 300 foraminíferos 124, 127 frecuencia 128, 168, 196, 197, 228, 230, 231, 237, 240 462 G Gadilidae 273 Galatheoidea 284, 297, 305 Gastropoda 244, 266 Gebiidea 284, 292, 304 Glomar Challenger 33 Glyceridae 169 Glypheidea 283 Glyphocrangonidae 292, 320, 321, 332, 334, 337, 345 golfo de California 26, 27, 34, 35, 36, 37, 163, 164, 165, 169, 226, 227, 245 Biodiversidad y comunidades del talud continental del Pacífico mexicano Goniasteridae 389 gradiente 212, 214 granulometría 136, 167, 213 GUAYTEC 42 Isaacs Kidd 65 islas 246 K H hábitat 39, 82, 85, 87 Hancock, Allan 26, 36 harpacticoides 127, 136 Harvard Museum de la Universidad de Harvard 87 hidrocalas 38, 41, 65 hipoxia 106, 110, 114, 117 hipóxica 37, 40 hipóxico 86 hipóxico, hidropóxica 37 Hippolytidae 290 H.M.S “Challenger” 24 Holasteroida 393 Holothuroidea 373, 379, 380, 381 Homolidae 300 I Idyanthidae 133 indicadores 40, 85 Índico, océano 125 infauna 161, 162, 165, 166, 168, 169 interacción océano-atmósfera 107 intervalo de profundidad 378, 379 intervalos latitudinales y batimétricos 248 investigador, investigadores 30, 36 Kamptosomatidae 393 Karling 69, 70, 229 Karling, draga 64, 65, 165, 169, 196, 209, 228, 230, 231, 235, 236, 237, 238, 239, 240, 246 king crabs 295 Korethrasteridae 389 L Labidiasteridae 390 laboratorio 25, 41, 42, 65, 79, 88 Laboratorio de Invertebrados Bentónicos 247 Laetmogonidae 394 langostas 283, 292, 294, 295, 304 langostinos 283, 304 Lasaeidae 258 Lernaeidae 150 Lernaeopodidae 147, 148, 150, 152 Lernanthropidae 150 licenciatura 74, 82 Limidae 264 Limoida 264 Limopsidae 265 limos 133, 136 lirios de mar 373, 376 Lithodidae 295, 297 Lucinacae 256 Luidiidae 388 Í ndice analítico 463 Lumbrineridae 169, 196 Mytilidae 259 Mytiloida 259 Myxasteridae 389 M macrobentos 123, 124 macrocrustáceos 36 macrofauna 39, 69, 85, 124, 226, 229, 239, 240 Macrouridae 411 maestría 82 Maldanidae 169, 175, 196, 197 malla 71, 74 Malletiidae 260 Maretiidae 393 masa de agua 107, 109, 114 materia orgánica 33, 71, 126, 127, 162, 164, 167, 168, 169, 246 Mediterráneo, mar 125, 126, 129 meiofauna 40, 69, 71, 86, 124, 125, 126 Mexamage 175, 191, 196 microbentos 123, 124 micronecton 65, 71 mínimo de oxígeno 37 Miraciidae 133, 134 Molpadiida 395 Molpadiidae 395 moluscos 36, 38, 40, 82, 86, 243 moluscos bentónicos 247 monografías 35 Monoplacophora 243 Munida 289, 297, 299, 308 Munididae 297 Munidopsidae 299, 303 Museum of Comparative Zoology 35 464 N Neilonellidae 260 Nematocarcinidae 289 Nematoda 125, 126 Neobradyidae 133, 134 Neomeniida 248 Neomeniidae 248 Nephropidae 295 Nereididae 169, 196, 208 nucleador 27, 36, 39, 65, 69, 71 nucleador de caja Reineck 229, 230, 231, 236, 237, 238 Nuculanidae 261 Nuculidae 262 Nuculoida 260 número de especies 164, 168, 196, 197, 206, 209, 211, 212, 213 O ofiuras 36 omnívoros 162 Onuphidae 208 Opheliidae 163, 169 Ophiacanthidae 391 Ophiacanthinae 391 Ophiactidae 392 Ophiochitonidae 392 Ophiolepididae 392 Biodiversidad y comunidades del talud continental del Pacífico mexicano Ophioleucinae 392 Ophionereidae 392 Ophioplinthacinae 391 Ophiotominae 391 Ophiotrichidae 392 Ophiuridae 392 Ophiurinae 392 Ophiuroidea 373, 375, 377, 380, 381 Oplophoridae 289 Orbiniidae 208 Oreasteridae 389 Oregon 297 ovovivíparas 400 oxígeno 164, 165, 168, 169, 196, 197, 206, 210, 211, 212, 214 oxígeno disuelto 39, 40, 63, 65, 68, 85, 86 oxígeno disuelto epibentónico 246 P Pacífico, océano 125, 133 Pandalidae 290, 303 Paramesochridae 133 parámetro 34, 40, 65, 71 Parapaguridae 299 parches 226, 237 Pasiphaea 39 Pasiphaeidae 289 Patellogastropoda 268 peces 26, 33, 36, 40, 85, 86 Pectinidae 258 pelágica, fauna 38, 42, 65, 68, 71 pelágica, red 71 pelágicas, especies 86 pepinos de mar 36, 373, 379 perfiles 38, 65, 68 Periplomatidae 253 Perú 37, 39 Pesca, Comisión de 26 pesquerías 38 Philinidae 267 plataforma continental 23, 33, 36, 38, 42, 63, 73, 86, 245 Poecilostomatoida 152 Poliplacophora 243 poliquetos 36, 40, 82, 85 Polychelidae 357, 358, 359, 361, 366, 367, 368 Poromyidae 254 potencial pesquero 290 predador 123 presión 126, 130 presupuesto 75 producción primaria 33 publicaciones 26, 27 Q quimera prieta 399 quimeras 399 R recursos pesqueros 36, 38 red camaronera 65 redes 25, 32, 34, 38, 39, 63, 71, 74 REMUS (Remote Environmental Monitoring Units) 32 Í ndice analítico 465 Rhabdidae 272 riqueza 286, 294, 300 riqueza específica 126, 128 ROPOS (Remotely Operated Platform for Ocean Science) 32 Rosette, estructura 68, 69 S Scaphopoda 270 Scripps 27, 36, 87 sedimento 25, 27, 33, 39, 40, 65, 68, 69, 71, 226, 227, 228, 229, 230, 235, 236, 237, 238, 239, 240, 246 sensor 39, 68 Sereptidae 264 Sicyonia 287 SIPCO 42, 71 Siphonostomatoida 149, 152 Smith-McIntyre, draga 68 Solemyoida 251 Spearman, correlación de 128 Sphyriidae 153 Stenopodidea 283, 286, 287 Stylodactylidae 289 submarino 28, 30, 32, 36 sustrato 123, 124, 129 T Taeniacanthidae 150 466 talud continental 37, 44, 63 tamiz 71 Teredinidae 266 Thraciidae 254 Thyasiridae 256 tiempo de residencia 106, 117 Tisbidae 133, 134 tolerancia 127 topografía 245 topografía del fondo 126, 130 Trieste 28, 29 trineo bentónico 27, 39, 64, 65, 69, 74, 228, 229, 230, 231, 235, 236, 237, 238, 239, 240, 246 trineos 34 Trochidae 268 tubos 226, 227, 228, 229, 231, 236, 237 V varianza 128 Velero 26, 27, 36 Veneroida 256 ventilas hidrotermales 284, 300 Verticordiidae 255 Vesicomyidae 257 Z ZEE (Zona Económica Exclusiva) 33 zona abisal 127 zona batial 133 zona del mínimo de oxígeno 106, 245 zooplancton 71 Zosimidae 133 Biodiversidad y comunidades del talud continental del Pacífico mexicano Biodiversidad y comunidades del talud continental del Pacífico mexicano, editado por Pablo Zamorano, Michel E. Hendrickx y Margarita Caso, se editó en formato electrónico en el Instituto Nacional de Ecología durante el mes de octubre de 2012.