una hebra de ARN es transformada en ADN complementario (ADNc
Anuncio

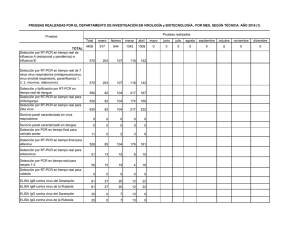
una hebra de ARN es transformada en ADN complementario (ADNc) usando una enzima transcriptasa reversa y el resultado, se amplifica en un PCR tradicional. Para la detección del VPRRS se han desarrollado varios métodos como la RT-PCR convencional, RT-PCR anidada y RT-PCR tiempo real. Existen protocolos RT-PCR universales que detectan tanto el genotipo 1 (Europeo) como el genotipo 2 (Americano) y RT-PCR específico para cada genotipo. Sin embargo, la tendencia mundial es hacia el uso de la RT-PCR en tiempo real ya que disminuye los riesgos de contaminación del producto final, el proceso es más rápido, tiene mayor sensibilidad y permite realizar mediciones cuantitativas de genes específicos en la muestra analizada. En los resultados de la técnica RT-PCR en tiempo real cuantitativa (RT-qPCR) se reporta el valor Ct del inglés cycle threshol, cuya traducción es ciclo umbral de la muestra o en otras palabras, el primer ciclo de la PCR en el que se detecta producto amplificado. El Ct es inversamente proporcional a la cantidad de ácido nucleico de partida presente en la muestra y se utiliza como punto de corte positivo o negativo de acuerdo con el umbral establecido por cada laboratorio durante la validación de la prueba. Los marcos abiertos de lectura ORF6 y ORF7 son los segmentos genómicos más conservados del VPRRS, estos se emplean como diana en los test diagnósticos basados en RT-PCR ya que permiten una detección más amplia de las diferentes variantes virales. Por su parte, el ORF5 se ubica en la superficie viral y sufre mayor presión de selección lo que lo hace altamente variable. Por esta razón, es el fragmento utilizado para evaluar la variabilidad genética de las poblaciones virales y establecer relaciones filogenéticas entre ellas. El uso de pool de muestras para la detección del virus es una práctica común para disminuir los costos. Para la detección del VPRRS por RT-PCR tiempo real se puede analizar pools de suero (máximo cinco animales) y fluido oral (máximo 20-25 animales). Se debe combinar muestras de porcinos de una misma edad, lote o grupo de producción 26 Enero-Febrero • 2013 • pero debe tenerse en cuenta que la carga viral y el número de muestras negativas dentro de un pool puede afectar la dilución de una muestra positiva y generar falsos negativos. Consideraciones generales para la realización e interpretación de estas pruebas: • El diagnóstico por pruebas RT-PCR puede realizarse en muestras de suero, tejidos (ganglios linfáticos, tonsila, pulmón), fluidos orales y macrófagos alveolares. • Para la prueba RT-qPCR se puede enviar al laboratorio pool de cinco sueros por grupo de edad. Es preferible enviar por separado el suero de cada animal para organizar los pooles en cantidades equivalentes. • Las muestras para pruebas RT-qPCR deben enviarse en condiciones de refrigeración. • Por medio de la técnica RT-qPCR se puede obtener evidencia de infección viral a las 24 - 48 horas postinfección. • Un resultado negativo en suero no descarta infección por el VPPRS ya que en el momento de colectar la muestra puede haber desaparecido la viremia.