Aplicación del 15 N en el estudio del ciclo del N en los ecosistemas
Anuncio
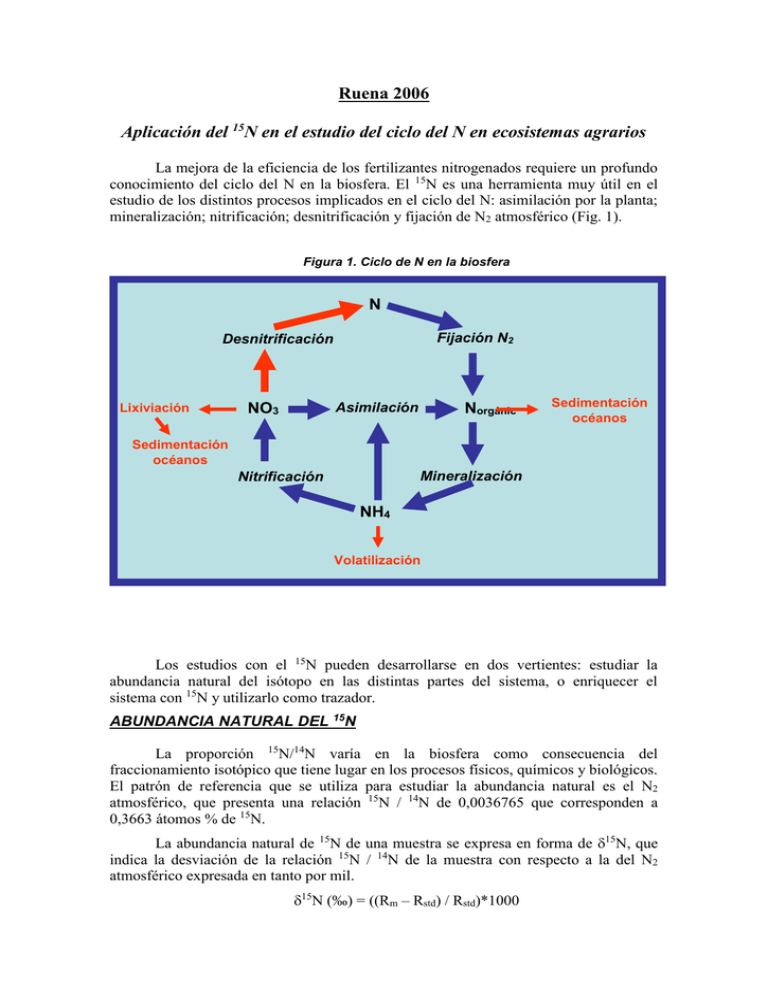
Ruena 2006 Aplicación del 15N en el estudio del ciclo del N en ecosistemas agrarios La mejora de la eficiencia de los fertilizantes nitrogenados requiere un profundo conocimiento del ciclo del N en la biosfera. El 15N es una herramienta muy útil en el estudio de los distintos procesos implicados en el ciclo del N: asimilación por la planta; mineralización; nitrificación; desnitrificación y fijación de N2 atmosférico (Fig. 1). Figura 1. Ciclo de N en la biosfera N 2 Fijación N2 Desnitrificación Lixiviación Asimilación NO3 Norgánic - o Sedimentación océanos Sedimentación océanos Mineralización Nitrificación NH4 + Volatilización Los estudios con el 15N pueden desarrollarse en dos vertientes: estudiar la abundancia natural del isótopo en las distintas partes del sistema, o enriquecer el sistema con 15N y utilizarlo como trazador. ABUNDANCIA NATURAL DEL 15N La proporción 15N/14N varía en la biosfera como consecuencia del fraccionamiento isotópico que tiene lugar en los procesos físicos, químicos y biológicos. El patrón de referencia que se utiliza para estudiar la abundancia natural es el N2 atmosférico, que presenta una relación 15N / 14N de 0,0036765 que corresponden a 0,3663 átomos % de 15N. La abundancia natural de 15N de una muestra se expresa en forma de 15N, que indica la desviación de la relación 15N / 14N de la muestra con respecto a la del N2 atmosférico expresada en tanto por mil. 15N (‰) = ((Rm – Rstd) / Rstd)*1000 donde Rm = 15N / 14N de la muestra y Rstd = 15N / 14N del patrón La discriminación isotópica y la consiguiente variación de la relación 15N / 14N que se produce en los procesos químicos y biológicos puede ser debida a un efecto isotópico sobre el equilibrio del proceso o sobre la cinética del mismo. Ello se debe a que, en general, los isótopos pesados requieren una mayor energía de activación para disociarse y además reaccionan más lentamente. Por ejemplo, en el equilibrio: NH4+ ↔ NH3 + H+ el NH4+ está enriquecido en 15N con respecto a el NH3 en aproximadamente un 2% Ello hace que la volatilización del NH3 enriquezca en 15N el NH4+ residual que queda en el suelo. Esta es una de las causas de que el suelo esté enriquecido en 15N con respecto al N2 atmosférico. Los métodos basados en la abundancia natural presentan bastantes dificultades debido a que las diferencias son pequeñas y, por tanto, requieren una alta precisión analítica y además son difíciles de interpretar, debido a la complejidad de los procesos del suelo. La aplicación más extendida de la abundancia natural es la estimación de la fijación de N2, sobre todo en los ecosistemas naturales, ya que es una técnica que no implica una excesiva manipulación del ecosistema. En los ecosistemas agrícolas están más extendidas las técnicas basadas en el enriquecimiento con 15N. ENRIQUECIMIENTO EN 15N Las técnicas basadas en la utilización del 15N como trazador han sido utilizadas para estudiar los distintos procesos implicados en el ciclo del N en la biosfera (Fig. 1), tanto en ecosistemas naturales como agrarios. Aquí vamos a revisar la aplicación de estas técnicas al estudio de la fijación de N2, la nitrificación, la desnitrificación y la mineralización, ya que su aplicación para el estudio de la asimilación del N por la planta se trata en otras ponencias. Fijación de N2 La fijación de N2 es un proceso que aporta anualmente alrededor de 270 millones de toneladas de N a la biosfera. De ellas 30 millones proceden de la fijación en procesos atmosféricos; 70 millones proceden de la fijación industrial para la fabricación de fertilizantes y 170 millones proceden de la fijación biológica por distintos tipos de bacterias simbióticas y de vida libre. Desde el punto de vista cuantitativo destacan la fijación de N2 por la simbiosis de las leguminosas con distintas bacterias Rhizobiaceas y la fijación de N2 por las cianobacterias de vida libre. La capacidad de fijar N2 que tienen estas bacterias se debe a la presencia del enzima nitrogenasa, que cataliza la reducción del N2 a NH3, el cual se incorpora posteriormente a la materia orgánica. Hay varios métodos isotópicos para medir la fijación de N2: Medidas integradas del ciclo de cultivo • Dilución del 15N aplicado • Abundancia natural de 15N Medidas puntuales • Reducción de 15N2 Métodos de dilución de 15N y abundancia natural Los métodos de dilución del 15N y de abundancia natural se basan en el mismo principio: comparar el contenido en 15N de una planta fijadora de N2 con el de una planta no fijadora. Dado que el suelo está normalmente más enriquecido en 15N que la atmósfera, la planta no fijadora tendrá mayor proporción de 15N que la fijadora ya que el N de esta última procederá tanto del suelo como de la atmósfera, mientras que el de la primera procederá exclusivamente del suelo. La diferencia entre los dos métodos es que en el de dilución se añade fertilizante marcado al suelo para aumentar el porcentaje de 15N del mismo, mientras que en el de la abundancia natural no se enriquece el suelo con 15N. El método de abundancia natural es sólo aplicable si el 15N del suelo es suficientemente grande como para que las pequeñas diferencias registradas se puedan medir con precisión. Por lo demás la metodología y los cálculos son similares en ambos métodos. El porcentaje de N en planta procedente de la fijación (%Ndfa) sería para el método de dilución: (% átomos 15N en exceso)fijadora %Ndfa = 1 - ------------------------------------------*100 (% átomos 15N en exceso)no fijadora En el método de abundancia habría que sustituir los % átomos 15N en exceso de la fórmula anterior, por los correspondientes valores de 15N. En el método de dilución puede también calcularse el porcentaje de N en planta procedente del fertilizante (%Ndff): % exceso 15N en planta %Ndff = --------------------------------- x 100 % exceso 15N en fertilizante Y el procedente del suelo (Ndfs): %Ndfs = 100 – (%Ndfa + %Ndff) La ventaja del método es que con una simple medida del 15N se puede conocer en porcentaje el origen del N incorporado por la planta a lo largo de todo el ciclo de cultivo. Si se conoce además el contenido en N total de la planta, se puede calcular la cantidad de N que procede de la fijación: %Ndfa x Ntotal en planta (kg ha-1) N fijado (kg ha-1) = -----------------------------------------100 En el método de dilución es conveniente añadir poca cantidad de N ya que el N combinado inhibe el desarrollo de los nódulos y la fijación de N2. En general se suele añadir una cantidad de 5 a 10 kg N ha-1 enriquecidos un 5 – 10 %. Es igualmente fundamental que el isótopo quede uniformemente distribuido en el suelo, por ello suele aplicarse en forma líquida con pulverizador. Pero lo más importante para que el método resulte fiable es la correcta selección de la planta no fijadora que sirve como referencia. La planta de referencia debe cumplir varios requisitos: • No debe fijar N2 • Las raíces de las dos plantas deben utilizar una misma zona de suelo e incorporar las mismas fracciones de fertilizante marcado y N del suelo • Su ciclo de crecimiento debe ser similar al de la planta fijadora • Ambos cultivos deben verse afectados de forma similar por las condiciones ambientales • La distribución del 15N entre raíces y parte aérea debe ser similar Para las leguminosas de grano se han usado como referencia: gramíneas como el trigo y la cebada, estirpes no nodulantes de leguminosas e inclusive la propia leguminosa no inoculada, si en los suelos no están presentes las estirpes adecuadas de Rhizobium. Para las leguminosas forrajeras la referencia más usual es Lolium perenne L. Método de reducción de 15N2 El método consiste en poner al material en estudio (cultivo de bacterias; suelo; planta entera; raíces etc) a una atmósfera enriquecida con 15N2 y después analizar el 15N incorporado por el material. El N fijado (%Ndfa) se calcula según la expresión: % exceso 15N en muestra %Ndfa = -------------------------------- x 100 % exceso 15N atmósfera Este método es el más directo para medir fijación de N2 y no requiere de planta de referencia. Sin embargo y salvo casos excepcionales no es susceptible de utilización “in situ” en el campo. La complejidad del método depende del sistema que se quiere estudiar. Si se trata de cultivos bacterianos, muestras de suelo, nódulos o raíces escindidas el sistema es fácil y cualquier recipiente hermético puede servir para realizar los ensayos. Sin embargo, si el sistema incluye la planta entera la complejidad aumenta ya que hay que diseñar un sistema hermético para las raíces de la planta o para toda la planta. La reducción de 15N2 suele aplicarse para calibrar el método de reducción de acetileno, que es un método no isotópico de medida puntual e indirecta de la fijación de N2. El método de reducción de acetileno es el más utilizado para medir fijación de N2, pero requiere calibrarse para poder conocer la relación molar acetileno reducido / N fijado. Nitrificación La nitrificación es el proceso de oxidación de amonio a nitrato. Tiene lugar por la acción secuencial de dos bacterias aerobias de los géneros Nitrosomonas y Nitrobacter : Nitrosomonas Nitrobacter NH4 -----------------------> NO2 ------------------->NO3+ Al ser bacterias aerobias, la nitrificación depende de la presencia de oxígeno en el suelo. La cuantificación de la nitrificación es compleja debido a que el NO3- puede ser movilizado, transformado o reciclado rápidamente en el suelo (Fig.2). Figura 2.Nitrificación y movilización de NO3- en el suelo. Mineralización Reducción no asimiladora NH4+ NO3- Inmovilización Desnitrificación Lixiviación El método isotópico para medir la nitrificación es el de dilución del 15NO3- y consiste en añadir al suelo 15NO3- y 14NH4+. La oxidación de este último dará lugar a la formación de 14NO3- con lo que el % de 15NO3- ira disminuyendo a medida que el 14 NH4+ se vaya oxidando y formando 14NO3- (Figura 3). El método isotópico para estudiar la nitrificación requiere: • Parcelas aisladas o ensayos de laboratorio para evitar pérdidas por escorrentía y lixiviación • Tiempos de incubación breves para evitar el reciclaje del NO3- • Distribución homogénea del 15NO3- con el nitrato del suelo • Los procesos de movilización y transformación del nitrato deben afectar de forma similar al nitrato marcado y al nitrato del suelo En estas condiciones la tasa de nitrificación bruta se puede calcular según la expresión: ((NTf – NTi) / t) * log (15Ni*NTf / 15Nf*NTi) Nitrificación = -----------------------------------------------------log (NTf / NTi) donde NT = nitrato total ; 15N = nitrato marcado y t = tiempo de incubación Figura 3. Esquema del método de dilución del 15 NO3- para la medida de la nitrificación 14 NH4+ 14 NH4+ 14NO 3 - Nitrificación T0 (Inicio) Pérdidas Nitrificación 15NO 3 - Tf (final) 14NO 3 - Pérdidas 15NO 3 - Desnitrificación La desnitrificación es el proceso de reducción del NO3- a N2. Tiene lugar en varias etapas: 2NO3- -------> 2NO2- ------> 2(NO) -------> N2O --------> N2 Todas las enzimas reductivas implicadas en el proceso son reprimidas por el O2, en particular la N2O reductasa. Por ello el proceso tiene lugar en condiciones anaerobias o en presencia de bajas concentraciones de oxígeno. En este último caso, se libera más N2O que en condiciones anaerobias. El proceso también depende de la concentración de NO3- y de la presencia de C orgánico. El método isotópico para medir la desnitrificación consiste en añadir 15NO3- al suelo y se mide el (15N2 + 15N2O) que se acumula en una cámara cerrada (Fig. 4). Si se añade 15NH4+ en vez de 15NO3- se puede conocer el acoplamiento entre nitrificación y desnitrificación. Figura 4. Cámara de incubación para medida de la desnitrificación N2 15NO 3 N2 El O2, el CO2 y el CO del aire deben eliminarse de las muestras antes de introducirlas en el espectrómetro ya que pueden dar lugar a compuestos con masas 28, 29 y 30, que interfieren en la medida isotópica del N2. El N2O liberado en la desnitrificación se reduce a N2 durante el proceso de eliminación de los contaminantes. Por lo tanto lo que se mide es el conjunto (N2 + N2O). Las ecuaciones utilizadas para calcular la emisión de N gas, a partir de las medidas de las relaciones isotópicas en las muestras de gas, por espectrometría de masas, son las siguientes: 1. r = (29N2/28N2) m - (29N2/28N2) r 2. r' = (30N2/28N2) m - (30N2/28N2) r m : muestra de gas recogida al tiempo t después de cerrar la cámara; r : muestra de gas recogida inmediatamente después de cerrar la cámara, t0; 29/28 y 30/28 : relaciones isotópicas determinadas por el espectrómetro de masas; 3.15XN: fracción molar de 15N en el conjunto de NO3- (sustrato de la desnitrificación) del suelo = 2(r'/r)/(1+(2(r'/r))) 4. d: fracción de N total gas, en la cámara de recolección, atribuible a la desnitrificación = r'/(15XN)2 5. C: gramos de N gas total liberado desde el suelo, en la cámara = g N2 total en la cámara d = 4,468 d 6. Flujo de N2 = C/(At) C = (g N2 total en la cámara d)t1 - (g N2 total en la cámara d)t0, cambio en la cantidad de 30N2 y 29N2 en la cámara durante el tiempo t; A: área de la superficie del suelo, cubierta por la cámara de incubación t: t1 - t0, tiempo de incubación, h. Mineralización La mineralización es el proceso de liberación de amonio a partir de la descomposición de la materia orgánica. La cuantificación de la nitrificación es compleja dadas las posibles transformaciones que puede sufrir el amonio en el suelo (nitrificación, volatilización, etc). El método isotópico para medir la mineralización es el de dilución del 15NH4+ y consiste en añadir 15NH4+ al suelo. El isótopo se irá diluyendo a medida que la materia orgánica no marcada se vaya descomponiendo y mineralizando (Fig. 5). Figura 5. Esquema del método de dilución del 14N org NO3- para la medida de la nitrificación 14 14 Norg NH4+ Mineralización 14 Pérdidas 15 T0 (Inicio) 15 NH4 NH4+ Mineralización Pérdidas + Tf (final) 15 NH4+ El método isotópico para estudiar la mineralización requiere: • Que no haya discriminación entre el 14N y el 15N en los procesos que implican pérdidas de amonio. • El amonio marcado que se añade debe estar homogéneamente mezclado con el amonio del suelo. • El N marcado inmovilizado durante el periodo experimental no debe remineralizarse. En estas condiciones la tasa de mineralización se puede calcular según la expresión: ((ATf- ATi) / t)* log (15Ai*ATf / 15Af*ATi) M = ---------------------------------------------------------log (ATf/ATi) donde AT = Amonio total; 15A = Amonio marcado y t = tiempo de incubación Bibliografía Carrasco D, Fernández Valiente E, Ariosa Y, Quesada A. (2004) Measurement of coupled nitrification – denitrification in paddy fields affected by Terrazole, a nitrification inhibitor. Biol. Fertil. Soils 39: 186 – 192 Chen DL, Chalk PM, Freney JR, Smith CJ y Luo QX (1995) Estimation of nitrification rates in flooded Soils. Microb. Ecol. 30: 269 – 284 Fernández Valiente E, Ucha A, Quesada A, Leganés F, y Carreres R. 2000. Contribution of N2 fixing cyanobacteria to rice production: availability of nitrogen from 15N-labelled cyanobacteria and ammonium sulphate to rice. Plant Soil. 221:109-114 Hauck RD y Weaver RW. (1986) Field measurement of dinitrogen fixation and denitrification. Soil Science Society of America Inc. Madison, Wisconsin, USA Högberg P (1997) 15N natural abundance in soil – plant systems. New Phytol. 137: 179203. Knowles R, y Blackburn TH. (1993) Nitrogen isotope techniques. Academic Press Inc. San Diego, California. Malone J.P., Stevens R.J. y Laughlin R.J.. (1998). Combining the 15N and acetylene inhibition techniques to examine the effect of acetylene on denitrification. Soil Biol. Biochem. 30: 31-37. Ucha A, y Fernández Valiente E. (2001) Dinámica del nitrógeno en los arrozales de Valencia. Generalitat Valenciana. Conselleria d’Agricultura,Peixca i alimentació. Valencia.
