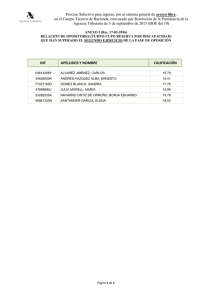
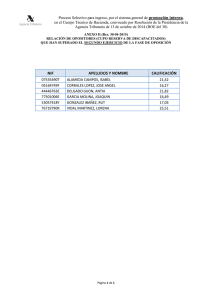
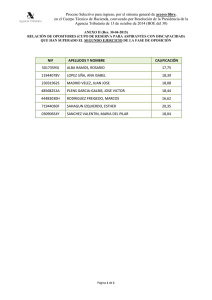
procedimiento de fabricacion de nanocapsulas con pared a base de
Anuncio

k OFICINA ESPAÑOLA DE PATENTES Y MARCAS 19 k kInt. Cl. : B01J 13/04 11 Número de publicación: 6 51 ESPAÑA k 2 108 272 A61K 9/51 TRADUCCION DE PATENTE EUROPEA 12 kNúmero de solicitud europea: 93909334.0 kFecha de presentación : 27.10.92 kNúmero de publicación de la solicitud: 0 611 326 kFecha de publicación de la solicitud: 24.08.94 T3 86 86 87 87 k 54 Tı́tulo: Procedimiento de fabricación de nanocápsulas con pared a base de proteı́nas reticuladas; nanocápsulas ası́ obtenidas y composiciones cosméticas farmacéuticas y alimentarias que comprenden la aplicación. k 73 Titular/es: Coletica k 72 Inventor/es: Perrier, Eric y k 74 Agente: Ungrı́a López, Javier 30 Prioridad: 31.10.91 FR 91 13522 32, Rue Saint Jean de Dieu 69007 Lyon, FR 45 Fecha de la publicación de la mención BOPI: 16.12.97 45 Fecha de la publicación del folleto de patente: ES 2 108 272 T3 16.12.97 Aviso: k k Huc, Alain k En el plazo de nueve meses a contar desde la fecha de publicación en el Boletı́n europeo de patentes, de la mención de concesión de la patente europea, cualquier persona podrá oponerse ante la Oficina Europea de Patentes a la patente concedida. La oposición deberá formularse por escrito y estar motivada; sólo se considerará como formulada una vez que se haya realizado el pago de la tasa de oposición (art◦ 99.1 del Convenio sobre concesión de Patentes Europeas). Venta de fascı́culos: Oficina Española de Patentes y Marcas. C/Panamá, 1 – 28036 Madrid 1 ES 2 108 272 T3 DESCRIPCION La presente invención se refiere esencialmente a un procedimiento de fabricación de nanocápsulas con pared a base de proteı́na reticulada ası́ como a las nanocápsulas ası́ obtenidas y a las composiciones cosméticas, farmacéuticas o alimentarias que las contienen. Se sabe que la encapsulación de substancias activas es muy importante con miras bien sea de proteger el principio activo, o de permitir una liberación lenta o diferida del principio activo en el organismo. Se ha propuesto encapsular los principios activos en liposomas, constituyendo los liposomas una forma galénica entusiasmante vista su muy buena afinidad con las membranas celulares, su muy buena biocompatibilidad y su tamaño submicrónico. Sin embargo, estas estructuras presentan numerosas limitaciones, incluso inconvenientes importantes que pueden resumirse en los cuatro puntos siguientes: - un mal rendimiento de encapsulación: los liposomas pueden contener o transportar diferentes tipos de moléculas: hidrófilos, lipófilos y anfifilos. Sin embargo, los rendimientos de encapsulación son muy bajos en todos los casos, lo cual, unido al problema de la difusión de los principios activos, disminuye también la eficacia de los liposomas y no permite, en muchos de los casos, considerar su utilización en aplicaciones terapéuticas. 5 10 15 20 25 30 35 - una mala reproductibilidad de los preparados liposomales cuando hay que realizar producciones industriales. - Una inestabilidad in vitro: la misma puede manifestarse de diferentes modos: inestabilidad quı́mica de los lı́pidos, inestabilidad del tamaño de los liposomas, inestabilidad de su estructura, formación de agregados, suelta de los agentes activos encapsulados, etc... - Una inestabilidad in vivo: la influencia de los lı́quidos biológicos sobre los liposomas aumenta muy a menudo las permeabilidades membranares de estos. Según la vı́a de administración utilizada, los liposomas pueden estar en contacto con lı́quidos biológicos tan diversos como la sangre, los jugos digestivos, los lı́quidos intersticiales...y deben por consiguiente ser capaces de resistir a numerosas interacciones. Ahora bien, el contacto con la mayorı́a de los lı́quidos biológicos conduce a un aumento claro de la permeabilidad membranar de los liposomas. Por fusión imperfecta con las células, o por contacto con sales, enzimas, lipasas, fosfolipasas, acil-transferasas - constituyentes plasmáticos, sales biliares, jugos digestivos, o por simples variaciones de pH, los liposomas pueden soltar de forma casi instantánea sus agentes activos en el medio circundante. 2 40 45 50 55 60 65 2 Se ha propuesto igualmente encapsular los principios activos en partı́culas o cápsulas de dimensión del orden de unas micras. Por ejemplo, el solicitante ha propuesto en el documento FR-A2.642.329 la preparación de microcápsulas con paredes mixtas de atelocolágenos y de glicosaminoglicanos para la encapsulación de principio activo. Este método es completamente satisfactorio pero no permite preparar cápsulas con una dimensión subcrómica, es decir cápsulas que tengan una dimensión nanométrica, llamada nanopartı́cula. Se ha propuesto por otro lado particularmente por Couvreur y col. en Febs Letters (1977), 84, 323-326 nanocápsulas con pared de poliacrilamida y por los mismos autores en J. Pharm. Pharmacol. (1979), 31, 331-332 nanocápsulas con pared de polimetilo y polietilo cianoacrilato. De igual modo, se ha propuesto en EP-A-0274.961 preparar nanocápsulas que forman sistemas coloidales a base de un copolı́mero de cloruro de vinilo y acetato de vinilo, poliisobutilcianoacrilato, ácido poli (d,l) láctico; por policondensación BEESTMAN y col. han propuesto en US-A-4.640.709 la preparación de esferas de pequeño tamaño cuyas membranas están constituidas por un material polimérico como la poliurea, la poliamida, la polisulfonamida, el poliester, el policarbonato y el poliuretano. Resulta igualmente conocido por el documento Journal of Controlled Release 14 (1990), 111-131, un procedimiento de fabricación de nanocápsulas de albúmina que comprenden la formación de una nanoemulsión y la reticulación térmica de esta a una temperatura comprendida entre 80-160◦C, ası́ como un procedimiento modificado que comprende una reticulación quı́mica de la 2,3-butanodiona. También es conocido por el documento AU84714/75 nanopartı́culas que comprenden una matriz reticulada de macromoléculas de origen natural, en particular proteı́nas, ası́ como su procedimiento de fabricación. Sin embargo, el método de fabricación descrito prevé la disolución en un disolvente de la macromolécula que se trata seguidamente con un agente disolvente en unas condiciones de formación de partı́culas y luego el tratamiento de las partı́culas con un agente reticulante (hardening agent), ver páginas 4 y 7. Los agentes reticulantes se precisan en la página 10, último párrafo, y están constituidos por aldehidos que conducen a la formación de enlaces inestables de tipo iminas, mientras que en el caso de la presente invención la reticulación tiene lugar con un dicloruro de ácido o un anhı́drido de ácido. Sin embargo, aunque con estos últimos documentos se obtienen cápsulas de tamaño nanométrico, un problema principal reside en el hecho de que estas partı́culas tienen generalmente una mala biocompatibilidad, una mala biodegradación in vitro e in vivo, que puede conducir en el almacenado a una fuerte concentración de partı́culas en algunos órganos, a una toxicidad de algunos monómeros o de algunos subproductos de polimerización o de algunos subproductos de degradación y a una mala protección de los principios activos cuando solo son absorbidos en la superficie de las nanopartı́culas que proporcionan 3 ES 2 108 272 T3 ası́ un efecto retardo insuficiente. Ası́, la presente invención tiene por objeto resolver el nuevo problema técnico que consiste en proporcionar una solución que permita la fabricación de partı́culas de dimensión nanométrica, llamadas nanopartı́culas, particularmente en forma de nanocápsulas o de nanoesferas que presentan una buena biocompatibilidad, una buena biodegradación in vivo, una ausencia de toxicidad o una toxicidad muy débil, ası́ como una protección muy buena de los principios activos y un efecto retardo significativo. La presente invención tiene también por objeto resolver el nuevo problema técnico enunciado anteriormente de una manera sencilla, poco costosa, utilizable a escala industrial. La presente invención permite por primera vez resolver estos problemas técnicos de una manera sencilla, poco costosa, fiable, utilizable a escala industrial y en el ámbito de la cosmética, de la farmacia, o del agroalimentario, obteniendo partı́culas o cápsulas de dimensión submicrónica, por consiguiente de tamaño inferior a 1 µm, y particularmente comprendida entre 100 y 800 nanometros aproximadamente. Ası́, según un primer aspecto, la presente invención proporciona partı́culas o cápsulas de dimensión inferior a un micrometro, llamadas nanopartı́culas o nanocápsulas, con pared de proteı́nas reticuladas, caracterizadas porque se obtienen por una reacción de reticulación interfacial entre una proteı́na y un agente reticulante que comprende al menos dos grupos acilantes que reaccionan con los grupos reactivos acilables de la indicada proteı́na, obteniendo ası́ la indicada nanopartı́cula o nanocápsula con pared a base de proteı́na reticulada. Otras caracterı́sticas de estas nanopartı́culas o nanocápsulas se enuncian en las sub-reivindicaciones que se incorporan aquı́ en su totalidad por referencia. Según un segundo aspecto, la presente invención proporciona un procedimiento de fabricación de partı́culas o de cápsulas de dimensión inferior a un micrometro, llamadas nanopartı́culas o nanocápsulas, con pared a base de proteı́nas reticuladas, caracterizada porque comprende la realización de una nanoemulsión que comprende una fase acuosa que contiene una proteı́na y una fase aceitosa que contiene un agente de reticulación interfacial que incluye al menos dos grupos acilantes que reaccionan con los grupos acilables de la indicada proteı́na formando ası́ micropartı́culas o microcápsulas cuya pared es a base de proteı́nas reticuladas por el indicado agente reticulante. Según una variante de realización, se añade un agente modificador de la viscosidad con el fin de disminuir la diferencia de viscosidad entre las fases lı́quidas en presencia para obtener la indicada nanoemulsión. Otras variantes resultan de las subreivindicaciones de procedimiento y de la descripción siguiente: Según otra variante de realización, este procedimiento se caracteriza porque el agente modificador de viscosidad es capaz de modificar la viscosidad de al menos 4 veces y de preferencia 5 10 15 20 25 30 35 40 45 50 55 60 65 4 de al menos 10 veces, con relación a la fase a la cual el indicado agente se añade. Según otra variante, este procedimiento se caracteriza porque, en el caso de la formación de una emulsión de agua-en-aceite, el indicado agente modificador de viscosidad se añade o substituye en la fase aceitosa con el fin de aumentar la viscosidad de al menos 4 veces con relación a la viscosidad de la fase aceitosa utilizada clásicamente (FR-A-2642329). De acuerdo con otra variante, este procedimiento se caracteriza porque en el caso de una emulsión de aceite-en-agua, se disminuye la viscosidad de la fase acuosa bien sea disminuyendo la proporción en proteı́na, o añadiendo un agente modificador de viscosidad en la fase acuosa (agente fluidificante de viscosidad) con el fin de disminuir su viscosidad y de preferencia de al menos 4 veces con relación a la viscosidad de la fase acuosa utilizada clásicamente (FR-A-2.642.329). Según otra variante este procedimiento se caracteriza porque se utiliza como proteı́na una proteı́na de efecto filmógeno, de preferencia elegida entre el grupo que consiste en una proteı́na animal tal como elastina, queratina, seda, albúmina, proteı́nas de la leche, proteı́nas de estructura tales como colágeno, particularmente colágeno sin telopéptido o atelocolágeno o un glicosaminoglicano; una proteı́na vegetal tal como proteı́na de trigo, de maı́z, de avena, de almendra; y una proteı́na procedente del medio marino particularmente extraı́da de pescados, de algas o también del placton o microplacton. Según otra variante este procedimiento se caracteriza porque la proteı́na anteriormente citada tiene un peso molecular al menos igual a 50 000 Daltons, siendo esta proteı́na utilizada sola o mezclada. Según otra variante, este procedimiento se caracteriza porque la proporción de proteı́na en la solución de emulsión varı́a entre 0,1 y 5% en peso con relación al peso total de la emulsión. Según otra variante este procedimiento se caracteriza porque la proteı́na se disuelve primeramente en una solución acuosa tamponada con un pH ligeramente básico, de preferencia comprendido entre aproximadamente 7,5 y aproximadamente 10,5. Según otra variante este procedimiento se caracteriza porque el agente modificador de viscosidad anteriormente citado es un aceite viscoso, en particular seleccionado entre el aceite de vaselina viscoso, cuya viscosidad es preferentemente de al menos 80 cp, de preferencia todavı́a de al menos 200 cp; o un agente modificador de viscosidad de los aceites tales como el estearato de magnesio. Según otra variante este procedimiento se caracteriza porque, durante la etapa de emulsión, se utiliza un agente tensioactivo o emulsionante capaz de formar una nanoemulsión, de preferencia glicerol sorbitan hidroxiisoestearato. Según otra variante este procedimiento se caracteriza porque la etapa de emulsión se realiza bajo una agitación con efecto cizallante, de preferencia de al menos 20000 r/min, o con efecto de cavitación. Según otra variante este procedimiento se caracteriza porque se realiza una emulsión muy fina 3 5 ES 2 108 272 T3 pasando la emulsión por un homogeneizador bajo una presión de por lo menos 400 bares, siendo este homogeneizador preferentemente una prensa French. Según otra variante este procedimiento se caracteriza porque la proteı́na anteriormente citada comprende colágeno. Según otra variante este procedimiento se caracteriza porque la proteı́na anteriormente citada comprende atelocolágeno. Según otra variante este procedimiento se caracteriza porque la proteı́na anteriormente citada comprende una mezcla de atelocolágeno y de glicosaminoglicano. Según otra variante este procedimiento se caracteriza porque una de las fases contiene un principio activo cosmético o farmacéutico, o alimentario, hidrosoluble, liposoluble, o insoluble. De acuerdo todavı́a con otra variante de realización, en el caso de la utilización de una substancia activa hidrosoluble, se utiliza una relación de emulsificación de aceite/agua próxima a 6. Según otra variante de realización, para el caso en que se utilice un principio activo liposoluble, se utiliza una proteı́na con alto o muy alto peso molecular, es decir de al menos 50 000 Daltons, a una concentración tal que la viscosidad de la solución obtenida sea baja, es decir inferior a 20 cp (mPa.s). Por otro lado, en este caso, se prefiere utilizar una relación de emulsificación de agua/aceite próxima a 20. Por otro lado, se utiliza en el marco del procedimiento, cualquier agente reticulante bien conocido del experto en la materia, tal como se ha descrito particularmente en FR-2.642.329. El agente reticulante descrito en FR - A 2.642.329 es un dicloruro de ácido o un anhı́drido de ácido o un ácido carboxı́lico di- o poli-básico. Según una caracterı́stica preferida, el agente reticulante es elegido entre el cloruro de tereftaloilo, el cloruro de ácido ftálico, el cloruro de ácido sebácico, el cloruro de ácido succı́nico, el cloruro de un ácido tricarboxı́lico como el ácido cı́trico, o un anhı́drido de ácido como el anhı́drido succı́nico. Según un tercer aspecto, la presente invención cubre igualmente una composición cosmética, farmacéutica o alimentaria, caracterizada porque comprende nanocápsulas con pared a base de proteı́nas reticuladas tales como las anteriormente definidas, de preferencia obtenidas por el procedimiento definido. De preferencia, estas nanocápsulas contienen al menos en parte un principio activo, en particular un principio activo cosmético, farmacéutico o alimentario, hidrosoluble, liposoluble o insoluble. Otros fines, caracterı́sticas y ventajas de la invención aparecerán claramente a la luz de la descripción explicativa que sigue realizada con referencia a diversos ejemplos de realización de la invención dados simplemente a tı́tulo de ilustración y que no limitarı́an por consiguiente en modo alguno el alcance de la invención. En los ejemplos, todos los porcentajes se facilitan en peso salvo indicación contraria. Ejemplo 1 según la invención Preparación de nanocápsulas con pared de proteı́4 5 10 15 20 25 30 35 40 45 50 55 60 65 6 nas a base de una mezcla atelocolágeno/glicosaminoglicanos a) Fabricación de la mezcla necesaria para la fabricación de las nanocápsulas Esta mezcla se preparó según un procedimiento descrito en FR-A-2.642.329, ejemplo 1 etapas a) a c). - A partir de pieles de terneros recién sacrificados, el colágeno fue extraı́do y luego se eliminaron los telopéptidos para obtener el atelocolágeno. - A partir de tabiques nasales de terneros, se extrajo la condroitina-4-sulfato, se dializó y luego se liofilizó. - Los dos preparados precedentes se colocaron ventajosamente en tampón básico tal como carbonato o fosfonato o cualquier otra substancia que permita obtener un poder tampón entre 7,5 y 10,5. Luego las soluciones se mezclaron con el fin de obtener por ejemplo, las concentraciones finales siguientes: Atelocolágeno: 1,6% Condroitina 4-sulfato: 0,6% Carbonato de sodio anhidro: 4,8% Parahidroxibenzoato de metilo: 0,4% Agua permutada: csp El pH del conjunto se llevó entre 7,5 y 10,5, por ejemplo a 8,5, mediante aporte de HCl, 6N o de NaOH,6N. Un kilo de esta solución ası́ preparada se utilizó en la siguiente fabricación. b) Preparación del agente reticulante 400 g de cloruro de tereftaloilo se trituraron en un mortero y se añadieron a 1 l de vaselina viscosa CODEX. El conjunto se agitó mediante agitación mecánica. c) Emulsificación En una cuba de acero inoxidable refrigerada, se introdujeron 6 l de aceite de vaselina viscosa CODEX con ı́ndice de viscosidad de 250 cp (mPa.s) y de preferencia 320 ml de un agente tensioactivo por ejemplo el glicerol sorbitan hidroxiisoestearato (Arlacel 780, ICI). El conjunto se agitó durante unos minutos. La solución de atelocolágeno y de condroitina sulfato preparada se añadió entonces y la emulsificación se realizó en unos minutos a 20 000 rpm con la ayuda de un aparato Ultra-TuraxR d) Reticulación La solución que contiene el agente reticulante preparado en la etapa b se introdujo entonces en la emulsión. Las partı́culas sólidas presentes en esta se añaden igualmente, y se disolvieron con el transcurso del tiempo. Después de 5 min de agitación a 20 000 rpm en el aparato Ultra-TuraxR , la solución se puso bajo agitación mecánica a velocidad de rotación reducida, durante 18 h al menos. Las nanocápsulas se separaron por centrifugación en discontinuo y el sobrenadante se eliminó (4000 rpm durante 15 min). 7 ES 2 108 272 T3 e) Lavados Las nanocápsulas se lavaron mediante cinco soluciones sucesivas de una fase orgánica miscible con el aceite de vaselina. Citemos por ejemplo el DRAGOXATR (DRAGOCO), el MYRISTATE D’ISOPROPYLE (STEARINIERIE DUBOIS), los triglicéridos (STEARINERIE DUBOIS), etc. En el transcurso de cada lavado, se añadieron 100 ml de nanocápsulas a 500 ml de fase orgánica. El conjunto se agitó durante unos minutos luego se centrifugó (4000 rpm durante 15 minutos). Las nanocápsulas obtenidas pueden ponerse en suspensión por ejemplo en geles de proteı́na o de polisacárido, o en una fase aceitosa. Ejemplo 2 de la invención Preparación de nanocápsulas que contienen un principio activo hidrosoluble o insoluble Se procede como se ha descrito en el ejemplo 1 solo que a la solución fabricada en a) se pueden añadir numerosos principios activos, como por ejemplo: 5 10 15 20 Ej 2A: 64 g de GLYCENTANER (Bioética) Ej 2B: 64 g de GINKGO BILOBA (Alban Muller Int.) 25 30 b) se añadieron a 25 ml de aceite de borraja, 5 ml de dicloruro de sebacoilo y se mezcló el conjunto mediante agitación mecánica. Ej 2E: 32 g de CAFEINE (SIGMA) Ejemplo de la invención Preparación de nanocápsulas con pared de proteı́nas a base de atelocolágeno Se procedió como se ha descrito en el ejemplo 1. Sin embargo, se utilizó como única proteı́na macromolecular, el atelocolágeno a una concentración del 2%. Ejemplo 4 de la invención Nanocápsulas a la elastina Se procedió como se ha descrito en el ejemplo 1 solo que se utilizó como proteı́na la elastina. Se puede igualmente elegir una proteı́na entre las proteı́nas animales tales como la elastina, la queratina, la seda, la albúmina, las proteı́nas de la leche, las proteı́nas vegetales tales como proteı́nas de trigo, de maı́z, de avena, de almendra o las proteı́nas procedentes del medio marino tales como colágeno u otras proteı́nas extraı́das de pescados, proteı́nas de algas, microplacton. Ejemplo 5 de la invención Todos los ejemplos descritos anteriormente pueden ser modificados utilizando otros métodos de emulsificación. Ası́, en el ejemplo 1 en particular, la etapa de emulsificación c) se modifica y después de un ligero removido por agitación mecánica, el conjunto se pasa una o varias veces a un homogeneizador de alta presión. Las presiones utilizadas pueden situarse entre 400 y 1000 bares pero se sitúan preferentemente alrededor de 700 bares. Los homogeneizadores de simple y doble efecto pueden ser utilizados indistintamente pero los simples se preferirán para proteı́nas muy filmógenas. Los ejemplos de homogeneizadores de alta presión que han sido utilizados son el Lab 60 (APV), el SHL 05 (ALPHA-LAVAL), o SODEXIM 2720 o 2735 (SODEXIM). Después de un tratamiento de homogeneización a 700 bares por ejemplo, se obtienen nanocápsulas con una dimensión inferior a 1 µm, comprendida entre 200 y 800 nanometros. De igual modo, otros aparatos que utilizan otros principios, pueden igualmente permitir la obtención de fuerzas de cavitación elevadas. Con la ayuda de estas, resulta entonces posible obtener nanoemulsiones (ejemplos: SONICATEURR BRADSON, SONOLATORR de SONIC Corp.). Ejemplo 6 de la invención En la etapa de emulsificación del ejemplo 1, se utilizó un agente viscosante de los aceites para aumentar la viscosidad de la solución de emulsificación por ejemplo el estearato de magnesio a una proporción del 2% en peso. Se obtienen nanocápsulas de dimensión comprendida entre los 200 y 800 nanometros. Ejemplo 7 Preparación de nanocápsulas que contienen agentes activos liposolubles a) A 250 ml de la solución descrita en el ejemplo 1 en a), se añadieron 750 ml de agua desmineralizada. Ej 2C: 32 g de GLUCOSE (MERCK) Ej 2D: 32 g de un ácido aminado tal como la L-Glutamina 8 35 40 45 50 c) Las soluciones a) y b) se adicionaron en continuo y se enviaron a un homogeneizador de alta presión del tipo Lab 60 (APV). Las presiones de homogeneización utilizadas se encuentran comprendidas entre 300 y 1000 bares, por ejemplo 800 bares, y se realizaron varias homogeneizaciones sucesivas, con válvulas de simple y doble efecto. Las esferas obtenidas son de tamaño inferior a un micrón, son notablemente estables y visto su escaso tamaño no se decantan en un medio diluido de almacenado. Ejemplo 8 Otros agentes activos liposolubles En el ejemplo 7, los 25 ml de aceite de borraja pueden ser substituidos por: Ej 8a: 25 ml de miristato de etilo 55 Ej 8b: 25 ml de miristato de isopropilo Ej 8c: 25 ml de aceite de vaselina fluida Ej 8d: 25 ml de oleato de etilo 60 Ej 8e: 25 ml de acetato de vitamina E Ej 8f: 25 ml de benzoato de bencilo. 65 Ejemplo 9 Ensayo de objetivación La liberación in vivo de una substancia encapsulada en nanocápsulas según la invención con relación a las microcápsulas. 5 9 ES 2 108 272 T3 Los resultados de los ensayos de objetivación más convincentes proporcionados por las nanocápsulas sin desde luego los relacionados con una modificación de la distribución espacio-temporal de la substancia activa. Esta modificación puede estar unida al tamaño de las partı́culas que se encuentran entonces especı́ficamente transportadas en algunas partes del organismo (sistema reticulo-endotelial, tejidos hepáticos), pero la misma puede estar igualmente unida al papel de depósito de agentes activos que pueden jugar las nanocápsulas. En este último caso, una liberación temporizada del agente activo puede permitir alcanzar una fuerte biodisponibilidad del principio activo, una asimilación más intensa, ası́ como una eliminación mucho más progresiva de los desechos procedentes de la metabolización del principio activo. El estudio comparativo descrito a continuación ha permitido a los inventores evaluar la presencia y la intensidad del efecto retardo, obtenido con cápsulas de tamaño micrométrico y con cápsulas de tamaño nanométrico según la invención. a) Materiales y métodos La piel dorsal de ratas (WISTAR macho, de aproximadamente 300 g), se trató con la ayuda de una emulsión de agua en aceite, siendo la fase aceitosa el aceite de vaselina viscosa codex con ı́ndice de viscosidad de aproximadamente 250 cm (mPa.s) (TISCCO) y siendo la fase acuosa representada por una u otra de las soluciones dadas a continuación: - una mezcla de colágeno/glicosaminoglicano (en abreviatura Coll/GAG) que incluye ácido para-aminobenzóico radioactivo (PABA∗ ) - microcápsulas de tipo A que incluye PABA∗ (tamaño medio 50 µm) tales como se han preparado según el método descrito en el ejemplo 1 de la patente FR-A-2.642.329 - nanocápsulas que incluyen PABA∗ (tamaño comprendido entre 100 y 800 nm) preparadas según el método del ejemplo 1 indicado anteriormente, Después de la aplicación sobre una superficie constante, del producto que se ha de someter a ensayo, la liberación del ácido ha sido seguida por medición de la radioactividad contenida en la orina recogida diariamente para cada animal. Para cada una de las tres soluciones descritas anteriormente, se trataron dos ratas mediante 0,3 g de emulsión, teniendo una radioactividad especı́fica próxima a 3.106 cpm/g en el caso de la solución de colágeno/GAG y de las microcápsulas, y próxima a 6.105 cpm/g en el caso de las nanopartı́culas de la invención. b) Resultados Después de la aplicación del compuesto radioactivo, encapsulado o no encapsulado, la radioactividad se midió cada dı́a en la orina de las ratas. Las curvas muestran la evolución de esta radioactividad en función del tiempo (en dı́as) están representadas en la figura 1. Los valores relacionados con este gráfico representan la radioactividad medida en las orinas, 6 5 10 15 20 25 30 35 40 10 dividida por la radioactividad total recuperada en las orinas y en la piel. Esta radioactividad total recuperada se contabilizó después de los 17 dı́as de mediciones y después del sacrificio de los animales. Este gráfico describe el efecto retardo observado con las microcápsulas y las nanocápsulas en la liberación del PABA∗ . La fuerte liberación de los primeros dı́as, observada con la solución de colágeno/GAG es menos intensa con las microcápsulas y muy baja con las nanocápsulas. El PABA∗ se elimina mucho más lentamente cuando se encapsula en las microcápsulas y aún menos rápidamente cuando se encapsula en las nanocápsulas. 17 dı́as después del tratamiento, las ratas se sacrificaron, la piel que ha recibido la aplicación se hidroliza, luego se midió la radioactividad. Los resultados obtenidos han sido indicados en la figura 2 y muestran que la radioactividad contenida en los tejidos cutáneos es baja (próxima al 4%) cuando el PABA∗ no ha sido encapsulado, mucho más fuerte (próximo al 10%) cuando las microcápsulas han sido utilizadas, y aún más intensa (>20%) cuando las nanocápsulas han encapsulado la substancia radioactiva. Esta diferencia muy clara ha sido confirmada en otra prueba que se ha realizado donde ratas rapadas macho de 300 g han sido utilizadas en el mismo tipo de prueba. c) Conclusiones - La velocidad de eliminación de la radioactividad encontrada en las orinas al estar directamente relacionada con la velocidad de absorción cutánea, cualquier retardo en la eliminación puede ser considerado como debido al efecto retardo de las esferas que encapsulan el elemento radioactivo. Este efecto retardo observado in vivo sobre la rata es muy claro con microcápsulas de 50 µm pero es aún más intenso con nanocápsulas (cuyo tamaño varı́a entre los 800 nm y los 100 nm). 45 50 55 60 65 - La radioactividad medida a nivel del tejido cutáneo, después de la aplicación de un elemento radioactivo, encapsulado o no, es una medición de la biodisponibilidad de este elemento, es decir de su capacidad para ser integrado en el metabolismo cutáneo. Después de la aplicación de una cantidad demasiado fuerte de PABA∗ , la eliminación es muy rápida, pudiendo solo aceptar los tejidos cutáneos una fracción alicuota del producto aplicado. Cuando se utilizan las microcápsulas o nanocápsulas, existe una liberación temporizada de PABA∗ que puede entonces metabolizarse además de las grandes cantidades en los tejidos cutáneos. Es lo que se observa con las nanocápsulas de la invención y en una menor medida con las microcápsulas. Si el tamaño de las cápsulas es suficientemente pequeño para que no se produzca estallido durante la aplicación (diámetro inferior a 100 µm), 11 ES 2 108 272 T3 resulta por consiguiente posible obtener gracias a las nanocápsulas una mejora de la biodisponibilidad de los agentes activos cosméticos. La presente invención cubre todos los medios que constituyen equivalentes técnicos de los me- 5 12 dios descritos. En particular, en la descripción y las reivindicaciones, la palabra “nanocápsula” no se limita a cápsulas propiamente dichas sino que cubren esferas o partı́culas cuya dimensión es nanométrica. 10 15 20 25 30 35 40 45 50 55 60 65 7 13 ES 2 108 272 T3 REIVINDICACIONES 1. Partı́cula o cápsula de dimensión inferior a 1 µm, llamada nanopartı́cula o nanocápsula, con pared de proteı́na reticulada, caracterizada porque se obtiene por una reacción de reticulación interfacial entre una proteı́na y una agente reticulante que comprende al menos dos grupos acilantes que reaccionan con los grupos reactivos acilables de la indicada proteı́na, obteniendo ası́ la indicada nanopartı́cula o nanocápsula con pared a base de proteı́na reticulada. 2. Nanopartı́cula o nanocápsula según la reivindicación 1, caracterizada porque la proteı́na anteriormente citada tiene un peso molecular al menos igual a 50 000 Daltons, siendo esta proteı́na utilizada sola o en mezcla. 3. Nanopartı́cula o nanocápsula según la reivindicación 1 ó 2, caracterizada porque la proteı́na anteriormente citada es elegida entre el grupo que consiste en una proteı́na animal tal como la elastina, la queratina, la seda, la albúmina, la proteı́na de la leche, proteı́na de estructura tal como el colágeno, particularmente colágeno sin telopéptido o atelocolágeno; una proteı́na vegetal tal como la proteı́na de trigo, de maı́z, de avena, de almendra; y una proteı́na procedente del medio marino particularmente de pescado o de alga o incluso del placton o microplacton. 4. Nanopartı́cula o nanocápsula según las reivindicaciones 1 a 3, caracterizada porque la proteı́na anteriormente citada comprende colágeno, atelocolágeno o una mezcla de atelocolágeno y de glicosaminoglicano. 5. Nanopartı́cula o nanocápsula según una de las reivindicaciones anteriores, caracterizada porque contiene un principio activo cosmético, farmacéutico o alimentario, hidrosoluble, liposoluble o insoluble. 6. Nanopartı́cula o nanocápsula según la reivindicación 4 o 5, caracterizada porque el glicosaminoglicano anteriormente citado es el condroitina-4-sulfato. 7. Nanopartı́cula o nanocápsula según una de las reivindicaciones 1 a 6, caracterizada porque el agente reticulante que comprende al menos dos grupos acilantes capaces de reaccionar con los grupos acilables de la proteı́na es elegido entre el grupo que consiste en un dicloruro de ácido, en particular el cloruro de tereftaloilo, el cloruro de ácido ftálico, el cloruro de ácido sebácico, el cloruro de ácido succı́nico, el cloruro de un ácido tricarboxı́lico como el ácido cı́trico, o un anhidrido de ácido tal como el anhı́drido succı́nico. 8. Composición cosmética, farmacéutica o alimentaria, caracterizada porque comprende una nanopartı́cula o una nanocápsula tal como la definida en una cualquiera de las reivindicaciones anteriores. 9. Procedimiento de fabricación de partı́culas o de cápsulas de dimensión inferior a 1 µm llamadas nanopartı́culas o nanocápsulas, de pared a base de proteı́na reticulada, caracterizado porque comprende la realización de una nanoemulsión que comprende una fase acuosa que contiene una proteı́na y una fase aceitosa que contiene un agente de reticulación interfacial que 8 5 10 15 20 25 30 35 40 45 50 55 60 65 14 comprende al menos dos grupos acilantes que reaccionan con los grupos acilables de la indicada proteı́na formando ası́ las micropartı́culas o microcápsulas cuya pared es a base de proteı́na reticulada por el indicado agente reticulante. 10. Procedimiento según la reivindicación 9, caracterizado porque se añade un agente modificador de viscosidad en una de las dos fases con el fin de disminuir la diferencia de viscosidad entre las fases lı́quidas en presencia para obtener la indicada nanoemulsión. 11. Procedimiento según la reivindicación 8 o 9, caracterizado porque se realiza la nanoemulsión pasando una emulsión de la fase acuosa y de la fase aceitosa por un homogeneizador a una presión de por lo menos 400 bares. 12. Procedimiento según una de las reivindicaciones 9 a 11, caracterizado porque se realiza la nanoemulsión bajo una agitación con efecto cizallante, de preferencia al menos 20000 r/min, o con efecto de cavitación. 13. Procedimiento según una de las reivindicaciones 9 a 11, caracterizado porque la proteı́na anteriormente citada tiene un peso molecular al menos igual a 50 000 Daltons, siendo esta proteı́na utilizada sola o en mezcla. 14. Procedimiento según una de las reivindicaciones 9 a 11, caracterizado porque el agente modificador de viscosidad es capaz de modificar la viscosidad de al menos 4 veces y de preferencia de al menos 10 veces, con relación a la fase a la cual se ha añadido el mencionado agente. 15. Procedimiento según una de las reivindicaciones 9 a 14, caracterizado porque en el caso de la formación de una emulsión de agua-enaceite, el indicado agente modificador de viscosidad es añadido a o constituye la fase aceitosa con el fin de aumentar la viscosidad de al menos 4 veces con relación a la viscosidad de la fase aceitosa utilizada clásicamente. 16. Procedimiento según una de las reivindicaciones 9 a 14, caracterizado porque en el caso de una emulsión de aceite-en-agua, se disminuye la viscosidad de la fase acuosa bien sea disminuyendo la proporción en proteı́na, o por el aporte de un agente modificador de viscosidad con el fin de disminuir su viscosidad, preferentemente en al menos 4 veces, con relación a la viscosidad de la fase acuosa utilizada habitualmente. 17. Procedimiento según una de las reivindicaciones 9 a 16, caracterizado porque se utiliza como proteı́na una proteı́na con efecto filmógeno, de preferencia elegida entre el grupo que consiste en una proteı́na animal tal como la elastina, la queratina, la seda, la albúmina, las proteı́nas de leche, las proteı́nas de estructura tal como el colágeno, particularmente el colágeno sin telopéptido o atelocolágeno o un glucosaminoglicano; una proteı́na vegetal tal como la proteı́na de trigo, de maı́z, de avena, de almendra; y una proteı́na procedente del medio marino particularmente de pescados o de algas o incluso del placton o microplacton. 18. Procedimiento según una de las reivindicaciones 9 a 17, caracterizado porque la proporción de proteı́na en la solución de emulsión varı́a entre 0,1 y 5% en peso con relación al peso total de la emulsión. 15 ES 2 108 272 T3 19. Procedimiento según una de las reivindicaciones 9 a 18, caracterizado porque el agente modificador de viscosidad anteriormente citado es un aceite viscoso, en particular seleccionado entre el aceite de vaselina viscosa, cuya viscosidad es preferentemente de al menos 80 cp, de preferencia aún de al menos 200 cp; o un agente modificador de viscosidad de los aceites tal como el estearato de magnesio. 20. Procedimiento según una de las reivindicaciones 9 a 19, caracterizado porque, durante la etapa de emulsión, se utiliza un agente tensioactivo o emulsionante capaz de formar una nanoemulsión, de preferencia glicerol sorbitan hidroxiisoestearato. 21. Procedimiento según una de las reivindicaciones 9 a 20, caracterizado porque la proteı́na anteriormente citada comprende colágeno, atelocolágeno, una mezcla de atelocolágeno y glicosaminoglicano. 22. Procedimiento según una de las reivindicaciones 9 a 21, caracterizado porque una de las fases contiene un principio activo cosmético, far- 5 10 15 20 16 macéutico o alimentario, hidrosoluble, liposoluble o insoluble. 23. Procedimiento según una de las reivindicaciones 9 a 22, caracterizado porque cuando el principio activo es hidrosoluble, se utiliza una relación de emulsión aceite/agua próxima a 6. 24. Procedimiento según una de las reivindicaciones 9 a 23, caracterizado porque cuando el principio activo es liposoluble, se utiliza una relación de emulsión de agua/ aceite próxima a 20. 25. Procedimiento según una de las reivindicaciones 9 a 24, caracterizado porque, cuando el principio activo es liposoluble, se utiliza una proteı́na de alto peso molecular al menos igual a 50 000 Daltons, la concentración de la proteı́na es tal que la viscosidad de la solución acuosa obtenida sea inferior a 20 cp (m.Pa.s). 26. Procedimiento según una de las reivindicaciones 9 a 25, caracterizado porque el agente reticulante es tal como el definido en la reivindicación 7. 25 30 35 40 45 50 55 60 NOTA INFORMATIVA: Conforme a la reserva del art. 167.2 del Convenio de Patentes Europeas (CPE) y a la Disposición Transitoria del RD 2424/1986, de 10 de octubre, relativo a la aplicación del Convenio de Patente Europea, las patentes europeas que designen a España y solicitadas antes del 7-10-1992, no producirán ningún efecto en España en la medida en que confieran protección a productos quı́micos y farmacéuticos como tales. 65 Esta información no prejuzga que la patente esté o no incluı́da en la mencionada reserva. 9 ES 2 108 272 T3 10 ES 2 108 272 T3 11