Cinética enzimática: fosfatasa alcalina
Anuncio
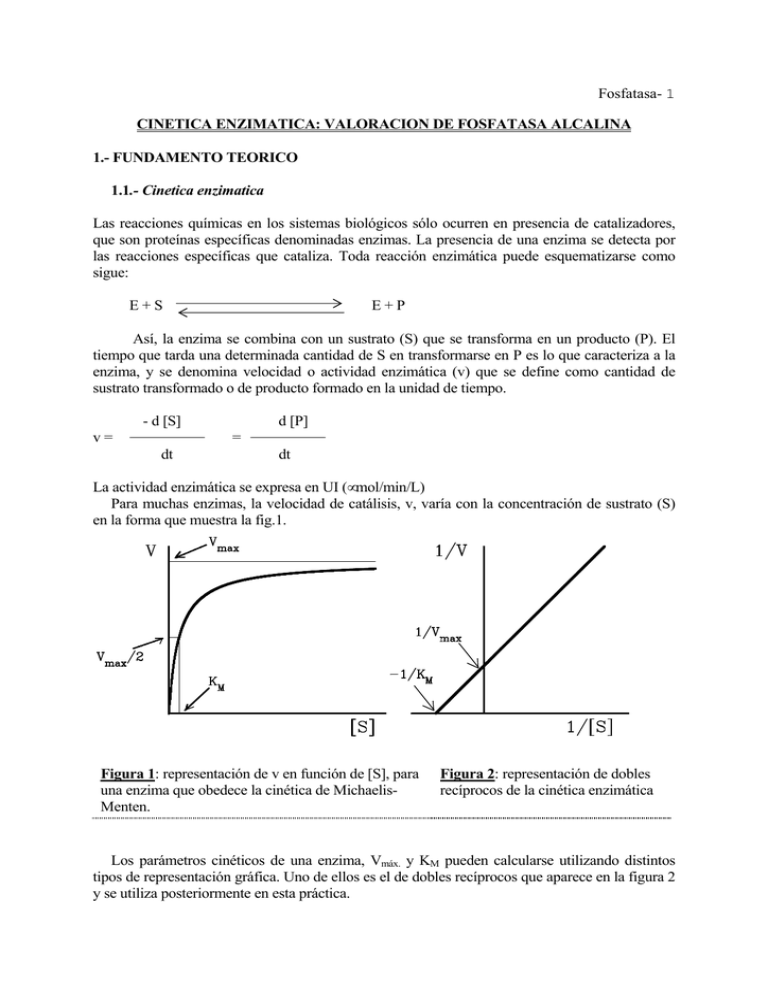
Fosfatasa- 1 CINETICA ENZIMATICA: VALORACION DE FOSFATASA ALCALINA 1.- FUNDAMENTO TEORICO 1.1.- Cinetica enzimatica Las reacciones químicas en los sistemas biológicos sólo ocurren en presencia de catalizadores, que son proteínas específicas denominadas enzimas. La presencia de una enzima se detecta por las reacciones específicas que cataliza. Toda reacción enzimática puede esquematizarse como sigue: E+S E+P Así, la enzima se combina con un sustrato (S) que se transforma en un producto (P). El tiempo que tarda una determinada cantidad de S en transformarse en P es lo que caracteriza a la enzima, y se denomina velocidad o actividad enzimática (v) que se define como cantidad de sustrato transformado o de producto formado en la unidad de tiempo. - d [S] v= d [P] = dt dt La actividad enzimática se expresa en UI (µmol/min/L) Para muchas enzimas, la velocidad de catálisis, v, varía con la concentración de sustrato (S) en la forma que muestra la fig.1. Figura 1: representación de v en función de [S], para una enzima que obedece la cinética de MichaelisMenten. Figura 2: representación de dobles recíprocos de la cinética enzimática Los parámetros cinéticos de una enzima, Vmáx. y KM pueden calcularse utilizando distintos tipos de representación gráfica. Uno de ellos es el de dobles recíprocos que aparece en la figura 2 y se utiliza posteriormente en esta práctica. Fosfatasa- 2 1.2.- MEDIDA DE LA ACTIVIDAD ENZIMÁTICA Los métodos más comunes de valoración de enzimas son: a) Volumétricos, cuando en la reacción enzimática se consume o se produce un producto gaseoso. b) Colorimétricos, cuando el producto formado es coloreado o da color en una reacción posterior (por ejemplo en la valoración de la fosfatasa alcalina). c) Espectrofotométricos, para aquellas reacciones enzimáticas que utilizan NAD(P) o NAD(P)H como coenzimas. d) Radiométricos, utilizando un sustrato marcado radiactivamente. 1.3.- FOSFATASA ALCALINA Las fosfatasas alcalinas son un grupo de enzimas similares, que catalizan la liberación de ácido fosfórico de algunos ésteres monofosfóricos a un pH elevado. Son por tanto fosfohidrolasas ortofosfóricas (EC 3.1.3.1) OH OH H2O R-O-P-OH R-OH + HO-P-OH O O Son proteínas de membrana cuya estructura es la de una glicoproteína. La parte glucídica está formada por cadenas de oligosacáridos que llevan generalmente en el extremo más alejado de la proteína ácido siálico. El papel fisiológico de la fosfatasa alcalina no está totalmente clarificado pero se cree que está en relación con el transporte, ya que es particularmente abundante en aquellos tejidos que tienen funciones de transporte de nutrientes y en el hueso durante el proceso de calcificación (niños, adultos con fracturas recientes, etc). Los niveles en suero se ven elevados en enfermedades óseas y hepáticas. La fosfatasa alcalina es un ejemplo de enzima cuya actividad puede ser medida por un método colorimétrico. Este se basa en la transformación de un sustrato, el p-nitrofenilfosfato (pNFP), en p-nitrofenol (p-NF), producto coloreado que en solución alcalina absorbe a 405 nm. Sustrato (incoloro) () Producto (amarillo 8 max 405nm) BIBLIOGRAFIA .- Richterich, R. Y Colombo, J.P. Química Clínica. Ed Salvat pg 404 (1983). .- Dixon, M. y Webb, E.C. Enzymes. Ed. Loongman London pg 343-635 (1979). .-Bowes, G.N. y Mc. Comb, R.B. Measurement of total alkaline phosphatase activity in human serum. Clin.Chem. 21 (1988). .- Bowes, G.N. y Mc. Comb, R.B. A continous spectrophotometric method for measuring the activity of serum alkaline phosphatase. Clin. Chem. 12, 70 (1966). .- Recommended methods for the determination of four enzymes in blood. Fosfatasa- 3 Scand.J.Clin.Invest. 33, 291 (1974). 2. MATERIAL Y REACTIVOS .- Tubos de ensayo .- Sustrato: p-nitrofenilfosfato (p-NFP) 10mM .- Colorímetro y cubetas de colorímetro .- Producto: p-nitrofenol (p-NF) 0,625 mM .- NaOH 0,2 N .-Muestra: extracto de hueso .-Tampón carbonato/bicarbonato 20 mM, pH 10,5 3.- PROCEDIMIENTO EXPERIMENTAL Y TRATAMIENTO DE LOS RESULTADOS 3.1.- CURVA DE CALIBRADO DE PRODUCTO (p-NF). La primera parte de la práctica consiste en la obtención de la curva de calibrado del p-nitrofenol (pNF), que se utilizará en el apartado 3 para calcular la [pNF] a partir de las absorbancias obtenidas. 3.1.1 Disponer 6 tubos como sigue: tubo tampón agua pNF 0,625mM NaOH 0.2N 0 1,5 mL 1,20 mL -- 0.3 mL 1 1,5 mL 1,17 mL 0,03 mL 0.3 mL 2 1,5 mL 1,14 mL 0,06 mL 0.3 mL 3 1,5 mL 1,11 mL 0,09 mL 0.3 mL 4 1,5 mL 1,05 mL 0,15 mL 5 1,5 mL 1,00 mL 0,20 mL V'⋅⋅C' Abs. 405 nm V tubo (mL) 0.3 mL 0,3 mL 3.1.2 Calcular la concentración de pNF en cada tubo teniendo en cuenta que: V⋅⋅C = Donde: Vi = Volumen de pNF que se añade a cada tubo. Ci = Concentración de la disolución de partida ([pNF] = 0,625 mM ) Vf = Volumen final en cada tubo. Cf = Concentración final de pNF en cada tubo. Tubo Vi (mL) [pNF]i (mM) Vf /tubo (mL) [pNF]f /tubo (mM) (producto) 1 2 3 4 5 3.1.3 Representar gráficamente las absorbancias frente a la concentración de pNF en Fosfatasa- 4 cada tubo y trazar la recta de calibrado. 3.2.- EFECTO DE LA CONCENTRACIÓN DE SUSTRATO A continuación, se realiza un estudio del efecto de la [S] sobre la velocidad de reacción enzimática. A partir de dicho estudio se determinarán los parámetros cinéticos Vmáx y KM. 3.2.1. Reacción enzimática. Preparar 6 tubos del siguiente modo (el extracto de hueso debe ser lo último que se añade): tubo tampón agua p-NFP 10 mM (sustrato) 0 1,5 mL 1,10 mL -- 0,1 mL 1 1,5 mL 1,07 mL 0,03 mL 0,1 mL 2 1,5 mL 1,04 mL 0,06 mL 0,1 mL 3 1,5 mL 0.95 mL 0,15 mL 0,1 mL 4 1,5 mL 0,80 mL 0,30 mL 0,1 mL 5 1,5 mL 0,50 mL 0,60 mL 0,1 mL extracto de hueso Abs. 405nm [p-NF] (producto) [p-NF] v = -------------t a) b) c) d) Incubar los tubos a temperatura ambiente durante 10 minutos. Añadir 0,3 mL de NaOH 0,2 N (para detener la reacción) Leer absorbancias a 405 nm, frente al blanco. Interpolar el valor de estas absorbancias en la recta patrón de p-NF (apartado 2.1) con el fin de conocer la concentración de producto obtenido. Anotar cada valor en la tabla, indicando las unidades. e) Calcular la velocidad de reacción o actividad enzimática, v, y anotar los valores en la tabla 3.2.1. 3.2.2. Calcular la concentración de sustrato [p-NFP] en cada tubo, siguiendo las indicaciones dadas en el apartado 3.1.2, y rellenar la tabla siguiente indicando las unidades: tubo Vi [p-NFP]i Vf.tubo [p-NFP]f /tubo [S] 1 2 3 4 5 Fosfatasa- 5 3.2.3. Representar gráficamente v frente a [S] (representación de Michaelis-Menten). Indicar las unidades. 3.2.4. Representación de dobles recíprocos. 3.2.4.1. Calcular para cada tubo la inversa de v y de [S]. Indicar las unidades: Tubo [S] v 1/[S] 1/v 1 2 3 4 5 3.2.4.2. Representar gráficamente recíprocos). 1/v frente a 1/[S] (representación de dobles 3.2.5. Calcular la KM y la Vmáx de la fosfatasa alcalina para p-NFP como sustrato, a partir de la gráfica anterior. Expresar la velocidad en UI/L.


