1 La secuencia de reacciones que sigue se emplea en la síntesis
Anuncio
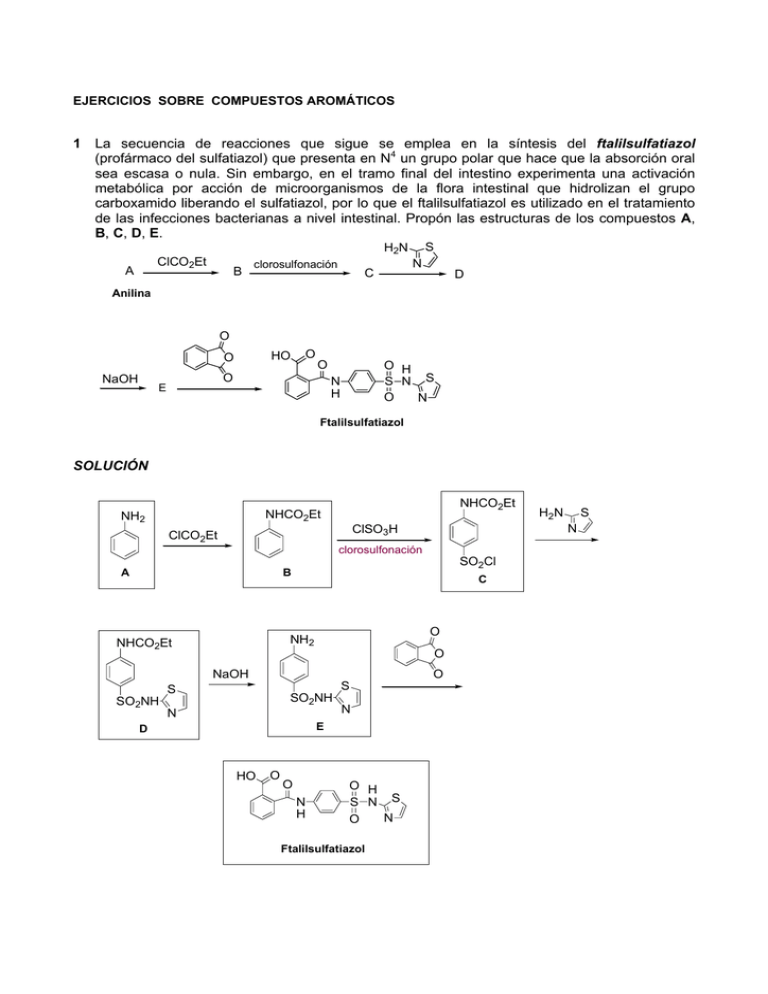
EJERCICIOS SOBRE COMPUESTOS AROMÁTICOS 1 La secuencia de reacciones que sigue se emplea en la síntesis del ftalilsulfatiazol (profármaco del sulfatiazol) que presenta en N4 un grupo polar que hace que la absorción oral sea escasa o nula. Sin embargo, en el tramo final del intestino experimenta una activación metabólica por acción de microorganismos de la flora intestinal que hidrolizan el grupo carboxamido liberando el sulfatiazol, por lo que el ftalilsulfatiazol es utilizado en el tratamiento de las infecciones bacterianas a nivel intestinal. Propón las estructuras de los compuestos A, B, C, D, E. S H2N ClCO2Et A B clorosulfonación N C D Anilina O HO O NaOH O O O E O H S N S O N N H Ftalilsulfatiazol SOLUCIÓN NHCO2Et NHCO2Et NH2 ClCO2Et clorosulfonación SO2Cl B A C O NH2 NHCO2Et O NaOH O S S SO2NH SO2NH N N E D HO O O N H O H S N S N O Ftalilsulfatiazol H2N S N ClSO3H 2 La siguiente secuencia sintética forma parte de un programa encaminado a la síntesis de fenoles que inhiben la acción de las hormonas que intervienen en el proceso de la coagulación de la sangre. La primera reacción es una alquilación de Friedel-Crafts a partir de un alcohol. ¿Cuál es la estructura de A y C? ¿Y la de los reactivos B y D? Br CH3 CH3 CH3 + B A C etapa 1 CH3 CH3 D (CH2)5COOH CH3 etapa 2 OH OH F SOLUCIÓN HO (CH2)5COOH CH3 CH3 B H3O+ (CH2)5COOH CH3 OH D Br2 / AlBr3 F F A C 3 La octopamina es una ariletanolamina simpatomimética, usada como estimulante cardíaco. HO CHCH2NH2 OH Octopamina A continuación se muestra una posible vía sintética de la octopamina, partiendo de fenol e hidrocloruro de aminoacetonitrilo, mediante una reacción de sustitución electrofílica aromática en la primera etapa. Completa el esquema sintético. + N C CH2NH2 AlCl3 H2O Octopamina A . HCl OH SOLUCIÓN O C CH2NH2 + OH N C CH2NH2.HCl AlCl3 H2 H2O Ni-Raney OH A B HO CHCH2NH2 OH Octopamina 4 La dopamina es un neurotransmisor excitador a nivel de sistema nervioso central. Tiene una estructura molecular muy sencilla, se trata de una fenetilamina, y dada su similitud estructural con las ariletanolaminas se comporta también como agonista adrenérgico. A nivel periférico, esta acción justifica el uso de la dopamina como cardiotónico por su capacidad de estimular los receptores β1 cardíacos. Su síntesis se inicia a partir del o-dimetoxibenceno, haciendo uso de una reacción clorometilación de anillos bencénicos activados, con metanal y cloruro de hidrógeno. Escribe las estructuras de los compuestos intermedios hasta llegar a la dopamina. + CH2O CH3O HCl A H2 KCN B catalizador CH3O H2 C HBr HO catalizador CH2CH2NH2 HO Dopamina SOLUCIÓN + CH3O CH2O KCN HCl CH3O CH3O CH2CN CH3O H2 catalizador CH3O HBr CH2Cl CH3O B HO HO CH2CH2NH2 Dopamina CH3O CH3O A CH2CH2NH2 C HBr 5 La dobutamina es un análogo del neurotransmisor dopamina, capaz de estimular los receptores β1 cardíacos, lo que justifica el uso de la dobutamina como agente cardiotónico. Completa el esquema indicado a continuación que conduce a la obtención de la dobutamina. HCHO CH3O C HBr D Ni-Ra (C9H11ClO2) O CH3 C CH2CH2 + H2 B HCl CH3O D KCN A (C10H15NO2) (C10H11NO2) OCH3 H2 Pd-C E HI (C8H11NO2) Dobutamina (C18H23NO3) (C19H25NO3) SOLUCIÓN HCHO CH3O HCl CH3O CH3O H2 Ni-Ra CH2Cl CH3O CH3O CH2CH2NH2 HBr CH3O HO HO HO HO HO CH2CH2NH2 + CH3 HO D O C CH2CH2 CH2CH2N C CH2CH2 CH3 CH2CH2N CH CH2CH2 E CH2CH2NH2 HO OCH3 D H CH3 CH2CN CH3O CH3O A C HO KCN OCH3 H2 Pd-C OCH3 HI B CH2CH2N CH CH2CH2 CH3 H HO HO OH Dobutamina 6 La observación de que las sulfamidas antibacterianas producían acidosis metabólica y alcalinización de la orina condujo a la obtención de diversas familias de fármacos diuréticos, a una de las cuales pertenece la bumetanida, utilizado en clínica como antihipertensivo y para el tratamiento del edema asociado a insuficiencia cardíaca, enfermedad renal, hepática o pulmonar. Completa la siguiente secuencia sintética que lleva a la obtención de la bumetanida. Cl ClSO3H COOH HNO3 A NH3 B C H2SO4 PhONa COOH F H2NO2S N OPh H CH3 Sn E D HCl Bumetanida SOLUCIÓN SO2Cl SO2Cl Cl ClSO3H Cl COOH COOH HNO3 Cl H2SO4 O2N A B SO2NH2 NH3 Cl SO2NH2 PhONa COOH O2N PhO Sn O2N HCl C COOH D COOH I CH3 F COOH H2NO2S N OPh H Bumetanida CH3 SO2NH2 PhO COOH H2N E 7 La furosemida es uno de los diuréticos más efectivos, desarrollado a partir de las sulfonamidas antibacterianas. Propón una posible vía de síntesis de la furosemida a partir del ácido 2,4diclorobenzoico, furfurilamina y los reactivos que consideres necesarios. CH2 O NH COOH Furosemida Cl SO2NH2 Cl COOH Ácido 2,4-diclorobenzoico Furfurilamina CH2NH2 O Cl SOLUCIÓN Cl Cl Cl COOH COOH COOH NH3 ClSO3H Cl Cl Cl SO2Cl Cl COOH O SO2NH2 O CH2NH2 CH2 NH COOH Cl SO2NH2 Cl SO2NH2 8 La tolpropamina, utilizada como antialérgico, pertene a una de las familias clásicas de antihistamínicos H1, las propilaminas. Completa su secuencia sintética. ClCOCH3 BrMg HCHO A AlCl3 CH3 B C HN(CH3)2 H3O+ calor D H2 Tolpropamina Pd-C SOLUCIÓN O O CH3 ClCOCH3 HCHO AlCl3 HN(CH3)2 A BrMg CH3 N(CH3)2 H2O B CH3 CH3 CH3 H3O+ HO N(CH3)2 H2 N(CH3)2 calor Pd-C N(CH3)2 D Tolpropamina C 9 El cloranfenicol (cloromicetina) fue un agente antibacteriano muy usado en la década de los cincuenta. En la actualidad, a pesar de presentar problemas tóxicos (puede producir anemia aplásica por su posible interacción con el ADN) que han restringido su uso, sigue siendo importante en el tratamiento de ciertas infecciones. HO H OH NO2 Cloranfenicol H NHCOCl2 Fue el primer producto farmacéutico de origen natural que tenía un grupo nitro y el primero que se obtuvo por síntesis química total, aunque también era viable aplicar la ruta de fermentación. La primera ruta sintética industrial del cloranfenicol se iniciaba con la condensación del benzaldehído y el β-nitroetanol. Tras la separación de los isómeros eritro y treo, se llevaba a cabo la reducción del grupo nitro en la mezcla racémica de los isómeros treo (R,R y S,S); seguidamente se resolvía la mezcla racémica con ácido (+)-tartárico, aislándose el isómero (R,R), se introducía el grupo nitro en posición aromática y por último se realizaba una dicloroacilación del grupo amino. Escribe todas las reacciones descritas que conducen al antibacteriano cloranfenicol. SOLUCIÓN H NO2 CHO + HOCH2CH2NO2 C CH CH2OH 1. Separación 2. H2 / Pd OH (eritro/treo 2:1) H NH2 C CH CH2OH HO H 1. ac. (+)-tartárico 2. Acetilación OH OH Mezcla racémica de los isómeros treo 3. Nitración (HNO3/H2SO4) 4. Desacetilación O2 N H NH2 HO H Cl2CHCOOCH3 H OH NHCOCHCl2 O2N 10 Aplica el análisis retrosintético al antiséptico nitrofural y sintetízalo, en una sola etapa, partiendo de los reactivos adecuados. O O2N CH N NH C NH2 O Nitrofural SOLUCIÓN Una desconexión adecuada es la que se señala en la estructura. O O2N CH N NH C NH2 O Síntesis en un solo paso. Formación de semicarbazona a partir del aldehído correspondiente y de la semicarbazida. El mecanismo es el de adición-eliminación de un nucleófilo con nitrógeno sobre un grupo carbonilo. O O2N O C H 5-Nitrofurfural 11 + H2N H N H2O C O NH2 H O2N Semicarbazida O C N NH C NH2 O Nitrofural La última etapa de una de las síntesis industriales del antiinflamatorio no esteroidal ibuprofeno, utilizado terapéuticamente como antiinflamatorio vaginal, consiste en la carbonilación del alcohol con monóxido de carbono dando el ácido carboxílico. CH3 CH CH2 CH3 CH CH3 OH CO PdCl2 HCl Ibuprofeno PPh3 CH3COCH2CH3 Esta síntesis no es estereoespecífica y se obtiene una mezcla racémica de ambos enantiómeros. Escribe la estructura de los dos enantiómeros del ibuprofeno. SOLUCIÓN La estructura del ibuprofeno sin estereoquímica es * CH COOH CH3 CH3 CH CH2 CH3 Los dos enantiómeros de este fármaco tienen las siguientes estructuras moleculares: H CH3 CH3 CH CH2 CH3 12 H CH3 COOH CH2 CH CH3 CH3 HOOC La sulfanilamida fue uno de los primeros quimioterápicos que se sintetizaron. Completa el siguiente esquema de síntesis. O CH3 ClSO3H NH3 A N H B NaOH Sulfanilamida SOLUCIÓN El compuesto A es el cloruro de 4-acetamidobencenosulfonilo y el compuesto B es la 4acetamidobencenosulfonamida. El esquema de síntesis completo es: O CH3 ClSO3H N H CH3 13 N H NH3 A SO2NH2 O CH3 SO2Cl O SO2NH2 NaOH N H H2N B Sulfanilamida La obtención del tuberculostático PAS (ácido p-aminosalicílico) es un ejemplo de ortocarboxilación de un fenol dando el correspondiente ácido orto-hidroxibencenocarboxílico (Síntesis de Kolbe-Schmitt). Escribe la reacción para obtener PAS (ácido 4-amino-2-hidroxibenzoico) a partir de maminofenol. SOLUCIÓN OH + CO2 OH KHCO3 H2N COOH 5-10 at NH2 PAS 14 Escribe el mecanismo de la síntesis del tuberculostático isoniazida. N N NH2 NH2 O C OCH2CH3 O Isonicotinato de etilo C NHNH2 Isoniazida SOLUCIÓN La formación de isoniazida a partir de isonicotinato de etilo e hidrazina es un proceso de adición + eliminación similar a la formación de amidas a partir de ésteres por reacción con NH3. La hidracina ataca nucleofílicamente al carbono del carboxilo y sale eliminado el etanol. N N NH2 NH2 O C CH3CH2O C O OCH2CH3 H NNH2 H N N + CH3CH2O C O O H NHNH2 15 C CH3CH2OH NHNH2 hidrazida del ácido isonicotínico Dibuja las estructuras de los productos intermedios representados por letras en la secuencia de reacciones que integran la síntesis total de la mostaza nitrogenada antineoplásica clorambucilo. (CH2)3CO2CH3 HNO3 H2SO4 A HCl, CH3OH B H2, Pd C ClCH2CH2 2 O POCl3 D E N CH2CH2Cl H2O CH2CH2CH2COOH Clorambucilo SOLUCIÓN NO2 A NO2 B CH2CH2CH2COOCH3 CH2CH2CH2COOH HOCH2CH2 N CH2CH2OH NH2 C D CH2CH2CH2COOCH3 CH2CH2CH2COOCH3 ClCH2CH2 N CH2CH2Cl E CH2CH2CH2COOCH3 16 El (S)-naproxeno es un fármaco antiinflamatorio no esteroideo perteneciente al grupo de los ácidos α-arilpropiónicos. El proceso de síntesis desarrollado por los Laboratorios Zambon permite la obtención del (S)-naproxeno enantioméricamente puro mediante la utilización de tartrato de metilo como auxiliar quiral, evitándose así la resolución óptica. H3C H C COOH (S)-Naproxeno CH3O La estrategia sintética, partiendo de la 1-(6-metoxi-2-naftil)-propan-1-ona, consta de cinco etapas. Escribe los reactivos necesarios para cada una de las cinco etapas: CH3OOC 1) O O O CH3O 2) COOCH3 CH3O COOCH3 CH3OOC O O COOCH3 CH3OOC O O CH3O Br CH3O Br RRS >> RRR HOOC COOCH3 CH3OOC 3) O Br O O O Br CH3O COOH Br CH3O Br RRS RRS 4) HOOC COOH CH3 O O Br CH3O COOH CH3O Br Br CH3 5) H C CH3 H C COOH CH3O H C COOH CH3O Br (S)-Naproxeno SOLUCIÓN 1. Utilización del auxiliar quiral (2R,3R)-tartrato de dimetilo: entra en la primera etapa y sale en la cuarta etapa. CH3OOC O + CH3O COOCH3 H OH HO H COOCH3 O COOCH3 O CH3O 2. Reacción de bromación: presenta una alta diastereoselectividad (RRS >> RRR). CH3OOC COOCH3 CH3OOC O O COOCH3 O O Br2 Br CH3O CH3O Br 3. Hidrólisis del diéster. COOCH3 CH3OOC HOOC O O H Br CH3O O H3O+ CH3 COOH O CH3 H Br CH3O Br Br 4. Transposición del arilo y conversión del cetal cíclico en ácido carboxílico. HOOC COOH O O CH3O Br H CH3 O HO C + H ∆ CH3O Br Br CH3 CH3O CH3 H H COOH Br 5. Reducción del bromo en la posición 5 del anillo aromático. CH3 CH3O Br H COOH CH3 H2 Ni (Raney) H COOH CH3O 17 Los derivados de ácidos arilacéticos y arilpropiónicos constituyen dos de las familias más representativas de fármacos antiinflamatorios no esteroideos. Dado el enorme interés terapéutico de estos fármacos, se han desarrollado numerosos métodos sintéticos para su obtención. A continuación se muestran dos vías alternativas para la síntesis del ibuprofeno (ácido 2-arilpropiónico antiinflamatorio). Propón las estructuras de los compuestos indicados con letras. 1. ClCOCH(CH3)2 AlCl3 A ClCH2COOEt AlCl3 2. Zn-Hg/HCl 1. EtONa D C B E 2. calor 2. ClCOOEt ClCOCH3 F AlCl3 KCN H3O HI/P G + COOH 1. H3O+ Ibuprofeno SOLUCIÓN COOEt 1. ClCOCH(CH3)2 AlCl3 1. EtONa ClCH2COOEt 2. ClCOOEt AlCl3 2. Zn-Hg/HCl A EtOOC B COOH COOEt EtOOC COOEt HNa 1. H3O+ ICH3 2. calor D E C O HO ClCOCH3 Ibuprofeno COOH CN HI/P KCN + H3O AlCl3 A G F Ibuprofeno 18 Los derivados de ácidos arilalcanoicos (ibuprofeno, flubiprofeno, naproxeno, indometacina, etc) constituyen el grupo más numeroso de AINES (antiinflamatorios no esteroideos), grupo en el que se encuentran descritos hasta la fecha los antinflamatorios más potentes. A continuación se muestra una posible vía de síntesis del antiinflamatorio flubiprofeno. a) Completa la secuencia sintética que conduce a la obtención del flubiprofeno. b) Sugiere un mecanismo para la conversión de A en B. F O CH2 C OEt O EtO OEt B A EtONa 1. HNa C 2. CH3I 1. KOH 2. HCl 3. calor Flubiprofeno SOLUCIÓN a) O O OEt F OEt EtO O 1. HNa OEt F O EtONa A OEt 2. CH3I B O F CH3 OEt CH3 OEt 1. KOH 2. HCl O 3. calor OH F O C Flubiprofeno b) EtO O H H OEt F O O EtOH EtO EtONa OEt F OEt F (base) OEt O O A B 19 a) Completa la síntesis del antiinflamatorio no esteroideo pirprofeno. b) Explica qué tipo de transformación tiene lugar en cada etapa. c) ¿Qué finalidad tiene el anhídrido acético? CH3 CHCOOH Cl N Pirprofeno CH2Br 1. Mg 2. CO2/H3O+ A EtOH H3O+ B HNO3 1. NaH C D 2. CH3I H2SO4 Sn HCl Pirprofeno BrCH2CH=CHCH2Br H H3O+ G Cl2 AlCl3 F Ac2O E SOLUCIÓN a) CH2COOH CH2COOEt B A CH3 CHCOOEt CH2COOEt NO2 CH3 CHCOOEt C D CH3 CHCOOEt CH3 CHCOOEt NH2 NHCOCH3 Cl NHCOCH3 E F NO2 CH3 CHCOOH Cl NH2 G H b) ¬ ¬ ¬ ¬ ¬ ¬ ¬ ¬ ¬ Formación del magnesiano y carboxilación: compuesto A Esterificación: compuesto B Nitración: compuesto C Alquilación en el carbono α al carbonilo del grupo éster: compuesto D Reducción del grupo nitro: compuesto E Formación de la amida: compuesto F Cloración: compuesto G Hidrólisis de la amida: compuesto H Formación del pirprofeno a partir de H: CH3 CHCOOH Cl − HBr CH3 CHCOOH Cl Br CH2CH=CHCH2Br NH2 Br HN CH3 CHCOOH − HBr Cl N Pirprofeno c) El uso del anhídrido acético tiene como objetivo convertir el grupo amino, que es un grupo fuertemente activante, en un grupo carboxamido, que es moderadamente activante; de esta forma, se puede conseguir en la cloración que el cloro entre exclusivamente en una de las dos posiciones orto al grupo carboxamido. 20 La benzocaína es un anestésico local de aplicación exclusivamente tópica debido a su baja solubilidad en agua. H N H COOCH2CH3 Benzocaína p-aminobenzoato de etilo a) Analiza las desconexiones sucesivas que deben aplicarse a la estructura benzocaína para su obtención. molecular de la b) Escribe una estrategia de síntesis de la benzocaína a partir de tolueno. SOLUCIÓN a) Análisis retrosintético H2N COO - CH2CH3 b) Estrategia sintética HNO3 CH3 H2 H2SO4 H2N COOH Pd/C 21 O2N CH3 EtOH KMnO4 O2N H2N COOH COOCH2CH3 H2SO4 Benzocaína ¿Cómo se podría preparar el analgésico derivado del ácido salicílico, la etenzamida (2etoxibenzamida), a partir de la salicilamida (2-hidroxibenzamida)? CONH2 OH CONH2 OCH2CH3 Salicilamida Etenzamida SOLUCIÓN Formación de un etilariléter, por reacción del fenol correspondiente con un agente alquilante, el sulfato de dietilo. CONH2 OH + O CH3CH2 O S O CH2CH3 O Salicilamida NaOH Sulfato de dietilo CONH2 OCH2CH3 Etenzamida El hidróxido sódico transforma el fenol en fenóxido de sodio, que es un buen nucleófilo. CONH2 OH CONH2 O Na + NaOH + H2O La alquilación tiene lugar mediante un mecanismo SN2, con el sulfato de dietilo (Et2SO4) como sustrato y el anión fenóxido (PhO− Na+) como nucleófilo. CONH2 O O + CH3CH2 O S O CH2CH3 O CONH2 OCH2CH3 SN2 Etenzamida 22 La búsqueda de compuestos estructuralmente relacionados con la morfina condujo a la obtención de la metadona, interesante por sus propiedades analgésicas, pero que conserva los efectos secundarios de la morfina, aunque con menor intensidad, por lo que se suele utilizar en el tratamiento de los síntomas del síndrome de abstinencia. A continuación se muestra una secuencia sintética que lleva a la obtención de metadona racémica. a) Dibuja las estructuras de los compuestos indicados por letras. b) La metadona presenta un centro estereogénico. Indica qué procedimiento permitirá disponer de (R)-metadona enantioméricamente pura. CHO 1.BrMgPh 2. H3O + A SOCl2 B KCN C 1. base 2. ClCH2CH N(CH3)2 Metadona racémica H3O+ BrMgEt E CH3 D SOLUCIÓN a) Cl Ph CH OH Ph CH A B CN Ph CH CN Ph C CH2CHN(CH3)2 CH3 D C Et C NH Et C O Ph C CH2CHN(CH3)2 Ph C CH2CHN(CH3)2 CH3 E CH3 Metadona racémica b) Para obtener (R)-metadona enantioméricamente pura podríamos llevar a cabo una resolución de la mezcla racémica de (R) y (S)-metadona, utilizando ácido (-)-dibenzoiltartárico. La reacción de la mezcla racémica con el ácido (−)-dibenzoil-tartárico daría lugar a la formación de las sales diastereoméricas correspondientes, cuya separación por cristalización y posterior hidrólisis conduciría a la obtención de la (R)-metadona enantioméricamente pura. Et C O N Ph C CH3 H CH3 CH3 (R)-Metadona 23 El paracetamol es un analgésico antitérmico, que proviene del metabolismo tanto de la acetanilida como de la acetofenetidina, utilizados inicialmente con esta finalidad terapéutica. Completa el esquema de síntesis del paracetamol, escribiendo sobre las flechas los reactivos necesarios para cada uno de los procesos químicos implicados. O OH NO2 NH2 OH OH NH C CH3 OH Paracetamol SOLUCIÓN El procedimiento de obtención del paracetamol tal como se muestra en el esquema consiste en tres etapas: ¬ La primera transformación es la nitración del fenol, según una reacción SEAr. ¬ En la siguiente etapa: El p-nitrofenol se reduce mediante una hidrogenación catalítica, transformándose en 4-aminofenol NO2 HNO3 NH2 H2 Ni-Raney OH OH OH ¬ Por último, el 4-aminofenol se acetila con anhídrido acético sobre el átomo de nitrógeno del grupo amino, más nucleófilo que el oxígeno del hidroxilo. O O NH2 CH3 O O NH C CH3 CH3 + CH3COOH OH OH Paracetamol 24 La entacapona es un fármaco de reciente aparición, utilizado para el tratamiento de la enfermedad de Parkinson asociado con la L-Dopa. La entacapona es resultado del diseño de inhibidores selectivos de la COMT (catecol O-metiltransferasa), enzima que metaboliza las catecolaminas. Esta inhibición enzimática reduce el metabolismo de la dopamina en el cerebro y potencia la acción de la L-Dopa. La síntesis de la entacapona consta de las etapas siguientes: CHO CH3COOH HO CHO NO2 HNO3 NO2 ∆ HO HO OCH3 OCH3 CH3 CHO NO2 HBr conc + N NC HO CHO OH NH CH3 O OH O NO2 CH3 N CN HO Entacapona CH3 OH Propón mecanismos para: a) La rotura del metiléter. b) La condensación que tiene lugar en la última etapa de la síntesis. SOLUCIÓN a) Ruptura del éter en medio ácido. La protonación del grupo metoxilo favorece el desplazamiento del fenol que es un buen grupo saliente y el ataque nucleofílico del bromuro sobre el metilo. O2N CHO H Br HO CH3 O CHO O2N HO CH3 HO Br O CHO O2N H H O b) Se trata de una condensación de tipo aldólico. La piperidina es una base suficientemente fuerte para arrancar el protón del metileno activo y formar un anión nucleófilo que ataca posteriormente al carbonilo del benzaldehído. El alcohol que se forma pierde agua transformándose en la amida α,β-insaturada que es la entacapona. CH3 CH3 N NC O CH3 + NH N NC O CH3 H + N H O C O2N HO O CH3 H N NC CH3 CH3 N CN HO O OH O O2N CH3 OH - H2O OH O O2N CH3 N CN HO O O2N HO CH3 OH CH3 N CN CH3 OH Entacapona 25 El haloperidol, cabeza de serie de los neurolépticos derivados de la butirofenona, es un antipsicótico de uso muy generalizado, cuyo descubrimiento fue resultado de la manipulación estructural de la petidina, uno de los análogos estructurales más antiguos de la morfina. CH3 CO2Et N CO2Et O N Análogo butirofenónico de la Petidina (analgésico y neuroléptico) Petidina (meperidina) (analgésico) OH O N Cl Haloperidol (neuroléptico) F El haloperidol, como es una molécula relativamente compleja, se obtiene por la reacción de dos sintones, que a su vez se preparan por separado, a partir de compuestos más simples. a) Aplica el análisis retrosintético a la molécula de haloperidol y propón la desconexión más adecuada. b) Escribe una posible vía de síntesis de ambos sintones. SOLUCIÓN a) La desconexión está señalada sobre la estructura: OH O N Cl F Los dos sintones que deben reaccionar para dar el haloperidol son: OH NH + F C CH2CH2CH2Cl O Haloperidol Cl γ-cloro-p-fluoro-butirofenona 4-(4-clorofenil)-piperidin-4-ol b) El agente alquilante, la γ-cloro-p-fluorobutirofenona, se prepara por una acilación de Friedel-Crafts sobre el anillo de fluorobenceno. + F AlCl3 ClCOCH2CH2CH2Cl C CH2CH2CH2Cl O F La piperidina disustituida en la posición 4 se obtiene mediante la siguiente secuencia de reacciones químicas: Cl C CH3 CH2 + 2 O C CH3 NH3 H C CH2CH2 NH Cl H HO CH2 CH3 Cl NH H3O+ CH3 C CH2 CH2 N CH2 H OH Cl O CH2 Cl H2O CH2 C CH2 CH2 N H HO Cl NH HBr H2O Cl NH 26 El antidepresivo melitraceno se prepara a partir de la 10H-antracen-9-ona. En la primera etapa de la secuencia sintética hay una doble alquilación en medio básico sobre el metileno activo de la posición 10 del antraceno. Como agente alquilante empleamos yoduro de metilo. El compuesto resultante de la alquilación anterior se trata con el magnesiano adecuado. Por último, la eliminación de agua en medio ácido conduce al fármaco. O O + I CH3 NaOH CH3 CH3 CH3 HO CH3 N CH3 ClMg N N CH3 CH3 CH3 HCl CH3 CH3 CH3 CH3 Melitraceno Escribe el mecanismo detallado de la primera reacción de la síntesis. ¿A qué tipo de reacción pertenece? SOLUCIÓN En medio básico se forma un anión, al perderse un hidrógeno ácido en el metileno del antraceno. El anión resultante ataca nucleofílicamente al ioduro de metilo. O O O SN2 I CH3 OH H H H H CH3 La segunda alquilación (metilación) se produce siguiendo un mecanismo idéntico, con el otro hidrógeno ácido que queda sobre el carbono 10 del antraceno. O O − I CH3 OH H CH3 CH3 CH3 27 La maprotilina es un prototipo de los antidepresivos tetracíclicos. En su síntesis se aprovecha la reactividad del sistema diénico del antraceno frente a dienófilos en reacciones de DielsAlder. Identifica los reactivos que corresponden a cada una de las etapas. CH2CH2CN b a O H2O NaOCH3 O CH2CH2COOH CH2CH2COOH c O CH2CH2COCl CH2CH2COOH CH2 CH2 d CH2CH2CH2NHCH3 CH2CH2CONHCH3 f e Maprotilina SOLUCIÓN ¬ Reacción de adición de Michael e hidrólisis ácida del grupo nitrilo. CH2CH2CN CH2 CH CN H2SO4 NaCH3O H2O O ¬ b a O Reducción del grupo carbonilo y deshidratación del alcohol correspondiente. CH2CH2COOH CH2CH2COOH c Zn/NH3 O ¬ Reacción de Diels-Alder entre el sistema diénico del antraceno y el eteno como dienófilo, creando un nuevo puente en la molécula. Conversión del ácido carboxílico en cloruro de ácido. CH2CH2COOH CH2 CH2 ¬ d CH2CH2COCl SOCl2 El cloruro de acilo formado se transforma en la amida N-metilsustituida, que se reduce, por último, hasta la amina correspondiente. e CH3NH2 CH2CH2CONHCH3 f LiAlH4 CH2CH2CH2NHCH3 Maprotilina 28 Completa el esquema de síntesis del ácido acetrizoico, medio de contraste para rayos X, escribiendo los reactivos que faltan. a COOH COOH b COOH O2N NH2 I I I NH2 c d COOH I I Ácido Acetrizoico COOH I CH3 C NH O Explica la causa de que se produzca directamente la trihalogenación del anillo aromático. SOLUCIÓN a) Partimos del ácido benzoico, que se nitra con ácido nítrico y ácido sulfúrico. El grupo nitro se reduce a amina con hierro en medio ácido. Posteriormente, se introducen tres átomos de yodo en las posiciones 2, 4 y 6, mediante el cloruro de yodo como electrófilo. La última etapa de la síntesis consiste en la acetilación del grupo amina, empleando anhídrido acético. COOH + HNO3 (conc) COOH H2SO4 (conc) O2N a I Fe / HCl COOH reducción b NH2 ICl halogenación c COOH Ac2O I COOH d NH2 I NH2 COOH I I I I I CH3 C NH Ácido Acetrizoico I O b) El grupo amino es fuertemente activante, por lo que la sustitución electrofílica está favorecida. La entrada del primer átomo de yodo en el anillo aromático aumenta la reactividad y las sucesivas sustituciones electrofílicas aromaticas de los átomos de yodo están cinéticamente favorecidas. 29 La adipiodona se emplea como medio de contraste radiológico. Propón una síntesis para la adipiodona, partiendo del ácido 3-amino-2,4,6-triiodobenzoico. I COOH I Adipiodona I COOH I O HN NH I O I SOLUCIÓN Dos moléculas del ácido 3-amino-2,4,6-triodobenzoico reaccionan con el dicloruro de hexanodioilo obteniéndose la adipiodona. I O I NH2 COOH + Cl Cl formación de la amida O I I COOH I Adipiodona COOH I O HN NH I I O I

