Hidratación - Política transfusional en UCI Fluidoterapia
Anuncio

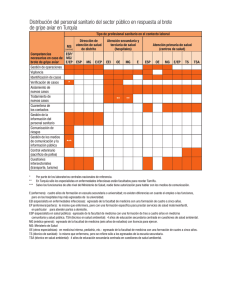
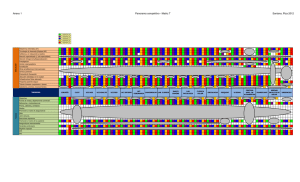
El enfermo crítico 4. Cardiovascular Hidratación - Política transfusional en UCI Fluidoterapia INTRODUCCIÓN La fluidoterapia es una de las medidas terapéuticas más importante y más frecuentemente utilizada en la Medicina Intensiva. Su objetivo principal es la recuperación y el mantenimiento del equilibrio hidroelectrolítico alterado, hecho habitual en pacientes críticos. DISTRIBUCIÓN DEL AGUA EN EL ORGANISMO En el hombre, el agua corporal total se estima en un 60% del peso, que equivaldría a unos 40 litros. Esta agua se distribuye en dos compartimentos: intracelular, que corresponde a dos tercios del agua corporal total y el extracelular, que representa un tercio. El 25% del fluido extracelular se encuentra en el espacio vascular, mientras que el 75% restante ocupa el espacio intersticial. El movimiento de los fluidos que administramos se gobierna mediante balance osmótico con idea de mantener la osmolaridad del medio. La membrana entre el espacio vascular e intersticial es permeable a la mayoría de los electrolitos, mientras que la membrana que separa el espacio extracelular del intracelular no permite el paso pasivo de los mismos. INDICACIONES DE LA FLUIDOTERAPIA INTRAVENOSA Las indicaciones de la fluidoterapia iv van a ser todas aquellas situaciones en las que existe una severa alteración de la volemia, del equilibrio hifroelectrolítico o ambos, y que requieren medidas de actuación urgentes encaminadas a restaurar la volemia y el equilibrio HE alterado: Shock Hipovolémico Hemorrágico No hemorrágico (quemaduras, deshidratación, 3er espacio) Depleción de líquido extracelular Vómitos Diarreas Fístulas Ascitis (3er espacio) Íleo Trastornos renales Depleción Acuosa Reducción ingesta: coma 12. Hidratación - Política transfusional en UCI 1 - 12 El enfermo crítico 4. Cardiovascular Aumento de pérdidas: sudoración ventilación mecánica, etc. excesiva, diabetes insípida, Depleción Salina Diuréticos Nefropatías Pérdidas digestivas Insuficiencia suprarrenal aguda Hipernatremia Causas renales Causas extrarrenales Diabetes insípida NORMAS GENERALES PARA EL USO DE FLUIDOTERAPIA IV No existe un protocolo general exacto de fluidoterapia iv para cada cuadro clínico. Las pautas de fluidos deben ser ajustadas a cada caso individualmente. Pautar líquidos en función de los déficits calculados. Ajustar especialmente en situaciones de insuficiencia orgánica (insuficiencia cardíaca, insuficiencia renal aguda, insuficiencia hepática). Seleccionar adecuadamente el fluido para cada situación clínica. Balance diario de líquidos, ajustando según aporte y pérdidas. Evitar soluciones hipotónicas en situaciones de hipovolemia por incrementar el volumen extravascular. Evitar soluciones glucosadas en enfermos neurológicos. Se comportan como hipotónico y pueden favorecer la aparición de edema cerebral. Monitorizar hemodinámicamente en enfermos crónicos sometidos a fluidoterapia intensiva: presión arterial, diuresis/hora, FC, PVC, ionograma, osmolaridad, etc. TIPOS DE SOLUCIONES. CLASIFICACIÓN Y CARACTERÍSTICAS CRISTALOIDES Los cristaloides son soluciones que contienen agua, electrolitos y/o azúcares en diferentes proporciones y que pueden ser hipotónicos, isotónicos o hipertónicos respecto al plasma. A. Sueros glucosados Proporcionan agua libre, que se distribuye libremente por los diversos compartimentos del organismo, ya que la glucosa es rápidamente metabolizada. Así, al infundir 1 litro de glucosa al 5%, solamente unos 100 ml permanecen dentro del espacio vascular. Por ello, estas soluciones no son efectivas para incrementar el volumen circulante. Aportan una pequeña cantidad de calorías en forma de glucosa (50 gr = 200 Kcal en 1000 cc de glucosado al 5%). Son empleadas para satisfacer 12. Hidratación - Política transfusional en UCI 2 - 12 El enfermo crítico 4. Cardiovascular unos mínimos requerimientos de glucosa así como para la corrección de situaciones de hipernatremia con la consiguiente hiperosmolaridad. B. Soluciones salinas 1. Suero fisiológico (ClNa al 0,9%): es isotónico y se distribuye exclusivamente por el espacio extracelular, por lo que según las proporciones antes indicadas, al infundir 1 litro y transcurridos unos 30-45 minutos sólo permanece el 25% en el espacio vascular. Se emplea como fluidoterapia de mantenimiento y en la reanimación del enfermo crítico, en cuyo caso y según la cinética antes comentada hay que administrar entre 3 y 4 veces el déficit vascular, con el riesgo de sobrecarga del espacio intersticial (edemas, ICC...). El aporte excesivo de cloruro sódico puede producir acidosis hiperclorémica, aunque ello no suele suponer problema, ya que si la función renal está conservada el exceso de cloro es excretado por la orina. 2. Suero hiposalino (ClNa al 0,45%): es hipotónico y puede estar indicado en la deshidratación con hipernatremia, pero no como expansor plasmático. 3. Sueros salinos hipertónicos (ClNa al 3-7,5%): son expansores en mayor medida que el volumen infundido, ya que se producirá el paso de agua desde el compartimento intracelular al extracelular. Se han utilizado en resucitación de enfermos con shock hemorrágico y con TCE grave, donde se postula que puede mejorar la hipertensión intracraneal al reducir el contenido de agua en las zonas dañadas del cerebro. En la resucitación de un shock hemorrágico, los efectos no se limitan a una simple reposición de volumen sino que ejercen un efecto beneficioso sobre la situación hemodinámica por diversos mecanismos: - desplazamiento del líquido al espacio intravascular - hemodilución y descenso de la viscosidad sanguínea - dilatación de los vasos de resistencia precapilares - constricción de los vasos de capacitancia - efectos inotrópicos positivos - liberación de vasopresina por activación de osmorreceptores En la 8ª edición del ATLS (1), en el apartado de fluidoterapia, ya se empieza a recomendar el uso de Ringer Lactato o SSF, como primera opción y como segunda aparece el salino hipertónico. Hasta esta edición, casi la única recomendación de las guías americanas eran los cristaloides tipo RL y como segunda el SSF) De todas maneras, su empleo se asocia con graves hipernatremias e hiperosmolaridad. La deshidratación cerebral puede desarrollarse rápidamente con el desarrollo de hemorragias y mielinosis pontina central. Por todo ello, el empleo de estas soluciones debe hacerse con sumo cuidado y siempre con un estrecho control de la natremia y osmolaridad plasmática. 4. Ringer Lactato: Es el cristaloide más ampliamente recomendado por las guías americanas ATLS. A pesar de que muchas veces se menciona como isotónico realmente es un cristaloide hipotónico, el 12. Hidratación - Política transfusional en UCI 3 - 12 El enfermo crítico 4. Cardiovascular cual tiene gran tendencia a salir del espacio intravascular y en diversos trabajos ya se ha publicado un empeoramiento de la función endotelial, inadecuada reposición volumétrica en los politraumatismos con shock hemorrágico, empeoramiento del flujo circulatorio y de la oxigenación tisular. Todo ello es debido a su tendencia a producir edema, por este exceso de agua que aporta, cuando se infunden grandes volúmenes en pacientes politraumatizados. Por otro lado, dado el empeoramiento de la microcirculación y su tendencia al edema tisular, con el consecuente empeoramiento de diversas funciones orgánicas, se están buscando variaciones a la solución de Ringer. En el mercado hay disponibles soluciones de Ringer acetato y Ringer malato, con una composición hidroelectrolítica más isoplasmática e isoosmolar. COLOIDES Son soluciones que contienen partículas de alto peso molecular en suspensión por lo que actúan como expansores plasmáticos. Estas partículas aumentan la osmolaridad plasmática por lo que retienen agua en el espacio intravascular, esto produce expansión del volumen plasmático y al mismo tiempo una hemodilución, que mejora las propiedades reológicas sanguíneas, favoreciéndose la perfusión tisular. Los efectos hemodinámicos son más duraderos y rápidos que los de las soluciones cristaloides. Están indicadas en caso de sangrado activo, pérdidas proteicas importantes o bien cuando el uso de soluciones cristaloides no consigue una expansión plasmática adecuada. En situaciones de hipovolemia suelen asociarse a los cristaloides en una proporción aproximada de 3 unidades de cristaloides por 1 de coloide. Existen coloides naturales y artificiales: A. Coloides naturales: Albúmina Es el principal determinante en el mantenimiento de la presión oncótica del plasma además de sus funciones como transportador de diversas sustancias incluyendo drogas, metales, hormonas y enzimas. Es un expansor de volumen muy efectivo, produciendo cuando se emplea al 20% un incremento de volumen cinco veces superior a la cantidad aportada. Este aumento ocurre a los 30-60 minutos y es debido a su alto poder oncótico. Se comercializa en soluciones de salino a diferentes concentraciones (5, 20 y 25%). Las soluciones de albúmina son preparadas por fraccionamiento de sangre de donantes sanos y calentada a 60º durante 10 horas lo que destruye los virus de la hepatitis y el VIH, pero pueden ser portadora de pirógenos y bacterias constituyendo un riesgo de infección. Asimismo en el proceso de pasteurización pueden formarse polímeros de albúmina muy alergénicos. Además contienen citrato, que tiene capacidad de captar calcio sérico y dar lugar a hipocalcemia con el consiguiente riesgo de alteración de la función cardiaca y renal. La alteración de la agregabilidad plaquetaria y la dilución de los factores de la coagulación aumentan el riesgo de sangrado. Por todo ello se prefiere el uso de coloides artificiales, más baratos e igual de potentes oncóticamente, con lo que estos riesgos están minimizados. Tampoco debe considerarse en el soporte nutricional dado su rápido paso al intersticio y por ser una proteína muy pobre en aminoácidos esenciales. Sin embargo, situaciones: el uso de albúmina es recomendado en diversas cirrosis y paracentesis: tras paracentesis cuantiosa (> 4 litros): 10 g de albúmina por litro de ascitis extraída 12. Hidratación - Política transfusional en UCI 4 - 12 El enfermo crítico 4. Cardiovascular síndrome nefrótico: para reposición plasmaféresis: en sesiones de alto recambio (> 20 ml/kg) situaciones de “tercer espacio”: pacientes críticos con albúmina < 2,5 g/dl. B. Coloides sintéticos 1. Dextranos: Son una mezcla de polímeros de glucosa que está disponible en dos soluciones: Dextrano 40 (peso molecular medio 40.000 Da) o Rheomacrodex y Dextrano 70 (peso molecular medio 70.000 Da) o Macrodex. Ambas fórmulas son hipertónicas respecto al plasma, siendo la duración del efecto expansor de unas 6 horas en el primer caso y 12 en el segundo. Las moléculas de peso molecular inferior a 50.000 Da son filtradas por el glomérulo y excretadas por el riñón. El resto se excreta por vía digestiva o pasan al intersticio donde son fagocitadas por las células del sistema retículo-endotelial. Los dextranos se asocian con un número considerable de efectos secundarios tales como: reacciones alérgicas, fracaso renal o diátesis hemorrágica. Las reacciones alérgicas son debidas a un mecanismo anafilactoide y aparecen en el 0,03-5% de los casos, aunque esta incidencia parece haber disminuido en los últimos años. El daño renal es más posible cuando coexiste disfunción renal previa o hipovolemia. Además la diuresis osmótica inducida puede agravar el cuadro. También poseen actividad antitrombótica por su acción sobre la hemostasia primaria (disminuyen la agregación plaquetaria) y sobre factores de la coagulación (facilitan la lisis del trombo). Otros efectos adversos comunicados son la interferencia con la determinación del grupo sanguíneo y la falsa elevación de los niveles séricos de bilirrubina y glucemia. Por todo ello, el empleo de dextranos como expansores plasmáticos no se recomienda hoy en día y sí pueden utilizarse como antiagregantes plaquetarios, especialmente cuando sólo podemos utilizar la vía intravenosa. De todas formas, no se recomienda administrar más de 20 ml/kg/día. 2. Gelatinas: Son preparados formados por la hidrólisis del colágeno bovino que resulta con un amplio rango de peso molecular. (Hemocé ) su eliminación es esencialmente renal. Su duración de acción es de unas 3-6 horas. Son ampliamente utilizados como sustitutos del plasma, produciendo una expansión de volumen de aproximadamente el 80-100% de la cantidad infundida. Se asocian con un pequeño número de efectos secundarios. No se ha comunicado fracaso renal, coagulopatía ni alteración de la determinación del grupo sanguíneo. El efecto adverso más frecuente atribuido al empleo de gelatinas es el desarrollo de reacciones anafilactoides, cuya incidencia es mal conocida, pero que se sitúa en el 0,2%, siendo, pocas de ellas graves. No está bien definida la dosis límite diaria, aunque no se recomienda superar los 2000 cc/día 3. Hidroxietilalmidón: es un polímero natural modificado de amilopectina con moléculas de tamaño heterogéneo pero con un peso molecular 12. Hidratación - Política transfusional en UCI 5 - 12 El enfermo crítico 4. Cardiovascular medio de 40.000-70.000 Da, aunque el rango es desde 10.000 hasta más de un millón. Los HEAs más recientes son moléculas de unos 200.000 Da de peso molecular. Se comercializan en soluciones al 6% de solución fisiológica (Hesteril , Elohes , Voluven ) Las moléculas de peso menor a 50.000 Da son eliminadas por vía renal. Por el contrario, aquellas de mayor peso son enzimáticamente degradadas por la amilasa en sangre, tejidos y células del sistema retículo-endotelial. Son unos excelentes expansores de volemia, ya que producen un incremento de la misma algo superior a la cantidad infundida y su duración de acción es de unas 24 horas. La dosis límite es de 20 ml/kg/día. Sus efectos secundarios son escasos, no habiéndose implicado en el desarrollo de disfunción renal, si bien se ha comprobado que se almacenan transitoriamente en el túbulo, por lo que se recomienda se evite su uso en el transplante renal. No se ha asociado definitivamente con el desarrollo de coagulopatía con traducción clínica, aunque puede provocar un descenso en el contaje de plaquetas y discreto alargamiento del tiempo de protrombina y del tiempo parcial de tromboplastina secundario a su efecto sobre la función del Factor VIII. Las reacciones anafilácticas son muy raras (0.006%) y no parecen alterar la determinación del grupo sanguíneo. Un prurito muy rebelde al tratamiento puede observarse en los casos de administración prolongada. Es importante recordar que los niveles de amilasa sérica pueden elevarse tras su uso, llegando incluso a triplicarse los valores normales, lo cual ocurre aproximadamente a las 24 horas sin incremento de la lipasa. Ello no significa que se acompañe de alteración de la función pancreática, pero sí en este contexto puede dificultar el diagnóstico de pancreatitis durante varios días. Uno de los cambios que se ha producido en los últimos años es la combinación de SSH al 7,2% con coloides tipo hidroxietilalmidón (HyperHAES ®) o con dextranos, con el objeto de aumentar la duración de los efectos beneficiosos con volúmenes muy bajos (250 ml). Posiblemente, estas combinaciones con bajos volúmenes, supongan un paso muy importante en la reanimación del paciente politraumático, al permitir la reanimación con pequeños volúmenes de fluidos, para así mantener la llamada reanimación hipotensiva, cuyo objeto final es evitar el aumento de sangrado si reponemos rápidamente las cifras tensionales. La principal indicación actual de SSH es la "small volumen resuscitation" (reanimación de pequeño volumen, reanimación con bajos volúmenes o reanimación hipotensiva o controlada) en shock hemorrágico y en el tratamiento o coadyuvante del TCE grave con hipertensión craneal. Estas maniobras de "small volumen resuscitation" no deberían usarse en pacientes con TCE o con severo compromiso de la circulación cerebral. 12. Hidratación - Política transfusional en UCI 6 - 12 El enfermo crítico 4. Cardiovascular POLÍTICA TRANSFUSIONAL EN UCI INTRODUCCIÓN La anemia representa una entidad muy frecuente en pacientes críticos. La transfusión de sangre alogénica (TSA) representa una medida rápida y eficaz en su corrección, aunque no exenta de importantes complicaciones y controversias. La TSA debe indicarse de forma individualizada en función de parámetros fisiológicos, no sólo ante cifras bajas de Hb. La aplicación de alternativas farmacológicas, reducción (en número y volumen) de las determinaciones analíticas, programas de donación autóloga y reinfusión sanguínea y el empleo de estrategias transfusionales restrictivas puede conseguir una reducción significativa de la demanda de transfusiones sanguíneas y contribuir a un uso más racional, seguro y eficiente de la TSA. LA ANEMIA EN EL PACIENTE CRÍTICO La anemia de los pacientes ingresados en Unidades de Cuidados Intensivos representa una entidad extremadamente prevalente (40-70%), constituyendo la alteración analítica más frecuente. En los enfermos críticos, la anemia presenta un origen multifactorial: anemia por enfermedad crónica (AEC), hemorragia perioperatoria, extracciones frecuentes de analíticas, hemorragia digestiva, coagulopatía, técnicas extracorpóreas, déficits nutricionales y/o férricos, hemodilución, hemólisis, fármacos que interfieren con la eritropoyesis (IECA). La anemia por enfermedad crónica representa probablemente la etiología más frecuente (hasta 50%), definida como una Hb < 13 g/dl asociada a un proceso inflamatorio (evidencia clínica o biológica). El déficit funcional de hierro, sustrato de la AEC, es consecuencia de la retención férrica en los depósitos biológicos (macrófagos del SER) y la inhibición de su absorción intestinal, reduciendo su disponibilidad para la eritropoyesis medular. Es también responsable de una alteración de la respuesta inmune en pacientes críticos, contribuyendo a una mayor duración de la respuesta inflamatoria, estancia y peor pronóstico. Las posibilidades terapéuticas en la anemia del paciente crítico pueden agruparse en: TSA, tratamiento farmacológico (estimuladores eritropoyéticos, ferroterapia, antifibrinolíticos/hemostáticos), programas de donación autóloga y/o reinfusión sanguínea, criterios transfusionales restrictivos e individualizados. TRANSFUSIÓN DE SANGRE AUTOLOGA (TSA) EN UCI Los objetivos generales del tratamiento de la anemia son minimizar los síntomas y complicaciones sistémicas asociados a la hipoxia y mejorar la calidad de vida y supervivencia. En condiciones fisiológicas la distribución de O2 (proporcional al gasto cardiaco y contenido sanguíneo de O2) es 4 veces superior al consumo. Lo cual garantiza un aporte suficiente para satisfacer las necesidades tisulares, incluso bajo condiciones de anemia (“reserva fisiológica”). Las respuestas adaptativas a la anemia incluirán cambios centrales, regionales, microcirculatorios y celulares, con incremento de la extracción tisular de O2. Habitualmente se emplea el valor de Hb como indicador tanto de la masa de hematíes como de la liberación de O2, aunque existen pocos datos en humanos que definan un valor de Hb por debajo del cual, al menos en situaciones de anemia crónica, esté comprometida la liberación de O2 y se manifieste la hipoxia tisular. Basándonos en parámetros indirectos (SO2, niveles de lactato) se considera el 12. Hidratación - Política transfusional en UCI 7 - 12 El enfermo crítico 4. Cardiovascular umbral transfusional en pacientes normovolémicos sin patología cardiovascular en torno a 7 g/dl de Hb. El trabajo de investigación de Quintana et al (2) (cuestionario en 84 UCI españolas) confirma el valor fundamentalmente orientativo de las cifras de Hb para el empleo de la TSA (tasa de TSA 20-40%) aunque la indicación parece unánime con valores de Hb < 7 g/dl (10 g/dl en caso de cardiopatía). Investigaciones recientes cuestionan la validez de la Hb como indicador universal de TSA, sugiriendo otros parámetros de consumo y oxigenación tisular como posibles indicadores fisiológicos de TSA (saturación venosa mixta, presión tisular de O2 intracerebral, índice de extracción de O2, pH de la mucosa gástrica etc.). A pesar de su empleo universal, no está claramente demostrado que la TSA mejore sistemáticamente la oxigenación tisular o el pronóstico de los pacientes anémicos. Hasta la fecha, no disponemos de estudios que apoyen firmemente el empleo de la TSA en el tratamiento de la anemia en pacientes críticos hemodinámicamente estables sin evidencia de sangrado agudo, y los datos disponibles confirman que cifras de Hb de 7-9 g/dl son bien toleradas por la mayoría de pacientes críticos sin evidencia de hemorragia aguda. Actualmente se recomienda valorar la utilización de TSA en función de parámetros fisiológicos, sin constituir el valor aislado de Hb un criterio exclusivo o suficiente. Napolitano et al (3) publicaron recientemente una guía clínica sobre TSA especialmente orientada al paciente crítico y traumático. Los autores consideran claramente indicada la TSA en enfermos con evidencia de shock hemorrágico y potencialmente indicada ante sangrados agudos asociados a inestabilidad hemodinámica o insuficiente disponibilidad de oxígeno, recomendando una estrategia transfusional restrictiva (Hb < 7 g/dl) en pacientes anémicos estables, con la posible excepción de enfermos con isquemia miocárdica (nivel 1 de recomendación). Sugieren asociar el valor de Hb al status hemodinámico, duración de la anemia y otros parámetros cardiopulmonares como indicadores de TSA (nivel 2 de recomendación). Finalmente la guía recoge una serie de medidas encaminadas a reducir las necesidades de TSA: utilidad potencial de la eritropoyetina recombinante, reducción de extracciones sanguíneas (en número y volumen) y empleo de dispositivos de reinfusión de muestras sanguíneas y recuperación perioperatoria. COMPLICACIONES ASOCIADAS A LA TSA La TSA representa una medida rápida y eficaz para restablecer los valores fisiológicos de Hb e incrementar así la capacidad transportadora de O2, especialmente útil en el contexto de anemia grave y/o hemorragia activa, pero no está exenta de importantes complicaciones: Transmisión de enfermedades infecciosas (por imposibilidad de detección viral, “periodos ventana” o nuevas infecciones emergentes) Reacciones de tipo inmune (alérgicas, hemolíticas, etc.) Reacciones no inmunes (error transfusional, sobrecarga férrica, etc.) Complicaciones cardiopulmonares y tromboembólicas Infecciones y otras complicaciones postoperatorias Prolongación de la estancia y mortalidad hospitalarias Recurrencia neoplásica, etc. 12. Hidratación - Política transfusional en UCI 8 - 12 El enfermo crítico 4. Cardiovascular 1. Complicaciones infecciosas asociadas a la TSA El riesgo de transmisión sanguínea de patógenos ha disminuido drásticamente en las últimas décadas con la introducción de técnicas de amplificación de ácidos nucleicos y otros métodos de screening. Los microorganismos potencialmente transmisibles a través de TSA incluyen: virus como VHB, VHC, VIH, VHA, parvovirus B 19, VLTH 1-2, CMV, VEB, West Nile Virus, simian foamy virus, virus del dengue, enterovirus, coronavirus y priones; bacterias como: treponema pallidum y otros géneros (staphylococcus, pseudomonas, yersinia, borrelia, serratia y enterobacter); protozoos (géneros leishmania, tripanosoma, plasmodium, toxoplasma, babesia). La incidencia de sepsis clínica secundaria a TSA se estima en 1:250.000 transfusiones, constituyendo el 14% de todas las muertes atribuidas a TSA en EE.UU. Asimismo, persiste el riesgo potencial de transmisión sanguínea de virus aún desconocidos, virus en expansión geográfica y nuevas variantes de la enfermedad de Creutfeldt- Jacob. 2. Complicaciones no infecciosas asociadas a la TSA Representan el grupo de efectos adversos más frecuentes tras TSA: Reacciones inmunes: reacciones hemolíticas, reacciones febriles, reacciones alérgicas, púrpura postransfusional, efecto injerto contra huésped, aloinmunización, efectos TRALI y TRIM. Complicaciones no inmunes: error transfusional, sobrecarga férrica, desequilibrios metabólicos y efecto TACO. El error en la administración de componentes sanguíneos es la más frecuente de las complicaciones no infecciosas asociadas a TSA, seguida por la reacción alérgica aguda, los eventos relacionados con Ig anti-D y las reacciones hemolíticas. El resto de los mecanismos no infecciosos por los cuales la TSA incrementa las complicaciones y mortalidad son diversos, pero destacan la producción de lesión pulmonar aguda (TRALI) el efecto inmunosupresor (TRIM), la sobrecarga circulatoria (TACO) y las alteraciones de la microcirculación. TRALI (transfusion-related acute lung injury): Constituye un efecto adverso grave de etiología incierta y representa uno de los principales responsables de la yatrogenia postransfusional. Frecuentemente infradiagnosticado, actualmente se considera la complicación mas frecuente y grave asociada a TSA. Se caracteriza por lesión pulmonar aguda asociada a edema pulmonar bilateral no cardiogénico, hipoxemia, disnea, taquipnea, cianosis, hipotensión y fiebre; aparece en las primeras horas después de un TSA, pudiendo considerarse una forma particular de SDRA. Anticuerpos antiHLA y antigranulocitos, lípidos reactivos y citocinas del donante frente a leucocitos del receptor han sido propuestos como agentes etiológicos, estimulando la liberación de oxidasas, mediadores inflamatorios y complemento, alterando la permeabilidad e integridad de la microcirculación pulmonar y desencadenando el efecto TRALI. Su incidencia se estima en 1:4.000-1:8.000 transfusiones, con una mortalidad global asociada del 5-25%. Precisa tratamiento conservador (oxígeno, fluidoterapia intravenosa) y ocasionalmente, ventilación mecánica y otras maniobras invasivas. 12. Hidratación - Política transfusional en UCI 9 - 12 El enfermo crítico 4. Cardiovascular TRIM (transfusion-related immunomodulation) El efecto TRIM constituye un estado de inmunosupresión vinculado a la TSA que se asocia a una mayor incidencia de neumonía, infección urinaria, mediastinitis, sepsis, infección postoperatoria, reactivación de virus latentes y tras cirugía oncológica, a un aumento de la recurrencia neoplásica. Las sustancias vasoactivas liberadas por los leucocitos y linfocitos transfundidos podrían ser responsables de este efecto inmunomodulador, asociado a una infrarregulación de la inmunidad celular y una suprarregulación de la inmunidad humoral. Un tiempo de almacenamiento prolongado de las bolsas de concentrados de hematíes (“lesión por almacenamiento”) podría implicar el deterioro morfológico y funcional de los eritrocitos, con cambios deletéreos en su vida media y afinidad por el oxígeno y capacidad para favorecer la vasoconstricción, lesión endotelial, isquemia tisular y presumiblemente, la infección. Varios estudios observacionales evidencian una asociación entre TSA almacenada >2-3 semanas y la aparición de complicaciones postoperatorias, estancia hospitalaria y/o mortalidad a corto/largo plazo. TACO (transfusion-associated circulatory overload) La sobrecarga circulatoria secundaria a TSA o TACO es secundaria a una alteración del gradiente hidrostático alveolocapilar por sobrecarga de volumen, con una incidencia estimada del 1-11% y un amplio espectro de síntomas, resultando especialmente vulnerables aquellos pacientes con patología cardiopulmonar, insuficiencia renal y niños. ALTERNATIVAS A LA TSA La recuperación de las cifras de Hb por medios distintos a la TSA contribuiría a la mejoría clínica del paciente y a la reducción de complicaciones y mortalidad, evitando transfusiones innecesarias en muchos casos. La administración de hierro (oral o parenteral) y agentes estimuladores de la eritropoyesis (ESA) representan las 2 medidas farmacológicas más empleadas como alternativas eficaces a la TSA. Asimismo, los programas de donación autóloga preoperatoria y el empleo de fármacos antifibrinolíticos y hemostáticos han conseguido reducir eficazmente la necesidad de TSA en múltiples disciplinas quirúrgicas (en asociación con ESA y/o ferroterapia adyuvantes). Agentes estimuladores de la eritropoyesis (ESA) La EPO humana es un polipéptido de 165 aminoácidos sintetizado principalmente en las células peritubulares del intersticio renal en respuesta al descenso del Hto, hipoxemia y/o incremento en la afinidad de la Hb por el O2. Constituye la principal hormona reguladora de la eritropoyesis medular. Distintos tipos de EPO exógena recombinante (rHuEPO), darbepoetina alfa, y metoxi polietilenglicol epoetina beta (CERA o activador continuo del receptor de la EPO) constituyen los principales agentes eritropoyéticos disponibles en el mercado. A pesar de una disminución cualitativa y cuantitativa de la eritropoyesis en pacientes críticos, la médula ósea puede responder a la administración de ESA. Sin embargo los datos disponibles sobre la utilidad de los ESA en pacientes críticos resultan contradictorios. Los primeros ensayos clínicos sobre el uso de ESA en pacientes críticos demostraron una disminución significativa de las necesidades transfusionales en pacientes tratados con ESA, sin diferencias en términos de morbilidad y mortalidad. 12. Hidratación - Política transfusional en UCI 10 - 12 El enfermo crítico 4. Cardiovascular Corwin et al (4) comprobaron posteriormente en un ensayo clínico multicéntrico con 1460 pacientes críticos que la administración de epoetina alfa (40.000 UI/ semana, asociada a hierro) no reducía las necesidades transfusionales ni la mortalidad, excepto en el subgrupo de pacientes traumáticos que recibieron ESA. El metaanálisis de Zarychanski et al (5) sobre el uso de rHuEPO en 3326 pacientes críticos (epoetina alfa, mayoritariamente a dosis de 40.000 UI/ semana) evidenció una pequeña reducción en el número de transfusiones respecto al grupo de control, sin impacto sobre la mortalidad, estancia hospitalaria, tiempo en UCI o necesidad de ventilación mecánica, por lo que los autores no recomiendan el uso rutinario de ESA en pacientes críticos. Es posible que una cuidadosa selección de los pacientes y un uso juicioso de los tratamientos coadyuvantes consiga optimizar el tratamiento con ESA en pacientes críticos. Ferroterapia Los pacientes críticos presentan un déficit funcional de hierro (DFH) difícilmente corregible con ferroterapia oral. La eritropoyesis inadecuada y la alteración inmunitaria asociadas al DFH pueden beneficiarse de la administración de hierro parenteral, contribuyendo así a un descenso de las necesidades transfusionales y a una potencial reducción de la estancia, parámetros inflamatorios y morbimortalidad (aunque su relación riesgo/beneficio no está claramente definida). El estudio de Van Iperen et al (6) evidenció una tendencia a la reducción de las necesidades transfusionales, respuesta inflamatoria y mortalidad en pacientes críticos con anemia que recibieron hierro sacarosa endovenoso (sólo o asociado a ESA). Georgopoulos et al (7) comprobaron un descenso en el porcentaje de transfusiones (y en el número de concentrados empleados) en un grupo de enfermos críticos mediante la administración de hierro endovenoso asociado a ESA (efecto dosis de ESA dependiente), aunque sin efecto en la estancia en UCI ni en la mortalidad. El trabajo de revisión de Muñoz et al (8) propone una dosis de 50 mg/d (100 mg/d en caso de pacientes sangrantes y/o estimulados por ESA) para cubrir las necesidades eritropoyéticas en pacientes críticos. Otras alternativas En el ámbito quirúrgico, aparte de los programas de donación autóloga y sistemas cell-savers, disponemos de sustancias antifibrinolíticas y hemostáticas para el manejo de la hemorragia perioperatoria y reducción de las necesidades transfusionales, como aprotinina, desmopresina, ácido ε-aminocaproico, ácido tranexámico, factor VII recombinante activado, con eficacia demostrada en cirugía cardiaca, digestiva y ortopédica, entre otras. Aprotinina ejerce un efecto antifibrinolítico que a pesar de haber demostrado su eficacia en cirugía cardiaca y otras especialidades quirúrgicas, su comercialización ha sido suspendida a raíz de un ensayo clínico randomizado multicéntrico que evidenció un incremento de la mortalidad en pacientes sometidos a cirugía cardiaca que recibieron aprotinina. Desmopresina, análogo de la hormona antidiurética, ejerce su efecto hemostático incrementando tanto las concentraciones plasmáticas de factor VIII y de Von Willebrand como la adhesión plaquetaria. Su posible beneficio en el paciente crítico no está aún esclarecido. Acido ε-aminocaproico y ácido tranexámico poseen acción antifibrinolítica al inhibir tanto la plasmina como la activación del plasminógeno, con eficacia demostrada en la reducción de pérdidas hemorrágicas y necesidades transfusionales en disciplinas quirúrgicas. El estudio CRASH-2 (estudio aleatorizado, controlado con placebo y doble ciego), 12. Hidratación - Política transfusional en UCI 11 - 12 El enfermo crítico 4. Cardiovascular ha concluido, tras incluir a 20.211 traumatizados, que el ácido tranexámico reduce significativamente la mortalidad, tanto global como la específicamente ligada a la pérdida sanguínea severa. Factor VII recombinante activado: su administración constituye una alternativa especialmente útil para reducir el sangrado y/o los requerimientos transfusionales en diversos procedimientos médicos o quirúrgicos que cursan con hemorragia masiva no controlada con los métodos convencionales. Soluciones artificiales transportadoras de oxígeno (emulsiones de fluorocarbonados y soluciones de Hb artificial) representan prometedoras líneas de investigación en terapia de sustitución sanguínea, aunque los entusiastas resultados iniciales han sido frenados por recientes estudios que suscitan dudas sobre su seguridad, efectos adversos y eficacia clínica. 12. Hidratación - Política transfusional en UCI 12 - 12