1 HORMONA FOLICULOEsTIMULANTE
Anuncio

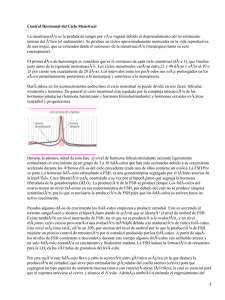
1 HORMONA FOLICULOEsTIMULANTE J. Herrero, A. Bernabeu y A. Voskuilen Puntos clave • La hormona foliculoestimulante (FSH) es una gonadotropina de origen hipofisario que actúa sobre las células de la granulosa ovárica. • Su función principal es el reclutamiento, el desarrollo y la maduración folicular. • El tratamiento exógeno con FSH permite el desarrollo de múltiples folículos en un único ciclo de reproducción asistida. • Existen diferentes preparados de FSH en el mercado, con características diferentes entre ellos. En términos generales, podemos diferenciar la FSH de origen urinario y la FSH recombinante. • Existen diversos estudios que han comparado la eficacia entre los distintos tipos de FSH comercializadas, con resultados heterogéneos. La revisión de la Cochrane 2011 homogeneizó los resultados. • Tradicionalmente, el tratamiento de primera línea de las pacientes con síndrome de ovario poliquístico (SOP) es mediante citrato de clomifeno. Actualmente, se plantea iniciar la estimulación ovárica mediante dosis bajas de FSH en aquellas mujeres con SOP y peor pronóstico. • A pesar de factores pronósticos bien estudiados en la respuesta al tratamiento con gonadotropinas, existen pacientes con respuestas más bajas a las predecibles. Estas variaciones parecen deberse a la variabilidad genética individual. • La variación genética más estudiada a día de hoy en relación a la diferente respuesta al tratamiento con FSH son los polimorfismos en el receptor de la FSH. • La farmacogenética abre nuevas puertas al tratamiento con gonadotropinas individualizando y adaptando las terapias. Farmacoterapia en Medicina de la Reproducción. SEF ©2015. Editorial Médica Panamericana. 2 farmacoterapia en medicina de la reproducción. Manual práctico INTRODUCCIÓN Existen diferentes tipos de hormona foliculoestimulante (FSH) en la industria farmacológica. La gonadotropina más antigua que continúa utilizándose, la gonadotropina menopáusica humana (hMG), se obtuvo en los años 70 del pasado siglo. Se recoge de la orina de mujeres menopáusicas. Se trata de una combinación de FSH y hormona luteinizante (LH) en una proporción de 1:1. Posteriormente fueron apareciendo otras gonadotropinas también de origen urinario, como la FSH purificada (FSH-P) y la FSH altamente purificada (FSH-HP). El desarrollo de la tecnología recombinante de ADN permitió la síntesis de una FSH recombinante (rFSH), que presenta las ventajas de ser un preparado de gran pureza, con una menor variabilidad interproducto y libre de todo contaminante proteínico, lo que la hace menos inmunogénica. El último preparado de gonadotropina recombinante en el mercado es la FSH de acción prolongada: la corifolitropina alfa (FSH-CPT), de la que se hablará en otro capítulo. En la tabla 1-1 podemos ver los distintos preparados con acción FSH comercializados tanto en España como en otros países junto con sus nombres comerciales. La rFSH presenta una mayor potencia biológica, una mayor homogeneidad interproducto y una ausencia de productos proteínicos, resultando menos inmunogénica y evitando la posible transmisión por priones. Tabla 1-1. Preparados comerciales con hormonas foliculoestimulantes hMG FSHu HP AlfaFSH recombinante Pergonal® 500 mg hMG-Lepori® 75 UI Fostipur® 75, 150 UI Bravelle ®75 UI Gonal F® pluma precargable (300, 450 o 900 UI) o viales (75 o 1.050 UI) hMG-HP BetaFSH recombinante Menopur®, 75, 600, 1.200 UI Puregon® pluma precargable (300, 600 o 900 UI) o viales (100 o 200 UI) Coriofolitropina alfa Elonva® 100 y 150 mg Productos comercializados en otros países, fuera de España: HMG: Merapur®, Repronex®, HMG massone®, Menogon®, Humegon® FsHu: Metrodin®, Fertinex®, Follistim® Farmacoterapia en Medicina de la Reproducción. SEF ©2015. Editorial Médica Panamericana. 1. Hormona FOLICULOESTIMULANTE 3 FARMACOLOGÍA Síntesis Existen tres tipos de gonadotropinas: FSH, LH y gonadotropina coriónica humana (hCG). Las dos primeras se sintetizan en la adenohipófisis, mientras que la hCG se sintetiza en el sincitiotrofoblástico placentario. Todas ellas están formadas por una cadena alfa y otra beta. La cadena alfa es común para las tres, mientras que la cadena beta es que la proporciona la especificidad en la función de cada una de ellas. Mecanismo de acción La secreción pulsátil de la hormona liberadora de gonadotropinas (GnRH) hipotalámica libera la FSH desde la adenohipófisis al torrente circulatorio. Ésta se une a sus receptores, situados en la célula de la granulosa ovárica. Los receptores de la FSH son polipéptidos de tipo G, de modo que al unirse la FSH a su receptor activa la adenilatociclasa y la proteína-cinasa dependiente de AMPc. También puede ejercer su función mediante la activación de la fosfolipasa C. Farmacodinámica La FSH únicamente puede absorberse por vía parenteral. La vida media de la FSH inyectada por vía intravenosa es de dos horas y de 35 horas si se administra por vía intramuscular. Las concentraciones de FSH en sangre se determinan mediante técnicas de inmunoensayo y / o quimioluminiscencia. Acción farmacológica La función de la FSH es la del desarrollo folicular, estimulando el crecimiento y la evolución de los folículos antrales a folículos maduros, capaces de poder ser fecundados. Este desarrollo folicular se realiza mediante varios procesos: • Conversión de estrógenos a partir de andrógenos por la activación del citocromo P450. • Adquisición de la cavidad antral. • Inducción de receptores de la LH en la granulosa. • Activación de enzimas sintetizadoras de progesterona. Farmacoterapia en Medicina de la Reproducción. SEF ©2015. Editorial Médica Panamericana. 4 farmacoterapia en medicina de la reproducción. Manual práctico La FSH es la hormona encargada del desarrollo folicular. Se sintetiza en la adenohipófisis y se une a su receptor en las células de la granulosa ovárica. TIPOs DE HORMONAs FOLICULOEsTIMULANTEs Gonadotropinas humanas Los primeros embarazos obtenidos a partir de la inducción de la ovulación con hMG fueron documentados por Lunenfeld et al. en 1962. Mediante técnicas de purificación se obtuvieron gonadotropinas humanas urinarias: la FSH purificada (FSH-P) y la FSH altamente purificada (FSH-HP). La FSH-P tiene una actividad en relación a la LH de un ratio de 150:1, y la FSH-HP menos de un 0,1 % de actividad luteotrófica. Gonadotropinas recombinantes La rFSH es la gonadotropina con mayor potencia biológica, con una pureza en la actividad foliculoestimulante del 100 %. Las ventajas de la rFSH son, además de la mayor potencia biológica, la mayor homogeneidad en la eficacia por producto –que permite la comparación de tratamientos intra e interpaciente– y la ausencia de productos antigénicos en comparación a la teórica existencia de éstos en las gonadotropinas urinarias. FARMACOCINÉTICA En la tabla 1-2 podemos ver los datos más relevantes de la farmacocinética de las FSH urinaria y recombinante y sus diferencias. DOsIs DE ADMINIsTRACIÓN La dosis y la duración del tratamiento con gonadotropinas varían en función de la paciente, e incluso en ocasiones también en distintos ciclos de estimulación de la misma paciente. Existen diferentes parámetros clínicos y analíticos asociados a la respuesta folicular, aunque el mejor factor predictor es la respuesta previa de la paciente en un ciclo de estimulación ovárica. La dosis de FSH requeridas en el tratamiento de un ciclo de estimulación ovárica previo es el mejor factor predictor de los requerimientos de FSH de una paciente en los siguientes ciclos. Farmacoterapia en Medicina de la Reproducción. SEF ©2015. Editorial Médica Panamericana. 1. Hormona FOLICULOESTIMULANTE 5 Los parámetros asociados a la respuesta folicular y, por tanto, a las dosis de gonadotropinas requeridas más ampliamente consensuados son: la edad, el índice de masa muscular, el recuento de folículos antrales, la FSH basal y la hormona antimülleriana (AMH). La edad es el factor individual más determinante de la respuesta folicular. Los distintos grupos de trabajo ajustan el inicio de dosis de gonadotropinas según sus propios criterios generando puntuaciones que clasifican a las pacientes en diferentes categorías, pero sin existir hasta el día de hoy un convenio estandarizado. Agrupando a las pacientes en tres categorías, como las respondedoras altas, las respondedoras normales o las respondedoras bajas, podemos realizar una aproximación de las dosis requeridas (Tabla 1-3). Tabla 1-2. Farmacocinética de la hormona foliculoestimulante urinaria y recombinante rFSH uFSH Vía parenteral Vía parenteral Absorción ligeramente mayor que con la uFSH Absorción Absorción más rápida vía subcutánea (TMáx 16 h) que i.m. (TMáx 25 h) Tiempo de vida media Eliminación Si administración i.m.: 35-40 h Si administración i.v.: 2 h 10 % renal 20 % renal Resto hepática Resto hepática El tiempo de eliminación es más variable entre individuos si se trata de intramuscular o subcutánea que con administración endovenosa. No difiere significativamente entre preparados TMáx: tiempo en el que se consigue la máxima concentración; rFSH: hormona foliculoestimulante recombinante; uFSH: hormona foliculoestimulante urinaria Tabla 1-3. Dosis iniciales recomendables de hormona foliculoestimulante para inseminación artificial y FIV / ICSI Categoría paciente Inseminación artificial FIV / ICSI Respondedoras bajas 75-150 UI 300 UI Respondedoras normales 50-75 UI 225 UI Respondedoras altas 25-50 UI 75-150 UI Streda R et al., 2012; La Marca A et al., 2012. FIV / ICSI: fecundación in vitro / inyección espermática intracitoplasmática. Farmacoterapia en Medicina de la Reproducción. SEF ©2015. Editorial Médica Panamericana. 6 farmacoterapia en medicina de la reproducción. Manual práctico UTILIDADES CLÍNICAS DE LA HORMONA FOLICULOESTIMULANTE Ciclos de técnicas de reproducción asistida Comparativa entre los distintos tipos de gonadotropinas Como se ha comentado anteriormente, existen diversos tipos de FSH en el mercado. Tras la aparición de la rFSH, aparecieron varios estudios comparativos entre ésta y los anteriores preparados de origen urinario: hMG, FSH-P y FSH-HP. Los distintos estudios iniciales mostraron resultados contradictorios en cuanto a la tasa de recién nacidos y el número de ovocitos obtenidos. Posiblemente, la causa de esta heterogeneidad se deba a los diferentes criterios, la dosis de administración y los protocolos terapéuticos entre los grupos de investigación, que hace difícil la comparación interestudio. Antes de la revisión de la Cochrane de 2011 se realizaron varias revisiones sistemáticas junto con un informe de la Health Technology Assessment. Éstas compararon diferentes estratégicas terapéuticas: rFSH frente a FSH urinaria, rFSH frente gonadotropinas urinarias (hMG, FSH-P, FSH-HP juntas) y rFSH frente a hMG. La primera revisión que comparó la rFSH (folitropina alfa y beta) frente a la FSH fue la de Daya et al. en 1998, ampliada posteriormente a la de Daya et al. en 2002. En esta última revisión se incluyeron ocho ensayos clínicos. Los resultados en cuanto a la tasa de éxito entre ambas fue semejante, si bien al analizar el subgrupo de las pacientes tratadas con folitropina alfa se observaron mayores tasas de embarazo en dicho grupo en comparación a la uFSH, de modo que las pacientes tratadas con folitropina alfa presentaron un embarazo más por cada 19 embarazos conseguidos con la uFSH. También se observaron unos menores requerimientos de dosis con la folitropina alfa frente a la uFSH. La revisión de Al-Inany et al. de 2003 comparó la uFSH con la hMG, la FSH-P y la FSH-HP en los ciclos de técnicas de reproducción asistida (TRA) mediante protocolo largo con análogos de la GnRH. En dicha revisión se incluyeron un total de 20 ensayos clínicos. No se mostraron diferencias estadísticamente significativas en relación a la tasa de embarazo con la rFSH frente a la hMG (OR 0,81; IC 95 % 0,63-1,05); FSH-P (OR 1,24, IC 95 % 0,98-1,58); FSH-HP (OR 1,14; IC 95 % 0,94-1,40). Al realizar la comparación de la rFSH en relación al conjunto de las gonadotropinas urinarias (hMG, FSH-P, FSH-HP) tampoco se observaron diferencias en la Farmacoterapia en Medicina de la Reproducción. SEF ©2015. Editorial Médica Panamericana. 1. Hormona FOLICULOESTIMULANTE 7 tasa de gestación por ciclo de fecundación in vitro / inyección espermática intracitoplasmática (FIV / ICSI) iniciado (OR 1,07; IC 95 % 0,94-1,22). En 2003 Van Wely et al. realizaron una revisión comparando la rFSH con la hMG en diferentes protocolos de FIV / ICSI: protocolo corto con descenso, protocolo largo con descenso y protocolo sin descenso. No existieron diferencias entre la rFSH y la hMG en ninguno de los protocolos descritos en cuanto a la tasa de gestación ni en recién nacido vivo, si bien en el grupo de pacientes en protocolo largo con descenso se mostró una diferencia estadísticamente límite a favor de la hMG en relación a la tasa de embarazo clínico por paciente, con una OR de 1,28 (IC 95 % 1,00-1,64). Debido a dicho resultado límite, en 2007 se publicó la revisión de Coomarasamy et al. en la que se comparó la rFSH con la hMG únicamente en los protocolos largos con análogos de la GnRH con descenso, incluyéndose en dicha revisión siete ensayos. Los resultados en cuanto a la tasa de recién nacido vivo y la tasa de gestación fue superior en el grupo de pacientes tratadas con hMG con un RR=1,18 (IC 95 % 1,02-1,38) y un RR=1,17 (IC 95 % 1,03-1,34) respectivamente. Finalmente, en 2011 la Cochrane realizó una revisión que buscaba homogeneizar los resultados previos, comparando la rSFH con los tres tipos principales de gonadotropinas urinarias (hMG, FSH-P, FSH-HP), incluyéndose en dicha revisión 42 ensayos clínicos con un total de 9.606 pacientes. Se analizaron todas las TRA independientemente del protocolo de inducción utilizado (protocolo corto, largo con análogos de la GnRH, etc.). La tasa de nacidos vivos fue semejante entre ambos grupos de pacientes con una OD de 0,97 (IC del 95 % 0,87-1,08), así como el porcentaje de síndrome de hiperestimulación ovárica con una OD del 1,18 (IC del 95 % 0,86-1,61). Al subanalizar los resultados por tipo de gonadotropina urinaria sí se aportó una tasa de recién nacido vivo mayor en el grupo de las pacientes tratadas con hMG altamente purificada (hMG-HP) y hMG en comparación a la rFSH, siendo estas diferencias pequeñas. No existieron diferencias en tasa de recién nacidos vivos y embarazo clínico entre la rFSH y las gonadotropinas urinarias en los ciclos de embriones congelados. La alta potencia estadística y la correcta calidad de estos resultados no hace necesaria la recomendación de otro estudio comparativo, de modo que la elección de un tipo u otro de gonadotropina dependerá de las decisiones individuales del clínico. Farmacoterapia en Medicina de la Reproducción. SEF ©2015. Editorial Médica Panamericana. 8 farmacoterapia en medicina de la reproducción. Manual práctico No existen diferencias estadísticamente significativas entre el uso de uFSH y rFSH tanto en los ciclos en fresco como en ciclos con embriones congelados. El uso de rFSH o uFSH dependerá de la elección individual del clínico. Gonadotropinas en pacientes con síndrome de ovario poliquístico Un caso particular lo representan las pacientes con diagnóstico de síndrome de ovario poliquístico (SOP). El SOP supone la endocrinopatía más frecuente de la mujer en edad fértil, con una prevalencia estimada que oscila entre el 4 y el 8 %. En este tipo de pacientes, el protocolo de inducción más frecuentemente utilizado es mediante dosis bajas de gonadotropinas en aumento y descenso progresivos con tal de disminuir el riesgo de síndrome de hiperestimulación ovárica y de gestación múltiple, más frecuente en estas mujeres. Varios estudios han comparado los distintos tipos de gonadotropinas utilizadas en las pacientes con SOP: • Sagle et al. compararon en 1991 la hMG frente a la uFSH en pauta lenta, sin demostrar diferencias estadísticamente significativas entre ambas. Ello indicaba que posiblemente el éxito en el tratamiento se debiera más al tipo de protocolo de inducción realizado (pauta lenta) que al tipo de gonadotropina utilizada. Coelingh et al. no demostraron en 1998 diferencias entre la rFSH y la uFSH en cuanto a la tasa de gestación y la ovulación, aunque sí requirieron de menores dosis y de menos días de tratamiento en las pacientes tratadas con rFSH. • Finalmente, la revisión de la Cochrane 2000 no demostró diferencias estadísticamente significativas entre la rFSH y la uFSH en relación a la tasa de ovulación por paciente, la tasa de embarazo, la tasa de aborto por embarazo, la tasa de embarazo múltiple por embarazo, el síndrome de hiperestimulación ovárica, ni otras variables como la dosis de gonadotropina requerida, la duración promedio de la estimulación ovárica, el número de folículos el día de la administración de la hCG y el nivel de estradiol el día de la administración de la hCG. Tampoco se han demostrado diferencias entre los tratamientos con rFSH o uFSH en las pacientes con SOP. Farmacoterapia en Medicina de la Reproducción. SEF ©2015. Editorial Médica Panamericana. 1. Hormona FOLICULOESTIMULANTE 9 Debido al alto porcentaje de pacientes con SOP resistentes al tratamiento con citrato de clomifeno (CC; mujeres que continúan con ciclos anovulatorios a pesar del tratamiento con dosis máximas de CC) y de pacientes que no responden al CC (imposibilidad de gestación a pesar de ciclos ovulatorios con CC durante seis meses), podría plantearse la posibilidad de tratamiento de primera línea mediante estimulación con gonadotropinas, especialmente en aquellas mujeres de más edad. R. Homburg et al. realizaron en 2012 el primer estudio que comparó ambos protocolos como primera línea terapéutica en las pacientes con SOP, demostrando mejores resultados reproductivos tras el tratamiento con bajas dosis de FSH con respecto al CC. Se evidenciaron mejores tasas con FSH frente a CC en relación a la tasa de gestación por paciente (44 % frente al 58 %, p=0,03), gestación evolutiva por paciente (39 % frente al 52 %, p=0,04) y gestación clínica por ciclo (54 % frente al 26,4 %, p=0,008). Deberían realizarse más estudios que compararan ambos protocolos terapéuticos como primera línea, así como valorar el coste-efectividad de dichas estrategias, teniendo en cuenta que el CC es más cómodo para la paciente al ser administrado por vía oral. Podría valorarse, en función de los resultados, iniciar el tratamiento directamente con gonodotrofinas en mujeres de más edad, ya que son las pacientes de peor pronóstico reproductivo. En las mujeres añosas con SOP el uso de dosis bajas de FSH podría utilizarse como tratamiento de elección, aunque son recomendables más estudios comparativos entre el CC y dosis bajas de FSH como primera línea terapéutica en estas mujeres. MARCADOREs DE ÉXITO EN TÉCNICAs DE REPRODUCCIÓN AsIsTIDA Históricamente se han propuesto diversos marcadores predictores del éxito de las TRA, tales como la edad, la reserva ovárica, el estado hormonal y el hábito tabáquico. A pesar de dichos marcadores, la respuesta ovárica a la FSH presenta una variabilidad interindividual no desdeñable. Aproximadamente el 9-24 % de las mujeres en un ciclo de FIV responden menos de lo que se esperaría según los factores pronósticos descritos. Además de las variables clínicas, la variabilidad genética jugaría un papel importante en cuanto a la respuesta terapéutica a la estimulación ovárica con gonadotropinas. Farmacoterapia en Medicina de la Reproducción. SEF ©2015. Editorial Médica Panamericana. 10 farmacoterapia en medicina de la reproducción. Manual práctico Existen varios marcadores pronósticos en los resultados de un ciclo de TRA; sin embargo, un porcentaje no desdeñable de pacientes presentan respuestas menores a las esperables. Probablemente la causa de esta heterogeneidad se deba a la variabilidad genética en la respuesta al tratamiento con FSH. La farmacogenética resultaría útil para el ajuste del tratamiento, individualizando y optimizando al máximo las terapias y evitando la cancelación de ciclos e hiperestimulaciones ováricas. La FSH y su receptor (FSH-R) son los dos elementos más importantes en la foliculogénesis y la regulación de la esteroidogénesis ovárica. El polimorfismo más frecuentemente implicado es la combinación alélica de T307-N680 y A307-S680. Las pacientes con el alelo S680 requieren una mayor cantidad de FSH exógena para el desarrollo folicular. El polimorfismo del gen del FSH-R en la posición 680 está asociado a diferentes respuestas en la estimulación ovárica (Tabla 1-4). El genotipado del gen del FSH-R podría ser un factor importante para el pronóstico de los ciclos de estimulación ovárica, pudiéndose utilizar como factor pronóstico asociado a otros marcadores, identificando a aquellas pacientes respondedoras bajas que requieran mayores dosis de FSH y / o protocolos terapéuticos diferentes para el desarrollo folicular en un ciclo de TRA. Tabla 1-4. Diferencias en los parámetros de la estimulación ovárica en función de los polimorfismos del receptor de FsH ss Ns NN (homoci(heteroci- (no poli- p valor gotas para gotas para morfismo ajustado s680) s680) s680) Días de duración para desarrollo folicular 11,8 ± 1,3 11,3 ± 1,3 11,4 ± 1,6 < 0,001 (días) 2.149,5 2.023,5 1.098 Dosis de gonadotrofi± ± ± < 0,001 nas requeridas (UI) 552,3 490,1 639,4 Número de ovocitos obtenidos (nº) 19,8 ± 8,9 18,5 ± 8,2 21,5 ± 9,2 < 0,001 Lledo B et al., 2013. Farmacoterapia en Medicina de la Reproducción. SEF ©2015. Editorial Médica Panamericana. 1. Hormona FOLICULOESTIMULANTE 11 Las alteraciones genéticas mayormente relacionadas hasta el día de hoy con la heterogeneidad en la respuesta al tratamiento con gonadotropinas se relacionan con el receptor en la FSH. El genotipado del gen del FSH-R podría ser una herramienta útil para el tratamiento individualizado, evitando el síndrome de hiperestimulación ovárica y las cancelaciones de ciclos. CONCLUsIONEs Existen diferentes tipos de gonadotropinas en el mercado, urinarias y recombinantes, presentando ambas igual tasa de eficacia. La decisión de la elección entre una u otra dependerá de los criterios individuales del clínico, que tendrá en cuenta la relación coste-beneficio. En las pacientes con SOP tampoco se han demostrado diferencias en los resultados reproductivos entre la uFSH y la rFSH. En aquellas pacientes con SOP y mal pronóstico reproductivo (edad avanzada) se podría plantear como primera línea terapéutica para estimulación ovárica el uso de gonadotropinas frente a CC. La tendencia actual nos lleva a personalizar al máximo la cantidad de gonadotropinas iniciales a administrar según diferentes parámetros predictores de respuesta ovárica. La existencia de polimorfismos genéticos se ha asociado a la variabilidad en la respuesta folicular, en especial los polimorfismos en el gen del R-FSH. No existe el biomarcador predictor de respuesta ovárica ideal. La farmacogenética podría ser útil para la individualización del pronóstico y el tratamiento en los ciclos de estimulación. BIBLIOGRAFÍA Alviggi C, Humaidan P, Ezcurra D. Hormonal, functional and genetic biomarkers in controlled ovarian stimulation: tools for matching patients and protocols. Reprod Biol Endocrinol 2012 Feb 6;10:9. doi: 10.1186 / 1477-7827-10-9. Bayram N, van Wely M, van der Veen F. FSH recombinante versus gonadotropinas urinarias o FSH recombinante para la inducción de la ovulación en la subfertilidad asociada a síndrome de ovario poliquístico (Revisión Cochrane traducida). En: La Biblioteca Cochrane Plus, 2008, Número 4. Oxford: Update Software Ltd. Disponible en: http://www.update-software.com. (Traducida de The Cochrane Library, 2008 Issue 3. Chichester, UK: John Wiley & Sons, Ltd.) Farmacoterapia en Medicina de la Reproducción. SEF ©2015. Editorial Médica Panamericana. 12 farmacoterapia en medicina de la reproducción. Manual práctico Bouloux P.M.G. et al. First human exposure to FSH-CPT en hypogonadotrophic hypogonadal males. Hum Reprod Vol. 16, 2001, No.8; 1592-1597. Broekmans FJ, Kwee J, Hendriks DJ, Mol BW, Lambalk CB. A systematic review of tests predicting ovarian reserve and IVF outcome. Hum Reprod Update 2006 Nov-Dec;12(6):685-718. Epub 2006 Aug 4. http://www.emea.europa.eu. La Marca A, Papaleo E, Grisendi V, Argento C, Giulini S, Volpe A. Development of a normogram base don markers of ovarian reserve for the individualization of the follicle-stimulating hormone starting dose in invitro fertilization cycles. BJOG 2012;119:1171-1179. Lledo B, Guerrero J, Turienzo, Ortiz JA, Morales R, Ten J, Llacer J, Bernabeu R. Effect of follicle-stimulating hormone receptor N680S polymorphism on the efficacy of follicle-stimulating hormone stimulation on donor ovarian response Pharmacogenetics and Genomics 2013, Vol 00 No 00. Lunenfeld B. Historical perspectives in gonadotrophin therapy. Human Reproduction Update, Vol.10, No.6, 2004; 453-467. Streda R, Mardesic T, Sobotka V, Koryntova D, Hybnerova L, Jindra M. Comparison of different starting gonadotropin doses (50, 75 and 100 IU daily) for ovulation induction combined with intrauterine insemination. Arch Gynecol Obstet 2012 October; 286(4): 1055-1059. Sykes D, Out HJ, Palmer SJ, van Loon J. The cost-effectiveness of IVF in the UK: a comparison of three gonadotrophin treatments. Hum Reprod 2001 Dec;16(12):2557-62. Van Wely M, Kwan I, Burt A, Thomas J, Vail A, Van der Veen F, Al-Inany H. Gonadotropina urinaria versus recombinante para la estimulación ovárica en los ciclos de tecnología reproductiva asistida (Revision Cochrane traducida). Cochrane Database of Systematic Reviews 2011 Issue 2. Art. No.: CD005354. doi: 10.1002/14651858.CD005354. Farmacoterapia en Medicina de la Reproducción. SEF ©2015. Editorial Médica Panamericana.