FORMULACIÓN-TEORIA
Anuncio
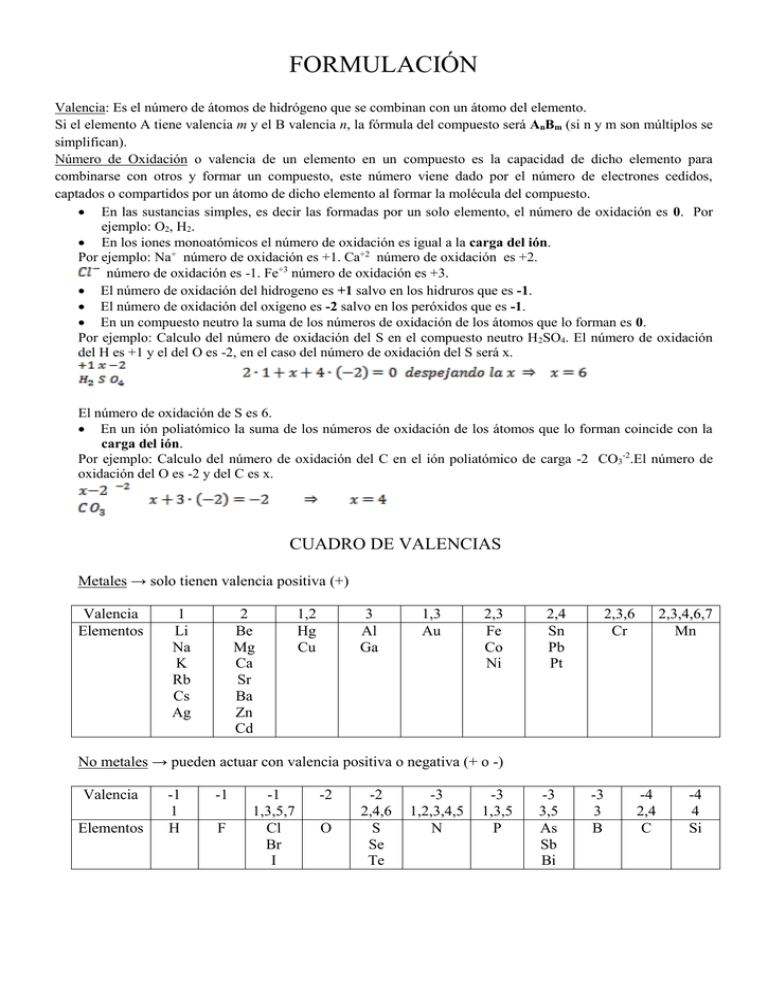
FORMULACIÓN Valencia: Es el número de átomos de hidrógeno que se combinan con un átomo del elemento. Si el elemento A tiene valencia m y el B valencia n, la fórmula del compuesto será AnBm (si n y m son múltiplos se simplifican). Número de Oxidación o valencia de un elemento en un compuesto es la capacidad de dicho elemento para combinarse con otros y formar un compuesto, este número viene dado por el número de electrones cedidos, captados o compartidos por un átomo de dicho elemento al formar la molécula del compuesto. En las sustancias simples, es decir las formadas por un solo elemento, el número de oxidación es 0. Por ejemplo: O2, H2. En los iones monoatómicos el número de oxidación es igual a la carga del ión. Por ejemplo: Na+ número de oxidación es +1. Ca+2 número de oxidación es +2. número de oxidación es -1. Fe+3 número de oxidación es +3. El número de oxidación del hidrogeno es +1 salvo en los hidruros que es -1. El número de oxidación del oxigeno es -2 salvo en los peróxidos que es -1. En un compuesto neutro la suma de los números de oxidación de los átomos que lo forman es 0. Por ejemplo: Calculo del número de oxidación del S en el compuesto neutro H2SO4. El número de oxidación del H es +1 y el del O es -2, en el caso del número de oxidación del S será x. El número de oxidación de S es 6. En un ión poliatómico la suma de los números de oxidación de los átomos que lo forman coincide con la carga del ión. Por ejemplo: Calculo del número de oxidación del C en el ión poliatómico de carga -2 CO3-2.El número de oxidación del O es -2 y del C es x. CUADRO DE VALENCIAS Metales → solo tienen valencia positiva (+) Valencia Elementos 1 Li Na K Rb Cs Ag 2 Be Mg Ca Sr Ba Zn Cd 1,2 Hg Cu 3 Al Ga 1,3 Au 2,3 Fe Co Ni 2,4 Sn Pb Pt 2,3,6 Cr 2,3,4,6,7 Mn No metales → pueden actuar con valencia positiva o negativa (+ o -) Valencia Elementos -1 1 H -1 F -1 1,3,5,7 Cl Br I -2 O -2 2,4,6 S Se Te -3 1,2,3,4,5 N -3 1,3,5 P -3 3,5 As Sb Bi -3 3 B -4 2,4 C -4 4 Si COMPUESTOS BINARIOS Formulación: Están formados por dos elementos que pueden ser o . Cuando los dos elementos sean no metales se escribe a la izquierda el elemento que aparezca antes en la siguiente secuencia. B - Si - C - Sb - As - P - N - H - Se - Te - S - I - Br - Cl - O – F. Nomenclatura: AnBm N. Stock: Nombre del elemento de la derecha acabado en –uro seguido del nombre del otro elemento sin modificar, se añade la valencia de este elemento si es que tiene más de una en números romanos y entre paréntesis. N. Sistemática: Se leen los subíndices de los elementos mediante prefijos griegos (mono-, di-, tri-, tetra-, penta-, exa-, hepta-, etc) primero se nombra el elemento de la derecha acabado en –uro y después el de la izquierda. Fórmula CaF2 CuBr2 CuBr N. Stock Fluoruro de calcio Bromuro de cobre (II) Bromuro de cobre (I) PCl5 KBr Cloruro de fósforo (V) Bromuro de potasio Al2S3 Sulfuro de aluminio N. Sistemática Difluoruro de calcio Dibromuro de cobre Monobromuro de cobre Bromuro de cobre Pentacloruro de fósforo Monobromuro de potasio Bromuro de potasio Trisulfuro de dialuminio ÓXIDOS Son combinaciones binaria del oxigeno con cualquier elemento (excepto el flúor). Como el oxigeno es mas electronegativo después del flúor se coloca siempre a la derecha y dichos compuestos se denominan óxidos siguiendo para nombrarlos las mismas reglas que en los compuestos binarios. Fórmula Na2O N. Stock Oxido de sodio Fe2O3 FeO Oxido de hierro (III) Oxido de hierro (II) CO2 CuO Oxido de carbono (IV) Oxido de cobre (II) Cl2O7 Oxido de cloro (VII) N. Sistemática Monóxido de disodio Oxido de disodio Trióxido de dihierro Monóxido de hierro Oxido de hierro Dióxido de carbono Monóxido de cobre Oxido de cobre Heptaoxido de dicloro PERÓXIDOS Son compuestos parecidos a los óxidos en los que el oxigeno actúa con número de oxidación -1. Se nombran con la palabra peróxido siguiendo para nombrarlos las mismas reglas que en los compuestos binarios. (El 2 que tiene como subíndice no se simplifica) Formula K2O2 BaO2 H2O2 Cu2O2 CuO2 N. Stock Peróxido de potasio Peróxido de bario Peróxido de hidrógeno Peróxido de cobre (I) Peróxido de cobre (II) N. Sistemática Dióxido de dipotasio Dióxido de bario Dióxido de dihidrógeno Dióxido de dicobre Dióxido de cobre COMPUESTOS BINARIOS DEL HIDRÓGENO HIDRUROS Son combinaciones binarias del hidrógeno con los elementos más electronegativos que él (metales o no metales: B C Si N P As Sb) Se nombran con la palabra hidruro y siguiendo las normas de los compuestos binarios en N. Stock y en N. Sistemática. Fórmula BH3 NH3 PH3 SnH2 SnH4 BeH2 AsH3 SbH3 SiH4 CH4 NiH2 NaH N. Stock Hidruro de boro Hidruro de nitrógeno (III) Hidruro de fósforo (III) Hidruro de estaño (II) Hidruro de estaño (IV) Hidruro de berilio Hidruro de arsénico (III) Hidruro de antimonio (III) Hidruro de silicio Hidruro de carbono (IV) Hidruro de níquel (II) Hidruro de sodio N. Sistemática Trihidruro de boro Trihidruro de nitrógeno Trihidruro fósforo Dihidruro de estaño Tetrahidruro de estaño Dihidruro de berilio Trihidruro de arsénico Trihidruro de antimonio Tetrahidruro de silicio Tetrahidruro de carbono Dihidruro de níquel Hidruro de sodio Nombre común Borano Amoniaco Fosfina Arsina Estibina Silano Metano HIDRÁCIDOS Son combinaciones binarias del hidrógeno con los halógenos (F, Cl, Br, I) que actúan con valencia -1 y con los calcógenos (S, Se, Te) que actúan con valencia -2. Se nombran como los compuestos binarios con el nombre del no metal acabado en –uro seguido de la palabra de hidrogeno y en la nomenclatura sistemática se añaden los prefijos correspondientes. Cuando están en disolución acuosa tienen propiedades ácidas y se nombran con la palabra ácido seguida del nombre del no metal acabado en –hídrico. Fórmula HF HCl HBr HI H2S H2Se H2Te N.Stock Fluoruro de hidrógeno Cloruro de hidrógeno Bromuro de hidrógeno Yoduro de hidrógeno Sulfuro de hidrógeno Seleniuro de hidrógeno Telururo de hidrógeno N.Sistemática Fluoruro de hidrógeno Cloruro de hidrógeno Bromuro de hidrógeno Yoduro de hidrógeno Sulfuro de dihidrógeno Seleniuro de dihidrógeno Telururo de dihidrógeno Disolución acuosa Ácido fluorhídrico Ácido clorhídrico Ácido bromhídrico Ácido yodhídrico Ácido sulfhídrico Ácido selenhídrico Ácido telurhídrico IONES MONOATÓMICOS Los cationes monoatómicos de los metales se nombran con la palabra ión seguida del nombre del metal, si puede formar varios se pone entre paréntesis la valencia. Ión sodio Ión calcio Ión hierro (II) Ión hierro (III) Los aniones monoatómicos de los no metales se nombran con la palabra ión seguida del nombre del no metal acabado en –uro, salvo el ión óxido . Ión fluoruro Ión sulfuro Ión óxido Ión nitruro COMPUESTOS TERNARIOS OXOÁCIDOS Son compuestos formados por tres elementos, hidrógeno, un no metal o un metal de número de oxidación elevado y oxígeno. Se obtienen añadiendo agua al oxido correspondiente. Nomenclatura tradicional: Se utilizan una serie de prefijos y sufijos dependiendo de la valencia a utilizar. Si la valencia del elemento va de menor a mayor los prefijos y sufijos son en el mismo orden Hipo…….oso, ………oso, ………..ico, per…………ico. Cl, Br, I valencia 1 Cl2O + H2O → H2Cl2O2 → HClO 3 Cl2O3 + H2O → H2Cl2O4 → HClO2 5 Cl2O5 + H2O → H2Cl2O6 → HClO3 7 Cl2O7 + H2O → H2Cl2O8 → HClO4 HBrO HBrO2 HBrO3 HBrO4 ácido hipobromoso ácido bromoso ácido brómico ácido perbrómico S, Se, Te valencia 2 SO + H2O → H2SO2 4 SO2 + H2O → H2SO3 6 SO3 + H2O → H2SO4 H2SeO2 H2SeO3 H2SeO4 ácido hiposelenioso ácido selenioso ácido selénico ácido hipocloroso ácido cloroso ácido clórico ácido perclórico HIO HIO2 HIO3 HIO4 ácido hipoyodoso ácido yodoso ácido yódico ácido peryódico ácido hiposulfuroso ácido sulfuroso ácido sulfúrico H2TeO2 H2TeO3 H2TeO4 ácido hipoteluroso ácido teluroso ácido telúrico Siguiendo de una forma similar podemos ir obteniendo el resto de ácidos. Un caso especial, por ejemplo, son los ácidos para el P y el As, donde podemos sumar una, dos o tres moléculas de agua, donde añadimos de sufijo: meta, piro- , orto- respectivamente. N, P, As C, Si Mn Cr Valencia 3 HNO2 5 HNO3 Valencia 3 HPO2 5 HPO3 ácido metafosforoso ácido metafosfórico HAsO2 HAsO3 ácido metaarsenioso ácido metaarsénico 3 5 H4P2O5 H4P2O7 ácido pirofosforoso ácido pirofosfórico H4As2O5 H4As2O7 ácido piroarsenioso ácido piroarsénico 3 5 H3PO3 H3PO4 ácido ortofosforoso ácido ortofosfórico H3AsO3 H3AsO4 ácido ortoarsenioso ácido ortoarsénico Valencia 4 4 H2CO3 H2SiO3 ácido carbónico ácido silícico Valencia 4 6 7 H2MnO3 H2MnO4 HMnO4 ácido manganoso ácido mangánico ácido permangánico H2CrO4 H2Cr2O7 ácido crómico ácido dicrómico Valencia 6 2H2CrO4 – H2O → ácido nitroso ácido nítrico Normas para formular oxoácidos. 1. Se escriben los símbolos de los elementos. 2. Se piensa la valencia del elemento central, si es par se ponen 2 hidrógenos y si es impar 1 hidrógeno. 3. Se calculan el número de átomos de oxígeno para que la fórmula sea neutra. Nomenclatura sistemática: Prefijo griego seguido de la palabra oxo para indicar el número de átomos de oxígeno, a continuación el nombre del elemento central acabado en –ato y entre paréntesis su valencia en números romanos y por último se añade de hidrógeno. Fórmula HNO2 HNO3 H3PO3 H3PO4 H2CO3 HClO N. tradicional Ácido nitroso Ácido nítrico Ácido fosforoso Ácido fosfórico Ácido carbónico Ácido hipocloroso N. sistemática Dioxonitrato (III) de hidrógeno Trioxonitrato (V) de hidrógeno Trioxofosfato (III) de hidrógeno Tetraoxofosfato (V) de hidrógeno Trioxocarbonato (IV) de hidrógeno Oxoclorato (I) de hidrógeno IONES POLIATÓMICOS OXOANIONES Los ácidos al disolverse en agua se disocian en un catión H+ y en anión. HClO3 → + H+ Nomenclatura tradicional: Se nombran sustituyendo la palabra ácido por la palabra ión y las terminaciones –oso e –ico por –ito y –ato. Ácido hipo……oso ……oso ……ico per……ico Ión hipo……ito ……ito ……ato per……ato Nomenclatura sistemática: Se nombran con la palabra ión seguida de la palabra -oxo con prefijos para indicar el número de oxígenos y el nombre del otro elemento acabado en –ato con su valencia entre paréntesis. Fórmula N. tradicional Ión hipoclorito Ión clorito Ión clorato Ión perclorato Ión sulfito Ión sulfato Ión nitrito Ión nitrato Ión fosfito Ión fosfato Ión carbonato Ión permanganato Ión cromato Ión dicromato N. sistemática Ión oxoclorato (I) Ión dioxoclorato (III) Ión trioxoclorato (V) Ión tetraoxoclorato (VII) Ión trioxosulfato (IV) Ión tetraoxosulfato (VI) Ión dioxonitrato (III) Ión trioxonitrato (V) Ión trioxofosfato (III) Ión tetraoxofosfato (V) Ión trioxocarbonato (IV) Ión tetraoxomanganato (VII) Ión tetraoxocromato (VI) Ión heptaoxodicromato (VI) Otros iones poliatómicos: → Ión cianuro → Ión hidróxido → Ión amonio HIDRÓXIDOS Son compuestos formados por la unión de un metal y un ión hidróxido que actúa con valencia -1. Se nombran con la palabra hidróxido seguida del nombre del metal. En nomenclatura sistemática con prefijos para indicar los subíndices y en nomenclatura Stock con la valencia del metal entre paréntesis si tiene más de una. Fórmula NaOH Fe(OH)2 Al(OH)3 CuOH Sn(OH)4 N. Stock Hidróxido de sodio Hidróxido de hierro (II) Hidróxido de aluminio Hidróxido de cobre (I) Hidróxido de estaño (IV) N. Sistemática Hidróxido de sodio Dihidróxido de hierro Trihidróxido de aluminio Hidróxido de cobre Tetrahidróxido de estaño SALES TERNARIAS NEUTRAS Son compuestos formados por tres elementos, un metal con valencia positiva y un no metal con oxígeno que forman un oxoanión. Se forman al reaccionar un oxoácido con un hidróxido dando lugar a una sal y agua. H2SO4 + 2NaOH → Na2SO4 + 2H2O Nomenclatura sistemática: se nombran escribiendo primero el nombre del anión y después el del metal indicando su valencia entre paréntesis si tiene más de una. Nomenclatura Stock: se nombran con el nombre del anión en nomenclatura tradicional seguido del nombre del metal indicando su valencia si tiene más de una. Fórmula Ba(IO4)2 Fe2(CO3)3 Cu(NO3)2 CaSO4 NaClO N. Stock Peryodato de bario Carbonato de hierro (III) Nitrato de cobre (II) Sulfato de calcio Hipoclorito de sodio N. Sistemática Tetraoxoyodato (VII) de bario Trioxocaronato (IV) de hierro (III) Trioxonitrato (V) de cobre (II) Tetraoxosulfato (VI) de calcio Oxoclorato (I) de sodio

