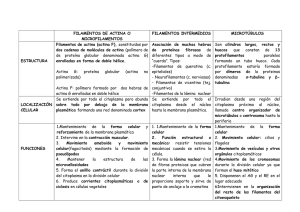
actina
Anuncio

varios videos interesantes en http://cellix.imolbio.oeaw.ac.at/Videotour/video_tour.html Extensiones citoplasmáticas basadas en el citoesqueleto de actina órgano mecanosensorial células epiteliales intestinales, riñón células mecanosensoras (Drosohila) fibroblastos, conos de crecimiento neuronales células sensoriales del órgano de Corti Revenu et al., Nature RMCB2004 Lamelas, pliegues y filopodios son extensiones citoplasmáticas dinámicas observables en células migratorias Extensiones planas y delgadas adheridas al substrato se denominan lamelas; extensiones que no se adhieren y que se pliegan sobre la parte ¨superior¨ de la célula se conocen como "ruffles". Proyecciones con forma de aguja adheridas al substrato se denominan filopodios. ruffles microscopía electrónica de barrido de fibroblastos filopodios lamela videos accesibles Los conos de crecimiento neuronales son sitios de elongación de axones y dendritas Los conos de crecimiento varían en morfología, extienden una lamela con numerosos filopodios. La estructura y dinámica de la región periférica de los conos de crecimiento (P) depende del citoesqueleto de actina (en rojo). Los microtúbulos abundan en la región central (C) del cono. actina microtúbulos Dent & Gertler, Neuron, 2003 La videomicroscopía revela que los filopodios y lamelas son estructuras dinámicas Robles et al, Neuron 2003 0.5' 2' 4' 18' 20' 22' filopodios Paglini et al JCB 1998 La marcación con falloidina fluorescente revela la abundancia de los filamentos de actina en filopodios, lamela y lamelipodio lamelipodio fibroblasto citoesqueleto de actina (rojo) predominante en la lamela y filopodios. Los microtúbulos (verde) terminan en un dominio proximal. lamela de avance citoplasma en retracción (cola) axón filopodios Paglini et al JCB 1998 lamela Suter & Forscher J. Neurobiol. 2000 Numerosas proteínas contribuyen a la organización tridimensional de los filamentos de actina Varias proteínas se unen a actina mediante dominios CH (Calponin-Homology). Proteínas monoméricas con más de un dominio CH, o diméricas, con un solo CH cada monómero, contribuyen a interconectar los filamentos de actina. CH Lodish et al., MCB2004 Diferentes arreglos 3D: Fascículos y redes de microfilamentos fascículos contráctiles "fibras de estrés" El número y ubicación de los dominios CH en las proteínas que unen actina determinan el arreglo tridimensional que estabilizan. Los sitios de unión a actina se muestran en rojo. redes bidimensionales fascículos no contráctiles Organización 3D de los microfilamentos. Microscopía electrónica Fascículos de microfilamentos unidos por fimbrina Redes de microfilamentos conectados por filamina Lodish et al., MCB2004 El espaciamiento de los filamentos de actina en las distintas estructuras celulares depende del tipo de proteínas accesorias Fascí Fascículo contrá contráctil Fascí Fascículo no contrá contráctil el mayor espaciamiento permite la unión de miosina II entre los filamentos. Ej. en fibras de estrés. el empaquetamiento denso de microflamentos impide la asociación de miosina. Ej. en filopodios. et al, Ne AlbertsRobles et al., MCB2002 Visualización de una red de filamentos de actina en lamelas y lamelipodios de keratinocitos lamela de keratinocito filamina estabiliza la red interaccionando con filamentos orientados perpendicularmente. la parte distal de la lamela, denominada lamelipodio, exhibe una red dendrítica de filamentos de actina nucleados y anclados en complejos Arp2/3 (flechas). actina videos disponibles Svitkina et al, JCB 1997 En el lamelipodio los complejos Arp2/3 nuclean actina y anclan los nuevos filamentos a filamentos preexistentes Los complejos Arp2/3 se asocian lateralmente a microfilamentos preformados y facilitan el ensamble de actina formando filamentos ¨ramificados¨. Los filamentos de actina formados a partir de Arp2/3 emergen del filamento parental a un ángulo de 70° arreglo dendrítico Alberts et al., MCB2002 La fasciculación y crecimiento de filamentos de actina en la región distal de la lamela puede generar filopodios filopodio red dendrítica de actina Los filopodios se forman a partir de filamentos de actina de la lamela. los círculos señalan ramas a partir de las cuales se originan filamentos de actina que se empaquetan y forman el esqueleto del filopodio. Svitkina et al JCB 2003 La proteína fascina contribuye a fascicular los filamentos de actina en los precursores de los filopodios La clave para la iniciación de un filopodio es la fasciculación (mediada por fascina) y la inhibición del “capping” o terminación de la elongación (mediada por proteínas de la familia ENA/VASP). Esquema de formación de un filopodio (ENA/VASP) fasciculación - elongación Svitkina et al JCB 2003 Fascículos contráctiles de microfilamentos o fibras de estrés le permiten a la célula traccionar sobre el substrato focos de adhesión (flechas) microscopía de reflexión focos de adhesión (verde) y fibras de estrés (rojo). Microscopía de fluorescencia la asociación de las fibras de estrés con miosina les permite ejercer fuerzas de tracción sobre las adhesiones focales fibras de estrés microscopía de fluorescencia fibra de estrés α−actinina actina adhesión focal vinculina las fibras de estrés se anclan a las integrinas de las adhesiones focales mediante proteínas tales como talina y paxilina talina integrinas Vinculina es un proteína abudante de focos de adhesión que ancla las fibras de estrés a las adhesiones focales focos de adhesión (vinculina) La unión a PIP2 induce la conformación activa de vinculina lo cual promueve su interacción con actina y con otras proteínas que unen actina. conformación inactiva Zamir & Geiger, JCS 2001. conformación activa Las proteínas ERM anclan el citoesqueleto cortical de actina a la membrana plasmática en células epiteliales polarizadas Ezrina, Radixina y Moesina son miembros de la familia de proteínas ERM. La asociación de las proteínas ERM a la actina y a proteínas de la membrana plasmática es regulado por fosforilación o unión a fosfoinosítidos fosforilados (PIP2). Espectrina y actina forman una red cortical que estabiliza la membrana de eritrocitos microscopía electrónica de la red cortical de espectrina complejo de anclaje s = spectrin Espectrina es un heterodímero que se asocia cabeza con cabeza formando tetrámeros de unos 200 nm de longitud. Los tetrámeros se unen a filamentos de actina en sitios denominados "nodos" o complejos de anclaje formando una malla bidimensional. Espectrina se ancla a la membrana plasmática a través de su unión a las proteínas periféricas ankirina y banda 4.1. complejos de anclaje a actina Varias proteínas contribuyen a remodelar la red de actina. Gelsolina, cofilina y severina inducen la fragmentación de los microfilamentos y el “capping” de los extremos (+). La actividad de gelsolina es regulada por calcio y PIP2 el fragmento formado se depolimeriza por el extremo (-) (-) (+) Ca++ Vía de señ señalizació alización que activa a gelsolina trombina receptor acoplado a proteína G PLC “capping” del extremo (+) impide el crecimiento ↑DAG/IP3 Ca++ ↑gelsolina Cambios en las concentraciones de calcio citosólico afectan la reorganización de la actina El compuesto fluorescente Fura 2 emite a una longitud de onda determinada cuando esta unido a Ca++. Esta fluorescencia puede ser visualizada en un microscopio. Debajo se visualiza en pseudocolor los niveles de calcio (azul = min rojo = max) en un leucocito. Observe la existencia de un gradiente con máximo niveles de calcio en la región de la célula opuesta al margen de avance. margen de avance ↑ Ca++ El aumento de Ca++ estimula la actividad de gelsolina, la cual promueve el desensamble de microfilamentos en la región de la célula opuesta al margen de avance. Remodelación del citoesqueleto de actina en plaquetas La activación de plaquetas involucra cambios morfológicos rápidos que son promovidos por la reorganización del citoesqueleto de actina. Varias proteínas que regulan el estado de polimerización de la actina (gelsolina, profilina) actúan de manera coordinada por señales citosólicas como el Ca2+ y el PIP2. trombina INACTIVATES plaqueta inactiva activa lamela contracción mediada por miosina II La plasticidad del citoesqueleto de actina es regulada por señales extracelulares (a) en una célula epitelial en reposo villina estabiliza los ramilletes de filamentos de actina en las microvellosidades; una pequeña fracción se encuentra asociada a PIP2 en membranas. (b) En respuesta a la estimulación de ciertos receptores (ej. EGFR) se hidroliza el PIP2 y aumenta el calcio citosólico. El calcio activa a villina y a otras proteínas que fragmentan filamentos de actina de las microvellosidades y promueven cambios en el arreglo tridimensional de la actina. estimulación Revenu et al, Nature RMCB 2004 Comparación de proteínas accesorias que regulan el estado de polimerización de la actina y tubulina proteínas que se unen a las subunidades no ensambladas * tubulina actina stathmin thymosin stathmin-P profilin *las proteínas promueven la depolimerizacion (↓)o polimerizacion (↑) de los respectivos polímeros proteínas que causan la fragmentación de los polímeros microtúbulos microfilamentos katanin gelsolin, severin proteínas que se asocian a las paredes de los polímeros y los estabilizan microtúbulos microfilamentos MAP2, Tau XMAP215 tropomyosin proteínas que se unen a los extremos de los polímeros microtúbulos γ-TuRC (-) nucleación catastrophins (+ y -) microfilamentos CapZ (+) capping Arp2/3 (-) nucleación proteínas que se asocian a las paredes de los polímeros y los desestabilizan microtúbulos XMAP215-P KIF2, Op18 microfilamentos cofilin Las GTPasas rho, rac y Cdc42 controlan la actividad de las proteínas involucradas en la organización tridimensional de la actina Fibroblastos quiescentes microinyectados con mutantes de GTPasas constitutivamente activas. Se muestra el citoesqueleto de actina y los focos de adhesión (vinculina). La microinyección de rho activo induce la formación de fibras de estrés; Rac induce la formación de lamelipodio; Cdc42 induce la formación de filopodios actina vinculina células quiescentes actina rho activo vinculina formación de fibras de estrés lamelipodio rac activo formación de lamelipodio Cdc42 activo formación de filopodios La actividad de rho, rac y Cdc42 es regulada por señales extracelulares La señalización de diversos receptores de superficie convergen en la activación de rho, rac y Cdc42 suero ECM ECM Arp2/3 La depolimerización de microtúbulos promueve la activación de rho, la formación de fibras de estrés y adhesiones focales (a) (b) (c) (d) (e) (f) (g) control, microtúbulos control, actina nocodazol 3 min, microtúbulos nocodazol 3 min, actina nocodazol 30 min, actina control, vinculina nocodazol 30 min, vinculina Bershadsky et al Curr. Biol., 1996 La extensión de la lamela de avance requiere de la activación de la GTPasa rac la activación de rac promueve la extensión de la lamela de avance a través de la activación de los complejos Arp2/3. localización de rac activo mediante FRET no interaction = no FRET interaction = FRET Rac-GDP Rac-GTP efector (-) nivel de activación (+) efector dirección del movimiento (del Pozo, Kiosses, Schwartz) lamela de avance integrinas factores de crecimiento ↑Rac ↑Scare/WAVE Pak LIMK ↑Arp2/3 cofilina ↑polimerización de actina Modelo de protrusión del lamelipodio: “treadmilling” de la red de actina En el lamelipodio la red dendrítica de actina experimenta un “treadmilling”, con un ensamble neto en el frente de avance y un desensamble neto por detrás de él. empuje CapZ Extensión de la membrana en el frente de avance. Nucleación de actina-ATP (proteínas Arp2/3); elongación de filamentos en un ángulo de 70°; terminación de la polimerización (proteínas CapZ). La polimerización de actina empuja la membrana hacia adelante (protrusión). Desensamble de la red de filamentos detrás del frente de avance. Asociación de cofilina (en verde) a la actina-ADP (en rojo) de los polímeros, evento que promueve el desensamble de la actina de los extremos (-). extensión remodelación Señales extracelulares activan a la GTPasa rac. Rac activa a las proteínas WASP/Scar y éstas a los complejos Arp2/3. Los complejos Arp2/3 activos se asocian a filamentos pre-existentes y nuclean actina. Este proceso da lugar a nuevos filamentos de actina (ramas). Alberts et al MBC 4th Ed La polaridad de las células migratorias involucra la actividad coordinada de las GTPasas rho, rac y Cdc42 Ridley et al, Science 2003 La polimerización de actina genera fuerzas de empuje sobre la membrana plasmática La reacción acrosomal en espermatozoides es disparada al contacto con la zona pelúcida del huevo y es mediada por una rápida polimerización de actina http://worms.zoology.wisc.edu/urchins/SUfert_acrosome.html La polimerización de actina es explotada por algunos parásitos para impulsar su movimiento intracelular La proteína ActA localizada en el polo caudal de la bacteria Listeria monocytogenes recluta y activa el complejo Arp2/3 de la célula huesped, induciendo la nucleación y polimerización de actina en ese polo. La nucleación y polimerización de actina es acelerada por otras dos proteínas del huesped, VASP y profilin. La rápida polimerización de actina en el polo caudal de la bacteria le permite moverse en el citosol de la célula huesped. dirección del movimiento polimerización de actina homólogos de ActA en eucariotas son las proteínas WASP/Scar video disponible Cameron et al, Nature RMCB 2001 Movimiento de Listeria monocytogenes basado en la polimerización de actina Visualización del movimiento de L. monocytogenes dentro de la célula empleando microscopía de fluorescencia. La bacteria se visualiza en rojo, y la actina polimerizada en el polo caudal se visualiza como una cometa en verde video disponible MBC2004 La migración de un fibroblasto involucra eventos que se repiten cíclicamente polimerización de actina en el lamelipodio. Arp2/3 adhesión mediada por integrinas contracción mediada por miosina II desensamble de los complejos adhesivos La migración direccional es una propiedad autónoma de la lamela de avance filamentos ramificados lamelipodio los filamentos de actina son el componente estructural dominante de la lamela. En el lamelipodio, los complejos Arp2/3 generan filamentos ramificados que empujan la membrana hacia adelante. video disponible Pollard & Borisy, Cell 2003 Miosina II asociada a los filamentos de actina contribuye a la translocación del núcleo en la dirección de avance La miosina se asocia a los filamentos de actina en la región de la lamela mas cercana al núcleo. Las moléculas de miosina se muestran en amarillo. La actividad de la miosina II sobre la actina se traduce en fuerzas de tracción sobre el substrato La fuerzas de tracción pueden visualizarse sembrando las células sobre un substrato deformable. La inhibición de la miosina elimina las fuerzas de tracción. contracción mediada por miosina II contracción inhibida Experimentos con trampas láser revelan fuerzas asociadas al citoesqueleto de actina en la lamela Con la ayuda de una trampa láser los investigadores posicionaron una microesfera cubierta con fibronectina sobre el borde de la lamela (a). A continuación midieron la velocidad y trayectoria de la microesfera filmando su posición en función del tiempo (línea blanca en a, y gráfico en b). a microesfera a b integrinas actina microesfera El escape de la microesfera de la trampa láser y su movimiento retró retrógrado hacia el centro de la célula requiere del anclaje de las integrinas al citoesqueleto de actina. actina. Choquet et al, Cell 1997 video disponible MBC Las células orientan las fuerzas de tracción y la dirección de la migración en respuesta a la rigidez del substrato substrato deformable microesfera substrato no deformable la migración direccionada de las células hacia regiones mas rígidas del substrato se denomina durotaxis redireccionamiento de la migración en respuesta a la tensión del substrato. En este experimento una célula sembrada en el borde un substrato que exhibe un gradiente de rigidez es filmada a distintos tiempos. redireccionamiento de la migración en respuesta al incremento de tensión ejercido por una micropipeta. Note la formación de una nueva lamela orientada hacia la región tensionada por la micropipeta. lamela tensión lamela micro pipeta Note que la célula produce una lamela (flecha) y migra hacia la región mas rígida (stiff) del substrato. En este experimento las células estan adheridas a un substrato deformable (poliacrilamida). Lo et al. Biophys J. 2000 Las fibras de estrés y la elongación de las células endoteliales se orientan en dirección del flujo de fluído la figura muestra que a las 16 h de exposición a un flujo laminar de medio de cultivo, la forma de las células y los filamentos de actina (en rojo) se orientan en dirección de la corriente del fluído (flecha) Noria et al Am. J. Pathol. 2004 Las miosinas constituyen una gran superfamilia de proteínas motoras asociadas a filamentos de actina microscopía electrónica. "Freeze etch" Todas las miosinas consisten de una o dos cadenas pesadas y una o varias cadenas livianas. Las cadenas pesadas exhiben tres dominios, cabeza, cuello y cola. Las colas de las miosinas I y V interaccionan con membranas. Las colas de las miosinas II interaccionan entre si formando filamentos gruesos bipolares de cuyos extremos proyectan las cabezas. Las cabezas de las miosinas se desplazan sobre filamentos de actina en una manera dependiente de la hidrólisis de ATP filamentos de actina (1-3 en b) se desplazan sobre moléculas de miosina adsorbidas a un vidrio. Las cabezas se desplazan hacia el extremo (+) de los filamentos en un proceso dependiente de ATP. Miosina II es requerida en diversos eventos celulares estructuras contráctiles formadas por actina y miosina II Mecanismos de regulación de la actividad de la miosina II En células musculares esqueléticas la actividad de la miosina II (MLC) es regulada por fosforilación mediada por MLCK. MLCK es activada por calcio y calmodulina. En células musculares lisas y no musculares la activación de MLC depende de la Rho kinasa. Rho kinase Rho kinase integrinas Rho Rho kinasa MLC-Pi + actina MLC fosfatasa contractilidad filamento grueso (empaquetamiento de las colas) Modelo del movimiento de la miosina II sobre el filamento de actina brazo móvil Las cabezas motoras (en azul) se conectan por un cuello móvil (en amarillo) a la región rígida "coiled coil" (en gris) de las colas. La hidrólisis del ATP extiende el brazo móvil ~ 10 nm hacia el extremo (+). (+) La cabeza de miosina unida a ADP-Pi interacciona con baja afinidad con la actina (en verde) del microfilamento. Pi La liberación del Pi de la cabeza motora incrementa la afinidad por la actina e induce un cambio conformacional del brazo móvil y una fuerza de torque que mueve al resto de la molécula de miosina sobre el filamento de actina ~10 nm (flecha) El reemplazo del ADP por ATP induce la disociación de la miosina del microfilamento. Vale & Milligan, Science 2000 Comparación de los ciclos mecano-químicos de kinesina y miosina miosina ejecuta un paso y se disocia del filamento. En contraste, kinesina es un motor áltamente procesivo y ejecuta varios cientos de pasos antes de disociarse del microtúbulo. Vale & Milligan, Science 2000 - Son polímeros no polares extremadamente estables - Los monómeros son proteínas fibrosas ricas en alfa hélice - Los monómeros no unen nucleótidos - El ensamblaje no requiere de hidrólisis de nucleótidos - No participan en motilidad celular ni se conocen motores asociados a IFs - Proveen resistencia al estrés mecánico Los filamentos intermedios se forman a partir de una familia de subunidades muy variada IF P ro te in M W (1 0 3 )* T issu e D istrib u tio n TYPE I A cid ic k e ra tin s 40 57 E pithelia T Y P E II B asic k e ra tin s 53 67 E pithelia T Y P E III V im e ntin D e sm in G lia l fib rillary a c id ic p ro tein P eriph e rin T Y P E IV N F-L N F-M N F-H In te rn ex in 57 53 50 57 62 10 2 11 0 66 M e se n c h ym e M u sc le G lia l ce lls a nd astro c yte s Pe rip h e ra l a n d ce ntral n e u ro n s M a tu re n e u ro n s M a tu re n e u ro n s M a tu re n e u ro n s D eve lo p in g c e n tra l n e rvo us syste m N O N S T A N D A R D T Y PE IV File n sin P ha k inin 83 45 Le n s fib e r c e lls TYPE V La m in A La m in B La m in C 70 67 67 N uc le us o f a ll c ells N uc le us o f a ll c ells N uc le us o f a ll c ells Las diferentes subunidades de los filamentos intermedios comparten un dominio rígido rico en alfa hélice, y difieren en las regiones amino y carboxilo Los filamentos intermedios son polímeros no polares que se ensamblan por interacciones laterales de dímeros y tetrámeros monómero 2 monómeros se asocian por sus α-hélice y forman un dímero coiled coil 2 dímeros se asocian lateralmente en orientación antiparalela. Tetrámero 2 tetrámeros se asocian lateralmente. Protofilamentos 8 protofilamentos asociados lateralmente forman los filamentos de 10 nm. Las células epiteliales poseen filamentos de la proteína queratina Los filamentos de queratinas se anclan en desmosomas y hemidesmosomas estabilizando la estructura del epitelio desmosomas filamentos de queratinas desmogleinas y desmocolinas integrinas (α6β4) hemidesmosomas miembros de la familia de las caderinas Mutaciones en la queratina desestabilizan la estructura de la epidermis Sección normal de piel epidermis esquema de epitelio mutante. La flecha indica la ruptura de las células debido a la fragilidad de los filamentos de queratina Sección de piel de ratón mutante en un gen de queratina Filamentos de la proteína desmina estabilizan la estructura de los sarcómeros en las células musculares Skelemina y sinemina alinean los filamentos de desmina con las miofibrillas. Ankirina y paranemina anclan los filamentos de desmina a la membrana plasmática. H Zone sarcomero Los Neurofilamentos (NFs) son esenciales para la estructura del axon Neurofilamentos axonales note la alta densidad de NFs en el axon Los NFs axonales estan áltamente interconectados por puentes de NFH Alteraciones en proteínas de neurofilamentos en neuronas motoras estan asociadas a la enfermedad neurodegenerativa amyotrophic lateral sclerosis (ALS). subunidades: - NF-L (light) NFs - NF-M (middle) - NF-H (heavy) Los filamentos de laminas estabilizan la envoltura nuclear Hay tres tipos de laminas: A, B y C. Las laminas son fosforiladas por Cdks-M al comienzo de la mitosis provocando el desensamble de los filamentos y el desarmado de la red. Los filamentos intermedios se asocian con microtúbulos mediante proteínas puente: plectina microscopía electrónica de barrido