Aquí hay un enlace covalente, ...
Anuncio
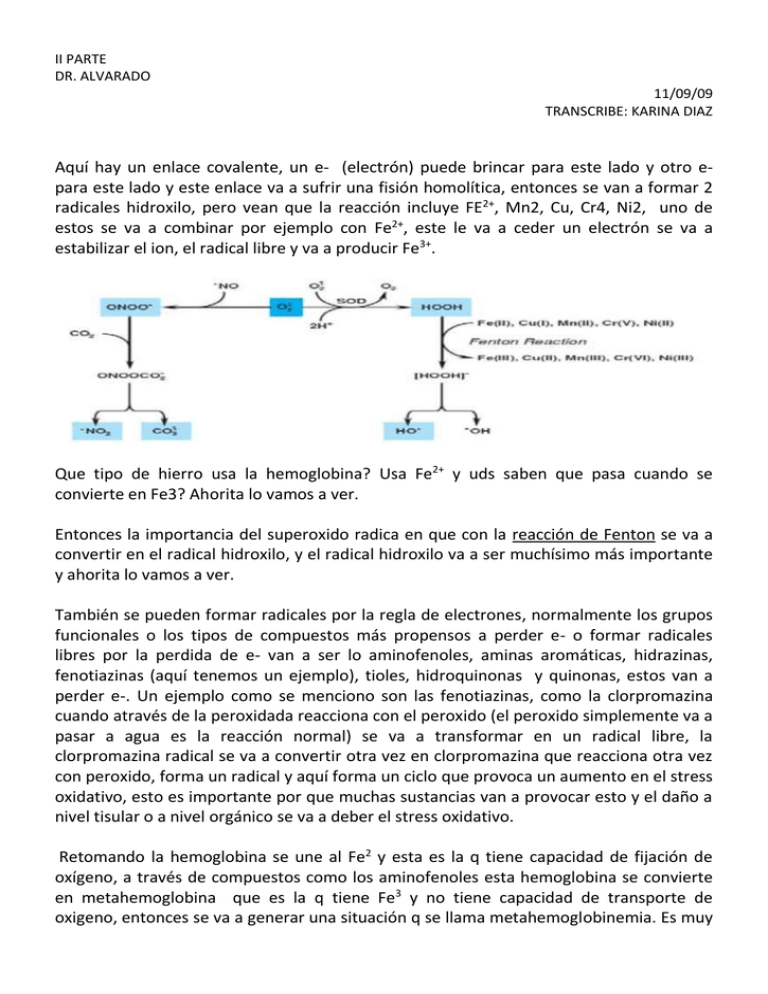
II PARTE DR. ALVARADO 11/09/09 TRANSCRIBE: KARINA DIAZ Aquí hay un enlace covalente, un e- (electrón) puede brincar para este lado y otro epara este lado y este enlace va a sufrir una fisión homolítica, entonces se van a formar 2 radicales hidroxilo, pero vean que la reacción incluye FE2+, Mn2, Cu, Cr4, Ni2, uno de estos se va a combinar por ejemplo con Fe2+, este le va a ceder un electrón se va a estabilizar el ion, el radical libre y va a producir Fe3+. Que tipo de hierro usa la hemoglobina? Usa Fe2+ y uds saben que pasa cuando se convierte en Fe3? Ahorita lo vamos a ver. Entonces la importancia del superoxido radica en que con la reacción de Fenton se va a convertir en el radical hidroxilo, y el radical hidroxilo va a ser muchísimo más importante y ahorita lo vamos a ver. También se pueden formar radicales por la regla de electrones, normalmente los grupos funcionales o los tipos de compuestos más propensos a perder e- o formar radicales libres por la perdida de e- van a ser lo aminofenoles, aminas aromáticas, hidrazinas, fenotiazinas (aquí tenemos un ejemplo), tioles, hidroquinonas y quinonas, estos van a perder e-. Un ejemplo como se menciono son las fenotiazinas, como la clorpromazina cuando através de la peroxidada reacciona con el peroxido (el peroxido simplemente va a pasar a agua es la reacción normal) se va a transformar en un radical libre, la clorpromazina radical se va a convertir otra vez en clorpromazina que reacciona otra vez con peroxido, forma un radical y aquí forma un ciclo que provoca un aumento en el stress oxidativo, esto es importante por que muchas sustancias van a provocar esto y el daño a nivel tisular o a nivel orgánico se va a deber el stress oxidativo. Retomando la hemoglobina se une al Fe2 y esta es la q tiene capacidad de fijación de oxígeno, a través de compuestos como los aminofenoles esta hemoglobina se convierte en metahemoglobina que es la q tiene Fe3 y no tiene capacidad de transporte de oxigeno, entonces se va a generar una situación q se llama metahemoglobinemia. Es muy importante por que muchos síndromes tóxicos o toxidron (toxidromeran es todo el conjunto de sintomatologías q producen un agente tóxico) hay muchos toxidron q se asocian a metahemoglobinemia q es cuando la persona se pone azul Tarea que es y como se trata la metahemoglobinemia La metahemoglobina se genera por la oxidación de las fracciones hemo al estado férrico, lo que origina un color azulado-pardo, "lodoso", similar a la cianosis. La metahemoglobina tiene una afinidad tan alta por el oxígeno que prácticamente no libera nada a los tejidos. Las concentraciones mayores de 50 a 60% suelen ser letales. La metahemoglobinemia congénita es consecuencia de mutaciones de la globina que estabilizan el 87His Tyr), o por mutaciones que merman las enzimas que hierro en estado férrico [HbM Iwata ( reducen la metahemoglobina a hemoglobina (p. ej., reductasa de metahemoglobina, diaforasa de fosfato de dinucleótido de nicotinamida y adenina [NADP]). La metahemoglobinemia adquirida es causada por toxinas que oxidan el hierro del hemo, en particular los compuestos que contienen nitratos y nitritos. Síntomas y Tratamiento La metahemoglobinemia con frecuencia causa síntomas de isquemia cerebral si la metahemoglobina está en concentraciones >15%; las concentraciones superiores a 60% suelen ser fatales. La inyección intravenosa de 1 mg de azul de metileno/kg de peso, es un tratamiento de urgencia eficaz. En los casos más leves y en el seguimiento de los graves es posible el tratamiento por vía oral con azul de metileno (60 mg tres o cuatro veces al día) o ácido ascórbico (300 a 600 mg/día) Causa: Ingestión de nitrito u otro oxidante . Harrison, 17a edición. 2009 Anestésicos como benzocaína y xilocaína Benceno Ciertos antibióticos (incluyendo dapsona y cloroquina) Nitritos (usados como aditivos para evitar que las carnes se dañen) http://www.nlm.nih.gov/medlineplus/spanish/ency/article/000562.htm Rompimiento homolítico es lo que les mencionaba ahora, por ej lo q pasa con el peroxido q pasa a radical hidroxilo y al ion hidróxido. Otro ejemplo cuando en el lab de bio le pusieron tetracloruro de carbono a los ratones, en hígado al CCl4 se le quita un Cl-, ese radical puede reaccionar muy fácilmente es sumamente reactivo y es el responsable del efecto hepatotoxico del CCl4 (los ratones tratados con CCl4 duraban más con el efecto de fentobarbital por q no pueden metabolizarlo). Importante para la gente q por su ocupación estén expuestas al CCl4. MECANISMOS DE INACTIVACCIÓN: Los más comunes los de reacción de fase 1 y la de fase 2. Las de fase 1 introduce grupos funcionales q le dan cierta polaridad a la molécula para q después puedan ser conjugados, por ej en este caso con sulfato puede ser también con ácido glucoronico. Los nucleófilos y electrófilos, (no se va a ver en detalle el mecanismo) van a ser fácilmente conjugados con glutatión o con ácido glucoronido, entonces los mecanismos de desintoxicación no van a ser tan complicados como los mecanismos q tiene los radicales libres q necesitan enzimas y energía, para la mayoría de sustancias es relativamente fácil, para los radicales libres hay muchísimos más mecanismos, x ej el peroxido q les decía q con la peroxido dismutasa se va a convertir en oxigeno y en peroxido d hidrógeno, este último va a tener varias rutas dependiendo de donde este ubicado, si está en el citosol, en la mitocondria o en el retículo endoplasmico, la glutatión peroxidasa lo va a convertir en agua y aquí podemos obtener una disminución de los niveles de glutatión, si estamos en citosol, mitocondria o en citosol de las células del miocardio (los cardiomiocitos) las peroxireductinas también lo van a convertir en agua. Finalmente la catalasa, en el hígado hay muchos peroxisomas los cuales tienen catalasas (peroxisomas organela especializada q se encarga de eliminar el peroxido de hidrogeno). La importancia del radical hidroxilo, el más peligroso y toxico q hay, es por q tiene una vida media tan corta tan corta (10-9 seg) q no da tiempo de eliminarlo, entonces casi de inmediato se a destruido o se ha combinado con otras macromoléculas, donde primero se va a dar una etapa de activación donde genera otro radical q genera otro radical y así sucesivamente. Esta sustancia ONOO- no es realmente un radical libre lo q tiene es un signo menos (diapo 29). Lo q pasa es q es un de los mecanismos de desintoxicación q tiene el superoxido también, se une con este radical libre a través de un proceso enzimático se forma esta “especie “ se une con CO2 y aquí va a darse una reacción q forma 2 radicales libres y estos si van a tener un efecto toxico importante. El aumento de cualquier tipo de radical libre va aumentar el stress oxidativo por lo tanto hay daño tisular, molecular, daño en diferentes parte de la célula. El glutatión es otro especie importante para desintoxicación principalmente de radicales libres… puede reaccionar con los radicales robándoles el e- q esta libre entonces el solito se forma un radical, lo q pasa es q como tiene azufre puede formar consigo mismo un puente de disulfuro y eliminar el radical, o sea el mismo puede terminar con la reacción. Esta otra especie no nos sirve por q no puede eliminar otros radicales libres. Entonces la glutatión reductasa lo q hace es transformar esto en glutatión reducido …. el problema de esto es q requiere de mucha energía y después cuando el glutatión se convierte en está especie más bien la reacción se va contrario a lo q normalmente sucede y se generan radicales libres y cuando el glutatión se acaba es cuando se generan efectos tóxicos como x ej el de la acetaminofen, cuando el glutatión de acaba se pueden acumular de estos radicales por que la reacción no se esta dando o se puede …. (no termina la idea) Mara ¿Como fue eso que si llegan muchos se me devuelve…? Esta sustancia también puede ser peligrosa, por q si no hay suficiente energía suficiente NADPH esta rx no se puede dar, entonces esta especie cuando se acumula se convierte en esta otra y más bien la rx se devuelve (GSSG pasa a 2GS.) y estos radicales libres son los q van a generar el efecto toxico, a través del mecanismo de toda esta rx (cuando hay suficiente glutatión, cuando hay suficiente energía) es cuando puede destoxificar electrofilos y otros radicales libres. Se comenta q la acetilcisteina posee grupos SH- al final de la cadena, los grupos SH- le permite a las enzimas (en los sitios activos) formar puentes de hidrogeno con las sustancias q reaccionan. Entonces estos grupos tiol van a estar disponibles para q algunas sustancias puedan reaccionar con ello. Se va a ver más adelante. Si estos mecanismos fallan ¿q pasa o x q pueden fallar estos mecanismos? Primero por q se saturan, el glutatión en algún momento se tiene q acabar, también se puede producir la inactivación enzimática q era lo q sucedía con CCl4, el CCl4 cuando forma radicales pueden provocar otras reacciones q van a inactivar la misma enzima q lo había transformado en radical libre, hay muchas sustancias q reaccionan con la misma enzima q las produce y la puede inhibir. También puede haber una reversión de reacciones q era lo q se menciono anteriormente o puede …. de sustancias reactivas donde un radicar reacciona con otro radical y ahí la rx sigue sigue y sigue o se producen perdidas reactivas de oxígeno como el superoxido. Volviendo al esquema (Diago 32), ya vimos lo q puede pasar cuando el agente se pude convertir en un agente toxico como por ej la formación de radicales libres. Ahora vamos a ver la etapa numero 2 q es la interacción de la molécula blanco, las cual tiene varias consideraciones especiales, primero el tipo de molécula blanco q es, después el tipo de enlace que se puede formar con esa molécula blanco y finalmente los efectos finales. LA MOLECULA BLANCO Normalmente la molécula blanco de las sustancias tóxicas son macromoléculas, las más importantes el ADN y las cisteínas. La imagen corresponde a la secuencia TATA unida a una proteína para q la polimerasa puede llegar a acoparse con el ADN. Entonces las macromoléculas de unión más común para los tóxicos van a ser el ADN y las proteínas, en segundo lugar y q no clasifican como macromoléculas van a estar los ácidos grasos ( y se acuerdan q la clase pasada les había dicho q principalmente están los ácidos graso insaturados o poliinsaturados ) objetivo de agentes tóxicos q generen peroxidación lipídica. Los fosfolípidos forman parte de la membrana plasmática, entonces si llega un radical libre q oxida un fosfolípidos la membrana plasmática se va a inestabilizar y puede llevar a muerte x necrosis y otros efectos. Vean esta proteína es la ATP sintasa q parce un carrusel, la parte de abajo va dando vueltas y cuando da vueltas va acoplando ADP con fosfatos y transforma ATP y cuando da la vuelta completa pasa x todo otra vez (es un video q dijo q nos iba a pasar pero no le dio tiempo o se le olvido). Nos muestra esta enzima para q veamos q la accesibilidad q tiene el agente toxico va a depende mucho de la configuración esterica q tenga la proteína, si el agente toxico tiene afinidad x residuos de aminoácidos q son hidrófobos y estos están al interior de la proteína, va a ser muy difícil q el agente toxico llegue a los residuos, de nada sirve q sea la proteína blanco si no la pueden atacar. Y hay proteínas q pueden tener los grupos expuestos en los sitios activos de las enzimas q tienen muchos grupos tioles o pueda ser q lo tengan escondido y cueste más llegar, es por eso q algunas proteínas requieren ser desnaturalizadas antes de ser atacada por los agentes tóxicos. Como dije las enzimas q catalizan las reacciones biológicas de las diferentes rutas biosinteticas son las más importantes y las q van a tener mayor efecto toxico. Como les decía el CCl4 va a ser convertido en radical por un citocromo y este radical va a producir daño local a nivel de las membranas microsomales, importante x q muchas veces el agente toxico es transformado en hígado y requiere ser llevado algún otro compartimento para poder ejercer su efecto toxico, hay otros q lo q hacen es actuar ahí mismo y entonces este radical q se genera como el CCl4 no solo va a dañar las membranas microsomales, sino también la enzima q lo produce (esto es muy importante en la moléculas blanco). También es importante el monóxido de carbono, tiene muchísimas más afinidad q el oxigeno x el grupo hem de la hemoglobina ( CO se une al grupo hem de la hemoglobina e inhibe el transporte de oxigeno) entonces pueda ser q este CO se una a alguna otra proteína q tenga el grupo hem también, pero q no produzca efecto toxico ¿x q creen q eso sea importante ? El citocromo o los citocromo son proteínas ligadas al grupo hem entonces el CO puede unirse al grupo hem de los citocromos también pero no los inhibe, no evita q funcione. Esto es importante x q los citocromos están ocupando el CO y evitando q se una con la hemoglobina entonces el efecto toxico va a ser menor. El citocromo se elimina cuando se elimina la enzima cuando la célula detecta q ese citocromo ya esta viejo q la proteína no funciona degrada la proteína, degrada el grupo hem. Conclusión puede ser q la sustancia toxica tenga una proteína blanco q no vaya a generar un efecto toxico final. En la clase anterior vimos una sustancia q se almacenaba en huesos y q no iba a ejercer efecto toxico en ellos (plomo). El plomo se almacena en huesos y no produce efecto toxico y evita q llegue a hígado y pueda producir un efecto toxico ahí. Angelina : ¿de q depende q salga de hueso y llegue a sangre? Cuando el polomo se acumula en huesos y llega al osteoclasto, cuando el hueso se esta degradando y se esta degradando la matriz de hidroxipatita, ese plomo puede pasar a sangre y eso genera toxicidad crónica. Otro ejemplo son los organofosforados, se unen a la acetilcolinesterasa, pero también se pueden unir a otras colinesterasas como la colinesterasa plasmática aquí el efecto toxico no va a ser tan grande como si se uniera a la acetilcolinesterasa. Entonces la unión de los organofosforados con la acetilcolinesterasa plasmáticas evita q llegue a la acetilcolinesterasa en las placas sinápticas. Eduviges ¿de q depende q se una a una enzima u a la otra? Puede depender de la cantidad q haya en el momento, puede depender de la afinidad q tenga, x ej si el grupo Hem esta expuesto con el CO, si los cambios conformacionales de la proteína exponen al grupo Hem, se va a unir más fácil a una proteína u a la otra, son cosas más de afinidad o de concentración. RESUMEN El agente toxico reacciona con la molécula y afecta su función negativamente. Esto puede deberse a q alcanza concentraciones efectivas en el sitio, si el agente toxico no alcanza concentraciones q tiene q alcanzar obviamente no va a inhibir a la proteína. Recordar las curvas de cinética de unión o de inhibición de proteínas o de enzimas, q tienen una forma sigmoideo y q dependiendo si el inhibidor es competitivo o no competitivo la curva se va a desplazar a la derecha o a la izquierda o se va hacer más baja. Altera el blanco y hay relación con toxicidad observada. Alcanza una concentración efectiva puede alterar el blanco y esa interacción con el blanco puede generar toxicidad o puede interaccionar con un blanco que no genere el efecto toxico. Hay una pag en Internet donde uno puede buscar según el agente toxico cuales proteínas posiblemente puede inhibir, sin embargo esto no me dice nada del efecto pueda darse al final, efecto toxico al final o lo q uno pueda ver en la persona q se esta intoxicando, yo puedo saber q va ha inhibir una proteína pero no puede saber el efecto final q va a tener en el organismo. CONSIDERACIONES CON TIPOS DE ENLACES Q SE FORMAN Recordar la unión a proteínas plasmáticas, pueden haber interacciones iónicas, interacciones hidrofobicas, formación de puentes de hidrogeno o fuerzas de van der Waals. Primero ¿Por q son importantes los enlaces covalentes? Lo q les dije anteriormente de los grupo tiol, si una proteína tiene expuesto un grupo SH- puede reaccionar con peroxido y va a provocar q se hidroxile el azufre, esta seria la primera parte, después este azufre hidroxilado puede reaccionar con un grupo tiol de una proteina 2 y formar un puente de disulfuro. Hay proteínas q tienen muchos uniones disulfuro (ej insulina, q son las q la mantienen rígida en conformación para q puede interaccionar con el receptor d insulinas) si se forman puentes de disulfuro entre dos proteínas, q primero pueda ser q no tengan nada q ver o entre dos grupos tiol de una misma proteína lo q hace es q la conformación de la proteína cambie y al cambiar … Este es un ejemplo de enlace covalente (imagen), enlaces no covalentes puede ser cuando una sustancia se intercala con el ADN no se esta uniendo covalentemente a las diferente bases nitrogenadas simplemente se intercala y se queda ahí unida por puentes d hidrogeno (x ej esta es la doxirubicina unida al ADN; otro ej el de los inhibidores de la neuroaminidasa como el oseltamivir o el zanamivir q se une a la neuroaminidasa por afinidad al sitio activo, el oseltamivir tiene parecido al sustrato natural neuroaminidasa q es el acido neuroaminico y esta conformación va a permite la formación de puentes de hidrogeno con la enzima y la inhiba). Otra forma de formación de enlaces puede ser la sustracción de hidrógenos de las moléculas principalmente las q tiene hidrógenos q son sensibles a ser removidos x ej el hidrogeno de los fenoles, q puede ser q un radical libre los encuentre y formen radicales libres y por resonancia el radical libre cambia de posición y reaccionar otra vez con un radical libre similar y forma un enlace covalente. El enlace covalente surgió de la eliminación del hidrogeno q estaba de intermedio. Y transferencia de electrones q es otra también por la q se podría o aumento de especies q tiene potencial redox como el de la hemoglobulina a hematoglobulinemia, este brinco de aquí a aquí es por una transferencia de electrones. Y finalmente las reacciones enzimáticas, es otra forma en la q se pueden formar enlaces con la molécula blanco, de reacción enzimáticas los ejemplos no son tanto de agentes químicos sino de toxinas biológicas, por ej hay bacterias q secretan proteínas formadoras de poros, las proteínas formadoras de poros tienen actividad enzimática para unirse entre ellas y formar un poro en la membrana de las células esos poros provocan q todo lo de la célula se salga y todo lo q esta afuera se equilibre con las concentraciones de adentro, por ej el calcio q presenta concentraciones intracelulares muy bajas y al llegar estas bacterias formadoras de poros las concentraciones de calcio se van a equilibrar y la célula va a morir por sobreexcitación através de calcio. El asunto es q muchas bacterias pueden secretar toxinas q tienen actividad enzimática que desestabiliza la célula. Otro ejemplo son las miotoxinas q tienen los venenos de serpiente, la fosfolipasa A2 presente en el veneno de la terciopelo, esta miotoxina desestabiliza la membrana de las células del músculo esquelético provocando la muerte. El asunto es q las reacciones enzimáticas lo q van hacer es desestabilizar la célula y posterior muerte. Otro ejemplo la toxina botulínica que es una proteasa. DISFUNCIÓN, DESTRUCCION O LA FORMACION DE NEOANTIGENOS Disfunción Lo primero q vamos a ver es la disfunción de las tranferinas: la morfina activa al receptor opioide y esta es la razón por la que es un analgésico. La atropina y curare lo q hacen es bloquear receptores de la neurotransmisión. La tetrodotoxina inhibe la apertura de canales de sodio. Los piretroides (insecticidas) inhiben el cierre de los canales de sodio. La colchicina inhibe la polimerización de la tubulina. Los anteriores son ejemplos de sustancias q pueden generar disfunción de su proteína blanco, no la destruyen simplemente inhiben su funcionamiento. Los inhibidores de bombas de protones evitan q funcione la bomba por un enlace covalente con ellas, es otro ejemplo más. Lo q pasa es q tenemos una macromolécula q se une con un agente toxico y puede alterar su conformación, puede alterar la forma del sitio activo de la enzima y eso es lo q genera la acción. Destrucción A nivel de destrucción la macromolécula se une con el agente toxico y es destruida, lo cual se puede producir con radicales libres ya q se da la fragmentación o por q se da unión entre otras moléculas (se unen 2 proteínas através puentes de disulfuro y esto puede destruir a las 2). El ejemplo más claro de destrucción es la peroxidación lipídica ¿Por qué salio Vioxx del mercado? El Vioxx provocaba peroxidación lipídica de las membranas de los cardiomiocitos, entonces la gente moría de infarto. Como se la peroxidación lipidica: Se da por radicales libres se da principalmente en ácidos grasos poliinsaturados o insaturados , primero el radical libre actúa con el ácido graso y produce un acido graso con radical libre (se abrevia como LH.), si un radical libre reacciona con una sustancia va a generar otro radical libre, el radical libre reacciona con el ácido graso y produce otro radical libre, el e- desapareado q queda ahí puede trasladarse a otros átomos diferentes de la misma molécula. Ver esquema no le interesa tanto las estructuras sino q vean el proceso de peroxidación lipídica q vean q empieza con un radical y ese radical se transfiere al acido graso y q finalmente termina en la ruptura del acido graso y esta ruptura desestabiliza la membrana de la célula, si los ácidos grasos comienzan a romperse empiezan a desaparecer y a fin de cuentas no vamos a tener membranas, lo q vamos a tener son acido grasos rotos y las cabezas polares q no van a servir para nada para formar una membrana. NO APRENDERSE LAS ESTRUCTURAS Neoantigenos Q simplemente es q el enlace entre xenobiótico y proteína endógena lo q genera es una respuesta inmunológica, y la respuesta inmunológica generada es tanto humoral como celular, después q se ha dado todo ese daño en proteínas y de q los efectos a nivel celular están afectando su funcionamiento se puede dar una reparación q puede ser inapropiadaza, entonces a nivel celular cuales van a ser los efectos q se van a generar si el agente toxico interacciona con la molécula blanco: puede ser q se de una desregulación de los genes de expresión, puede ser q la unión de ese agente toxico con el ADN provoq una desregulación de los protooncogenes y se conviertan en oncogenes, q generen cáncer. Desregulación de expresión genética de acuerdo a la síntesis de una proteína especifica, q cuando aumenta su concentración lo q va a provocar son efectos tóxicos. Puede desregularse la función celular q esta sucediendo en ese momento por ej la inactividad a nivel neuromuscular, atropina bloqueando la transmisión sináptica a través de la acetilcolina, puede darse una disminución del mantenimiento intracelular (x ej concentraciones de calcio dentro y fuera de la célula) o disminución de mantenimiento extracelular como sangrados x toxina de venenos de serpiente (ej muy claro) como de cascabel, terciopelo. Pueden darse un serie de mecanismos de reparación: molecular (de lípidos, proteínas, ADN donde hay enzimas específicas), celular q son más generales y a nivel de tejido que pueden generar proliferación o apoptosis que puede considerarse como un mecanismo de reparación (célula dañada muere por un proceso natural y no puede causar daño).