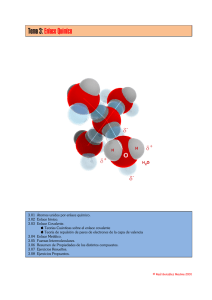
Tipos de enlace Símbolos de Lewis
Anuncio

TEORÍA ENLACE La palabra enlace designa el conjunto de interacciones que mantienen a los átomos, moléculas e iones unidos entre sí para dar lugar a estructuras más estables que las de partida. Es decir la causa de que se produzca un enlace va a ser la búsqueda de estabilidad. El enlace químico es la fuerza responsable de la unión estable entre los iones, átomos o moléculas que forman las sustancias. El origen de estas fuerzas hay que buscarlo en la estructura electrónica de los átomos a la que está ligada su capacidad para ceder o ganar electrones y su capacidad para compartirlos. Cuando se unen dos elementos representativos, ambos tienden a alcanzar la estructura de gas noble. Los elementos de transición difícilmente alcanzarán esta estructura, debido a que tendrían que eliminar o captar gran número de electrones d para completar este orbital. En este caso suele alcanzarse una configuración electrónica estable cuando los orbitales d están llenos o semillenos. Tipos de enlace Cualquier teoría de enlace tiene que explicar tres aspectos fundamentales de la molécula: a) la energía de la molécula, es decir, porqué se forma la molécula y de qué clase o tipo es la fuerza que la mantiene estable. b) el número de átomos de cada elemento que intervienen. c) Su distribución espacial, es decir, la geometría de la molécula. En general, para facilitar su estudio los enlaces se agrupan en dos grandes clases: a) enlaces interatómicos o intramoleculares:son los que mantienen unidos entre sí a un conjunto de átomos para dar lugar a una molécula. Se dividen en : - iónico, entre metal y no metal. - covalente, entre no metales. - Metálico, de un mismo entre los átomos metal b) enlaces intermoleculares: son los que mantienen unidas entre sí las moléculas de una misma sustancia. Se dividen en: - fuerzas de Van der Waals. - puentes o enlaces de hidrógeno. los enlaces intermoleculares son más débiles que los intramoleculares. Símbolos de Lewis Debido a que los electrones de las capas internas se encuentran atraidos con más fuerza por el núcleo, no suelen participar en la formación de enlaces y son los electrones de la capa o nivel de valencia los que participan, generalmente, en dicho proceso. Lewis introdujo un simbolismo muy útil que consiste en representar por un punto o una cruz cada uno de los electrones de valencia rodeando al símbolo del elemento. Una representación de esta clase se denomina estructura de Lewis, símbolo de Lewis o símbolo de puntos. Ej: Na: 1s 2 2s 2 2p 6 3s 1 Mg: 1s 2 2s 2 2p 6 3s 2 Cl: 1s 2 2s 2 2p 6 3s 2 3p 5 TEORÍA ENLACE Regla del octeto Lewis estudiando la gran estabilidad de los gases nobles que poseen 8 electrones de valencia propuso la siguiente regla: en la formación de un compuesto, un átomo tiende a perder, ganar o compartir electrones hasta que el número de estos en su capa de valencia sea igual a 8. Enlace iónico Se produce por la transferencia total de electrones de un átomo a otro. Como los átomos son neutros, cuando un átomo cede electrones forma un catión. Si un átomo capta electrones se transforma en un anión. Una vez producidos los iones, estos se atraen mutuamente mediante fuerzas electrostáticas. Es decir, el enlace iónico se establece por atracción electrostática entre iones de distinto signo. El enlace iónico se establece por combinación de elementos muy electronegativos (grupo 14 al 17) con elementos fuertemente electropositivos (grupos 1 y 2). Esto es, entre elementos situados en los extremos opuestos de la tabla periódica. Se llama electrovalencia o valencia iónica al número de electrones que un elemento suele ganar o perder al formar compuestos iónicos. En el enlace iónico cada catión está rodeado, en una ordenación simétrica, de cierto número de aniones, y viceversa, se forman así “moléculas” gigantes en las que cada catión atrae a varios aniones con fuerzas que dependen de las distancia que los separe. Estas moléculas gigantes son cristales, y la ordenación característica de los iones en los cristales se llama estructura cristalina. La forma cristalina adoptada requiere que se cumplan dos condiciones: - empaquetamiento máximo - cristal neutro. El índice de coordinación o número de coordinación de un ion en una red cristalina iónica es el número de iones de signo contrario que le rodea a la misma distancia. El carácter iónico de una unión depende de las siguientes características por orden de importancia: - es mayor cuanto mayor sea la diferencia de electronegatividades de los átomos constituyentes. - es mayor cuanto menor sea la carga de los iones. - es mayor cuanto mayor sea el tamaño del ión positivo y menor el del ión negativo. Sustancias iónicas (compuestos) - Hidróxidos: NaOH, Ba(OH)2, Al(OH)3, ... Óxidos (metales): Na2O, CaO, Al2O3, Cr2O3, ... Peróxidos: K2O2, ... Hidruros metálicos (grupos 1 y 2): RbH, CaH2, MgH2, ... - Sales: Binarias: NaCl, CsF, CaS, ... Oxisales: Na2CO3, BaSO4, KNO3, ... Ácidas: NaHS, NH4HS, KHCO3, ...