Química - La Colina
Anuncio
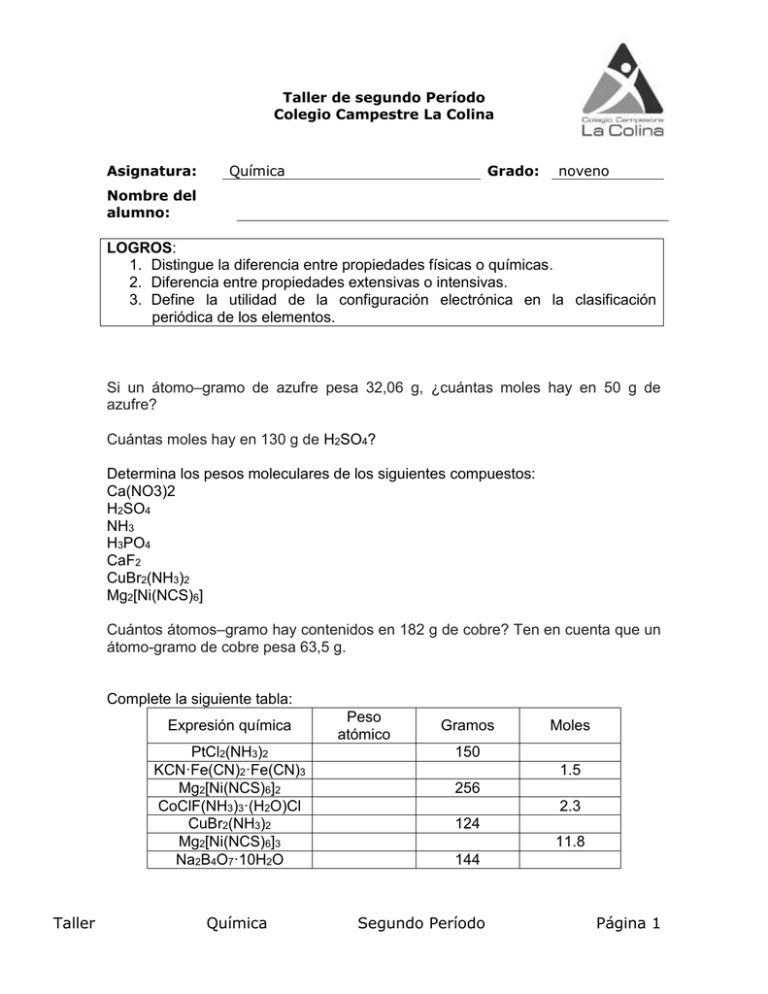
Taller de segundo Período Colegio Campestre La Colina Asignatura: Química Grado: noveno Nombre del alumno: LOGROS: 1. Distingue la diferencia entre propiedades físicas o químicas. 2. Diferencia entre propiedades extensivas o intensivas. 3. Define la utilidad de la configuración electrónica en la clasificación periódica de los elementos. Si un átomo–gramo de azufre pesa 32,06 g, ¿cuántas moles hay en 50 g de azufre? Cuántas moles hay en 130 g de H2SO4? Determina los pesos moleculares de los siguientes compuestos: Ca(NO3)2 H2SO4 NH3 H3PO4 CaF2 CuBr2(NH3)2 Mg2[Ni(NCS)6] Cuántos átomos–gramo hay contenidos en 182 g de cobre? Ten en cuenta que un átomo-gramo de cobre pesa 63,5 g. Complete la siguiente tabla: Expresión química PtCl2(NH3)2 KCN·Fe(CN)2·Fe(CN)3 Mg2[Ni(NCS)6]2 CoClF(NH3)3·(H2O)Cl CuBr2(NH3)2 Mg2[Ni(NCS)6]3 Na2B4O7·10H2O Taller Química Peso atómico Gramos Moles 150 1.5 256 2.3 124 11.8 144 Segundo Período Página 1 Un elemento tiene Z = 45. Con esta información indica: ¿Cuántas moles de potasio hay en 80 g, teniendo en cuenta que una mol de este elemento pesa 39,09 g? Elabore los diagramas de Lewis para los siguientes elementos y realice 4 ejemplos de formación de enlaces entre ellos. Li P Ca C O F K Escribe frente a cada sustancia, elemento, sustancia pura, compuesto o mezcla de acuerdo con su naturaleza. a. Azúcar b. Gaseosa c. Oro d. Gas carbónico e. Agua con sal f. Ensalada ¿Cuáles de las anteriores sustancias se pueden separar procedimientos físicos? a. Cuando se cambian 2L de agua de un recipiente de 4 L a uno de dos, mencione qué tipo de propiedades cambian (intrínsecas o extrínsecas) y menciónelas por b. Si disminuyo el volumen de agua a la mitad, ¿Cambia la densidad? Explica por qué. El análisis de una sustancia desconocida arrojó los siguientes resultados: a. Tiene color gris y aspecto metálico. b. c. d. e. f. Taller Se oxida fácilmente cambiando su apariencia. Reacciona violentamente con el agua. Al contacto con la piel produce quemaduras. Es blando y maleable. Clasifica estas propiedades en físicas y químicas. Explica la razón de tu clasificación. Química Segundo Período Página 2 9. Encuentre los estados de oxidación de cada elemento para los siguientes compuestos: H2SO4 HNO3 HNO2 H2S HCl NaF Fe2O3 CaSO3 10. Escribe las posibles interacciones existentes entre los siguientes pares de moléculas: AlI3 y SO2 HF y HCl AlCl3 y SO CO2 y N2 H2 y N2 CO y CH4 CaF2 y H2O NH3 y H2O 11. Asigna a cada elemento el número de oxidación correspondiente: a. HCl b. KNO3 c. Al(OH)3 d. H3PO4 e. Ca(NO3)2 f. HClO3 Encuentre los estados de oxidación de cada elemento para los siguientes compuestos: H3PO4 H2SO4 HNO3 HNO2 H2S HCl NaF Fe2O3 CaSO3 Taller Química Segundo Período Página 3




![Síntesis de los isómeros de enlace [Co(NH3)5(ONO)]Cl2 y](http://s2.studylib.es/store/data/004634023_1-a7bad7440b4885f96ebec76789583aea-300x300.png)
![Síntesis de los isómeros cis y trans de [Co(NH3)4(Cl)2]NO3](http://s2.studylib.es/store/data/004545132_1-c89f520546387504edd10c147928bf3b-300x300.png)





