Filamentos intermedios
Anuncio

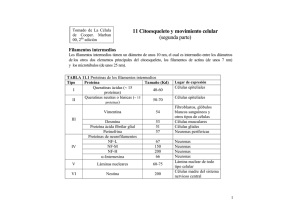
Filamentos intermedios INTRODUCCION La organización de los filamentos intermedios (FI) y su asociación con la membrana plasmática sugiere que su principal función es estructural: mantener la forma de las células y organizarlas en tejidos. Esto lo logra, primero dando soporte mecánico a la membrana plasmática que contacta con otras células o con la matriz extracelular y, segundo, siendo extremadamente estable. Las unidades de los FI son moléculas cilíndricas conformadas por una disposición en α-hélice. Suelen dividirse en seis clases, según se ve en la Tabla subyacente. Prof. Iván Rebolledo Los filamentos intermedios (FI) se encuentran en el citosol de casi todas las células eucarióticas. Rodean al núcleo y se extienden hasta la periferia de las células. Están unidos a los desmosomas y hemidesmosomas. También se encuentran dentro del núcleo, formando la lámina nuclear, a la cual se une la cromatina. Algo interesante, las células que crecen in vitro no producen FI. Pareciera que estas proteínas son necesarias cuando la células se encuentran sometidas a tensiones en los tejidos y pueden proporcionar soporte a las células y a los tejidos. Tipo Proteína integrante Distribución I Queratina ácida Epitelio II Queratina básica Epitelio III Vimentina Desmina Proteína glial Periferina Mesénquima Músculo Célula glial Célula nerviosa IV-E Neurofilamento Internexina Neuronas S.N. en desarrollo IV-NE Filensina Faquinina Cristalino Cristalino V Lámina A, B y C Envoltura nuclear E: estándar; NE: no estándarª Citoesqueleto La arquitectura del FI muestra que está conformado por proteínas alargadas. Cada molécula proteica constituye un monómero con dominios terminales globulares separados por una larga región alfahélice. Dos monómeros pueden asociarse en orientación paralela con sus terminaciones alineadas para formar dímeros (45 nm largo). Dependiendo del tipo de FI, los dímeros pueden estar compuestos de monómeros idénticos,llamándose homodímeros, en caso contrario, se llaman heterodímeros. Los dímeros pueden asociarse en forma escalonada antiparalela para formar los tetrámeros. Esta es la unidad básica de ensamble. Los tetrámeros se unen extremo con extremo para formar un protofilamento de unos 2-3 nm de grosor. Ocho de estos protofilamentos llegan a forman un simple filamento intermedio de unos 10 nm de diámetro. protofilamento filamento Vamos a detallar ahora algunas características y funciones de los principales FI, entre ellos los filamentos de queratina, presentes principalmente en la piel; los filamentos que existen en las neuronas, llamados neurofilamentos y los que existen en las células gliales (células de soporte de las neuronas) Considerando que los dímeros apuntan en direcciones opuestas, los tetrámeros carecen de polaridad, una gran diferencia con los microfilamentos y microtúbulos. El FI encontrado en las células gliales es considerado una proteína acídica fibrilar de un tamaño cercano a 51 kd, es llamado filamento glial. Evidencias recientes sugieren que son importantes en la formación de los procesos de los astrocitos cuando está ocurriendo la organogénesis del sistema nervioso. Citoesqueleto También hay sugerencias que este FI pudiera intervenir en la aparición de enfermedades neurodegenerativas (Creutzfeldt Jakob) al unirse a los priones. Por último, se ha detectado la presencia de este FI en las placas nerviosas identificadas en la enfermedad de Alzheimer. La vimentina es un FI del tipo III con un peso molecular de 54 kd encontrada en los fibroblastos. Se asocian en manojos o en mallas orientadas al azar por el citosol. La desmina es otro FI del tipo III con un peso molecular de 53 kd encontrado en la musculatura lisa, esquelética y cardíaca. Tiene doble función en la musculatura esquelética: mantiene juntos los sarcómeros vecinos y une las bandas Z de las miofrillas periféricas al sarcolema. Son muy abundantes en las fibras musculares lisas formando manojos que unen los sitios de convergencia de los filamentos de actina con la cara interna de la membrana. De esta manera, asegura la distribución uniforme del estímulo nervioso. Los neurofilamentos son una característica propia del cuerpo y prolongaciones de la neurona (axón y dendritas). Estos FI se agrupan según sus pesos moleculares en 210 kd, 160 kd y 68 kd. Ellos se disponen paralelo al eje mayor de la prolongación, proporcionando un soporte interno y ayudando a mantener el estado de gel del axoplasma. Esta última característica se deduce al aplicar iones Ca+2 que activan la degradación de los neurofilamentos. Los FI de queratina son característicos de las células epiteliales, siendo muy abundantes en las células del estrato espinoso de la piel. Ellos forman una familia de proteínas conformada por 6-7 subunidades de polipéptidos de 4070 kd de peso molecular. Los FI de queratina no sufren ensamble y desensamble rápidos, como el caso de los microtúbulos. Su función es esencialmente mecánica, estabilizando la forma de la célula. Los llamados tonofilamentos presentes en células epiteliales son manojos de FI de queratina que se extienden desde los desmosonas o hemidesmosomas hasta la profundidad del citosol llegando a formar una especie de canasta alrededor del núcleo. Así como existen proteínas asociadas con microfilamentos, también hay proteínas asociadas a los FI. Entre ellas podemos mencionar a la filagrina, la plectina y la sinamina. La filagrina se encuentra en las célulaS epiteliales unida a los filamentos de queratina, promoviendo su agrupamiento en manojos. La plectina parece estar en las intersecciones de los filamentos de vimentina. La sinamina se encuentra en la musculatura esquelética ayudando a cohesionar los FI.