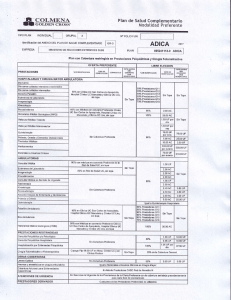
Responda las siguientes preguntas con base
Anuncio
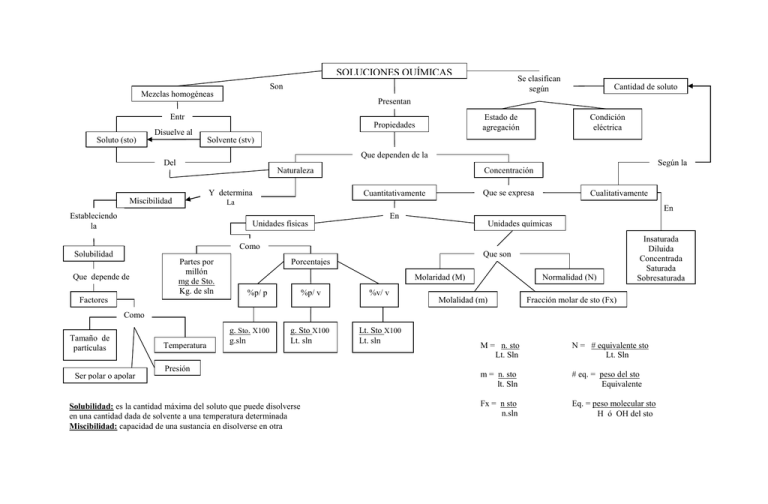
SOLUCIONES QUÍMICAS Se clasifican según Son Mezclas homogéneas Presentan Entr e Disuelve al Soluto (sto) Cantidad de soluto Estado de agregación Propiedades Condición eléctrica Solvente (stv) Que dependen de la Del Según la Naturaleza Y determina Miscibilidad Concentración Que se expresa Cuantitativamente Cualitativamente La Estableciendo la En En Unidades físicas Unidades químicas Como Que son Solubilidad Que depende de Partes por millón mg de Sto. Kg. de sln Factores Porcentajes Molaridad (M) %p/ p %p/ v %v/ v g. Sto X100 Lt. sln Lt. Sto X100 Lt. sln Normalidad (N) Molalidad (m) Insaturada Diluida Concentrada Saturada Sobresaturada Fracción molar de sto (Fx) Como Tamaño de partículas Temperatura g. Sto. X100 g.sln Presión Ser polar o apolar Solubilidad: es la cantidad máxima del soluto que puede disolverse en una cantidad dada de solvente a una temperatura determinada Miscibilidad: capacidad de una sustancia en disolverse en otra M = n. sto Lt. Sln N = # equivalente sto Lt. Sln m = n. sto lt. Sln # eq. = peso del sto Equivalente Fx = n sto n.sln Eq. = peso molecular sto H ó OH del sto INSTITUTO TECNOLOGICO DEL SUR Caminando hacia una educación diversificada, alternativa, Humanista y trascendente. 2. Podemos afirmar que la concentración en la solución 4 es: Soluciones Responda las siguientes preguntas con base en la siguiente información La concentración de una solución se refiere a la cantidad de soluto que existe en un volumen o peso dados del solvente o solución. A continuación se muestra la preparación de unas soluciones a partir de una solución 1. Solución 2 Se toma 2 lt de sln 1 y se le agrega 4/16 de los moles del soluto de la sln inicial Solución 4 Se toma la sln 2 y se le adicionan 2 lt agua Menor que en la solución 3. Menor que en la solución 2. Mayor que en la solución 2. Igual que en la solución 3 3. La molaridad de la solución 2 es: a. b. c. d. 1 Molar 0.25 Molar 5 Molar 3 Molar 4. Si en la solución 1 se emplearon 7.5 lt de agua (δ=1 gr/ml) La molalidad del solución 1 es: Solución 1 4 moles en 8 lt Solución 3 Se toma 4 lt de la sln y se le adiciona solvente hasta igualar el volumen de la sln 1 a. b. c. d. Solución 5 Se toma 4 lt de la sln 2 y se somete a evaporación hasta ¼ de solvente 1. Conociendo que el número de moles de soluto no cambia al diluir la solución; podemos afirmar de las soluciones obtenidas por dilución que la concentración de: a. La solución 5 es la menor que la solución 2. b. L a solución 1 es la mayor. c. La solución 2 es la menor. d. Las soluciones 1 y 4 son iguales. a. b. c. d. 5.3 molal 533 molal 0.53 molal 0.0053 molal 5. La fracción molar del agua en la solución 1 es: a. b. c. d. 0.75 1 0.0095 0.99 6. A un tubo de ensayo que contiene agua, se le agregan 20g de NaCl; posteriormente, se agita la mezcla y se observa que una parte del NaCl agregado no se disuelve permaneciendo en el fondo del tubo. Es v·lido afirmar que en el tubo de ensayo el agua y el NaCl conforman A. una mezcla heterogénea B. un compuesto C. una mezcla homogénea D. un coloide 9. RESPONDA LAS PREGUNTAS 7 Y 8 DE ACUERDO CON LA SIGUIENTE INFORMACIÓN A 1L de agua se adiciona continuamente una sal obteniendo la gráfica que se presenta a continuación Dos recipientes contienen dos mezclas distintas .El recipiente 1 contiene agua y aceite y el recipiente 2 contiene metanol y gasolina. Al combinar los contenidos de los dos recipientes, el número de fases que se obtiene de acuerdo con los datos de la tabla es 7. De acuerdo con la gráfica es correcto afirmar que bajo estas condiciones en 1L de agua la cantidad de sal disuelta en el punto A. 1 B. 2 C. 3 D. 4 10. La siguiente gráfica ilustra la solubilidad de una sustancia X en 100g de agua, con respecto a la temperatura. A. Y es mayor de 20g B. X es igual a 20g C. Y es menor de 20g D. X es menor de 20g 8. Si se realiza el experimento utilizando 2L de agua y las mismas cantidades de sal, la gráfica que representa correctamente la variación de la concentración de sal disuelta en función de la cantidad de sal adicionada es Si una solución al 10% (p/p) de la sustancia X se prepara a 30ºC y después se enfría hasta alcanzar una temperatura de 0ºC es válido afirmar que A. se precipitaron 10g de X, porque el solvente esta sobresaturado a 0ºC B. no se presentará ningún precipitado, porque la solución esta saturada a 0ºC C. no se presentará ningún precipitado, porque la solución esta sobresaturada a 0ºC D. se precipitaran 5g de X, porque el solvente solo puede disolver 5g a 0ºC A 25ºC y 1 atm de presión, se mezclan en un recipiente abierto los compuestos U, V y W. Si estos compuestos son insolubles y no reaccionan entre sÌ, es muy probable que al aumentar la temperatura a 280ºC el recipiente contenga 11. A temperatura constante y a 1 atmósfera de presión, un recipiente cerrado y de volumen A. los compuestos U y V en estado líquido y el compuesto W en estado sólido B. el compuesto V en estado líquido y el compuesto W en estado sólido C. el compuesto U en estado líquido, el compuesto W en estado sólido y los productos de la descomposición de V D. el compuesto W en estado sólido y los productos de la descomposición de V variable, contiene una mezcla de un solvente líquido y un gas parcialmente miscible en él, tal como lo muestra el dibujo 13. A una mezcla de los líquidos X y W, inmiscibles entre si, se agrega una sal que es soluble en los 2 líquidos. Posteriormente se separa la mezcla por decantación en dos recipientes. El líquido X se evapora completamente quedando en el recipiente la sal como sólido. De acuerdo con esta información, si se evapora completamente la mezcla inicial (X, W y sal) es probable que Si se aumenta la presión, es muy probable que la concentración del gas en la fase A. líquida aumente B. líquida permanezca constante C. gaseosa aumente D. gaseosa permanezca constante 12. Se cuenta con tres compuestos cuyas propiedades se presentan en la tabla. A. quede una menor cantidad de sal en el recipiente B. quede en el recipiente el líquido W y la sal disuelta C. el recipiente quede vacío D. quede una mayor cantidad de sal en el recipiente 14. A 40ºC una solución contiene una cantidad desconocida de X en 100 g de Y; se disminuye gradualmente la temperatura de la solución hasta 0ºC, con lo cual se obtienen 10 g de precipitado, a partir de esto es válido afirmar que la solución contenía inicialmente A. 25 g de X B. 20 g de X C. 15 g de X D. 10 g de X SUERTE Dulfay Roa Lic en Química INSTITUTO TECNOLOGICO DEL SUR Caminando hacia una educación diversificada, alternativa, humanista y trascendente. SOLUCIONES Y COLOIDES Guía De Apoyo Objetivos 1. Explicar el proceso de solubilidad en función de los factores que la afectan 2. Expresar en términos cualitativos y cuantitativos la relación soluto y solvente en una solución. 3. Plantear y solucionar problemáticas cotidianas en donde estén inmersos los conceptos de básicos de soluciones. 4. construye el concepto de coloide a partir de las diferencias entre mezcla, solución y combinación.