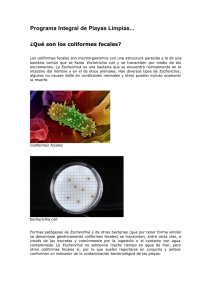
(Odocoileus virginianus mexicanus) EN PUEBLA, MÉXICO
Anuncio

EVALUACIÓN DEL CONTEO DE GRUPOS FECALES Y DEL ANÁLISIS MORFOMÉTRICO DE PELLETS COMO MÉTODOS DE OBTENCIÓN DE PARÁMETROS DEMOGRÁFICOS DEL VENADO COLA (Odocoileus virginianus mexicanus) EN PUEBLA, MÉXICO TESIS QUE PRESENTA ANGELA ANDREA CAMARGO SANABRIA PARA OBTENER EL GRADO DE MAESTRÍA EN CIENCIAS Xalapa, Veracruz, México 2008 3 BLANCA Aprobación final del documento final de tesis de grado: “Evaluación del conteo de grupos fecales y del análisis morfométrico de pellets como métodos de obtención de parámetros demográficos del venado cola blanca (Odocoileus virginianus mexicanus) en Puebla, México”. Nombre Firma Director Dr. Salvador Mandujano Rodríguez Comité Tutorial Dr. Roger Enrique Guevara Dr. Jairo Pérez Torres Jurado Dr. Eduardo Naranjo Piñera Dr. Gerardo Sánchez Rojas 4 AGRADECIMIENTOS Al Instituto de Ecología, A.C. por la oportunidad brindada para llevar a cabo mis estudios de maestría y por las facilidades para culminar el proyecto de tesis. Al Departamento de Biodiversidad y Ecología Animal por el apoyo financiero y logístico para el desarrollo del presente proyecto. A mi director, Dr. Salvador Mandujano, por su orientación, apoyo en campo y constantes correcciones al documento. A los integrantes de mi comité tutorial, Dr. Roger Guevara por su continua asesoría en la parte estadística y su disposición a cualquier inquietud; y al Dr. Jairo Pérez-Torres por sus acertados comentarios. A los doctores Eduardo Naranjo Piñera y Gerardo Sánchez-Rojas, miembros del jurado evaluador, por sus observaciones al documento final que sin duda fueron de gran valor. A Don Toño y Doña Nina que me acogieron en su casa en el Rancho El Salado. Y a Coco, Arturo y Joanna por su colaboración en campo. Al M. en C. Luis Enrique Martínez y a la Biól. Delfina Pérez por la ayuda en el muestreo de los venados en cautiverio y por todas las facilidades prestadas por la UMA-Zoológico Flor del Bosque para desarrollar esta parte del proyecto. A mis amigos del Instituto, Armando, Evis, Roger, Cori, Rodri, Lore, Paco, Silvia, Manuel; y de Colombia, Adriana y Gina que siempre están ahí. A mis padres y hermanos por su amor, por el apoyo incondicional y por ser mi sustento en todo sentido, en especial en la última fase de la tesis. A Hugo por todo tu apoyo, colaboración, por la aventura emprendida y por la compañía. Por saber que puedo contar contigo a pesar de todo, gracias! 5 A mi mami, a mi papi y a mis hermanos 6 DECLARACIÓN Excepto cuando es explícitamente indicado en el texto, el trabajo de investigación contenido en esta tesis fue efectuado por Angela Andrea Camargo Sanabria como estudiante de la carrera de Maestría en Ciencias entre septiembre de 2005 y abril de 2008, bajo la supervisión del Dr. Salvador Mandujano Rodríguez. Las investigaciones reportadas en esta tesis no han sido utilizadas anteriormente para obtener otros grados académicos, ni serán utilizadas para tales fines en el futuro. Candidato: Director de tesis: 7 ÍNDICE LISTA DE FIGURAS .............................................................................................. 10 LISTA DE CUADROS ............................................................................................ 13 RESUMEN ............................................................................................................... 15 INTRODUCCIÓN GENERAL ................................................................................ 16 I. ANTECEDENTES GENERALES ......................................................................................... 17 El venado cola blanca mexicano en la Mixteca Poblana .................................................... 17 Abundancia y estructura poblacional ................................................................................. 18 Monitoreo poblacional........................................................................................................ 22 II. OBJETIVOS .......................................................................................................................... 24 Objetivo General ................................................................................................................ 24 Objetivos Específicos ......................................................................................................... 24 III. PRESENTACIÓN ................................................................................................................ 24 IV. LITERATURA CITADA ..................................................................................................... 25 COMPARACIÓN DE DOS MÉTODOS DE MUESTREO DE CONTEO DE GRUPOS FECALES PARA ESTIMAR LA DENSIDAD POBLACIONAL DEL VENADO COLA BLANCA .................................................................................... 30 I. INTRODUCCIÓN .................................................................................................................. 31 II. HIPÓTESIS............................................................................................................................ 33 III. MÉTODOS ........................................................................................................................... 33 Área de estudio ................................................................................................................... 33 Fase de campo .................................................................................................................... 36 Procedimientos para la estimación de la densidad poblacional.......................................... 38 Simulación del efecto de la variación en el esfuerzo de muestreo sobre la precisión de la estimación de densidad promedio de ind/km2 .................................................................... 40 IV. RESULTADOS .................................................................................................................... 42 Tamaño de muestra............................................................................................................. 42 8 Comparación de la densidad promedio de venados/km2 estimada con las técnicas de muestreo de grupos fecales FSC-P, FAR-P y FSC-TL ...................................................... 45 Efecto del esfuerzo de muestro sobre la estimación de densidad promedio de venados/km2 y su precisión ...................................................................................................................... 49 V. DISCUSIÓN .......................................................................................................................... 54 Comparación entre técnicas de estimación poblacional ..................................................... 55 Análisis de la relación entre esfuerzo de muestreo y precisión de las estimaciones de densidad .............................................................................................................................. 59 VI. CONCLUSIONES Y RECOMENDACIONES ................................................................... 64 VII. LITERATURA CITADA ................................................................................................... 64 ANÁLISIS Y EVALUACIÓN DE LA MORFOMETRÍA DE PELLETS COMO MÉTODO DE CATEGORIZACIÓN DE SEXOS Y EDADES EN VENADO COLA BLANCA (Odocoileus virginianus mexicanus) EN PUEBLA, MÉXICO . 70 I. INTRODUCCIÓN .................................................................................................................. 71 II. HIPÓTESIS............................................................................................................................ 74 III. MÉTODOS ........................................................................................................................... 74 Área de estudio ................................................................................................................... 74 Población en estudio ........................................................................................................... 75 Fase de campo .................................................................................................................... 75 Análisis de datos ................................................................................................................. 77 IV. RESULTADOS .................................................................................................................... 81 Variación morfométrica entre grupos fecales de un mismo individuo dentro y entre épocas ............................................................................................................................................ 81 Comparación entre grupos fecales de individuos de distintas clases de edad y sexo......... 85 Evaluación del desempeño de la técnica de clasificación fuzzy ........................................ 90 V. DISCUSIÓN .......................................................................................................................... 96 VI. CONCLUSIONES Y RECOMENDACIONES ................................................................. 101 VII. LITERATURA CITADA ................................................................................................. 102 DISCUSIÓN GENERAL ....................................................................................... 106 9 LISTA DE FIGURAS CAPÍTULO II Figura 1. Localización del municipio de Jolalpan, Puebla. Mapa tomado de Google Earth. ....... 34 Figura 2. Diagrama ombrotérmico del periodo comprendido entre 1943 y 1999 para la estación climática del municipio de Jolalpan, Pue., ubicada en las coordenadas geográficas 18º32’N y 98º82’W.......................................................................................................................................... 35 Figura 3. Esquema de la disposición en campo del cuadrante de muestreo de un km2. ............... 36 Figura 4. Histograma del número de grupos fecales por parcela colectados en un cuadrante de 500 parcelas en el Rancho El Salado, Jolalpan, Pue. ..................................................................... 43 Figura 5. Histogramas de la distancia perpendicular de los grupos fecales registrados en un cuadrante de un km2 en el Rancho El Salado, Jolalpan, Pue., durante el muestreo de mayo de 2006 (arriba) y mayo de 2007 (abajo). ........................................................................................... 44 Figura 6. Número de grupos fecales presentes en cada periodo de seguimiento del tiempo de deterioro. ........................................................................................................................................ 45 Figura 7. Gráficas de ajuste de los modelos seleccionados a los datos del muestreo de mayo de 2006 y valores de la prueba de bondad de ajuste. a) Modelo Uniforme + Coseno (3) ajustado a los datos sin truncamiento, n = 326. b) Modelo Seminormal + Coseno ajustado a los datos con truncamiento del 5%, n = 310. c) Modelo Uniforme + Coseno ajustado a los datos con truncamiento del 10%, n = 293. ..................................................................................................... 46 Figura 8. Gráficas de ajuste de los modelos seleccionados a los datos del muestreo de mayo de 2007 y valores de la prueba de bondad de ajuste. a) Modelo Uniforme + Coseno ajustado a los datos sin truncamiento, n = 293. b) Modelo Uniforme + Coseno ajustado a los datos con truncamiento del 5%, n = 278. c) Modelo Seminormal ajustado a los datos con truncamiento del 10%, n = 264. ................................................................................................................................. 48 Figura 9. Densidad de venados/km2 e intervalos de confianza del 95% para la simulación de aumento del número de parcelas, mayo de 2006. .......................................................................... 50 Figura 10. Densidad de venados/km2 e intervalos de confianza del 95% para la simulación de aumento en la longitud de transectos de parcelas, mayo de 2006. ................................................. 50 10 Figura 11. Densidad de venados/km2 e intervalos de confianza del 95% para la simulación de aumento de número de transectos de 390 y 790 m de longitud, mayo de 2006. ............................ 51 Figura 12. Densidad de venados/km2 e intervalos de confianza del 95% para la simulación de aumento en la longitud del transecto de línea, mayo de 2006........................................................ 52 Figura 13. Densidad de venados/km2 e intervalos de confianza del 95% para la simulación de aumento en el número de transectos de línea de 390 y 790 m de longitud, mayo de 2006. .......... 52 Figura 14. Densidad de venados/km2 e intervalos de confianza del 95% para la simulación de aumento en el número de transectos de franja de 390 y 790 m de longitud, mayo de 2006. ......... 53 Figura 15. Relación entre esfuerzo de muestreo y porcentaje de cambio detectable de la población para tres métodos de estimación de densidad poblacional evaluados a dos longitudes (390 y 790 m). TP = Transecto de parcelas, TL = Transecto de línea, TF = Transecto de franja. La línea punteada indica el porcentaje de cambio de la población que representa la detección de ± 1 individuo/km2. ............................................................................................................................. 54 Figura 16. Esquema del experimento para determinar tasa de deterioro. Pi representa la fecha de deposición del grupo i, Gi la fecha de desaparición del grupo i, Xi el tiempo de vida de la señal (desde que es depositada hasta que desaparece), xi la edad del grupo fecal medida en la revisita. La señal 1 estuvo presente en el momento de la visita, mientras que la señal 2 ya había desaparecido. Tomado de Laing et al. (2003). ............................................................................... 58 CAPÍTULO III Figura 1. Esquema del procesamiento de una fotografía de un grupo fecal con el programa de cómputo Image J. La fotografía digital es convertida a un archivo binario (en blanco y negro) y las medidas de las variables área, eje mayor y eje menor son proporcionadas asumiendo que los pellets tienen forma de elipse. ........................................................................................................ 77 Figura 2. Variación en el eje mayor entre épocas dada la identidad de cada individuo focal. En el recuadro rosado la primera letra indica la identidad de cada animal, la segunda letra indica el sexo del mismo, H = Hembra, M = Macho. Los números en los bordes externos de la gráfica indican el periodo de muestreo. ...................................................................................................................... 82 11 Figura 3. Representación gráfica de la variación en las medidas morfométricas de los pellets durante los tres periodos de muestreo para un mismo individuo. .................................................. 83 Figura 4. Valores promedio y desviación estándar para cada una de las medidas morfométricas, según sexo y edad, n = 180. Las letras en la parte superior de cada punto indican la significancia del ANOVA, combinaciones “aa” o “bb” indican diferencias no significativas, combinación “ab” indica diferencias significativas (p < 0.05). ................................................................................... 87 Figura 5. Valores promedio y desviación estándar para cada una de las medidas morfométricas para tres categorías de edad, n = 181. El valor junto a cada punto es el valor promedio para la categoría de edad. Las letras en la parte superior de cada barra indican la significancia del ANOVA, combinaciones “aa” o “bb” indican diferencias no significativas, combinación “ab” indica diferencias significativas (p < 0.05). ................................................................................... 88 Figura 6. Remuestreo del número de pellets vs. promedio de la variable morfométrica para el grupo fecal 60. Línea azul representa el promedio de la variable para ese grupo fecal; las líneas rojas son los límites del intervalo de confianza del 95%. .............................................................. 89 Figura 7. Distribución de los porcentajes de asignación de 189 grupos fecales a los tres conjuntos generados por fuzzy. ...................................................................................................................... 93 Figura 8. Número de grupos fecales de animales focales asignado a cada cluster. El número en la parte superior de las barras corresponde al tamaño de muestra para ese individuo. ...................... 94 Figura 9. Distribución de los porcentajes de asignación de 189 grupos fecales a cada cluster, considerando tres categorías de edad; J = Juveniles, H = Hembras, M = Machos. ....................... 95 Figura 10. Distribución de los porcentajes de asignación de 189 grupos fecales a cada cluster, considerando a) dos categorías de edad; JH = Juveniles+Hembras, M = Machos; y b) dos categorías de edad; JHM = Juveniles+Hembras+Machos < 5 años, M = Machos de 5 y 6 años. . 96 DISCUSIÓN GENERAL Figura 1. Representación gráfica del diseño de muestreo recomendado. Las áreas sombreadas de distinto color representan estratos que varían en la abundancia relativa de venado. ................... 109 12 LISTA DE CUADROS CAPÍTULO II Cuadro 1. Resumen de los parámetros estimados para cada uno de los modelos seleccionados en los tres ensayos. Mayo de 2006. ..................................................................................................... 47 Cuadro 2. Resumen de los parámetros estimados para cada uno de los modelos seleccionados en los tres ensayos. Mayo de 2007. ..................................................................................................... 48 Cuadro 3. Comparación de las estimaciones de densidad de venados/km2 producidas por el conteo de grupos fecales aplicado con las técnicas FSC-P y FSC-TL para 2006 y 2007. ............. 49 Cuadro 4. Variación en la densidad promedio de venados en relación al tiempo de depósito de los grupos fecales. .......................................................................................................................... 49 CAPÍTULO III Cuadro 1. Tipo de muestreo, fecha y número de días de tres periodos de muestreo de grupos fecales de individuos en cautiverio en la UMA-Zoológico Flor del Bosque, 2006 y 2007. .......... 76 Cuadro 2. Número de muestras por periodo de muestreo para ocho venados focales durante el periodo de muestreo 2006-2007. .................................................................................................... 81 Cuadro 3. Promedios de cada medida morfométrica por periodo de muestreo y por sexo y resultados del modelo estadístico de efectos mixtos. Se presentan los valores de t y p para la comparación entre sexos, y el porcentaje de varianza que es explicado por el factor ÉPOCA para cada medida morfométrica. ............................................................................................................ 81 Cuadro 4. Resultados de la significancia para pruebas de ANOVA anidada de la comparación de las medidas morfométricas de los grupos fecales dentro de épocas por cada individuo focal. ..... 84 Cuadro 5. Número y porcentaje de grupos fecales por clase de sexo y edad para la época seca, n = 180. Abril – mayo de 2006.......................................................................................................... 85 13 Cuadro 6. Resultados de la prueba de ANOVA para la comparación de las medidas morfométricas entre sexos (g.l. = 1, 169), edades (g.l. = 5, 169) y la interacción sexo:edad (g.l. = 4, 169)............................................................................................................................................. 86 Cuadro 7. Esquema de asignación de individuos por clase de edad y sexo a cada conjunto con base en la mayor membresía, y porcentaje de grupos fecales colocados en cada conjunto, n = 189. ........................................................................................................................................................ 90 Cuadro 8. Esquemas de asignación de individuos por clase de edad y sexo a cada conjunto, utilizando cada una de las medidas morfométricas independientemente, y porcentaje de grupos fecales colocados en cada conjunto, n = 189. ................................................................................ 91 Cuadro 9. Esquema de asignación de individuos por clase de edad y sexo a cada conjunto, quitando los datos de machos de 5 años, y porcentaje de grupos fecales colocados en cada conjunto, n = 184............................................................................................................................ 92 Cuadro 10. Esquema de asignación de individuos por clase de edad y sexo a cada conjunto, quitando los datos de machos de 5 y 6 años, y porcentaje de grupos fecales colocados en cada conjunto, n = 159............................................................................................................................ 92 Cuadro 11. Comparación de las estructuras poblacionales (%) generadas en cada ensayo con la estructura real del grupo en cautiverio. .......................................................................................... 93 DISCUSIÓN GENERAL. Cuadro 1. Ventajas y desventajas de los métodos de conteo de grupos fecales evaluados. ....... 108 14 RESUMEN El conocimiento del tamaño y de la estructura de edades y sexo de una población de fauna silvestre es necesario para lograr estrategias efectivas de manejo. El venado cola blanca mexicano (Odocoileus virginianus mexicanus) es una especie cuya importancia cinegética está creciendo en el estado de Puebla. Con el fin de proponer protocolos que puedan ser usados para evaluar las poblaciones silvestres de la especie en la Mixteca Poblana, este estudio buscó: 1) comparar dos métodos de muestreo y estimación de la densidad poblacional basados en el conteo de grupos fecales (conteo en parcelas y transecto de línea), y 2) evaluar el análisis morfométrico de pellets como herramienta para categorizar clases de edad y sexo. Los resultados mostraron que las estimaciones de densidad de grupos fecales generadas por los dos métodos difirieron en precisión, debido a que éstos permiten obtener tamaños de muestra muy diferentes. Se discute el efecto de la variación en el esfuerzo de muestreo (número de parcelas, así como número y longitud de transectos) sobre la precisión del estimado de densidad de venados/km2 y se sugiere el método y el esfuerzo de muestreo adecuado para evaluar las tendencias poblacionales de la especie. Por otro lado, se evidenció que el análisis morfométrico de pellets es una metodología poco confiable para determinar la estructura de edad y sexo de una población de O. virginianus mexicanus, debido a la alta variación en las medidas morfométricas de los pellets de un mismo individuo y la baja variación mostrada entre pellets de individuos de diferentes clases. En consecuencia, la técnica de clasificación de conjuntos difusos no logró una categorización adecuada pues sólo discriminó a los machos más grandes de la población en estudio. Se finaliza destacando algunos puntos interesantes para ser estudiados en el futuro, con el fin de mejorar los métodos de evaluación de las poblaciones de venado en un ambiente tropical como la selva baja caducifolia. 15 CAPÍTULO I INTRODUCCIÓN GENERAL 16 I. ANTECEDENTES GENERALES El venado cola blanca mexicano en la Mixteca Poblana El venado cola blanca (Odocoileus virginianus) es la especie con más amplia distribución en México (Galindo-Leal y Weber 1998) y según Méndez (1984) en el país están presentes 14 de las 34 subespecies distribuidas en el continente americano. El venado cola blanca se distribuye en una gran cantidad de ambientes, con la única excepción de los climas más séricos del norte del país (Galindo-Leal y Weber 1998). Es una especie altamente plástica y tolerante, capaz de ocupar una amplia variedad de hábitats, llegando incluso a prosperar en áreas transformadas por el hombre (Baker 1984, Teer 1994). La subespecie O. virginianus mexicanus se distribuye de forma natural en el centro de México, en los estados de Guanajuato, Puebla, Querétaro, Hidalgo, Guerrero, Oaxaca, Morelos, México, Distrito Federal, Querétaro, San Luís Potosí, Tlaxcala, Michoacán y Veracruz. En el estado de Puebla se encuentra principalmente en la región mixteca, en los volcanes Iztaccíhuatl y Popocatépetl y en menor medida en el altiplano central (Villarreal-Espino y Barros 2000). En la Mixteca Poblana es donde las poblaciones de venado cola blanca mexicano son más abundantes, debido a su relativo aislamiento, topografía accidentada, baja densidad poblacional humana y vegetación en un grado moderado de conservación (Villarreal-Espino y Barros 2000). La Mixteca es una región étnica que se localiza al sur del estado de Puebla, está conformada por 47 municipios y cuenta con una superficie de 10.565 km2 (INEGI 2000 citado en Villarreal-Espino y Guevara 2002). Con base en una evaluación que combinó información ecogeográfica, de tipos de vegetación y económica, Villarreal y Guevara (2002) definieron las áreas con la posible presencia del venado, encontrando que la especie se distribuye principalmente en la zona oeste de la Mixteca Poblana, donde se encuentra la selva baja caducifolia, disminuyendo paulatinamente al 17 centro y poniente. La superficie total de distribución corresponde a 5.475 km2, que representa el 51.8% de la región. Las actividades económicas de la región son la ganadería extensiva, la agricultura de temporal, la minería y la silvicultura, las cuales son poco productivas y han producido la degradación de los ecosistemas naturales (López-Tellez et al. 2007). El aprovechamiento racional del venado cola blanca mexicano dentro de Unidades de Manejo para la Conservación de la Vida Silvestre (UMAS) de tipo extensivo, combinado con la explotación de ganado, se ha propuesto como un modelo que produciría beneficios ecológicos, económicos y sociales para la región (Villarreal-Espino y Barros 2000). Con el fin de proponer áreas prioritarias para el aprovechamiento y conservación de la especie en la Mixteca, López-Tellez et al. (2007) estimaron la densidad poblacional y caracterizaron el hábitat en cuatro municipios, encontrando que las densidades son bajas, alrededor de 2 ind/km2, debido posiblemente a la cacería furtiva, la extensión de la frontera agrícola y la competencia entre ganado y venado. El Rancho El Salado, con una densidad estimada de 3.4 ind/km2, la más alta de los cuatro municipios estudiados por López-Tellez et al. (2007) fue la localidad seleccionada para desarrollar el presente estudio. Abundancia y estructura poblacional El éxito del manejo de poblaciones silvestres de fauna depende en gran medida del conocimiento de la estructura y función de las respectivas poblaciones y ante todo de sus variaciones en el tiempo o dinámica poblacional (Ojasti 2000). La dinámica de cualquier población animal es función de la densidad poblacional, la estructura de edades, la proporción de sexos y la tasa de crecimiento (Ezcurra y Gallina 1981). De éstos, el tamaño poblacional es quizá el aspecto más importante pues la finalidad y éxito de las acciones de manejo son frecuentemente 18 expresadas en términos de este número (Lancia et al. 1996). En el caso de los ungulados en los que las tasas de sobrevivencia y mortalidad varían según las clases de sexo y edad (Clutton-Brock y Lonergan 1994, Coulson et al. 2001), el conocimiento de la estructura poblacional juega un papel fundamental en su manejo. Para el venado cola blanca, la especie de fauna silvestre más importante desde el punto de vista económico y cinegético en México, el conocimiento de la proporción de sexos y estructura de edades de sus poblaciones resulta tan importante como el de su densidad (Villarreal 1996). Métodos de estimación de la abundancia poblacional en ungulados.--La mayoría de decisiones relacionadas con el manejo de una población de vida silvestre requiere información sobre el número de animales (Caughley 1994, Lancia et al. 1996, Ojasti 2000). Éste se puede expresar como abundancia o tamaño total de individuos en la población, como densidad expresada en número de individuos por unidad de área, o por medio de índices que se relacionan proporcionalmente con el tamaño poblacional (Ojasti 2000). Existen muchos métodos para obtener un estimativo de la densidad los cuales varían en la magnitud de su exactitud, precisión y costo (Caughley 1994). El método más indicado en cada caso dependerá del objetivo, la especie, la población, el hábitat, la escala espacio-temporal y los recursos económicos disponibles (Ojasti 2000, Marques et al. 2001). En el caso de los ungulados la densidad poblacional ha sido estimada a través de métodos de conteo directo y métodos de conteo indirectos. Los métodos directos se pueden separar en tres grandes grupos: conteo en transectos de franja y transectos de línea (Gates et al. 1968, Robinette et al. 1974, Eberhardt 1978, Focardi et al. 2002), captura-marcaje y recaptura (Nichols y Dickman 1996) y reconstrucción poblacional con base en datos de cacería (Cattadori et al. 2003). Los métodos indirectos se basan en el número de rastros detectados por unidad de esfuerzo 19 (Ojasti 2000) y los más utilizados son el conteo de huellas (Mayle et al. 2000, Mandujano 2005) y el conteo de grupos fecales (Neff 1968, Batcheler 1975, Bailey y Putman 1981, Freddy y Bowden 1983, Rivero et al. 2004). El muestreo de grupos fecales es el método más consolidado en la estimación de abundancia de cérvidos y otros herbívoros de mayor porte (Ojasti 2000). Inicialmente fue utilizado como índice de abundancia y luego evaluado como método para censar poblaciones de venado bajo los siguientes supuestos: 1) los animales tienen una tasa de defecación constante de 13 grupos fecales/venado/día, 2) se conoce la fecha de depósito de los grupos fecales, 3) todos los grupos en la parcela son contados y correctamente identificados, 4) el tamaño de la unidad muestral es eficiente y 5) se obtienen estimaciones válidas del error de muestreo (Eberhardt y Van Etten 1956). Este método busca determinar la densidad de grupos de heces en un área y el número de venados necesario para obtener ese número (Burgoyne y Moss 1974), a partir de la utilización de la tasa de defecación y el tiempo de depósito como factores de conversión (Bailey y Putman 1981). Comúnmente el muestreo se hace en parcelas circulares o rectangulares dispuestas a lo largo de transectos de variada longitud para facilitar su localización (Neff 1968, Smith 1968, Burgoyne y Moss 1974). Recientemente, se ha aplicado el método del transecto de línea (Buckland et al. 1993) al conteo de grupos fecales para evitar el sesgo producido por no la detección de todos los grupos (Marques et al. 2001, Walsh et al. 2001, Ellis y Bernard 2005). Si el objetivo primordial del estudio es detectar diferencias entre lugares o periodos, la transformación del índice en densidad no es necesario (Ojasti 2000). Como índice, el conteo de grupos fecales ofrece varias ventajas: provee un registro persistente de la presencia del venado independientemente de su actividad, por tratarse de una evidencia inerte puede ser sometido a un muestreo parcelado y a análisis estadístico, es capaz de producir datos bajo la mayoría de condiciones de campo y no es afectado por el observador (Eberhardt y Van Etten 1956, Neff 20 1968, Burgoyne y Moss 1974). La premisa que un índice es proporcional a la densidad poblacional es lógica pero muchas veces no se cumple. En el caso del conteo de grupos fecales, Forsyth et al. (2007) demostraron que existe una relación positiva y aproximadamente lineal entre los conteos de grupos fecales y la densidad de venados. Las estimaciones de la densidad poblacional son requeridas para definir tasas de aprovechamiento, establecer épocas de veda, ajustar la relación machos:hembras y conocer el porcentaje de sobrevivencia de las crías (Gallina 1994, Villarreal 1999), por tanto, es necesario transformar el índice aplicando dos factores de conversión, el tiempo de depósito y la tasa de defecación. El primero se refiere al periodo de acumulación de los grupos y varía según el tipo de hábitat (Prugh y Krebs 2004) mientras que el segundo es el número de grupos fecales depositados por animal por día, el cual depende de la calidad del forraje y la edad (Rogers 1987, Sawyer et al. 1990). Para evitar sesgos en la estimación de densidad éstos factores deberían ser determinados de manera particular para cada área de estudio. Métodos de estimación de la estructura poblacional.--Los individuos que integran una población de vertebrados no son idénticos, su estructura demográfica es la que más importa en la dinámica poblacional porque se refiere a la frecuencia de las clases de edad o tamaño, segregadas por sexo. Esta estructura adquiere una importancia singular en el estudio de la dinámica poblacional cuando las tasas de sobrevivencia y fecundidad varían según la edad (Ojasti 2000). Conocer la proporción de sexos y la estructura de edades de una población proporciona indicios importantes sobre la historia reciente, el estado actual y probablemente las tendencias futuras inmediatas (Dimmick y Pelton 1996). Las edades estimadas pueden ser absolutas o relativas. La estimación de la edad absoluta en unidades de tiempo se basa en ciertos rasgos morfológicos asociados al crecimiento y desarrollo, mientras que la clasificación en edades relativas se fundamenta en etapas sucesivas de la vida, tales como juvenil, subadulto y adulto (Ojasti 2000). 21 Los métodos que estiman edades absolutas buscan detectar correlaciones entre la edad y características corporales (Kunz et al. 1996). Por ejemplo, para los cérvidos existen varios métodos que varían en exactitud pero que han sido ampliamente usados. Severinghaus (1949) y Gilbert y Stolt (1970) examinaron la relación entre el grado de desgaste dental y la edad en venado cola blanca. La deposición anual de capas de cemento en incisivos de varias especies de cérvidos fue relacionada con la edad por Gilbert (1966). El peso del cristalino ha sido considerado un buen criterio de edad porque aumenta durante toda la vida por la acumulación de proteínas insolubles (Ojasti 2000) y su relación con la edad fue evaluada por Brokx (1972) para el venado cola blanca en Venezuela. Estos métodos tienen en común que requieren la captura del individuo o muestras procedentes de animales cazados o de restos encontrados en campo (Kunz et al. 1996, Ojasti 2000). Dentro de los métodos que estiman edades relativas está el análisis morfométrico de pellets que ha sido usado en ungulados como el venado cola blanca de Coues (O. virginianus couesi) (Ezcurra y Gallina 1981), el alce (Alces alces) (MacCracken y van Ballenberghe 1987) y el venado bura (O. hemionus) (Sánchez-Rojas et al. 2004). Idealmente, un criterio para determinar sexo y edad debe permitirle al manejador: a) asignar al animal individual a un grupo de sexo y edad con un mínimo de subjetividad, y b) segregar clases de sexo y edad con poco o nada sobrelapamiento (Dimmick y Pelton 1996). Monitoreo poblacional Toda población tiene en un momento dado un tamaño N y una densidad D reales, que casi nunca pueden determinarse; aplicando un metodología apropiada, sin embargo, se obtienen estimadores de los parámetros y o índices proporcionales a éstos (Ojasti 2000). El desempeño de un estimador se mide en términos de su exactitud, precisión y sesgo. La exactitud 22 es una medida de qué tan cerca está un estimador poblacional del tamaño poblacional real (Lancia et al. 1996). Si fuera posible tener k muestras de la población objetivo, el promedio aritmético de todas las posibles muestras sería el valor esperado; la diferencia entre éste y el tamaño poblacional verdadero es el sesgo del método (Lancia et al. 1996, Thompson et al. 1998). La precisión es una medida del error de muestreo o de la dispersión de los valores muestrales alrededor del promedio y de la repetibilidad del muestreo y es proporcional a la varianza muestral (Ojasti 2000). Ésta última juega un papel muy importante en el monitoreo poblacional. Un monitoreo poblacional se refiere a la evaluación de la abundancia, densidad u otro atributo poblacional dentro de un área definida en varios periodos de tiempo, con el fin de detectar cambios en estos atributos tanto en magnitud como en dirección (Thompson et al. 1998). La importancia del monitoreo radica en que es la herramienta a ser usada para evaluar y alcanzar objetivos de manejo específicos y el cual debe ser visto como parte integral de un programa más general (Thompson et al. 1998, Gibbs et al. 1999). La hipótesis nula en el monitoreo es que no hay cambios en el tamaño poblacional y la intención es rechazarla, pues fallar en hacerlo significa que probablemente se decide no ejecutar ninguna acción para asistir o manejar la población. Asumir incorrectamente que debido a que no se rechazó la hipótesis nula no hay un cambio en la población podría traer un efecto dramático sobre la misma (Zielinski y Stauffer 1996, Thompson et al. 1998). La validez de esta decisión depende del poder de la prueba y éste está directamente relacionado con la precisión de los datos. El poder estadístico (1 - β) se define como la probabilidad de detectar un cambio cuando ha ocurrido, es decir, de rechazar la hipótesis nula cuando ésta es falsa (Zielinski y Stauffer 1996). Como parte de un esquema de monitoreo adecuado el manejador debe conducir un proceso de toma de decisiones que lo lleve a establecer el valor de alfa, el poder deseado y la máxima disminución aceptable (Kendall et al. 1992). La cuestión es entonces seleccionar el 23 método y el esquema de muestreo que tenga mayor probabilidad de detectar un declive en la población (Taylor y Gerrodette 1997). II. OBJETIVOS Objetivo General Evaluar el método de conteo de grupos fecales y el análisis morfométrico de los pellets como herramientas para estimar parámetros demográficos del venado cola blanca (Odocoileus virginianus mexicanus) en Puebla, México. Objetivos Específicos 1. Comparar los estimativos de densidad del venado cola blanca producidos por el conteo de grupos fecales aplicado con las técnicas FAR-P, FSC-P y FSC-Transecto de línea. 2. Analizar el efecto de diferentes diseños de muestreo (número de parcelas, distancia entre parcelas, número de transectos, longitud de los transectos) sobre la precisión de la estimación de densidad de venado cola blanca producida por el conteo de grupos fecales. 3. Evaluar el análisis morfométrico de los pellets como método de categorización de clases de edad y sexo en individuos de venado cola blanca. 4. Proponer un diseño de muestreo para la futura aplicación de estos métodos en la Mixteca Poblana con base en los resultados obtenidos. III. PRESENTACIÓN Este documento está organizado en cuatro capítulos. En los capítulos que siguen se estudia en detalle cada uno de los métodos objeto de evaluación. En el capítulo II “Comparación 24 de dos métodos de muestreo de conteo de grupos fecales para estimar la densidad poblacional del venado cola blanca”, busco definir cuál es el método y diseño de muestreo de grupos fecales más adecuado para ser utilizado en futuros estudios y evaluaciones poblacionales de la especie. En el capítulo III sobre el “Análisis y evaluación de la morfometría de pellets como método de categorización de sexos y edades en venado cola blanca (Odocoileus virginianus mexicanus) en Puebla, México”, evalúo el desempeño de esta herramienta para estimar la estructura de edad y sexo de poblaciones del venado cola blanca mexicano. En el capítulo final de Discusión General resumo los hallazgos más importantes, hago recomendaciones para la aplicación de los métodos objeto de evaluación y sugiero algunos temas de estudio que son necesarios para mejorar la información obtenida mediante el uso de estos métodos. El formato del documento sigue los lineamientos generales establecidos por la guía para la elaboración de tesis del posgrado del INECOL y las instrucciones de la revista The Journal of Wildlife Management. IV. LITERATURA CITADA BAILEY, R. E. Y R. J. PUTMAN. 1981. Estimation of fallow deer (Dama dama) populations from faecal accumulation. The Journal of Applied Ecology 18: 697-702. BAKER, R. H. 1984. Origin, classification and distribution. Págs. 1-18 in L. K. Halls (ed.). White tailed deer: Ecology and management. Stackpole Books, Harrisburg, PA, USA. BATCHELER, C. L. 1975. Development of a distance method for deer census from pellet groups. The Journal of Wildlife Management 39: 641-652. BROKX, P. A. 1972. Age determination of Venezuelan white-tailed deer. The Journal of Wildlife Management 36 : 1060-1067. BUCKLAND, S. T., D. R. ANDERSON, K. P. BURNHAM Y J. L. LAAKE. 1993. Distance sampling: estimating abundance of biological populations. Chapman and Hall. London. 25 BURGOYNE, G. E. Y M. L. MOSS. 1974. The 1974 deer pellet group surveys. Survey and Statistical Servirces Report No. 134. CATTADORI, I. M., D. T. HAYDON, S. J. THIRGOOD Y P. J. HUDSON. 2003. Are indirect measures of abundance a useful index of population density? The case of red grouse harvesting. Oikos 100: 439-446. CAUGHLEY, G. Y A. R. E. SINCLAY. 1994. Wildlife ecology and management. Blackwell Scientific Publications. Boston. CLUTTON-BROCK, T. H. Y M. E. LONERGAN. 1994. Culling regimes and sex ratio biases in highland red deer. The Journal of Applied Ecology 31: 521-527. COULSON, T., E. A. CATCHPOLE, S. D. ALBON, B. J. T. MORGAN, J. M. PEMBERTON, T. H. CLUTTON-BROCK, M. J. CRAWLEY Y B. T. GRENFELL. 2001. Age, sex, density, winter weather, and population crashes in Soay sheep. Science 292: 1528-1531. DIMMICK, R. W. Y M. R. PELTON. 1996. Criteria of sex and age. Págs. 169-214 in T. A. Bookhout, editor. Research and Management Techniques for Wildlife and Habitats. Fifth edition. The Wildlife Society. Bethesda, MD., USA. EBERHARDT, L. 1978. Transect methos for population studies. The Journal of Wildlife Management 42: 1-31. --------, Y R. C. VAN ETTEN. 1956. Evaluation of the pellet group count as a deer census method. The Journal of Wildlife Management 20: 70-74. ELLIS, A. M. Y R. T. F. BERNARD. 2005. Estimating the density of Kudu (Tragelaphus strepsiceros) in subtropical thicket using line transect surveys of dung and Distance software. African Journal of Ecology 43: 362-368. EZCURRA, E. Y S. GALLINA. 1981. Biology and populations dynamics of white-tailed deer in northwestern Mexico. Págs. 77-108 in P. F. Ffolliot y S. Gallina, editores. Deer biology, habitat requirements, and management in western North America. Instituto de Ecologia, A. C. México. FOCARDI, S., R. ISOTTI Y A. TINELLI. 2002. Line transect estimates of ungulate populations in a mediterranean forest. The Journal of Wildlife Management 66: 48-58. FORSYTH, D. M., R. J. BARKER, G. MORRIS Y M. P. SCROGGIE. 2007. Modeling the relationship between fecal pellet indices and deer density. The Journal of Wildlife Management 71: 964-970. 26 FREDDY, D. J. Y D. C. BOWDEN. 1983. Sampling mule deer pellet-group densities in juniperpinyon woodland. The Journal of Wildlife Management 47: 476-485. GALINDO-LEAL, C. Y M. WEBER. 1998. El Venado de la Sierra Madre Occidental. Ecología, manejo y conservación. EDICUSA-CONABIO. México D.F. GALLINA, S. 1994. Dinámica poblacional y manejo poblacional del venado cola blanca en la Reserva de la Biósfera La Michilía, Durango, México. Págs. 207-234 in C. Vaughan y M. A. Rodríguez (eds.). Ecología y manejo del venado cola blanca en México y Costa Rica. Ed. Euna. 1 edición. Heredia, Costa Rica. GATES, C. E., W. H. MARSHALL Y D. P. OLSON. 1968. Line transect method of estimating grouse population densities. Biometrics 24: 135-145. GIBBS, J. P., H. L. SNELL Y CH. E. CAUSTON. 1999. Effective monitoring for adaptative wildlife management: lessons from the Galápagos Islands. The Journal of Wildlife Management 63: 1055-1065. GILBERT, F. F. 1966. Aging white-tailed deer by annuli in the cementum of the first incisor. The Journal of Wildlife Management 30: 200-203. --------. Y S. L. STOLT. 1970. Variability in ageing Maine white-tailed deer by tooth characteristics. The Journal of Wildlife Management 34: 532-535. KENDALL, K. C., L. H. METZGAR, D. A. PATTERSON Y B. M. STEELE. 1992. Power of sign surveys to monitor population trends. Ecological applications 2: 422-430. KUNZ, T. H., C. WEMMER Y V. HAYSSEN. 1996. Appendix 5: Sex, age, and reproductive condition of mammals. Págs. 279-290 in D. E. Wilson, F. Russell-Cole, J. D. Nichols, R, Rudran y M. S. Foster, editors. Measuring and monitoring biological diversity, Standard methods for mammals. Smithsonian Institution. USA. LANCIA, R. A., J. D. NICHOLS Y K. H. POLLOCK. 1996. Estimating the number of animals in wildlife populations. Págs. 215-253 in T. A. Bookhout, editor. Research and Management Techniques for Wildlife and Habitats. Fifth edition. The Wildlife Society. Bethesda, MD., USA. LÓPEZ-TELLEZ, M. C., S. MANDUJANO Y G. YÁNES. 2007. Evaluación poblacional del venado cola blanca en un bosque tropical seco de la Mixteca Poblana. Acta Zoológica Mexicana 23: 116. 27 MACCRACKEN, J. G. Y VAN BALLENBERGHE. 1987. Age-and sex-related differences in fecal pellet dimensions of moose. The Journal of Wildlife Management 51: 360-364. MANDUJANO, S. 2005. Calibration of tracks count to estimate population density of white-tailed deer (Odocoileus virginianus) in a Mexican tropical forest. The Southwestern Naturalist 50: 223-229. MARQUES, F., S. T. BUCKLAND, D. GOFFIN, C. E. DIXON, D. L. BORCHERS, B. A. MAYLE Y A. J. PEACE. 2001. Estimating deer abundance from line transect surveys of dung: sika deer in sourthern Scotland. The Journal of Applied Ecology 38: 34-363. MAYLE, B. A., R. J. PUTMAN Y I. WYLLIE. 2000. The use of trackway counts to establish an index of deer presence. Mammal Review 30: 233-237. MÉNDEZ, E. 1984. Mexico and Central America. Págs. 513-524 in L. K. Halls (ed.). White tailed deer: Ecology and management. Stackpole Books, Harrisburg, PA, USA. NEFF, D. J. 1968. The pellet-group count technique for big game trends, census, and distribution: a Review. The Journal of Wildlife Management 32: 597-614. NICHOLS, J. D. Y C. R. DICKMAN. 1996. Capture-Recapture methods. Págs. 217-226 in D. E. Wilson, F. Russell-Cole, J. D. Nichols, R, Rudran y M. S. Foster, editors. Measuring and monitoring biological diversity, Standard methods for mammals. Smithsonian Institution. USA. OJASTI, J. 2000. Manejo de fauna silvestre neotropical. F. Dallmeier, editor. SIMAB Series No. 5. Smithsonian Institution/MAB Program, Washington, D.C. PRUGH, L. R. Y CH. J. KREBS. 2004. Snowshoe hare pellet-decay rates and aging in different habitats. Widlife Society Bulletin 32: 386-393. RIVERO, K., D. I. RUMIZ & A. B. TABER. 2004. Estimating brocket deer (Mazama gouazoubira and M. americana) abundance by pellet counts and other indices in seasonal chiquitano forest habitats of Santa Cruz, Bolivia. European Journal of Wildlife Research 50: 161-167. ROBINETTE, W. L., C. M. LOVELESS Y D. A. JONES. 1974. Field test of strip census methods. The Journal of Wildlife Management 38: 81-96. ROGERS, L. L. 1987. Seasonal changes in defecation rates of free-ranging white-tailed deer. The Journal of Wildlife Management 51: 330-333. SÁNCHEZ-ROJAS, G., S. GALLINA & M. EQUIHUA. 2004. Pellet morphometry as a tool to distinguish age and sex in the mule deer. Zoo-Biology 23: 139-146. 28 SAWYER, T. G., R. L. MARCHINTON Y W. M. LENTZ. 1990. Defecation rates of female white-tailed deer in Georgia. Wildlife Society Bulletin 18: 16-18. SEVERINGHAUS, C. W. 1949. Tooth development and wear as criteria of age in white-tailed deer. The Journal of Wildlife Management 13: 195-216. SMITH, R. 1968. A comparison of several sizes of circular plots for estimating deer pellet groupdensity. The Journal of Wildlife Management 32: 585-591. TAYLOR, B. L. Y T. GERRODETTE. 1997. The uses of statistical power in conservation biology: the vaquita and northen spotted owl. Conservation Biology 7: 489-500. TEER, J. 1994. El venado cola blanca: historia natural y principios de manejo. Págs. 33-47 in C. Vaughan y M. A. Rodríguez (eds.). Ecología y manejo del venado cola blanca en México y Costa Rica. Ed. Euna. 1 edición. Heredia, Costa Rica. THOMPSON, W. L., G. C. WHITE Y CH. GOWAN. 1998. Monitoring vertebrate populations. Academic Press. USA. VILLARREAL, J. 1996. Importancia de la relación machos:hembras en la producción de trofeos de venado cola blanca (Odocoileus virginianus). Memorias V simposio de venados en México. UNAM, Quintana Roo. --------. 1999. Venado cola blanca. Manejo y aprovechamiento cinegético. Unión Ganadera Regional de Nuevo León. México. VILLARREAL-ESPINO, O. Y O. BARROS. 2000. El aprovechamiento sustentable de venado cola mexicano (Odocoileus virginianus mexicanus), una alternativa para el uso del suelo en la región de la Mixteca Poblana. VII Simposio sobre venados en México. Facultad de Medicina Veterinaria y Zootecnia, UNAM, México, D.F. --------. Y R. V. GUEVARA. 2002. Distribución regional del venado cola blanca mexicano (Odocoileus virginianus mexicanus) en la Mixteca Poblana, México. Revista Producción Animal 14: 35-40. WALSH, P. D., L. WHITE, C. MBINA, D. IDIATA, Y. MIHINDOU, F. MAISELS Y M. THIBAULT. 2001. Estimates of forest elephant abundance: projecting the relationships between precision and effort. The Journal of Applied Ecology: 38: 217-228. ZIELINSKI, W. J. Y H. B. STAUFFER. 1996. Monitoring martes populations in California: survey desing and power analysis. Ecological Applications 6: 1254-1267. 29 CAPÍTULO II COMPARACIÓN DE DOS MÉTODOS DE MUESTREO DE CONTEO DE GRUPOS FECALES PARA ESTIMAR LA DENSIDAD POBLACIONAL DEL VENADO COLA BLANCA 30 I. INTRODUCCIÓN El manejo de las poblaciones silvestres de venado cola blanca (Odocoileus virginianus) debe basarse en información precisa y objetiva (Galindo-Leal y Weber 1998). El tamaño poblacional es uno de los parámetros demográficos más importantes y para estimarlo en el caso particular del venado cola blanca, existen métodos directos e indirectos. Dentro de los primeros están el conteo en transectos de franja y transectos de línea (Gates et al. 1968, Robinette et al. 1974, Eberhardt 1978, Focardi et al. 2002), captura-marcaje y recaptura (Nichols y Dickman 1996) y reconstrucción poblacional con base en datos de cacería (Cattadori et al. 2003). Los métodos indirectos más utilizados son el conteo de huellas (Tyson 1959, Mayle et al. 2000, Mandujano 2005) y el conteo de grupos fecales (Neff 1968, Batcheler 1975, Bailey y Putman 1981, Freddy y Bowden 1983, White 1992, Rivero et al. 2004). El conteo de grupos fecales ofrece varias ventajas sobre otros métodos (Eberhardt y Van Etten 1956, Neff 1968, Burgoyne y Moss 1974, Barnes 2002) y consiste en determinar la densidad de grupos de heces en un área y el número de venados necesario para obtener ese número (Burgoyne y Moss 1974), a partir de la utilización de la tasa de defecación y el tiempo de depósito como factores de conversión (Bailey y Putman 1981). Metodológicamente esto se puede llevar a cabo mediante el conteo de todos los grupos fecales presentes en parcelas y la estimación de la tasa de desaparición de los mismos (FSC, Faecal Standing Crop) o examinando la tasa de acumulación de los grupos en parcelas fijas que son limpiadas regularmente (FAR, Faecal Accumulation Rate) (Wemmer et al. 1996, Marques et al. 2001). La segunda categoría a menudo produce estimaciones más exactas pero menos precisas que la primera debido a que el número de parcelas vacías suele ser mucho mayor (Bailey y Putman 1981, Nchanji y Plumptre 2001, Campbell et al. 2004). 31 Ambas técnicas requieren la detección de todos los grupos presentes en las parcelas y por tanto consumen tiempo (Marques et al. 2001). Como alternativa al muestreo FSC en parcelas, recientemente se ha aplicado el método del transecto de línea (Buckland et al. 1993) al conteo de grupos fecales para evitar el sesgo producido por la no detección de todos los grupos y especialmente en lugares de baja densidad donde el número de parcelas instaladas debería ser lo suficientemente grande para generar estimaciones con adecuada precisión (Marques et al. 2001, Walsh et al. 2001, Ellis y Bernard 2005). En México, el conteo de grupos fecales es el método más empleado para estimar la densidad de las especies de venado (Galindo-Leal 1993), aunque en los estados del noreste del país son más frecuentes métodos directos como el conteo físico nocturno de animales con auxilio de luz artificial y el conteo aéreo (Villarreal 1999). En el método indirecto, el diseño de muestreo comúnmente utilizado se puede catalogar dentro de la técnica FAR, pues consiste en establecer parcelas circulares de 9.29 m2 distanciadas 10 m a lo largo de transectos de 390 m de longitud que se limpian al inicio del estudio (Ezcurra y Gallina 1981). El tiempo de depósito utilizado en los estudios mexicanos ha sido variable, con valores oscilando de 50 a 120 días (Ezcurra y Gallina 1981, Morales et al. 1989, Gallina 1990, Mandujano y Gallina 1995, Corona 2003, OrtizMartínez et al. 2005). Para determinar la confiabilidad del método se requiere conocer el sesgo y la precisión de sus estimaciones poblacionales, pero hasta el momento los trabajos que discuten algunos aspectos del mismo son pocos (Galindo-Leal y Morales 1987, Morales et al. 1989, Galindo-Leal 1992, Gallina y Ezcurra 1992), con escaso sustento empírico y carentes de nuevas propuestas para su aplicación. Dado el creciente interés en el aprovechamiento cinegético de la especie en el estado de Puebla, se evidencia la necesidad de contar con métodos de estimación de la densidad poblacional que puedan ser utilizados en lugares con bajos niveles poblacionales de venado y en 32 donde se dificulta el uso de métodos directos (López-Téllez et al. 2007). Este estudio buscó responder ¿cómo es el desempeño de las técnicas FAR-Parcelas (FAR-P), FSC-Parcelas (FSC-P) y FSC-Transecto de línea (FSC-TL) en términos de precisión para estimar la densidad poblacional de venado cola blanca? y ¿cómo afecta la variación en el esfuerzo de muestreo, representado en el número de parcelas de muestreo, y número y longitud de transectos la estimación de densidad poblacional promedio y su precisión?. Las respuestas a estas preguntas permitirán definir cuál es el método y diseño de muestreo de grupos fecales más adecuado para ser utilizado en futuros estudios y evaluaciones poblacionales de la especie. II. HIPÓTESIS 1.- Debido a que las técnicas FAR y FSC varían en el tamaño de muestra que permiten obtener en campo, la precisión de sus estimaciones de densidad promedio de ind/km2 diferirá. Al compararlas, la técnica FSC aplicada con transecto de línea (FSC-TL) proporcionará la estimación de densidad promedio más precisa, seguida por FSC con parcelas (FSC-P) y finalmente FAR (FAR-P). 2.- En ausencia de sesgo, la estimación de la densidad promedio de venados/km2 no debe diferir significativamente al variar el esfuerzo de muestreo (número de parcelas, número y/o longitud de transectos). En cambio, espero que al incrementar el esfuerzo de muestreo aumente la precisión asociada al estimativo. III. MÉTODOS Área de estudio El estudio se llevó a cabo en el municipio de Jolalpan en la Mixteca Poblana ubicada al sur del estado de Puebla (Fig. 1). Jolalpan se ubica en las coordenadas geográficas 18º12’18’’ y 33 18º27’54’’ de latitud norte y 98º46’24’’ y 99º04’06’’ de longitud occidental; presenta una extensión de 423,53 km2, la topografía es muy accidentada y cuenta con una altitud que varía de los 600 a los 2750 msnm. El clima es cálido subhúmedo con lluvias en verano y la vegetación característica es la selva baja caducifolia asociada a vegetación secundaria arbustiva (INAFED 2005). N ÍJolalpan 940 km 18º 17’36 N, 98º51’29 O Veracruz Tlaxcala Morelos Puebla Guerrero Oaxaca Figura 1. Localización del municipio de Jolalpan, Puebla. Mapa tomado de Google Earth. En el periodo comprendido entre 1943 y 1999 la precipitación media anual fue de 816.5 mm; el mes más lluvioso fue julio con una precipitación media mensual de 168.82 mm, mientras que el más seco fue diciembre con 1.17 mm. En el mismo periodo, la temperatura media anual 34 fue de 20.8ºC; el mes más cálido fue mayo con una temperatura media mensual de 24.2ºC y el mes más frio enero con 16.4ºC (Fig. 2). Las principales actividades económicas del municipio 90 180 80 160 70 140 60 120 50 100 40 80 30 60 20 40 10 20 0 Precipitación (mm) Temperatura ( C) son la agricultura, la ganadería, la pesca y la horticultura (INAFED 2005). 0 ENE FEB MAR ABR MAY JUN JUL AGO SEP OCT NOV DIC Mes Precipitación media mensual Temperatura media mensual Figura 2. Diagrama ombrotérmico del periodo comprendido entre 1943 y 1999 para la estación climática del municipio de Jolalpan, Pue., ubicada en las coordenadas geográficas 18º32’N y 98º82’W. El cuadrante de muestreo se localizó en el ejido El Salado que actualmente está dado de alta como UMA y donde López-Tellez et al. (2007) registraron para el venado cola blanca una densidad poblacional de 3.4 ± 0.02 (E.E.) ind/km2, la densidad de venado más alta comparada con otras localidades de la región. El ejido presenta una altura promedio de 1056.2 msnm y una extensión de 31.25 km2, de los cuales el 0.6% (0.18 km2) corresponde a asentamientos humanos mientras que el restante 99.4% (31.07 km2) está destinado a la agricultura como actividad primaria (López-Tellez 2006). La pendiente clasificada como ladera tiene una inclinación del 18%; el estrato arbóreo tiene una altura promedio de 6 m y una densidad arbórea de 9.6 ind/m2, el 35 sotobosque está bien desarrollado y el grado de perturbación del hábitat es relativamente menor que en otras localidades del municipio como Mitepec o Huachinantla (López-Tellez 2006). Fase de campo Desde el 23 de mayo al 2 de junio de 2006, instalé un cuadrante de un km2 en donde coloqué cinco transectos paralelos de 1000 m de longitud separados 250 m, iniciando a los 0 m. En cada transecto establecí 100 parcelas de 9.29 m2 distanciadas 10 m teniendo un total de 500 parcelas de muestreo. Cada transecto de 1000 m quedó dividido por un camino, de tal forma que a cada lado de éste fueron instaladas 50 parcelas, siempre paralelas a la pendiente (Fig. 3). Figura 3. Esquema de la disposición en campo del cuadrante de muestreo de un km2. La selección del sitio para la ubicación del cuadrante de 1 km2 no se hizo al azar sino que se apoyó en criterios como presencia relativamente alta de venado, rápido acceso para los muestreos periódicos, y cercano al poblado para evitar que los animales fueran perturbados por 36 posibles cazadores furtivos. De esta manera, atendiendo las recomendaciones de los ejidatarios el cuadrante se ubicó en un sector a aproximadamente 1 km de distancia del poblado. Pinté, marqué con cinta flaggy y georreferencié el punto sobre el camino. Seguí el rumbo definido por la brújula para tratar de que el transecto permaneciera lo más recto posible, al tiempo que coloqué un hilo nylon para indicar el centro de la línea. Cada 10 m marqué el centro de la parcela y lo nombré con su respectivo número consecutivo y de transecto. En cada parcela colecté los grupos fecales presentes en un radio de 1.72 m, aproximadamente. Consideré un grupo fecal como el conjunto de diez o más pellets de apariencia similar. Durante el mismo recorrido, medí la distancia perpendicular de la línea a los grupos fecales observados a lado y lado de la misma, asegurando que aquellos encontrados sobre la línea fueran detectados. Colecté estos grupos y registré su ubicación aproximada en la línea. También medí la distancia perpendicular a la línea de los grupos colectados en parcelas. Contabilicé el tiempo empleado en la instalación y revisión de las parcelas y del transecto de línea, así como el número de hombres/día empleados durante su ejecución. Debido a que la técnica FSC requiere el cálculo de la tasa de decaimiento de los grupos fecales, los días 3 y 4 de junio, escogí 50 parcelas de manera sistemática y en cada una coloqué un grupo fecal fresco procedente de la UMA-Zoológico Flor del Bosque. Todos los grupos tuvieron una cantidad inicial de 50 pellets y fueron revisados en enero de 2007 para determinar si continúan visibles o no. Si había menos de diez pellets consideré que el grupo había desaparecido. En enero de 2007 reinicié la revisión del cuadrante continuando a los 60 y 120 días. En cada revisión conté y marqué con pintura de color los grupos fecales encontrados en parcelas, esto último con el fin de detectar posibles pérdidas de grupos a lo largo de los siguientes meses de registro y de contabilizar como nuevos los que así lo fueran. 37 Procedimientos para la estimación de la densidad poblacional Método de estimación en parcelas.--Para estimar la densidad promedio de venados ( ) a partir del conteo de grupos fecales en parcelas (FSC-P y FAR-P), utilicé el modelo de Eberhardt y Van Etten (1956), como: . . , donde NP = número de parcelas de 9.29 m2 en un km2, PG = número promedio de grupos fecales por parcela, E.E. = error estándar de PG, TP = tiempo de depósito de los grupos fecales para el caso de FAR y tiempo de deterioro para el de FSC y, TD = tasa de defecación, en este caso la máxima de 25 grupos fecales/venado/día calculada por Pérez-Mejía et al. (2004) para O. virginianus mexicanus para producir estimaciones conservativas de la densidad de animales. El error estándar se calculó como , donde X = promedio de grupos fecales por parcela, k = parámetro de la binomial negativa y n = número de parcelas; , donde S2 = varianza. El tiempo de depósito se refirió al número de días transcurridos desde que se limpiaron las parcelas hasta el conteo de los grupos fecales, mientras que el tiempo de deterioro se refirió al número promedio de días que sobrevivieron los grupos fecales marcados en enero hasta su revisión en mayo de 2007. Método de estimación en transecto de línea.--Para estimar la densidad ( ) de grupos fecales a partir de los datos del transecto de línea (FSC-TL) usé la expresión = número de grupos fecales, , donde n 0 = función probabilística de densidad para distancias en ángulo recto, evaluada a 0 m de la línea, y L = longitud total del transecto. La función de detección fue estimada usando el programa de cómputo DISTANCE 5.0. (Thomas et al. 2005). Para analizar los datos en el software, utilicé cuatro modelos recomendados por Buckland et al. (1993): 1) Uniforme + Coseno (Uniform + Cosine), 2) Semi-normal + Coseno (Half-norm + Cosine), 3) 38 Semi-normal + Polinomial (Half-norm + Hermite polynomial) y 4) Aleatorio + Coseno (Hazard Rate + Cosine). Obtuve directamente la densidad de venados/km2 especificando en el programa de cómputo un tiempo de depósito de 120 días y una tasa de defecación de 25 grupos fecales/venado/día, como factores de conversión. El programa selecciona el modelo que mejor se ajusta a la distribución de los datos con base en el menor AIC (Akaike Criterion Information) y posteriormente lo evalúa con el test de Kolmogorov-Smirnof y la prueba de bondad de ajuste del chi-cuadrado. Para cada muestreo hice tres análisis variando la distancia de truncamiento, en el primero utilicé todos los datos, en el segundo trunqué el 5% de los datos y en el tercero, trunqué el 10% de los mismos. Seleccioné el modelo final con base en el menor coeficiente de variación, es decir, el que proporcionaba mayor precisión en el estimador. Comparación de la densidad promedio de venados/km2 estimada con las técnicas de muestreo de grupos fecales FSC-P, FAR-P y FSC-TL.--Para comparar las técnicas de muestreo FSC-P y FSC-TL, utilicé las estimaciones de densidad de venados/km2 de los muestreos realizados en mayo de 2006 y mayo de 2007. El tiempo de deterioro fue expresado como el número de días promedio que sobrevivieron los grupos fecales en campo para el intervalo comprendido entre enero y mayo de 2007. No se cuenta con una estimación del tiempo de deterioro para 2006, por tanto en los dos años se utilizó la encontrada para 2007. Calculé el área muestreada con cada método, con el de parcelas multipliqué el número de parcelas por el área de cada una y con el transecto de línea multipliqué el ancho efectivo por la longitud total de transectos. Para comparar las técnicas FSC-P y FAR-P, utilicé la estimación de densidad de venados/km2 producida con los datos de mayo de 2007. Los datos para FAR comprendieron el número de grupos fecales contabilizados tras 120 días de depósito, mientras que para FSC incluyeron los grupos que se encontraron en el primer muestreo (enero de 2007) al igual que los 39 del muestreo de mayo. Para conocer el efecto del aumento en el tiempo de depósito de los excrementos sobre la estimación de densidad, utilicé los conteos de grupos fecales en parcelas de marzo y mayo de 2007. Apliqué el modelo de Eberhardt y Van Etten (1956) variando en cada caso el tiempo de depósito, para marzo de 60 días y para mayo de 120 días. Simulación del efecto de la variación en el esfuerzo de muestreo sobre la precisión de la estimación de densidad promedio de ind/km2 Con el fin de conocer el efecto de la variación en el esfuerzo de muestreo (número de parcelas, número y longitud de transectos) sobre la estimación de densidad y su medida de precisión, procedí a hacer una serie de simulaciones remuestreando la base de datos de número de grupos fecales por parcela y distancias perpendiculares obtenida de los muestreos de mayo de 2006, en el programa de cómputo R (R Development Core Team 2006). Adicionalmente, se simuló el método del transecto de franja, que es una variación del transecto de línea en el que el observador cuenta todos los animales u objetos dentro de un ancho predeterminado con el supuesto que todos los objetos presentes en la franja son registrados (Gates 1981). En los tres métodos simulados la densidad de grupos fecales fue convertida a densidad de venados/km2 aplicando un tiempo de depósito de 120 días y una tasa de defecación de 25 grupos fecales/venado/día. A continuación detallo el procedimiento seguido en cada caso. Efecto del número de parcelas.--Se fijaron 46 esfuerzos de muestreo, desde 40 hasta 490 parcelas en pasos de diez. Cada número de parcelas fue seleccionado aleatoriamente 100 veces para calcular la densidad de grupos fecales. Efecto de la longitud del transecto de parcelas.--Se varió la longitud de un transecto de 40 390 a 990 m en pasos de 100, dejando constante una distancia entre parcelas de 10 m. Cada esfuerzo de muestreo fue repetido 100 veces y en cada una se calculó la densidad de grupos fecales. Efecto del número de transectos de parcelas de 390 m y 790 m de longitud.--Para el caso de transectos de 390 m de longitud se varió el número de transectos de uno hasta diez y para el de transectos de 790 m de longitud de uno hasta cinco, dejando constante en ambos casos una distancia entre parcelas de 10 m. Cada esfuerzo de muestreo fue repetido 100 veces y en cada una se calculó la densidad de grupos fecales. Efecto de la longitud del transecto de línea.--Con un número constante de un transecto, se varió la longitud del mismo de 390 a 990 m en pasos de 100. La densidad de venados de cada remuestreo fue obtenida con el programa de cómputo DISTANCE (Thomas et al. 2005). En este caso sólo se hicieron ocho repeticiones debido a que la estimación de densidad con dicho programa consume mucho más tiempo. Para estimar la densidad de venados de cada remuestreo utilicé dos modelos. El primero fue el que presentó un mejor ajuste a los datos, considerando para su selección los criterios mencionados anteriormente: AIC, prueba de Kolmogorov-Smirnof y prueba de chi-cuadrado. El segundo, fue el modelo que mejor se ajustó a los datos del muestreo de mayo de 2006, lo cual se hizo con el fin de poder comparar estimativos de densidad generados con el mismo modelo. Efecto del número de transectos de línea de 390 m y 790 m de longitud.--Para el caso de transectos de 390 m de longitud se varió el número de transectos de uno hasta diez y para el de transectos de 790 m de uno hasta cinco. De igual manera que el caso anterior, cada esfuerzo de muestreo fue repetido ocho veces y en cada una se obtuvo la densidad de venados/km2 utilizando dos modelos en el programa DISTANCE. Efecto del número de transectos de franja de 390 y 790 m de longitud.--Para este diseño 41 utilicé los datos del transecto de línea, haciendo un subconjunto de las distancias perpendiculares menores o iguales a un metro, siendo éste el valor fijado como ancho del transecto. Para el caso de transectos de 390 m de longitud se varió el número de transectos de uno hasta diez y para el de transectos de 790 m de uno hasta cinco. Cada esfuerzo de muestreo fue repetido 100 veces y en cada una la densidad de grupos fecales ( ) se obtuvo con la fórmula , donde n = número de grupos fecales, w = ancho del transecto y L = longitud total del transecto. Determinación del método más adecuado en términos de precisión.--Relacioné el esfuerzo de muestreo con el porcentaje de cambio de la población que se detectaría aplicando ese esfuerzo. Definí este valor como el porcentaje que representa la diferencia entre los límites superior e inferior del intervalo de confianza, de la densidad promedio para ese esfuerzo de muestreo. Esto lo hice para los métodos de transecto de parcelas, transecto de línea y transecto de franja evaluados a dos longitudes 390 y 790 m. IV. RESULTADOS Tamaño de muestra En mayo de 2006, mediante el conteo en parcelas se colectaron 71 grupos fecales, los cuales se encontraron en 48 parcelas (Fig 4). El promedio de grupos fecales por parcela fue de 0.142 ± 0.05 grupos (E.E.), k = 0.123. En mayo de 2007, se registraron 48 grupos fecales en 33 parcelas; en este caso, el promedio de grupos fecales por parcelas fue de 0.118 ± 0.09 grupos (E.E.), k = 0.045 (Fig. 4). 42 Mayo 2007 500 300 100 200 Frecuencia 300 200 100 Frecuencia 490 400 Mayo 2006 400 500 487 0 2 0 1 2 1 0 3 4 5 8 1 0 6 1 0 9 7 0 No. Grupos por parcela 1 2 0 3 1 0 4 5 6 No. Grupos por parcela Figura 4. Histograma del número de grupos fecales por parcela colectados en un cuadrante de 500 parcelas en el Rancho El Salado, Jolalpan, Pue. En mayo de 2006, con el transecto de línea se registraron 326 grupos fecales. La distancia perpendicular osciló entre 0 y 7.78 m, con un promedio de 1.59 ± 1.43 m (D.E.). La tasa de encuentro fue de 65.2 ± 21 grupos/km. Para mayo de 2007, se encontraron 293 grupos fecales, a una distancia perpendicular del transecto que varió entre 0 y 5.20 m, con un promedio de 1.67 ± 1.22 m (D.E.), registrándose una tasa de encuentro de 58.6 ± 34 grupos/km. Al graficar las frecuencias de las distancias perpendiculares a intervalos de 100 y 50 cm, se encontró que en ambos muestreos, mayo de 2006 y mayo de 2007, se presenta un “hombro” en la distribución y no se observa comportamiento evasivo previo a la detección como puede pasar con los datos de conteos directos (Fig. 5). Esto sugiere que los datos no violan ninguno de los supuestos del método, es decir, que los objetos sobre la línea fueron detectados con certidumbre, que fueron detectados en su posición inicial y que las medidas fueron exactas. 43 120 80 Frecuencia 0 0 200 400 600 800 0 600 800 100 0 0 Intervalo 50 cm 60 Frecuencia 60 400 Distancia perpendicular (cm) Intervalo 100 cm 20 200 20 100 Distancia perpendicular (cm) Frecuencia Intervalo 50 cm 40 120 80 40 0 Frecuencia Intervalo 100 cm 0 100 300 500 0 Distancia perpendicular (cm) 100 200 300 400 500 Distancia perpendicular (cm) Figura 5. Histogramas de la distancia perpendicular de los grupos fecales registrados en un cuadrante de un km2 en el Rancho El Salado, Jolalpan, Pue., durante el muestreo de mayo de 2006 (arriba) y mayo de 2007 (abajo). Para ambos años el tamaño de muestra obtenido con el conteo de grupos en parcelas representó cerca del 21% del tamaño de muestra conseguido con el transecto de línea. En cuanto al área muestreada, por medio de las parcelas se muestreó el 0.05% del cuadrante en estudio, mientras que con el transecto de línea varió entre el 0.11% para 2006 y 0.14% para 2007. 44 Comparación de la densidad promedio de venados/km2 estimada con las técnicas de muestreo de grupos fecales FSC-P, FAR-P y FSC-TL La estimación de densidad producida por FSC-P y FSC-TL se obtuvo utilizando un tiempo de deterioro de 123 ± 2.8 días (D.E.) calculado para el intervalo de tiempo comprendido entre enero y mayo de 2007. Los grupos fecales marcados en junio de 2006 no sobrevivieron la temporada de lluvias pues ninguno fue encontrado en enero de 2007, por tanto, se siguieron nueve grupos encontrados en este último mes. Al final del segundo periodo de seguimiento (enero 2007 – mayo 2007), se encontró que sobrevivió el 78% de los grupos marcados en enero, mientras que al finalizar el tercer periodo de seguimiento (marzo 2007 – mayo 2007) sobrevivió 60 50 50 40 7 Periodo 1 Ene-07 Ene-07 0 0 Periodo 2 14 13 May-07 10 8 Mar-07 9 May-07 20 Mar-07 30 Jun-06 Número de grupos fecales el 93% de los grupos marcados en marzo (Fig. 6). Periodo 3 Periodo de seguimiento Figura 6. Número de grupos fecales presentes en cada periodo de seguimiento del tiempo de deterioro. La densidad promedio de venados estimada con el conteo de grupos fecales en parcelas (FSC-P) fue de 5.0 ind/km2 (Intervalo 3.2 - 6.8, CV 36.2%) para mayo de 2006 y de 4.1 ind/km2 (Intervalo 1.0 -7.2, CV 65.0%) para mayo de 2007. 45 La densidad promedio de venados estimada con el conteo de grupos fecales en transecto de línea (FSC-TL) no difirió de la estimada con FSC-P. Para mayo de 2006, la densidad promedio fue de 4.6 ind/km2 (Intervalo 3.1 - 6.8, CV 12.9%), estimada a partir del modelo Seminormal + Coseno, con base en el menor CV (Cuadro 1). La densidad estimada por tres modelos que variaban en la distancia de truncamiento no difirió de manera significativa, en la Figura 7 presento los histogramas de cada uno de ellos. a) 1 b) 1.2 Probabilidad de detección Probabilidad de detección 1.2 χ2 = 6.43, g.l. = 8, P = 0.60 0.8 0.6 0.4 0.2 χ2 = 9.90, g.l. = 15, P = 0.83 1 0.8 0.6 0.4 0.2 0 0 0 1 2 3 4 5 6 7 0 8 Distancia perpendicular (m) 1 2 3 4 5 Distancia perpendicular (m) c) Probabilidad de detección 1.2 χ2 = 6.12, g.l. = 9, P = 0.73 1 0.8 0.6 0.4 0.2 0 0 1 2 3 4 Distancia perpendicular (m) Figura 7. Gráficas de ajuste de los modelos seleccionados a los datos del muestreo de mayo de 2006 y valores de la prueba de bondad de ajuste. a) Modelo Uniforme + Coseno (3) ajustado a los datos sin truncamiento, n = 326. b) Modelo Seminormal + Coseno ajustado a los datos con truncamiento del 5%, n = 310. c) Modelo Uniforme + Coseno ajustado a los datos con truncamiento del 10%, n = 293. 46 Cuadro 1. Resumen de los parámetros estimados para cada uno de los modelos seleccionados en los tres ensayos. Mayo de 2006. Modelo N Uniforme + coseno Seminormal + coseno Uniforme + coseno w (m) 326 7.78 AIC AE (m) 938.23 2.3 310 4.53 769.36 2.2 293 3.16 629.84 2.0 Test k-s n/L Test Chi2 65.2 6.43, P=0.60 62 9.90, P=0.83 58.6 6.12, P=0.73 0.034, P=0.85 0.036, P=0.83 0.038, P=0.80 D E.E. CV% IC 95% 4.61 0.70 14.92 3.12 – 6.84 4.65 0.60 12.89 3.35 – 6.45 4.68 0.60 13.22 3.35 – 6.53 n: número de observaciones; w: ancho del transecto; AE: ancho efectivo del transecto; n/L: tasa de encuentro (número de grupos/km); AIC: Akaike Criterion Information; k-s: Test de Kolmogorov-Smirnof; D: Densidad de venados/km2; E.E.: Error estándar de D; CV%: Coeficiente de variación de D; IC: Intervalo de confianza. La densidad promedio de venados/km2 estimada para mayo de 2007 fue menor que la del año anterior y tampoco difirió entre modelos. En la Figura 8 presento los histogramas de cada uno de los modelos seleccionados y en el Cuadro 2 el resumen de los parámetros de cada uno de ellos. El modelo escogido con base en el menor coeficiente de variación fue el Uniforme + Cosino, con el cual se estimó una densidad de venados de 3.2 ind/km2 (Intervalo 1.6 – 6.6, CV 26.1%). a) 1.2 χ2 = 15.93, g.l. = 23, P = 0.86 1 0.8 0.6 0.4 0.2 1.2 χ2 = 9.77, g.l. = 14, P = 0.78 1 0.8 0.6 0.4 0.2 0 0 0 1 2 3 4 5 6 0 1 2 3 Distancia perpendicular (m) Distancia perpendicular (m) 47 b) 1.4 Probabilidad de detección Probabilidad de detección 1.4 4 c) Probabilidad de detección 1.4 1.2 χ2 = 6.41, g.l. = 8, P = 0.60 1 0.8 0.6 0.4 0.2 0 0 1 2 3 4 Distancia perpendicular (m) Figura 8. Gráficas de ajuste de los modelos seleccionados a los datos del muestreo de mayo de 2007 y valores de la prueba de bondad de ajuste. a) Modelo Uniforme + Coseno ajustado a los datos sin truncamiento, n = 293. b) Modelo Uniforme + Coseno ajustado a los datos con truncamiento del 5%, n = 278. c) Modelo Seminormal ajustado a los datos con truncamiento del 10%, n = 264. Cuadro 2. Resumen de los parámetros estimados para cada uno de los modelos seleccionados en los tres ensayos. Mayo de 2007. Modelo Uniforme + Coseno Uniform + Coseno Seminormal N w (m) 293 5.2 AIC AE (m) 844.62 2.8 278 4.0 717.19 2.5 264 3.4 624.11 2.4 Test k-s Test Chi2 0.04, P=0.64 0.04, P=0.77 0.04, P=0.81 15.93, P=0.86 9.77, P=0.78 6.41, P=0.60 n/L D E.E. CV% IC 95% 58.6 3.240 0.84 26.11 1.60 – 6.57 55.6 3.510 0.94 26.70 1.72 – 7.16 52.8 3.434 0.93 27.22 1.68 – 7.03 n: número de observaciones; w: ancho del transecto; AE: ancho efectivo del transecto; n/L: tasa de encuentro (número de grupos/km); AIC: Akaike Criterion Information; k-s: Test de Kolmogorov-Smirnof; D: Densidad de venados/km2; E.E.: Error estándar de D; CV%: Coeficiente de variación de D; IC: Intervalo de confianza. Al comparar la estimación de densidad producida por el conteo en parcelas (FSC-P) y el transecto de línea (FSC-TL), se encontró que la densidad promedio de venados no varió significativamente en ninguno de los años; sin embargo, la precisión expresada como el coeficiente de variación de la estimación fue menor para el transecto de línea (FSC-TL) en ambos años (Cuadro 3). 48 Cuadro 3. Comparación de las estimaciones de densidad de venados/km2 producidas por el conteo de grupos fecales aplicado con las técnicas FSC-P y FSC-TL para 2006 y 2007. Año de muestreo 2006 2007 Densidad (ind/km2) 5.0 4.1 FSC-P Coeficiente de variación 36% 65% Densidad (ind/km2) 4.6 3.2 FSC-TL Coeficiente de variación 26% 13% Para mayo de 2007 con la técnica FAR-P se contabilizaron 48 grupos fecales (0.096 ± 0.05 grupos/parcela, (E.E.), k = 0.10), mientras que con FSC-P se registraron 59 grupos (0.118 ± 0.08 grupos/parcela, (E.E.), k = 0.04), pues éste último incluyó 11 grupos encontrados en enero de 2007. La densidad promedio de venados/km2 estimada con el conteo de grupos fecales en parcelas (FAR-P) fue de 3.4 ind/km2, la cual no fue diferente de la estimada con FSC-P de 4.1 ind/km2. No se evidenció un efecto del aumento en el tiempo de depósito sobre la estimación de densidad promedio de venados producida por la técnica FAR-P, pues las densidades estimadas a los 60 y 120 días no variaron apreciablemente, pero sí sobre la precisión del estimado (Cuadro 4). Cuadro 4. Variación en la densidad promedio de venados en relación al tiempo de depósito de los grupos fecales. Mes de muestreo Marzo 2007 Mayo 2007 Tiempo de depósito (días) 60 120 Número de GFs 21 48 Promedio GFs por parcela 0.042 0.096 Densidad venados ind/km2 (CV%) 3.0 (92.4%) 3.4 (48.6%) Efecto del esfuerzo de muestro sobre la estimación de densidad promedio de venados/km2 y su precisión Efecto del número de parcelas.--La precisión mejoró con el aumento en el número de unidades muestrales. Para mayo de 2006 el intervalo de confianza de la estimación de densidad 49 de venados promedio disminuyó de 5.1 (0.4 - 12.6) con 40 parcelas a 5.1 (4.7 - 5.2) con 490 parcelas (Fig. 9). Figura 9. Densidad de venados/km2 e intervalos de confianza del 95% para la simulación de aumento del número de parcelas, mayo de 2006. Efecto de la longitud del transecto de parcelas.--Con el aumento en la longitud del transecto se incrementa la precisión del estimado, aunque no es tan evidente como en el caso anterior. Con un transecto de 390 m de longitud se obtiene una densidad promedio de 5.0 (0.9 – 10 8 6 4 2 0 Densidad de venados (Ind/km2) 11.7) ind/km2 y con uno de 990 m se obtiene una estimación de 5.1 (2.2 – 9.0) ind/km2 (Fig. 10). 400 600 800 1000 Longitud del transecto Figura 10. Densidad de venados/km2 e intervalos de confianza del 95% para la simulación de aumento en la longitud de transectos de parcelas, mayo de 2006. 50 Efecto del número de transectos de parcelas de 390 m y 790 m de longitud.--En este caso la precisión también mejoró conforme aumenta el esfuerzo de muestreo. Con un transecto de 390 m de longitud la estimación de densidad promedio fue de 4.2 (0.0 – 9.9) ind/km2 mientras que con diez fue de 5.2 (4.3 – 5.9) ind/km2. Con transectos de 790 m de longitud, la estimación de 2 4 6 8 10 10 2 4 6 8 TP 790 m 0 Densidad de venados (Ind/km2) 10 2 4 6 8 TP 390 m 0 Densidad de venados (Ind/km2) densidad promedio pasó de 5.4 (2.0 – 8.3) ind/km2 a 5.1 (4.3 – 5.7) ind/km2 (Fig. 11). 1 Número de transectos 2 3 4 5 Número de transectos Figura 11. Densidad de venados/km2 e intervalos de confianza del 95% para la simulación de aumento de número de transectos de 390 y 790 m de longitud, mayo de 2006. Efecto de la longitud del transecto de línea.--Al remuestrear los datos del transecto de línea aumentando el tamaño del transecto de 390 a 990 m, la disminución en los intervalos de confianza de la estimación conforme aumenta el esfuerzo de muestreo no es tan evidente como en los anteriores casos. Con el modelo elegido se obtiene un patrón más claro que con el modelo estándar. Con el primero, el intervalo de confianza para la estimación pasó de 3.2 (1.4 - 4.9) ind/km2 con un transecto de 390 m de longitud a 4.2 (2.8 – 5.4) ind/km2 con un transecto de 990 m (Fig. 12). 51 400 600 800 1000 12 Modelo estándar 0 2 4 6 8 Densidad de venados (Ind/km2) 12 0 2 4 6 8 Densidad de venados (Ind/km2) Modelo elegido 400 Longitud del transecto 600 800 1000 Longitud del transecto Figura 12. Densidad de venados/km2 e intervalos de confianza del 95% para la simulación de aumento en la longitud del transecto de línea, mayo de 2006. Efecto del número de transectos de línea de 390 m y 790 m de longitud.--En este caso presento los resultados utilizando solamente el modelo elegido, encontrándose que para ambas longitudes el aumento en el número de transectos provoca una estimación más precisa. Con un transecto de 390 m la densidad promedio fue de 5.1 (4.6 - 5.6) ind/km2 mientras que con diez fue de 4.4 (1.5 – 6.9) ind/km2. Con un transecto de 790 m la densidad promedio fue de 4.1 (2.1 – 5.7) 2 4 6 8 10 10 2 4 6 8 TL 790 m 0 Densidad de venados (Ind/km2) 10 2 4 6 8 TL 390 m 0 Densidad de venados (Ind/km2) ind/km2, mientras que con cinco fue de 4.8 (4.3 - 5.3) ind/km2 (Fig. 13). 1 Número de transectos 2 3 4 5 Número de transectos Figura 13. Densidad de venados/km2 e intervalos de confianza del 95% para la simulación de aumento en el número de transectos de línea de 390 y 790 m de longitud, mayo de 2006. 52 Efecto del número de transectos de franja de 390 y 790 m de longitud.--Con el aumento en el número de transectos de franja también se logró un incremento en la precisión de la estimación de densidad como en los casos anteriores. La densidad promedio pasó de 6.0 (1.3 12.0) ind/km2 con un transecto a 4.7 (3.8 - 5.3) ind/km2 con diez de 390 m; y de 4.7 (1.7 - 7.4) ind/km2 con un transecto a 4.7 (4.0 - 5.1) ind/km2 con diez transectos de 790 m de longitud (Fig. 2 4 6 8 2 4 6 8 10 TF 790 m 0 Densidad de venados (Ind/km2) 2 4 6 8 10 TF 390 m 0 Densidad de venados (Ind/km2) 14). 10 1 Número de transectos 2 3 4 5 Número de transectos Figura 14. Densidad de venados/km2 e intervalos de confianza del 95% para la simulación de aumento en el número de transectos de franja de 390 y 790 m de longitud, mayo de 2006. Determinación del mejor método en términos de precisión.--La relación entre esfuerzo de muestreo y porcentaje de cambio detectable de la población estuvo descrita por una exponencial negativa (Fig. 15). El transecto de línea a las dos longitudes evaluadas (390 y 790 m) fue el método más preciso y por ende el que permitiría a un nivel de esfuerzo dado detectar cambios más pequeños en el tamaño poblacional. 53 % de cambio detectable de la población 120 TP390 TP790 100 TL390 TL790 80 TF390 TF790 60 40 20 0 0 2 4 6 8 10 Número de transectos Figura 15. Relación entre esfuerzo de muestreo y porcentaje de cambio detectable de la población para tres métodos de estimación de densidad poblacional evaluados a dos longitudes (390 y 790 m). TP = Transecto de parcelas, TL = Transecto de línea, TF = Transecto de franja. La línea punteada indica el porcentaje de cambio de la población que representa la detección de ± 1 ind/km2. V. DISCUSIÓN Mis resultados coincidieron con las hipótesis planteadas pues los métodos y técnicas con las cuales se obtuvo un tamaño de muestra mayor produjeron las estimaciones de densidad más precisas. Esto es un resultado esperable en función del teorema del límite central que expresa que a medida que aumenta el tamaño de muestra, los promedios de las muestras de una población de cualquier distribución se comportarán como una distribución normal (Sokal y Rolfh 1969). Sin embargo, dada la importancia del monitoreo de las poblaciones para determinar el efecto de las acciones de manejo, establecer cuál método y qué esfuerzo de muestreo producen las estimaciones más precisas es el primer paso para definir metodologías que produzcan información comparable a escala local y regional. En las siguientes secciones discuto en detalle los resultados correspondientes a cada hipótesis. 54 Comparación entre técnicas de estimación poblacional La estimación de densidad de venados generada por el transecto de línea (FSC-TL) fue más precisa que la proporcionada por el conteo en parcelas (FSC-P). Aunque no hay trabajos que comparen estos dos métodos de estimación de densidad basados en el registro de grupos fecales, Marques et al. (2001) sugirieron que en sitios de bajas densidades donde se requeriría un número muy alto de parcelas para obtener estimaciones con adecuados niveles de precisión, el transecto de línea probablemente sería una metodología que proporcionaría una mejor relación costobeneficio. Estudios que comparan el transecto de línea contra otros métodos han llegado a conclusiones similares, por ejemplo, Bollinger et al. (1988) compararon el transecto de línea y las parcelas circulares, encontrando que el primero fue más preciso porque fue capaz de seguir mejor los cambios en la abundancia del tordo (Dolichonyx oryzivorus) en dos sitios y dos tiempos diferentes. Ruette et al. (2003) encontraron que el transecto de línea aplicado a conteos de zorros con luz artificial resultó más preciso que el transecto de puntos. Smart et al. (2004) encontraron que el transecto de línea aplicado a imágenes termales proporcionó las estimaciones más precisas y por tanto el mayor poder estadístico. Estos resultados probablemente se sustentan en tres ventajas del transecto de línea en comparación al menos con el transecto de franja: 1) no tiene supuestos fuertes sobre la función de detección (que para el caso del TF debe ser igual a 1 en todo el ancho del transecto), 2) el sesgo no aumenta con el ancho del transecto, y 3) se pueden utilizar todos los datos disponibles (Burnham et al. 1985). Cabe resaltar que las estimaciones de densidad promedio de venados/km2 no variaron apreciablemente entre los métodos estudiados y que los dos coincidieron en la tendencia decreciente que se presentó entre años. Las implicaciones de este resultado dependen del objetivo del estudio, si se busca conocer el estado de una población en un momento determinado emplear el método más rápido y menos costoso podría ser el criterio para elegir. Sin embargo, si la 55 intención es seguir los cambios poblacionales en el tiempo para determinar el efecto de acciones de manejo como la cosecha o la manipulación del hábitat, utilizar el método que produzca las estimaciones más precisas sería lo recomendable. Evidencié un aumento en la precisión de la técnica FAR-P con el incremento en el tiempo de depósito. Campbell et al. (2004) para 26 sitios de muestreo encontraron una relación inversa entre el periodo de acumulación medido en días y el coeficiente de variación de la estimación de densidad. Smart et al. (2004) concluyeron que el pobre desempeño de FAR se debió a los pocos grupos fecales colectados en un corto periodo de acumulación de 60 días. En general, la precisión de la estimación con la técnica FAR mejora si el periodo de acumulación se extiende, aunque Welch et al. (1990) y Campbell et al. (2004) reconocen que el incremento en el tiempo de depósito puede aumentar el riesgo de pérdida de grupos fecales entre visitas y por tanto de obtener resultados sesgados de la densidad de individuos. Bajo las condiciones de mi estudio esto no resultaría problemático pues al menos para el periodo comprendido entre enero y mayo de 2007 el número de grupos fecales perdidos fue mínimo. Por otro lado, Campbell et al. (2004) afirman que el método del transecto de línea mejoraría la precisión de los conteos FSC pues una mayor área podría ser buscada para un esfuerzo dado y de hecho, éste método sólo favorecería a FSC, pues no puede ser aplicado a FAR que requiere que todos los grupos fecales sean detectados en la primera visita con el fin de que éstos detectados en la segunda puedan ser tratados como nuevos. Las estimaciones de densidad promedio de ind/km2 no variaron aprecidablemente entre las técnicas FAR-P y FSC-P debido probablemente a la pequeña diferencia entre la tasa de acumulación utilizada para FAR y el tiempo de deterioro de los grupos fecales estimado para FSC. Esto pudo resultar de la manera cómo se condujeron las observaciones para medir tiempo de deterioro. Se determinó con certeza que los grupos fecales no sobreviven la época de lluvias 56 pues ninguno de los grupos dejados en campo en junio de 2006 fue encontrado en enero de 2007; esto probablemente se debe al lavado producto de las lluvias intensas, a la mayor humedad relativa y al aumento en la actividad bacterial, fúngica y de escarabajos coprófagos (Wallmo et al. 1962, Neff 1968, Ezcurra y Gallina 1981, Prugh y Krebs 2004). El tiempo de deterioro estimado para la época seca (enero - mayo de 2007) se subestimó porque no fue posible determinar la edad exacta de los grupos seguidos, pues los grupos marcados en enero ya estaban en el lugar y es factible que hayan sido depositados en meses anteriores. Este tipo de estudio en el que se identifican grupos frescos en un punto en el tiempo y luego se realizan visitas repetidas para determinar cuándo desaparecen se trata de un “estudio prospectivo” y puede producir estimaciones sesgadas -si la tasa de deterioro varía estacionalmente (como en este estudio)- pues no estima el tiempo promedio de decaimiento de los rastros presentes en el momento del estudio (Laing et al. 2003). Para solventar este problema, Laing et al. (2003) propusieron un “estudio retrospectivo” en el que se localizan y marcan señales frescas en varias fechas previas al estudio y luego se retorna para registrar si son o no visibles en el momento de la evaluación. Considerando que los resultados obtenidos en mi estudio no fueron una estimación adecuada del tiempo de deterioro de los grupos fecales para las condiciones de la Mixteca poblana, sugiero adelantar el seguimiento anual de por lo menos 50 grupos fecales frescos. En la Figura 16, presento el esquema de cómo se conduciría el experimento de deterioro, en donde la variable respuesta Y toma valores de 1 si en la revisita el grupo fecal permanece y de 0, si no; y x representa la edad del grupo fecal medida en la revisita, si el grupo ha sobrevivido. 57 Figura 16. Esquema del experim mento para deeterminar tassa de deteriooro. Pi repressenta la fechha de deposicióón del grupo i, Gi la fechha de desaparrición del grrupo i, Xi el tiempo t de vida de la señaal (desde quue es deposittada hasta quue desaparecce), xi la edadd del grupo fecal medidaa en la revisiita. La señal 1 estuvo preesente en el momento m de la visita, miientras que la l señal 2 ya había desapareccido. Tomad do de Laing et e al. (2003). A Aunque en mii estudio no se hizo una evaluación exacta e del tiempo demanndado por caada técnica de muestreo, FSC-P requirió más díass en campo que q FAR-P. Para FSC-P P se realizaroon dos visitaas al experim mento de tiem mpo de deterrioro y otra para p la revisiión de las paarcelas; FAR R-P requirió sólo s dos visiitas, una paraa limpiar las parcelas y otra o para revvisarlas. Cam mpbell et al. (2004) y Smart et al. (2004) coincidieron conntrario a mis resultados, que FSC-P fue f menos po que FAR--P, aunque ellos fallaronn en incluir en sus cálculoos el tiempo demandannte en tiemp requeridoo para la estiimación del tiempo t de deeterioro. Debbido a que laas tasas de deterioro d varíían entre sitioos es necesarrio estimarlaas para cada área en partticular (Baileey y Putmann 1981, Wem mmer et al. 19996, Marques et al. 2001, Prugh y Kreebs 2004); sin embargo, si se estimann a partir de un estudio bien diseñado o (como el reecomendadoo anteriormennte) no habrría necesidadd de estimarllas en C resultaría más m efectivoo porque requueriría menoos cada evalluación pobllacional y poor tanto, FSC visitas a campo. c Adiccionalmente,, se podrían explorar varriables que ayudaran a a prredecir la tassa de 58 deterioro de los grupos fecales como lo hace Barnes et al. (1997) quienes identifican que la precipitación de los dos meses previos a la deposición sería un buen predictor del tiempo promedio de duración de los grupos fecales. Debido a que aplicando la técnica FAR se controla el tiempo de depósito de los grupos fecales se asume que produce estimaciones más exactas (Bailey y Putman 1981, Nchanji y Plumptre 2001, Prugh y Krebs 2004). Sin embargo, como hice notar inicialmente la exactitud de un método sólo puede ser evaluada comparando con el tamaño real de la población. Smart et al. (2004) construyeron modelos de simulación en los que con una densidad de individuos conocida compararon tres técnicas (FSC, FAR y muestreo de distancias de imágenes termales), encontrando que FSC produjo las estimaciones más exactas. Por el contrario, Mayle et al. (1999 citado en Smart et al. 2004) y MacDonald y Johnson (1998 citado en Smart et al. 2004) concluyeron que FAR generó mejores estimaciones. Considerando que no hay resultados concluyentes sobre cuál técnica es la más adecuada en términos de exactitud para conocer la densidad poblacional del venado en un área particular y que contar con una población silvestre de tamaño conocido es casi imposible, sugiero explorar el uso de modelos de simulación en el que controlando la densidad de individuos se pongan a prueba estas dos categorías metodológicas, detectando si existe un sesgo en las estimaciones producidas y la dirección del mismo. Análisis de la relación entre esfuerzo de muestreo y precisión de las estimaciones de densidad La precisión de las estimaciones de densidad promedio de venados/km2 mejoró con el aumento en el esfuerzo de muestreo de cada método, como se esperaba de acuerdo a mis hipótesis. Esto concuerda con lo registrado por Smart et al. (2004) quienes evidenciaron que generalmente la precisión de las tres técnicas evaluadas mejoró con el esfuerzo de muestreo y con 59 Plumptre (2000) y Marques et al. (2001) que trabajando específicamente con el transecto de línea encontraron el mismo comportamiento. Plumptre (2000) observó que al incrementar la distancia caminada disminuía el coeficiente de variación de la densidad estimada de primates y Marques et al. (2001) encontraron una relación positiva entre el esfuerzo de muestreo asignado a bloques que diferían en densidad y la precisión del estimado de densidad de venados. La principal ventaja de una alta precisión es que los límites probables de una estimación de densidad están mucho más próximos, haciendo más fácil detectar diferencias entre poblaciones o entre tiempos (Thompson et al. 1998). Estudios que utilizan índices como conteo de huellas (Kendall et al. 1992, Hayward et al. 2002) o conteo de estaciones visitadas (Zielinski y Stauffer 1996, Sargeant et al. 2003), han determinado una relación positiva entre el esfuerzo de muestreo y el poder estadístico del método, entendido este último como la capacidad de acertadamente rechazar la hipótesis nula cuando ésta es falsa (Zielinski y Stauffer 1996). En mi estudio la relación entre esfuerzo de muestreo y porcentaje de cambio detectable de la población parece ser descrita por una exponencial negativa, indicando que al principio incrementos en el esfuerzo de muestreo mejoran significativamente la precisión, mientras que sólo cambios pequeños se logran con esfuerzos extremos (Kendall et al. 1992, Hayward et al. 2002). El transecto de línea a las dos longitudes evaluadas (390 y 790 m) fue el método más preciso y por ende el que permitiría a un nivel de esfuerzo dado detectar cambios más pequeños en el tamaño poblacional. Al respecto de cuál longitud utilizar, Marques et al. (2001) para el caso del transecto de línea sugieren que una vez se ha determinado la longitud total del transecto, se deben preferir muchas líneas cortas a pocas largas, ya que las primeras dan una mejor cobertura de la variabilidad espacial y por tanto los estimados de precisión serían más reales. Por el contrario, Gates (1981) menciona que un número muy alto de transectos no es práctico pues la mayoría tendrían cero registros; por tanto, para estimar la densidad con determinado nivel de 60 precisión se deberían utilizar transectos largos, aunque su longitud no debe ser tal que se intercepten coberturas vegetales diferentes. Algunos autores han definido para el transecto de línea que su longitud debe asegurar la detección de un mínimo de observaciones por transecto, 40 (Anderson et al. 1979), 60 - 80 objetos (Buckland et al. 1993) y 100, si se trata de un monitoreo de los cambios poblacionales (Plumptre 2000). Las estimaciones de alta precisión y exactitud cuestan dinero debido al tiempo y personal extra requeridos para obtener muestras grandes (Plumptre 2000), por tanto, aunque el esfuerzo de muestreo requerido para detectar determinado nivel de cambio en la población debería ser el implementado en las evaluaciones poblacionales, los recursos económicos disponibles son los que determinan el esfuerzo que se puede hacer. En mi estudio la revisión de un transecto (de línea o parcelas) de 390 m de longitud ocupó 2 horas aproximadamente; sin embargo, la relación entre número de transectos y horas no puede considerarse lineal pues se debe tener en cuenta el tiempo que se gastaría trasladándose entre ellos en un terreno pendiente y con un sotobosque abundante. Al respecto Campbell et al. (2004) mencionan que generalmente el tiempo de viaje entre transectos fue más alto que el tiempo de revisión de los mismos. En todo caso, dado que para cada nivel de precisión deseado, el transecto de línea requiere la instalación de un menor número de transectos será también el que necesite menos esfuerzo expresado como días/hombre. Por otro lado, dado que el transecto de franja aquí fue tratado como una variación del transecto de línea no existen registros de tiempo para este método; sin embargo, Burnham et al. (1985) afirman que el tiempo gastado en medir distancias en la práctica es casi insignificante, que en la mayoría de estudios los objetos están esparcidos y se gasta más tiempo buscándolos que haciendo las mediciones, por tanto se gastaría menos tiempo en TL que en TF. El tiempo de análisis de datos tampoco fue incluido en mi comparación, pero es evidente que el tratamiento de los datos del transecto de línea toma más tiempo pues deben ser analizados con un programa de cómputo 61 especial, mientras que para TP y TF la expresión matemática que calcula la densidad promedio es bastante sencilla. Independientemente del método seleccionado para realizar las evaluaciones poblacionales del venado, una consideración muy importante que no fue posible definir con mi estudio es la intensidad de muestreo en el área estudio. Se definió el número de transectos requeridos para asegurar determinado nivel de precisión si el área de interés tuviera un km2; sin embargo, ¿cuántos transectos proporcionarían un nivel de precisión similar para toda la UMA del ejido El Salado que cuenta con una extensión de 31 km2? Ezcurra y Gallina (1981) por ejemplo, para un área de18.78 km2 en la Reserva de la Biósfera La Michilía utilizaron 16 transectos para estimar la densidad de grupos fecales con un error de ± 0.01/ha (P < 0.01), es decir, aproximadamente 1 transecto de 390 m de longitud por cada km2. Si el comportamiento encontrado en mi estudio se extrapolara a un área mayor, es claro, que un transecto de esa longitud por km2 proporciona estimaciones de densidad muy poco precisas. Esta situación sugiere la necesidad de replicar la metodología planteada en este estudio en otros sectores del ejido El Salado. Se podría implementar un muestreo estratificado en el que se delimiten unidades de muestreo más o menos homogéneas con el fin de reducir la dispersión de los resultados y mejorar la asignación del esfuerzo de muestreo, muestreando más donde la densidad es mayor y menos donde la densidad es menor (Telleria 1986). La delimitación de los estratos con base en la abundancia relativa de la especie podría determinarse a partir de un premuestreo o indagando con los pobladores que conocen bastante bien la distribución del venado en su ejido. Es de destacar que las estimaciones promedio de densidad de los diferentes remuestreos no variaron apreciablemente de la obtenida utilizando el máximo tamaño de muestra conseguido con cada método. En el caso de los métodos basados en parcelas, la estimación de densidad estuvo alrededor de 5.0 ind/km2 que fue la generada utilizando 500 parcelas y para el caso del 62 transecto de línea la mayoría de remuestreos produjeron estimaciones cercanos a 4.6 ind/km2, que fue la obtenida usando 5000 m de línea. Aunque el transecto de línea proporcionó las estimaciones más precisas, éstas oscilaron más alrededor del valor promedio que por ejemplo las producidas por el transecto de parcelas. Esto pudo deberse a que las simulaciones para el TL solo tuvieron ocho repeticiones en comparación con las 100 para los otros dos métodos y a que DISTANCE ajusta modelos de detección individuales a los datos generados en cada repetición. Estos modelos son muy específicos, con buen ajuste y alta precisión pero pueden variar mucho entre repeticiones en respuesta a los datos particulares (Smart et al. 2004). Las comparaciones entre métodos a una escala que cubra un área mayor que un km2 son necesarias. Definir la intensidad de muestreo para un área de densidad de venado relativamente baja como esta selva baja caducifolia y compararla con un área de densidad alta evidenciaría las circunstancias bajo las cuales un método es más apropiado que otro; por ejemplo, a densidades altas el transecto de línea en el que la distancia de cada grupo detectado a la línea debe medirse exactamente llegaría a ser menos eficiente que el transecto de parcelas (Burnham et al. 1985, Marques et al. 2001). Por lo que el diseño y construcción de modelos de simulación que incorporen la distribución espacial de la especie a la escala de un ejido, por ejemplo, serían la herramienta para evaluar la exactitud de los diseños de muestreo bajo el método seleccionado. Adicionalmente, el uso de técnicas moleculares podría ser otra alternativa para conocer el tamaño poblacional de la especie en un lugar y comparar contra él las estimaciones producidas por los distintos métodos del conteo de grupos fecales (Kohn et al. 1999, Barnes 2001, Webbon et al. 2004). 63 VI. CONCLUSIONES Y RECOMENDACIONES La precisión de las estimaciones de densidad promedio de venados/km2 varió entre las tres técnicas de conteo estudiadas (FAR-P, FSC-P y FSC-TL) y como se predijo FSC-TL produjo las estimaciones más precisas dado que permite registrar un mayor número de grupos fecales. La estimación de densidad no varió apreciablemente entre las dos técnicas FAR-P y FSCP aunque utilizan un factor de conversión diferente. Se sugiere un experimento para estimar la tasa de deterioro de los grupos fecales para las condiciones de la Mixteca Poblana. Una evaluación confiable y precisa de este factor favorecería la aplicación de FSC pues en el mediano plazo resultaría dando una mejor relación costo-beneficio. Las estimaciones de densidad no variaron significativamente con el incremento en el esfuerzo de muestreo. En cambio, la precisión si aumentó para todos los esquemas considerados. El transecto de línea resultó ser el método de muestreo que para cualquier nivel de esfuerzo proporcionaría las estimaciones de densidad más precisas. Se sugiere la replicación de la metodología seguida en este estudio en otros sectores del ejido El Salado para definir la intensidad de muestreo necesaria a esta escala. Recomiendo el diseño y construcción de modelos de simulación para determinar qué método y qué diseño de muestreo produce las estimaciones más exactas y precisas sobre un amplio rango de condiciones, como por ejemplo, distintos niveles de densidad del venado. VII. LITERATURA CITADA ANDERSON, D. R., J. L. LAAKE, B. R. CRAIN Y K. P. BURNHAM. 1979. Guidelines for line transect sampling of biological populations. The Journal of Wildlife Management 43: 70-78. BAILEY, R. E. Y R. J. PUTMAN. 1981. Estimation of fallow deer (Dama dama) populations from faecal accumulation. The Journal of Applied Ecology 18: 697-702. 64 BARNES, R. F. W. 2001. How reliable are dungs counts for estimating elephant numbers? African Journal of Ecology 39: 1-9. --------. 2002. The problem of precision and trend detection posed by small elephant populations in West. Africa. African Journal of Ecology, 40: 179-185. --------, B. ASAMOAH-BOATENG, J. NAADA MAJAM Y J. AGYEI-OHEMENG. 1997. Rainfall and the population dynamics of elephant dung-piles in the forest of sourthen Ghana. African Journal of Ecology 35: 39-52. BATCHELER, C. L. 1975. Development of a distance method for deer census from pellet groups. The Journal of Wildlife Management 39: 641-652. BOLLINGER, E. K., T. A. GAVIN Y D. MCINTYRE. 1988. Comparison of transects and circular-plots for estimating bobolink densities. The Journal of Wildlife Management 52: 777-786. BUCKLAND, S. T., D. R. ANDERSON, K. P. BURNHAM Y J. L. LAAKE. 1993. Distance sampling: estimating abundance of biological populations. Chapman and Hall. London. BURGOYNE, G. E. Y M. L. MOSS. 1974. The 1974 deer pellet group surveys. Survey and Statistical Servirces Report No. 134. BURNHAM, K. P., D. A. ANDERSON Y J. L. LAAKE. 1985. Efficiency and bias in strip and line transect sampling. The Journal of Wildlife Management 49: 1012-1018. CAMPBELL, D., G. M. SWANSON Y J. SALES. 2004. Comparing the precision and cost-effectiveness of faecal pellet group count methods. The Journal of Applied Ecology 41: 1185-1196. CATTADORI, I. M., D. T. HAYDON, S. J. THIRGOOD Y P. J. HUDSON. 2003. Are indirect measures of abundance a useful index of population density? The case of red grouse harvesting. Oikos 100: 439-446. CORONA, P. 2003. Bases biológicas para el aprovechamiento del venado cola blanca en el ejido “El Limón de Cuauchichinola”, Municipio de Tepalcingo, Morelos. Tesis de Maestría. Instituto de Ecología, A. C., Ver. EBERHARDT, L. 1978. Transect methos por population studies. The Journal of Wildlife Management 42: 1-31. --------. Y R. C. VAN ETTEN. 1956. Evaluation of the pellet group count as a deer census method. The Journal of Wildlife Management 20: 70-74. 65 ELLIS, A. M. Y R. T. F. BERNARD. 2005. Estimating the density of Kudu (Tragelaphus strepsiceros) in subtropical thicket using line transect surveys of dung and Distance software. African Journal of Ecology 43: 362-368. EZCURRA, E. Y S. GALLINA. 1981. Biology and population dynamics of white-tailed deer in northwestern Mexico. Págs. 77-108 in P. F. Ffolliot y S. Gallina, editores. Deer biology, habitat requirements, and management in western North America. Instituto de Ecologia, A. C. México. FOCARDI, S., R. ISOTTI Y A. TINELLI. 2002. Line transect estimates of ungulate populations in a mediterranean forest. The Journal of Wildlife Management 66: 48-58. FREDDY, D. J. Y D. C. BOWDEN. 1983. Sampling mule deer pellet-group densities in juniper-pinon woodland. The Journal of Wildlife Management 47: 476-485. GALINDO-LEAL, C. 1992. Overestimation of deer densities in Michilia Biosphere Reserva, Durango, Mexico. The Southwestern Naturalist 37: 209-212. --------. 1993. Densidades poblacionales de los venados cola blanca, cola negra y bura en Norte América. Págs. 371-391 in R. A. Medellín & G. Ceballos, editores. Avances en el estudio de los mamíferos de México. AMMAC, Publicaciones especiales, Vol. 1. México, D. F. --------. Y A. MORALES. 1987. Aspectos del muestreo en la estimación de poblaciones de venados. Memorias V Simposio sobre fauna silvestre en México. UNAM, AZARM. México. --------. Y M. WEBER. 1998. El Venado de la Sierra Madre Occidental. Ecología, manejo y conservación. EDICUSA-CONABIO. México D.F. GALLINA, S. 1990. El venado cola blanca y su hábitat en la Michilía, Durango. Tesis de doctorado. UNAM. México, D.F. --------. Y E. EZCURRA. 1992. Deer densities in La Michilia: a reply a Galindo. The Southwestern Naturalist 37: 422-424. GATES, C. E. 1981. Optimizing sampling frequency and numbers of transects and stations. Studies in Avian Biology 6: 399-404. --------, W. H. MARSHALL Y D. P. OLSON. 1968. Line transect method of estimating grouse population densities. Biometrics 24: 135-145. HAYWARD, G. D., D. G. MIQUELLE, E. N. SMIRNOV Y CH. NATIONS. 2002. Monitoring Amur tiger populations: characteristics of track surveys in snow. Wildlife Society Bulletin 30: 11501159. 66 INAFED. 2005. Enciclopedia de los municipios de México. http://www.elocal.gob.mx/wb2/ELOCAL/ELOC_Enciclopedia. Página visitada en febrero de 2008. KENDALL, K. C., L. H. METZGAR, D. A. PATTERSON Y B. M. STEELE. 1992. Power of sign surveys to monitor population trends. Ecological applications 2: 422-430. KOHN, M. H., E. YORK, D. KAMRADT, G. HAUGHT, R. SAUVAJOT Y R. K. WAYNE. 1999. Estimating population size by genotyping faeces. Proceedings of The Royal Society 266: 657-663. LAING, S. E., S. T. BUCKLAND, R. W. BURN, D. LAMBIE Y A. AMPHLETT. 2003. Dung and nest surveys: estimating decay rates. The Journal of Applied Ecology 40: 1102-1111. LÓPEZ-TÉLLEZ, M. C. 2006. Análisis de la densidad poblacional y caracterización del hábitat del venado cola blanca (Odocoileus virginianus mexicanus) en cuatro localidades del Municipio de Jolalpan, Puebla. Tesis de maestría. UNAM, Facultad de ciencias. México. --------, S. MANDUJANO Y G. YÁNES. 2007. Evaluación poblacional del venado cola blanca en un bosque tropical seco de la Mixteca Poblana. Acta Zoológica Mexicana 23: 1-16. MANDUJANO, S. 2005. Calibration of tracks count to estimate population density of white-tailed deer (Odocoileus virginianus) in a Mexican tropical forest. The Southwestern Naturalist 50: 223-229. --------. Y S. GALLINA. 1995. Comparison of deer censusing methos in tropical dry forest. Wildlife Society Bulletin 23: 180-186. MARQUES, F., S. T. BUCKLAND, D. GOFFIN, C. E. DIXON, D. L. BORCHERS, B. A. MAYLE Y A. J. PEACE. 2001. Estimating deer abundance from line transect surveys of dung: sika deer in sourthern Scotland. The Journal of Applied Ecology 38: 34-363. MAYLE, B. A., R. J. PUTMAN Y I. WYLLIE. 2000. The use of trackway counts to establish an index of deer presence. Mammal Review 30: 233-237. MORALES, A., M. WEBER Y C. GALINDO-LEAL. 1989. Factores que afectan las estimaciones de abundancia del venado cola blanca por métodos indirectos. Memorias III Simposio sobre venados en México. Universidad Autónoma de Nuevo León. NCHANJI, A. C. Y A. J. PLUMPTRE. 2001. Seasonality in elephant dung decay and implications for censusing and population monitoring in south-western Cameroo. African Journal of Ecology 39: 24-32. 67 NEFF, D. J. 1968. The pellet-group count technique for big game trends, census, and distribution: a Review. The Journal of Wildlife Management 32: 597-614. NICHOLS, J. D. Y C. R. DICKMAN. 1996. Capture-Recapture methods. Págs. 217-226 in D. E. Wilson, F. Russell-Cole, J. D. Nichols, R, Rudran y M. S. Foster, editors. Measuring and monitoring biological diversity, Standard methods for mammals. Smithsonian Institution. USA. ORTIZ-MARTÍNEZ, T., S. GALLINA, M. BRIONES-SALAS Y G. GONZÁLEZ. 2005. Densidad poblacional y caracterización del hábitat del venado cola blanca (Odocoileus virginianus oaxacensis, Goldman y Kellog, 1940) en un bosque templado de la sierra norte de Oaxaca, Mexico. Acta Zoológica Mexicana 21: 65-78. PÉREZ-MEJÍA, S., S. MANDUJANO Y L. E. MARTÍNEZ-ROMERO. 2004. Tasa de defecación del venado cola blanca, Odocoileus virginianus mexicanus, en cautividad en Puebla. Acta Zoológica Mexicana (n.s.). 20: 167-170. PLUMPTRE, A. 2000. Monitoring mammal populations with line transect techniques in African forest. The Journal of Applied Ecology 37: 356-368. PRUGH, L. R. Y CH. J. KREBS. 2004. Snowshoe hare pellet-decay rates and aging in different habitats. Widlife Society Bulletin 32: 386-393. R DEVELOPMENT CORE TEAM. 2006. R: A language and environment for statistical computing. R Foundation for Statistical Computing, Vienna, Austria. ISBN 3-900051-07-0, URL http://www.R-project.org. RIVERO, K., D. I. RUMIZ & A. B. TABER. 2004. Estimating brocket deer (Mazama gouazoubira and M. americana) abundance by pellet counts and other indices in seasonal chiquitano forest habitats of Santa Cruz, Bolivia. European Journal of Wildlife Research 50: 161-167. ROBINETTE, W. L., C. M. LOVELESS Y D. A. JONES. 1974. Field test of strip census methods. The Journal of Wildlife Management 38: 81-96. RUETTE, S., P. STAHL Y M. ALBARET. 2003. Applying distance-sampling methods to spotlight counts of red foxes. The Journal of Applied Ecology 40: 32-43. SARGEANT, G. A., D. H. JOHNSON Y W. E. BERG. 2003. Sampling designs for carnivore scentstation surveys. The Journal of Wildlife Management 67: 289-298. SMART, J., A. I. WARD Y P. WHITE. 2004. Monitoring woodland deer populations in the UK: an imprecise science. Mammal Review 34: 99-114. 68 SOKAL, R. R. Y F. J. ROLFH. 1969. Biometry. The principles and practice of statistics in biological research. W.H. Freeman and Company. Third edition.New York. TELLERÍA, J. 1986. Manual para el censo de los vertebrados terrestres. Ed. Raíces. Madrid. THOMAS, L., J. L. LAAKE, S. STRINDBERG, F. F. C. MARQUES, S. T. BUCKLAND, D. L. BORCHERS, D. R. ANDERSON, K. P. BURNHAM, S. L. HEDLEY, J. H. POLLARD, J. R. B. BISHOP, Y T. A. MARQUES. 2005. Distance 5.0. Release “b”. Research Unit for Wildlife Population Assessment, University of St. Andrews, UK. http://www.ruwpa.st-and.ac.uk/distance/ THOMPSON, W. L., G. C. WHITE Y CH. GOWAN. 1998. Monitoring vertebrate populations. Academic Press. USA. TYSON, E. L. 1959. A deer drive vs. track census. Transnational Noth America Wildlife Conference 24: 457-464. VILLARREAL, J. 1999. Venado cola blanca. Manejo y aprovechamiento cinegético. Unión Ganadera Regional de Nuevo León. México. WALLMO, O. C., A. W. JACKSON, T. L. HARLEY Y R. L. CARLISLE. 1962. Influence of rain on the count of deer pellet groups. The Journal of Wildlife Management 26: 50-55. WALSH, P. D., L. WHITE, C. MBINA, D. IDIATA, Y. MIHINDOU, F. MAISELS Y M. THIBAULT. 2001. Estimates of forest elephant abundance: projecting the relationships between precision and effort. The Journal of Applied Ecology: 38: 217-228. WEBBON, CH., P. BAKER Y S. HARRIS. 2004. Faecal density counts for monitoring changes in red fox numbers in rural Britain. The Journal of Applied Ecology 41: 768-779. WELCH, D., B. W. STAINES, D. C. CATT Y D. SCOTT. 1990. Habitat use by red (Cervus elaphus) and roe (Capreolus capreolus) deer in a Scottish Sitka spruce plantation. The Journal of Zoology 221: 453-476. WEMMER, C., T. H. KUNZ, G. LUNDIE-JENKINS Y W. J. MCSHEA. 1996. Mammalian sign. Págs. 157-176 in D. E. Wilson, F. Russell-Cole, J. D. Nichols, R, Rudran y M. S. Foster, editors. Measuring and monitoring biological diversity, Standard methods for mammals. Smithsonian Institution. USA. WHITE, G. C. 1992. Do pellet counts index white-tailed deer numbers and population change?: a comment. The Journal of Wildlife Management 56: 611-612. ZIELINSKI, W. J. Y H. B. STAUFFER. 1996. Monitoring martes populations in California: survey desing and power analysis. Ecological Applications 6: 1254-1267. 69 CAPÍTULO III ANÁLISIS Y EVALUACIÓN DE LA MORFOMETRÍA DE PELLETS COMO MÉTODO DE CATEGORIZACIÓN DE SEXOS Y EDADES EN VENADO COLA BLANCA (Odocoileus virginianus mexicanus) EN PUEBLA, MÉXICO 70 I. INTRODUCCIÓN El estudio de la dinámica de una población de fauna silvestre requiere conocer su estructura por sexo y edad pues las tasas de supervivencia y fecundidad suelen variar según la estructura de cada población (Caughley y Sinclair 1994, Kunz et al. 1996, Ojasti 2000). En ungulados se ha demostrado que diferentes edades y sexos responden diferencialmente a factores como la densidad poblacional y el clima (Clutton-Brock y Lonergan 1994, Coulson et al. 2001), conduciendo a que independientemente del tamaño poblacional fluctuaciones en la estructura poblacional tengan fuertes impactos en su dinámica (Coulson et al. 2001). En especial, para el manejo de especies que son aprovechadas por el hombre, los manejadores necesitan conocer la edad y otras características de ungulados silvestres con el fin de definir tasas de extracción para cada sexo (Clutton-Brock y Lonergan 1994) o evaluar el efecto de prácticas de manejo del hábitat pues éstas pueden resultar benéficas para un sexo y desfavorables para el otro (Stewardt et al. 2003). En consecuencia, la estimación sesgada de la estructura poblacional podría conducir a decisiones equivocadas sobre el manejo de la población, de aquí la importancia de contar con métodos confiables que permitan distinguir entre sexos y edades. En ungulados se utilizan varios métodos para estimar la edad y sexo de los individuos. Por ejemplo, aquellos que estiman edades absolutas buscan detectar correlaciones entre la edad y características corporales (Kunz et al. 1996), dentro de estos se cuentan el grado de desgaste dental (Severinghaus 1949, Gilbert y Stolt 1970), la deposición anual de capas de cemento en incisivos (Gilbert 1966) y, el peso del cristalino para el venado cola blanca (Odocoileus virginianus) (Brokx 1972). Estos métodos tienen en común que requieren la captura del individuo o muestras procedentes de animales cazados o de restos encontrados en campo (Kunz et al. 1996, Ojasti 2000). 71 En métodos indirectos como el análisis morfométrico de pellets se ha evidenciado que existe una relación entre el sexo y edad de los individuos y la morfología del pellet, demostrando su utilidad en ungulados como el venado cola blanca de Coues (O. virginianus couesi) (Ezcurra y Gallina 1981), el alce (Alces alces) (MacCracken y van Ballenberghe 1987) y el venado bura (O. hemionus) (Sánchez-Rojas et al. 2004). Estos trabajos han utilizado análisis como la función discriminante por pasos (Manly 1994), las relaciones de la media con respeto a la varianza de las mediciones o la técnica de clasificación de conjuntos difusos (Equihua 1990), que se parametrizan mediante el análisis de muestras provenientes de individuos de edad y sexo conocido para posteriormente clasificar muestras de individuos de identidad desconocida. Sin embargo, MacCracken y van Ballenberghe (1987) sugieren que la técnica de morfometría de pellets no sería útil para animales que no exhiben un fuerte dimorfismo sexual y en poblaciones donde los machos grandes son fuertemente cazados. El venado cola blanca mexicano (O. virginianus mexicanus) es una subespecie con un dimorfismo sexual moderado si se compara con el venado bura o con subespecies de venado cola blanca distribuidas a otras latitudes. La proporción del peso de la hembra respecto al macho es de 70% en O. virginianus borealis (Sauer 1984), de 54% en O. hemionus (Geist 1998), de 64% en O. virginianus couesi (Galindo-Leal y Weber 1998); en contraste con el 98% encontrado en el venado cola blanca en la Selva Lacandona (E. Naranjo, Ecosur, com.pers.) y de 85% en O. virginianus peruvianus (F. Gutierrez, com. pers.). La creciente importancia económica del venado cola blanca mexicano en el estado de Puebla se evidencia en el alto número de Unidades de Manejo para la Conservación de la Vida Silvestre de tipo extensivo interesadas en su manejo, que según Villarreal-Espino (2002) ascendía a 11 en un área de 14335 ha. Esta actividad combinada con la explotación de ganado se ha propuesto como un modelo que produciría beneficios ecológicos, económicos y sociales en zonas 72 como la Mixteca Poblana (Villarreal-Espino y Barros 2000), donde estimaciones recientes del tamaño poblacional del venado cola blanca mexicano indican que sus densidades son bajas, debido posiblemente a la cacería furtiva, la extensión de la frontera agrícola y la competencia entre ganado y venado (López-Tellez et al. 2007). Las bajas densidades de venado y la topografía accidentada de la región, hacen que el método de conteo de grupos fecales sea el más factible de utilizar para conocer el tamaño poblacional de la especie y monitorear las tendencias a través del tiempo (López-Tellez 2006). Por lo tanto, resultaría ventajoso si mediante el análisis morfométrico de pellets se pudiese obtener una adecuada estimación de la estructura de edades y sexos de la población (MacCracken y van Ballenberghe 1987, Sánchez-Rojas et al. 2004). Esto resultaría de gran utilidad para el manejo de las UMAS de tipo extensivo ya que la SEMARNAT (1997), exige en su normatividad implementar métodos para monitorear las poblaciones sujetas a explotación. Dicho esto el objetivo de este estudio fue evaluar el método de morfometría de pellets como posible herramienta para estimar la estructura de edad y sexo de poblaciones del venado cola blanca mexicano. Además, considerando que Ezcurra y Gallina (1981), McCullough (1982), Wemmer et al. (1996) afirman que el peso de los grupos fecales y el número de deposiciones de un animal por día pueden variar con la época del año como resultado de cambios en la dieta, este estudio buscó separar los componentes de la variación en las medidas morfométricas de los pellets no sólo por edad y sexo sino también en función del tiempo Este estudio buscó responder ¿cómo es la variación en las medidas morfométricas entre pellets de un mismo grupo fecal, entre grupos fecales de un mismo individuo en un mismo y diferentes tiempos y entre grupos fecales de diferentes individuos de la misma clase de edad y sexo?, y ¿cómo es el desempeño de la técnica de clasificación de conjuntos difusos para categorizar grupos fecales en clases de sexo y edad? 73 II. HIPÓTESIS 1.- El valor promedio de las variables morfométricas dentro de un mismo grupo fecal y entre grupos fecales de un mismo individuo no cambia de manera estadísticamente significativa a lo largo de un año. 2.- Teniendo en cuenta el desempeño mostrado por el análisis morfométrico de pellets en la categorización de clases de edad y sexo en trabajos previos, espero que el valor promedio de las variables morfométricas de grupos fecales de individuos de distintas clases de edad y sexo sea estadísticamente diferente, de tal forma que los individuos puedan ser segregados en categorías discretas de manera correcta. 3.- La técnica de clasificación de conjuntos difusos logrará asignar correctamente a los individuos cuya variación intra-grupo fecal sea mínima y por tanto, la exactitud de la técnica dependerá más de esta variación que de la presentada entre grupos fecales de animales de distintos sexos y edades. III. MÉTODOS Área de estudio La colecta de los grupos fecales se hizo en el parque General Lázaro Cárdenas del Río “Flor del Bosque” perteneciente a la SEDUEEP (Secretaría de Desarrollo Urbano y Ecología del Estado de Puebla), ubicado en las coordenadas 19º 01’ y 19º 02’ de latitud norte y 98º 05’ y 98º 07’ de longitud oeste, al suroeste del municipio de Amozoc. El parque cuenta con una superficie de 614 ha y su temperatura media anual es de 18 ºC y posee una altitud que va de los 2200 hasta los 2470 msnm (Romero y Martínez-Romero 1998). 74 Población en estudio El parque incluye una UMA-Zoológico que para abril de 2006 mantenía un grupo de 35 venados cola blanca subespecie O. virginianus mexicanus en un cercado de 4 ha rodeado de malla ciclónica de 4 m de altura. En esta zona existe vegetación secundaria, pastizales y una zona de eucaliptos (Romero y Martínez-Romero 1998). La población en cautiverio estaba conformada por doce machos adultos (34%), quince hembras adultas (43%) y ocho individuos de las clases juvenil y crías (23%) (L. E. Martínez-Romero, UMA-Zoológico Flor de Bosque, com. pers.). No se conoce la estructura poblacional detallada del grupo ya que en la UMA no existen registros fiables de la edad y sexo de los animales. Según la bióloga encargada de los venados, de los doce machos adultos se conoce que hay uno de 4 años, uno de 5 y dos de 6 años, datos similares no existen para las hembras (D. Pérez, UMA-Zoológico Flor de Bosque, com. pers.). Los venados eran alimentados en la mañana con alfalfa fresca, alfalfa acicalada, hierbas, maleza de la temporada y fruta, y en la tarde con alimento comercial (potrerina y generaleche). Fase de campo Para examinar si el valor promedio de las variables morfométricas de distintos grupos fecales de un mismo individuo cambia de manera estadísticamente significativa a lo largo de un año, realicé el muestreo de los grupos fecales de los venados en tres periodos de tiempo (Cuadro 1). En el primer periodo de muestreo, colecté inmediatamente después del suministro de alimento (mañana o tarde), los grupos fecales de todos los individuos cuya edad y sexo era identificada. Las muestras fueron guardadas en bolsas de papel y marcadas con el nombre o número del animal, número del grupo fecal y la fecha. Luego fueron secadas a temperatura ambiente. Registré el número de pellets por grupo y tomé fotos de todos los grupos fecales 75 separando cada pellet para poder calcular las medidas morfométricas con un paquete de análisis de imágenes. Cuadro 1. Tipo de muestreo, fecha y número de días de tres periodos de muestreo de grupos fecales de individuos en cautiverio en la UMA-Zoológico Flor del Bosque, 2006 y 2007. Periodo de muestreo Muestreo 1 Muestreo 2 Muestreo 3 Tipo de muestreo Total Animales focales Animales focales Fecha 3 abril – 6 mayo 21 – 25 agosto 29 dic – 18 enero No. días 25 5 10 En este primer muestreo identifiqué ocho animales que fueron utilizados como focales para seguir muestreándolos posteriormente. Estos animales eran reconocidos por marcas naturales, artificiales o comportamiento improntado. Sus grupos fecales fueron colectados en los dos siguientes periodos de muestreo procediendo de igual forma que con las muestras del primer periodo. Todas las fotos de los grupos fecales fueron analizadas (Fig. 1) con el programa de cómputo Image J (Rasband 1997), con el cual obtuve las medidas de área, longitud (L) y ancho (A) de cada pellet; el programa asemeja la forma del pellet a la de una elipse. A partir de las medidas de longitud y ancho, calculé el volumen (V) y la proporción L/A. Todas las medidas fueron reportadas en mm. 76 Figura 1. Esquema del procesamiento de una fotografía de un grupo fecal con el programa de cómputo Image J. La fotografía digital es convertida a un archivo binario (en blanco y negro) y las medidas de las variables área, eje mayor y eje menor son proporcionadas asumiendo que los pellets tienen forma de elipse. Análisis de datos Analicé las medidas de las cinco variables morfométricas (área, eje mayor, eje menor, proporción L/A y volumen) en el programa de cómputo R (R Development Core Team 2006) y obtuve una matriz de las estadísticas descriptivas: media, varianza, desviación estándar, mediana, máximo y mínimo, y número de pellets por grupo fecal. Variación morfométrica en los grupos fecales de un mismo individuo dentro y entre épocas.--Para conocer la variación en las medidas morfométricas de los grupos fecales de un mismo individuo, utilicé los datos de los animales focales. Inicialmente, comparé el valor 77 promedio de cada variable para todos los individuos focales entre periodos de muestreo con un modelo de efectos mixtos de la forma: ~ , ~É | , donde: Y = variable morfométrica SEXO = efecto fijo random = ~ ÉPOCA | ID = efecto aleatorio: desviaciones respecto de la media del factor época dada la identidad del individuo Realicé análisis de varianza anidados (grupos fecales dentro de épocas) para cada individuo focal y por variable morfométrica para determinar si existen diferencias significativas en las medidas de los grupos fecales de un individuo dentro de épocas. Así mismo, apliqué un análisis de varianza de una sola vía para los datos de la época seca para cada individuo focal y por variable morfométrica para examinar si existen diferencias significativas en las medidas de los grupos fecales dentro de esta época. Seleccioné este periodo de muestreo pues es el que cuenta con mayor número de muestras de grupos fecales y en el que tiene más sentido conocer la variación intra-época porque es en ella cuando se hacen los muestreos para conocer el estado de las poblaciones silvestres de venado. Comparación entre grupos fecales de individuos de distintas clases de edad y sexo.-Inicialmente, apliqué un análisis multivariado de varianza (MANOVA) teniendo como variables respuestas las cinco medidas morfométricas transformadas en rangos (Conover y Iman 1981). Posteriormente, apliqué análisis de varianza a cada variable morfométrica nuevamente transformada en rangos para determinar si había diferencias significativas en las medidas morfométricas entre los factores sexo, edad y su interacción. A continuación, llevé a cabo una prueba de Tukey para comparar los niveles de los factores y así determinar que combinaciones de sexo y edad difieren de manera significativa entre sí. 78 Para analizar los datos de la manera que lo hacen Sánchez-Rojas et al. (2004) quienes dividen a los individuos en tres categorías (juveniles, < 1.5 años de edad; hembras, > 3 años de edad; machos, > 3 años de edad), clasifiqué los datos de los individuos de mi estudio en las siguientes clases: crías y juveniles de 0 a 2 años de edad; hembras de >2 a 5 años de edad; y, machos de >2 a 6 años. Realicé un análisis de varianza por cada variable morfométrica tomando estas nuevas categorías de edad como factor. Para encontrar el tamaño de muestra mínimo que habría que medir para representar el valor promedio de las variables morfométricas, utilicé todos los datos del primer periodo de muestreo. Para esto, hice remuestreos en R variando el tamaño de muestra de 2 pellets hasta el total de pellets del grupo en cuestión, la variable respuesta era el promedio de la medida morfométrica. Los remuestreos se detenían cuando con la medida morfométrica en cuestión se alcanzaba una precisión del 95%. A partir de la rutina obtuve una matriz que contenía el número mínimo de pellets a medir por grupo fecal y por variable morfométrica, los cuales fueron promediados para obtener un valor por variable. Evaluación del desempeño de la técnica de clasificación de conjuntos difusos.--Utilicé el programa de cómputo Fuzzy clustering tool (Equihua-Zamora 2001) para categorizar los grupos fecales colectados en el primer muestreo y así, probar la exactitud de la técnica k-medias difusa, en adelante referida como “fuzzy” para asignar individuos a clases de edad y sexo conocida. Este programa indaga los siguientes parámetros: número de conjuntos, parámetro de difusión (m) y norma para la distancia métrica; siguiendo el trabajo de Sánchez-Rojas et al. (2004), fijé como número de conjuntos tres (teniendo en cuenta la categorización en juveniles, hembras adultas y machos adultos), m = 2 y norma euclidiana para la distancia métrica. Realicé varios ensayos de categorización: 1) usando como variable de clasificación la mediana, 2) usando como variable de clasificación la media, 3) usando cada medida morfométrica por separado, es decir, tomando en 79 cada análisis las medianas de una sola variable y 4) quitando los datos de machos adultos de 5 y 6 años. Este último ensayo se hizo considerando que los datos de los machos de estas edades fueron separados en conjuntos aparte en los ensayos 1 y 2. Asigné cada grupo fecal a uno de los tres conjuntos con base en la mayor membresía. Con los resultados generados al usar las cinco medidas morfométricas y la mediana, grafiqué el porcentaje de grupos fecales asignado a cada conjunto, por sexo y en orden ascendente de edad, esperando que estos porcentajes evidencien la existencia de tres distribuciones. La primera distribución debería estar sesgada hacia los datos de juveniles de 1 y 2 años de edad; la segunda debería exhibir una forma de campana con la moda en las edades de 3 y 4 años; y, la tercera debería estar sesgada hacia las mayores edades. Con los datos del primer periodo de muestreo de los animales focales, grafiqué por cada animal el número de grupos que eran clasificados en cada conjunto; de esta forma pude examinar visualmente el desempeño de la técnica para categorizar los grupos fecales de un mismo animal. Espero que todos los grupos fecales de un individuo sean asignados a un solo conjunto. Para conocer cómo puede variar la estructura poblacional del grupo en cautiverio dependiendo de los grupos fecales usados en la técnica de clasificación fuzzy, seleccioné al azar tres grupos fecales de cada animal focal y 14 pellets de cada grupo y luego calculé la mediana del eje mayor. Este procedimiento fue repetido 50 veces y con cada matriz de datos corrí el programa de cómputo Fuzzy clustering tool. Comparé con una prueba de χ2 la frecuencia de grupos fecales asignado a cada cluster con la frecuencia conocida de la población de los animales focales (2 juveniles, 2 hembras adultas y 4 machos adultos). Con este procedimiento busqué evaluar la exactitud de la técnica para generar una estructura poblacional conocida. La exactitud, medida de la cercanía entre el valor estimado y el valor verdadero (Lancia et al. 1996) fue evaluada como el porcentaje de veces en que la prueba de χ2 resultó no significativa. 80 IV. RESULTADOS Variación morfométrica entre grupos fecales de un mismo individuo dentro y entre épocas El número total de muestras para los animales focales varió entre 11 y 34 (Cuadro 2). La comparación de las medidas morfométricas con el modelo de efectos mixtos mostró que existen diferencias significativas entre sexos y que el mayor porcentaje de la variación de los datos está explicado por las diferencias entre épocas (Cuadro 3). Cuadro 2. Número de muestras por periodo de muestreo para ocho venados focales durante el periodo de muestreo 2006-2007. Sexo Identidad A B Hembras C D E Machos F G H Total Edad (años) 1 3 4 2 4 5 6 6 Periodo 1 2006 8 20 19 6 7 5 16 9 90 Periodo 2 2006 1 2 1 5 4 2 2 4 21 Periodo 3 2007 3 12 5 3 † 6 4 2 35 Total 12 34 25 14 11 13 22 15 146 Cuadro 3. Promedios de cada medida morfométrica por periodo de muestreo y por sexo y resultados del modelo estadístico de efectos mixtos. Se presentan los valores de t y p para la comparación entre sexos, y el porcentaje de varianza que es explicado por el factor ÉPOCA para cada medida morfométrica. Prueba t con g.l. = 138, 6 Época % de varianza explicada por la época Periodo 1 Periodo 2 Periodo 3 Variable H M H M H M 2 68.1 88.1 102.3 110.9 76.0 93.8 18.0* Área (mm ) 12.5 12.8 13.8 11.4 13.0 22.4* Eje mayor (mm) 11.2 7.7 8.9 10.1 10.2 8,4 9.1 28.8* Eje menor (mm) 1.4 1.4 1.3 1.4 1.4 1.5 Proporción L/A 26.0* 9.6* Volumen (mm3) 2851.4 4309.0 5634.6 6122.3 3496.3 4670.5 H = Hembras, M = Machos; p ≤ 0.05 “*”; “-” = modelo no corrió para esta variable. 81 75% 82% 75% En la Figura 2 presento un ejemplo para la variable morfométrica eje mayor. En general todas las variables, excepto la proporción L/A, presentaron los valores más bajos en el periodo 1 que corresponde con la época seca, los valores intermedios en el periodo 3 y los más altos en el periodo 2 que corresponde con las lluvias. Al colapsar los niveles de los periodos 1 y 3 en uno solo, los modelos generados para las variables área, eje menor y volumen presentaron un AIC menor que los que consideraban los tres niveles (Área: AIC Modelo 1 = 1220.6, AIC Modelo 2 = 1165.1; Eje menor: AIC Modelo 1 = 407.4, AIC Modelo 2 = 356.8; Volumen: AIC Modelo 1 = 2490.5, AIC Modelo 2 = 2422.8), es decir, que no existen diferencias significativas entre las medidas morfométricas de los periodos 1 y 3 y que éstas difieren significativamente de las de la época de lluvias. Figura 2. Variación en el eje mayor entre épocas dada la identidad de cada individuo focal. En el recuadro rosado la primera letra indica la identidad de cada animal, la segunda letra indica el sexo del mismo, H = Hembra, M = Macho. Los números en los bordes externos de la gráfica indican el periodo de muestreo. 82 El boxplot para los grupos fecales de cada individuo permitió observar la gran variabilidad que existe en las medidas de los pellets dentro y entre grupos fecales de un mismo periodo y entre grupos de periodos diferentes (Fig. 3). Las gráficas para los otros siete animales se presentan en el Anexo 1. Periodo 1 Periodo 2 Periodo 3 Figura 3. Representación gráfica de la variación en las medidas morfométricas de los pellets durante los tres periodos de muestreo para un mismo individuo. 83 La comparación de las medidas morfométricas de los grupos fecales dentro de cada época mostró que sólo en los casos de la hembra de 4 años y de uno de los machos de 6 años las dimensiones de sus grupos fecales no variaron de manera significativa dentro de cada periodo de muestreo. La hembra de 1 año y el macho de 2 años presentaron diferencias significativas en las variables área, eje menor y volumen. Los grupos fecales de la hembra de 3 años, el macho de 4 años y el otro macho de 6 años difirieron significativamente dentro de épocas en todas las variables excepto en la proporción L/A. Los grupos del macho de 5 años variaron con algún grado de significancia en todas las variables. En suma, la proporción L/A y el eje mayor fueron las medidas morfométricas que exhibieron menos variabilidad dentro de épocas para seis y cinco de los ocho animales focales, respectivamente (Cuadro 4). Cuadro 4. Resultados de la significancia para pruebas de ANOVA anidada de la comparación de las medidas morfométricas de los grupos fecales dentro de épocas por cada individuo focal. Venado Sexo Edad Área Eje mayor Eje menor Proporción L/A H 1 A *** n.s. ** n.s. n.s. H 3 B *** *** * n.s. H 4 C n.s. n.s. n.s. n.s. M 2 D ** n.s. ** n.s. M 4 E ** * ** M 5 F ** * ** * n.s. M 6 G n.s. n.s. n.s. n.s. M 6 H ** ** * p ≤ 0.001 “***”, p ≤ 0.01 “**”, p ≤ 0.05 “*”, p > 0.05 “n.s.”. Volumen *** *** n.s. ** ** *** n.s. ** Los grupos fecales dentro del primer periodo de muestreo variaron de manera significativa con una p < 0.001 en todos los individuos focales y todas las medidas morfométricas. 84 Comparación entre grupos fecales de individuos de distintas clases de edad y sexo Para comparar las medidas morfométricas de grupos fecales de individuos de distintas clases de edad y sexo, se utilizaron los datos de 189 grupos colectados en el primer periodo de muestreo. El número de muestras por sexo y clase de edad no fueron equitativos, sólo las clases de edad de 2 y 5 años tuvieron tamaños de muestra similares entre machos y hembras (Cuadro 5). Considerando la clasificación en tres categorías de edad, 60 grupos fecales (33%) fueron de juveniles, 74 (36%) de hembras adultas y 55 (30%) de machos adultos. Cuadro 5. Número y porcentaje de grupos fecales por clase de sexo y edad para la época seca, n = 180. Abril – mayo de 2006. Edad <1 1 2 3 4 5 6 >6 Total No. Muestras Hembras Machos 1 15 3 17 24 25 12 34 13 7 5 25 8 98 82 Total por clase de edad 1 18 41 37 47 12 25 8 189 Porcentaje Hembras Machos 83% 41% 68% 72% 58% 0% 100% 17% 59% 32% 28% 42% 100% 0% El MANOVA indicó que existe un efecto altamente significativo sobre las medidas morfométricas de los factores sexo, edad y su interacción (Sexo, g.l. = 1, Wilks = 0.8, p < 0.001; Edad, g.l. = 5, Wilks = 0.3, p < 0.001; Sexo:Edad, g.l. = 4, Wilks = 0.7, p < 0.001), por lo cual se puede confiar en la significancia de los ANOVAS realizados a cada variable. Encontré diferencias altamente significativas al comparar el área, el eje mayor, el eje menor y el volumen entre sexos, entre edades y en la interacción sexo:edad. La proporción L/A varió significativamente entre edades y en la interacción sexo:edad, pero no entre sexos (Cuadro 6). 85 Cuadro 6. Resultados de la prueba de ANOVA para la comparación de las medidas morfométricas entre sexos (g.l. = 1, 169), edades (g.l. = 5, 169) y la interacción sexo:edad (g.l. = 4, 169). Variable Área Eje mayor Eje menor Proporción L/A Volumen Entre sexos F = 23.4, p < 0.05 F = 19.3, p < 0.05 F = 23.0, p < 0.05 F = 0.006, p = 0.93 F = 22.5, p < 0.05 Resultados ANOVA Entre edades F = 13.8 , p < 0.05 F = 9.1, p < 0.05 F = 17.8, p < 0.05 F = 4.9 , p < 0.05 F = 16.1, p < 0.05 Sexo:Edad F = 4.4, p < 0.05 F = 6.0, p < 0.05 F = 3.5 , p < 0.05 F = 3.8, p < 0.05 F = 4.4 , p < 0.05 Al comparar entre sexos y edades gráficamente se observa que los machos más grandes siempre tuvieron los mayores valores promedio de las variables morfométricas, excepto para la proporción L/A. Las edades 1, 2, 3 y 4 de los machos y todas las edades de las hembras tuvieron promedios similares para todas las variables (Fig. 4). En el Anexo 2 presento el valor promedio de cada una de las variables por clase de edad para las hembras y los machos. 86 b Área 120 Promedio 100 80 a aa a aa b 16 aa a a 60 40 12 aa aa aa aa a 1 2 3 4 5 b a 8 4 20 0 0 0 1 2 3 4 5 a 8 aa a a a a a a a a 1.5 6 4 6 Proporción L/A 2 b b Promedio 10 0 6 Eje menor 12 Promedio Eje mayor 20 b Promedio 140 a aa a a aa a a b b 1 0.5 2 0 0 Promedio 0 1 8000 7000 6000 5000 4000 3000 2000 1000 0 2 3 4 5 Volumen a 0 1 a b aa aa a 2 3 4 a 0 6 1 2 3 4 5 6 b Hembras Machos a a 5 6 Edad Figura 4. Valores promedio y desviación estándar para cada una de las medidas morfométricas, según sexo y edad, n = 180. Las letras en la parte superior de cada punto indican la significancia del ANOVA, combinaciones “aa” o “bb” indican diferencias no significativas, combinación “ab” indica diferencias significativas (p < 0.05). Al agrupar las edades en tres categorías (juveniles, hembras adultas y machos adultos), no encontré diferencias significativas entre ellas en la variable proporción L/A (ANOVA, F = 0.24, gl = 2 y 178, p = 0.78) pero sí en el área (ANOVA, F = 33.3, gl = 2 y 178, p < 0.05), eje mayor (ANOVA, F = 18.8, gl = 2 y 178, p < 0.05), eje menor (ANOVA, F = 23.4, gl = 2 y 178, p < 0.05) y volumen (ANOVA, F = 35.3, gl = 2 y 178, p < 0.05) (Fig. 5). 87 120 80 67.5 65.1 40 20 Juveniles 12 Hembras a a 10.8 10 12.1 10.6 8 6 4 0 Machos Eje menor a 7.8 a 8 7.6 8.6 6 Promedio b 10 Promedio (mm) 12 b 2 0 4 2 0 Juveniles Hembras Machos 6000 Promedio (mm3) Eje mayor 14 83.4 a a 60 b Promedio (mm) 100 Promedio (mm2) 16 Área 4000 3000 a Proporción L/A a a 1.43 Juveniles 1.40 Hembras Machos a 1.41 Machos 3976.8 a 2686.6 Hembras b Volumen 5000 1.8 1.6 1.4 1.2 1 0.8 0.6 0.4 0.2 0 Juveniles 2850.8 2000 1000 0 Juveniles Hembras Machos Categorías de edad Figura 5. Valores promedio y desviación estándar para cada una de las medidas morfométricas para tres categorías de edad, n = 181. El valor junto a cada punto es el valor promedio para la categoría de edad. Las letras en la parte superior de cada barra indican la significancia del ANOVA, combinaciones “aa” o “bb” indican diferencias no significativas, combinación “ab” indica diferencias significativas (p < 0.05). El número de pellets a medir para alcanzar una precisión del 95% varió entre grupos fecales y variables morfométricas. En la Figura 6 presento un ejemplo para un grupo fecal de una hembra de 1 año, en la cual se observa que el eje menor es la medida menos variable. 88 Figura 6. Remuestreo del número de pellets vs. promedio de la variable morfométrica para el grupo fecal 60. Línea azul representa el promedio de la variable para ese grupo fecal; las líneas rojas son los límites del intervalo de confianza del 95%. A partir de una matriz de datos que contenía el número mínimo de pellets a medir por grupo fecal y por variable morfométrica, obtuve el número de pellets promedio para alcanzar una precisión del 95%. El eje menor con 5 pellets y el volumen con 40, fueron las variables que menor y mayor número de pellets, respectivamente, necesitaron para alcanzar la precisión deseada. El área, el eje mayor y la proporción L/A necesitaron 23, 14 y 13 pellets, respectivamente. 89 Evaluación del desempeño de la técnica de clasificación fuzzy Primer ensayo.--Usando la mediana como variable de clasificación, la técnica fuzzy colocó al 56% de las muestras en el conjunto I, el 32% en el conjunto II y el 12% en el conjunto III. El conjunto I presentó los valores más bajos en todas las variables, excepto en la proporción L/A, seguido por el conjunto II y finalmente el conjunto III. Con este análisis, en el conjunto I quedaron incluidos individuos de todas las edades, excepto los machos de 5 años, en el conjunto II todas las edades, excepto crías, hembras de 1 año y machos de 5 años, y en el conjunto III los machos adultos de 5 y 6 años y un grupo fecal de una hembra de 4 años (Cuadro 7). Cuadro 7. Esquema de asignación de individuos por clase de edad y sexo a cada conjunto con base en la mayor membresía, y porcentaje de grupos fecales colocados en cada conjunto, n = 189. Hembras Edad 0 1 2 3 4 5 Machos 14 1 2 3 4 Conjunto I Conjunto II Conjunto III 5 6 % 56 32 12 Segundo ensayo.--Análisis como los dos anteriores con el total de muestras y las cinco variables morfométricas, los hice también con la media en cambio de la mediana y encontré los mismos resultados, tanto en porcentajes como en esquema de asignación de individuos a cada conjunto. Por tanto, en los siguientes ensayos utilicé la mediana preferiblemente. Tercer ensayo.--Al utilizar cada una de las medidas morfométricas, encontré que tanto la asignación a cada conjunto como el porcentaje de grupos fecales pertenecientes a cada uno varía (Cuadro 8). Es decir, que mientras en el primer ensayo en donde se utilizan todas las variables el mayor número de muestras pertenecen al conjunto I (valores bajos), con el eje mayor, por ejemplo, la mayoría de muestras corresponden al conjunto II (valores medios). Con algunas 90 medidas no fue posible lograr una clasificación ni con la media ni con la mediana, pues como en el caso de la proporción L/A los centroides o valores medio de cada conjunto resultan iguales generando membresías idénticas. La clasificación obtenida utilizando solamente el volumen produjo los mismos resultados que la proporcionada por todas las variables. Cuadro 8. Esquemas de asignación de individuos por clase de edad y sexo a cada conjunto, utilizando cada una de las medidas morfométricas independientemente, y porcentaje de grupos fecales colocados en cada conjunto, n = 189. a) Área con mediana Edad Conjunto I Conjunto II Conjunto III 0 1 2 Hembras 3 4 5 14 1 2 Machos 3 4 5 6 % 50 37 13 14 1 2 Machos 3 4 5 6 % 32 52 16 14 1 2 Machos 3 4 5 6 % 39 47 14 14 1 2 Machos 3 4 5 6 % 56 32 12 b) Eje mayor con media Edad Conjunto I Conjunto II Conjunto III 0 1 2 Hembras 3 4 5 c) Eje menor con mediana Edad Conjunto I Conjunto II Conjunto III 0 1 2 Hembras 3 4 5 d) Volumen con mediana Edad Conjunto I Conjunto II Conjunto III 0 1 2 Hembras 3 4 5 Cuarto ensayo.--En ausencia de los datos de machos de 5 años, nuevamente en los conjuntos I y II quedaron clasificados individuos de todas las edades y en el conjunto III se logró 91 separar a los machos de 6 años (Cuadro 9). Sin los datos de machos de 5 y 6 años, la clasificación es poco discriminatoria, individuos de todas las edades quedan asignados a los tres conjuntos, a excepción del dato de la cría que no es incluida en los conjuntos II ni III y machos de 1 año que no son incluidos en el conjunto II (Cuadro 10). Cuadro 9. Esquema de asignación de individuos por clase de edad y sexo a cada conjunto, quitando los datos de machos de 5 años, y porcentaje de grupos fecales colocados en cada conjunto, n = 184. Edad Conjunto I Conjunto II Conjunto III 0 1 2 Hembras 3 4 5 14 1 Machos 2 3 4 6 % 58 32 10 Cuadro 10. Esquema de asignación de individuos por clase de edad y sexo a cada conjunto, quitando los datos de machos de 5 y 6 años, y porcentaje de grupos fecales colocados en cada conjunto, n = 159. Edad Cluster I Cluster II Cluster III 0 1 2 Hembras 3 4 5 14 1 Machos 2 3 4 % 42 40 18 Considerando que los porcentajes de grupos fecales asignados a cada conjunto representan la estructura de edades de la población en cautiverio, en el cuadro 11 presento el resumen de las estructuras poblacionales generadas en cada uno de los ensayos anteriores comparadas con la estructura real. 92 Cuadro 11. Comparación de las estructuras poblacionales (%) generadas en cada ensayo con la estructura real del grupo en cautiverio. Categoría de edad Ensayo 1 Estructura real Ensayo 3 Ensayo 2 Área J 23 56 56 50 H 43 32 32 37 M 34 12 12 13 J: Juveniles, H: Hembras adultas, M: Machos adultos Ensayo 4 Eje mayor Eje menor Volumen Sin M5 Sin M5 y M6 32 52 16 39 47 14 56 32 12 58 32 10 42 40 18 Distribución de los porcentajes de asignación de grupos fecales a los conjuntos de fuzzy, según sexo y edad.--La distribución del porcentaje de grupos fecales asignados a cada conjunto no mostró la distribución esperada, pues en el conjunto I aunque fueron clasificados la mayoría de grupos fecales pertenecientes a las edades de 0 a 2 años, fueron colocados también grupos fecales de individuos de 3 a 4 años y hasta 5 en el caso de las hembras. En el conjunto II fueron clasificados grupos de todas las edades, excepto crías y machos de 5 años aunque en porcentajes menores a los conjuntos I y III; y en el conjunto III fueron clasificados sólo machos adultos de 5 y 6 años (Fig. 7). 100 90 80 Porcentaje 70 60 50 40 30 20 10 0 D 0 H M 1 H M 2 H M H 3 M 4 H M H 5 M 6 Edad/Sexo Conjunto I Conjunto II Conjunto III Figura 7. Distribución de los porcentajes de asignación de 189 grupos fecales a los tres conjuntos generados por fuzzy. 93 Asignación de los grupos fecales de individuos focales a los conjuntos de fuzzy.--Al analizar el desempeño de la técnica fuzzy para asignar los grupos de un mismo individuo a una clase de edad y sexo conocida, se observa en la Figura 8 que los grupos fecales de todos los individuos, excepto los del macho de 2 años, son asignados a más de un conjunto. Los grupos fecales de hembras y machos de 1 a 4 años son clasificados en los conjuntos I y II, mientras que los de los machos adultos son asignados a los conjuntos II y III; aunque incluso uno de los grupos Número de grupos fecales fecales de uno de los machos de 6 años es clasificado en el conjunto I. 22 20 18 16 14 12 10 8 6 4 2 0 22 21 18 8 7 H1 H3 H4 10 8 6 M2 M4 M5 M6 M6 Individuo (Sexo-Edad) Conjunto I Conjunto II Conjunto III Figura 8. Número de grupos fecales de animales focales asignado a cada cluster. El número en la parte superior de las barras corresponde al tamaño de muestra para ese individuo. Evaluación del desempeño de fuzzy para clasificar en categorías de edad.--Considerando las categorías de edad de juveniles, hembras y machos, el mayor porcentaje de grupos fecales de juveniles (73%) quedó clasificado en el conjunto I, mientras que el 27% quedó asignado al conjunto II. En el caso de las hembras el 57% fue clasificado en el conjunto I, el 42% en el conjunto II y sólo el 1% en el conjunto III. Para los machos, el 36% de los grupos fecales quedó asignado en el conjunto I, el 25% en el conjunto II y el 38% en el conjunto III (Fig. 9). 94 Porcentaje de grupos 80 70 60 50 40 30 20 10 0 J Conjunto I H Categoría de edad Conjunto II M Conjunto III Figura 9. Distribución de los porcentajes de asignación de 189 grupos fecales a cada cluster, considerando tres categorías de edad; J = Juveniles, H = Hembras, M = Machos. Teniendo en cuenta que las categorías de juveniles y hembras no difirieron significativamente en el valor promedio de sus variables (ver Fig. 4), se probó uniendo los resultados generados por fuzzy para estas dos clases de edad. De esta forma, en el caso de juveniles + hembras, el 99% de sus grupos son clasificados en el conjunto I, mientras que en el caso de los machos, el 62% es asignado al conjunto I y el 38% al conjunto III (Fig. 10a.). Esta nueva forma de clasificación no mejora los resultados pues se espera que los grupos fecales de machos sean preferiblemente asignados al conjunto III. Cuando a los datos de juveniles y hembras se unen los datos de machos de 3 y 4 años y se dejan aparte los de machos de 5 y 6 años, (que en el análisis inicial de fuzzy fueron separados en el conjunto III (ver cuadro 7)), se obtiene que los juveniles, las hembras y los machos de hasta 4 años son asignados a los conjuntos I + II, mientras que los machos más grandes lo son al conjunto III (Fig. 10b). En suma, según fuzzy, el 88% de los grupos fecales pertenecen al conjunto I + II y el 12% al conjunto III. Esta última clasificación coincide mejor con la distribución total de las muestras, pues el 84% (159 grupos fecales) fue de juveniles, hembras y machos menores de 3 y 4 años, mientras que el 16% (30 grupos fecales) fue de los tres machos de 5 y 6 años. 95 a) 80 60 40 20 0 JH M Categoría de edad Conjunto I + II Conjunto III 100 Porcentaje de grupos Porcentaje de grupos 100 b) 80 60 40 20 0 JHM M Categorías de edad Conjunto I + II Conjunto III Figura 10. Distribución de los porcentajes de asignación de 189 grupos fecales a cada cluster, considerando a) dos categorías de edad; JH = Juveniles + Hembras, M = Machos; y b) dos categorías de edad; JHM = Juveniles + Hembras + Machos < 5 años, M = Machos de 5 y 6 años. Comparación entre estructuras poblacionales estimadas y real.--Al comparar las estructuras estimadas con una real compuesta por dos juveniles (1 y 2 años), dos hembras adultas (3 y 4 años) y cuatro machos adultos (4, 5 y 6 años), se encontraron diferencias significativas (p < 0.05) en el 30% de las comparaciones. Por otro lado, considerando que cuando los machos intermedios de 3 y 4 años fueron separados de los machos de 5 y 6 años, se encontró una distribución de los porcentajes de asignación a cada conjunto más similar a la distribución real del total de las muestras (Fig.9b), se realizó una segunda comparación entre las estructuras poblacionales observadas y una real compuesta por dos juveniles (1 y 2 años), dos hembras adultas y un macho adulto intermedio (3 y 4 años) y tres machos grandes (5 y 6 años). En este caso, se encontraron diferencias significativas sólo en el 2% de las comparaciones. V. DISCUSIÓN Mis resultados sugieren que dada la alta variación presentada en las medidas morfométricas de los pellets de un mismo individuo en una misma época y entre épocas del año, y la baja variación mostrada entre grupos fecales de individuos de diferentes clases de edad y 96 sexo, el análisis morfométrico de pellets es una metodología poco confiable para determinar la estructura de edad y sexo de una población de O. virginianus mexicanus. En consecuencia, la técnica de clasificación fuzzy no logra una categorización adecuada de la población en estudio pues sólo separa a los machos adultos de 5 y 6 años, mientras que los juveniles y las hembras no son discriminados en clases separadas. En lo que sigue se discute en detalle estos resultados. Este estudio evidenció que las medidas morfométricas de los pellets de los grupos fecales de un mismo individuo varían de manera significativa dentro y entre épocas. Ninguno de los trabajos realizados anteriormente con morfometría de pellets (Ezcurra y Gallina 1981, MacCracken y van Ballenberghe 1987, Sánchez-Rojas et al. 2004) había considerado cómo cambian las medidas morfométricas de los pellets de un individuo con el tiempo. La variación entre épocas en donde los pellets de la época de lluvias (periodo 2) son más grandes que los de los otros periodos podría relacionarse con cambios en la dieta. En otros estudios que evalúan el efecto de la época sobre el número de grupos fecales depositados por animal, se ha encontrado que este número cambia de manera significativa entre estaciones como resultado del aumento en la ingesta de comida y el incremento en el contenido de fibra de los recursos consumidos (Rogers 1987). La variación individual dentro de épocas también ha sido registrada para el peso de los grupos fecales y de los pellets (Arthur y Alldredge 1980, McCullough 1982). Ezcurra y Gallina (1981) compararon el tamaño de los pellets de individuos de un zoológico con los de otros cautivos en un encierro en la Reserva La Michilía, encontrando que los de éstos últimos eran mucho más pequeños que los del zoológico, por tanto, concluyeron que la dieta tenía una fuerte influencia sobre el tamaño del pellet. Para determinar el efecto de la dieta sugiero conducir un estudio experimental en el que se controle el tipo y cantidad de alimentos consumidos por los animales y se tomen las medidas morfométricas de pellets de grupos fecales colectados durante días sucesivos. 97 Otro de los resultados importantes de mi trabajo es que el análisis morfométrico de pellets para esta subespecie de venado no evidenció diferencias significativas entre animales de sexos y edades diferentes. Sólo los grupos fecales de los machos más grandes tuvieron promedios significativamente diferentes que las otras edades. El método morfométrico se basa en el supuesto que el tamaño del cuerpo es un indicador de la edad del animal y que las medidas de los pellets dependen del tamaño corporal. Por ejemplo, Bubenik (1982 citado en MacCracken y van Ballenberghe 1987), afirma que el tamaño de los pellets del wapiti (Cervus elaphus) depende de la edad del animal y su forma es sexo-específica. Sin embargo, aún cuando el dimorfismo sexual ocurra, las medidas de machos y hembras usualmente se sobrelapan (Kunz et al. 1996); por tanto, es de esperarse que si el tamaño del cuerpo influye el tamaño del pellet y el primero es un criterio fiable solamente en los extremos, los grupos de pellets que pueden separarse son los de los animales más pequeños y más grandes, esto último como en el presente estudio. La poca diferenciación en las medidas morfométricas de pellets de hembras y machos encontrada en este estudio, contrasta con las diferencias intersexuales en el consumo de dietas y uso de hábitats de diferente calidad registradas por otros trabajos. Debido a sus requerimientos energéticos y a restricciones anatómicas se ha propuesto que las hembras consumen forrajes más nutritivos y ocupan hábitats de mejor calidad que los machos (Beier 1987, McCullough et al. 1989, Barboza y Bowyer 2000). Si el tipo de comida consumida determina la forma y tamaño del pellet, la dieta suplementada en cautiverio podría tener un efecto homogenizador que no está presente en las poblaciones silvestres en donde al parecer los sexos son capaces de seleccionar forrajes diferentes. Realizar un estudio en el que animales de edad y sexo conocido se alimenten libremente y se tomen muestras de sus grupos fecales, puede ser el medio para comprobar el efecto de la dieta sobre la morfometría de los pellets. 98 El análisis morfométrico de pellets varió en exactitud al igual que los métodos que estiman edades absolutas. Por ejemplo, para poblaciones del corzo (Capreolus capreolus) el desgaste dental produjo resultados sesgados (Hewinson et al. 1999), mientras que resultó ser correcto y repetible para estimar la edad del antílope (Saiga saiga) (Lundervold et al. 2003). El conteo de capas de cemento en secciones de dientes ha resultado ser exacto para determinar la edad del corzo (Aitken 1975), el antílope (Lundervold et al. 2003) y el alce (Alces alces) (Rolandsen et al. 2007). Para el caso del análisis morfométrico de pellets, su exactitud no hace posible estimar edades absolutas sino relativas, es decir, categorías gruesas como juveniles, hembras adultas y machos adultos. Ezcurra y Gallina (1981) para la subespecie de venado cola blanca O. v. couesi y Sánchez-Rojas et al. (2004) para el venado bura, encontraron diferencias en la morfometria de los pellets de individuos de edad y sexo conocido; sin embargo, éstas sólo permitieron asignar individuos a categorías de sexo y edad. En el presente estudio, la falta de poder discriminatorio del método de clasificación podría deberse al pequeño dimorfismo sexual que existe en la subespecie del venado cola blanca mexicano en comparación al venado cola blanca de Coues o al venado bura. Según MacCracken y van Ballenberghe (1987) el análisis morfométrico de pellets puede no ser útil cuando se presenta esta situación. Por tanto, se sugiere evaluar en otras subespecies de venado pequeñas el desempeño del análisis morfométrico de pellets para asignar individuos a categorías de sexo y edad. Si se encuentra el mismo patrón, es decir, que sólo se separa a los machos más grandes de la población, se podría concluir que este método sólo funciona para subespecies grandes. La técnica de clasificación fuzzy no permitió categorizar de manera adecuada el grupo de venados en estudio, a diferencia de lo registrado por Sánchez et al. (2004) para el venado bura. La variación individual dentro y entre épocas en las medidas morfométricas de los pellets pudo producir esta baja exactitud pues excepto tres animales focales (hembra de 1 año, macho de 2 99 años y macho de 5 años), los grupos fecales de los restantes individuos no fueron asignados correctamente a un solo conjunto de fuzzy. Esto se traduce en que dependiendo de los pellets o el grupo fecal medido, un animal puede quedar clasificado como juvenil en unas ocasiones y como hembra en otras. Según mis resultados, sólo el 73% de los grupos fecales de juveniles, el 72% de los grupos de las hembras y el 38% de los grupos de machos adultos, fueron asignados al conjunto correcto. Esto contrasta con lo encontrado por Sánchez-Rojas et al. (2004), quienes lograron diferenciar claramente tres categorías de edad y clasificar correctamente en ellas al 75% de los juveniles, al 83% de las hembras y al 100% de los machos. Cuando los datos de machos de edades intermedias (3 y 4 años) son colocados junto con los datos de juveniles y hembras adultas (JHM), el porcentaje de grupos fecales correctamente asignados aumenta a 99% para la clase de JHM y a 70% para los machos adultos más grandes. El nivel de exactitud logrado en mi estudio separando los individuos en dos grandes categorías de edad, juveniles, hembras y machos intermedios por un lado y macho grandes por otro, sugeriría trabajar en fuzzy con dos conjuntos; sin embargo, procediendo de esta forma no se logra separar a los machos más grandes en un conjunto aparte. Por tanto, seguir aplicando el significado biológico al utilizar tres conjuntos que representan tres categorías de edad parece más conveniente. La estructura de edades generada por fuzzy de 56% de juveniles, 32% de hembras y 12% de machos, difirió de la real compuesta por un 23% de juveniles, 43% de hembras adultas y 34% de machos adultos. Mis análisis sugieren que una estimación menos sesgada de la estructura poblacional, se podría obtener cuando se unen los datos de los grupos fecales de juveniles, hembras adultas y machos intermedios clasificados en los conjuntos I y II. Las diferentes pruebas realizadas para evaluar el desempeño de fuzzy sugieren que al menos para la subespecie O. virginianus mexicanus la técnica es confiable solamente para asignar 100 a los machos más grandes de una población a la clase de edad y sexo correcta. Considerando que los venados macho más grandes son los individuos objeto de aprovechamiento en la región de la Mixteca Poblana, la utilidad del análisis morfométrico de pellets para separar esta clase de sexo y edad podría ser suficiente. Sin embargo, en poblaciones manejadas con fines cinegéticos, donde el objetivo principal es maximizar la extracción anual de machos maduros, es necesario aprovechar también algunas hembras, esto hace que se deban aplicar tasas de extracción diferenciales a los dos sexos (Clutton-Brock y Lonergan 1994). Para aplicar las tasas de cosecha correctas se debe contar con estimaciones exactas de la estructura poblacional; si el análisis morfométrico de pellets no proporciona esta información se hace necesario explorar otras herramientas metodológicas. La determinación del sexo a partir de heces ha sido utilizada en el venado cola blanca y el alce (Huber et al. 2002, Lindsay y Belant 2007). Aunque las bajas concentraciones de DNA y la inhibición de la polimerasa son los mayores problemas para usar el extracto fecal como plantilla para la PCR (Kohn y Wayne 1997), colectar suficientes muestras para repetir las pruebas varias veces parece resolverlos (Huber et al. 2002). La proporción estradiol/testosterona también se ha usado para conocer la proporción de venados de cada sexo; sin embargo, los niveles fecales de esteroides pueden verse afectados por la composición de la dieta y su uso debe limitarse a máximo diez días después de la deposición (Martínez-Romero 2004). VI. CONCLUSIONES Y RECOMENDACIONES Dado la variación individual y entre individuos de clases de edad y sexo diferentes en las medidas morfométricas de los pellets, el análisis morfométrico no es una metodología recomendable para estimar la estructura poblacional de la subespecie de venado cola blanca mexicano en Puebla. 101 La técnica de clasificación fuzzy no logró proporcionar la estructura de edades y sexo correcta de la población en estudio, por lo que se recomienda interpretar con mucha precaución los resultados generados por esta técnica cuando se aplique en poblaciones silvestres de la subespecie de venado cola blanca mexicano. Se recomienda explorar qué factores explican la variación individual en la medidas morfométricas de los pellets. Posibles factores pueden ser la dieta, la actividad o la hora del día. Se sugiere realizar un estudio similar a este con otras subespecies de venado que no exhiban un fuerte dimorfismo sexual como aquellas distribuidas hacia el Sur de México. VII. LITERATURA CITADA AITKEN, R.J. 1975. Cementum layers and tooth wear as criteria for ageing roe deer (Capreolus capreolus). The Journal of Zoology 175: 15-28. ARTHUR, W. J. Y A. W. ALLDREDGE. 1980. Seasonal estimates of masses of mule deer fecal pellets and pellets groups. The Journal of Wildlife Management 44: 750-752. BARBOZA, P. S. Y R. T. BOWYER. 2000. Sexual segregation in dimorphic deer: a new gastrocentric hypothesis. Journal of Mammalogy 81: 473-489. BEIER, P. 1987. Sex differences in quality of white-tailed deer diets. Journal of Mammalogy 68: 323-329. BROKX, P. A. 1972. Age determination of Venezuelan white-tailed deer. The Journal of Wildlife Management 36:1060-1067. CAUGHLEY, G. Y A. R. E. SINCLAIR 1994. Wildlife ecology and management. Blackwell Science. USA. CLUTTON-BROCK, T. H. Y M. E. LONERGAN. 1994. Culling regimes and sex ratio biases in highland red deer. The Journal of Applied Ecology 31: 521-527. CONOVER, W. J. Y R. L. IMAN. 1981. Rank transformations as a bridge between parametric and non parametric statistics. The American Statistician 35: 124-129. 102 COULSON, T., E. A. CATCHPOLE, S. D. ALBON, B. J. T. MORGAN, J. M. PEMBERTON, T. H. CLUTTON-BROCK, M. J. CRAWLEY Y B. T. GRENFELL. 2001. Age, sex, density, winter weather, and population crashes in Soay sheep. Science 292: 1528-1531. EQUIHUA, M. 1990. Fuzzy clustering of ecological data. Journal of Ecology 78: 519-534. --------. 2001. Fuzzy clustering tool. Versión 2.0. Instituto de Ecología, A.C. EZCURRA, E. Y S. GALLINA. 1981. Biology and populations dynamics of white-tailed deer in northwestern Mexico. Págs. 77-108 in P. F. Ffolliot y S. Gallina, editores. Deer biology, habitat requirements, and management in western North America. Instituto de Ecologia, A. C. México. GALINDO-LEAL, C. Y M. WEBER. 1998. El Venado de la Sierra Madre Occidental. Ecología, manejo y conservación. EDICUSA-CONABIO. México D.F. GEIST, V. 1998. Deer of the world. Their evolution, behaviour, and ecology. Stackpole Books. Pennsylvania. GILBERT, F. F. 1966. Aging white-tailed deer by annuli in the cementum of the first incisor. The Journal of Wildlife Management 30: 200-203. --------. Y S. L. STOLT. 1970. Variability in ageing Maine white-tailed deer by tooth characteristics. The Journal of Wildlife Management 34: 532-535. HEWINSON, A. J. M., J. P. VINCENT, J. M. ANGIBAULT, D. DELORME, G. VAN LAERE Y J. M. GAILLAR. 1999. Tests of estimation of age from tooth wear on roe deer of known age: variation within and among populations. Canadian Journal of Zoology 77: 58-67. HUBER, S. U. BRUNS Y W. ARNOLD. 2002. Sex determination of red deer using polymerase chain reaction of DNA from feces. Wildlife Society Bulletin 30: 208-212. KOHN, M. H. Y R. K. WAYNE. 1997. Facts from feces revisited. Trends in Ecology and Evolution 12: 223-227. KUNZ, T. H., C. WEMMER Y V. HAYSSEN. 1996. Appendix 5: Sex, age, and reproductive condition of mammals. Págs. 279-290 in D. E. Wilson, F. Russell-Cole, J. D. Nichols, R, Rudran y M. S. Foster, editors. Measuring and monitoring biological diversity, Standard methods for mammals. Smithsonian Institution. USA. LANCIA, R. A., J. D. NICHOLS Y K. H. POLLOCK. 1996. Estimating the number of animals in wildlife populations. Págs. 215-253 in T. A. Bookhout, editor. Research and Management 103 Techniques for Wildlife and Habitats. Fifth edition. The Wildlife Society. Bethesda, MD., USA. LINDSAY, A. R. Y J. L. BELANT. 2007. A simple and improved PCR-based technique for whitetailed deer (Odocoileus virginianus) sex identification. Conservation Genetics. DOI 10.1007/s10592-007-9326-y. LÓPEZ-TÉLLEZ, M. C. 2006. Análisis de la densidad poblacional y caracterización del hábitat del venado cola blanca (Odocoileus virginianus mexicanus) en cuatro localidades del Municipio de Jolalpan, Puebla. Tesis de maestría. UNAM, Facultad de ciencias. México. --------, S. MANDUJANO Y G. YÁNES. 2007. Evaluación poblacional del venado cola blanca en un bosque tropical seco de la Mixteca Poblana. Acta Zoológica Mexicana 23: 1-16. LUNDERVOLD, M., R. LANGVATN Y E. J. MILNER-GULLAND. 2003. A comparison of age estimation methods for the saiga antelope Saiga tarica. Wildlife Biology 9: 219-227. MACCRACKEN, J. G. Y VAN BALLENBERGHE. 1987. Age-and sex-related differences in fecal pellet dimensions of moose. The Journal of Wildlife Management 51: 360-364. MANLY, B. F. J. 1994. Multivariate statistical methods: A primer. Second edition. Chapman & Hall, UK. MARTÍNEZ-ROMERO, L. E. 2004. Determinación de fechas de aprovechamiento del venado cola blanca (Odocoileus virginianus) a través de hormonas sexuales y comportamiento. Tesis de Maestría. Instituto de Ecología, A.C. México. MCCULLOUGH, D. R. 1982. White-tailed deer pellet-groups weights. The Journal of Wildlife Management 46: 829-832. --------, D. H. Hirth y S. J. Newhouse. 1989. Resource partitioning between sexes in white-tailed deer. The Journal of Wildlife Management 53: 277-283. OJASTI, J. 2000. Manejo de fauna silvestre neotropical. F. Dallmeier, editor. SIMAB Series No. 5. Smithsonian Institution/MAB Program, Washington, D.C. R DEVELOPMENT CORE TEAM. 2006. R: A language and environment for statistical computing. R Foundation for Statistical Computing, Vienna, Austria. ISBN 3-900051-07-0, URL http://www.R-project.org. RASBAND, W.S. 1997-2007. ImageJ, U. S. National Institutes of Health, Bethesda, Maryland, USA, http://rsb.info.nih.gov/ij/. Java 1.5.0_09 104 ROGERS, L. L. 1987. Seasonal changes in defecation rates of free-ranging white-tailed deer. The Journal of Wildlife Management 51: 330-333. ROLANDSEN, CH. M., E. J. SOLBERG, M. HEIM, F. HOLMSTRØM, M. I. SOLEM Y B. SAETHER. 2007. Accuracy and repeatability of moose (Alces alces) age as estimated from dental cement layers. European Journal of Wildlife Research DOI 10.1007/s10344-007-0100-8. ROMERO, S. Y. L. E. MARTÍNEZ-ROMERO. 1998. Programa de rescate del venado cola blanca (Odocoileus virginianus) en el parque estatal General Lázaro Cárdenas del Río “Flor del Bosque”, en Puebla. Memorias VI simposio de venados en México, UNAM, Xalapa, Ver. SÁNCHEZ-ROJAS, G., S. GALLINA & M. EQUIHUA. 2004. Pellet morphometry as a tool to distinguish age and sex in the mule deer. Zoo-Biology 23: 139-146. SAUER, P. R. 1984. Physical characteristics. Págs. 73-90 in L. K. Halls (ed.). White tailed deer: Ecology and management. Stackpole Books, Harrisburg, PA, USA. SEMARNAT. 1997. Programa de conservación de la vida silvestre y diversificación productiva en el sector rural 1997-2000. Primera edición. México, D.F. SEVERINGHAUS, C. W. 1949. Tooth development and wear as criteria of age in white-tailed deer. The Journal of Wildlife Management 13:195-216. STEWARDT, K. M., T. E. FULBRIGHT, D. L. DRAWE Y R. T. BOWYER. 2003. Sexual Segregation in White-Tailed Deer: Responses to Habitat Manipulations. Wildlife Society Bulletin 31: 1210-1217. VILLARREAL-ESPINO, O. 2002. El grand-slam de venado cola blanca mexicano, una alternativa sostenible. Archivos de Zootecnia 51: 183-193. VILLARREAL-ESPINO, O. Y O. BARROS. 2000. El aprovechamiento sustentable de venado cola mexicano (Odocoileus virginianus mexicanus), una alternativa para el uso del suelo en la región de la Mixteca Poblana. VII Simposio sobre venados en México. Facultad de Medicina Veterinaria y Zootecnia, UNAM, México, D.F. WEMMER, C., T. H. KUNZ, G. LUNDIE-JENKINS Y W. J. MCSHEA. 1996. Mammalian sign. Págs. 157-176 in D. E. Wilson, F. Russell-Cole, J. D. Nichols, R, Rudran y M. S. Foster, editors. Measuring and monitoring biological diversity, Standard methods for mammals. Smithsonian Institution. USA. 105 DISCUSIÓN GENERAL 106 El venado cola blanca es la especie de fauna silvestre mexicana más importante desde el punto de vista económico y cinegético, por tanto, para su adecuado manejo el conocimiento de la proporción de sexos y estructura de edades de sus poblaciones resulta tan importante como el de su densidad (Villarreal 1996). Este estudio evaluó dos metodologías comúnmente usadas para estimar la densidad y la estructura poblacional del venado cola blanca: el conteo de grupos fecales y el análisis morfométrico de pellets, respectivamente. Esto con el fin de determinar si son adecuadas para ser usadas con la subespecie O. virginianus mexicanus en un área de la Mixteca Poblana y de ser posible hacer recomendaciones para mejorar su aplicación. Este es el primer trabajo que compara los métodos de transecto de línea y parcelas para estimar la densidad de individuos con base en el registro de grupos fecales. Aunque muchas de las comparaciones hechas aplicando estos métodos a observaciones directas pueden extenderse a los rastros, mi trabajo refuerza la idea que el transecto de línea produce estimaciones más precisas (Bollinger et al. 1988, Ruette et al. 2003, Smart et al. 2004) y que podría desempeñarse mejor que las parcelas en sitios con baja densidad de venados (Marques et al. 2001). En el siguiente cuadro resumo algunas ventajas y desventajas ofrecidas por los métodos de estimación de densidad evaluados. El transecto de línea ofrece más ventajas comparativamente que el transecto de parcelas. Con el transecto de línea no hay problema en decidir si un grupo debe registrarse, mientras que con las parcelas se debe estar seguro si un grupo está o no dentro de la unidad (Neff 1968). El transecto de línea produce estimaciones más precisas y por tanto tiene mayor poder para detectar cambios en la población. La necesidad de ir dos veces a campo hace que con FAR-P se altere más la vegetación, lo que puede ser problemático pues probablemente el venado evita áreas con evidencias de actividad humana (Ezcurra y Gallina 1981). Por el contrario, la dificultad para conocer la edad de los grupos fecales encontrados, hace 107 que cualquier método aplicado bajo la técnica FSC sea menos conveniente que FAR en donde el tiempo de depósito se puede controlar con exactitud. Cuadro 1. Ventajas y desventajas de los métodos de conteo de grupos fecales evaluados. Criterios Tiempo empleado en el montaje del esquema de muestreo Tiempo de revisión Procesamiento y análisis de datos Registro de grupos “dudosos” Precisión de la estimación Poder estadístico Alteración de la vegetación Dificultad para datar grupos “+” = ventaja; “-” = desventaja Métodos Transecto de Transecto de parcelas línea + + + + + + FAR FSC + + + - El poder estadístico de un método definido como la capacidad para detectar diferencias entre dos estimaciones cuando realmente las hay (Thompson et al. 1998), está relacionado con la precisión del mismo. En un monitoreo poblacional es probablemente más importante contar con estimaciones precisas que exactas, pues suele ganarse precisión a expensas de aplicar un método sesgado (Bollinger et al. 1988, Plumptre 2000). Considerando la importancia de monitorear las poblaciones de venado objeto de aprovechamiento, sugiero atender principalmente al criterio de precisión y aplicar el método de transecto de línea, adelantando previamente un experimento para estimar el tiempo de deterioro pues éste método sólo puede ser aplicado bajo la técnica FSC. Una posible opción para un diseño de muestreo eficiente es estratificar el área de acuerdo a la abundancia relativa de la especie, seleccionar cuadrantes de un km2 que son estudiados intensamente empleando dos transectos de 790 m de longitud en cada uno; el número de cuadrantes estudiados debe ser proporcional al área del estrato en la zona de estudio (Fig. 1). 108 Figura 1. Representaación gráficaa del diseño de muestreoo recomendaddo. Las áreaas sombreadaas de c represeentan estratoss que varían en la abunddancia relativva de venadoo. distinto color d un método sólo puedee ser evaluadda comparanndo con el taamaño real de la Laa exactitud de poblaciónn (Bollinger et al. 1988). Los trabajoos que evalúaan exactitudd con datos de d campo lo hacen connsiderando que q el tamañño poblacionnal estimado tras un muestreo continuuo y exhausttivo puede connsiderarse muy m cercano al tamaño reeal (Hounsom me et al. 20005). En zonaas tropicales de México donde d no exiisten lugaress con muestreos a largo plazo como para tener un u estimado similar all tamaño pob blacional, y tampoco t es posible p dem marcar un área y censar laa población existente,, la construccción de moddelos de simuulación puedde ser una heerramienta para p evaluar la exactitudd de métodoss de estimaciión poblacioonal. Los passos propuestoos para el modelo seríann: 1) especificaar área de esstudio, 2) gennerar una pooblación de venados, v esppecificando abundancia, a reglas de movimiento o de los indivviduos y regglas de depossición de loss grupos fecaales, 3) generar el d muestreo, 4) conducirr el muestreoo y 5) calculaar estimadoss de densidadd y su medidda de sistema de precisiónn. En una sim mulación estoos pasos no están e definiddos tan marccadamente, pero p visualizzarlos de esta manera m buscaa facilitar el diseño d y orgganización deel modelo. El E desempeño del modeloo no sólo depeenderá de la programacióón sino de laa información biológica utilizada, enn esta medidaa, se deben tenner datos sob bre área de acción a y patrrones de despplazamiento del venado cola blanca,, tipo de distribbución espaccial de los gruupos fecaless, tasa de deffecación del venado, entre otros. No obstante, el modelo es e sólo una posible p herraamienta, el manejador m deebe ayudarsee del 109 conocimiento del hábitat en el área de estudio para generar mapas de hábitat en los que el balance entre esquemas de muestreo, costos logísticos y sesgo del muestreo puedan ser evaluados directamente (Gibbs et al. 1999). Para mejorar las estimaciones producidas por los métodos evaluados todavía son varios los aspectos sobre los que debe estudiarse, a continuación sugiero algunos puntos interesantes: 1. Los esquemas de muestreo completamente aleatorios son los recomendados para asegurar la representatividad del área de estudio; sin embargo, éstos producen tasas de encuentro demasiado bajas que restringe el poder para detectar tendencias poblacionales (Gibbs et al. 1999). Esto puede ser superado estratificando de acuerdo a los tipos de hábitats frecuentemente usados por la especie (Thompson et al. 1998) o con base en el conocimiento del investigador. Esto último puede producir resultados engañosos pues si el sitio elegido corresponde a uno de alta densidad y la población sufre ciclos naturales, el conteo inicial puede coincidir con un pico del ciclo y los descensos detectados posteriormente serán resultado de artefactos del procedimiento de muestreo más que de tendencias poblacionales verdaderas (Gibbs et al. 1999). La cacería también puede tener efectos sobre los movimientos y el uso del hábitat del venado haciéndolo moverse hacia coberturas que le ofrezcan mayor protección (Swenson 1982, Root et al. 1988), haciendo que el cambio detectado no necesariamente refleje una disminución en el tamaño poblacional. Comparar el desempeño de esquemas de muestreo permanentes y temporales entre años podría dar luces sobre el efecto de estos aspectos y la forma de superarlos. 2. No es claro si el conteo de grupos fecales utilizado como índice de abundancia podría funcionar mejor para monitorear la población que la densidad de individuos conseguida a partir de la aplicación de factores de conversión. La utilización del método como índice es factible porque la relación con el número de animales es positiva y aproximadamente lineal (Eberhardt y 110 Van Etten 1956, Forsyth et al. 2007). Usar el índice sería apropiado porque se evita agregar dos fuentes de variación a la estimación, los coeficientes de variación de los factores de conversión (Plumptre 2000). Por otro lado, utilizar la estimación de densidad de individuos resulta más conveniente si hay cambios en los factores de conversión sin que en realidad exista un cambio en la población (Barnes et al. 1997). 3. En especies donde la extracción de individuos es selectiva por sexo y edad, una cosecha sesgada hacia cualquier sexo podría tener efectos adversos sobre la población, especialmente cuando las tasas de cosecha son altas y las densidades son bajas (Ginsberg y Milner-Gulland 1994, Schliebe et al. 1999). Por tanto, contar con estimaciones exactas parece más importante que obtener estimaciones precisas. De acuerdo a los resultados de mi estudio el análisis morfométrico de pellets logró identificar los grupos fecales pertenecientes a los machos más grandes de la población. En situaciones de manejo donde los machos son el foco de interés, esta estimación podría ser suficiente; sin embargo, muchos estudios reconocen la importancia de conocer el resto de la estructura poblacional (Clutton-Brock y Lonergan 1994). Es importante entender cuál es el efecto sobre la dinámica poblacional de extraer determinado número de individuos a partir de una estimación errónea de la estructura poblacional, este efecto será más evidente en poblaciones con bajas densidades. 4. Es deseable que a partir de los muestreos de grupos fecales empleados para estimar densidad de venados se conozca la estructura poblacional. Con un método de muestreo definido y teniendo certeza que es posible estimar la estructura de edades y sexos a partir de heces, a partir del análisis morfométrico de pellets, la cuantificación de niveles hormonales (Martínez-Romero 2004) o la extracción de DNA (Huber et al. 2002), sería interesante probar la hipótesis nula que las estimaciones de la estructura poblacional no diferirán significativamente al aplicar diferentes diseños de muestreo de grupos fecales. 111 Es evidente que para las condiciones de una selva baja aún son muchos los aspectos metodológicos que faltan abordar, este estudio buscó aportar resultados concretos para avanzar en esa dirección. LITERATURA CITADA BARNES, B. ASAMOAH-BOATENG, J. NAADA MAJAM Y J. AGYEI-OHEMENG. 1997. Rainfall and the population dynamics of elephant dung-piles in the forest of sourthen Ghana. African Journal of Ecology 35: 39-52. BOLLINGER, E. K., T. A. GAVIN Y D. MCINTYRE. 1988. Comparison of transects and circular-plots for estimating bobolink densities. The Journal of Wildlife Management 52: 777-786. CLUTTON-BROCK, T. H. Y M. E. LONERGAN. 1994. Culling regimes and sex ratio biases in highland red deer. The Journal of Applied Ecology 31: 521-527. EBERHARDT, L. Y R. C. VAN ETTEN. 1956. Evaluation of the pellet group count as a deer census method. The Journal of Wildlife Management 20: 70-74. EZCURRA, E. Y S. GALLINA. 1981. Biology and populations dynamics of white-tailed deer in northwestern Mexico. Págs. 77-108 in P. F. Ffolliot y S. Gallina, editores. Deer biology, habitat requirements, and management in western North America. Instituto de Ecologia, A. C. México. FORSYTH, D. M., R. J. BARKER, G. MORRIS Y M. P. SCROGGIE. 2007. Modeling the relationship between fecal pellet indices and deer density. The Journal of Wildlife Management 71: 964-970. GIBBS, J. P., H. L. SNELL Y CH. E. CAUSTON. 1999. Effective monitoring for adaptative wildlife management: lessons from the Galápagos Islands. The Journal of Wildlife Management 63: 1055-1065. GINSBERG, J. R. Y E. J. MILNER-GULLAND. 1994. Sex-biased harvesting and population dynamics in ungulates: implications for conservation and sustainable use. Conservation Biology 8: 157-166. 112 HOUNSOME, T. D., R. P. YOUNG, J. DAVISON, R. W. YARNELL, I. D. TREWBY, B. T. GARNETT, R. J. DELAHAY AND G. J. WILSON. 2005. An evaluation of distance sampling to estimate badger (Meles meles) abundance. The Journal of Zoology 266: 81-87. HUBER, S. U. BRUNS Y W. ARNOLD. 2002. Sex determination of red deer using polymerase chain reaction of DNA from feces. Wildlife Society Bulletin 30: 208-212. MARQUES, F., S. T. BUCKLAND, D. GOFFIN, C. E. DIXON, D. L. BORCHERS, B. A. MAYLE Y A. J. PEACE. 2001. Estimating deer abundance from line transect surveys of dung: sika deer in sourthern Scotland. The Journal of Applied Ecology 38: 34-363. MARTÍNEZ-ROMERO, L. E. 2004. Determinación de fechas de aprovechamiento del venado cola blanca (Odocoileus virginianus) a través de hormonas sexuales y comportamiento. Tesis de Maestría. Instituto de Ecología, A.C. México. NEFF, D. J. 1968. The pellet-group count technique for big game trenes, census, and distribution: a Review. The Journal of Wildlife Management 32: 597-614. PLUMPTRE, A. 2000. Monitoring mammal populations with line transect techniques in African forest. The Journal of Applied Ecology 37: 356-368. ROOT, B. B., E. K. FRITZELL Y N. F. GIESSMAN. 1988. Effects of intensive hunting on white-tailed deer movement. Wildlife Society Bulletin 16: 145-151. RUETTE, S., P. STAHL Y M. ALBARET. 2003. Applying distance-sampling methods to spotlight counts of red foxes. The Journal of Applied Ecology 40: 32-43. SCHLIEBE, S. L., T. J. EVANS, A. S. FISCHBACH Y M. A. CRONIN. 1999. Using genetics to verify sex of harvested polar bears: management implications. Wildlife Society Bulletin 27: 592597. SMART, J., A. I. WARD Y P. WHITE. 2004. Monitoring woodland deer populations in the UK: an imprecise science. Mammal Review 34: 99-114. SWENSON, J. E. 1982. Effects of hunting on habitat use by mule deer on mixed-grass prairie in Montana. Wildlife Society Bulletin 10: 115-120. 113 THOMPSON, W. L., G. C. WHITE Y CH. GOWAN. 1998. Monitoring vertebrate populations. Academic Press. USA. VILLARREAL, J. 1996. Importancia de la relación machos:hembras en la producción de trofeos de venado cola blanca (Odocoileus virginianus). Memorias V simposio de venados en México. UNAM, Quintana Roo. 114 ANEXO 1. Representación gráfica de la variación en las medidas morfométricas de los pellets durante los tres periodos de muestreo para los animales focales. El color de la caja indica el periodo de muestreo al que pertenecen, gris: periodo 1, blanco: periodo 2, negro: periodo 3. La “n” indica el número de grupos fecales totales para cada animal. Venado A (Hembra 1 año), n = 12 115 116 Venado B (Hembra 3 años), n = 34 Grupo Fecal 117 Venado C (Hembra 4 años), n = 25 Grupo Fecal 118 Venado D (Macho 2 años), n = 14 Grupo Fecal 119 Venado E (Macho 4 años), n = 11. No existen datos para el tercer periodo de muestreo, pues el animal murió antes de ello. Grupo Fecal 120 Venado F (Macho 5 años), n = 13 Grup o Fe ca l 121 Venado G (Macho 6 años), n = 22 Grup o Fe ca l 122 Venado H (Macho 6 años), n = 15 Grup o Fe cal 123 ANEXO 2. Promedio y desviación estándar de las variables morfométricas de los pellets para las hembras (arriba) y los machos (abajo), durante la época seca de 2006. Eje mayor Eje menor Proporción Volumen (mm3) (mm) (mm) L/A Prom. D.E. Prom. D.E. Prom. D.E. Prom. D.E. Prom. D.E. 0* 49.9 6.5 9.1 1.0 7.0 0.3 1.3 0.1 1857.4 303.5 1 63.9 15.2 11.1 1.8 7.3 1.0 1.5 0.3 2545.3 1070.6 2 65.3 11.1 10.7 1.5 7.8 0.7 1.4 0.2 2729.9 653.3 3 70.2 15.2 10.7 1.5 8.3 0.9 1.3 0.2 3.160.3 995.2 4 68.4 12.4 11.3 1.8 7.7 0.8 1.5 0.3 2842.8 730.6 5 64.4 9.5 10.3 1.2 7.9 0.6 1.3 0.2 2736.5 563.2 14** 63.7 12.5 9.6 1.1 8.4 0.8 1.1 0.1 2903.0 827.6 *En realidad el sexo de esta muestra de cría se desconoce, se colocaron sus datos acá para propósitos comparativos. **El dato de esta hembra se dejó intencionalmente para compararlo con los datos de las demás. Edad Edad 1 2 3 4 5 6 Área (mm2) Área (mm2) Prom. 62.6 68.5 64.6 71.3 107.4 99.2 D.E. 14.5 14.0 13.5 17.7 20.9 20.3 Eje mayor (mm) Prom. D.E. 10.3 1.5 11.1 1.5 11.0 1.6 11.2 1.6 14.7 1.7 13.1 1.7 Eje menor (mm) Prom. D.E. 7.7 0.8 7.9 0.9 7.4 0.9 8.0 1.1 9.3 1.1 9.6 1.0 124 Proporción L/A Prom. D.E. 1.4 0.2 1.4 0.2 1.5 0.2 1.4 0.2 1.6 0.2 1.4 0.2 Volumen (mm3) Prom. 2609.1 2920.8 2603.6 3128.5 5416.3 5171.9 D.E. 894.6 913.0 835.9 1246.0 1652.8 1532.5