Replicación del ADN
Anuncio

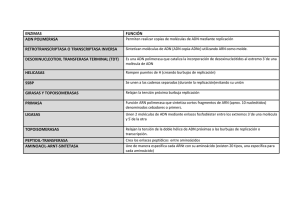
Replicación del ADN La división celular requiere de la duplicación del material genético mitosis meiosis mitosis Mecanismo general La misma estructura del ADN sugirió un mecanismo de replicación de la información ◦ Cada hebra sirve como molde para replicar la complementaria Propiedades Semiconservativa: cada nueva molécula esta formada por una hebra parental y una recién sintetizada ◦ Experimentos de Meselson y Stahl Bidireccional: Se da hacia ambos lados del sitio de inicio denominado origen de replicación A cada lado de la burbuja de replicación se forma una horquilla de replicación Dirección de la síntesis: 5’ 3’ Semidiscontinua: Una de las hebras no puede ser sintetizada de continuo ◦ Consecuencia de la direccionalidad Replicación en procariotas Mecanismo Inicio ◦ Reconocimiento de orígenes de replicación. ◦ Separación de hebras. ◦ Posicionamiento de maquinaria transcripcional. Elongación ◦ Crecimiento bidireccional de las horquillas de replicación. ◦ Replicación semiconservativa, semidiscontinua, coordinada. Terminación ◦ Reconocimiento de señales de terminación. ◦ Desensamble de replisomas. ADN polimerasas: ◦ ◦ ◦ ◦ Pol I Pol II Pol III (replicasa) Pol IV y V Necesitan 3’ OH libre Maquinaria enzimática ADN polimerasas: Síntesis de ADN Primasas: Generación 3’OH libres Ligasas: Unión los fragmentos de Okazaki Helicasas: Separación de hebras Topoisomerasas: Mantenimiento del grado de superenrollamiento SSBs: Mantenimiento de simples hebras Inicio Reconocimiento del origen y apertura de las hebras Elongación Primasa: ◦ Sintetiza fragmentos de ARN (cebadores) que provean los 3’ OH libres ◦ Puede comenzar sin necesidad de cebador Replisoma Terminación Replicación en eucariotas Los mecanismos son similares Más de un origen de replicación por cromosoma Es más complejo Proteins RPA PCNA RFC Pol α/primase Pol δ / ε FENI DNA2 DNA ligase I Mcm2-7 Functions Single-stranded DNA binding; stimulates DNA polymerases; facilitates helicase loading Stimulates DNA polymerases and RFC ATPase DNA-dependent ATPase; primer-template DNA binding; stimulates DNA polymerases; PCNA loading RNA-DNA primer synthesis DNA polymerase; 3'-5' exonuclease Nuclease for removal of DNA/RNA primers Nuclease for removal of DNA/RNA primers Ligation of DNA DNA helicase; primosome assembly, licensing factor ADN polimerasas Ocurre durante la fase S Una única vez por ciclo celular Horquilla eucariota Telómeros Son secuencias repetidas que se encuentran en los extremos de los cromosomas lineales Entre otras funciones resuelven los problemas de replicar este tipo de cromosomas Telomerasa Enzima capaz de resolver el problema de acortamiento de los extremos Ribonucleoproteína Mantenimiento de la información hereditaria Errores durante la replicación: ◦ Las ADN polimerasas no son 100% fieles ◦ Los errores son reparados en un alto porcentaje de las veces ◦ Cuando los errores escapan los mecanismos de reparación ocurren cambios en la secuencia del ADN: Mutaciones Las mutaciones también pueden ocurrir por fenómenos post replicación (mutágenos físicos, químicos, etc.) Mecanismos de reparación Las propias replicasas son capaces de reparar sus errores durante la elongación: ◦ actividad correctora de prueba (proofreading) ◦ Implica una actividad exonucleasa 3’ 5’ Mecanismos de reparación Replicación de ADN in-vitro: PCR Permite la amplificación de un fragmento de ADN de interés Algunas aplicaciones: ◦ ◦ ◦ ◦ ◦ ◦ Clonado acelular de moléculas de ADN Detección de secuencias sin purificación previa Análisis de expresión génica Secuenciación de ácidos nucleicos Amplificación de ADN para su posterior clonación celular Aplicaciones en medicina: Diagnostico de enfermedades hereditarias/infecciosas Diagnóstico parental (amniocentesis, vellosidades coriónicas) Tipado de tejidos para transplantes Detección de células tumorales Estudios de asociación genotipo-fenotipo ◦ Técnicas forenses: huellas genéticas (Identificación de polimorfismos) Identificación individual Tests de paternidad ◦ Filogenia ◦ Análisis de genética poblacional Reacción de replicación in-vitro: Molde ADN polimerasa: Taq polimerasa (termoestable) Cebadores: ◦ 3’ OH libre ◦ Definen la región a amplificar dNTPs (A, C, G, T) Condiciones para el funcionamiento de la enzima: ◦ Buffer ◦ Mg++ (cofactor de la enzima) Procedimiento Desnaturalización del ADN (94ºC) Agregado e hibridación de los cebadores (50ºC65ºC dependiendo de los cebadores) Elongación (72ºC) Repetición de estas etapas (25-35 ciclos) Luego de terminados los ciclos se obtienen millones de moléculas de la región blanco La hace una técnica extremadamente sensible ◦ Ventaja: se puede amplificar ADN partiendo de muy poco material ◦ Desventaja: Contaminaciones Variantes del método rt- PCR: ◦ Se usa una transcriptasa reversa para pasar una muestra de ARN a ADN obteniendose ADN copia (ADNc) ◦ Se realiza un PCR para amplificar el ADNc de interés ◦ Estudios de expresión génica ◦ Clonado de genes eucariotas (eliminación de intrones) PCR cuantitativo (real time PCR, qPCR): ◦ Se diferencia en que en cada ciclo de amplificación se cuantifica la cantidad de ADN obtenida ◦ Permite inferir la cantidad de moléculas de molde que existía originalmente en la muestra: Cuantificación de la expresión génica Cuantificación de microorganismos Secuenciación de ADN Método de Sanger (nobel en 1980) Utiliza dideoxinucleotidos (ddNTPs) para terminar una reacción de síntesis de ADN invitro Realizando 4 reacciones independientes (una para cada base) se puede inferir la secuencia original Secuenciación automática Sigue el mismo principio A diferencia del método anterior cada ddNTP se marca con una molecula fluorescente diferente Esto permite realizar una unica reaccion en la cual estan presentes los 4 ddNTPs marcados Los fragmentos obtenidos se separan por electroforesis capilar La detección se realiza en un punto fijo al final de la corrida Secuenciación de genomas Cada reacción de secuencia es capaz de leer unas 500 pb Como se obtuvo la secuencia continua del conjunto de los cromosomas humanos? Cada cromosoma tiene en promedio 150Mb (genoma completo 109) Construcción de biblioteca de ADN genómico fragmentado al azar Lectura de secuencias individuales Las secuencias individuales son solapadas y ensambladas (contigs) Para asegurarse de que todas las secuencias estén representadas se leen unas 10 veces la cantidad de bases del genoma La velocidad de producción de las secuencias ha ido en aumento. Recientemente se dio un salto en este sentido con el desarrollo de los secuenciadores de “próxima generación” No usan terminación de cadena Se coloca una base cada vez y se detecta cual fue incorporada a cada molécula que se esta secuenciando Producen en una única reacción de secuencia millones de lecturas de fragmentos diferentes (paralelización) 109 1011 bases por corrida (menos de 1 día) De esta forma se secuencio el genoma entero de Watson en menos de 1 mes a un “bajo” costo