1 ESPERMATOGÉNESIS Y OOGÉNESIS DE LA CUCHA VERDE
Anuncio

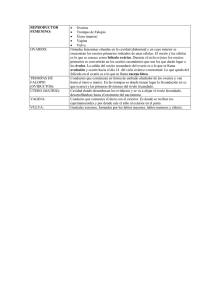
ESPERMATOGÉNESIS Y OOGÉNESIS DE LA CUCHA VERDE AMARILLA (Hemiancistrus subviridis) CAPTURADA EN INÍRIDA (GUAINÍA) PAOLA ALEXANDRA MORENO NÚÑEZ Aspirante al título de Magíster en Estudios Amazónicos de la Sede Amazonia de la Universidad Nacional de Colombia Director MIGUEL ÁNGEL LANDINES PARRA, Ph. D. Profesor Facultad de Medicina Veterinaria y de Zootecnia Universidad Nacional de Colombia Trabajo presentado para la obtención del título de Magister en Estudios Amazónicos Línea Biodiversidad y Conservación MAESTRÍA EN ESTUDIOS AMAZÓNICOS UNIVERSIDAD NACIONAL DE COLOMBIA SEDE AMAZONIA 1 TABLA DE CONTENIDO 1. INTRODUCCIÓN…………………………………………………………………………………... 2. JUSTIFICCACIÓN…………………………………………………………………………………. 3. MARCO TEÓRICO………………………………………………………………………………… 3.1.1. Peces Ornamentales………………………………………………………. 3.1.2. Loricarridae…………………………………………………………………. 3.1.3. Hemiancistrus subviridis…………………………………………………. 3.1.4. Desarrollo Reproductivo en Machos…………………………………… 3.1.4.1. Morfología Testicular………………………………………… 3.1.4.2. Espermatogénesis……………………………………………. 3.1.5. Desarrollo Reproductivo en Hembras…………………………………. 3.1.5.1. Morfología Ovárica…………………………………………… 3.1.5.2. Oogénesis……………………………………………………… 4. ANTECEDENTES…………………………………………………………………………………. 5. METODOLOGÍA…………………………………………………………………………………... 5.1. Obtención de los Individuos……………………………………............................... 5.2. Clasificación gonadal……………………………………………………………………. 6. RESULTADOS Y DISCUSIÓN…………………………………………………………………... 6.1. Clasificación gonadal macroscopica y microscopica….……............................. 6.1.1. Machos…………………………………………………………..….……….. 6.1.1.1. Macroscopica………………………………………………….. 6.1.1.2. Microscopica……………………………………..........……… 6.1.1.2.1. Fase Inicio de maduración…………………………... 6.1.1.2.2. Fase de vacío…………………………………………... 6.1.1.2.3. Descripción células de tejido germinativo……….. 6.1.1.2.3.1. Espermatogonias…………………………………. 6.1.1.2.3.2. Espermatocitos……………………………………. 6.1.1.2.3.3. Espermátidas y espermatozoides……………… 6.1.2. Hembras………………………………………………………….………….. 6.1.2.1. Macroscopica……………………………………………… …. 6.1.2.2. Microscopica…………………………………………………... 6.1.2.2.1. Madurando……………………………………………… 6.1.2.2.2. Madura…………………………………………………... 6.1.2.2.3. Desovada……………………………………………….. 6.1.2.2.4. Descripción de células del tejido germinativo…… 6.1.2.2.4.1. Oocitos perinucleorales…………………………. 6.1.2.2.4.2. Oocitos alvéolo cortical………………………….. 6.1.2.2.4.3. Oocitos marudos………………………………….. 7. CONCLUSIONES………………………………………………………………………………….. 8. BIBLIOGRAFIA……………………………………………………………………………………. 2 3 3 5 5 6 6 6 6 8 9 9 9 11 13 13 13 15 15 15 15 15 16 17 19 19 20 21 25 25 26 26 26 27 28 28 29 29 32 33 INTRODUCCIÓN La Orinoquia colombiana cuenta con el 50% de las especies ícticas de agua dulce registradas para Colombia (Lasso et al., 2004) y junto con la región amazónica son los lugares con más pesca ornamental en el país (INPA, 1999; 2000; INCODER, 2004). Dentro de esta zonas, la región de Inírida específicamente, es reconocida como uno de los lugares de mayor importancia en el mercado de peces ornamentales (Ramírez–Gil y Ajiaco–Martínez, 2001) ya que, debido a sus condiciones biogeográficas, cuenta con una vasta red hidrográfica, conformada por ríos, quebradas, caños y lagos cada uno con características ambientales diferentes, que permiten establecer una amplia variedad de nichos ecológicos, que encierran un gran potencial pesquero (Castro, 1994). Hemiancistris subviridis o cucha verde amarilla es una de especie de alto valor comercial, que se captura en la Orinoquia. Pertenece al grupo de las llamadas “cuchas finas”, las cuales son comercializadas con amplia aceptación en los mercados nacional e internacional. Su comercialización es estacional y se realiza principalmente en los primeros meses del año (enero – abril), época durante la cual está sometida a una gran presión de captura, lo que en el mediano o largo plazo podría comprometer drásticamente su sostenibilidad. A pesar de lo anterior, no existen estudios completos referentes a la biología reproductiva de la especie, los cuales serían el punto de partida para la probable implementación de programas de reproducción en cautiverio; destinados al repoblamiento o a la producción controlada. En ambos casos, dichos programas propenderían por el aprovechamiento racional del recurso. Por lo anterior, este trabajo se enfocó en describir los procesos de espermatogénesis y oogénesis de la cucha verde amarilla (Hemiancistrus subviridis) capturada en Inírida (Guainía), determinando las diferencias entre los distintos tipos celulares en la línea germinativa de la cucha verde amarilla (Hemiancistrus subviridis) y estableciendo el estado sexual de los individuos 3 para cada uno de los sexos de la cucha verde amarilla (Hemiancistrus subviridis), aspectos fundamentales para la posible implementación de programas de reproducción bajo condiciones controladas. JUSTIFICACIÓN En Colombia la pesca y comercialización de peces ornamentales se han llevado a cabo por más de 40 años, siendo en su mayoría destinada al mercado internacional. En los últimos años, la mayor parte del volumen de exportación provino de la cuenca del río Orinoco, de la cual se extraen alrededor del 85% del total de peces exportados. Desafortunadamente, dicho volumen es obtenido totalmente del medio natural, siendo los principales lugares de captura y acopio, los municipios de Puerto Gaitán, Inírida, Puerto Carreño, Arauca y Villavicencio. La extracción de los animales del hábitat natural puede inducir significativos deterioros de las poblaciones silvestres, considerando las bajas tasas de supervivencia observadas en la mayoría de las especies explotadas. El recurso genético se ha visto disminuido dramáticamente en los últimos años (INPA, 1999; 2000), con un gran impacto económico y por ende social en las comunidades que viven de este recurso. Muestra de ello es que, en los inicios de la actividad de pesca de peces ornamentales, se observaba un mayor desarrollo alrededor de puertos; actualmente tanto el esfuerzo de pesca como la duración de las faenas han aumentado debido, principalmente al desplazamiento de los pescadores a lugares cada vez más lejanos (Rodríguez, 2005). La falta de conocimientos sobre la biología y la dinámica poblacional de las especies ornamentales en los diferentes hábitats y durante los ciclos estacionales anuales no permite una visión clara sobre la sostenibilidad del recurso. La cría de los peces en cautiverio podría ser una alternativa para disminuir los impactos negativos que tiene su extracción sobre el ecosistema. Para ello es necesario conocer a cabalidad las características ambientales y el desarrollo de 4 gametos, por su estrecha relación con las condiciones requeridas para el cultivo. Es importante mencionar que este tipo de trabajos puede apoyar a entidades gubernamentales encargadas de la legislación ambiental, ya que, a partir del conocimiento básico del comportamiento reproductivo de especies explotadas comercialmente, se podrían elaborar planes de manejo para la explotación racional del recurso. MARCO TEÓRICO Peces ornamentales Los órdenes Siluriformes y Characiformes están registrados por FAO (2000) como los más representativos en la Orinoquía y en la Amazonía. El primero tiene 17 familias y más de 80 especies y el segundo está compuesto por 11 familias, que agrupan más de 100 especies. Hay que resaltar que de las especies registradas como ornamentales en Colombia, el 76,0% proviene de la Orinoquia, el 21,6% es extraído de la zona del Amazonas y el 2,0% restante es capturado en la región del Pacífico, del Magdalena y de la región Atlántica (Ajiaco–Martínez et al., 2001). Hoet (1998) describe a los silúridos como peces de forma alargada, la mayoría de los cuales tiene el cuerpo casi cilíndrico. Todas las aletas son blandas, pero en muchas especies se encuentran aletas de uno a tres radios, duros y osificados y en algunas otras se pueden observar aletas adiposas. Generalmente tienen la piel sin escamas, sin embargo, algunas especies presentan placas o escudos (Werneke et al., 2005). Este orden se distribuye desde Costa Rica hasta el río de La Plata y está presente en todas las cuencas colombianas (Cala, 1990). Dentro del orden Siluriformes se encuentra la familia Loricariidae, a la cual pertenece la especie objeto de estudio. Loricariidae Esta familia está representada por alrededor de 690 especies en 70 géneros (Reis et al., 2003), en aguas neotropicales de América del Sur y parte de 5 América Central (Fowler, 1954). Por su amplia distribución está sujeta a la pesca predatoria y a los efectos de la polución urbana, agrícola e industrial. Los individuos pertenecientes a esta familia se caracterizan por presentar placas óseas que cubren su cuerpo, con una boca ventral y labios bien desarrollados (Nelson, 1994) y específicamente el género Hemiancistrus se caracteriza por la presencia de manchas en el cuerpo (Werneke et al., 2005). Estos peces generalmente habitan cerca o en el fondo de ríos y lagunas, que constituyen su medio predilecto, y en horas nocturnas prefieren capturar a sus presas como peces y anfibios (Hoet, 1998). También se caracterizan por alimentarse de algas que cubren algunas superficies, ya sea del medio natural o en cautiverio (Suzuki et al., 2000). Son peces que se caracterizan por tener cuidado parental y tener varias estrategias reproductivas, incluso en ocasiones, los padres transportan los huevos y las larvas adheridos a la parte ventral de la cabeza (Agostinho et al., 1991). Hemiancistrus subviridis (Werneke et al., 2005) Familia: Loricaridae Subfamilia: Hypostominae Tribu: Ancistrini (Ambruster, 2004) Genero Hemiancistrus Especie: H. subviridis Especie que en promedio tiene una longitud estándar de 14,9 cm se caracteriza por presentar un color verde oliva y especialmente por presentar puntos de color amarillo – oro ubicados en la parte anterior dorsal. Se alimenta básicamente de material orgánico en el que se han identificado principalmente plantas vasculares, sin embargo, también se han observado larvas de insectos y algas filamentosas. Es una especie que se encuentra asociada a ambientes de aguas con fondos rocosos y con corrientes. Se ha reportado en los ríos: Orinoco, Iguapo, Ventuari, Casiquiare y Siapa. 6 Desarrollo Reproductivo en Machos Morfología testicular A pesar de que desde hace cerca de 50 años se ha intentado describir la estructura testicular de los peces teleósteos (Sneed y Clemens, 1963; Billard, 1969), aun existe controversia sobre la clasificación real que se debe adoptar para el estudio morfológico de los testículos y en general del sistema reproductivo de los machos de peces. En primera instancia, varios autores han descrito que los peces pueden tener dos tipos de testículo: lobular y tubular (Grier, 1980; 1981; Billard, 1986). En el primer tipo, la espermatogénesis se va desarrollando en cistos separados y los espermatozoides son liberados en un lumen que se une a un ducto eferente, ubicado en la parte final del testículo (Billard, 1986). En el segundo, el túbulo seminífero no tiene lumen y en su periferia apical se encuentran las espermatogonias, que dan origen a los cistos en proceso de división celular, para originar los espermatozoides que, finalmente, serán liberados a un ducto eferente, ubicado en la parte final del túbulo (Billard, 1986). Adicionalmente, se caracteriza por la presencia de redes que forman curvas con grandes ramificaciones, las cuales generalmente se presentan en los peces clasificados en las taxa más bajas (Grier y Uribe, 2009). Posteriormente, Grier (1993) y Parenti y Grier (2004), coincidieron en una nueva organización morfológica que dio como resultado que, según la distribución de las espermatogonias los peces presentaban testículos espermatogoniales irrestrictos y restrictos. Espermatogonial irrestricto: En este tipo, los compartimentos germinativos se extienden hacía la periferia del testículo, formando un lóbulo. Se caracteriza por la presencia de espermatogonias a lo largo del lóbulo. Durante la espermiación, los espermatozoides son liberados en el lumen del lóbulo, para finalmente llegar al ducto eferente. 7 Espermatogonial restricto: Este tipo de testículo es similar al anterior, ya que los compartimentos germinativos se extienden hacia la periferia del testículo, pero las espermatogonias nunca se distribuyen a lo largo del lóbulo, encontrándose restrictas a la parte distal terminal del mismo. En el proceso de la espermatogénesis el cisto migra hacia el ducto eferente y las células germinativas maduran dentro. Por otro lado, en muchos casos es frecuente encontrar estructuras anexas a los testículos, con participación directa en el proceso reproductivo, tales como las vesículas seminíferas, comúnmente encontradas en los silúridos (Loir et al., 1989; Legendre et al., 1996; Batlouni et al., 2005; Mazzoldi et al., 2007). Espermatogénesis. La espermatogénesis es una secuencia de cambios morfológicos y fisiológicos de células germinativas que parten de una espermatogonia diploide y dan origen a cuatro espermatozoides haploides (Hess y Fraca 2007; Grier y Uribe 2009 y Schulz et al., 2009). En peces, este proceso de división celular ocurre en cistos, que son formados cuando una espermatogonia es rodeada por las proyecciones del citoplasma de una o dos células císticas o de Sertoli (Grier, et al., 1980; De Rooij y Russel, 2000; Ehmcke et al., 2006 y Schulz et al., 2009), las cuales son consideradas como células madre (Hess y Fraca, 2007). Su única función está relacionada con el desarrollo de las células germinativas y se basa en una intensa interacción paracrina (Rüdiger y Miura, 2002). Durante la diferenciación celular, el testículo, presenta diversos cambios, pudiéndose identificar diferentes tipos celulares. La división celular comprende entonces, varias células intermedias denominadas espermatogonias, espermatocitos y espermátides (Schulz et al., 2009). El proceso inicia con las espermatogonias, las cuales están localizadas en el interior del lóbulo (Weltzien et al., 2002), lugar en donde por mitosis darán origen a los espermatocitos (primarios y secundarios); estos a su vez se convertirán en espermátides, quienes originarán los espermatozoides (Zanuy et al., 2009), luego del proceso 8 de espermiogénesis, caracterizado por el gran aumento en el volumen de cada cisto, anastomosis y liberación celular hacia la luz del lóbulo (espermiación). Desarrollo Reproductivo en Hembras Morfología ovárica En teleósteos los ovarios se diferencian por la estacionalidad del desarrollo, por la época de transformación de los oocitos y por la distribución de los mismos dentro del ovario. Esto ha dado como resultado el reconocimiento de cuatro tipos de desarrollo ovárico (Carrillo y Zanuy, 1993; Vazzoler, 1996). Ovario sincrónico en un grupo: se puede identificar un solo lote de oocitos, los cuales se van desarrollando de manera sincrónica y homogénea hasta alcanzar la maduración. En este tipo de ovario no existen oocitos en stock de reserva, pues las especies que los poseen desovan una única vez. Ovario sincrónico en dos grupos: se pueden identificar claramente dos lotes de oocitos, el primero de los cuales se va desarrollando de manera sincrónica y homogénea hasta que todos sus oocitos alcanzan la madurez, momento en el cual se realiza un desove total. El segundo lote corresponde al stock de reserva que será utilizado durante el siguiente periodo reproductivo. Ovario sincrónico en grupos: se pueden identificar más de dos lotes de oocitos; el primer lote se va desarrollando de manera sincrónica y homogénea hasta que todos sus oocitos alcanzan la madurez; los lotes restantes van madurando, también de manera sincrónica y a medida que cada lote alcanza la madurez se realiza el desove de ese lote (especies de desove múltiple o parcelado). Ovario asincrónico: No se pueden identificar lotes de oocitos definidos. Por el contrario, se observan oocitos en todos los estadios de maduración y es evidente que su desarrollo no es homogéneo ni sincrónico. Cuando un número 9 significativo de oocitos alcanza la madurez, tiene lugar el desove (especies de desove intermitente). Oogénesis. La oogénesis es el proceso mediante el cual las células de la línea germinativa completan su desarrollo, dando lugar a la célula de mayor tamaño que el individuo puede producir, el óvulo. En términos generales, la oogénesis es la transformación de oogonias en oocitos, proceso que se cumple cíclicamente en el ovario del pez durante toda su vida reproductiva (Harvey y Carolsfeld, 1993; Landines, 2005). En las lamelas ovígeras, se inicia el proceso de crecimiento primario (mitosis de las oogonias). En segunda instancia, aparecen los oocitos primarios, los cuales posteriormente pasarán por una serie de transformaciones hasta convertirse en óvulos. Dichas transformaciones comprenden varios estadios de desarrollo, a saber: cromatina nucleolar, perinucleolar, alveolo cortical, vitelogénesis, maduro y finalmente, llegar a la fase de folículos postovulatorios (Palmer et al., 1995; Romagosa et al., 2002; Landines, 2005; Medina et al., 2007; Mañanós et al., 2009). Cromatina nucleolar. Son células que permanecen agrupadas y se localizan en las regiones vascularizadas de las lamelas ovígeras. Poseen poco citoplasma y un núcleo redondeado, fuertemente basófilo y por lo general con un único nucleolo (Vazzoler, 1996; Carrillo y Rodríguez, 2001). Perinucleolar. En esta fase, las células han adquirido mayor tamaño, su citoplasma es basófilo y de tamaño superior (Vazzoler, 1996). Histológicamente se reconocen fácilmente por la presencia de numerosos nucléolos en la periferia del núcleo (Utoh et al., 2004). Alveolo cortical: Durante esta fase el oocito presenta vacuolización, principalmente cerca de la membrana citoplasmática y se inicia la síntesis de 10 vesículas de vitelo, siendo evidente la formación de alvéolos corticales, fundamentalmente en inmediaciones de la célula micropilar (Guraya, 1986; Kunz, 2004; Landines, 2005). Vitelogénico: En esta etapa existe presencia densa de gránulos de vitelo en el citoplasma, ahora abundante y con afinidad acidófila. Los gránulos de vitelo van avanzando centrípetamente desplazando hacia el centro de la célula a las vacuolas que estaban periféricas. El núcleo se torna irregular y aun presenta nucléolos en la periferia (Vazzoler, 1996). Maduro: El oocito aumenta rápidamente de tamaño en función del aumento de los gránulos de vitelo. El núcleo se encuentra desplazado hacia la periferia y su contorno es irregular. Los oocitos están listos para liberarse del folículo ovárico y ser fertilizados. 11 ANTECEDENTES Existen trabajos clásicos sobre el desarrollo de las células germinativas en peces como los de Grier (1975; 1976). En el primero se presentan los resultados de su investigación en la espermiogénesis de Gambusia afinis, enfatizando en la caracterización de los microtúbulos. En el segundo se explica el desarrollo del esperma en peces, teniendo como caso de estudio Oryzias latipes. Posteriormente, Selman et al. (1988) realizan una descripción de oogénesis en Fundulis heteroclitus. También Wallace y Selma (1981) describen la dinámica del crecimiento de los oocitos en peces, a partir de los mecanismos hormonales reguladores de la maduración. Otros trabajos importantes son los de Schulz et al. (2002 y 2009). En el primero realizan un análisis del sistema endocrino de la espermatogénesis y en el segundo una recopilación del todo lo relacionado a la espermatogénesis en peces. Vicentini et al. (2001) publican su investigación sobre la morfología y ultraestructura testicular en Prochilodus scrofa, que contribuyó al conocimiento sobre el tipo de testículo tubular y la estructura de los tubos seminíferos. Mack y Segner (2003) publican el desarrollo morfológico de las gónadas en zebrafish, donde identifican los diferentes tipos celulares en machos y hembras. Con esta especie trabajó el grupo de investigación liderado por Leal et al., (2009), quienes realizaron un estudio sobre la espermatogénesis, enfatizando el desarrollo de las espermatogonias, usando marcadores moleculares, determinando la duración de las fases meioticas y espermiogénicas. En cuanto al desarrollo de células germinativas en hembras, Lubzens et al. (2009) incluyen información de maduración y ovulación, además de anotar algunas diferencias entre los oocitos en peces. Suzuki et al. (2000) registran la relación existente entre la morfología de los oocitos y la estrategia reproductiva. También Duarte y Araujo (2002) aportan conocimiento sobre la relación entre el desarrollo ovárico y la fecundidad con respecto a la longitud total, el peso total y el de la gónada. Adicionalmente Acosta y Gerson (1999) y Favaro y De Tarso (1999) publicaron la biología reproductiva de Hemiancistrus sp. y una caracterización de algunos aspectos 12 morfológicos y citoquímicos de la oogenesis de Hypostomus cf. tietensis, repectivamente. Mazzoni y Caramashi (1997) trabajaron con Hypostomus luetkni, y establecieron que presenta un periodo reproductivo largo, que va desde junio hasta abril, cuando los niveles pluviométricos son bajos para la zona del río Paraiba do Sul. En Venezuela, García et al. (1984) estudiaron la biología reproductiva de Hypostomus watwata y para Colombia, específicamente, algunos trabajos versan sobre la biología reproductiva de Ancitrus triradiatus y de Chaetostoma fischeri (García, 1981; 1990). 13 METODOLOGÍA Obtención de individuos Fueron colectados noventa peces en la ribera alta del río Orinoco. Fueron pescados con método de buceo una a una por los pescadores de la región y luego fueron enviados vivos, por vía aérea, hasta la ciudad de Bogotá, donde fueron trasladados al laboratorio de ictiología de la Facultad de Medicina Veterinaria y de Zootecnia de la Universidad Nacional de Colombia, para iniciar su procesamiento. Los peces colectados fueron sacrificados con una sobredosis de anestésico (Metasulfonato de tricaina: 0,5 g/L). Posteriormente, se les realizó un corte en la médula espinal, teniendo en cuenta las consideraciones éticas propuestas por el International Council for Laboratory Animal Science (Close et al., 1996). Finalmente, se extrajeron las gónadas para su correspondiente fijación y análisis. Clasificación gonadal Macroscópica: Los peces fueron disectados y según la observación macroscópica realizada tanto para hembras como para machos, se clasificaron en diferentes estadios de maduración gonadal, según escalas de Agostinho (1987); Vazzoler (1996) y Duarte et al. (2007). Microscópica: Análisis histológico Luego de extraídas, las gónadas fueron fijadas en solución de Karnovsky modificado (pH 7,4), durante 24 horas; posteriormente se hicieron lavados con búfer fosfato durante dos días y finalmente fueron conservadas en alcohol etílico (70%) (Prieto, 2002). 14 Posteriormente, las muestras se sometieron a una rutina de deshidratación en concentraciones crecientes de alcohol, para ser incluidas en Historresina Leica®. Se obtuvieron cortes de 3µm de espesor, utilizando un micrótomo Leica® RM 2265. Los cortes fueron coloreados con azul de toluidina y con hematoxilina-eosina (H&E). Con la placas ya terminadas se realizó la clasificación microscópica del desarrollo gonadal de los individuos según las escalas de Leino et al. (2005); Duarte et al. (2007); Grier et al., (2009) y Grier y Uribe (2009). Finalmente, se tomaron fotografías con una cámara digital Cannon®, con adaptación para microscopio óptico. Las imágenes fueron analizadas con el programa Image Pro Plus® 4.1. 15 RESULTADOS Y DISCUSIÓN CLASIFICACIÓN GONADAL MACROSCÓPICA Y MICROSCÓPICA MACHOS Macroscópica: Macroscópicamente, los machos de Hemiancistrus subviridis presentan un par de testículos bilobulados, localizados en la pared dorsal de la cavidad abdominal, unidos por el mesorquio y localizados a ambos lados de la vejiga gaseosa, dorsalmente al intestino. Son independientes, pero se encuentran fusionados hacía la parte caudal en un sólo espermiducto, que confluye en la papila urogenital. Al observar las gónadas de H. subviridis se identificaron tres estadios de maduración: inmadura, en maduración y madura. La gónada clasificada como inmadura es elongada, aunque se nota una aumento de tamaño en la parte craneal (Figura 1A). En los individuos clasificados como en maduración (Figura 1B), la gónada aumentó su tamaño haciéndose más notoria en la parte craneal y en algunas se observó la presencia de pliegues en la parte media. Finalmente las gónadas maduras presentaron un mayor volumen con respecto a la anterior y todo el tiempo se observaron pliegues en la parte media (Figura 1C). B A B C Figura 1. Gónadas de macho Hemiancistrus subviridis. A. Madura, B. Madurando, C. Inmadura. Clasificación según escala de Duarte et al. (2007). Microscópica: Análisis histológico 16 Cuando se realizó el análisis histológico de las gónadas, se encontró que el 97,3% de los machos estaban en una fase de vacío (Figura 2A) y el 2,63% estaban en fase de maduración (Figura 2B), resultado que no coincidió con la clasificación macroscópica, ya que las gónadas que fueron clasificadas como en maduración y maduras realmente se encontraban en fase de vacío y las que fueron clasificadas como inmaduras realmente se encontraban en la fase de inicio de maduración. En el primer estadio se pudo observar la presencia de algunos espermatozoides en la luz del lóbulo seminífero y unos cistos de espermatocitos primarios (Figura 2A). En cuanto al estadio de inicio de maduración, se diferenciaron pocos espermatozoides en la luz del lóbulo seminífero y se observaron espermatogonias primarias y algunos cistos de espermatocitos primarios y de espermátidas (Figura 2B). Ts cp cp Ls z z cd gp B A Figura. 2. Gónadas de macho Hemiancistrus subviridis. A. Estadio vacío. Túbulo seminífero (TS), espermatozoides (z), cistos de espermatocitos primarios (cp). B. Estadio en maduración. Túbulo seminífero, espermatozoides (z), espermatogonias primarias (gp), cistos de espermatocito primario (cp) y de espermátidas (cd). Fase Inicio de Maduración. En esta fase se identificó un compartimento germinativo y uno intersticial. El primero está compuesto de células en proceso de espermatogénesis. Se observaron espermatogonias (primarias y secundarias), espermatocitos 17 (primarios, en división y secundarios). En esta fase se siguen observando la presencia de espermatidas y espermatozoides en la luz del túbulo (Figura 3B). En cuanto al compartimento intersticial, se identificaron células de Sertoli, células mioides y vasos sanguíneos (Figuras 3A, B, C, D y E). La irrigación en esta fase es elevada, ya que se observa un número considerable de vasos sanguíneos y además es evidente la luz en el túbulo seminífero (Figura 3A). Ambas características no son comunes en otras especies en esta fase de desarrollo. A Figura. 3. A. Espermatogonias primarias (gp) y secundarias (gs), células de Sertoli, vasos sanguíneos (vs). Luz en el túbulo seminífero (L). B. Espermatogonias secundarias (gs), cistos de espermatocitos primarios (cp) y espermátidas (cd), posibles espermatozoides (z) en la luz del túbulo. C. Cistos de espermatocitos primarios (cp) y secundarios (cs), cistos de espermátidas (cd). D. Espermatogonias secundarias (gs), cistos de espermatocitos primarios (cp) y en división (cpd). E. Espermatogonias primarias (gp), espermatogonias secundarias (gs), cisto de espermátidas (csd), células de sertoli y 18 mioides. Amplia luz en el túbulo seminífero. F. Espermatogonias primarias (gp), espermatogonias secundarias (gs), cisto de espermatocitos primarios en división (cpd), vasos sanguíneos (vs) sigue la luz dentro del túbulo seminífero. Fase de vacío El testículo de Hemiancistrus subviridis presentó los mismos compartimentos (intersticial y germinativo), en los cuales se encontraron: espermatogonias primarias, espermatogonias secundarias y algunos cistos de espermatocitos primarios y en división. Se observó anastomosis y algunos espermatozoides en la luz del túbulo. El epitelio germinativo es aplanado y ordenado, se observa un gran espacio (luz de túbulo semínifero) para el depósito de los espermatozoides y adicionalmente dentro de este espacio se observa la presencia de un líquido de consistencia viscosa, que puede tratarse de líquido seminal (Figura 4). Durante esta fase, también se observa la presencia de numerosas células miodes. 19 A C E B D F Figura. 4. A. Espermatogonias primarias (gp), espermatogonias secundarias (gs), espermatozoides (z) en la luz del túbulo, líquido seminífero (Ls). Indicios de anatomosis. B. Espermatogonias secundarias (gs), cistos de espermatocitos primarios (cp), espermatozoides (z) y líquido seminal (Ls). C. Espermatogonias primarias (gp), espermatogonias secundarias (gs), espermatozóides (z), células miodes (m) y líquido seminal (Ls). D. Epiltelio germinativo aplanado y ordenado (Eg), espermatogonias primarias (gp), espermatogonias secundarias (gs) y espermatozoides (z) dentro del líquido seminal. E. Espermatogonias primarias (gp), espermatogonias secundarias (gs), células de sertoli (S) y miodes (m), espermatozoides (z) en la luz de túbulo, presencia de líquido seminal (Ls) e indicios de anastomosis. F. Espermatogonias secundarias (gs), células de sertoli (S), cistos de espermatocitos primarios (cp) y en división, (cpd) espermatozoides (z) en la luz del túbulo seminífero y se observa líquido seminífero (Ls). Descripción de las células del tejido germinativo: Espermatogonias: En el análisis histológico de testículo de H subviridis, fueron diferenciadas espermatogonias primarias y secundarias. Las primeras se caracterizan por ser 20 las células de mayor tamaño en el proceso de espermatógenesis. Presentan un núcleo pequeño con respecto al citoplasma con la presencia de nucleólos, se encuentran rodeadas por las proyecciones de las células de Sertoli. En cuando a las espermatogonias secundarias, se diferencian porque son células de menor tamaño, su núcleo tiene una mayor área con respecto al citoplasma y presenta varios nucleólos (Figura 5). A partir de las imágenes se realizaron medidas de células y núcleos y se estableció que las espermatogonias primarias tiene un área promedio de 124,34 ± 17,6 µm2 y un diámetro promedio de 12,47 ± 0,8 µm. Para el caso de la espermatogonias secundarias, no se diferenció el citoplasma, por lo que se midió el núcleo dando como resultado un área de 35,11 ± 6,6 µm2 y diámetro de 6,6 ± 0,6 µm. gs gp A vs B Figura 5. A. Espermatogonias primarias (gp) y B.secundarias (gs) de H. subviridis. Espermatocitos: Son el resultado de la división mitótica de las espermatogonias; se encuentran en cistos ubicados casi siempre en la periferia del testículo. Se observó la presencia de espermatocitos primarios, que son células con un núcleo de menor tamaño con respecto a las espermatogonias y adicionalmente no se diferencia muy bien el citoplasma. Presentan un área 33,96 ± 3,6 µm2 con un diámetro de 6,50 ± 0,3 µm. También se hallaron espermatocitos secundarios, los cuales poseen un núcleo aún más condensado y son de menor tamaño. Aunque su diferenciación dentro 21 del proceso de espermiogénesis es difícil, se logró encontrar dentro de la fase de inicio de maduración. Adicionalmente se diferenciaron espermatocitos secundarios en división meiótica que finalmente darán origen a las espermátidas (Figura 6). Figura 6. Espermatocitos primarios (cp), espermatocitos secundarios (cs) y espermatocitos secundarios en división (csd) de H. subviridis. Espermátidas y espermatozoides: Las espermátidas son células con un núcleo redondeado y denso; se encontraron en cistos ubicados en mayor porcentaje a lo largo de la periferia de la gónada. Los espermatozoides fueron encontrados en la luz del túbulo dentro del líquido seminífero. Su cabeza es redonda y el núcleo es denso. Es importante destacar la presencia de posibles cistos de espermatozoides (Figura 7). cd cd A B 22 Z cpd C Fig 7. A y B. Espermatidas (cd) C. Espermatocitos primarios en división y espermatozoides DISCUSIÓN: Hemiancistrus subvidis pertenece a la familia de los silúridos uno de los grupos más diversos en aguas marinas y continentales (Nelson, 1994) y de amplia distribución en la regiones tropicales del mundo (Teugels, 1996 y Ferraris, 1998), por lo tanto, cuenta con una diversificación en la morfología testicular (Lopes et al., 2004), que puede ir desde simples bolsas elongadas que convergen en una papila urogenital a órganos compuestos por prolongaciones o franjas con función espermatogénica, además de tener zonas con funciones especificas de secreción o almacenamiento (Ortiz, 2008). En el caso de esta especie, el testículo presenta una estructura elongada que no tiene vesícula seminal ni proyección alguna, características que se le suman a las anteriormente descritas y que coincide con lo reportado por Lior et al. (1989) y con las descripciones de morfología testicular en los estudios de Verissimo – Silveira (2003), Gumarães-Cruz et al. (2005); Duarte et al. (2007); Cek y Yilman (2007) y Grier y Uribe (2009). En cuanto al análisis histológico, H. subviridis presenta un testículo de tipo espermatogonial irrestricto que se caracteriza porque el tejido germinativo está dispuesto a manera de red, formando curvas desde la periferia hasta el conducto eferente (Grier, 1993; López et al., 2004 y Grier y Uribe, 2009), las espermatogonias se presentan a lo largo del lóbulo y durante la espermiación los espermatozoides son liberados en el lumen para llegar al conducto eferente (Grier, 1993 y Parenti y Grier, 2004), característica propia de especies en taxas 23 primitivas como los silúridos (Parenti y Grier, 2004 y Grier y Uribe, 2009). Se trata entonces de un testículo cuyos compartimentos germinativos forman lóbulos y las espermatogonias se distribuyen a lo largo de ellos, por lo tanto es un testículo espermatogonial irrestricto (Grier, 1981; Grier, 1993 y Parenti y Grier, 2004). A diferencia de un testículo restricto, donde en el proceso de espermatogénesis el cisto migra al ducto eferente y las células germinativas maduran dentro. Esta especie independientemente del tipo testicular, presenta un proceso de espermatogénesis cística, ya que el desarrollo celular germinativo ocurre dentro de cistos delimitados por células de Sertoli y presentan diferenciación sincrónica, como lo reportado por Mattei et al. (1993) y Guimarães-Cruz et al. (2005). El rompimiento del cisto sólo ocurre cuando las espermatidas ya se han dividido dado origen a los espermatozoides que son finalmente liberados en la luz del túbulo seminífero. En cuanto a las fases de desarrollo gonadal (Inicio de maduración y vacío) Veríssimo-Silveira (2003), afirma que la fase de inicio de maduración en este tipo de testículo, se caracteriza por contar con un epitelio germinativo activo y continúo, además se pueden observa túbulos con luz en las porciones de la periferia, lo que coincide con lo observado en esta especie. Sin embargo, los túbulos con luz no se limitan a la periferia sino que se observan a lo largo de la gónada. Otros estudios de desarrollo gonadal en machos como los de Alexandrino et al. (1985); Vicentinni (2002) y Duarte et al. (2007), afirman que en esta fase de maduración, la gónada cuenta con todos los tipos celulares del proceso de la espermatogénesis, incluyendo la presencia de algunos espermatozoides, tal y como se observó en esta especie. Sin embargo, no reportan la presencia de túbulos con luz, ni en la periferia ni a lo largo de la gónada. Lo anterior, puede indicar que H. subviridis tarda mucho en pasar de la fase de vacío a la fase de inicio de maduración nuevamente, pues comienza su proceso de división celular para el siguiente ciclo reproductivo, existiendo aún, 24 luz en los túbulos seminíferos que hace parte del ciclo anterior. Dicho atraso posiblemente se deba a que la gónada es muy anastomosada y por lo tanto, el proceso de regeneramiento tisular sea lento; esta característica de anastomosis entre tubos seminíferos también fue reportada por GuimarãesCruz et al. (2005) en Loricaria lentiginosa. Este proceso de anastomosis y de regeneramiento del tejido, puede a su vez explicar la alta presencia de vasos sanguíneos, ya que se necesitan ciertos niveles nutricionales para completar dicha labor. En cuanto a la fase de vacío, H. subviridis presenta algunos espermatozoides distribuidos al azar libremente en los túbulos seminíferos, como lo reportan los estudios de Duarte et al. (2007) para Loricariichthys spixii y Soares et al. (1995) para Shizodon knerii y Leporinus piau, pero no cumple con lo señalado por Verissimo-Silveira (2003), quien asegura que para este tipo de testículo (tubular anastomosado), el tejido germinativo es discontinuo, ya que se observan espermatogonias dispersas y adicionalmente se presenta una reducción en la luz de los túbulos seminíferos. Teniendo en cuenta lo anterior, se puede afirmar que durante esta fase de desarrollo gonadal, esta especie presenta algunos espermatozoides libres, pero las espermatogonias no están dispersas, sino que se presentan alineadas en forma de rosario y finalmente los túbulos no están reducidos, sino que presentan una amplia luz. Es importante destacar que dentro de estos túbulos se pudo establecer la presencia de un líquido PAS positivo, lo que según Guimarães-Cruz et al. (2005), puede tratarse de una glicoproteína, utilizada por las células germinativas como sustancia nutritiva o también puede ser una secreción que facilita la salida de los espermatozoides en el proceso de espermiación. Aunque pueden ser muchas las teorías con respecto a la función de esta secreción, lo que si se pude establecer en este estudio, es que esta sustancia da la apariencia de una gónada madura si se realiza solamente una clasificación gonadal macroscópica, por lo tanto, la presencia de este líquido en 25 la gónada fue el responsable de que la clasificación macroscópica y microscópica no coincidieran, pues daba la apariencia de una gónada voluminosa y con una irrigación sanguínea, destacadas características de una gónada madura. HEMBRAS Macroscopica: Macroscópicamente, las hembras de Hemiancistrus subviridis presentan un ovario bilobulado, donde la gónada izquierda es de mayor tamaño que la derecha. Los dos ovarios están ubicados en la pared dorsal de la cavidad abdominal y dorsalmente al intestino. Se encuentran fusionados hacía la parte caudal en un sólo oviducto (Figura 8). A B C Figura 8. Gónadas de hembra de Hemiancistrus subviridis. A. Madurando, B. Desovada, C. Madura. Clasificación según escala de Vazzoler (1996). En la clasificación macroscópica se utilizó la escala de Vazzoler (1996), con ésta, se estableció que las gónadas se encontraban en tres estadios: madurando (46,2%), madura (30,8%) y desovada (23,1%), teniendo en cuenta un n de 50 individuos. La gónada madura ocupa tres cuartas partes de la cavidad abdominal, se caracteriza por la presencia de oocitos de gran tamaño, es de color amarillo intenso y se encuentra muy irrigada (Figura 8C). La gónada en estadio de maduración, ocupa menos espacio en la región abdominal, tiene oocitos en crecimiento y su color es amarillo opaco (Figura 8A). En desove, las gónadas 26 se presentan como dos bolsas flácidas, delgadas y de un color amarillo transparente (Figura 8B). En contraste con lo encontrado en machos, los estadios macroscópico y microscópicos de las hembras, si coincidieron. Microscópica: Análisis histológico En el análisis histológico de los ovarios de Hemiancistrus subviridis, realizado durante el tiempo de estudio (enero – abril), se estableció que los ejemplares colectados estaban en tres fases de desarrollo: Madurando (Figura 9), madura (Figura 10) y desovada (Figura 11). Madurando: Este estadio se caracterizó por la presencia de oocitos perinucleolares y en alvéolo cortical. Específicamente en los individuos encontrados, los oocitos en alvéolo cortical están en la fase inicial de su desarrollo, ya que el número presente es poco con relación a los perinucleolares (Figura 9). p P Ac Ac A Figura. 9. Gónadas madurando. A. Oocitos en alvéolo cortical (Ac) y en perinucleolar (P). 200X Madura: Los individuos encontrados en este estadio, se caracterizaron por la presencia de oocitos en estado maduro; sin embargo, en el lumen ovárico se observó la presencia de oocitos perinucleolares, que darán origen al siguiente lote de oocitos en el siguiente ciclo reproductivo. En los oocitos se pudo diferenciar la 27 teca y la capa granulosa, además de los gránulos de vitelo. Es importante mencionar que por el tamaño de las células germinativas maduras no se pudo obtener una imagen del área total, solo de parte de ellas, pero que teniendo en cuenta la presencia de vitelo y su tamaño, se pudo establecer que son oocitos maduros (Figura 10). T m m G GV P L L P V P m L m Figura 10. Hembra madura. Oocitos en estadio maduro (m) y en perinucleolar (p). Se observa el Lumen (L), la capa granulosa (G) , la Teca (T) y en detalle 20X Gránulos de vitelo (GV). Desovada: En este estadio se observó una gónada vacía, presentando folículos postavulatorios separados de la membrana basal, también se observó la presencia de uno o dos oocitos vitelogénicos y mayor cantidad de perinucleolares, pero no ubicados sobre el lumen ovárico, como en la fase anterior. Es importante mencionar que en esta fase se encontraron oocitos en estadio perinucleolar, lo que puede dar indicios, de que se inicia el nuevo ciclo reproductivo (Figura 11). 28 V F V P F F P Ac P F Figura 11. Hembra Desovada. Oocitos en estadio vitelogénico (V), en perinucleolar (P) y el alveolo cortical (Ac). Foliculos posovulatorios (F). Descripción de las células del tejido germinativo: Oocitos perinicleolares: Son los oocitos en el proceso de oogénesis de menor tamaño (Figura 12). Tienen un núcleo con nucléolos en la periferia, su citoplasma es basófilo y a partir de las imágenes se estableció que tienen un área de 138 µm2. P GV P A B Figura 12. Oocitos perinucleolar (P). Se pueden observar gránulos de vitelo (GV) en la figura A. 29 Oocitos alvéolo cortical: Un oocito de mayor tamaño con respecto al anterior estadio, se caracteriza principalmente por la presencia de vesículas en el citoplasma y por la reducción del núcleo con respecto al tamaño del citoplasma (Figura 13). A partir de las imagines se estableció un área de 254 µm2. Ac Figura 13. Oocitos en estadio alveolo cortical (AC). Oocitos maduros Son los oocitos de mayor tamaño dentro del proceso de maduración. Se caracterizan por la acumulación de glóbulos de vitelo en el citoplasma y el núcleo es de difícil definición (Figura 14). En H. subviridis estos oocitos son de color amarillo fuerte y tienen un diámetro promedio de 3,58 ± 0,35 mm. V Figura 14. Oocitos en estadio vitelogénico (V) C 30 DISCUSIÓN El ovario de H. subviridis en un órgano pareado en forma de saco que se encuentra sostenido por un mesenterio. Los dos ovarios se ubican en la cavidad abdominal y están unidos por un oviducto corto como los reportados por Agostinho et al. (1979); Grizzler (1979); Agostinho et al. (1987); Lieno et al. (2005) y López et al. (2006). En cuanto al análisis histológico se estableció que H. Subviridis presentó tres de los cinco tipos de células germinativas que comúnmente son definidas en teleósteos: oocitos perinucleolares, oocitos en alveolo cortical y oocitos maduros y que han sido reportados por Wallace y Selman (1981); Agostinho et al. (1987); Palmer et al. (1995); Romagosa et al. (2002); Montoya – López et al. (2006); Medina et al. (2007) y Duarte et al. (2007). Asimismo, los ejemplares capturados se encontraron en tres fases de desarrollo reproductivo: madurando, madura y desovada, definidos por el tipo de células de la línea germinativa encontrado en cada una de ellas. La gónada madurando cuenta con oocitos en estado perinucleolar y de alveolo cortical; en la madura se observaron oocitos maduros y perinucleolares; finalmente en la desovada se ve claramente la presencia de oocitos previtelogénicos y como en los dos anteriores hay oocitos perinucleolares. Estas características coinciden con lo descrito por Agostinho et al. (1987) y Vazzoler (1996) y con lo reportado para H. ternetzi, M. aculeatus y R. aspera (Suzuki et al., 2000; Agosthino et al., 1987). Según la descripción anterior se puede observar que la gónada de H subviridis evidencia la presencia de oocitos perinucleolares en las etapas del ciclo de reproducción estudiado. Esto puede indicar que la especie cuenta con un stock de reserva, característica común ya que es fácil encontrar especies con oocitos previtelogénicos (perinucleolares, alveolo cortical) en todos las fases de la oogénesis y que desovan en repetidas ocasiones durante todo el año (Deza et al., 2005). 31 A partir de las fases de la oogénesis, en los teleósteos se establece un patrón de desarrollo ovárico. Wallace y Selman (1981) reportan ovarios Sincrónicos, Sincrónicos en grupos y Asincrónicos; mientras que Grier et al., (2009), establecen la existencia de ovarios sincrónicos en grupos y asincrónicos. Como ya se ha observado H. subvidiris, presenta por lo menos dos tipos celulares germinativos en cada uno de los estadios encontrados, por lo tanto y teniendo en cuenta las clasificaciones anteriores, presenta un ovario sincrónico en grupos. Adicionalmente en los teleósteos las especies pueden ser clasificadas en desovadores totales o parciales. Se sabe que durante la fase de maduración las hembras presentan cambios en el folículo ovárico. Éste inicia con cambios nucleares, seguido de cambios citoplasmáticos con la acumulación de vitelo en el citoplasma y finalmente se registra un desarrollo de la pared folicular (Wallace y Selman, 1981; Agostinho et al., 1987; Domitrovic, 1990; Palmer et al., 1995; Romagosa et al., 2002; Montoya – López et al., 2006; Medina et al., 2007 y Duarte et al., 2007). Este desarrollo oocitario relacionado con la frecuencia de los desoves dentro de un periodo de reproducción y el número de reproducciones realizadas durante su ciclo de vida determina el tipo de desovador; es así como se tienen especies con más de un lote de oocitos eliminado en cada periodo de reproducción (desovadores parciales) y los que en el ciclo expulsan solo el lote de oocitos maduros (desovadores totales) (Vazzoler, 1996). Teniendo la información anterior y lo observado para H. subviridis tenemos entonces un desovador total, como lo reportado para Hemiancistrus sp. (Ramos y Konrad, 1999) y para Rhinelepis aspera y Megalancistrus aculeatus (Vazzoler, 1994), especies que pertenecen a la familia Loricarridae. En relación al tamaño de los oocitos encontrados, es importante saber que en las fases de desarrollo (proceso de oogénesis) se cumple un proceso cíclico en el ovario del pez durante toda su vida; éste, inicia con oogonias que gracias a divisiones mitóticas y meióticas pueden aumentar hasta 100 veces su tamaño al final del ciclo (Harvey y Carolsfeld, 1993). El crecimiento del oocito se da 32 gracias a la acumulación de vitelo en el ooplasma que es definida como “material nutritivo” y que se convierte en un recurso nutricional y de aporte de energía para el embrión luego de la fertilización (Grier et al., 2009). Lo que explica el tamaño de los oocitos maduros encontrados en las gónadas maduras de esta especie, ya que los oocitos perinucleolares registraron una área media de 138 µm2 y los oocitos maduros finalizan en promedio con un área de 11246,9 ± 0,35 µm2. Este crecimiento oocitario se ha registrado del mismo modo en Rhinelepis aspera (familia loricarridae), con un área inicial de 1256,6 µm2 (perímetro es de 400 µm) para perinucleolares y finalizan con áreas medias de 4172,4 µm2 para los oocitos maduros. El tamaño de los oocitos en esta familia puede ser debido a la estrategia de reproducción, la cual generalmente se caracteriza por presentar cuidado parental (Winemiller, 1989 y Agostinho et al., 1991). Esto explicaría el bajo número de oocitos por ciclo, pues la especie le apuesta al cuidado y no al número. La estrategia reproductiva en las especies tropicales depende de las lluvias y la temperatura (Duarte et al., 2007), las condiciones del río (aguas altas o bajas), el comportamiento social y la disponibilidad de alimentación (Polenov y Guerbilski, 1975; Chaparro, 1994; Vazzoler, 1996; Araujo, 2001; Urbinati, 2005 y Duarte et al., 2007). La captura de los ejemplares H. subvidiris se realizó en época seca o de aguas abajo, por lo tanto, puede ser que el periodo reproductivo este influenciado por las condiciones del río y por la disponibilidad de alimento que aseguraría el desarrollo de las nuevas poblaciones. CONCLUSIONES 1. El estado sexual de los individuos encontrados durante la investigación fueron: madurando, maduros y en desove para hembras y en proceso de espermiación y vacío para machos. 2. Los mahos de Hemiancistrus subviridis presentaron un testículo del tipo espermatogonial irrestricto. 33 3. El testículo presentó un líquido (PAS positivos), que afecta la morfología macroscópica de la gónada. 4. Las hembras de H subviridis presentaron un ovario sincrónico en grupo 5. Es una especie clasificada como desovador total. BIBLIOGRAFÍA Ambruster JW. 2004. Pseudancistrus sidereus, a new species from southern Venezuela (Siluriformes: Loricariidae) with a redescription of Pseudancistrus. Rev. Zootaxa 628:1-15p. Agostinho AA, Barbieri CM, Barbieri G, Agostinho, C. 1987. Biologia reproductiva de Rhinelepis áspera (Agassiz, 1829) (Teleostei, Loricariidae) no Rio Paranapanema. Estructura dos ovários e estadios de maturação. Rev. Brasil Biologia. Rio de Janeiro. 47 (3): 319-328p. _____________, Hanh, NS, Agostinho CS. 1991. Ciclo reproductivo e primeira maduracão de fêmeas de H. commersonii (Valenciennes, 1840) (Siluriformes) no Reservatório Capivari - Cachoeira, PR. Rev. Brasil. Biol., Rio de Janeiro, 51(1):31-37. _____________ 1979. Ajiaco-Martínez R, Blanco-Castañeda M, Berreto-Reyes C, Ramírez-Gil H. 2001. Las exportaciones de peces ornamentales. En: Ramírez, G. H y R. E. Ajiaco. 2001. La pesca en la baja Orinoquia colombiana: una visión integral. Ministerio de agricultura, Programa Nacional de Transferencia y Tecnología Agropecuaría, Colciencias e INPA. Editorial Produmedios. Bogotá. 211-217p. Batlouni SR, Carreño FR, Romagosa E y Borella MI. 2005. Cell junctions in the germinal epithelium may play an important role in spermatogenesis of the catfish P. fasciatum (Pisces, Siluriformes). J Mol Hist. 36:97-110p. Billard R. 1969. La espermatogénesis de Poecilia reticulata. Ann Biol. Anim. Bioch. Byphys. 9(2):251-271p. Cala P. 1990. La ictiofauna dulceacuícola de Colombia; una visión histórica y su estado actual. Revista de la Academia Colombiana de Ciencias Exactas, Físicas y Naturales. 17: 62p. 34 Castro DM. 1994. Peces del Putumayo. Sector Puesto Leguízamo. Corporación Autónoma Regional del Putumayo. Editorial Servigráfico S.A. Mocoa Putumayo. 3 p. Carrillo M, Zanuy S. 1993. En: Catello. F. Acuicultura Marina. Fundamentos biológicos y tecnología de la producción. Universidad de Barcelona (ed). Barcelona. 133p. Carrillo MA y Rodríguez J. 2001. Bases fisiológicas de la reproducción de peces tropicales.189-217 p. En: Rodríguez, H.; P. Victoria y M. Carrillo (Eds). Fundamentos de Acuicultura Continental. Instituto Nacional de Pesca y Acuicultura, INPA. Bogotá, D.C., Colombia. Segunda edición. 423 p. Chaparro N. 1994. Reproducción artificial y manipulación genética en peces. Editorial Mejoras. Barranquilla. Colombia. 17- 43p. Close B, Banister K, Baumans V, Bernoth E, Bromage N, Buyan J, Erhardt W, Flecknell P, Gregory N, Hackbarth H, Morton D, Warwickk C. 1996. Recomendaciones para la eutanasia de los animales de experimentación. Lab. Animals. 30:293-316p. De Rooij DG, Russel LD. 2000. All you wanted to Kwon about spermatogonia but were afraid to ask. J Androl. 21:776-798p. Deza S, Bazán R, Culquichicón, Z. 2005. Biología y pesquería de Pseudoplastystoma fasciatum (Linnaes, 1766; Pises), Doncella, en la región de Ucayali. Folia Amazónica. 14(2):5-17p. Duarte, S. y Araújo, F. 2002. Fecundity of the Hypostomus affinis (Siluriformes, Loricariidae) in the Lajes Reservoir, Rio de Janeiro, Brazil. Rev. Biol. Trop. 50(1): 193-197. ________, Araújo F, Sales A, Bazzoli N. 2007. Morphology of Gonads, Maturity and Spawning Season of Loricariichthys spixii (Siluriformes, Loricariidae) in a Subtropical Reservoir. Brazilian archives of biology and technology an international journal. 50(6):1019-1032p. Ehmcke J, Wistuba J, Schlatt S. 2006. Espermatogonial stem cell: questions, models and perpectives. Hum Reprod Update. 12:275-282p. FAO, Dgis, Fundación Fiduciaria Dr. Manuel Pérez. 2000. Diagnóstico de los recursos hidrobiológicos del amazonas. En: Memorias Institucionales con las publicaciones de 1990 –1999. Archivo Pdf. 35 Favaro LF y De Tarso Cunha P. 1999. Aspectos morfológicos y citoquímicos da ovogénesis de Hypostomus cf teitensis (Loricariidae) so Lago Igapó (Londrina, PR, Brazil). Acta Biol. Par., Curituva. 28 (1,2,3,4):125-139. Fowler H. 1954. Os peixes de água doce do Brasil. Arq. Zool. São Paulo: I-XII. 1-4000. García H. 1990. Biología reproductiva de Ancitrus triradiatus (Loriicariidae). Tesis para el titulo de Biólogo Marino. Universidad Jorge Tadeo Lozano. Bogotá. García L, Quiñones G, Friso G. 1984. Biología reproductiva de Hypostomus watwata (Osteichthyes - Loricariidae), armadillo pintado del lago de Maracaibo, Venezuela. Centro de aprendizaje agropecuario Don Bosco. Venezuela. García T. 1981. Contribución al estudio biológico pesquero de la cucha Chaetostoma fischeri, (Steindachner, 1879). Tesis para obtener el titulo de Biólogo Marino de la Universidad Jorge Tadeo Lozano. Grier, HJ. 1975. Spermatogenesis in the teleost Gambusi affinis with particular reference to the role played by microtubules. Cell Tiss Res. 165:89-102p. _________. 1976. Sperm development in the teleost Oryzias latipe. Cell Tiss Res. 168:419-431p. _________, Lonton Jr, Leantherland Jf, De Vlaming Vl. 1980. Structural evidence for two different testicular types in teleots fishes. Amer. J. Anat. 159:331-345p. GRIER 1981 __________. 1993. Comparative organization of Sertoli cells including the Sertoli cell barrier. In: Russell LD, Griswold MD (eds) The Sertoli cell. Cache River Press, Clearwater. 704–739p. _________, Uribe, MC. 2009. The testis and spermatogenesis in teleosts. En: Barrie, GM (Ed). Reproductive biology and phylogeny of fishes (Agnathas and bony fishes). 120-142p. _________, Uribe MD, PAtino R. 2009. The ovary, folliculogenesis and oogenesis in teleosts.- En: Barrie, GM (Ed). Reproductive biology and phylogeny of fishes (Agnathas and bony fishes). 25-84p. Guimarães-Cruz RJ, dos Santos JE y Santos GB. 2005. Gonadal structure and gametogenesis of loricaria Lentiginosa isbrücker (pisces, teleostei, siluriformes). Rev. Bras. Zool. 22:556-564p. 36 Guraya S. 1986. The cell and molecular biology of fish. Oogenesis. Monographs in developmental biology. New York. Vol 28. 82p Hess RA y França LR. 2007. Spermatogenesis and cycle of the seminiferous epithelium. In: Cheng CY (ed) Molecular mechanisms in spermatogenesis. Landes Bioscience. 1–15p. Harvey, B. y Carolsfeld, J. (1993). Induced Breeding in Tropical Fish Culture, Ottawa:International Development Research Centre. Hoet M. 1998. Tratado de Piscicultura. Tercera edición. Ediciones Mundiprensa. Madrid, Barcelona. Incoder. 2004. Peces ornamentales de Colombia. Archivo en CD. Inpa. 1999-2000. Boletín estadístico pesquero colombiano. Ministerio de Agricultura. Instituto Nacional de Pesca y Acuacultura. Bogotá. Kunz YW. 2004. Developmental biology of teleost fi shes. Springer Edit. Noruega. 638 p. Landines MA. 2005. Mecanismos celulares de la reproducción de los peces. Capitulo I En: Daza, p.; Landines, M. A. y Sanabria, A. (eds). 2005. Reproducción de peces del trópcio. Incoder y Universidad Nacional de Colombia. Bogotá. Lasso CA, Mojica JI, Usma JS, Maldonado-Campo JA, Donacimiento C, Taphorn DC, Provenzano F, Lasso-Alcalá OM, Galvis G, Vásquez L, Lugo M, Machado-Allison A, Royero, R, Suárez C, Ortega-Lara, A. 2004. Peces de la cuenca del Río Orinoco. Parte I. Lista de distribución por subcuencas. Biota Colombiana 5(2). 95-158p. Leal MC, Cardoso E, Nóbrega R, Batlouni S, Bogerd J, França L, Shulz R. 2009. Histological and stereological evaluation of Zebrafish (Danio rerio) spermatogenesis with na emphasis on spermatogonial generations. Biology of Reproduction. 81:177-187p. Leino RL, Jensen KM y Ankley GT. 2005. Gonadal histology and characteristic histopathology associated with endocrine disruption in the adult fathead minnow (Pimephales promelas). Environmental Toxicology and Pharmacology.19: 8598p. Loir M, Cauty C, Planquette P y Le Bail P. 1989. Comparative study of the male reproductive tract in seven families of South-American catfishes. Aquat. Living Resour., 2:45-56p. 37 Lopes DC, Bazzoli N, Brito MFG y Maria TA. 2004. Male reproductive system in the South American catfish Conorhynchus conirostris. J. Fish Biol., 64:1419-24, 2004. Lubzens E, Young G, Bobe J, Cerdá. 2009. Oogenesis in teleosts: How fish eggs are formed. General and comparative endocrinology. Artículo en prensa. Mack G, Segner H. 2003. Morphological development of the gonads in zebrafish. Journal of fish biology. 62:895-906p. Mananos E, Duncan N y Mylonas C. 2009. Reproduction and control of ovulation, spermiation and spawning in cultured fish. 3–80. In: Cabrita E, Robles V y Herraez P. (eds.): Methods in Reproductive Aquaculture: Marine and Freshwater Species. 549 pp. Mazzoni R y Caramaschi EP. 1997. Observations on the reproductive biology of female Hypostomus luetkeni Lacepede 1803. Ecology of Freshwater Fish. 6: 53-56p. Mazzoldi C, Lorenzi V y Rasotto MB. 2007 Variation of male reproductive apparatus in relation to fertilization modalities in the catfish families Auchenipteridae and Callichthyidae (Teleostei: Siluriformes). J. Fish Biol., 70:243-56p. Montoya – López A, Tabares CJ, Echeverri A, Arboleda L, Olivera-Angel M. 2006. Descripción anatómica e histological de ls gónadas de Sabaleta (Brycon henni, Eigenmann 1913). Universidad de Antioquia. Colombia. Revista Colombiana de Ciencias Pecuarias. 19(2):187-196p. Nelson JS. 1994. Fishes of the world. 600p. Palmer EE, Sorensen PW, Adelman IR. 1995. A histological study of seasonal ovarian development in freshwater drum in the Red Lakes, Minnesota. Journal of Fish Baiology. 47:199–210p. Parenti L, Grier, H. 2004. Evolution and phylogeny of gonad morphology in bony fishes. Integr. Comp. Biol., 44:333–348p. Polenov AL, Guerbilskii NL. 1975. Regulación hormonal del ciclo sexual en los peces. Editorial Industrias Alimentarías. Moscú. 180 p. Ramírez–Gil H, Ajiaco–Martínez RH. 2001. La pesca de especies de interés comercial en el área de Influecia de Inírida, Guainía. En: Ramírez, G. H y R. E. Ajiaco. 2001. La pesca en la baja Orinoquia colombiana: una visión integral. Ministerio de agricultura, Programa Nacional de Transferencia y Tecnología Agropecuaría, Colciencias e INPA. Editorial Produmedios. Bogotá. 139-154p. 38 Ramos LA y Konrad HG. 1999. Biologia reprodutiva de Hemiancistrus sp. (Osteichthyes, Loricariidae) do rio Dos Sinos, rs. Boletim do Instituto de Pesca. São Paulo. 25: 45-50p. Reis R, Kullander SO, Ferraris F. 2003. Family Loricariidae .318p. Em: Reis, R. E, S. O. Kullander & C. F. Ferraris Jr. (Eds.). Check List of the Freshwater Fishes of South and Central America. Porto Alegre, Edipucrs, 729p. Romagosa E, De Paiva P, Godinho HM, Andrade-Talmelli EF. 2002. Características morfométricas e crescimento do cachara, Pseudoplatystoma fasciatum (Linnaeus, 1766), mantido em confinamento. Acta scientarium 25(2): 277–283p. Rodríguez MS, Miquelanera AM. 2005. A new species of Rineloricaria (Siluriformes: Loricariidae) from the Paraná and Uruguay River basins, Misiones, Argentina. Zootaxa 945: 1-15p. Rüdiger WS, Miura T. 2002. Spermatogenesis and its endocrine regulation. Fish Fisiology and Biochemistry. Netherlands. Kluwer Academia Publishers. No. 26, 43-56p. Selman K, Wallace R, Barr V. 1988. Oogenesis in Funulus feteroclitus V. The relationship of yolk vesicles and corical alveoli. The journal of experimental zoology. 246:42-56p. Schulz RW, Miura T. 2002. Spermatogenesis and its endocrine regulation. Fish Physiology and biochemistry. 26:43-56p. Schulz RW, França LR, Lareyre JJ. LeGac F, Chiarini.García H, Nobrega RH, Miura T. 2009. Spermatogenesis in fish. General and comparative endocrinology. Artículo en prensa. Sneed KE y Clemens HP. 1963. The morphology of the testes and accesory reproductive glands of the catfishes (Ictaluridae). Copeia. 4:606-11. Suzuki HI, Agostinho AA, Winemiller K. 2000. Relationship between oocyte morphology and reproductive strategy in Loricariid catfish of the Paraná River. Brazil. Journal of fish biology 57(3):791-807p Teugels GG. (1996). Taxonomy, phylogeny and biogeography of catfishes (Ostariophysi, Siluroidei): an overview. In The Biology and Culture of Catfishes (Legendre M. & Proteau, J.-P., eds). Aquatic Living Resources 9 (hors se´rie), 9–34. 39 Urbinati E. 2005. Bases fisiológicas de la reproducción en peces tropicales. En: Daza et al., 2005. Reproducción de peces del trópico. INCODER y Universidad Nacional de Colombia. 23-43p. Utoh T, Mikawa N, Okamura A, Yamada Y,Tanaka S, Horie N, Akazawa A y Oka HP. 2004. Ovarian morphology of the Japanese eel in Mikawa Bay. Journal of Fish Biology,64: 502-513p Vazzoler AM. 1996. Biologia da reprodução de peixe teleósteos: Teoria e práctica. Editorial da Universidade Estudual de Maringá. Marina-Paraná. Brasil. 4-8p. Veríssimo-Silveira R. 2003. Ciclo reprodutivo e cinética da espermatogênese do Dourado (Salminus maxillosus, 1849). Unpublished M. Sc. Dissertation, Universidade Estadual Paulista. Jaboticabal. 60p. Vicentini CA, Vicentini-Franceschini IB, Benetti EJ, Orsi AM. 2001. Testicular ultrastructure and morphology of the seminal pathway in Prochilodus scrofa. Wallace RA y Selman K. 1981. Cellular and dynamic aspects or oocyte growth in teleosts. American Zoologist. Vol 21(2). 325-343p. Weltzien FA,Taranger GL, Karlsen O y Norberg B. 2002. Spermatogenesis and related plasma androgen levels in Atlantic halibut (Hippoglossus hippoglossus L.). Com. Bio and Phy. 132:567-575p. Werneke CD, Sabaj MH, Lujan NK, Armbruster J. 2005. Baryancistrus demantoides and Hemiancistrus subviridis, two new uniquely colored species of catfishes from Venezuela (Siluriformes: Loricariidae). Neotropical Ichthyology, 3(4):533-542p. Winemiller Kira. 1989. Patterns of variation in life history among South American fishes in seasonal environments. Oecologia 81: 225-241p. 40