I-2.- En un recipiente cerrado y vacío de 5 litros se introducen 5,08 g
Anuncio

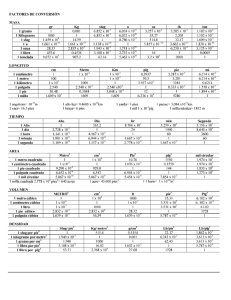
CANTABRIA / SEPTIEMBRE 00. LOGSE / QUIMICA / CINETICA Y EQUILIBRIO / OPCION I / PROBLEMA 2 I-2.- En un recipiente cerrado y vacío de 5 litros se introducen 5,08 g de yodo. Se eleva la temperatura a 900 ºC y se alcanza el equilibrio: I2 (g) • 2 I (g) El valor de Kc para este equilibrio a 900ºC es de 5,2·10-4. Calcular: a) (0,5 puntos) El valor de Kp para el equilibrio a 900ºC. b) (1 punto). El grado de disociación del yodo. c) (0,5 puntos) La presión parcial del yodo sin disociar en el equilibrio. DATOS: Masas atómicas: I = 127. R = 0,082 atm L / K mol. Solución: a) La relación entre Kc y Kp es la siguiente: Kp = Kc·(RT)∆n Sustituyendo los valores: Kc = 5,2·10-4 R = 0,082 atm·L / K·mol T = 900 + 273 = 1173 K, se obtiene: Kp = 5,2·10-4 · ( 0,082 · 1173)1 = 5,0·10-2 I2 (g) • 2 I (g) b) Equilibrio de disociación: inicialmente C0 -- se disocia αC0 -- se forma -- equilibrio C0 (1-α) 2αC0 2αC0 Aplicando la ley de acción de masas Kc = [I]2 /[I2 ] : 5,2·10-4 = (2αC0 )2 / C0 (1-α) = 4 α2 C0 / (1-α) La C0 se calcula con los datos del problema : C0 = nº moles / V(L) nº moles = m(g) / Mm = 5,08 / 254 = 0,02 moles C0 = 0,02 / 5 = 4·10-3 moles/L www.profes.net es un servicio gratuito de Ediciones SM ∆n = 2 – 1 = 1 CANTABRIA / SEPTIEMBRE 00. LOGSE / QUIMICA / CINETICA Y EQUILIBRIO / OPCION I / PROBLEMA 2 Quedando entonces: 5,2·10-4 = 4· α2 · 4·10-3 / (1-α) 5,2·10-4 - 5,2·10-4 α - 1,6·10-2 α 2 = 0 Resolviendo esta ecuación de segundo grado se obtiene el grado de disociación: α = 0,164 = 16,4 % c) Calculo de la presión parcial a partir del valor de Kp: Kp = ( Pp I)2 / Pp I2 = (PT · X I)2 / (PT · X I2) = (PT · X I2 ) / (X I2) X = fracción molar = moles de soluto / moles totales Sabiendo que α = 0,164 , C0 = 4·10-3 moles/L y V =5 L, se calcula la composición en moles: nT = (C0 (1-α) + 2αC0 ) · V = 2,33·10-2 moles n I2 = C0 (1-α) · V = 1,67·10-2 n I = 2αC0 · V = 6,56·10-3 Así las fracciones molares serán: X (I2 ) = 1,67·10-2 / 2,33·10-2 = 0,716 X (I) = 6,56·10-3 / 2,33·10-2 = 0,284 Hallamos la presión total de la mezcla gaseosa a partir de su relación con Kp: PT = Kp · X (I2 ) / X2 (I) PT = 5,0·10-2 · 0,716 / (0,284)2 = 0,443 atm De modo que la presión parcial de I2 es: Pp (I2 ) = PT · X (I2 ) = 0,443 · 0,716 = 0,317 atm. www.profes.net es un servicio gratuito de Ediciones SM