C - Universidad de Granada
Anuncio

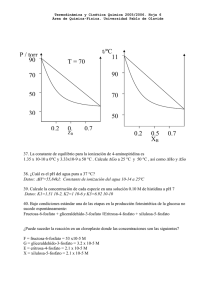
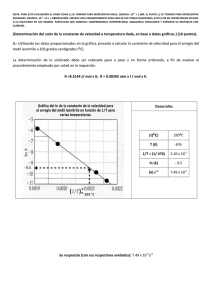
Facultad de Farmacia. Universidad de Granada Departamento de Química Física. Práctica 1 DETERMINACIÓN ESPECTROFOTOMÉTRICA DE UNA MEZCLA DE SUSTANCIAS Objetivo de la práctica: Determinar las concentraciones de vitamina B2 y B12 en una mezcla de ambas, utilizando un método espectrofotométrico. Fundamentos teóricos La ley más importante sobre la absorción de radiación electromagnética en disoluciones, es la de Beer : A=abc Siendo: P0 Ps P0= Potencia de la radiación incidente Ps= Potencia de la radiación a la salida b= espesor de la cubeta que contiene a b la muestra Ps - log — = - log T = A P0 =abc Ps / P0 = Transmitancia A = Absorbancia (adimensional) a = absortividad molar (L . mol-1. cm-1 ) c = concentración molar (moles/L) A = - log T = - log ( T.100/100) = - log T% + 2 ; A = 2 – log T% Determinación de a: 1.- Registro del espectro de la sustancia ( A frente a la longitud de onda, λ ) Longitud de onda λ (nm) 2.- Selección de la longitud de onda máxima ( λmax) en el espectrofotómetro 3.- Preparación de disoluciones patrón de concentraciones conocidas. 4.- Medida de la Absorbancia (A) de cada disolución de concentración conocida a la longitud de onda seleccionada ( λmax) Concentración Absorbancia (A) C1 A1 C2 A2 C2 A3 C3 A4 C4 A5 C5 A6 5.- Representación de A (absorbancia) frente a C (concentración). A y2 6.- Trazar la recta que mejor se ajuste a los datos experimentales. Si pasa por el origen se cumple la ley de Beer y la pendiente será a.b y1 (absortividad . espesor de la cubeta). x1 x2 C Nota: Para determinar la pendiente por el método gráfico, se toman dos puntos de la recta (no experimentales): (y2 ,x2) e (y1 , x1) y se plantea la siguiente expresión Pendiente = y2 − y1 x2 − x1 Análisis de mezclas Amezcla = Acomponente 1 + Acomponente 2+ Acomponente 3+ .... 1.- Se escogen tantas λmax como componentes tenga la mezcla. A 445 nm 550 nm Longitud de onda (nm) En nuestro caso serán dos: 445 nm (máximo de la vitamina B2) y 550 nm (máximo de la vitamina B12) 2.- Se determinan las absortividades molares de cada vitamina mediante la ley de Beer, a las 2 λmax seleccionadas: a 445 B2 445 B12 ;a a 550 B2 = 0 (No absorbe a esa λ ) ;a 550 B12 Se establece el sistema de ecuaciones: 550 mezcla A =a 550 B2 ⋅ b ⋅ cB 2 + a 550 B12 ⋅ b ⋅ cB12 = a 445 445 Amezcla = aB445 ⋅ b ⋅ c + a B2 B12 ⋅ b ⋅ c B12 2 Calculamos cB2 y cB12 550 B12 ⋅ b ⋅ cB12 Método experimental Esquema de un espectrofotómetro de haz simple. Lámpara W Rendijas Red Detector Muestra Indicador Espectrofotómetros: Spectro 23 SP-2100P+ El manejo de cada uno de ellos se indica a continuación. Manejo del SP-2100P+ Encender el espectrofotómetro pulsando el botón rojo. Seleccionar la longitud de onda mediante las flechas. El modo de medida (transmitancia o absorbancia) con el botón MODE. Abrir la tapa del portamuestras Colocar las cubetas de la referencia y la muestra en los lugares señalados. Muestra Referencia Entre R y S1 se encuentra el obturador (en esa posición intermedia, la transmitancia debe ser 0%) Cuando la radiación atraviesa la referencia, debemos ajustar al 100 %T. Para ello, pulsar el botón que indica 100%T. Tirar suavemente del mando externo Cuando la radiación incida sobre el obturador, la transmitancia debe ser del 0 %. De no ser así, la fijaremos pulsando el botón 0%T Si seguimos tirando del mando externo, la radiación incide sobre la muestra y podremos leer el valor de transmitancia. Si deseamos el valor de absorbancia, pulsaremos el botón MODE Manejo del Spectro 23 Encender el espectrofotómetro Seleccionar Absorbance pulsando A T / C F, Ajustar la longitud de onda mediante el mando adecuado. Abrir la tapa del receptáculo que contiene los portacubetas. Colocar la referencia en el camino de la radiación. Introducimos la muestra en el portacubetas adecuado. Cerrar la tapa. Pulsar en 0 de A, 100% T (corresponde a la referencia) Cuando la referencia es atravesada por la radiación, el valor de Absorbancia debe ser 0.000 Con la tapa cerrada y tirando del mando suavemente, la muestra queda colocada en la trayectoria de la radiación. Efectuar la medida de absorbancia Método experimental Partiremos de dos disoluciones de las vitaminas B2 y B12: 1º) Disolución madre (DM) de vitamina B2 que contiene 0’030 g disueltos en 1 L de agua (peso molecular de la vitamina B2 = 376’4 g/mol). 2º) Disolución madre de vitamina B12 que contiene 0’150 g disueltos en 1 L de agua (peso molecular de la vitamina B12 = 1355’4 g/mol). Material Células de vidrio de 1 cm de espesor 2 Pipetas graduadas de 10 ml Tubos de ensayo Disoluciones de Vitamina B2 y B12 1.- Registrar los espectros visibles de cada una de las disoluciones anteriores (vitamina B2 y vitamina B12) y calcular la longitud de onda a la cual presentan el máximo de absorción. λmax B2 = 445 nm λmax B12 = 550 nm 2 - Preparar 9 disoluciones de vitamina B2, tomando 1,2,3,4,5,6,7,8,9 ml de la disolución madre de vitamina B2 (0,030 g/L) completando hasta 10 ml con agua destilada. Concentración de la disolución madre (DM) de vitamina B2 : 0,030 g/L Expresada en molaridad sería: ( 0,030 g/L) / (376,4 g/mol) = 7.97 10-5 M donde 376,4 g/mol es el peso molecular de la vitamina B2 . Concentración en cada tubo: VDM . CDM = VFinal . CFinal Tubo 1 (1 mL) Î 1. 7,97 .10-5 = 10 . C1 Î C1 = 7,97 .10-6 M Tubo 1 (2 mL) Î 2. 7,97 .10-5 = 10 . C2 Î C2 = 1,59 .10-5 M Tubo 1 (3 mL) Î 3. 7,97 .10-5 = 10 . C3 Î C3 = 2,39 .10-5 M Tubo 1 (4 mL) Î 4. 7,97 .10-5 = 10 . C4 Î C4 = 3,19 .10-5 M Tubo 1 (5 mL) Î 5. 7,97 .10-5 = 10 . C5 Î C5 = 3,99 .10-5 M Tubo 1 (6 mL) Î 6. 7,97 .10-5 = 10 . C6 Î C6 = 4,78 .10-5 M Tubo 1 (7 mL) Î 7. 7,97 .10-5 = 10 . C7 Î C7 = 5,58 .10-5 M Tubo 1 (8 mL) Î 8. 7,97 .10-5 = 10 . C8 Î C8 = 6,38 .10-5 M Tubo 1 (9 mL) Î 9. 7,97 .10-5 = 10 . C9 Î C9 = 7,17 .10-5 M Es decir, basta multiplicar la concentración del tubo 1 por: 2, 3, 4, 5, 6, 7, 8 y 9. 4.- Medir la absorbancia de cada uno de estos tubos a la longitud de onda del máximo: 445 nm. La vitamina B2 no absorbe a 550 nm. Vitamina B2 c (mol/L) 7,97E-06 1,59E-05 2,39E-05 3,19E-05 3,99E-05 4,78E-05 5,58E-05 6,38E-05 7,17E-05 A(λ=445 nm) 5.- Construir una curva de calibrado para la longitud de onda de 445 nm, representando A (absorbancia) en ordenadas frente a concentración A en moles/L , en abscisas . 1,600 1,400 1,200 1,000 0,800 0,600 0,400 0,200 0,000 0,00E + 00 2,00E -05 4,00E -05 c (m o l/L ) 6,00E -05 8,00E -05 6.- Comprobar el cumplimiento de la Ley de Beer y calcular la absortividad molar de la vitamina B2 , por el método gráfico y por el método de los mínimos cuadrados, a dicha longitud de onda. a445B2 = ……….. L. mol-1.cm-1 7.- Preparar 9 disoluciones de vitamina B12, tomando 1,2,3,4,5,6,7,8,9 ml de la disolución madre (DM) de vitamina B12 (0,150 g/l) completando hasta 10 ml con agua destilada. Concentración de la disolución madre (DM) de vitamina B12 : 0,150 g/L Expresada en molaridad sería: ( 0,150 g/L) / (1355,4 g/mol) = 1,107 10-4 M donde 376,4 g/mol es el peso molecular de la vitamina B12 . Concentración en cada tubo: VDM . CDM = VFinal . CFinal Tubo 1 (1 mL) Î 1. 1,107 .10-4 = 10 . C1 Î C1 = 1,11 .10-5 M Tubo 1 (2 mL) Î 2. 1,107 .10-4 = 10 . C2 Î C2 = 2,21 .10-5 M Tubo 1 (3 mL) Î 3. 1,107 .10-4 = 10 . C3 Î C3 = 3,32 .10-5 M Tubo 1 (4 mL) Î 4. 1,107 .10-4 = 10 . C4 Î C4 = 4,43 .10-5 M Tubo 1 (5 mL) Î 5. 1,107 .10-4 = 10 . C5 Î C5 = 5,54 .10-5 M Tubo 1 (6 mL) Î 6. 1,107 .10-4 = 10 . C6 Î C6 = 6,64 .10-5 M Tubo 1 (7 mL) Î 7. 1,107 .10-4 = 10 . C7 Î C7 = 7,75 .10-5 M Tubo 1 (8 mL) Î 8. 1,107 .10-4 = 10 . C8 Î C8 = 8,86 .10-5 M Tubo 1 (9 mL) Î 9. 1,107 .10-4 = 10 . C9 Î C9 = 9,96 .10-5 M Es decir, basta multiplicar la concentración del tubo 1 por: 2, 3, 4, 5, 6, 7, 8 y 9. 8.- Mediremos las absorbancias a 445 y 550 nm de las disoluciones de B12. Vitamina B12 c (mol/L) 1,11 .10-5 2,21 .10-5 3,32 .10-5 4,43 .10-5 5,54 .10-5 6,64 .10-5 7,75 .10-5 8,86 .10-5 9,96 .10-5 A(λ=445 nm) A(λ = 550 nm) 9.- Construir las curvas de calibrado para la longitudes de onda de 445 y 550 nm, representando A (absorbancia) en ordenadas frente a concentración en moles/L , en abscisas . Vitamina B12 10.- Comprobar el cumplimiento de la Ley de Beer y calcular la absortividad molar de la vitamina B12 , por el método gráfico y por el método de los mínimos cuadrados, a las dos longitudes de onda (445 y 550 nm). a445B12 = ……….. L. mol-1.cm-1 a445B12 = ……….. L. mol-1.cm-1 Valoración simultánea de una mezcla de vitaminas B2 y B12 Mezclar x ml de vitamina B2 con y ml de vitamina B12 . Medir la absorbancia de la mezcla a las longitudes de onda de 445 nm y 550 nm. Plantear el sistema de dos ecuaciones con dos incógnitas, indicado en los fundamentos teóricos. Calcular las concentraciones de ambas vitaminas en la mezcla problema.