Ejercicio 18 - Hoja de ejercicios Teoría atómico
Anuncio

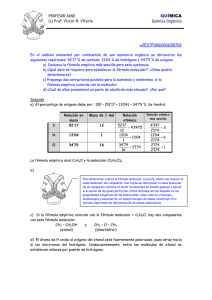
Ejercicio 18 - Hoja de ejercicios Teoría atómico-molecular. Al analizar un determinado compuesto se ha obtenido la siguiente composición centesimal: 71,8 % de cloro, 24,2 % de carbono y 4,0 % de hidrógeno. Deduce su fórmula empírica y molecular, si se sabe que al introducir 2,780 g del compuesto en un recipiente de 1 litro a una temperatura de 127 °C, la presión es de 700 mmHg. Masas atómicas(u): H = 1; C = 12; Cl = 35,5. R = 0 ,082 atm·l mol·K Para obtener la fórmula empírica se parte de la composición centesimal, cuyos porcentajes se corresponden con los gramos de cada elemento en 100 gramos de compuesto. Ordenando los datos en una tabla, para 100 g de compuesto se tiene: masa (g) número de moles Relación de moles Cl 71,8 71,8 g = 2 ,02 mol g 35,5 mol 2,02 =1 2,02 C 24,2 24,2 g = 2,02 mol g 12 mol 2,02 =1 2,02 H 4,0 4,0 g = 4 ,0 mol g 1 mol 4,0 =2 2,02 La relación de moles coincide con la relación de átomos en la molécula, por tanto, la fórmula empírica es: CH2Cl Para hallar la fórmula molecular es necesario calcular la masa molecular a partir de los datos facilitados en el enunciado y utilizando la ecuación del gas perfecto: p ⋅V = n ⋅ R ⋅ T → p ⋅V = m M ⋅ R ⋅T → M = atm⋅L ⋅ 400 K m ⋅ R ⋅ T 2,780 g ⋅ 0 ,082 mol ⋅K = = 99 1 atm p ⋅V 700 mmHg ⋅ 760 mmHg ⋅ 1 L g mol La masa molecular del compuesto es M = 99 g/mol. Como la fórmula molecular guarda la misma proporción que la empírica, se puede escribir como (CH2Cl)x y su masa molecular sería M = 49,5·x g/mol, igualándola con la calculada se puede hallar el valor de x: 49 ,5 ⋅ x = 99 → La fórmula molecular, por tanto, es C2H4Cl2 x= 99 =2 49,5