Definición de Bronsted-Lowry Acidez
Anuncio
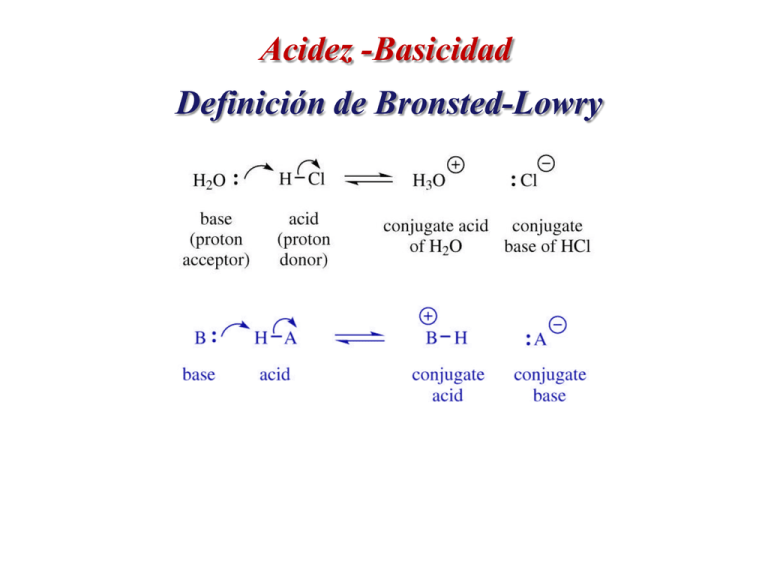
Acidez -Basicidad Definición de Bronsted-Lowry Acidez –Basicidad Definición de Lewis Acidez –Basicidad Definición de Lewis Acidez Basicidad Agua Acidez-Basicidad Fuerza ácida y pKa Factores Estructurales que afectan la Acidez Electronegatividad A lo largo de la columna en la tabla periodica, mientras se incrementa la electronegativadad A la ácidez H-A se incrementa. Factores Estructurales que afectan la Acidez Electronegatividad incrementa electronegatividad Valores pKa O CH4 >45 RCH3 45 NH3 34 RNH2 35 H2O 16 ROH 18 HF 3.5 R C CH3 20 O R C NH2 15 O R C OH 5 Factores Estructurales que afectan la Acidez Electronegatividad y Tamaño pKa Values Incremento del tamaño pKa Values HF 3.5 F– 1.36 Å H2O 16 HCl –7 Cl– 1.81 Å H2S 7 H2Se 4 H2Te 3 HBr HI –9 –10 Br– 1.95 Å I– 2.16 Å Cargas positivas o negativas están mas estabilizadas cuanto mayor se pueden dispersar en volumen grande. Factores Estructurales que afectan la Acidez Efecto Inductivo, polarización de carga trasmitida a través de los enlaces σ Grupos Atractores de densidad electrónicas Cl C F, Cl, Br, O, N Grupos dadores de de densidad electrónicas CH3 C R, CH3, B, Si Factores Estructurales que afectan la Acidez Efecto Inductivo, grupos atractores de densidad electrónica Cl O C O Factores Estructurales que afectan la Acidez Efecto Inductivo, grupos atractores de densidad electrónica La acidez se incrementa con el aumento de electronegatividad de los sustituyentes Factores Estructurales que afectan la Acidez Efecto Inductivo, grupos atractores de densidad electrónica El efecto del sustituyente electronegativo disminuye con la distancia al grupo acídico. Cl C C C O O Factores Estructurales que afectan la Acidez Efecto Inductivo Efecto inductivo de algunos grupos funcionales Grupos Atractores (-I) Grupos Dadores (+I) Otros grupos -I, en orden descendente de su poder de atracción electrónica: COOH Halógenos OR (SR) Grupos dadores de electrones por efecto inductivo (+I) Estos grupos se pueden clasificar en: Fuertemente dadores O COO Débilmente dadores (provenientes de hidrocarburos) CH3 CH3 CH3 CH2 CH3 CH Factores Estructurales que afectan la Acidez Efecto Inductivo, grupos dadores de densidad electrónica Desestabiliza la base conjugada por incremento de la densidad electrónica, da como resultados ácidos mas débiles. Factores Estructurales que afectan la Acidez Efecto Inductivo, grupos dadores de densidad electrónica Grupos alquílicos voluminosos impiden una solvatación efectiva, en las bases conjugadas Factores Estructurales que afectan la Acidez Efecto Hibridización Mientras mayor sea el % del orbital “s” mayor será su carácter acídico. La carga negativa se estabilizára mientras mas cerrca este del núcleo. Factores Estructurales que afectan la Acidez Efecto Hibridización Efecto inductivo resultante de la hibridización Factores Estructurales que afectan la Acidez Efecto Resonancia, deslocalización de la carga en A- 2.- EFECTO DE RESONANCIA (MESOMÉRICO) Involucra la deslocalización de electrones superposición con un sistema conjugado por Sistema conjugado: Sistema donde coexisten enlaces simples y dobles en forma alternada ya sea en estructuras lineales o cíclicas. R CH CH CR No son sistemas conjugados: sp3 sp3 CH2 CH CH2 CH CH2 sp3 Grupos dadores de electrones por efecto de resonancia (mesomérico) (+R) Es característico de ellos poseer un átomo con un par de electrones no compartido. Si este átomo está conjugado con el centro de reacción, cederá el par de electrones por resonancia Ejemplos .. OR .. .. NR2 .. :X .. Grupos aceptores de electrones por efecto de resonancia (mesomérico) (- R) Es característico de ellos estar compuesto por un par de átomos unidos entre sí por enlaces múltiples donde el átomo más alejado es más electronegativo Ejemplos O N O C O C R N Repaso Acidez –Basicidad Generalidad Acidez-Basicidad Fuerza ácida y pKa Valores seleccionados de pKa Repaso Significado del valor del pka ácido débil Acido Fuerte Un ácido puede ser desprotonado por una base cuyo ácido conjugado tiene una valor de pKa superior. ácido débil Acido Fuerte Dado que los valores de pKa de muchos ácidos carboxílicos están alrededor de ~5, bases que tengan ácidos conjugados con valores de pKa mayor a 5 son lo suficientemente fuerte para desprotonarlos Acidez-Basicidad Fuerza ácida y pKa Bases comúnmente usadas para desprotonar a los ácidos carboxílicos Dos estructuras de resonancia del acetato, base conjugada Increasing acid strength Strongest Acid HSbF6 (a super acid) HI H2SO4 HBr HCl C6H5SO3H (CH3)2O+H (CH3)2C=O+H CH3O+H2 H3O+ HNO3 CF3CO2H HF H2CO3 CH3CO2H CH3COCH2COCH3 NH4+ C6H5OH HCO3− CH3NH3+ H2O CH3CH2OH (CH3)3COH CH3COCH3 HC≡CH H2 NH3 CH2=CH2 Weakest Acid CH3CH3 Approximate pKa < −12 −10 −9 −9 −7 −6.5 −3.8 −2.9 −2.5 −1.74 −1.4 0.18 3.2 3.7 4.75 9.0 9.2 9.9 10.2 10.6 15.74 16 18 19.2 25 35 38 44 50 Conjugate Base SbF6− Weakest Base − I HSO4− Br− Cl− C6H5SO3− (CH3)2O (CH3)2C=O CH3OH H3O HNO3− CF3CO2− F− HCO3− CH3CO2− CH3COCH−COCH3 NH4+ C6H5O− HCO32− CH3NH3 HO− CH3CH2O− (CH3)3CO− − CH2COCH3 HC≡C− H− NH2− CH2=CH− CH3CH2− Strongest Base Increasing base strength Acid Factores Estructurales que afectan la Acidez Efecto Resonancia, H acídicos adyacentes a grupos C=O Aniones Enolatos Cualquier cosa que estabilice a la base conjugada A:¯ hace que el ácido H—A sea más acídico. Factores Estructurales que afectan la Acidez Efecto Resonancia, deslocalización de la carga en A- Efecto Resonancia anillos aromáticos Ruptura de enlace -O-H Incremento de la acidez debido a la estabilización de las bases conjugadas. pKa R OH 18 OH 10 O CH3 C O O R C OH 5 O CH3 C O Efecto Resonancia anillos aromáticos pKa 10 Efecto Resonancia anillos aromáticos Factores Estructurales que afectan la Acidez Efecto Resonancia, deslocalización de la carga en AIncrementa la acidez Incrementa la estabilidad de la base conjugada Factores Estructurales que afectan la Acidez Efecto Inductivo Incrementa la acidez Mas ácido Menos acídico Mas estable Menos estable Incrementa la estabilidad de la base conjugada Factores Estructurales que afectan la Acidez Efecto sobre anillos aromáticos sustituidos W = Grupos Atractores de electrones Depende del balance de sus efectos inductivos o de resonancia Es más ácido que el ácido benzoico W estabiliza el anion carboxilato D = Grupos Dadores de electrones Es menos ácido que el ácido benzoico D desestabiliza el anion carboxilato Factores Estructurales que afectan la Acidez Efecto sobre anillos aromáticos sustituidos D W Esto grupos hacen al Ac. Benzoico menos ácidos Esto grupos hacen al Ac. Benzoico mas ácidos Efecto Resonancia anillos aromáticos Efecto Resonancia anillos aromáticos Factores Estructurales que afectan la Acidez Efecto Inductivo Sustituyentes Halogenados Efecto inductivo del sustituyente Factores Estructurales que afectan la Acidez Efecto Inductivo ácidos hidroxi-benzoicos Factores Estructurales que afectan la Acidez Efecto Inductivo ácidos hidroxi-benzoicos Factores Estructurales que afectan la Acidez Efecto Resonancia vs. Inductivo Factores Estructurales que afectan la Acidez Efecto Inductivo sobre anillos arómaticos Basicidad Generalidad Bronsted, una base es una especie capaz de captar protones y Lewis, de ceder electrones. Una especie tendrá carácter básico si dispone de pares de electrones que pueda compartir con especies deficientes en ellos, ejemplos de potenciales bases: .. .. O (R) H H (R) H .. _ O .. : R .. NH2 R C R O CH3 .. _ CH2 Basicidad Generalidad H + - •• CH 3 - N - H ••O- H H + •• •• CH3 - N •• H- ••O- H H Methylammonium hydroxide H Methylamine + Kb = K eq [H 2 O] = - [CH 3 NH 3 ][OH ] [CH 3 NH 2 ] = 4.37 x 10 -4 Basicidad Generalidad CH 3 NH 3 + Acido conjugado + H2 O CH 3 NH 2 + Base Bases fuertes tienen valores de Ka pequeños, es decir, valores grades de pKa + H3 O Basicidad Generalidad Ka BH + H2O B Kb + H3O pKa NH3 NH4 CH3NH3 NH3 10 CH3NH2 NH2 10,6 4,6 Valores de pKa grande, base más fuerte Valores de pKa pequeños, base más débil Factores Estructurales que afectan la Basicidad Electronegatividad Factores Estructurales que afectan la Basicidad Electronegatividad pKa 9.2 -1.7 La basicidad de un compuesto es dada por el pKa de su ácido conjugado Neutro a ácido Fuertemente básico Limite de medida en agua Base superiormente fuerte Factores Estructurales que afectan la Basicidad Efecto Inductivo en fase gaseosa Mas estabilización de la carga positiva por parte de los grupos alquílicos En fase gaseosa el incremento de la basicidad posee el orden esperado, 3°>2°>1°> ion amonio Factores Estructurales que afectan la Basicidad Efecto Inductivo Estabilidad por Puentes de H del catión disminuye En solución acuosa el orden es 2°>1° >3°> ion amonio Factores Estructurales que afectan la Basicidad Efecto Inductivo Cl Cl NH2 Cl NH2 Factores Estructurales que afectan la Basicidad Efecto Hibridización sobre Nitrógeno Factores Estructurales que afectan la Basicidad Efecto Hibridización sobre Oxígeno Oxígenos protonables: alcoholes> cetonas > aldehidos Factores Estructurales que afectan la Basicidad Efecto Resonancia Átomos con pares de e- deslocalizados por resonancia, los hace menos disponibles a ser protonados, menor basicidad Factores Estructurales que afectan la Basicidad Efecto Resonancia Factores Estructurales que afectan la Basicidad Sustitución sobre la anilina NH2 NH3 + H2O G + OH G Grupos Dodores de electrones estabilizán el ion anilinium, hacen al compuesto una base más fuerte. Grupos Atractores de electrones destabilizan al ion anilinium, hacen al compuesto una base más débil. Factores Estructurales que afectan la Basicidad Sustitución sobre el anillo aromático -NH2, -NHR, -NR2 -OH -OR -NHCOCH3 -C6H5 -R -H -X -CHO, -COR -SO3H -COOH, -COOR -CN -NR3+ -NO2 Grupos Dadores Grupos Atractores Factores Estructurales que afectan la Basicidad Efecto Resonancia Grupos Atractores Factores Estructurales que afectan la Basicidad Efecto Resonancia vs Inductivo Grupos Dadores Factores Estructurales que afectan la Basicidad Aminas vs Amidas La imposibilidad de protonar al N es debido a la deslocalización del par de e- en la amida neutra El oxígeno de la amida es más básico que el agua. Factores Estructurales que afectan la Basicidad Amidinas Es entre los compuestos orgánico la base más fuerte Factores Estructurales que afectan la Basicidad Ácidos carboxílicos y Esteres Factores Estructurales que afectan la Basicidad Heterociclos nitrogenados pKa N N N H H H piperidina 11.2 pirrolidina 11.1 Es más básico que dietilamina 10.9 H H piperidina H N N En la piridina el par de electrones están sobre orbital sp2, lo que significa que los electrones están mas cercanos al nitrógeno y de allí menos disponible en comparación con la piperidina N Factores Estructurales que afectan la Basicidad Heterociclos nitrogenados Factores Estructurales que afectan la Basicidad Heterociclos nitrogenados aromáticos No ocurre, muy inestable Factores Estructurales que afectan la Basicidad Heterociclos nitrogenados aromáticos Par de electrones sobre un orbital sp2, no están involucrados en la aromaticidad del anillo. La protonación ocurre aquí Acidos y Bases Polifuncionales Acido Dibásico, posee dos grupos ionzables Acido Tribásico, posee tres grupos ionzables Acidos y Bases Polifuncionales En general la pérdida del segundo protón va a ser mucho mas difícil a partir del anión. •En la molécula sin ionizar el segundo grupo carboxílico ejerce un efecto atractor (W) que estabiliza la base conjugada. •Este efecto disminuye con el incremento de la cadena. •Una vez formado el anión carboxilato COO-, se invierte el efecto inductivo, dado que pasa a ser un grupo dador de electrones (D), lo que disminuye su fuerza como ácido. Acidos y Bases Polifuncionales Acidos y Bases Polifuncionales En general la segunda protonación va a ser mas difícil a partir del canión. •En la molécula sin protonar el segundo grupo amino ejerce un efecto dador (D) que favorece por efecto inductivo al ácido conjugado -NH3+. •Este efecto disminuye con el incremento de la cadena. •Una vez formado el catión amonio, se invierte el efecto inductivo, dado que pasa a ser un grupo atractor de electrones (W), lo que disminuye su fuerza como base. Acidos y Bases Polifuncionales Acidos y Bases Polifuncionales El opium, el latex seco de Papaver somniferum, 25% alcaloides (12-15% morfina) Contienem mas de 40 alcaloides Repaso Acidos y Bases Polifuncionales Compuestos Anfotéricos: Amino ácidos Amino ácidos aromáticos Fenilalanina Phe F Tirosina Tyr Y Triptófano Trp W Todos pueden participar en interaccionar hidrofóbicas. Tienen propiedades espectroscópicas (absorben luz ultravioleta): Trp absorbe mayormente a 280 nm, Tyr a 274 nm y Phe a 257 nm. En estudios de fluorescencia se han utilizado para estudiar cambios conformacionales y estructurales de proteínas. Valores de pKa para ácidos X-H




