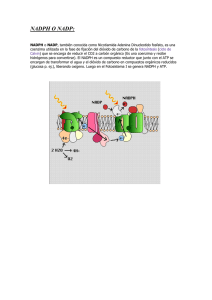
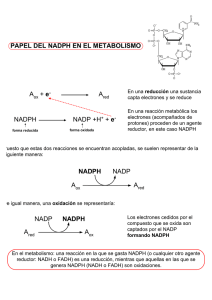
uso del cofactor enzimatico nadph en la produccion de un
Anuncio

k OFICINA ESPAÑOLA DE PATENTES Y MARCAS 19 k ES 2 055 163 kInt. Cl. : A61K 31/095 11 N.◦ de publicación: 5 51 ESPAÑA A61K 31/70 A61K 31/195 k TRADUCCION DE PATENTE EUROPEA 12 kNúmero de solicitud europea: 89890158.2 kFecha de presentación : 01.06.89 kNúmero de publicación de la solicitud: 0 345 248 kFecha de publicación de la solicitud: 06.12.89 T3 86 86 87 87 k 54 Tı́tulo: Utilización del cofactor-enzima NADPH para la preparación de un medicamento ası́ como el medicamento preparado de este modo y procedimiento para su preparación. k 73 Titular/es: Jörg Birkmayer k 72 Inventor/es: Birkmayer, Jörg k 74 Agente: Durán Moya, Luis Alfonso 30 Prioridad: 03.06.88 AT 1454/88 Schwarzspanierstrasse 15 A-1090 Wien, AT 45 Fecha de la publicación de la mención BOPI: 16.08.94 45 Fecha de la publicación del folleto de patente: 16.08.94 Aviso: k k k En el plazo de nueve meses a contar desde la fecha de publicación en el Boletı́n europeo de patentes, de la mención de concesión de la patente europea, cualquier persona podrá oponerse ante la Oficina Europea de Patentes a la patente concedida. La oposición deberá formularse por escrito y estar motivada; sólo se considerará como formulada una vez que se haya realizado el pago de la tasa de oposición (art◦ 99.1 del Convenio sobre concesión de Patentes Europeas). Venta de fascı́culos: Oficina Española de Patentes y Marcas. C/Panamá, 1 – 28036 Madrid 1 2 055 163 DESCRIPCION La presente invención se refiere a la utilización del cofactor enzimático NADPH o de una sal del mismo, para la fabricación de un medicamento para el tratamiento del sı́ndrome de Parkinson, ası́ como un medicamento para el tratamiento del sı́ndrome de Parkinson que contiene el cofactor enzimático NADPH o una sal del mismo y un procedimiento para su fabricación. La enfermedad de Parkinson se traduce en una alteración de la neurotransmisión dopaminérgica en los ganglios basales, en general como resultado de una transferencia creciente de las neuronas dopaminérgicas en primer lugar hacia la llamada substancia negra y en el proceso de la enfermedad también a otras áreas. En casos avanzados también se puede comprobar una falta creciente de Noradrenalina (por ejemplo en el Locus caeruleus). Incluso en etapas iniciales de la enfermedad se observa asimismo una disminución muy notable de la actividad tirosina-hidroxilasa, que, de forma interesante, también disminuye fuertemente en otros sistemas y órganos (por ejemplo en las cápsulas suprarrenales) (ver tabla 3 de Birkmayer und Riederer, Die Parkinson-Frankheit, 2. Aufl., S. 34, Springer Verlag Wien, 1985). 5 10 15 20 25 TABLA 3. Tirosinhidroxilasa en diferentes áreas cerebrales en el sı́ndrome de Parkinson Area cerebral N.caudatus (15) Putamen (5) S.nigra (4) L.caeruleus (4) N.ruber (5) Raphe + R.F. (4) Hypothalamus (5) C.mamillare (5) N. accumbens (5) Nebenniere (5) (Medulla) Controles E.Parkinson 27,8 ± 2,3 3,5 ± 1,0(6)∗ 16,2 ± 5,9 1,2 ± 0,4(6)∗ 19,4 ± 6,2 4,9 ± 1,8(4)∗ 3,3 ± 0,1 2,0 ± 0,6(2) 5,7 ± 1,9 2,1 ± 1,4(3) 0,9 ± 0,6 1,5 ± 0,4(5) 3,1 ± 1,0 1,5 ± 0,3(3) 0,6 ± 0,4 0,5 ± 0,9(2) 2,0 ± 0,7 2,7 ± 2,2(3) 186,2 ± 5,5 49,7 ± 12,4(4)∗ Número de pacientes dentro del paréntesis Valor medio ± sem (nmol Dopa/g-Tejido,Hora) ∗ p < 0,01 En las terapias convencionales la actividad dopaminérgica faltante o reducida se sustituye por la etapa previa de dopamina L-DOPA; al desaparecer este efecto se puede aumentar nuevamente el efecto L-DOPA por la reducción especı́fica de la enzima MAO-B que reduce la dopamina. Estas estrategias de tratamiento condujeron no obstante, a pesar de que con su aplicación la expectativa de vida de los pacientes quedó mejorada, después de algunos años de utilización, a frecuentes y graves variaciones en la movilidad previamente no predecibles (fluctuaciones, fenómenos on-off), que influyen de manera sensible en la calidad de vida del paciente. Estos efectos pueden ser suprimidos o por lo menos reducidos parcialmente por la utilización oportuna de agonistas postsinápticos tales como lisúridos. Para la reducción brusca de la movilidad se discutió por Birkmayer y Riederer, que la causa 2 30 35 40 45 50 55 60 65 2 básica consiste en un agotamiento enzimático pasajero de la tirosina-hidroxilasa (Birkmayer und Riederer, Die Parkinson-Krankheit, 2. Aufl., S. 81, Springer Verlag Wien, 1985). En realidad se puede apoyar también desde el punto de vista bioquı́mico, un aumento de la carga de la tirosinahidroxilasa por una parte, de las terapias normales . Se debe considerar que, en condiciones normales, esta enzima clave de la sı́ntesis de dopamina (y noradrenalina) es inducida de manera suficiente y posee cofactores. En la enfermedad de Parkinson pueden participar no obstante el fallo de la programación de la sı́ntesis de tirosinahidroxilasa. Investigaciones clı́nicas han revelado de manera sorprendente que también en pacientes con enfermedad de Parkinson avanzada y graves alteraciones de la movilidad la administración del cofactor enzimático NADPH (nicotinamidaadenina-fosfato dinucleótido) en forma reducida provoca una notable mejora de la movilidad. Era esencial para ello su utilización en forma reducida, puesto que el NADP se ha mostrado prácticamente sin efecto. Los resultados clı́nicos del ejemplo con dos enfermos de Parkinson se muestran en la siguiente tabla. Caso 1: Duración de la enfermedad 3 años, edad 43 años, sin terapia Primera revisión 11.05.1987, dolores desde hacı́a un año en ambos hombros y temblores en la mano izquierda, descontrol del pie izquierdo. Objetivo: al andar el pie izquierdo avanza en exceso. No es posible golpear con el brazo izquierdo hacia arriba si no está completamente estirado. Expresión verbal algo desarticulada. Sin movimientos inducidos en la parte izquierda. Diagnóstico: Hemiparkinson, incapacidad 20. Terapia: Madopar (R) 125 (= L-DOPA + Benserazid) 3 veces al dı́a Jumex (R) (= Deprenyl) 2 veces media tableta. Control 18.11.1987. Cansancio prematuro, rigidez de la mitad izquierda del cuerpo, andar dificultoso, desplazamiento del pie izquierdo. Incapacidad 40, fase off por la tarde de 2-3 horas, rigidez del lado izquierdo. NADPH 25 mg 1 vez a la semana, mejora en plazo corto, Control 23.03.1988: Hemiparkinson izquierdo, incapacidad 50, fase off diariamente 2-3 horas. Terapia: NADPH 25 mg, 2 veces por semana, Control: 10.05.1988. Capacidad de movimiento completamente normal, no se presenta rigidez ni temblores, la administración de 25 mg de NADPH 1 vez a la semana garantiza 3-5 dı́as de movilidad normal. Al cesar los efectos es suficiente un Madopar (R) 125 al dı́a. Continuación de la terapia con NADPH sin Madopar (R). Incapacidad 0, movilidad completamente normal, cansancio en la noche, movimientos lentos. Caso 2: Duración de la enfermedad 3 años, edad 58 años Traumatismo craneal practicando esquı́, 4 horas sin conocimiento (13.02.1985). Después de 3 años arrastra el pie izquierdo, expresión verbal lenta, imposibilidad salto. 3 2 055 163 Diagnóstico: Parkinson postraumático, Terapia: Madopar (R) 200/50 (= L-DOPA + Benserazid) media tableta 3 veces al dı́a, Jumex (R) (=Deprenyl) una al dı́a. Incapacidad 30 (13.02.1985) 29.01.1986 Incapacidad 15, Mejora de estado, continuación de la terapia. Control: 23.02.1988. Se sabe desde hace un año que su enfermedad progresa. Acción de andar con pasos pequeños, arrastra los pies, patada hacia arriba imposible, el salto no se levanta del suelo, habla lenta y mal articulada. RR100/80, de modo estable 90/70. Terapia: Madopar (R) 125/6 (= L-DOPA + Benserazid) diariamente, Jumex 2 veces al dı́a. Incapacidad 40. 14.4.1988 Incapacidad 40, Terapia: NADPH 25 mg, 2 veces a la semana. Incapacidad 20 después de una semana (al principio del efecto hiperquinesia durante un tiempo reducido. Interrupción del tratamiento con Madopar (R), después de 3 semanas, incapacidad 15 (ligera debilidad al andar intensamente). Después de continuar con estas inyecciones el efecto se prolonga, toma 2 Madopar (R) 125 (= L-DOPA + Benserazid) diariamente y 2 veces a la semana NADPH 25 mg. Los datos de los pacientes muestran que la toma de NADPH o de una sal del mismo lleva a una notable mejora de la incapacidad. Esto se comprueba tanto en la fase on como en la fase off y se consigue tanto por la administración simultánea de preparados standard como sin administración simultánea de medicamentos conocidos contra el Parkinson. Con la medicación según la presente invención se consigue acortar la fase off. Para la utilización según la presente invención se puede preparar el cofactor enzimático NADPH o una sal aceptable fisiológicamente del mismo de manera habitual con substancias auxiliares o 5 10 15 20 25 30 35 40 4 de soporte aceptables farmacéuticamente. En caso deseado el NADPH se puede utilizar asimismo en combinación con otras substancias, por ejemplo dopaminagonistas postsinápticos tal como Lisurid o Amorfina. Se muestra especialmente eficaz la administración simultánea de compuestos orgánicos de selenio monosubstituı́dos tales como aminoácidos de selenio, proteı́nas de selenio y polipéptidos de selenio, de manera que se observó un efecto sinérgico cuyo efecto sobrepasó al de la administración aislada de compuestos orgánicos de selenio monosubstituı́dos y NADPH. Para su utilización como medicamento, el NADPH puede ser preparado en las formas de administración galénicas habituales para la vı́a oral, parenteral (tal como intravenosa o subcutánea) o sublingual. Los preparados pueden adoptar forma sólida tal como tabletas, cápsulas, grajeas o bien forma lı́quida tal como soluciones suspensiones, sprays o emulsiones, ası́ como formas de administración con efecto de emisión prolongado. Para la mejora de la motoricidad en pacientes con enfermedad de Parkinson, la dosis individual para aplicaciones parenterales se encuentra entre 5 y 500 mg, preferentemente entre 25 y 100 mg y la dosis diaria entre 5 y 1500 mg, preferentemente entre 25 y 300 mg. Las dosis orales pueden encontrarse dentro de la misma gama de cantidades de substancia activa que en la utilización parenteral o en caso deseado hasta 1000 % más elevadas. En caso de que el cofactor enzimático NADPH adopte forma de una sal fisiológicamente admisible son adecuados para ello todos los ácidos y generadores de sales básicas de tipo conocido, tales como ácidos orgánicos e inorgánicos, tales como ácido clorhı́drico, ácido sulfúrico, ácido cı́trico, ácido maléico e hidróxidos de metales alcalinos y alcalinotérreos y sus sales. 45 50 55 60 65 3 5 2 055 163 REIVINDICACIONES 1. Procedimiento para la fabricación de un medicamento para el tratamiento del sı́ndrome de Parkinson que contiene el cofactor enzimático NADPH o una sal del mismo ası́ como, en caso deseado, compuestos orgánicos de selenio monosubstituı́do, caracterizado porque el cofactor enzimático NADPH o una sal del mismo, ası́ como en caso deseado componentes orgánicos de selenio monosubstituı́dos, tales como aminoácidos de 5 10 6 selenio, proteı́nas de selenio y polipéptidos de selenio tales como, por ejemplo, selenio metionina, selenio cisteı́na, selenio tirosina o similares son llevados, con las apropiadas substancias vehı́culo, auxiliares y/o aditivos a una forma apropiada de administración. 2. Procedimiento según la reivindicación 1, caracterizado porque se utiliza el NADPH en cantidades comprendidas entre 5 y 500 mg, preferentemente entre 25 y 100 mg por unidad de administración. 15 20 25 30 35 40 45 50 55 60 NOTA INFORMATIVA: Conforme a la reserva del art. 167.2 del Convenio de Patentes Europeas (CPE) y a la Disposición Transitoria del RD 2424/1986, de 10 de octubre, relativo a la aplicación del Convenio de Patente Europea, las patentes europeas que designen a España y solicitadas antes del 7-10-1992, no producirán ningún efecto en España en la medida en que confieran protección a productos quı́micos y farmacéuticos como tales. 65 Esta información no prejuzga que la patente esté o no incluı́da en la mencionada reserva. 4