1. Anatomía quirúrgica para estrabología
Anuncio

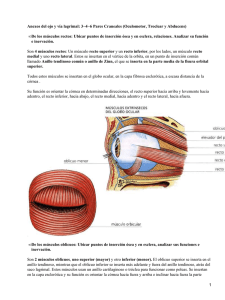
CAPÍTULO 3. TRATAMIENTO QUIRÚRGICO 3 1. Anatomía quirúrgica para estrabología Manuel Romera Becerro, Javier Puig Galy Buena parte del éxito de la cirugía estrabológica pasa por el conocimiento de los tejidos involucrados, las relaciones de los músculos oculares, las características de trayecto e inserción de cada uno de estos músculos, la delicada manipulación de la conjuntiva, la disección limpia de las fascias tenonianas, etc. En este capítulo revisaremos los puntos anatómicos que debe conocer el cirujano que aborda una intervención de estrabismo. CONJUNTIVA Prácticamente todos los procedimientos quirúrgicos estrabológicos se realizan a través de abordajes transconjuntivales (1). Esta primera membrana se extiende por toda la superficie ocular, tanto bulbar (excepto la córnea) como por la cara interna de los párpados. La conjuntiva está formada por dos capas: el epitelio y la lámina propia. El epitelio es plano estratificado no queratinizado en la conjuntiva bulbar, y se transforma en epitelio cúbico o columnar estratificado al acercarse a los fórnices; en la conjuntiva palpebral vuelve a ser escamoso y pasa a queratinizarse en la unión mucocutánea del borde palpebral. El epitelio conjuntival presenta abundantes células caliciformes mucosecretoras. La lámina propia es un tejido conectivo laxo, a través del cual discurren los vasos conjuntivales, y que está en relación con la cápsula de Tenon (2). Los siguientes son los hitos anatómicos de la conjuntiva que deben tenerse presentes: a) Limbo: Zona de transición entre la conjuntiva y la córnea. La importancia del limbo radica en ser el asiento de las células progenitoras del epitelio corneal y en ser la barrera para la vascularización de la córnea, por lo que daños a este nivel se pueden traducir en conjuntivalización corneal o defectos epiteliales persistentes (2). Por tanto, debe respetarse el limbo cuando se realicen incisiones conjuntivales circunferenciales (1). b) Pliegue semilunar y carúncula: En el extremo nasal de la conjuntiva se observa un engrosamiento en forma de media luna con la concavidad hacia fuera, denominado pliegue semilunar y considera- Figura 1: Pliegue semilunar y carúncula. do un vestigio de la membrana nictitante (2). Este pliegue está recubierto por epitelio conjuntival, su estroma está muy vascularizado y presenta adipocitos y fibras musculares lisas. La carúncula se ubica medial al pliegue semilunar y muestra características tanto mucosas como cutáneas: tiene epitelio no queratinizado y glándulas lacrimales accesorias, pero también folículos pilosos y glándulas sebáceas (2). Conviene respetar el pliegue semilunar en las incisiones de acceso al recto medial para evitar desplazamientos del pliegue y formación de pseudopterigión o cicatrices que limiten la abducción (1,3). La carúncula, en cambio, es un punto de entrada para abordajes de la pared medial orbitaria. c) Fórnix conjuntival: La conjuntiva redunda lo suficiente como para permitir el libre movimiento del globo ocular. El fórnix es el fondo de saco donde la conjuntiva bulbar se repliega para cubrir la superficie interna del párpado. La conjuntiva del fornix no está libre, pues el tejido redundante abultaría y se plegaría irregularmente con los movimientos oculares; para evitarlo, los fondos de saco tienen adherencias con las prolongaciones fasciales de los músculos rectos, con el elevador del párpado superior y con la fascia cápsulopalpebral del párpado inferior, de manera que el fórnix acompaña al globo ocular en sus movimientos (2). El fórnix superior es el más profundo, seguido del inferior, mientras que el fórnix lateral tiene poca profundidad y es inexistente a nivel medial, donde se halla el pliegue semilunar. Los fondos de saco pueden perder pro- 58 Figura 2: Relaciones anatómicas de la conjuntiva y la cápsula de Tenon con el resto de las estructuras oculares. La conjuntiva está representada en color verde y la cápsula de tenon en azul. fundidad u obliterarse debido a la formación de un simbléfaron, por ejemplo en casos de penfigoide o causticaciones (2); pudiendo limitar la motilidad del globo ocular o el correcto cierre de los párpados. ESCLERA Esta túnica fibrosa proporciona el principal soporte estructural al globo ocular. La esclera está formada por tejido conectivo denso, principalmente por haces de colágeno tipo I, escasos fibroblastos y fibras elásticas, y una matriz extracelular de proteoglicanos. A diferencia de la córnea, la esclera carece de transparencia por la disposición desordenada de sus fibras colágenas y por la menor hidratación del tejido. Los haces de colágeno superficiales se disponen en capas mientras que los haces más profundos se entrecruzan en todas las direcciones. La orientación de las fibras superficiales tiende a ser circunferencial alrededor de la córnea y el nervio óptico, y longitudinal en la porción ecuatorial del globo. Las fibras de los tendones de los músculos oculares se entrecruzan con las capas superficiales de la esclera (2). El grosor escleral es variable según la localización. En su porción anterior el grosor es de 550 micras, similar al espesor corneal. Llega a un grosor mínimo de 300-390 micras justo por detrás de la inserción de los músculos rectos. En el polo posterior la esclera tiene alrededor de 1 mm de grosor. Estado actual del tratamiento del estrabismo La delgadez escleral detrás de las inserciones musculares es un importante dato quirúrgico, pues es en esta zona donde se reinsertan los músculos durante los retrocesos, y se debe cuidar de no perforar más allá de la esclera (2). Otras condiciones donde la esclera puede ser especialmente delgada son la miopía magna, la osteogénesis imperfecta y otros trastornos de síntesis del colágeno, los estafilomas, el buftalmos y la escleromalacia (2). La esclera es un tejido eminentemente avascular, excepto en la episclera, una capa de tejido conectivo laxo ubicada por delante de las inserciones de los rectos, entre la cápsula de Tenon y la esclera, donde se forma un plexo vascular por la ramificación de los vasos ciliares largos anteriores. Dicho plexo discurre por la episclera hasta el limbo y numerosas ramas penetran la esclera para alcanzar el interior del globo. La dilatación de este plexo durante las uveítis anteriores origina la inyección ciliar (2). CÁPSULA DE TENON, POLEAS Y APARATO SUSPENSOR DEL GLOBO La cápsula de Tenon o fascia bulbar es una lámina de tejido conectivo denso que envuelve el globo ocular a modo de bolsa, en la cual el ojo puede girar con facilidad, actuando a modo de membrana serosa, aunque sin serlo anatómicamente. Está conectada por expansiones fasciales con los músculos oculares, los ligamentos suspensores y las paredes orbitarias (fig. 2). El conjunto de estas estructuras forma el aparato suspensor del globo, encargado de mantener el ojo centrado en la órbita y evitar el deslizamiento lateral de los músculos durante los movimientos de rotación ocular (4). El conocimiento de estas estructuras es imprescindible para la comprensión de numerosos tipos de estrabismo, así como para la correcta disección durante la cirugía estrabológica y orbitaria (3). a) Cápsula de Tenon (CT): Envuelve el globo ocular desde el limbo corneal hasta la salida del nervio óptico. La entrada de los músculos rectos en la CT divide a esta última en una porción anterior y otra posterior (2,4). La nomenclatura se presta a confusión entre los autores, ya que mientras unos consideran que el desdoblamiento de la CT que envuelve los músculos corresponde a la parte posterior de la CT anterior, otros directamente la consideran CT posterior. Aquí optamos por la primera opción, ya que el origen embriológico de la porción anterior, incluyendo las vainas musculares, es diferente al de la CT posterior. 1) La porción anterior se inicia en el limbo, donde está fusionada con la conjuntiva y el tejido epies- 3.1. Anatomía quirúrgica para estrabología cleral en sus primeros 2-3 mm y firmemente adherida al limbo. A partir de aquí la Tenon es fácilmente disecable de la conjuntiva suprayacente y de la esclera subyacente, de las que está separada por tejido conectivo laxo. El segmento posterior de la CT anterior está perforada por la entrada de los músculos rectos y oblicuos (5). A este nivel la CT se une con las vainas en forma de manguito que envuelven los tendones musculares, como se verá más adelante (4). El común de las intervenciones estrabológicas se practica en el espacio subtenoniano anterior. La disección excesiva de la Tenon o su apertura periférica permiten la herniación de la grasa extraconal, dificultando la cirugía y favoreciendo los síndromes adherenciales (1). 2) La porción posterior de la CT se extiende desde detrás de la entrada de los rectos hasta la emergencia del nervio óptico, donde se fusiona con la vaina del mismo (4). La CT posterior separa la grasa orbitaria intraconal del globo ocular y es perforada por las venas vorticosas y los vasos y nervios ciliares posteriores (2,5). El espacio de Tenon, situado entre la cápsula y la esclera, tiene continuidad alrededor de todo el globo ocular, siendo fácil de separar y de infiltrar con fármacos, que difunden por todo ese espacio periocular. La CT compartimenta el espacio orbitario ocupado por el ojo, de modo que dificulta la extensión de procesos infecciosos entre la órbita y el globo ocular (4,5). b) Vainas musculares y ligamento intermuscular: La porción anterior de los músculos oculares extrínsecos y sus tendones están recubiertos por unas extensiones de la cápsula de Tenon que forma las vainas musculares, las cuales están laxamente adheridas al cuerpo muscular. Hacia atrás las vainas se continúan con el epimisio de los músculos que recubre los vientres hasta sus inserciones posteriores. Las vainas están más desarrolladas en los músculos rectos que en los oblicuos (4). De los bordes laterales de las vainas de los rectos salen unas expansiones fasciales que unen a los cuatro músculos rectos y que se denominan ligamento o fascia intermuscular (figs. 3, 4 y 5). Este ligamento forma una banda circunferencial desde el nivel de inserción de los rectos hasta un poco detrás del ecuador ocular, donde los rectos perforan la CT. El ligamento intermuscular se relaciona externamente con la CT anterior que lo cubre, e internamente con la esclera. En su trayecto extratenoniano los rectos también presentan tractos fasciales intermusculares que forman un septum incompleto, que en ningún caso cierra ni separa los espacios intra y extraconal (4). Durante la disección quirúrgica de los músculos rectos las aletas laterales del ligamento intermuscu- 59 Figura 3: Fascia intermuscular uniendo los músculos rectos. Figura 4: Se observan las expansiones de tejido conjuntivo fibroso que parten de los bordes laterales de los músculos rectos para unirse con el contiguo formando la fascia intermuscular. Figura 5: Disección quirúrgica del músculo recto superior en la que se aprecian las aletas laterales que parten del mismo. 60 lar correspondiente al músculo intervenido deben ser seccionadas para individualizarlo correctamente. Sin embargo, es recomendable mantener indemnes las vainas musculares, ya que esto previene hemorragias intraoperatorias o hematomas de la vaina por rotura de las arterias ciliares largas anteriores, y evita adherencias postoperatorias indeseables (3). c) Poleas musculares: Uno de los avances más recientes en el campo de la cinemática ocular ha sido la caracterización de las poleas de los músculos oculares extrínsecos. Una polea es una estructura anatómica que desvía la trayectoria del músculo y actúa como una inserción funcional (6). El ejemplo más claro es la tróclea del oblicuo superior, a través de la cual se refleja su tendón y cambia el vector de tracción del mismo. Los demás músculos extraoculares también poseen sus propias poleas, pero no tienen una anatomía tan definida como la tróclea (7,8). Las poleas son tractos de tejido conectivo que conectan las vainas de los músculos con las paredes orbitarias, fijando un punto de inflexión en el trayecto del vientre muscular (6). En los músculos rectos este punto de inflexión se ubica a 6-10 mm. por detrás del ecuador ocular, aproximadamente a nivel de la unión de los tercios posterior y medio del globo. Aquí la polea forma un anillo fibroso a través del cual el músculo puede deslizarse durante la contracción y la relajación. A partir de este anillo las poleas de los rectos se dirigen hacia adelante y hacia las paredes orbitarias, donde se insertan cerca del reborde y participan en la formación de varios ligamentos orbitarios (7,8), tal como se describe más adelante. La fijación del vientre muscular a nivel de la polea evita el deslizamiento lateral de los músculos dentro de la órbita, como se ha demostrado en estudios por resonancia magnética en posiciones secundaria y terciaria de la mirada, y en casos de transposición quirúrgica de los músculos rectos (2,9). Las poleas son esencialmente tractos colágenos, pero también contienen abundantes fibras elásticas y células de músculo liso inervadas por el sistema autónomo (8). La flexibilidad de las poleas, que pueden desplazarse hacia atrás y hacia adelante, así como la presencia de músculo liso, hacen suponer que no se trata de estructuras estáticas sino que pueden cambiar su posición activamente (6,7). Esta teoría de poleas activas, expuesta por Miller (10) y Demer (11), explica una serie de peculiaridades cinemáticas de los globos oculares (12,13), especialmente en movimientos hacia posiciones terciarias, que hasta ahora no tenían explicación convincente (13,14). Asimismo, la malposición o debilidad de las poleas musculares puede explicar ciertos tipos de estrabis- Estado actual del tratamiento del estrabismo mo, como los síndromes alfabéticos o el estrabismo asociado a la miopía magna (6,13). d) Ligamentos orbitarios: La grasa orbitaria está cruzada por numerosos tractos y desdoblamientos fasciales que conectan entre sí la cápsula de Tenon, los músculos extraoculares, los fondos de saco conjuntival, los retractores de los párpados y las paredes orbitarias. Algunos de estos tractos constituyen ligamentos bien definidos (4): 1) Ligamentos orbitarios laterales o retináculos laterales: Son condensaciones fibrosas en las paredes orbitarias medial y lateral. El retináculo medial está formado por la polea del recto medial y fibras adheridas a su vaina que convergen en forma de abanico para insertarse en la cresta lacrimal posterior junto al tendón del ligamento cantal medial de los párpados; este ligamento emite una expansión fascial importante hacia el tendón del oblicuo superior y al complejo recto superior/elevador, y otra expansión más débil hacia el complejo oblicuo inferior/recto inferior. El retináculo lateral incluye la polea del recto lateral y adherencias de su vaina que convergen para insertarse en el tubérculo de Withnall del cigomático, junto al tendón cantal lateral palpebral; el retináculo lateral tiene inserciones en el fondo de saco conjuntival lateral y emite expansiones débiles hacia el recto superior y el complejo oblicuo inferior/recto inferior (2). 2) Ligamento de Lockwood: Es un tracto fibroso en forma de hamaca ubicado debajo del globo ocular. Está formado por la polea y las vainas compartidas por el recto inferior y el oblicuo inferior (15), la fascia cápsulo-palpebral [lámina que conecta las vainas del oblicuo y recto inferiores con el borde del tarso inferior, y que actúa como retractor del párpado inferior (16)] y las expansiones laterales que se fijan a las paredes orbitarias medial y lateral, cerca de los retináculos laterales. Este complejo ligamentoso participa activamente en la dinámica palpebral durante la mirada hacia abajo (2,4). 3) Ligamento de Withnall: Es una banda horizontal de tejido conectivo denso que va desde la tróclea hasta el desdoblamiento perióstico que envuelve la glándula lacrimal. Este ligamento funciona como polea para la aponeurosis del músculo elevador. MÚSCULOS OCULARES EXTRÍNSECOS La musculatura ocular presenta diversas peculiaridades en cuanto a estructura, inervación y función que los diferencia del resto de los músculos estriados del cuerpo y que se ajustan a la complejidad del sistema oculomotor. 3.1. Anatomía quirúrgica para estrabología Generalidades: Los músculos oculares extrínsecos se disponen en tres pares, dos rectos horizontales (RM y RL), dos rectos verticales (RS y RI) y dos oblicuos (OS y OI). Cada pareja produce rotación en cada uno de los tres ejes de Fick(2,4,17,18). Las inserciones musculares en el vértice orbitario forman un anillo de tejido conectivo denso muy resistente y firmemente adherido al hueso, llamado anillo de Zinn, ubicado por delante del canal óptico y del tercio medial de la hendidura esfenoidal. El anillo de Zinn presenta un brazo superior, del que nacen el recto superior y el elevador del párpado, y un brazo inferior donde se origina el recto inferior; el origen del recto medial cierra nasalmente el anillo, mientras que el recto lateral nace por dos cabezas del extremo lateral de los brazos del anillo (2,4). El tejido del anillo de Zinn se fusiona parcialmente con las meninges de la vaina del nervio óptico, lo que explica que en casos de neuritis óptica retrobulbar el dolor aumente con los movimientos oculares (2). Los vientres musculares de los cuatro músculos rectos tienen una longitud de unos 40 mm pero la longitud de sus tendones y el grosor muscular varían ampliamente (1). Desde su origen los músculos rectos siguen una trayectoria divergente hacia adelante, paralelos a sus respectivas paredes orbitarias; al llegar a las poleas (a nivel de la unión de los tercios posterior y medio del globo) se curvan hacia el ojo y penetran la Tenon justo detrás del ecuador ocular (2,4). La línea de inserción de los rectos en la esclera describe una convexidad dirigida hacia la córnea (aunque también puede ser recta o incluso cóncava). La distancia desde el limbo es diferente para la inserción de cada músculo recto: el RM es el más cercano, a unos 5,5 mm del limbo, le sigue el RI a 6,5 mm, el RL a 7 mm y el RS, el más alejado, a unos 7,9 mm (2,4). Esta distancia progresivamente mayor de las inserciones de los rectos dibuja una línea espiral, llamada espiral de Tillaux (2,4). Los valores antes mencionados son promedios y, aunque varían entre individuos, siempre se mantiene la distribución espiral. La inserción anterior de los rectos transluce parcialmente bajo la conjuntiva, lo que ayuda a su localización (1). Por su parte, los dos músculos oblicuos alcanzan el globo desde la pared orbitaria medial, el OS tras reflejarse en la tróclea y el inferior directamente desde su inserción anatómica. Penetran la cápsula de Tenon por delante del ecuador del globo, pero se insertan por detrás del mismo. Estructura de los músculos oculares: El estudio histológico muestra grandes diferencias entre los 61 Figura 6: Esquema de los elementos integrantes del anillo de Zinn y de las estructuras que lo atraviesan. músculos extraoculares y el común de los músculos estriados del organismo. En primer lugar, las fibras de los músculos extraoculares son mucho más finas que las del músculo esquelético (9-17 mm vs 90-100 mm) (19). En segundo lugar, los músculos oculares presentan dos tipos de fibras musculares, unas de contracción rápida y otras de contracción lenta (2). Las de contracción rápida tienen una ultraestructura similar a la del músculo estriado con- Figura 7: Posición relativa de las inserciones de los músculos rectos respecto al limbo, constituyendo la espiral de Tillaux. 62 vencional, con sarcómeras y miofibrillas bien organizadas (disposición llamada Fibrillenstruktur), en contraste con las de contracción lenta, que presentan una estriación irregular, miofibrillas menos estructuradas y un pobre desarrollo del retículo sarcoplásmico (disposición llamada Felderstruktur). La inervación de ambos tipos de fibras es diferente: las de contracción rápida tienen un único punto de inervación a través de un axón mielinizado y una placa motora convencional, mientras las de contracción lenta están multi-inervadas, con axones finos no mielinizados y terminaciones neuromusculares en forma de racimo. Esta mezcla de miocitos tipo Fibrillenstruktur y Felderstruktur se observa en los músculos de anfibios y aves, pero en los mamíferos es exclusiva de la musculatura extraocular (19). Los campos de inervación son significativamente más pequeños en los músculos oculares (relación de fibra nerviosa/muscular de 1:1 a 1:12) respecto al músculo esquelético (relación de 1:100 a 1:300). Esto influye en la extrema rapidez y precisión de los movimientos oculares. Se asume que las fibras de contracción rápida son las responsables de los movimientos sacádicos, mientras que las de contracción lenta participan en los movimientos lentos y de mantenimiento de la fijación (19). La información propioceptiva de los músculos oculares proviene de husos neuromusculares y de órganos tendinosos de Golgi, aunque la relevancia de la propiocepción no está dilucidada, ya que la coordinación del movimiento ocular se basa más en la información visual que en la propioceptiva (12). En cualquier caso, estos órganos propioceptivos son más numerosos en el extremo distal de los músculos, precisamente la zona manipulada en la cirugía estrabológica, cuyo daño puede ser responsable de desequilibrios musculares en el postoperatorio inmediato (19). El vientre muscular de los músculos oculares presenta dos capas: una externa, adyacente a las paredes orbitarias, llamada lámina orbitaria (LO), y otra capa interna orientada hacia el eje orbitario, la lámina bulbar (LB). Las fibras de la LB se extienden desde la inserción ósea hasta la inserción escleral, mientras que las fibras de la LO sólo llegan hasta la polea de cada músculo. El 10% de las fibras de la LB y el 20% de la LO corresponde a fibras lentas multi-inervadas. Se considera que la LB es la principal responsable del movimiento del globo, mientras que la LO participa en los cambios de posición de las poleas y en el mantenimiento tónico de la posición ocular (19). Rectos horizontales: Tanto el RM como el RL se ubican, en condiciones normales, en el plano del meridiano horizontal del globo y sus insercio- Estado actual del tratamiento del estrabismo nes quedan simétricamente bisecadas por dicho meridiano. Los rectos horizontales tienen básicamente acción en el plano horizontal: el RM es aductor puro y el RL abductor puro y, aunque sus acciones secundarias no son relevantes, ambos rectos son discretamente elevadores si el ojo está en supraducción y depresores si está en infraducción. Este efecto tiene utilidad quirúrgica, pues desplazando hacia arriba la inserción de un recto horizontal se aumenta su acción elevadora, e insertándolo más abajo aumenta su acción depresora, lo que puede ayudar en la corrección de patrones alfabéticos (1,3). El RM es el músculo de mayor diámetro y masa de todos los extraoculares, probablemente por tener un efecto tónico constante durante la convergencia. Su inserción escleral mide unos 11 mm de ancho y la longitud de su tendón es de 4 mm, la más corta entre los músculos rectos. También su arco de contacto es el más corto, de unos 6 mm. El RM es el más anterior respecto al limbo (5,5 mm) (1,4). Puede resultar dañado durante intervenciones de la superficie ocular, especialmente en cirugía de pterigión (1). La vaina muscular del RM es la única entre los cuatro rectos que carece de expansiones fasciales que anclen el recto a un músculo oblicuo (20); esta soledad del RM lo convierte en el músculo con más posibilidades de ser perdido durante la cirugía y más difícil de recuperar, pues se retrae hacia el fondo orbitario (1). El RL presenta el tendón y el arco de contacto más largos entre los rectos, 8 y 10 mm respectivamente. La inserción del RL mide 10 mm de ancho y está a unos 7 mm del limbo (1,2,4). La vaina del RL tiene adherencia con la del OI que le cruza por debajo (fig. 8); si se pierde el RL durante una cirugía es factible recuperarlo traccionando hacia adelante del OI (1). Rectos verticales: El RS y el RI tienen ambos una inclinación con respecto al eje visual en posición primaria de unos 23°. Ello hace que, aparte de su acción primaria en el eje vertical, los rectos verticales tengan acción torsora y sobre el plano horizontal. La inserción de los rectos verticales no es paralela al limbo, sino que se insertan de forma inclinada, quedando el extremo temporal de los rectos más alejado del limbo que el extremo medial. Ambos rectos verticales tienen estrecha relación con el oblicuo y el párpado correspondiente. El RS es primariamente elevador del globo, pero secundariamente es aductor y terciariamente inciclotorsor. La inserción del RS es la más alejada del limbo, a unos 7,7-8 mm, tiene un ancho de 11,5 mm y un arco de contacto de 6,5 mm (1,2,4). Se relaciona por arriba con el músculo elevador del párpado su- 3.1. Anatomía quirúrgica para estrabología 63 Figura 8: Disección intraoperatoria del recto lateral izquierdo, que discurre por encima de la inserción del oblicuo inferior. perior y por abajo con el tendón del músculo OS, con quienes comparte expansiones fasciales (fig. 10). La polea del RS comparte estructura y función con el ligamento de Withnall, y envía expansiones al fondo de saco conjuntival superior, de manera que se coordinan los movimientos de elevación del ojo y del párpado (2,4). El retroceso quirúrgico del RS puede inducir retracción del párpado superior si no se disecan las adherencias fasciales con el músculo elevador. También es recomendable identificar el tendón del OS durante las intervenciones sobre el RS (1) (fig. 9). El RI es depresor del globo (primario), aductor (secundario) y exciclotorsor (terciario). Se inserta a 6,5 mm del limbo, su tendón tiene una longitud de 7 mm y un ancho de 10,5 mm. Su arco de contacto es de 7 mm (1,2,4). El RI tiene una relación muy cercana con el OI a través de la vaina muscular y la polea que comparten, que son elementos del ligamento de Lockwood (4). Esto permite recuperar un RI deslizado mediante tracción anterior sobre el OI (1). Asimismo, la vaina del RI emite la fascia cápsulo-palpebral que se inserta en el tarso inferior, Figura 10: Vista superior de la cavidad orbitaria que muestra la posición de los músculos extraoculares y sus inserciones en el globo ocular. y expansiones al fondo de saco conjuntival inferior, para coordinar la retracción del párpado inferior en la mirada hacia abajo. La disección del RI durante su retroceso debe ser cuidadosa, para minimizar la retracción del párpado inferior, frecuente complicación debida a la persistencia de adherencias con los retractores palpebrales no liberadas durante la intervención (1,3). Del mismo modo, los cirujanos estrabológicos deben tener en cuenta la posibilidad de encontrar diferencias considerables entre los patrones insercionales de los músculos rectos del ojo derecho y del izquierdo, sobre todo al realizar retrocesos bilaterales (21,22). Músculos oblicuos: Tanto el OS como el OI se insertan en el globo detrás del ecuador y con un ángulo Figura 9: Recto superior de ojo izquierdo (visión del cirujano). Se observa la inserción del oblicuo superior en forma de abanico en el lado temporal en la parte inferior de la imagen. Apenas perceptible en A. Se coge con un gancho en B. Se observa la inserción escleral y cómo pasa por debajo del recto superior para dirigirse hacia la tróclea en C. 64 de 51° respecto al eje visual en PPM. Ello confiere a los oblicuos una acción eminentemente torsora, aunque también tienen acciones secundarias y terciarias. Ambos oblicuos alcanzan el globo pasando bajo la cara inferior de su respectivo músculo recto (fig. 11). El OS nace en el vértice orbitario, donde se inserta en el ala menor del esfenoides, superonasalmente al anillo de Zinn. Desde allí se dirige por el ángulo nasal superior de la órbita hasta alcanzar la tróclea, que es una fuerte polea ubicada en la fosa troclear del hueso frontal, justo detrás del reborde orbitario. La tróclea es una estructura compleja, formada por un anillo de tejido conectivo denso y cartílago, de 4-6 mm, firmemente insertado en el hueso. No se limita a dejar correr libremente el tendón del OS a través del anillo, sino que las fibras del tendón presentan un movimiento «telescópico», desplazándose más las centrales que las periféricas durante la excursión del mismo. El OS tiene el vientre muscular más corto de todos los músculos extraoculares, sólo 32 mm, pero tiene la longitud total más larga, a expensas de un tendón de unos 26 mm que se inicia unos 10 mm detrás de la tróclea (1,2,4). El tendón se dirige al globo en forma de abanico, para insertarse en el cuadrante superior-temporal-posterior del globo (figs. 12 y 13). En esta amplia inserción hay que distinguir un tercio anterior, donde las fibras son paralelas al ecuador y son las responsables del efector inciclotorsor del OS, y los dos tercios posteriores de la inserción, donde las fibras tendinosas son oblicuas y tienen efecto depresor y abductor sobre el globo (23). Unas u otras Figura 11: Localización anatómica de la inserción de ambos músculos oblicuos del ojo derecho: el OS tras pasar entre el RS y el globo ocular, y el OI tras hacerlo por debajo del RI. De manera que el recto inferior queda entre la esclera y el oblicuo inferior. Estado actual del tratamiento del estrabismo Figura 12: Relación entre la inserción del músculo oblicuo superior derecho, las venas vorticosas superiores y las inserciones de los músculos rectos horizontales y superior. fibras del tendón del OS pueden modificarse quirúrgicamente por separado, según se desee actuar sobre el elemento torsor o el depresor (1). El ancho del tendón del OS y su distancia respecto a la inserción del RS es variable, por lo que se recomienda la identificación quirúrgica cuidadosa de las estructuras. En general el tendón del OS está a 3-4,5 mm por detrás del borde temporal del RS y se extiende hasta unos 6,5 mm por encima del nervio óptico (4,23). El OI es el único músculo ocular que nace en la órbita anterior. Su origen está en el hueso maxilar, justo lateral al ostium del conducto lacrimonasal. Se dirige hacia fuera y hacia atrás, pasando entre los paquetes adiposos medial y central del párpado inferior (aquí es susceptible de lesión durante blefaroplastias inferiores). Posteriormente su vaina se une con la del RI y el ligamento de Lockwood, tal y como se describe previamente (15). El trayecto del OI termina en el cuadrante posterior-inferiortemporal del globo, justo temporal al área macular. Su inserción escleral con frecuencia es bífida, trífida o multífida (23,24), por lo que en cirugías de debilitamiento del OI es importante asegurarse de no dejar perdidos fascículos del vientre muscular (1). El OI tiene una longitud muscular de 37 mm y un tendón de sólo 1 mm (1,4). Se localiza quirúrgicamente entre los músculos RI y RL, aprovechando la relación que guarda con éstos (1). 3.1. Anatomía quirúrgica para estrabología Figura 13: Imagen intraoperatoria que muestra la inserción del oblícuo superior izquierdo tras pasar por debajo del recto superior y junto a la salida de una vena vorticosa. VASOS Y NERVIOS A CONSIDERAR DESDE EL PUNTO DE VISTA QUIRÚRGICO La irrigación de la musculatura ocular proviene mayoritariamente del sistema de la carótida interna, a través de la arteria oftálmica y, en menor medida, de la carótida externa, a través de la arteria infraorbitaria, rama de la maxilar interna (25). La inervación está proporcionada por los nervios craneales III, IV y VI. a) Irrigación arterial: La arteria oftálmica nace de la carótida interna, justo cuando ésta emerge del seno cavernoso, y entra en la órbita a través del canal óptico, inferior y lateral al nervio óptico. Dentro de la órbita emite múltiples ramas para irrigar la mayor parte de las estructuras orbitarias y oculares: arteria central de la retina, arterias ciliares posteriores cortas y largas, arteria lacrimal, arterias etmoidales posterior y anterior y arterias supratroclear, infratroclear y supraorbitaria. La irrigación muscular se produce a través de dos ramas específicas: las arterias musculares medial (o inferior) y lateral (o superior) (2,25). La arteria muscular medial irriga a los músculos RM, RI y OI. La arteria muscular lateral irriga al RL, RS/elevador y OS. Adicionalmente los músculos reciben vasos de otras ramas arteriales adyacentes: la arteria supraorbitaria para RS/elevador y OS, la arteria lacrimal para RL y RS, y la arteria infraorbitaria para OI y RI. Existe una gran variabilidad entre individuos en cuanto a la disposición vascular (25). Las arterias principales se convierten en arterias ciliares anteriores dentro de los vientres musculares de los músculos rectos, siendo responsables de la irrigación del segmento anterior del globo (2). Las ciliares anteriores se hacen visibles al emerger en los tendones de los rectos; habitualmente cada recto 65 proporciona dos ramas ciliares anteriores, a excepción del recto lateral que sólo emite una. Las siete arterias ciliares anteriores forman un plexo en el espacio episcleral anterior y múltiples ramas perforan la esclera para proporcionar abundante irrigación a cuerpo ciliar e iris (4). Cuando se desinserta un músculo recto se corta por completo el flujo a través de sus arterias ciliares anteriores. Normalmente el resto de arterias ciliares anteriores suple dicha irrigación, pero si se desinsertan más de dos rectos en un mismo acto quirúrgico se corre el riesgo de inducir isquemia del segmento anterior (1). Esto representa un riesgo especial en pacientes con arteriosclerosis, síndromes de hiperviscosidad o cirugía muscular previa. b) Retorno venoso: Las venas acompañan a sus arterias correspondientes y drenan en las venas oftálmicas superior (RS, RM y OS) e inferior (RL, RI y OI). La vena oftálmica superior discurre entre el recto superior y el nervio óptico, recoge la mayor parte del retorno venoso ocular y orbitario, y drena en el seno cavernoso. La vena oftálmica inferior se ubica cerca del suelo orbitario y drena a la vez en el seno cavernoso y en el plexo pterigoideo (2,25). Otros vasos a tener en consideración durante procedimientos estrabológicos son las venas vorticosas, que recogen el flujo de la coroides a través de cuatro troncos ubicados uno en cada cuadrante Figura 14: Principales arterias que irrigan el globo ocular y sus anejos: musculatura extrínseca y glándula lagrimal. 66 Figura 15: Relación entre la salida del globo ocular de la vena vorticosa temporal inferior, la mácula y la inserción del músculo oblicuo inferior. posterior del globo (fig. 15). La vena vorticosa temporal inferior es fácilmente visible durante la disección del oblicuo inferior. Las vorticosas superiores pueden ser dañadas en disecciones del tendón del oblicuo superior (1). c) Tercer nervio craneal (nervio oculomotor o motor ocular común): se origina en el mesencéfalo, a partir de un complejo nuclear situado delante del acueducto de Silvio. Emerge del tallo en la fosa interpeduncular, pasa entre las arterias cerebelosa superior y cerebral posterior, discurre justo bajo la arteria comunicante posterior y penetra en el seno cavernoso adherido a su pared lateral. Antes de salir del seno cavernoso el III NC se divide en una rama superior y otra inferior, que alcanzan la órbita cruzando la hendidura esfenoidal, por dentro del anillo de Zinn (2,28). La división superior del III NC inerva al RS y al elevador del párpado superior, mientras la división inferior inerva a RM, RI y OI, además de portar fibras parasimpáticas hacia el ganglio ciliar18. Las ramas para cada músculo recto penetran en el vientre muscular por su cara bulbar, aproximadamente en la unión del tercio posterior con el medio (2,4). La rama para el OI penetra en el músculo justo a nivel del borde lateral del RI, en forma de un paquete vasculonervioso que, fijado en el tejido conectivo de la vaina común, hace de anclaje para evitar el desplazamiento anterior del OI. Durante las cirugías de avance del OI hay que cuidar la disección y la excesiva tracción anterior del OI, para evitar dañar este paquete neurovascular (1). Estado actual del tratamiento del estrabismo d) Cuarto nervio craneal: su núcleo está en el mesencéfalo inferior, emerge por la cara posterior del tallo, al cual rodea para dirigirse hacia adelante y entrar en el seno cavernoso, adherido a la duramadre lateral. Entra en la órbita por la hendidura esfenoidal, por fuera del anillo de Zinn, y desde allí se desvía hacia la órbita medial, donde alcanza al vientre muscular del OS (4,18). e) Sexto nervio craneal: Su núcleo se ubica en la protuberancia, en relación con el fascículo del VII nervio craneal. Emerge en el surco bulboprotuberancial, recorre el espacio subaracnoideo sobre el clivus, atraviesa el canal de Dorello (bajo el ligamento petroclinoideo) y entra en el seno cavernoso, lateral a la carótida interna y sin adherirse a la pared dural (18). Penetra en la órbita por la hendidura esfenoidal, por dentro del anillo de Zinn, y alcanza la cara bulbar del RL a unos 1,5 cm de su inserción posterior (2,4). GRASA ORBITARIA La cavidad orbitaria está rellena por tejido fibroadiposo, a través del cual discurren los músculos y estructuras neurovasculares, además de servir como soporte y «cojín» al globo ocular (26). La grasa orbitaria está parcialmente septada por tabiques de tejido colágeno, el cual es más denso en la parte anterior de la órbita y más laxo hacia la órbita posterior, alrededor del nervio óptico. La parte más anterior de la grasa orbitaria está contenida por el septum orbitario y forma los paquetes adiposos del párpado. En el párpado superior existen dos paquetes, medial y central, mientras en el párpado inferior se distinguen tres bolsas, medial, central y lateral. Recordemos que el músculo oblicuo inferior discurre entre los paquetes medial y central a nivel de su inserción anterior (2,15). Actualmente se considera que la grasa tiene un papel relevante en la biomecánica de la motilidad ocular, pues tiene un comportamiento viscoelástico que determina su deformación y deslizamiento durante las rotaciones del globo (26,27). Tales propiedades viscoelásticas varían de acuerdo con la proporción de tejido conectivo en cada región orbitaria (28). De hecho, las poleas musculares son condensaciones de tejido conectivo especializado dentro de la grasa orbitaria. La modificación del volumen y fluidez de la grasa tras traumatismos, orbitotomías, cirugía de descompresión orbitaria y patología tumoral o inflamatoria de la órbita puede determinar cambios en la dinámica oculomotriz (29). 3.1. Anatomía quirúrgica para estrabología 67 PAREDES ORBITARIAS La órbita tiene forma de pirámide de base cuadrangular, la cual corresponde al reborde orbitario, y en cuyo vértice se ubican el agujero del canal óptico y los extremos mediales de las hendiduras esfenoidal y esfenomaxilar. Las paredes mediales de ambas órbitas son aproximadamente paralelas, y forman con sus respectivas paredes laterales ángulos de unos 45°. Veamos las peculiaridades de cada pared orbitaria y del recubrimiento perióstico: a) Pared medial: Está formada eminentemente por la lámina papirácea del etmoides, que separa la órbita de las celdas etmoidales (2,18). Hacia la parte más anterior está el hueso lacrimal o unguis, en cuya cresta lacrimal posterior se inserta el brazo posterior del tendón cantal medial y el retináculo del recto medial (4). La pared medial es plana o ligeramente convexa y guarda poca distancia con el músculo recto medial (30). b) Pared superior: Constituida en su mayor parte por el hueso frontal y en su extremo posterior por el ala menor del esfenoides (2). Tiene forma cóncava y su curvatura se continúa con la de la pared lateral (18). En su ángulo anteromedial presenta la fosa troclear, donde se inserta la polea del OS, y en el ángulo anterolateral está la fosa lacrimal para la glándula homónima. El techo orbitario guarda relación anteriormente con el seno frontal y hacia atrás con la fosa cerebral anterior (30). c) Pared lateral: Formada por el ala mayor del esfenoides y, en su extremo anterior, por la apófisis orbitaria del cigomático (18). Es la pared más gruesa y resistente. Por fuera de esta pared está la fosa temporal que aloja al músculo temporal (30). d) Pared inferior: Está constituida por el hueso maxilar y en su porción anterolateral por el cigomático (18). El suelo de la órbita es más o menos convexo y describe una pendiente de medial a lateral. Separa la órbita del seno maxilar y presenta un surco por el que discurre el nervio infraorbitario (30). e) Periórbita: Con este término se designa al periostio que recubre las paredes orbitarias. Está formada por tejido colágeno muy denso y resistente. El periostio se ancla firmemente en el reborde orbitario, en las suturas interóseas y alrededor de los canales y agujeros orbitarios, pero es fácilmente separable de la superficie ósea de cada pared. La periórbita presenta dos desdoblamientos: uno lateral que envuelve el lóbulo orbitario de la glándula lacrimal, y otro medial que envuelve al saco lacrimal (30). El periostio orbitario puede ser útil para formar colgajos resistentes en reconstrucciones palpebrales o en ciertos casos de estrabismo de gran ángulo. Figura 16: Esquema de las porciones óseas que integran las paredes orbitarias. LA ÓRBITA INFANTIL Y SU CRECIMIENTO Las mediciones antes proporcionadas sobre longitudes musculares y distancia de sus inserciones corresponden a valores promedios para el adulto. Sin embargo, las dimensiones varían durante el desarrollo infantil y, siendo los niños los principales afectados de estrabismo, es necesario conocer cómo evoluciona el crecimiento ocular y sus posibles efectos en la cirugía estrabológica (31). La longitud del eje axial al nacimiento es de 16 a 17,5 mm (versus 23 a 24,5 mm del adulto). La curva de crecimiento se puede dividir en tres períodos: (1) desde el nacimiento hasta los 18 meses, donde el ritmo es acelerado y el eje gana hasta 4 mm; (2) desde los 18 meses hasta los 5 años se reduce la tasa de crecimiento y se gana 1 a 1,5 mm de diámetro; (3) a partir de los 5 años el crecimiento se enlentece y alcanza valores de adulto, aproximadamente hacia los 15 años. Sin embargo, el diámetro corneal casi no cambia desde el nacimiento hasta la edad adulta (2). La inserción escleral de los músculos rectos está unos 2 mm más cercana al limbo en el recién nacido, y la anchura de las inserciones es menor. A pesar de esta inserción adelantada los rectos están más cercanos al ecuador que en el ojo desarrollado. Los oblicuos presentan una inserción más cercana al polo posterior del globo. Como el crecimiento del ojo se produce principalmente a expensas de los dos tercios posteriores del globo, el ecuador se aleja de las inserciones de los rectos y los oblicuos se des- 68 plazan más adelante a medida que el ojo crece. La distancia de las inserciones de los rectos respecto al limbo suele alcanzar los valores del adulto antes del año de edad (2). La cápsula de Tenon es más gruesa y resistente en el niño que en el adulto, lo que, sumado a una hendidura palpebral más corta y un ojo proporcionalmente más grande respecto a la órbita, hace que el campo operatorio pueda ser especialmente incómodo en niños pequeños (1). BIBLIOGRAFÍA 1. Wright KW. Colour Atlas of Strabismus Surgery. Strategies and techniques. 3rd ed. New York, USA: Springer science+business media, LLC; 2007. 2. Remington LA. Clinical anatomy of the visual system. 2nd ed. St Louis (Missouri): Elsevier Inc; 2005. 3. Coats DK, Olitsky SE. Strabismus surgery and its complications. Berlin: Springer-Verlag Berlin Heidelberg; 2007. 4. Von Noorden GK, Campos EC. Summary of the gross anatomy of the extraocular muscles. In: Von Noorden GK, Campos EC. Binocular vision and ocular motility. 6 ed. St Louis, Missouri (USA): Mosby, Inc; 2002. p. 38-51. 5. Roth A, Mühlendyck H, De Gottrau Ph. La function de la capsule de Tenon revisitée. J Fr Ophthalmol 2002; 25 (9): 968-76. 6. Van den Bedem SPW, Schutte S, Van der Helm FCT, Simonsz HJ. Mechanical properties and functional importance of pulley bands or «faisseaux tendineux». Vision Research 2005; 45: 2710-4. 7. Ruskell GL, Haugen IK, Bruenech JR, Van der Werf F. Double insertions of extraocular rectus muscles in humans and the pulley theory. J Anat (2005); 206: 295-306. 8. Osanai H, Murakami G, Ohtsuka A, Suzuki D, Nakagawa T, Tatsumi H. Histotopographical study of human periocular elastic fibers using aldehyde-fuchsin staining with special reference to the sleeve and pulley system for extraocular rectus muscles. Anat Sci Int (2009); 84: 129-40. 9. Jiao Y, Zhao K, Wang Z, Qian X, Wu X, Man F, Lu W, She H. Magnetic resonance imaging of the extraocular muscles and corresponding cranial nerves in patients with special forms of strabismus. Chin Med J 2009; 122 (24): 2998-3002. 10. Miller JM. Understanding and misunderstanding extraocular muscle pulleys. J Vis 2007 Aug 30; 7(11): 10, 1-15. 11. Demer JL. Refuting the polemic against the extraocular muscle pulleys: Jampel and Shi’s platygean view of extraocular muscle mechanics. J Pediatr Ophthalmol Strabismus 2006; 43(5): 296-305. 12. Agnes MF, Wong MD. Listing’s law: clinical significance and implications for neural control. Surv Ophthalmol 2004 Nov-Dec; 49 (6): 563-75. Estado actual del tratamiento del estrabismo 13. Demer JL. Mechanics of the orbita. Dev Ophthalmol 2007; 40: 132-57. 14. Thurtell MJ, Kunin M, Raphan T. Role of muscle pulleys in producing eye position-dependence in the angular vestibuloocular reflex: a model-based study. J Neurophysiol 2000; 84: 639-50. 15. Stager DR. The neurofibrovascular bundle of the inferior oblique muscle as its ancillary origin. Trans Am Ophthalmol Soc1996; 94: 1073-94. 16. Hwang K, Kim DJ, Hwang SH, Chung IH. The relationship of capsulopalpebral fascia with orbital septum of the lower eyelid: an anatomic study under magnification. J Craniofac Surg 2006 Nov; 17 (6): 1118-20. 17. Kaufman PL, Alm A. Adler fisiología del ojo. Aplicación clínica. 10 ed. Madrid: Elsevier España, SA.; 2004. 18. Loayza Villar F. Atlas de anatomía ocular. Lima: Ministerio de Salud. Instituto de Oftalmología; 2001. 19. Von Noorden GK, Campos EC. Histology and physiology of the extraocular muscles. In: Von Noorden GK, Campos EC. Binocular vision and ocular motility. 6 ed. St Louis, Missouri (USA): Mosby, Inc; 2002. p. 101-113. 20. Lee KM, Lai AP, Brodale J, Jampolsky A. Sideslip of the medial rectus muscle during vertical eye rotation. Invest Ophthalmol Vis Sci 2007 Oct; 48 (10): 4527-33. 21. Cho HK, Shin SY. Is the insertional anatomy of rectus extraocular muscles binocularly symmetrical? Ophthalmic Res 2010; 43: 179-84. 22. Von Lüdinghausen M, Miura M, Würzler N. Variations and anomalies of the human orbital muscles. Surg Radiol Anat 1999; 21: 69-76. 23. Yalçin B, Ozan H. Insertional pattern of the inferior oblique muscle. Am J Ophthalmol 2005 Mar; 139 (3): 504-8. 24. Paik DJ, Shin SY. An anatomical study of the inferior oblique muscle: the embalmed cadaver vs the fresh cadaver. Am J Ophthalmol 2009 Mar; 147(3): 544-549. 25. Hayreh SS. Orbital vascular anatomy. Eye (2006); 20: 1130-44. 26. Schutte S, Van den Bedem SPW, Van Keulen F, Van der Helm FCT, Simonsz HJ. A finite-element analysis model of orbital biomechanics. Vision Res 2006 May; 46 (11): 1724-31. 27. Yoo L, Reed J, Shin A, Kung J, Gimzewski JK, Poukens V, Goldberg RA, Mancini R, Taban M, Moy R, Demer JL. Characterization of ocular tissues using microindentation and hertzian viscoelastic models. Invest Ophthalmol Vis Sci 2011 Jun 1; 52 (6): 3475-82. 28. Yoo L, Gupta V, Lee C, Kavehpore P, Demer JL. Viscoelastic properties of bovine orbital connective tissue and fat: constitutive models. Biomech Model Mechanobiol 2011; 10: 901-14. 29. Chen K, Weiland JD. Mechanical properties of orbital fat and its encapsulating connective tissue. J Biomech Eng 2011 Jun; 133 (6): 064505. 30. René C. Update on orbital anatomy. Eye 2006; 20: 1119-29. 31. Brémond-Gignac D, Cussenot O, Deplus S, Peuchmar M, Ferkadji L, Emaleh M, Lassau JP. Computation of eyeball growth by magnetic resonance imaging. Surg Radiol Anat (1994) 16: 113-15.