ENLACE QUÍMICO
Anuncio
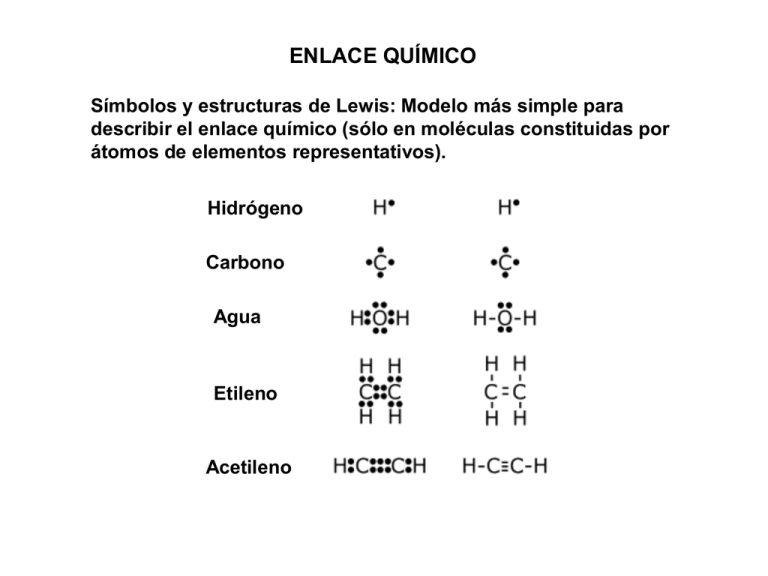
ENLACE QUÍMICO Símbolos y estructuras de Lewis: Modelo más simple para describir el enlace químico (sólo en moléculas constituidas por átomos de elementos representativos). Hidrógeno Carbono Agua Etileno Acetileno TEORÍA UNIÓN VALENCIA (TEORÍA ENLACE VALENCIA) H-H y F-F enlaces descritos de la misma manera en el modelo de Lewis. Se sabe experimentalmente que la distancia de enlace y la energía de disociación son diferentes para estas moléculas. Teoría unión valencia el enlace químico se forma por el traslape de orbitales atómicos centrados en diferentes átomos. Energía calculada para diferentes valores de la distancia H-H. Traslape óptimo dH-H de equilibrio H2 Edisociación = 436.4 kJ/mol dH-H=74x10-12 m ¿Cómo explica la teoría de Unión Valencia que para la molécula de F2 Edisociación = 150.6 kJ/mol y dF-F = 142 x 10-12 m? ¿Cómo describe la teoría de unión valencia el enlace en moléculas que contienen dos o más átomos? CONCEPTO DE HIBRIDACIÓN. Molécula BeCl2 Berilio átomo central. Be (Z=4) 1s22s2 no presenta orbitales con ocupación simple. Cl (Z=17) [Ne]3s23p5 Es posible alcanzar el estado excitado 1s22s12px1 que posee dos orbitales que pueden traslapar con los orbitales 3px de los átomos de cloro. Problema: se sabe experimentalmente que la molécula BeCl2 tiene geometría lineal y está formada por dos enlaces Be-Cl equivalentes. . 2s y 2px no son orbitales equivalentes (no permiten explicar la geometría lineal de la molécula). Se propone la formación de dos orbitales híbridos equivalentes: A partir de dos orbitales atómicos 2s y 2px no equivalentes se propuso la formación dos orbitales híbridos sp equivalentes. Los orbitales 2py y 2pz restantes no participan del proceso de hibridación. HIBRIDACIÓN sp2 BF3 Geometría plano trigonal con tres enlaces B-F equivalentes. B (Z=5) 1s22s22px1 (átomo central) F (Z=9) 1s22s22p5 En el estado basal el boro sólo podría formar un enlace B-F. Tres orbitales híbridos equivalentes sp2 HIBRIDACIÓN sp3 Metano CH4 geometría tetraédrica con cuatro enlaces C-H equivalentes. C (Z=6) 1s22s22p2 átomo central H (Z=1) 1s1 En el estado basal el carbono sólo podría formar dos enlaces C-H. Procedimiento para formar orbitales híbridos. El concepto de hibridación sólo se utiliza en moléculas para explicar el enlace químico (no se utiliza en átomos aislados). Hibridación mezcla de dos o más orbitales atómicos no equivalentes de un mismo átomo. Número de orbitales híbridos = Número de orbitales atómicos que participan en el proceso de hibridación. En moléculas poliatómicas el enlace químico se forma por el traslape de los orbitales híbridos en el átomo central con los orbitales de los átomos periféricos (sólo enlaces simples). Tipos de hibridación: sp dos orbitales híbridos equivalentes sp2 tres orbitales híbridos equivalentes sp3 cuatro orbitales híbridos equivalentes geometría lineal. geometría plano trigonal. geometría tetraédrica. Otros tipos de hibridación sp3d cinco orbitales híbridos equivalentes geometría de bipirámide trigonal. sp3d2 seis orbitales híbridos equivalentes geometría octaédrica. Enlace en moléculas que contienen dobles y triples enlaces. Eteno Hibridación sp2 en los átomos de carbono (geometría plano trigonal) tres enlaces equivalente (dos C-H y uno C-C). Los orbitales 2pz que no participan del proceso de hibridación forman un enlace adicional C-C. Acetileno TEORÍA DE ORBITALES MOLECULARES Teoría alternativa a la teoría de Unión Valencia (en realidad la teoría de orbitales moleculares es la más empleada actualmente en el campo de la química cuántica). Átomos polielectrónicos configuraciones electrónicas se construyen como productos de orbitales atómicos (funciones hidrogenoides). Li(Z=3) 1s22s1 Orbital molecular función que describe a un electrón dentro de una molécula. Los n orbitales moleculares que describen a los n electrones presentes en una molécula se construyen a partir de los orbitales atómicos (funciones hidrogenoides) centrados en los diferentes átomos que constituyen la molécula. Orbital molecular: función que describe al electrón en toda la molécula (no sólo traslape entre orbitales atómicos como en la teoría de unión valencia). Teoría Unión Valencia los electrones están asociados con el átomo de origen. Traslape entre funciones 1s centradas en cada uno de los átomos. Teoría de Orbitales moleculares Los electrones pertenecen a la molécula y no están asociados con ningún átomo en particular. Orbitales moleculares: se obtienen como combinación de los orbitales atómicos centrados en los diferentes átomos que constituyen la molécula. Molécula de hidrógeno H2 HA + 1sA HB 1sB funciones hidrogenoides: poseen un carácter ondulatorio cuando se combinan entre sí puede existir una interferencia constructiva o destructiva (como con cualquier onda). Orbital tipo : orbital simétrico ante rotación del eje internuclear. = 1sA + 1sB Interacción constructiva (orbital molecular de enlace): incrementa la densidad electrónica en la región internuclear, por tanto favorece la formación del enlace químico al compensar la repulsión entre los núcleos. * = 1sA 1sB Interacción destructiva (orbital molecular de antienlace): Disminuye la densidad electrónica en la región internuclear, por lo que no favorece la formación del enlace químico. (también es simétrico ante rotación del eje internuclear) Diagrama de orbitales moleculares El orbital 1s tiene menor energía que el orbital 1s* Cada orbital molecular se puede asociar con dos funciones de espín (principio de exclusión de Pauli). configuración del estado basal de la molécula de H2: 12 Para las moléculas diatómicas homonucleares (con cinco o más electrones ) que pueden formar los elementos del segundo período, son necesarios los orbitales moleculares que se obtienen como combinaciones lineales de las funciones 2s y 2p. = 2sA + 2sB y * = 2sA 2sB obedecen un patrón semejante al discutido para los OM obtenidos de las funciones 1s. Li2 Orbitales moleculares obtenidos a partir de las funciones 2p centradas en diferentes átomos. (se considera z como el eje internuclear). * = 2pzA + 2pzB interferencia destructiva orbital de antienlace. = 2pzA 2pzB interferencia constructiva orbital de enlace. = 2pxA + 2pxB interacción constructiva orbital molecular de enlace. * = 2pxA 2pxB interacción destructiva orbital molecular de antienlace. Los orbitales obtenidos para las combinaciones de los orbitales atómicos 2pyA y 2pyB son equivalentes y tienen la misma energía. Orbital tipo : Tienen una superficie nodal que contiene al eje internuclear: la densidad electrónica se localiza arriba y debajo de esta superficie (no es simétrico ante rotación del eje internuclear). Orden de enlace = ½ [número de electrones en orbitales de enlace número de electrones en orbitales de antienlace] ¿Qué predicción se obtiene de la teoría de orbitales moleculares respecto a la estabilidad de la molécula de He2? N2 molécula diamagnética O2 molécula paramagnética benceno

