¿Qué es un compuesto de coordinación? Ión complejo: Átomo o ión
Anuncio
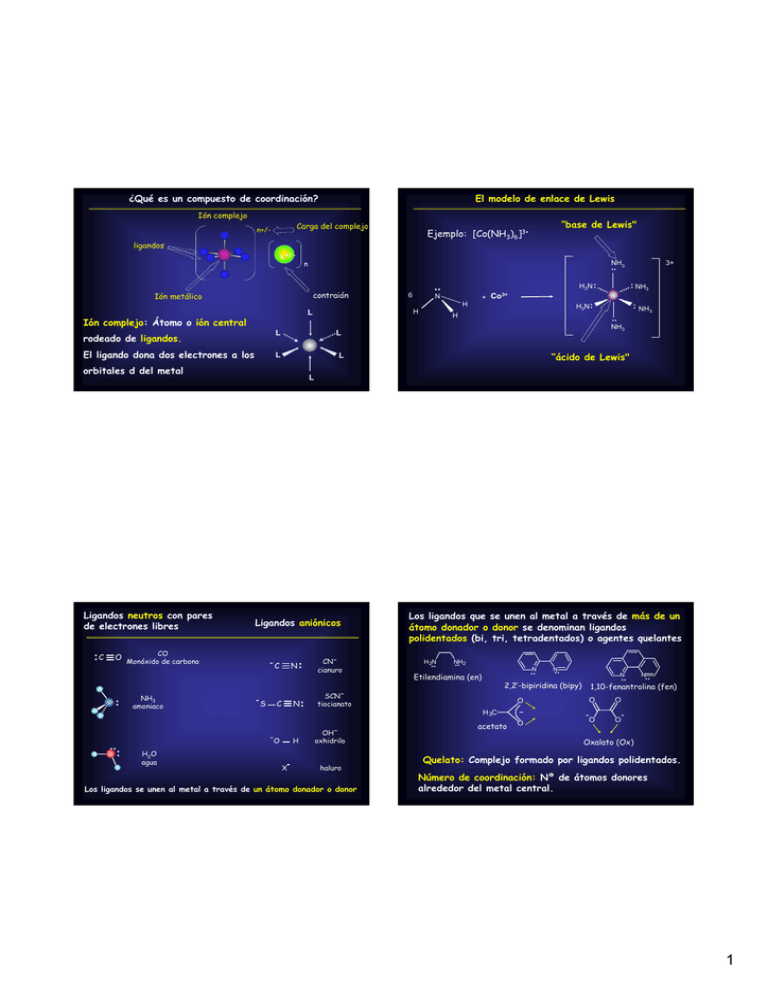
¿Qué es un compuesto de coordinación? El modelo de enlace de Lewis Ión complejo Carga del complejo n+/- ligandos X+/- n NH3 contraión L El ligando dona dos electrones a los z z C L Ligandos aniónicos C S N C z z H2O agua z z N H3N z z NH3 zz NH3 “ácido de Lewis" z z CNcianuro Los ligandos que se unen al metal a través de más de un átomo donador o donor se denominan ligandos polidentados (bi, tri, tetradentados) o agentes quelantes H 2N zz NH2 zz N Etilendiamina (en) zz SCNtiocianato H X OHoxhidrilo haluro Los ligandos se unen al metal a través de un átomo donador o donor N zz N zz 2,2’-bipiridina (bipy) O H 3C O zz NH3 z z z z H L CO NH3 amoniaco H z z + Co3+ L O Monóxido de carbono z z N L orbitales d del metal Ligandos neutros con pares de electrones libres H3N zz 6 H L Ión complejo: Átomo o ión central 3+ zz Ión metálico rodeado de ligandos. “base de Lewis" Ejemplo: [Co(NH3)6]3+ acetato O O N zz 1,10-fenantrolina (fen) O O O - Oxalato (Ox) Quelato: Complejo formado por ligandos polidentados. Número de coordinación: Nº de átomos donores alrededor del metal central. 1 Ejemplos Geometrías más comunes en los complejos Tetraédrica 109o Plana cuadrada 90o N.C. 4 Bipirámide trigonal 120o + 90o N.C. 5 Geometría lineal N.C. 4 Geometría Plana trigonal [CuCl2]180o [Au(CN)2]- Geometría tetraédrica Pirámide de base cuadrada 90o N.C. 5 90o [MnO4]- N.C. 6 109o [NiCl4]2- Número de coordinación 5 Geometría Bipirámide trigonal 3- Cl Cl Cu Geometría Pirámide de base cuadrada Cl Cl Cl + N Co [AuBr4]- 90o [Co(CN)4]2- Número de coordinación 6 Geometría octaédrica CN [Mn(H2O)6]2+ [CrCl6]3- CN [Co(CN)5]3- [CuCl5]3- N Co NC Geometría plano cuadrada 3- CN NC [HgI3]- [PtCl4]2- [CoCl4]2- Octaédrica 120o N N O O O V O Geometría prismática trigonal O Br [Co(Me6tren)Br]+ [VO(acac)2] 2 Teoría del Campo Cristalino Teoría del Campo Criatalino Postulados: En los iones metálicos libres, los cinco orbitales d tienen la misma energía (degenerados) M M x2-y2 yz z2 xz xy Energía x2-y2 yz z2 xz xy En presencia de una distribución de carga esférica, los orbitales se desestabilizan (aumentan su energía). Teoría del Campo cristalino: geometría octaédrica 9Los ligandos están representados por cargas puntuales negativas. 9Las interacciones entre el catión metálico y los ligandos son puramente electrostáticas. 9Existe una repulsión entre los electrones d del metal y los ligandos. 9Esta interacción es diferencial y depende de la disposición espacial de los ligandos alrededor del metal (geometría del entorno). 9Como consecuencia se produce un desdoblamiento de los orbitales d. Teoría del Campo cristalino: geometría octaédrica 3 TCC: geometría octaédrica TCC : geometría octaédrica La diferencia de energía entre los niveles eg y t2g se denomina Energía de desdoblamiento del Campo Cristalino, Δo. M Energía M x2-y2 z2 Campo esférico eg Campo octaédrico eg Baricentro x2-y2 yz z2 xz xy yz x2-y2 yz z2 xz xy t2g + 0.6 Δo Δo xz xy x2-y2 z2 eg - 0.4 Δo t2g xy, yz, xz más estables respecto al campo esférico x2-y2, z2 menos estables respecto al campo esférico yz xz t xy 2g Teoría del Campo cristalino: geometría tetraédrica TCC: geometría tetraédrica Ión libre Simetría esférica Campo tetraédrico yz xz xy t 2 Δtet e x2-y2 z2 + 0.4 Δtet - 0.6 Δtet x2-y2 yz z2 xz xy x2-y2, z2 más estables que en el campo esférico xy, yz, xz menos estables que en el campo esférico 4 Ejemplo: [Ti(OH2)6]3+ Complejos con iones d2 y d3 3+ Ión de configuración electrónica d1 [V(OH2)6]3+ eg En solución acuosa, presenta color violeta d2 eg t2g + 0.6 Δoct - 0.4 Δoct t2g [Cr(OH2)6]3+ eg d3 El electrón d ocupa uno de los orbitales t2g t2g Complejos de espín alto y bajo Complejos con iones d4 Complejos de alto espín Iones d1, d2, d3, d8 , d9: una sola configuración. eg Δo < P t2g 4 e- desapareados Iones d4, d5, d6, d7: dos configuraciones posibles Complejo de alto espín (campo débil) eg Complejos de bajo espín eg Complejo de bajo espín (campo fuerte) eg Δoct Δoct Δo > P t2g 2 e- desapareados P representa la energía requerida para aparear dos electrones en un orbital d t2g Δ es pequeña Los electrones ocupan los 5 orbitales d antes de aparearse t2g Δ es grande Los electrones se aparean en los orbitales t2g antes de ocupar los eg 5 Complejos con iones d6 Complejos con iones d5 Alto spin Espín alto eg eg 5 e- desapareados 4 e- desapareados t2g t2g Bajo spin Espín bajo eg eg 1 e- desapareado 0 e- desapareados t2g t2g Complejos con iones d7 Complejos con iones d8, d9 y d10 Espín alto eg eg eg 3 e- desapareados t2g t2g t2g 2 e- desapareados 1 e- desapareado Espín bajo 1 e- desapareado t2g t2g 0 e- desapareados 6 Factores que determinan el valor de Δ Factores que afectan el valor de Δ 1. Geometría del complejo 2. Estado de oxidación del ión metálico Comparación de campo octaédrico y tetraédrico Δ aumenta al aumentar el estado de oxidación del metal eg t2 Δoct yz xz Δoct = 10 000 cm-1 [Fe(OH2)6]3+ Δoct = 14 000 cm-1 [Co(OH2)6]2+ Δoct = 9 700 cm-1 [Co(OH2)6]3+ Δoct = 18 000 cm-1 3. Naturaleza del ión metálico, ubicación en la T.P. xy Δtet e Al “bajar” en un grupo aumenta el valor de Δ x2-y2 z2 Δtet = 4/9 Δoct t2g [Fe(OH2)6]2+ [Co(NH3)6]3+ Δoct = 22 900 cm-1 [Rh(NH3)6]3+ Δoct = 34 100 cm-1 [Ir(NH3)6]3+ Δoct = 41 000 cm-1 Los complejos tetraédricos son siempre de alto espín y bajo campo: Los complejos de metales de 2ª y 3ª serie de transición son siempre de bajo spin Δtet < P El color en los complejos de los metales de transición Factores que afectan el valor de Δ 4. Ligandos eg eg I- < Br- < S2- < SCN- ≈ Cl-< NO3- < F- < OH- < ox2- Δoct t2g Δoct [Ti(OH2)6]3+ eg Complejos de alto espín Δo t2g < H2O < NH3 ≈ en < bipy < fen ≈ NO2- < CN- ≈ CO Ligandos de campo débil eg hν Serie Espectroquímica t2g Espectro de absorción: λmax = 510 nm Luz blanca 400-800 nm t2g Ligandos de campo fuerte Complejos de bajo espín (siempre que sean octaédricos!) 490-580 nm azul: 400-490 nm Amarillo-verde: 490-580 nm rojo: 580-800 nm 7 Determinación experimental de Δo El color en los complejos de los metales de transición eg 490-580 nm A hν eg Δoct Δoct Espectro de absorción t2g t2g Δ pequeña Se absorbe luz de baja energía Δ grande λ / nm Se absorbe luz de alta energía eg 9El color del complejo dependerá de la magnitud de Δ. hν 9Por lo tanto dependerá de los 4 factores que determinan Δ. t2g 9Un complejo se ve del color complementario al de la luz que absorbe. Longitud de onda, λ (nm) eg Δo t2g Espectro de absorción: λmax = 510 nm → 243 kJ mol-1 8

