Caracteristicas de protones e iones pesados caracteristicas de
Anuncio

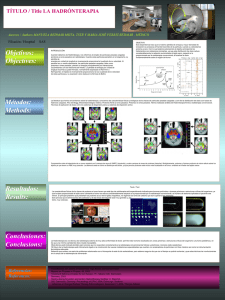
Hadronterapia E. Herranz, J.L. Herraiz, E. Vicente, S. España, J. Cal, J.M.Udías. Grupo de Física Nuclear, Dpto. Física Atómica, Molecular y Nuclear Universidad Complutense de Madrid, Madrid, Spain INTRODUCCI ÓN INTRODUCCIÓN El objetivo de la radioterapia consiste en maximizar la dosis aplicada sobre la región del tumor sin irradiar el tejido sano colindante. En el caso de la radiación electromagnética, la distribución de dosis, exponencial decreciente cuando el haz penetra en el organismo, hace difícil aproximarse a esta situación ideal, sobre todo en tumores profundos. La inevitable dosis proporcionada a tejidos sanos constituye un serio factor limitante para la radioterapia convencional. El empleo de partículas pesadas cargadas (protones e iones) en radioterapia permite una distribución de dosis en los tejidos completamente diferente y que constituye su principal ventaja frente a la radioterapia con fotones. CARACTER ÍSTICAS DE CARACTERÍSTICAS DE PROTONES PROTONES E E IONES IONES PESADOS PESADOS Protones vs Iones de Carbono Fórmula de Bethe y Pico de Bragg Máxima pérdida de energía al final del recorrido de la partícula: PICO de BRAGG Principal ventaja de los iones de carbono frente a protones: Efectividad Biológica Relativa mayor. Protones: partículas de baja Transferencia Lineal de Energía (LET) (30 kev/µm). Su efectividad biológica es similar a la de fotones. Iones de carbono: LET (30 kev/µm – 100 kev/µm). Valor máximo de LET en el pico de Bragg. Elevada eficiencia biológica porque la contribución de alta LET se restringe principalmente a la zona del tumor. Mayor probabilidad de múltiples daños en el mismo gen. Curva de distribución Dosis - Profundidad La dosis depositada al final del recorrido es mucho mayor que la depositada a la entrada. La deposición de energía disminuye bruscamente justo después del pico de Bragg Fig.1 – Distribución dosis- profundidad para hadrones y fotones Fig.3- Los iones de carbono tienen menor dispersión lateral (straggling) que los protones. Fig.2 – Trayectorias de protones e iones de carbono comparadas con el tamaño de una molé´cula de ADN HADRONTERAPIA HADRONTERAPIA VS VS RADIOTERAPIA RADIOTERAPIA La dosis depositada en los tejidos sanos se reduce considerablemente en el caso de la hadronterapia y el número de sesiones aplicadas al paciente es menor. Esto hace que esta técnica esté especialmente indicada para tumores profundos, situados en zonas próximas a estructuras críticas del organismo o tumores pediátricos, donde una posible irradiación de órganos sanos sería inaceptable. Fig.4 – Comparación entre el tratamiento de un tumor cerebral con 9 campos de rayos-X (IMRT) (izquierda) y dos campos de iones de carbono (derecha). Fig.5 – Comparación entre el tratamiento de un tumor cerebral con 9 campos de rayos-X (IMRT) (izquierda) y cuatro campos de iones de protones (derecha). TTÉCNICAS ÉCNICAS DE ÓN DE DE APLICACI APLICACIÓN DE DOSIS DOSIS Sistemas de dispersión pasiva Sistemas de dispersión activa Primeros tratamientos con haces de protones: 1954 en el Lawrence Berkeley Laboratory 1997: nuevo sistema de aplicación de dosis (en GSI y PSI) los hadrones cargados son guiados magnéticamente sobre la zona de tratamiento. Fig 6.- El haz se distribuye sobre el volumen blanco empleando dispersores, compensadores y colimadores adaptados de la radioterapia convencional de fotones. Fig 7.- El haz de partículas se focaliza punto a punto sobre el tumor para cada energía de los iones empleando un sistema de desviación magnética (Técnica de ‘spot scanning’ o ‘raster scann’). INSTALACIONES INSTALACIONES Centros de Hadronterapia HICAT (Heavy Ion Cancer Therapy, Heidelberg) Más de 50.000 pacientes tratados en todo el mundo. La gran mayoría de países europeos tienen ya un centro de hadronterapia en funcionamiento o en construcción. Fig.9 – Ejemplo de instalación de Hadronterapia, Heidelberg( Izqd). Grantry isocéntrico empleado en dicha instalación y diseñado para iones de carbono (Centro y Derecha) Fig.8 – Hadronterapia en el mundo Protonterapia : ~ 45.000 pacientes Terapia con iones de carbono: ~ 2.200 pacientes 3 áreas de tratamiento, más de 1000 pacientes/año, 1 área de desarrollo e investigación Cadena de aceleración: inyector linac ( 7 MeV/u), sincrotrón (diámetro:65 m) Gantry isocéntrico. Iones de baja y alta LET: p, He, C, O. Energías : 50 – 430 MeV/u Principal desventaja: elevado coste de las instalaciones. CONCLUSIONES CONCLUSIONES Técnica de radioterapia de muy alta conformidad de dosis: permite tratar tumores localizados en zonas próximas a estructuras críticas del organismo. Está indicada para tumores que no responden correctamente a la radioterapia convencional de fotones y electrones (tumores radioresistentes). El futuro de la hadronterapia está íntimamente ligado a la construcción de nuevas instalaciones especializadas que cuenten con aceleradores de partículas con fines médicos así como la instrumentación tecnológica adecuada. BIBLIOGRAF ÍA BIBLIOGRAFÍA ‘Radiotherapy with beams of carbon ions’, Ugo Amaldi and Gerhard Kraft. Reports on Progress in Physics, 68, 2005 ‘Proton beams in radiotherapy’, V.S. Khoroshkov, E.I. Minakova. Eur.J.Phys. 19, 1998. ‘Treatment delivery principles for ion therapy’. Th. Haberer,GSI, Darmstadt, Germany, 2003. ‘Gantry design for proton and carbon Hadrontherapy facilities’, U. Weinrich, GSI, Darmstadt, Germany. Proccedings of EPAC, 2006.