Metales y aleaciones
Anuncio

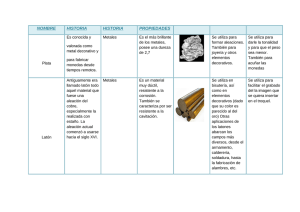
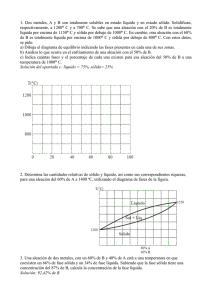
METALES Se llama metales a los elementos químicos caracterizados por ser buenos conductores del calor y la electricidad. Poseen alta densidad y son sólidos en temperaturas normales (excepto el mercurio); sus sales forman iones electropositivos (cationes) en disolución. La ciencia de materiales define un metal como un material en el que existe un solape entre la banda de valencia y la banda de conducción en su estructura electrónica (enlace metálico). Esto le da la capacidad de conducir fácilmente calor y electricidad, y generalmente la capacidad de reflejar la luz, lo que le da su peculiar brillo. El concepto de metal se refiere tanto a elementos puros, así como aleaciones con características metálicas, como el acero y el bronce. Los metales comprenden la mayor parte de la tabla periódica de los elementos y se separan de los no metales por una línea diagonal entre el boro y el polonio. En comparación con los no metales tienen baja electronegatividad y baja energía de ionización, por lo que es más fácil que los metales cedan electrones y más difícil que los ganen. En astrofísica se llama metal a todo elemento más pesado que el helio. http://es.wikipedia.org/wiki/Metal ALEACIONES METÁLICAS Una aleación es una mezcla homogénea, de propiedades metálicas, que está compuesta de dos o más elementos, de los cuales, al menos uno es un metal. Las aleaciones están constituidas por elementos metálicos: Fe (hierro), Al (aluminio), Cu (cobre), Pb (plomo). Pueden tener algunos elementos no metálicos, como: P, C, Si, S, As. Para su fabricación se mezclan llevándolos a temperaturas tales que sus componentes se fundan. http://es.wikipedia.org/wiki/Aleaci%C3%B3n Propiedades Las aleaciones presentan brillo metálico y alta conductividad eléctrica y térmica, aunque usualmente menor que los metales puros. Las propiedades físicas y químicas son, en general, similares a la de los metales, sin embargo las propiedades mecánicas tales como dureza, ductilidad, tenacidad y otras pueden ser muy diferentes, de ahí el interés que despiertan estos materiales. Las aleaciones no tienen una temperatura de fusión única, dependiendo de la concentración, cada metal puro funde a una temperatura, coexistiendo simultáneamente la fase líquida y fase sólida como se puede apreciar en los diagramas de fase.. Hay ciertas concentraciones específicas de d cada aleación para las cuales la temperatura de fusión se unifica. Esa concentración y la aleación obtenida reciben el nombre de eutéctica, y presenta un punto de fusión más bajo que los puntos de fusión de los componentes. DIAGRAMAS DE FASE En termodinámica y ciencia de materiales se denomina diagrama de fase, fase diagrama de equilibrio de fases o diagrama de estados de la materia, materia a la representación gráfica a de las fronteras entre diferentes estados de la materia de un sistema, en función de variables elegidas para facilitar el estudio del mismo. Cuando en una de estas representaciones todas las fases corresponden a estados de agregación diferentes se suele denominar diagrama de cambio de estado. Los diagramas de equilibrio quilibrio son gráficas que representan las fases y estado en que pueden estar diferentes concentraciones de materiales que forma una aleación a distintas temperaturas. Dichas temperaturas van desde la temperatura por encima de la cual un material está en fase fase líquida hasta la temperatura ambiente y en que generalmente los materiales están en estado sólido. Diferentes diagramas de equilibrio Existen diferentes diagramas de equilibrio según los materiales sean totalmente solubles en estado sólido y líquido o sean miscibles a que sean insolubles. También pueden darse casos particulares. Dos metales (A, B) a temperaturas superiores a sus respectivos puntos de fusión (TA, TB) se encuentran en estado líquido pudiéndose disolver y conformar así una fase única líquida. líquida Esto quiere decir que no podemos establecer diferencias de comportamiento u observación entre las distintas partes del líquido y que los metales en las proporciones mezcladas tienen la propiedad de miscibilidad. Si la mezcla líquida, XA + XB, la sometemoss a un proceso de solidificación, mediante enfriamiento, llegamos a obtener el producto que se denomina aleación de los metales A y B. Es conocido que las aleaciones mejoran las características de los metales puros. Realmente debería decirse que introducen variables que diferencian el comportamiento de los metales puros que las componen, porque en algunas circunstancias pueden perjudicar sus propiedades. Obviamente, conformar una aleación es uno de los medios más primitivos que la ingeniería ha dispuesto para pa actuar sobre las propiedades de los metales puros, incluso históricamente la aleación es predecesora como lo justifica el bronce, Edad del bronce. bronce Cuando la aleación es completamente miscible a estado sólido se tiene gráficas como la siguiente: Cuando la inmiscibilidad lidad es total: Eutéctico es una mezcla de dos componentes con punto de fusión (solidificación) o punto de vaporización (licuefacción) mínimo, inferior al correspondiente a cada uno de los compuestos en estado puro. Esto ocurre en mezclas que poseen alta estabilidad en estado líquido, cuyos componentes son insolubles en estado sólido. La solidificación comienza formándose un primer núcleo del componente A, y a continuación otro núcleo de metal B. Este proceso se repite continuamente, de manera que las dos fases A y B se disponen en forma de láminas entremezcladas. No forman una estructura uniforme como sería el caso de sustancias con solubilidad total en estado sólido. Cuando la inmiscibilidad es parcial: Líquido: miscibilidad total Sólido= miscibilidad parcial En este caso tenemos dos fases de soluciones sólidas de miscibilidad parcial, la solución α que es B disuelto en A y la solución β que es A disuelto en B. Regla de la palanca Se traza una isoterma para definir el porcentaje en peso de cada elemento, representada en la imagen por el segmento L α para cada temperatura T. Esta línea nea se traza horizontalmente desde la temperatura de composición de una fase ase hasta la otra (en este caso desde el líquido L al sólido α). ). El porcentaje en peso del elemento B en el líquido viene dado por wl y en el sólido por ws. El porcentaje de sólido y líquido puede ser calculado usando las siguientes ecuaciones, que constituyen la regla de la palanca: segmento T L % peso de la fase sólida:: = ------------------segmento L α segmento α T % peso de la fase líquida: líquida = ------------------segmento L α Cantidad % de A y B presente en el sólido a la Tn se obtiene trazando la línea vertical desde αn a la concentración correspondiente. correspondiente Cantidad % de A y B presente en el líquido a la Tn se obtiene trazando la línea vertical desde Ln a la concentración correspondiente. correspondiente Peritéctico La reacción peritéctica es aquella que se da en algunas aleaciones donde en el curso de la solidificación se está formando cristales de una fase determinada (ejemplo α), y al solidificar completamente tanto el líquido L y la fase α pasan a una fase totalmente diferente β. Cambios de estado alotrópicos: Algunos metales tienen la característica de que cambian de red de cristalización dependiendo de la temperatura a que se encuentren, entonces se dice que el metal es politrópico, y a cada uno de los sistemas en que cristaliza el metal se le llaman estados alotrópicos. En el hierro puro se distinguen cuatro estados alotrópicos: Uno de los diagramas de equilibrio más clásico es el de los aceros que tiene particularidades y donde afecta claramente la concentración y las diferentes cristalizaciones que puede darse en el hierro estando en estado sólido y a diferentes temperaturas. En los casos de alotropía se tienen como puntos característicos el “eutectóide ξ” y el “peritectóide ρ” En el caso de las aleaciones hierro – carbono (FeC) se tienen tres puntos característicos, un peritéctico a 1.493 ºC y 0,16 % de C, un eutéctico a 1.147 ºC y 4,3 % de C, y un eutectóide a 723 ºC y 0,8 % de C.