Moléculas Poliatómicas
Anuncio

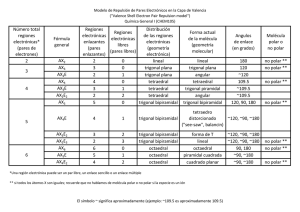
Química General e Inorgánica A Moléculas Poliatómicas Tema 6 Enlaces en moléculas poliatómicas 1) predicción de la forma molecular TRPECV (teoría de la repulsión de los pares electrónicos de la capa de valencia) 2) descripción de los enlaces - TEV-VD (teoría del enlace valenciavalencia dirigida). Hibridación - TOM (teoría del orbital molecular), para moléculas que admiten más de una estructura de Lewis. 6.1 1 Teoría de la Repulsión (TRPECV) • los pares electrónicos que rodean al átomo central se clasifican en: - pares enlazados (p.e.), que se encuentran compartidos entre dos átomos y tienen una nube electrónica concentrada - pares aislados (p.a.), que pertenecen solamente al átomo central y tienen una nube electrónica más blanda y esparcida • Las moléculas se simbolizan ALmNn A: átomo central L: ligandos m: cantidad de ligandos N: pares aislados n: cantidad de pares aislados Por ej. NH3 se simboliza AL3N 6.2 • los pares electrónicos enlazados y aislados se ubican tan alejados entre sí como sea posible, para disminuir al mínimo la repulsión interelectrónica • la repulsión se ordena: p.a. – p.a. > p.a. – p.e. > p.e. – p.e. • m + n = distribución espacial o geometría de la molécula • m = forma de la molécula determinada por los pares enlazados tipo σ (los pares enlazados tipo π no se tienen en cuenta para la forma) 6.3 2 Teoría de la repulsión de los pares electrónicos de la capa de valencia (TRPECV) Predice la forma de la molécula en base a la repulsión electrostática entre los pares electrónicos que rodean al átomo central Tipo AL2 m = pares enlazados 2 n = pares aislados distribución o geometría 0 forma molecular lineal lineal B B 6.4 Cloruro de berilio Cl Be Cl 2 átomos enlazados al átomo central 0 pares libres en el átomo central 6.5 3 TRPECV Tipo AL2 AL3 m = pares enlazados 2 3 n = pares aislados 0 0 distribución o geometría lineal trigonal plana forma molecular lineal trigonal plana 6.6 Trifluoruro de boro Plana 6.7 4 TRPECV m = pares enlazados tipo n = pares aislados distribución o geometría forma molecular AL2 2 0 linear linear AL3 3 0 trigonal plana trigonal plana AL4 4 0 tetraédrica tetraédrica 6.8 Metano Tetraédrica 6.9 5 TRPECV m = pares enlazados tipo n = pares aislados distribución o geometría AL2 2 0 lineal AL3 3 0 trigonal plana AL4 4 0 AL5 5 0 tetraédrica bipirámide trigonal forma molecular lineal trigonal plana tetraédrica bipirámide trigonal 6.10 Pentacloruro de fósforo Bipirámide trigonal 6.11 6 TRPECV tipo m = pares enlazados n = pares aislados distribución o geometría forma molecular AL2 2 0 lineal lineal AL3 3 0 trigonal plana trigonal plana AL4 4 0 tetraédrica tetraédrica AL5 5 0 bipirámide trigonal bipirámide trigonal AL6 6 0 octaédrica octaédrica 6.12 Hexafluoruro de azufre Octaédrica 6.13 7 •la repulsión se ordena: p.a. – p.a. > p.a. – p.e. > p.e. – p.e. 6.14 TRPECV tipo m = pares enlazados n = pares aislados AL3 3 0 AL2N 2 1 distribución o geometría forma molecular trigonal plana trigonal plana trigonal plana angular 6.15 8 TRPECV tipo m = pares enlazados n = pares aislados distribución o geometría forma molecular AL4 4 0 tetraédrica tetraédrica AL3N 3 1 tetraédrica pirámide trigonal 6.16 TRPECV tipo m = pares enlazados n = pares aislados distribución o geometría forma molecular AL4 4 0 tetraédrica tetraédrica AL3N 3 1 tetraédrica pirámide trigonal AL2N2 2 2 tetraédrica angular O H H 6.17 9 TRPECV tipo m = pares enlazados n = pares aislados AL5 5 0 AL4N 4 1 distribución o geometría forma molecular bipirámide trigonal bipirámide trigonal tetraedro bipirámide distorsionado trigonal 6.18 TRPECV tipo m = pares enlazados n = pares aislados AL5 5 0 AL4N AL3N2 4 3 1 2 distribución o geometría forma molecular bipirámide trigonal bipirámide trigonal bipirámide trigonal bipirámide trigonal tetraedro distorsionado forma en T F F Cl F 6.19 10 TRPECV tipo m = pares enlazados n = pares aislados AL5 5 0 AL4N 4 1 AL3N2 3 2 AL2N3 2 3 distribución o geometría forma molecular bipiramidal trigonal bipiramidal trigonal bipiramidal trigonal bipiramidal trigonal tetraedro distorsionado forma en T bipiramidal trigonal lineal I I I 6.20 TRPECV tipo m = pares enlazados n = pares aislados distribución o geometría forma molecular AL6 6 0 octaédrica octaédrica AL5N 5 1 octaédrica pirámide cuadrada F F F Br F F 6.21 11 TRPECV tipo m = pares enlazados n = pares aislados distribución o geometría forma molecular AL6 6 0 octaédrica octaédrica AL5N 5 1 octaédrica AL4N2 4 2 octaédrica pirámide cuadrada cuadrada plana F F Xe F F 6.22 Cómo predecir la forma molecular ? • • Plantear la estructura de Lewis para la molécula Contar el número de pares enlazados al átomo central (ligandos), representado por m Contar el número de pares aislados del átomo central, representado por n Predecir la geometría (m + n) de la molécula • • • m+n geometría 2 lineal 3 triangular 4 tetraédrica 5 bip. trigonal 6 octaédrica Predecir la forma molecular (m), sin considerar los pares aislados 6.23 12 ¿Cuáles son las formas moleculares de SH2 y SF4? •• H─S─H •• AL2N2 angular F F S F AL4N F Tetraedro distorsionado S H H 6.24 Momento dipolar de enlace y momento dipolar resultante (μ) Momento dipolar resultante = 1.46 D Momento dipolar resultante = 0.24 D 6.25 13 ¿Cuáles de las siguientes moléculas tienen momento dipolar? H2O, CO2, SO2 y CH4 O H S H O O μ≠0 molécula polar μ≠0 molécula polar H O C H O μ=0 molécula no polar C H H μ=0 molécula no polar 6.26 Momentos dipolares de algunas moléculas polares Molécula Geometría Lineal Momento dipolar (D) Lineal Lineal Lineal Angular Angular Piramidal Angular 6.27 14 Campo eléctrico de la microonda Dipolos (moléculas polares) y microondas Dirección de Dirección de onda Campo eléctrico de la microonda onda Dirección Direccióndede onda onda 6.28 Descripción de los enlaces Teoría del Enlace Valencia (TEV) N 1s22s22p3 H 1s1 NH3 Si los enlaces se forman por el solapamiento de orbitales 2p del nitrógeno con el orbital 1s de cada átomo de hidrógeno, ¿cuál sería la geometría molecular de NH3? TEV predice ángulos de 900 para la superposición de los 3 orbitales 1s con los tres orbitales 2p H-N-H ángulo experimental 107.30 6.29 15 Hibridación (TEV-VD) mezclar dos o más orbitales atómicos puros para formar nuevos orbitales atómicos denominados híbridos 1. Mezclar por lo menos dos OA puros no equivalentes (por ejemplo s y p). Los OA híbridos tienen forma muy diferente de los OA originales 2. El número de OA híbridos es igual al número de OA puros usados en el proceso de hibridación 3. Los enlaces covalentes se forman por: a. Solapamiento de OA híbridos con OA puros b. Solapamiento de OA híbridos con otros OA híbridos 6.30 Formación de los orbitales híbridos sp 2 O.A. puros enlaces 2 O.A. híbridos “sp” pz-sp sp-pz σ σ 6.31 16 Formación de orbitales híbridos sp2 3 O.A. puros 3 O.A. híbridos sp2 6.32 Formación de orbitales híbridos sp3 Hibridación 4 O.A. puros 4 O.A. híbridos sp3 6.33 17 Formación de enlaces covalentes 6.34 Nitrógeno con hibridación sp3 en NH3 Predecir el ángulo correcto del enlace 6.35 18 ¿Cómo predecir la hibridación del átomo central? •contar el número de pares enlazados al átomo central (m) •contar el número de pares aislados del átomo central (n) •m + n = geometría o distribución espacial m+n Hibridación Ejemplos 2 sp BeCl2 3 sp2 BF3 4 sp3 CH4, NH3, H2O 5 sp3d PCl5 6 sp3d2 SF6 6.36 Hibridación sp de un átomo de carbono Estado fundamental Promoción de electrón Estado hibridado sp orbitales sp 6.37 19 Hibridación sp2 de un átomo de carbono Estado fundamental Promoción de electrón Estado hibridado sp2 orbitales sp2 6.38 El orbital 2pz es perpendicular al plano de los orbitales híbridos 6.39 20 Enlace en el etileno enlace σ: la densidad electrónica se encuentra entre los dos átomos enlace π: la densidad electrónica se encuentra por arriba y por debajo del plano internuclear 6.40 Formación del enlace π en la molécula de etileno 6.41 21 Enlace en el acetileno 6.42 Moléculas con enlaces múltiples Enlace simple 1 enlace sigma Enlace doble 1 enlace sigma y 1 enlace pi Enlace triple 1 enlace sigma y 2 enlaces pi ¿Cuántos enlaces σ y π hay en la molécula de ácido acético ( vinagre) CH3COOH? O H H C C O H enlaces σ = 6 + 1 = 7 enlaces π = 1 H 6.43 22 Ruptura de la localización • SO2 molécula con más de una estructura de Lewis O ↔ O S O S S-O simple = 1.54 Å S=O doble = 1.40 Å S-O experimental = 1.43 Å O 1.43 O S 1.43 O 6.44 Teoría de la Resonancia Pauling S S O O O estructura contribuyente I O estructura contribuyente II E S O S O O O Estructuras contribuyentes Energía de resonancia Híbrido de resonancia 6.45 23 Teoría del Orbital Molecular (TOM) • SO2 - la estructura sigma no se modifica - se solapan los orbitales atómicos pz pz de S pz de O1 pz de O2 3 Orbitales Moleculares π deslocalizados policéntricos - se forma una nube π deslocalizada, los electrones no pertenecen a un enlace en particular sino que están móviles - el enlace no es ni simple ni doble, tiene una longitud intermedia 6.46 Los orbitales moleculares deslocalizados no están confinados entre dos átomos enlazados adyacentes, sino que en realidad se extienden sobre tres o más átomos 6.47 24 Densidad electrónica arriba y abajo del plano de la molécula de benceno. 6.48 E S O S O O O estructuras localizadas Energia de deslocalización Estructura deslocalizada 6.49 25