Union receptores intracelulares 18 mayo
Anuncio
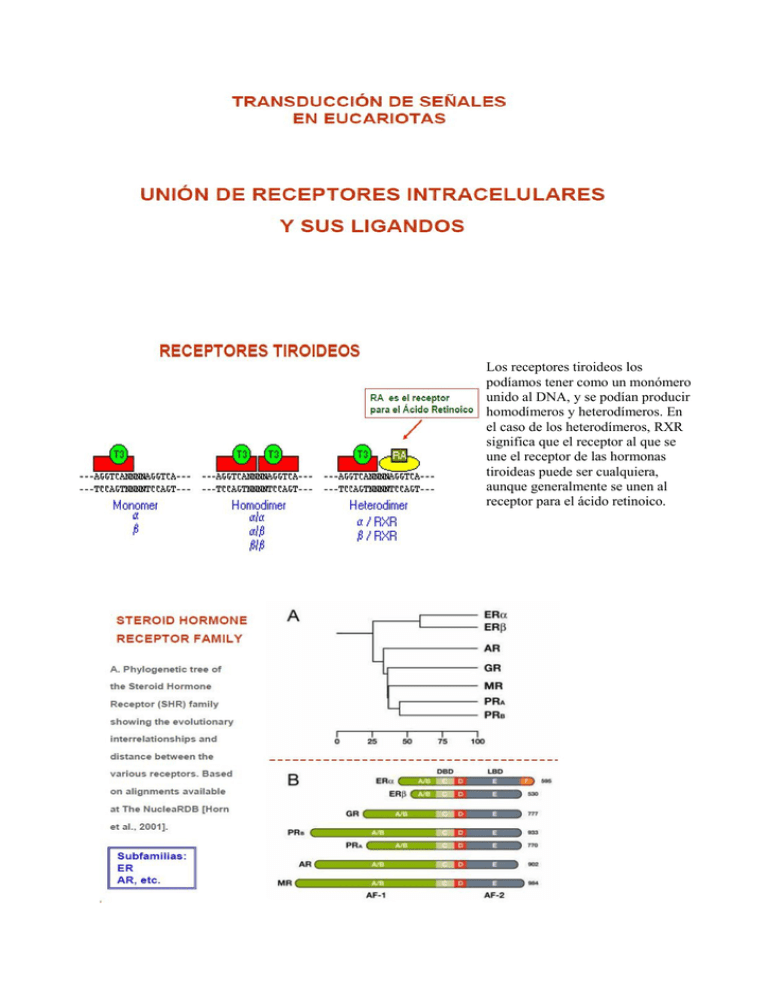
Los receptores tiroideos los podíamos tener como un monómero unido al DNA, y se podían producir homodímeros y heterodímeros. En el caso de los heterodímeros, RXR significa que el receptor al que se une el receptor de las hormonas tiroideas puede ser cualquiera, aunque generalmente se unen al receptor para el ácido retinoico. Todos estos receptores vienen de un tronco común que se he ido separando durante la evolución. En primer lugar se divide en 2 ramas principales: una de ellas se subdivide en los receptores de estrógenos (subtipos alfa y beta) y la otra, posteriormente en el tiempo en receptores para ácido retinoico, glucocorticoides, mineralcorticoides y los receptores de progesterona. Abajo, en la comparación de las moléculas vemos tamaños diferentes (incluso dentro de los mismos subtipos), aunque todos con los mismos dominios estructurales y funcionales. En uno de los receptores de estrógenos aparecen un dominio que no está en el resto, por ejemplo. Los números indican el número de aminoácidos. Su similitud nos permite agruparlos en cuanto a su forma de comportarse. FAMILIA DE RECEPTORES PARA GLUCOCORTICOIDES GR - Predominantemente en el citoplasma (traslación al núcleo) - Ligandos: glucocorticoides, aldosterona, progesterona y andrógenos - Grandes similitudes estructurales - La familia más reciente desde el punto de vista evolutivo - 2 casos de isorreceptores: - progesterona - mineralcorticoides Se van a encontrar sobre todo en el citoplasma tras sintetizarse, y ahí estarán de forma no activa hasta que les llegue el ligando correspondiente y se activen. Son bastante similares entre sí en cuanto a estructura, y se cree que es la familia más reciente desde el punto de vista evolutivo. Sólo aparecen 2 casos de isorreceptores: en los receptores de progesterona y en los de mineralcorticoides. FAMILIA DE RECEPTORES PARA HORMONAS TIROIDEAS TR - Predominantemente en el núcleo - Gran heterogeneidad estructural - Familia más antigua desde el punto de vista evolutivo - Múltiples isorreceptores - Región A/B corta - Gran afinidad por el DNA - No forman complejos estables con hsps - Heterodimerización Están sobre todo en el núcleo y los isorreceptores son múltiples (se puede medir de alguna forma el tiempo que llevan esas moléculas en el organismo porque tienen más codificación). Presentan una región A/B corta y una gran afinidad por el DNA que se puede explicar teniendo en cuenta que ya están en el núcleo, encima del DNA. No formarán complejos estables con las proteínas de choque térmico aunque las necesitan para la biosíntesis (no quedan unidos a ella). En síntesis vemos que tienen características opuestas a los anteriores. FAMILIA DE RECEPTORES PARA ESTRÓGENOS ER - Intermedia en sus características - En núcleo y citoplasma OTROS - Homólogas a receptores nucleares sin ligando conocido - Gran diversidad estructural - Algunos receptores intracrinos cuyos ligandos son metabolitos celulares La familia de receptores para el estrógeno presentan características intermedias entre los anteriores, existiendo tanto en el núcleo como en el citoplasma. “Otros” agrupa a una serie de moléculas proteicas con características homólogas a los receptores nucleares pero no se les conoce ligando. Engloban algunos receptores intracrinos, cuyos ligandos serán moléculas que están dentro de la célula (por ejemplo, metabolitos celulares). La hormona reconoce a la célula diana y se tiene que unir a su receptor específico para que exista una respuesta celular. Entre medias de esto hay una serie de fases (que ya estudiaremos). Se suelen reunir bajo el epígrafe “activación del receptor” (el receptor está inactivo y cuando llega el ligando se producen una serie de cambios). Es una vía importantes para las 2 clases de receptores (en ellos hay algunas cosas que suceden igual y otras que son diferentes). ACTIVACIÓN DE RECEPTORES NUCLEARES - Unión a proteínas de choque térmico durante la biosíntesis → separación al unirse al ligando - Cambio conformacional - Dimerización - Unión del ligando → aumento de la afinidad por DNA → núcleo - Fosforilación: datos no concluyentes Los receptores están unidos a proteínas de choque térmico durante la biosíntesis hasta que se separan al unirse el ligando. Se produce un cambio conformacional del receptor, movilizándose una serie de hélices α. Además se van a dimerizar: antes estaban como monómeros en citoplasma o núcleo. Cuando se les une el ligando presentan un aumento de su afinidad por el DNA (lógico, ya que su acción va encaminada a unirse al DNA y activar la transcripción) y se translocan al núcleo. Hay una serie de estudios sobre la fosforilación de los receptores: parece que se fosforilan pero hay una serie de datos que no son concluyentes (algunos encuentran evidencias que lo afirman, otros que no). ACTIVADORES DE RECEPTORES NUCLEARES Fosforilación * Fosforilación de GR s en sitios consenso para proteinquinasas dirigidas por Pro Fosforilación de GR s por 2-3 veces Desfosforilación: después de la unión al núcleo → asociada al reciclaje → no fosforilación → no vuelven a entrar en el núcleo * Fosforilación de TR s Hay 2 sitios de fosforilación en Trα1: la fosforilación de al menos uno es necesaria para la actividad biológica completa En Trβ1 la fosforilación aumenta la transcripción y la unión al DNA En GR se sabe que se da en sitios consenso para protein kinasas que van a estar dirigidas por prolinas. La fosforilación aumenta cuando se les une el ligando (si no se une no hay fosforilación). Sin embargo, esta fosforilación no es permanente: se da después una desfosforilación. Se produce tras la unión al núcleo y está asociada al reciclaje (tras la transducción de la señal se liberan del ligando y esperan a otro nuevo). Si no hay fosforilación no habrá reciclaje y no pueden volver a entrar en el núcleo (parece ser un proceso necesario para el ciclo correcto de estos receptores). En el caso de los receptores de hormonas tiroideas, hay 2 sitios de fosforilación en uno de los isorreceptores (Trα1) y hace falta que se fosforile al menos uno para que la actividad biológica de ese isorreceptor (esa molécula) sea completa. Sin embargo, en Trβ1 parece que la fosforilación aumenta la transcripción y la unión al DNA. Así, la fosforilación puede activar moléculas para que realicen su función adecuadamente. UNIÓN DE HORMONAS A SU RECEPTOR INTRACELULAR - Cambio conformacional del receptor - Disociación de inhibidores de la activación (como la hsp90) - Formación del dímero - Fosforilación - Translocación al interior del núcleo - Unión a DNA (HRE) y a otros factores de transcripción - Activación de la transcripción de los genes que están al lado - Separación del ligando - Reciclamiento del receptor (desfosforilación) ya que han cumplido la transducción → activación sin ligando: choque térmico (GR) Esto sería lo que sucede, en orden temporal. Al final de la transducción, si son receptores que estaban en el citoplasma se quedarán ahí, si están en el núcleo irán al núcleo. Quedan libres para volver a unir otro ligando. Hay excepciones: muchos receptores de glucocorticoides se pueden activar sin ligando. Se activan por un choque térmico (elevación brusca de la temperatura). Los investigadores lo justifican diciendo que como estas moléculas realmente son factores de transcripción, han conservado el hecho de poder ser activados de otras formas (anteriormente en el proceso evolutivo lo podían hacer). La característica de poderse activar sin ligando hace que puedan por ejemplo desencadenar una reacción inflamatoria más rápido que si tuviesen que esperar a determinados mensajeros. Dado un receptor inactivo, observamos sus diferentes dominios estructurales (como el de unión al ligando). Se le van a unir proteínas de choque térmico que lo mantienen inactivo (son proteínas inhibidoras en conjunto). En el momento en que el ligando se une, cambia la conformación de la molécula, se separa la hsp90 (un ejemplo de proteína inhibidora) y se le une otra proteína (el co-activador). Al mismo tiempo, si estaba en el citoplasma va a pasar al núcleo, se une al DNA en el “elemento de respuesta hormonal”(donde se tiene que unir) y comienza la transcripción de los genes que tiene a continuación). En el caso de los receptores de glucocorticoides, el cortisol por ejemplo entra en la célula a través de la membrana y entonces el receptor, que tiene unidas la hsp60, hsp90 y la inmunofilina (proteína relacionada con el cambio conformacional de otras proteínas) se separa de ellas. Se transloca al núcleo, se dimeriza y se coloca sobre el DNA, activándose la transcripción. Los receptores de estrógenos suelen estar más en el núcleo (aunque hay de los 2 tipos). En el núcleo, el receptor inactivo con su hsp90 unida se separa cuando entra el ligando, formándose el dímero (que se unirá a la forma correspondiente del DNA). Tiene además unido un co-activador que ayudará a la transcripción (a activar el receptor). Se trata de un co-activador con actividad histona acetil transferasa (produce la acetilación de las histonas). La mayoría de los receptores TR están en el núcleo, ya unidos al DNA. Aunque ya estén dimerizados y colocados en su sitio correspondiente del DNA tienen un co-rrepresor unido cuando no tienen su ligando. Esta molécula tiene actividad histona desacetilasa (la transcripción está reprimida). Al llegar la hormona tiroidea y unirse, se separa el correceptor y se une un coactivador (con actividad histona acetil transferasa). RXR representa a cualquier receptor que se pueda unir al receptor de hormonas tiroideas. DR4 viene de directo (D), repetición ( R ) y el 4 se refiere a que hay 4 nucleótidos entre medias de las dos cadenas. Como vemos en el dibujo, está toda la maquinaria colocada pero no hay transcripción por estar unido el correpresor. Cuando aparece la hormona tiroidea T3 se une y provoca que se separa el producto represor, la maquinaria de transcripción se mueve y se produce una transcripción basal. Podría darse una transcripción activada (más rápida) que se produce cuando a la estructura se le une un coactivador. Los cofactores pueden ser correpresores o coactivadores, y permiten modular la velocidad de transcripción de determinados genes como respuesta a las hormonas tiroideas. Observamos la hormona del productor tiroideo (TR) cuando no hay T3 y cuando sí que hay. Cuando no lo hay, no se dará la transcripción. Cuando llega, el complejo de coactivación provocará una activación por acetilación de las histonas. La flecha superior indica la actividad desacetilasa del correceptor, la inferior se refiere a la actividad acetilasa del coactivador. La hormona esteroidea viene por la sangre unida a una proteína de la que se tiene que separar antes de entrar en la célula. Una vez dentro, o bien entra directamente al núcleo o se une a receptores del citoplasma, que son inactivos y tienen unidas proteínas. A continuación se activan los receptores y se separan dichas proteínas, translocándose el receptor al núcleo. En el caso de que hayan entrado directamente al núcleo, se activa el receptor y se llega a la misma situación. En ambos casos se van a unir a la molécula de DNA y se produce la transcripción a mRNA, que sale al citoplasma y se transforma en una proteína, provocando una respuesta biológica. Este proceso es bastante largo y habrá mensajeros que no pasen por él. Los que tienen receptores intracelulares van a realizarlo siempre. Un ejemplo es el de los mecanismos moleculares de la acción de la testosterona. Se puede unir bien la testosterona o bien un metabolito activo de ella (el 5α-dihidroxitestosterona). Ambas son activas pero no tienen exactamente las mismas funciones. Hay otras moléculas que también se unirán a la RNApol para producir la transcripción (factores de transcripción generales, por ejemplo). Este es el metabolismo de la testosterona: cómo pasa de testosterona a 5α-dihidroxitestosterona. Lo cataliza una enzima reductasa 5α de tipo 2. Observamos los 2 dedos de zinc (dominio de unión al DNA) y cómo en la caja P hay 3 aa que van a encontrar realmente el elemento de respuesta hormonal y unirse a él. En la caja D están los aminoácidos que van a formar parte de las uniones con el otro monómero y formar dimerización. Se observan también los átomos de Zn y cisteínas correspondientes que da lugar a estos 2 dedos de Zn (que no son del mismo tamaño como se ve aquí). Aquí se indica cómo se forma esta vía y cómo puede estar unido a otro tipo de señalización que al final va a dar lugar a la transducción. Hay una serie de reguladores que se unen y van complicando las vías (no hay una sola). No se conocen todas las moléculas que van a formar parte de todas las vías. Aparecen también correguladores en la transcripción y la respuesta. En este cuadro tenemos los receptores intracelulares, cuyos ligandos son moléculas de tipo lipofílico o hidrofóbico. Ya veremos que el óxido nítrico también va a tener receptores intracelulares (no serán como los vistos hasta ahora), concretamente una guanilil ciclasa citosólica. (Consultar si se quiere ampliar). Página web dedicada íntegramente a receptores nucleares y sus ligandos.

