SERIE 5
Anuncio

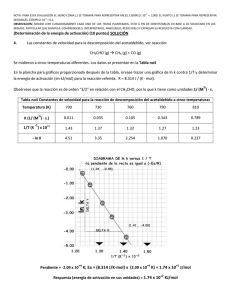
SERIE 5 CINETICA QUÍMICA Conocimientos previos: - Velocidades de reacción Orden de reacción Ecuación de Arrhenius Interpretación de gráficos Mecanismos Fe 1) Para la reacción N2 (g) + 3 H2 (g) → 2 NH3 (g) a) Escriba la expresión de las velocidades de desaparición de reactivos y aparición del producto. b) ¿Qué relación hay entre estas velocidades? c) ¿Cómo actúa el catalizador? 2) A 27 ºC se obtuvieron los siguientes datos para la reacción: 2 NOCl (g) → 2 NO (g) + Cl2 (g) [NOCl] inicial (mol/L) Velocidad inicial (mol/L.s) 0,3 0,6 0,9 3,6 10 -9 1,44. 10 -8 3,24 10 -8 a) ¿Cuál es el orden de la reacción? b) Escriba la expresión de la ley de velocidades (ecuación cinética) c) Determine la constante de velocidad Rta: a) 2; b) k = 4. 10 -8 M -1 s -1 3) Se han determinado los siguientes valores de la constante de velocidad en función de distintas temperaturas para la descomposición del pentóxido de dinitrógeno gaseoso: T (K) 338 318 298 273 k s -1 4,87 10 -3 4,98 10 -4 3,46 10 -5 7,87 10 -7 a) Escriba la expresión de la ley de velocidades (ecuación cinética) b) Determine el tiempo de vida media a 25 ºC c) Calcule el tiempo necesario para que se descomponga el 90 % del pentóxido de dinitrógeno inicial a 25 ºC d) Determine la energía de activación de la reacción Rta: b) 5,6 h; b) 18,5 h; c) E = 105 kJ/mol 4) La concentración inicial de un medicamento es, al envasarse, 100 unidades por mL. Se sabe que el medicamento se hace ineficaz cuando su concentración es menor que 50 unidades por mL Si la constante de velocidad de la reacción de descomposición de dicho medicamento es 2,09 10-5 h-1, a 25ºC. ¿Cuál es el tiempo que puede conservarse el medicamento a partir de la fecha de envase? Rta: 3,79 años 5) Para la reacción de descomposición del ioduro de hidrógeno en fase gaseosa, a 391 ºC, se obtuvieron los siguientes valores: Tiempo (min) 0 200 417 715 [HI] (mol / L) 2 10 -2 1,8 10 -2 1,6 10 -2 1,4 10 -2 a) Indique el orden de reacción b) Indique cuál es la composición del sistema al cabo de 2 horas Rta: a) 2º; b) [H2]=[I2]= 6,25 10 -4 M 6) Se tiene una solución de un medicamento que se descompone a temperatura ambiente a) Si la energía de activación es 104,5 kJ/mol y k a 25ºC es 43,5 10 -5 h -1 ¿ a qué temperatura debe almacenarse el medicamento para que la constante de velocidad sea menor que 2,4 10-5 h -1 c) Discutir en qué condiciones sería viable la distribución y venta de un medicamento como el indicado. Rta a) 5,8 ºC 7) ¿Qué energía de activación se necesita para que la velocidad de reacción aumente en un factor de 3 al elevar la temperatura a) de 300 a 310 K b) de 1000 a 1010 K? Rta: a) 84,8 kJ /mol; b) 919 kJ/mol 8) La reacción de descomposición de un antibiótico tiene una energía de activación de 107,5 kj/mol y el factor A de la ecuación de Arrhenius tiene un valor de 5.1013 s -1. Se pide: a) ¿a qué temperatura tendrá que conservarse el medicamento para que tenga un tiempo de vida media de 30 días? b) ¿Cuál será el tiempo de vida media de ese antibiótico si se lo conserva a 75 ºC? Rta: a) 4,6 ºC ; b) 3,3 minutos 9) La constante específica de reacción para la descomposición de un insecticida en solución acuosa a 12 ºC es 1,45 años -1. Se produce un accidente y una cierta cantidad de insecticida es arrastrada hacia un lago el 1º de junio, lo que origina una concentración de 5 10-7 M. Suponga que la temperatura del lago es 12ºC y que la reacción de descomposición es: 2 A → C a) ¿Cuál será la concentración del insecticida el 1º de junio del año siguiente? b) ¿Cuánto tiempo tomará para que la concentración del insecticida se reduzca a un 30% de la concentración inicial? c) ¿Cuál será el tiempo de vida media para esta reacción? Rta: a) 2,75 10-8 M; b) 0,415 años; c) 0,24 años 10) La reacción de descomposición del compuesto A se produce en una sola etapa de acuerdo a: A → B+ C, transcurridos 20 minutos desde el comienzo de la reacción se descompuso un 35,6 % de A. a) ¿Cuál debería ser el porcentaje de descomposición después de transcurridos otros 20 minutos? b) Escriba la ley de expresión de velocidad. Rta: a) 58,5% 11) . El peróxido de hidrógeno (H2O2) se descompone espontáneamente según la siguiente reacción: 2 H2O2 (ac) → 2 H2O (l) + O2 (g) Experimentalmente se obtiene que k = 1. 10-3 hs. -1, a 30 ºC Para determinar la concentración real de un frasco etiquetado como H2O2 0,2 M se descomponen 10 mL de dicha solución, usando catalizador, recogiendo sobre agua 20 mL de oxígeno medidos a una presión atmosférica de 1 atm y a 30 ºC. a) Escriba la expresión de la ley de velocidad b) ¿Cuánto tiempo lleva preparada la solución del frasco? c) Calcular el tiempo de vida media Pvagua a 30ºC = 31,82 mm Hg Rta: b) ; c) 12) La reacción: A + B → P, es de orden cero respecto del reactivo B y de orden dos respecto del reactivo A. Si partiendo de una concentración 0,1 M de A al cabo de 5 minutos la misma se reduce a la décima parte, determinar: a) La constante específica de reacción b) El tiempo de vida media c) ¿Cuál de los siguientes mecanismos es consistente con los datos cinéticos? Justificar la respuesta Mecanismo I Mecanismo II Mecanismo III 2 A → A2 A2 + B → A + P A + B → AB AB → P Rta: a) k= 2A → C + D B+C → P b) c) 13) Para la reacción A + B Æ C , ΔH < 0, se obtuvieron los siguientes datos, a temperatura constante: Experiencia nº [A] [B] 1 2 3 0.15 0,30 0,30 0,30 0,60 0,30 velocidad de formación de C (M/s) 7,0 10-4 2,8 10-3 1,4 10-3 a) ¿Cuál es la expresión de la ley de velocidad? b) ¿Cuál es el valor de la constante de velocidad, k? c) Dibujar el diagrama de energía en función del avance de reacción Rta: a) b) 14) Se estudió la cinética de la reacción: CO (g) + NO2 (g) Æ CO2 (g) + NO (g) y se obtuvieron los siguientes datos experimentales, a 100 ºC: Experimento Nº 1 2 3 4 [CO] (mol/L) 5,0 x10 -4 5,0 x10 -4 1,0 x10 -3 1,5 x10 -3 [NO2] (mol/L) 0,36 x10 -4 0,18 x10 -4 0,36 x10 -4 0,72 x10 -4 Velocidad inicial mol/ L hora 3,4 x 10 -8 1,7 x 10 -8 6,8 x 10 -8 ? a) Escribir la expresión de la ley de velocidad b) Calcular la constante de velocidad (k) c) ¿Cuál es la velocidad inicial de la reacción en el experimento 4?