UNIDAD IV Compuestos anulares de cinco miembros con un
Anuncio
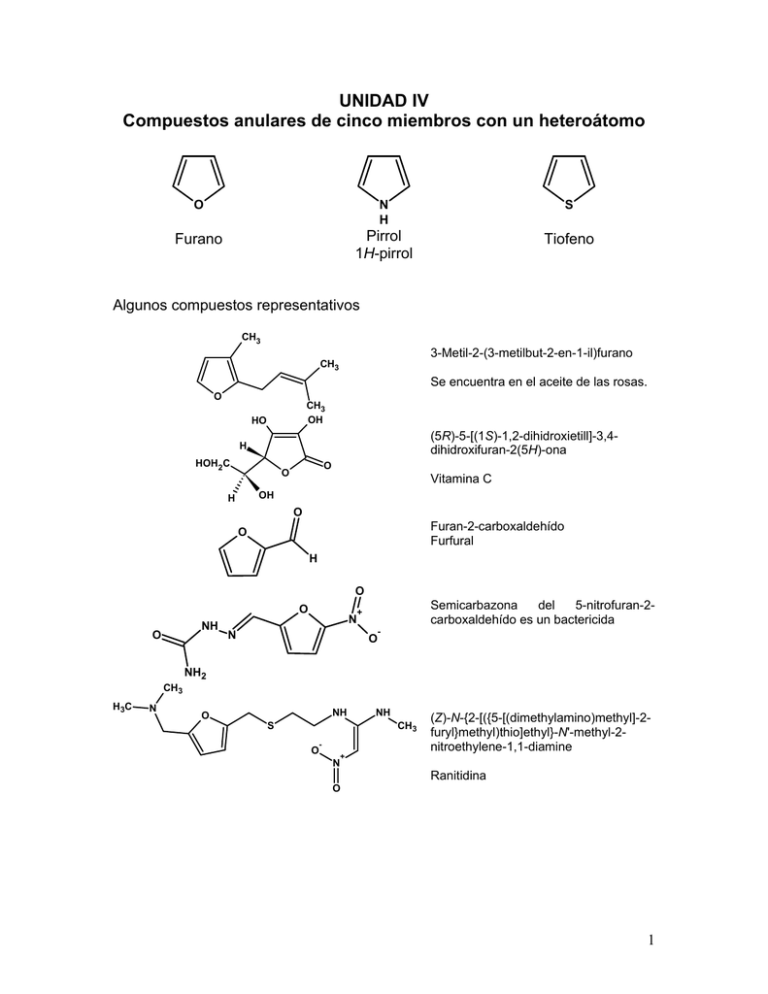
UNIDAD IV
Compuestos anulares de cinco miembros con un heteroátomo
O
N
H
S
Furano
Pirrol
1H-pirrol
Tiofeno
Algunos compuestos representativos
CH3
3-Metil-2-(3-metilbut-2-en-1-il)furano
CH3
Se encuentra en el aceite de las rosas.
O
CH3
OH
HO
(5R)-5-[(1S)-1,2-dihidroxietill]-3,4dihidroxifuran-2(5H)-ona
H
HOH2C
O
O
Vitamina C
OH
H
O
Furan-2-carboxaldehído
Furfural
O
H
O
O
NH
O
N
Semicarbazona
del
5-nitrofuran-2carboxaldehído es un bactericida
+
-
N
O
NH2
CH3
H3C
N
NH
O
S
NH
CH3
-
O
N
(Z)-N-{2-[({5-[(dimethylamino)methyl]-2furyl}methyl)thio]ethyl}-N'-methyl-2nitroethylene-1,1-diamine
+
Ranitidina
O
1
O
OH
OH
O
N
H
Porfobilinógeno
NH2
Cl
Pirrolonitrina
Cl
NO2
N
H
Cl
O
HO
Cl
N
Pioluteorina
CH3
OH
H3C
Feromona de los insectos
COOCH3
N
H
N
H
OH
(S)-Prolina
N
Nicotina
H
O
H
CH3
N
O
HN
5-[(3aS,4S,6aR)-2-oxohexahydro-1Hthieno[3,4-d]imidazol-4-yl]pentanoic
acid
NH
H
H
Biotina (Vitamina H)
S
H
(CH2)4CO2H
2
Resonancia de los heterociclos
.
.
C
C
H
H
.
.
C
C
H
H
..
N
H
H
H
H
H
X
X
X
X
X
Calores de Combustión y energías de estabilización de heterocíclos de
cinco miembros
H, Kcal/mol
Compuesto
Experimental
Benceno
Furano
Pirrol
Tiofeno
789
507
578
612
Calculado
E.E.
827
523
594
623
37.9
16
16
11
Momentos Dipolares de los heterocíclos
O
1.7 D
O
0.7 D
N
H
1.57 D
N
H
1.80 D
S
0.52 D
S
1.87 D
3
El pirrol solo puede formar una sal a expensas de su carácter aromático. Es una
base muy débil pKa = 0.4, que en realidad se protona de preferencia en un
átomo de carbono del anillo en ácido fuerte; se polimeriza en estas condiciones
probablemente por ataque de una molécula de pirrol, no protonada, sobre su
ácido conjugado.
H
H
+
H
H
N
N
H
H
+
H
N
H
Los furanos reaccionan violentamente con ácidos fuertes, pero la hidrólisis
cuidadosa en ácidos minerales diluidos puede producir compuestos 1,4dicarbonílicos con buenos rendimientos.
H
H
CH3
H3C
O
H2O, CH3COOH
(H2SO4),
CH3
H3C
O
H2O
CH3
H3C
H
O
O
H
-H
(86 - 89%)
CH3
H3C
CH3COCH2CH2COCH3
H
O
O
MÉTODOS DE SÍNTESIS
Furano
El furano se puede obtener económicamente de su derivado 2-aldehído, el
furfural, que a su vez se obtiene con facilidad por hidrólisis de polisacáridos de
cáscaras de avena o de otras sustancias naturales que contienen fragmentos de
pentosas, como mazorcas de maíz y paja.
4
CHO
CHO
CHO
H
C
OH
HO
C
H
H
C
OH
H
12% HCl
C
OH
C
H
C
OH
C
O
H
C
H
H
C
OH
H
H
CH2OH
CH2OH
CH2OH
H
H
C
H
C
H
H 2C
O
O
OH
H
O
H
CH3
CHO
O
CHO
H
(1) NaOH
2
CHO
+
O2
COOH
Cu2O / Ag2O
O
200oC
O
O
(2) H3O
(86-90%)
(72-78%)
El furano es un líquido, p. eb. 31°C, ligeramente soluble en agua.
Pirrol
RNH2, H2O
Al2O3, 400oC
O
N
R
El pirrol se prepara comercialmente mediante destilación fraccionada de
alquitrán de hulla y aceite de hueso, o haciendo pasar furano, amoniaco y vapor
sobre un catalizador de alúmina a 400°C. En un segundo proceso se puede
sustituir el amoniaco por una amina primaria, y en este caso se obtiene un pirrol
1-sustituido.
H
OH
H
OH
H
H
NH4
glicerol
OOC
OHHO
COO
NH4
N
H
(37-40%)
El pirrol también se puede obtener en el laboratorio calentando mucato de
amonio; a temperaturas elevadas, la sal de amonio se disocia dando el ácido
libre, que sufre deshidratación, descarboxilación y por último ciclación con el
amoníaco.
El pirrol, es un líquido, p.eb. 129°C, que tiende a oscurecerse cuando se expone
al aire y la luz. Sus moléculas se encuentran asociadas en fase líquida.
5
Tiofeno
CH2
COO
Na
CH2
COO
Na
+ P 2S 3
S
(25-30%)
La síntesis comercial de tiofeno se efectúa mediante ciclación de butano,
butadieno o butenos con azufre. A escala de laboratorio, el tiofeno se prepara
calentando una mezcla de succinato de sodio y trisulfuro de fósforo. Puede
utilizarse un ácido succínico sustituido.
El tiofeno es un líquido, p.eb. 84°C, que se encuentra en el alquitrán de hulla. Su
presencia como contaminante en el benceno derivado del alquitrán de hulla fue
detectada por Víctor Meyer en 1882, quién acuño el término “Tiofeno” para
resaltar su aparente similitud con el benceno.
Síntesis de Paal-Knorr
H
O
C6H5
H
C6H5
O
C6H5
H
OH
PPA
O
O
C 6H5
C6H5
140-150OC
H
C6H 5
En este procedimiento se calienta un compuesto 1,4-dicarbonílico enolizable con
un agente deshidratante (H2SO4, P2O5, ZnCl2, etc.), o bien, con amoniaco o una
amina primaria, o con un sulfuro inorgánico.
H3C
H
OH
H
CH3
CH2
C
O
NH4CO3
NH2
CH2
C
O
110-115oC
CH3
CH3
O
CH3
H3C
HO
N
H
OH
H3C
N
H
CH3
(81-86%)
6
H
CH2
CH2
P2S3
C (CH2)2COOCH 3
H5C6 C
C (CH2)2COOCH 3
H5C6 C
95oC
O
O
CH2
CH
O
S
H
H
(CH 2)2COOCH 3
H5C6
S
H5C6
OH
(CH 2)2COOCH 3
S
(50%)
H
Síntesis de Furano de Feist-Benary
CH3
COOC 2H5
H 2C
C
C
+
O
H5C2OOC
O
H2C
piridina
benceno
Cl
CH3
CH3
H3C
O
25oC
Es la reacción entre una -halocetona o un aldehído con un -cetoéster (o dicetona) en presencia de una base tal como hidróxido de sodio o piridina.
Síntesis de Pirroles de Hantzsch
COOC 2H5
H2C
C
COOC 2H5
NH3
O
HC
+
éter
C
CH3
H3C
C
O
CH3
H3C
N
H
H2C
NH2
H5C2OOC
CH3
Cl
Cuando una base nitrogenada como el amoniaco o una amina primaria
participan en la reacción, la reacción con el cetoéster precede a la condensación
con el componente halocarbonílico, produciéndose predominantemente pirrol.
7
Síntesis de Pirroles de Knorr
COOC 2H5
H2C
C
NaNO2
C
O
CH3COOH
CH3
C
N OH
Zn
CH3COOH
O
NH2 CH3COCH2COOC2H5
C
O
N OH
C
+
O
C
CH3
N
H
(57-64%)
H3C
CH3
Zn
O
CH3COOH
CH CH3
CH3
COOC2H5
H5C2OOC
CH3COOH
CH3
CH3
C
C
CH3
CH3
C
H3C
COOC 2H5
COOC 2H5
CH3
H3C
N
H
O
(40-44%)
CH3
Consiste en la condensación de una -aminocetona o un -cetoéster con una
cetona o cetoéster en presencia de reactivos como ácido acético (con
frecuencia) o álcalis (con menor frecuencia), para producir pirroles. Las aminocetonas suelen prepararse por nitrosación de -cetoésteres o -dicetonas
para dar la oxima correspondiente, la cual posteriormente se reduce con zinc en
ácido acético.
Reacciones
Sustituciones electrofílicas.
X
E
X
-H
H
H
H
X
E
E
X
E
E
H
H
X
E
X
E
E
X
-H
X
8
H
E
X
Estado de
transición
H
X
E
E
Energía
H
+
X
E
X
+
E
H
X
Trayectoria de la reacción
O
O
(1) CH3COO NO2
S
O
. SO
+
O
-10oC
(2) piridina
N
SO 3
3
S
O
(51%)
NO2
O
dicloruro de etileno
100-110oC
8-10 horas
S
O
(90%)
OH
O
La sulfonación de furano y pirrol no puede realizarse bajo condiciones ácidas
muy fuertes, por lo que se emplea sulfonato de 1-proto-1-piridinio para obtener
los ácidos 2-sulfónicos respectivos con buenos rendimientos.
9
-25oC
Br
O
H3CO
O
Br
O
OCH3
(72-76%)
H
H
Br2
H
H
CH3OH
CH3COOH,
H
H
CH3COO K
H3COCO
10oC
O
OCOCH3
(70%)
La halogenación directa del furano es muy fuerte, y casi nunca se pueden aislar
productos útiles porque el halogenuro de hidrógeno liberado produce
polimerización. No obstante, en condiciones leves el bromo se adiciona al furano
formando un intermediario inestable, que solvoliza con rapidez con el medio
empleado.
O
O
+
N
H3C
-
O
O
H
H3C
H
O
-10oC
O
H3C
C
O
O
O
NO2
O
NO2
(60%)
La nitración del furano, puede llevarse a bajas temperaturas, utilizando nitrato de
acetilo como electrófilo.
O
O
BF3
+
H3C
O
O
CH3
O
CH3COOH
O
(75-92%)
CH3
La acilación del furano se puede llevar a cabo con facilidad empleando un ácido
de Lewis débil, ya que los productos son relativamente estables ante dichos
ácidos.
O
O
+
S
Cl
CH3
S
CH3
Debido a la elevada estabilidad del tiofeno en condiciones ácidas, la acilación de
Friedel-Crafts puede efectuarse con una gran variedad de catalizadores. Las
posiciones 2 y 3 son atacadas en proporciones 1:1 a 3:1, dependiendo del
reactivo y los catalizadores que se empleen.
10
A continuación se dan algunos ejemplos de otras sustituciones electrofílicas:
POCl 3
CH
(CH 3) 2NCHO
N
H
N
H
N
CH3
CH3COO Na
CH3
H2O
Cl
CHO
N
H
CH 2O
CH2Cl
HCl
S
S
Cuando las posiciones 2 y 5 de los heterociclos anteriores ya tienen
sustituyentes, el ataque electrofílico se efectuará en una o ambas posiciones
(átomos de carbono 3 y 4).
O 2N
O 2N
H
HN
HN
COOC2H5
O
CH3
O
CH3
O
COOC2H5
O
-H
HN
O
O
COOC2H5
O 2N
CH3
HN
COOC2H5
O
CH3
O
H
NO2
NO2
HN
O
O
COOC2H5
-H
CH3
HN
O
COOC2H5
O
CH3
CH2Cl
CH 2O
CH3
H3COOC
S
HCl
ZnCl 2, CHCl 2, TA
CH3
H3COOC
S
(92.6%)
11
Un fenónemo bastante común observado en sustitución electrofílica de algunos
derivados 2,5-disustituidos de furano, pirrol y tiofeno, es el desplazamiento de un
átomo o grupo unido al núcleo por la entrada del electrófilo.
O2N
O2N
H
-H
COOH
H3C
COOH
H3C
O
O
(secundario)
H3C
COOH
O
HNO3
(CH3CO)2 10oC
NO2
-H
C
H3C
O
H3C
H
NO2
O
O
O
(principal)
Br
CH3
Br
CH3
(1) HCN, HCl
H3C
N
H
COOH
(2) H2O
H3C
CHO
N
H
O
O
O
N
N
O
O2N
A
COCH 3
COCH 3
H
N
N
CH3
BF3
N
B
O
COCH 3
N
CH3
CH3
O
O
O2 N
etc
H
N
COCH 3
O
N
O2N
COCH 3
H
COCH 3
H
(CH3CO)2O
100oC
N
N
N
CH3
CH3
CH3
CH3
O
N
O
C
O
H
H3COC
N
O
O 2N
H
N
CH3
H3COC
etc
N
CH3
H3COC
N
CH3
12
a) Sustituyente sustractor de electrones en la posición 3
CHO
CHO
(1) HNO3, (CH3CO)2O
O2N
(2) aq. H2SO4
O
O
COOH
COOH
Br2
Br
CH3COOH, 25oC
S
S
(69%)
b) Sustituyente donador de electrones en la posición 3
CH3
CH3
(1) HCN, HCl
CHO
(2) H2O
O
Br
O
Br
Br
HNO3
S
S
NO2
S
-H
H
H
H
(CH3CO)2O
Br
Br
NO2
S
etc
NO2
NO2
S
(55-60%)
c) Sustituyente Sustractor de electrones en la posición 2
NO2
O
HNO3
NO2
O2N
(CH3CO)2O
O
O2N
NO2
HNO3
NO2
(CH3CO)2O
S
+
O2 N
S
NO2
S
(85%)
(15%)
O2N
NO2
N
H
HNO3
(CH3CO)2O
NO2
N
H
(80%)
+
O2N
NO2
N
H
(20%)
13
HNO3
O
O
O2N
(CH3CO)2O
O
O
CH3
CH3
O2N
HNO3
O
O
(CH3CO)2O
S
+
S
CH3
O
O2 N
S
CH3
(50%)
(50%)
CH3
O2 N
O
HNO3
O
N
H
(CH3CO)2O
N
H
CH3
O
O2 N
+
N
H
CH3
(67%)
(33%)
CH3
d) Sustituyente donador de electrones en posición 2
H
H
NO2
NO2
A
Br
HNO3 fum
Br
S
O2 N
B
S
H
O2 N
(CH3CO)2O
etc
Br
S
0 C
Br
S
O2N
H
-H
Br
Br
o
NO2
-H
Br
S
S
S
H
C
H
O2N
H5C 6
OCH3
S
N
O2 N
S
S
etc
Br
O 2N
S
(57%)
OCH3
OHC
POCl3
S
HNO3
(58%)
O 2N
CH 3
S
(CH3CO)2O
S
Br
CH3
CHO
65-70oC
CH3
-H
H
Br
NO2
CH3
+
S
(30%)
(70%)
NO2
OCH 3
S
HNO3
(CH3CO)2O
-20oC
O2 N
OCH3
S
(36%)
+
OCH 3
S
(24%)
14
Sustituciones Nucleofílicas
Parámetros de activación para el desplazamiento nucleofílico en piperidina a
200°C.
E* kcal
Compuesto
2-clorofurano
Clorobenceno
2-bromofurano
Bromobenceno
2-yodofurano
2-yodo-5-metilfurano
Yodobenceno
22
27
22
24
31
26
23.6
El grupo activador de mayor utilidad es la función carboxi o carbalcoxi, ya que
puede eliminarse con facilidad, como se ve en los siguientes ejemplos.
Br
COOCH3
NaOCH3
H3CO
CH3OH
O
100oC, 90min
H3CO
COOCH3
O
COOCH3
O
(42%)
(1) 10% NaOH
(2) Cu, quinolina
reflujo
OCH3
O
(36%)
C6H5SCu
Br
COOH
O
quinolina
200oC, 4-5 horas
SC6H5
O
(90%)
Los halotiofenos y furanos no activados por un sustituyente electrofílico, a
menudo puede someterse a reacciones de sustitución en condiciones forzadas.
15
Cu2(CN)2
Br
H3C
CN
H3C
piridina,
reflujo 8 horas
S
S
(73%)
Velocidades relativas de desplazamiento de pseudo-primer orden en piperidina a
25°C
Compuesto
Velocidad
m-bromonitrobenceno
p-bromonitrobenceno
o-bromonitrobenceno
5-bromo-2-nitrotiofeno
2-bromo-3-nitrotiofeno
5-bromo-3-nitrotiofeno
4-bromo-2-nitrotiofeno
3-bromo-3-nitrotiofeno
4-bromo-3-nitrotiofeno
1
185
1620
2.84 x 104
6.32 x 105
muy rápida
1360
2.5 x 106
muy rápida
Reacciones de acidez y metalación
Pirrol
+
+
H2O
H3O
N
N
H
pKa 17.5
NO2
pKa 10.6
N
H
16
NaNH2 ó KNH2
NH3 liq.
Enlace iónico
N
Na ó K, Benceno
M
CH3CH2MgBr
éter
N
N
MgBr
H
Enlaces covalentes
n-BuLi
hexano o éter
N
Li
Mecanismo propuesto para la reacción de metalación.
+
H
CH3Li
CH3
N
N
CH3
CH3
Li
Li
N
CH3
Sustitución en el carbono
E
N
E
E
H
N
H
N
H
H
H
H
E
E
H
H
N
N
H
H
Intermediarios en la sustitución electrofílica del pirrol.
17
Sustitución en el nitrógeno
La sustitución en el nitrógeno se favorece por el empleo de (a) la sal de sodio o
potasio, (b) un disolvente polar aprótico y (c) un electrófilo “duro”.
O
R
C
Cl
N
. SO
R
O
3
N
SO 3
N
SO3H
N
(CH3)3SiCl
M
N
Si(CH3)3
O
H3C
CH3
N
O
CH3
H3C
H3C
C
N
N
H3C
+
CN
E
E
N
N
M
M (Li o Mg)
(Li o Mg)
O
+
N
N
N
S
H
MgCl
R
O
R
(80-95%)
18
Protonación
H
H
H
H
H
N
Polímero
H
N
H
pKa -3.60
H
pKa -5.9
N
N
N
H
H
H
Reacciones en el anillo de pirrol
O
O
O
H3C
O
CH3
N
CH3
H
Cl
N
2 Cl2
Cl
Cl
Cl
SO3H
N
H
H
N2
N
N
SO3H
N
H
Sustitución electrofílica en el pirrol
Grupo funcional
introducido
Reactivos y condiciones
Productos
Refs
y notas
HNO3, (MeCO)2O, 20°C
2- y 3- (14:1)
a, b
NO2
2- y 2,5a
Cl
SOCl2, éter
Br
N-Bromosuccinimida
2c
CHO
Me2NCHO, POCl3
2a, d
COMe
MeC≡N+Me, BF-4, luego H2O
2e
COCH2Cl
Me2NCOCH2Cl, POCl
2a, f
H2C=CHCOMe, BF3
2- y 2,5a
CH2CH2COMe
+
CH2O, Me2NH, H
2a, g
CH2NMe2
SO3H
SO3, piridina, 100oC
2 y 2,5a
MeS
MeSCl, K2CO3
2 y 2,5a
+
N=NPh
PhN2 Cl
2a
b J. H. Boyer, Nitroazoles, VCH, Deerfield Beach, Florida, 1986. c H. M. Gilow y
D. E. Burton, J. Org. Chem., 1981, 46, 2221. d La reacción de Vilsmeier; el
electrófilo es CHCl=N+Me2 y el grupo formilo se produce por hidrólisis. e S. C.
Eyley, R. G. Giles y H. Heaney, Tetrahedron Letters., 1985, 26, 4649. f P. Dalla
Croce, C. La Rosa y A. Ritieni, Synthesis, 1989, 783. g La reacción de Mannich;
el electrófilo es H2C=N+Me2.
19
Prueba de Erlich de los Pirroles
H
O
OH
H
N
H
N
H
N
CH3
H
N
CH3
CH3
H3C
N
CH3
H3C
N
CH3
CH3
- H2O
N
N
H
H
H
H
Coloración púrpura
Síntesis de derivados de Porfirinas
PhCHO, H
pirrol
Ph
N
-H
N
H
N
H
H
H
Ph
NH
PhCHO, H
Ph
N
Ph
N
aire
H
N
H
N
etc.
H
N
H
H
HN
Ph
Ph
Ph
N
H
N
H
H
Ph
Ph
H
Ph
H
Propiedades de los pirroles sustituidos
Pirrolocarboxaldehídos
H
H
N
O
H
N
O
H
20
2-Hidroximetilpirroles
R2
R2
R2
R3
R3
R3
N
CH2 OH
N
R1
R1
R1
N
CH2
H
H
H
CH2
Acoplamiento de pirroles a través de un acetoximetilderivado
H3C
H 3C
H3C
H
+
PhCH2O2C
PhCH2O2C
N
R
R H 3C
R
R
N
CH2OAc
CO2tBu
N
H
H
H
CO2tBu
N
H
R= (CH2)2CO2CH3
Nitrofuranos
O
O
H3 C
O
O
O
O
O
CH3
O
CH3
H
H
O
O
H3C
O
O
CH3
O
O
H
CH3
O
Furfurildiacetato
21
O
O
O
N
H
O
O
N
H
O
O
O
H3 C
O
CH3
O
O
O
AcO
H
O
N
AcO
N
H 3C
O
O
O
O
O
H
H3C
O
CH3
Nitrato de acetilo
O
O
H2O
OAc
O2N
O
- 2 AcOH
OAc
H
O
O2N
O
H
5-Nitro-2-furfuraldehído.
Compuestos de interés farmacológico
Ref. A. Kleemann und J. Angel. Pharmazeutische Wirkstoffe. Synthesen.
Patente, Anwendungen. 2. neubearbeitete und erweiterte Auflage. Georg Thieme
Verlag Stuttgart. New York.
Furazolidona
Compuesto Trichomonicida. Tratamiento de trichomoniasis
3-{[(1E)-(5-nitro-2-furil)metilene]amino}-1,3-oxazolidin-2-ona
O
O
NH
H2N
OH
+
(H5C2O)
2-hidrazinoetanol
N
O
O
NH2
O(C2H5)
O
3-amino-1,3-oxazol-2(3H)-ona
carbonato de dietilo
N
CHO
N
O2 N
O
CHO
O
O 2N
O
N
N
O
Furazolidona
22
Nitrofurantoína
Antibacteriano
1-{[(1E)-(5-nitro-2-furil)metilene]amino}imidazolidin-2,4-diona
1-(5-nitro-2-furfurilidenamino)hidantoina
O
NH2
O
O
H2N
+
NH2
hidrazina
H 2N
Cl
NH
OH
ácido
hidrazinoacético
OH
ácido cloroacético
N
H2N
O
KNCO
OH
O
O
H2N
NH
O2N
N
CH(O-COCH 3)2
N
N
O
NH
O
O
O2N
O
1-aminoimidazolidin-2,4-diona
Nitrofurantoina
1-aminohidantoina
Nitrofural o Nitrofurazona
Tratamiento de enfermedades tropicales
2-[(5-nitro-2-furanil)metilen)hirazinocarboxamida
semicarbazona del 5-nitro-2-furaldehido
O
O
CHO
O2 N
NH2
HN
+
NH2
5-Nitro-2-furfuraldehído.
O
O2 N
N
NH
NH2
HCl
Nitrofural
clorhidrato de semicarbazida
O
Nifurzid
Antibacteriano
5-nitro-N'-[(1E,2E)-3-(5-nitro-2-furil)-2-propeniliden]tiofen-2-carbohidrazida
Ácido 5-nitro-2-tiofencarboxilico [3-(5-nitro-2-furanil)-propeniliden)hidrazida
N1-(5-Nitro-2-furilacriliden)-N2-(5-nitro-2-tienil)hidrazina
O
O2N
S
NH
NH2
+
5-nitrotiofen-2-carbohidrazida
O2N
O
CH=CH-CHO
(2E)-3-(5-nitro-2-furil)acrilaldehido
O
O2 N
O
S
NH
NO2
N
Nifurzid
23
Nifurtimox
Tratamiento de la Trypanosomiasis americana (Enfermedad de Chagas)
1,1-dioxido de 3-metil-N-[(1E)-(5-nitro-2-furil)metilen]tiomorfolin-4-amina
HO
O
HO
KOH
+
SH
S
2-sulfaniletanol
(2/mercaptoetanol)
KHSO4
HO
CH3
2-metiloxirano
CH3
1-[(2-hidroxietil)sulfanil]propan-2-ol
O
H2O2
S
H3C
2-metil-1,4-oxatiano
O
O
O
S
H2N
O
NH2
H2N
N
O2 N
S
hidrazina
O
O2N
N
O
O
CHO
H3C
Nifurtimox
H3C
4,4-dioxido de
2-metil-1,4-oxatiano
S
O
O
H3C
N
1,1-dioxido de
3-metiltiomorfolin-4-amina
Nifurprazina
Antibacteriano. Tratamiento de Enfermedades Tropicales.
6-[(E)-2-(5-nitro-2-fuil)vinil]piridazin-3-amina
1-(5-nitro-2-furil)-2-(6-amino-3-piridazil)etileno
3-amino-6-[2-(5-nitro-2-furil)-vinil]piridazina
O
N
O2N
CHO
H3C
+
O
N
NH
H3C
O
CH3
O
O
H3C
5-nitro-2-furfuraldehido
N-(6-metilpiridazin-3-il)acetamida
N
O2N
N
HCl
NH
O
NH2
O2N
O
O
H3C
N
N
Nifurprazina
N-{6-[(E)-2-(5-nitro-2-furil)vinil]piridazin-3-il}acetamida
24
Nifuroxazida
Antiséptico
4-hidroxi-N'-[(1E)-(5-nitro-2-furil)metilen]benzohidrazida
1-(p-hidroxibenzoil)-2-(5-nitrofurfuriliden)hidrazina
5-nitro-2-furfuraldehido p-hidroxibenzoilhidrazona
O
O
H2N
H2N
+
NH2
NH
O
CH3
hidrazina
OH
OH
4-hidroxibenzohidrazida
O
O2 N
O
O2 N
CHO
NH
N
O
OH
Nifuroxazida
Nifuratel
Antibacteriano, antifúngico, antiprotozoario (Trichomona vaginalis)
5-[(metillsulfanil)metil]-3-{[(1E)-(5-nitro-2-furil)metilen]amino}-1,3oxazolidin-2-ona
5-(metilmercaptometil)-3-(5-nitrofurilidenamino)-2-oxazolidinona
5-[(metiltio)metil]-3-[(5-nitrofurfuriliden)amino]-2-oxazolidinona
O
OH
Cl
+
H3 C
SH
H2N
Cl
S
hidrazina
CH3
metanotiol
2-(clorometil)oxirano
NH2
1-cloro-3-(metiltio)propan-2-ol
O
O
O
OH
H2 N
NH
(H 5C2O)
S
O(C2H5)
S
N
H2N
CH3
CH3
1-hidrazino-3-(metiltio)propan-2-ol
carbonato de dietilo
3-amino-5-[(metiltio)metill]-1,3-oxazolidin-2-ona
O
O
O2 N
CHO
O
H3C
S
N
N
Nifuratel
O
NO2
25
Tenonitrazol
Antifúngico, antiprotozoario (Trichomonas vaginalis)
N-(5-nitro-1,3-tiazol-2-il)tiofen-2-carboxamida
O
O
O2 N
S
S
NH2
Piridina / KOH
+
S
O2N
S
NH
Cl
N
N
5-nitro-1,3-tiazol-2-amina
cloruro de tiofen-2-carbonilo
2-amino-5-nitrotiazol
Tenonitrazol
Cloropirilen
Antihistamínico
N1-[(5-clorotien-2-il)metil]-N2,N2-dimetil-N1-piridin-2-iletan-1,2-diamina
2-[(5-cloro-2-tienil)(2-dimetilaminoetil)amino]piridina
N,N-dimetil-N'-(2-piridil)-N'-(5-cloro-2-tienil)etilendiamina
N
Cl
Cl
S
+
Cl
S
N
NaNH2 / Tolueno
HN
N
CH3
2-cloro-5-(clorometil)tiofeno
N
N
CH3
H 3C
CH3
N1,N1-dimetil-N2-piridin-2-iletan-1,2-diamina
Cloropirilen
Dantrolen
Relajante muscular
1-({(1E)-[5-(4-nitrofenil)-2-furil]metilen}amino)imidazolidin-2,4-diona
1-[{5-(p-nitrofenil)furfuriliden}amino]hidantoina
O
O2N
O
H 2N
CHO
N
O
NH
+
5-(4-nitrofenill)-2-furfuraldehido
O
1-aminoimidazolidin-2,4-diona
1-aminohidantoina
H
N
O2 N
N
N
O
O
Dantrolen
26
Furosemida
Antihipertensivo y relajante muscular
ácido 5-(aminosulfonil)-4-cloro-2-[(2-furilmetil)amino]benzóico
ácido 4-cloro-N-(2-furilmetil)-5-sulfamoilantranilico
Cl
Cl
Cl
O
Cl
NH2
O
1. ClSO3H
O
2. NH3
O
1-(2-furil)metanamina
S
H2N
OH
Diglima,
O
OH
ácido
5-(aminosulfonil)-2,4-diclorobenzóico
ácido 2,4-diclorobenzóico
O
NH2
O
S
OH
O
O
NH
Cl
Furosemida
Clopirac
Antiinflamatorio
Ácido [1-(4-clorofenil)-2,5-dimetil-1H-pirrol-3-il]acético
Cl
Cl
O
H3C
CH3
1. CH2O / (CH3)2NH / CH3COOH
+
2. CH3I
O
N
hexane-2,5-diona
CH3
H3C
NH2
4-cloroanilina
1-(4-clorofenil)-2,5-dimetil-1H-pirrol
Cl
Cl
1. NaCN / (CH3)2SO
2. KOH / Etanol
3. HCl
N
H 3C
CH3
CH3
N
I
H 3C
N
OH
CH3
CH3
Yoduro de
[1-(4-clorofenil)-2,5-dimetil-1Hpirrol-3-il]-N,N,N-trimetilmetan
amonio
CH3
O
Cloropirac
27
Bromuro de Heteronio
Anticolinérgico
Bromuro de 3-{[hidroxi(fenil)tien-2-ilacetil]oxi}-1,1-dimetilpirrolidinio
OH
OH
H3C
Na
N
+
O
O
OCH3 / n-C7H16
N
O
S
CH3
OH
S
OH
1-metilpirrolidin-3-ol
acetato de 1-metilpirrolidin-3-il hidroxi(fenil)tiofeno
ácido
hidroxi(fenil)tien-2-ilacético
CH3Br
OH
O
Br
S
O
N
CH3
CH3
Bromuro de Heteronio
Porfirinas y productos naturales pirrólicos relacionados
3
CH2
5
4
CH3
A
2
NH
1
N
B
H3C
N
10
20
N
CH2
Fe Cl
HN
C
D
N
N
N
H3C
15
CH3
Porfirina
Hemina
O
O
OH
HO
28
CH2
CH3
CH3
H3C
N
N
Mg
N
N
CH3
H3C
H
CH3
H
CH3
O
H3C
O
O
O
O
CH3
Clorofila a
H3C
CH3
HOOC
COOH
HOOC
NH
HOOC
H
N
H
N
HN
NH
COOH
H
N
H
N
O
O
H3 C
H3C
HN
CH3 H3C
H2 C
OH
COOH
O
HO
CH2
O
Bilirrubina
COOH
COOH
Uroporfobilinógeno III
precursor biosintético común
O
H2N
H2N
CH3
O
H2N
O
H3C
NH2
N
H3C
O
N
H3C
N
Co
+
N
N
CH3
O
NH2
CH3
H3C
CH3
Vitamina B12
H3C
O
O
NH
O
O
N
NH2
CH3
P
O
-
O
OH
N
H
H
CH3
H
HO
O
H
29
Serie 3
1. Prediga el principal producto de las siguientes reacciones:
(a)
OH
H3 C
O
CH3
H3 C N
CH3
C12 H12 O2
H. E. Winberg, F. S. Fawcett, W. E. Mochel, y C. W. Theobald, J. Am. Chem.
Soc. 82, 1428 (1960).
éter
(b)
+
N
O
MgBr
Y. H. Wu, J. R. Corrigan, y R. F. Feldkamp, J. Org. Chem., 26, 1531 (1961).
(c)
Cl
+
N
O
MgI
H. Rapoport y C. D. Willson, J. Am. Chem. Soc. 84, 630 (1962).
+
(d) H3C
Cl
O
CN
(1) HCON(CH3)2
(e)
CH3
O
POCl3
(2)H2O
D. A. H. Taylor, J. Chem. Soc. 1959, 2767
Br
(f)
Br
S
1 eq. CH3(CH2)3Li
S
Br
Cl
éter, -70 C
H. Wynberg y A. Kraak, J. Org. Chem. 29, 2455 (1964)
O
(g)
S
OH
S
O
O
+
CH3 O
CH3
NaOC2H5
C10H14O4S
C2H5OH
H. J. Jakobsen, E. H. Larsen, y S-O. Lawesson, Rec. Trav. Chim., 82, 791
(1963)
30
(1) tolueno
(h)
(2)ClCH2CN
N
H
R. J. Gritter y R. L. Chriss. J. Org. Chem. 29, 1163 (1964)
(i)
O
O
O
+
NH2 HCl
H5 C6
H
O
H3C
CH3
H. Nakano, et. al., Tetrahedron Letters, 7, 737 (1966)
2. Sugiera un mecanismos razonable para cada una de las siguientes
transformaciones:
C6H5
H5C6
(a)
C 6 H5
O
O
-CO2
O
O
C6H5
A. Padwa y R. Hartmann, Tetrahedron Letters. 21, 2277 (1966)
(b)
Br
H2 C
CHO
N
H
+
H5C6
+
NaH
C6 H5
éter, reflujo
P C6 H5
N
24 hrs
E. E. Schwizer y K. K. Light, J. Am. Chem. Soc. 86, 2963 (1064).
H3 C
O
H5C6
(c)
H5C6
CH3
10% KOH
N NH
H3CO
H3 C
H2O, 60oC, 40 min
H3CO
N
H
CHO
O
R. L. Wineholt, E. Wyss, y J. A. Moore, J. Org. Chem. 31, 48 (1968).
CH3
CH3
H2O2
(d) H C
3
O
CH3
H2O
(HClO4)
H3C
O
O
CH3
ClO4
A. T. Balaban y C. D. Nenitzescu, Chem. Ber., 93, 599 (1960).
31
3. Indique por cuales métodos de sintéticos se pueden obtener los productos
indicados, a partir de las materias primas que se indican.
O
(a)
H3C
CH3
CHO
O
O
(b)
N
N
H3C
NH2
CH3
CH3
O
N
(c)
CH3
Cl
S
S
J. B. Sullivan y W. C. McCarthy, J. Org. Chem. 30, 662 (1965)
4. Escriba un mecanismo para la formilación de Vilsmeier del Pirrol, mostrando
los intermediarios de la reacción.
5. Formule los pasos implicados en cada una de las reacciones que siguen.
(a) El 3,4-dimetilpirrol reacciona con formaldehído en presencia de ácido
acético para dar el siguiente tetrámero con alto rendimiento.
H3C
CH3
CH3
H3C
NH
HN
NH
HN
CH3
H3C
CH3
CH3
B. von Maltzan, Angew. Chem. Int. Edn. Engl., 1982, 21, 785.
(b) El 2-metilindol, cuando se calienta con metilvinilcetona,
metilcarbazol.
da
2-
32
H
N
CH3
J. Szmuszkovicz, J. Am. Chem. Soc., 1957, 79, 2819.
(c) El 3,4-dinitro-1-metilpirrol reacciona con piperidina en acetonitrilo a reflujo,
para dar el siguiente pirrol.
O2 N
N
N
H3C
G. Devincenzis, P. Mancarelli y F. Stegel, J. Org. Chem. 1983, 48, 162.
6. Prediga las posiciones más probables para el ataque electrofílico a cada uno
de los compuestos que siguen:
(a) 1-metilpirrol
(b) 2,4-dimetilpirrol
(c) Ácido 5-metilpirrol-2-carboxílico
(d) Furano-2-carboxaldehído
(e) 2,3-dimetilindol
(f) Ácido benzotiofeno-3-carboxílico
(g) 1-fenilisoindol.
7. Todas las reacciones que siguen ocurren a través de intermediarios
detectables o aislables. Proponga estructuras para ellos y escriba
mecanismos para las reacciones.
Ph
CN
+
(a)
+
?
HCl
-
NH2 Cl
N
N
EtO
CN
K
NC
CN
R. Neidlein y G. Jeromi. Chem. Ber., 1982, 115, 714.
CF3
F3 C
(b)
+
F3 C
C
C CF3
O
?
1. H2 / Pt
2. Calor
O
C. D. Weiss, J. Org. Chem. 1962, 27, 3693.
33
MeOC
(c)
+
H3C
O
PhCHO
h
H
Ph
H2O
?
CH3
H+
MeOCH 2C
H
OH
S. L. Schreiber, A. H. Hoveyda y H-J. Wu, J. Am. Chem. Soc., 1983, 105, 660.
(d)
CH 2Cl
+
NC
?
KCN aq.
O
CH3
O
S. Divald, M. C. Chun y M. M. Joullié, J. Org. Chem. 1976, 41, 2835.
8. El 2,5-dimetilpirrol, cuando se calienta con estaño y ácido clorhídrico acuoso,
prpduce el dihidroisoindol siguiente con 57% de rendimiento. Proponga un
mecanismo para la reacción.
CH3
CH3
NH
CH3
CH3
R. Bonnett y J. D. White, Proc. Chem. Soc., 1961, 119.
9. El indol siguiente se calentó con carbonato de potasio en acetonitrilo, y dio un
producto cristalino de bajo punto de fusión C10H9N que no muestra absorción
correspondiente a NH en el espectro infrarrojo. Proponga una estructura para
el producto y explique su formación.
Br
N
H
J. E. Johansen, B. D. Christie y H. Rapport, J. Org. Chem. 1981, 46, 4914.
10. El pirrol siguiente se preparo como sigue. La oxima de la acetofenona se
alquilo en el oxígeno por tratamiento con acetiléndicarboxilato de dimetilo en
presencia de metóxido de sodio, y la oxima alquilada se calentó después a
170-180°C empleando el mecanismo de la síntesis de indoles de Fischer
como analogía, formule un mecanismo para la reacción.
CO2Me
Ph
N
H
CO2Me
T. Sheradsky, Tetrahedron Letters, 1970, 25.
34
