Cambios de estado
Anuncio
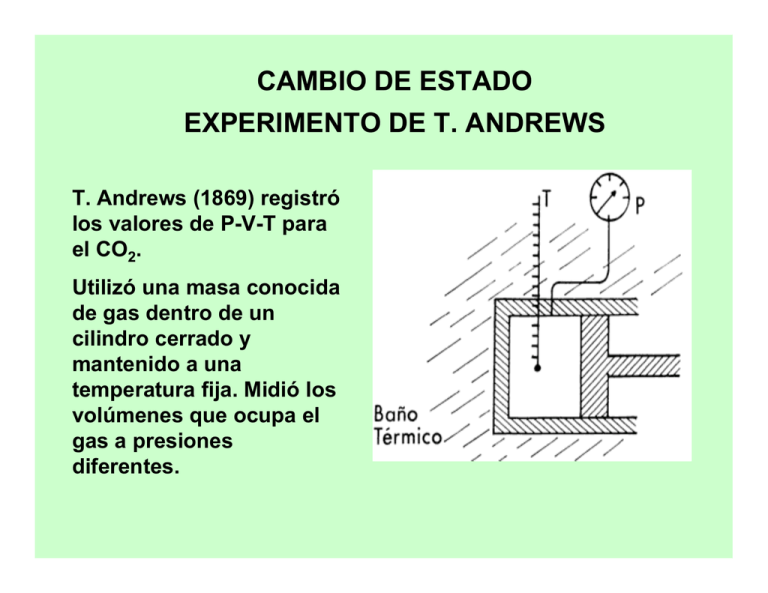
CAMBIO DE ESTADO EXPERIMENTO DE T. ANDREWS T. Andrews (1869) registró los valores de P-V-T para el CO2. Utilizó una masa conocida de gas dentro de un cilindro cerrado y mantenido a una temperatura fija. Midió los volúmenes que ocupa el gas a presiones diferentes. Presión DIAGRAMA PRESIÓN vs. VOLUMEN CO2 73 atm 31.1 oC 29.9 oC 13.1 oC 71 atm 50 atm Volumen Presión DIAGRAMA PRESIÓN vs. VOLUMEN Punto crítico Presión crítica T4 T crítica T2 T1 Volumen Equilibrio Liquido & Vapor (B-C) Condensación Disminución del Volumen Presión Constante Temperatura Constante Presión EQUILIBRIO LÍQUIDO-VAPOR Líquido Vapor Líquido & C B Vapor Volumen Condensación T2 T1 FASE LÍQUIDA (C) Condensó todo el vapor El líquido es incompresible El volumen casi no varía Presión FASE LÍQUIDA Líquido Vapor Líquido & C Vapor Volumen T2 T1 PUNTO CRÍTICO Por encima del PUNTO CRÍTICO, - No hay condensación - El vapor se comporta como “gas ideal”. Punto crítico Presión Vapor Líquido T3 Vapor T2 T1 Volumen (courtesy F. Remer) PUNTO CRÍTICO isoterma crítica Vapor Presión La temperatura máxima a la cual puede licuarse un gas, es decir, la temperatura por encima de la cual no puede existir líquido, se denomina temperatura crítica, y la presión necesaria para provocar la licuefacción a esta temperatura se denomina presión crítica. Líquido T3 Vapor T2 T1 Volumen (courtesy F. Remer) Punto Crítico y Fuerzas Intermoleculares Temperaturas y presiones críticas de algunas sustancias Sustancia NH3 Argón CO2 N2 O2 C3H8 H2O H2S Temperatura crítica (oC) 132.6 -122.1 31.3 -146.9 -118.6 97.0 374.6 100.5 Presión crítica (atm) 111.5 48 73 33.5 49.7 42.0 225 88.9 Explicar las diferencias observadas en las temperaturas y presiones críticas en relación a las fuerzas intermoleculares de las sustancias presentadas en el cuadro Respuesta: En principio un gas se puede licuar al enfriarlo con lo cual disminuye la energía cinética de las moléculas, de modo que éstas se agregan y forma gotas de líquido. O bien, por compresión con lo cual se reduce la distancia entre las moléculas de forma que se mantienen unidas por atracción mutua. . El cuadro muestra que las sustancias no polares de bajo peso molecular tienen temperaturas y presiones críticas más bajas que las sustancias polares o de alto peso molecular La Tc de una sustancia refleja la intensidad de sus fuerzas intermoleculares por lo tanto, el agua, y el amoníaco que tienen interacciones moleculares fuertes (puentes de hidrógeno) también tienen temperaturas críticas altas. DIAGRAMA DE FASES DIAGRAMA DE FASES DIAGRAMA DE FASES Las líneas del gráfico representan valores P-T donde coexisten dos fases en equilibrio. El PUNTO TRIPLE indica la presión y temperatura a la que coexisten el sólido, líquido y vapor en equilibrio. DIAGRAMA DE FASES El H2O líquida es más compacta que el hielo. El aumento de la presión favorece la compactación de las moléculas por lo tanto, disminuye la temperatura de fusión del agua. PRESIÓN DIAGRAMA DE FASES 6 kJ/mol H2O (l) hielo fusión LÍQUIDO congelación vaporización 47 kJ/mol 40.7 kJ/mol vapor SÓLIDO condensación VAPOR sublimación deposición TEMPERATURA Cambios de Estado y Fuerzas Intermoleculares Los cambios de fase van acompañados por un cambio en la energía del sistema. Al aumentar la temperatura de un líquido, las moléculas se mueven con mayor energía por lo cual, la concentración de moléculas en la fase gaseosa arriba del líquido también aumenta. Estas moléculas ejercen una presión llamada presión de vapor. Cambios de Estado y Fuerzas Intermoleculares La presión de vapor aumenta al incrementar la temperatura, hasta igual la presión externa sobre el líquido. En este punto, el líquido ebulle y las moléculas del líquido pasan al estado gaseoso donde están muy separadas unas de otras. Los valores de Hvap son mayores que los Hfus porque en la transición del estado líquido al gaseoso, las moléculas deben eliminar todas sus fuerzas de atracción intermolecular, mientras que al fundirse, muchas de estas interacciones de atracción subsisten. ENERGÍA LIBRE DE GIBBS G = H –T S dG = dH – T dS – S dT (1) H=E+PV dH = dE + P dV + V dP (2) Reemplazo (2) en (1) dG = dE + PdV + VdP - TdS - SdT (3) dS = dq/T 2do principio dE = dq - PdV expresión del 1er principio con trabajo de expansión de un gas dq = dE + PdV TdS = dE + PdV (4) Reemplazo (4) en (3) dG = dE + PdV + VdP- dE - PdV - SdT dG = VdP - SdT (5) EQUILIBRIO DE FASES ECUACIÓN DE CLAUSIUS-CLAPEYRON Equilibrio líquido-vapor G = 0 Para un cambio infinitesimal, dGlíquido = dGvapor Según la ecuación (5) dGL = VL dP - SL dT (6) dGV = VV dP - SV dT (7) Igualando (6) y (7), VL dP - SL dT = VV dP - SV dT (SV - SL) = dP/dT (8) (VV - VL) ECUACIÓN DE CLAUSIUS-CLAPEYRON (SV - SL) = dP/dT (8) (VV - VL) Por el 2do principio para el cambio de fase reversible, en (8), dP = Hvap dT T (VV - VL) 1º hipótesis: si T<< Tc VV >> VL dP = dT Hvap T VV S = H/T ECUACIÓN DE CLAUSIUS-CLAPEYRON 2º hipótesis: 1 mol de gas ideal dP = dT P2 dP = P1 P P Hvap R T2 T2 Hvap R T1 dT T2 ECUACIÓN DE CLAUSIUS-CLAPEYRON 3º hipótesis: Hvap constante en el intervalo de temperaturas ln (P2/P1) = Hvap ( 1 - 1) T1 T2 R Análogamente para el equilibrio sólido-vapor ln (P2/P1) = Hsubl ( 1 - 1) R T1 T2 ECUACIÓN DE CLAUSIUS-CLAPEYRON: APLICACIÓN AL T.P. La integral indefinida de : (dP/dT) = PHvap/ RT2 ln P = -(Hvap/ RT) + C pendiente = -Hvap/ R REGLA DE LAS FASES DE GIBBS FASE: Parte homogénea de un sistema, con características físicas y químicas comunes. COMPONENTE: Cada una de las sustancias que componen el sistema químicamente independiente. GRADOS DE LIBERTAD o VARIANZA: Número de variables intensivas independientes (temperatura, presión, composición, etc.) necesarias para especificar el estado termodinámico de un sistema. REGLA DE LAS FASES DE GIBBS L=C–F+2 L = número de grados de libertad C = número de componentes F = número de fases APLICACIÓN DE LA REGLA DE LAS FASES A UN DIAGRAMA DE FASES L=C-F+2 C= 1 (sustancia pura) L=3-F a) En el punto triple F=3 L=3–F=0 b) Sobre las curvas F= 2 L=3–F=1 c) Superficies abiertas F= 1 L=3–F=2 INTERPRETACIÓN DE LA REGLA DE LAS FASES a) En el punto triple, el sólido, líquido y vapor se encuentran en equilibrio y L = 0. No hay grados de libertad lo que significa que el punto triple solo se produce para valores definidos de presión ( 4,58 torr) y temperatura (0,01 oC). b) A lo largo de las líneas encontramos dos fases en equilibrio y L = 1. Por ejemplo, con líquido y vapor en equilibrio, una vez que fijamos T, entonces P, presión de vapor de equilibrio del agua líquida a la temperatura T, también está fijada. El punto de ebullición normal es la temperatura a la cual la presión de vapor del líquido es igual a 1 atm. INTERPRETACIÓN DE LA REGLA DE LAS FASES c) Las regiones de una fase son las superficies abiertas donde L = 2. Existen dos grados de libertad ya que para describir un estado intensivo es necesario fijar tanto P como T. CUESTIONARIO 1- Utilizando el diagrama de fases del CO2 explique por qué el sólido no funde a la presión de 1 atm y temperatura ambiente. 2- ¿Cuál es la T y P máximas a las cuales se puede condensar el agua?. 3- ¿Por qué flota el glaciar Perito Moreno?. 4- Explique por qué el Hvapor es mayor que el Hfus para una sustancia. 5- Dos recipientes rígidos , A y B de 4 litros de capacidad se mantienen a 25 C y contienen solamente agua. A contiene 1lt de agua liquida y 3lt de vapor de agua. B contiene 3lt de agua liquida y 1lt de vapor de agua. Indique si la presión dentro del recipiente A es igual, menor o mayor que la presión dentro de B. Justifique su respuesta. BIBLIOGRAFÍA “Química la Ciencia Central” de T. Brown, H.E. LeMay, B. Bursten y J.R. Burge, Pearson-Prentice Hall, Capítulo 11, 9na edición (2004) “Fisicoquímica” de Ira N. Levine, Mc Graw Hill, Vol. 1 (1996).


