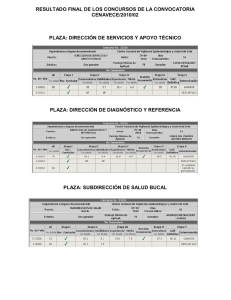
Manual para la Vigilancia Epidemiológica de las Enfermedades
Anuncio

Manual para la Vigilancia Epidemiológica de las Enfermedades Prevenibles por Vacunación 1 Secretaria de Salud Subsecretaria de Prevención y Promoción a la Salud Dirección General Adjunta de Epidemiología ISBN Francisco de P. Miranda 177, 5° Piso Unidad Lomas de Plateros CP 01480 Delegación Álvaro Obregón Ciudad de México, Marzo de 2016 Tel. 52 (55) 5337 16 00 www.salud.gob.mx/ www.dgepi.salud.gob.mx Impreso en México 2 SECRETARÍA DE SALUD Dr. José Narro Robles Secretario de Salud Dr. Pablo Antonio Kuri Morales Subsecretario de Prevención y Promoción de la Salud Dr. Eduardo González Pier Subsecretario de Integración y Desarrollo del Sector Salud Lic. Marcela Guillermina Velasco González Subsecretario de Administración y Finanzas Dr. Cuitláhuac Ruiz Matus Director General de Epidemiología 3 4 DIRECCIÓN GENERAL DE EPIDEMIOLOGÍA Dr. Cuitláhuac Ruíz Matus Director General de Epidemiología Dra. María Eugenia Jiménez Corona Directora General Adjunta de Epidemiología Dr. José Alberto Díaz Quiñonez Director General Adjunto del INDRE 5 6 DIRECCIÓN GENERAL ADJUNTA DE EPIDEMIOLOGÍA Dra. María Eugenia Jiménez Corona Directora General Adjunta de Epidemiología Biól. José Cruz Rodríguez Martínez Director de Vigilancia Epidemiológica de Enfermedades Transmisibles Dr. Martín Arturo Revuelta Herrera Director de Información Epidemiológica Dra. María del Rocío Sánchez Díaz Directora de Vigilancia Epidemiológica de Enfermedades no Transmisibles Dr. Javier Montiel Perdomo Director de Investigación Operativa Epidemiológica 7 8 Grupo Técnico Interinstitucional del Comité Nacional para la Vigilancia Epidemiológica (CONAVE) 9 ÍNDICE Introducción 13 Marco Legal 15 Justificación 16 Objetivos del Milenio 17 Objetivo General 18 Objetivos Específicos 18 Determinantes de Salud 19 Mecanismos de Vigilancia 21 Metodologías y Procedimientos para la Vigilancia Epidemiológica de las EPV 22 Vigilancia epidemiológica a. Sarampión y Enfermedad Febril Exantemática 27 i. Situación Epidemiológica ii. Definiciones Operacionales iii. Acciones ante caso por Nivel Técnico Administrativo iv. Procedimientos de Laboratorio v. Evaluación b. Rubéola y Síndrome de Rubéola Congénita 49 i. Situación Epidemiológica ii. Definiciones Operacionales iii. Acciones ante caso por Nivel Técnico Administrativo iv. Procedimientos de Laboratorio v. Evaluación c. Poliomielitis y Parálisis Flácida Aguda 75 10 i. Situación Epidemiológica ii. Definiciones Operacionales iii. Acciones ante caso por Nivel Técnico Administrativo iv. Procedimientos de Laboratorio v. Evaluación d. Tos Ferina y Síndrome Coqueluchoide 101 i. Situación Epidemiológica ii. Definiciones Operacionales iii. Acciones ante caso por Nivel Técnico Administrativo iv. Procedimientos de Laboratorio v. Evaluación e. Difteria 118 i. Situación Epidemiológica ii. Definiciones Operacionales iii. Acciones ante caso por Nivel Técnico Administrativo iv. Procedimientos de Laboratorio v. Evaluación f. Infecciones invasivas por Haemophilus influenzae b 134 i. Situación Epidemiológica ii. Definiciones Operacionales iii. Acciones ante caso por Nivel Técnico Administrativo iv. Procedimientos de Laboratorio v. Evaluación g. Enfermedades Inflamatorias del Sistema Nervioso Central 147 i. Situación Epidemiológica ii. Definiciones Operacionales iii. Acciones ante caso por Nivel Técnico Administrativo iv. Procedimientos de Laboratorio 11 v. Evaluación h. Tétanos y Tétanos Neonatal 166 i. Situación Epidemiológica ii. Definiciones Operacionales iii. Acciones ante caso por Nivel Técnico Administrativo iv. Procedimientos de Laboratorio v. Evaluación Actividades a desarrollar en caso de brote 184 Análisis de la Información 185 Difusión de la Información 189 Capacitación 190 Colaboración interinstitucional 191 Supervisión 194 Anexos 197 Bibliografía 269 12 INTRODUCCIÓN México es uno de los países promotores de iniciativas mundiales en favor de las condiciones de salud y bienestar de la niñez. Estas iniciativas han tenido un gran precedente a nivel mundial al haberse establecido, entre otros compromisos, la decisión de reducir los indicadores de mortalidad infantil y preescolar, mortalidad materna y desnutrición, así como el reforzamiento del desarrollo integral en la población infantil. En materia de salud, los compromisos adquiridos representan un reto importante, en tanto persistan obstáculos que incidan en la cobertura, calidad y desarrollo de los programas y servicios que se ofrecen a la población. Bajo estas circunstancias, los servicios de salud encaran dos retos: 1) atender las patologías tradicionales propias del atraso económico y educativo en diversos sectores de la población y; 2) responder con prontitud y eficacia a los problemas emergentes y de nueva aparición. El logro de estos compromisos converge en el objetivo central de incrementar la supervivencia, protección y desarrollo infantil fortaleciendo el ejercicio pleno de sus derechos mediante acciones encaminadas a evitar las principales enfermedades y causas de muerte, incluyendo entre ellas, las relativas a las Enfermedades Prevenibles por Vacunación (EPV). Las acciones de vacunación universal, inscriben sus objetivos dentro de estas iniciativas y propósitos, al reconocer la problemática de los niños como una prioridad que no puede postergarse; así como, por los efectos negativos que tiene en el marco general de la salud. En este contexto, los programas de vacunación y de vigilancia epidemiológica son considerados como una estrategia esencial de los servicios de salud, por lo que en la actualidad se desarrollan mecanismos institucionales para otorgarles una acreditación permanente que permita alcanzar las metas de impacto epidemiológico establecidas. Desde que se estableció el Programa Ampliado de Inmunizaciones (PAI) en la Región de las Américas, se han intensificado las acciones de vacunación que han beneficiado a una 13 proporción muy importante de niños con la aplicación de todos los biológicos incluidos en el Programa. Actualmente en México, el programa de vacunación universal previene 23 padecimientos. En el desarrollo de estas acciones, se han logrado coberturas sin precedente, con lo que se han evitado miles de casos y defunciones por Poliomielitis, Difteria, Sarampión, Rubéola, Síndrome de Rubéola Congénita, Tos ferina, Tétanos y Tétanos neonatal. Los compromisos internacionales incluyen prioritariamente implementación de sistemas de vigilancia epidemiológica altamente sensibles y específicos, el logro y mantenimiento de coberturas elevadas de inmunización en grupos blanco y la intervención enérgica ante la presencia de casos y brotes con la participación de todas las instituciones del Sistema Nacional de Salud, para prevenir el riesgo de reintroducción de enfermedades prevenibles por vacunación que ya han sido erradicadas y/o eliminadas de la Región. Desde hace algunas décadas el sarampión es una enfermedad controlada y en proceso de eliminación en México. Los pocos casos que se han presentado en los dos últimos años han sido importados de Europa y Asia. Por lo anterior, se mantiene el esquema de vacunación hasta 29 años de edad con la finalidad de disminuir la bolsa de susceptibles y con ello la probabilidad de la reactivación de la circulación del virus. Hasta el momento sólo se han identificado algunos casos de sarampión importado, en poliomielitis el último caso reportado fue el 18 de octubre de 1990, lográndose la certificación de la erradicación en el país y la Región de las Américas. El último caso de difteria se confirmó en octubre de 1991; la incidencia de infecciones invasivas por Haemophillus influenzae tipo b han disminuido considerablemente, reportándose un caso por año, en tétanos neonatal, se confirman dos casos por año. En lo que respecta a tosferina, la incidencia va en incremento debido a mayor notificación de casos, nuevas pruebas de laboratorio más sensibles y específicas. 14 Por otra parte, la consolidación y desarrollo de los mecanismos específicos de vigilancia epidemiológica y el control de brotes de EPV, y la disminución de sus cifras de morbilidad y mortalidad, forman parte de los objetivos que establece, desde su inicio, el Plan Nacional de Salud 2007-2012 en México. Conforme a ello, las Instituciones del Sector Salud han fijado su interés primordial en el fortalecimiento de las estrategias antes mencionadas y la investigación aplicada, como base para determinar el efecto que tienen las acciones específicas en el comportamiento de estos padecimientos a nivel nacional. MARCO LEGAL En México, el Artículo 4° de la Constitución Política de los Estados Unidos Mexicanos hace referencia al derecho que tiene toda persona a la protección de la salud. Las enfermedades prevenibles por vacunación son enfermedades de notificación obligatoria, con base en el Título Octavo, Capítulo Segundo, Artículo 136 fracción III de la Ley General de Salud. Y en el Título Octavo, Capítulo Segundo, Artículo 134 fracción IV de la misma Ley, la Secretaría de Salud y los gobiernos de las entidades federativas realizarán vigilancia epidemiológica, prevención y control de dichas enfermedades. Lo anterior, se refuerza en el Acuerdo Secretarial No. 130.Por lo anterior, y de acuerdo a lo establecido en el Proyecto de Norma Oficial Mexicana PROY-NOM-017-SSA2-2012, para la vigilancia epidemiológica, las unidades de vigilancia de todas las instituciones del Sistema Nacional de Salud (SNS) deben notificar la ocurrencia de casos nuevos de estos padecimientos. Asimismo, en lo correspondiente a la información para la salud, se sustenta en el Título Sexto, Capítulo Único, Artículo 104 fracciones I y II; así como en el numeral 5.1 de la Norma Oficial Mexicana NOM-040-SSA2-2004, en materia de información en salud. Norma Oficial Mexicana NOM-031-SSA2-1999, para la atención a la salud del niño, numerales 6.3.3, 6.5.1.1 y 6.5.2.1. PROYECTO de Norma Oficial Mexicana PROY-NOM045-SSA2-2005, para la vigilancia epidemiológica, prevención y control de las infecciones nosocomiales, numerales 6.6.1, 6.6.3, 6.17.2 y 6.17.3. 15 Asimismo en el artículo 32 bis 2, del Reglamento Interior de la Secretaria de Salud, en donde hace referencia a las funciones de la DGE, dentro de las cuales está lo correspondiente a la vigilancia epidemiológica de las enfermedades transmisibles de las cuales forman parte las EPV. El presente manual sustituye las anteriores versiones de los manuales de cada una de las enfermedades prevenibles por vacunación y tiene como objetivo unificar los procedimientos para la vigilancia epidemiológica de las enfermedades prevenibles por vacunación en México, de acuerdo a las recomendaciones de la OMS. JUSTIFICACIÓN Cada año, las EPV presentan una mejoría gradual en sus indicadores epidemiológicos, si bien, se reconocen rezagos importantes que afectan a diversos grupos de población, particularmente, aquellos que no tienen acceso a los servicios formales de salud. En algunos países, se observa un deterioro de los indicadores de seguimiento de los programas de inmunización y vigilancia epidemiológica, lo que puede tener serias implicaciones, tanto a nivel regional, como nacional y local. Por ello, para lograr y mantener dentro de un adecuado nivel de control epidemiológico a las EPV, se necesita una labor continua que disminuya la susceptibilidad y las condiciones de riesgo en la población, mediante la plena aplicación de las estrategias nacionales de vigilancia epidemiológica y las recomendadas por los organismos internacionales. En nuestro país las EPV constituyeron un grave problema de morbilidad y mortalidad en décadas pasadas. Es hasta fechas recientes, que se han logrado adelantos importantes. Las tendencias en los indicadores epidemiológicos de las EPV han dado inicio al establecimiento de nuevas iniciativas y propuestas para mantener la erradicación del poliovirus salvaje y, en paralelo, transitar hacia la eliminación del tétanos neonatal así 16 como sarampión y difteria, rubéola y rubéola congénita. Con estos mismos propósitos, se estableció la prioridad de mantener las acciones de control para tos ferina y tétanos no neonatal. A pesar de la diversidad geopolítica y socio-demográfica de nuestro país, se han logrado adelantos importantes en la ejecución de estas iniciativas, por lo que de mantenerse las tendencias actuales, los perfiles epidemiológicos de estas enfermedades, que hace apenas una generación fueron causa importante de morbilidad, mortalidad y discapacidad en los grupos de población infantil y preescolar, se habrán eliminado para principios del próximo milenio. Por lo anterior y a fin de cumplir con lo establecido en el Programa Nacional de Salud 2007-2012, en el cual se establece: “Actualizar los diferentes subsistemas de vigilancia epidemiológica de las enfermedades prevenibles por vacunación”, se realizó la presente actualización del Manual de Vigilancia Epidemiológica de las Enfermedades Prevenibles por Vacunación, en el cual se están integrando los procedimientos de vigilancia epidemiológica a seguir en las siguientes patologías: Sarampión y Enfermedad febril exantemática, Poliomielitis y Parálisis flácida aguda, Tos ferina y Síndrome coqueluchoide, Difteria, Infecciones invasivas por Haemophilus influenzae tipo B, Rubéola y Síndrome de Rubéola congénita, Meningitis, Tétanos y Tétanos neonatal. OBJETIVOS DEL MILENIO Dentro de los objetivos del milenio se encuentra el reducir la mortalidad de las niñas y niños menores de 5 años. En México, la mortalidad en este grupo se ha reducido de manera constante gracias a las acciones emprendidas para control de las enfermedades prevenibles por vacunación. México se encuentra a menos de dos puntos de cumplir la meta y muy cerca de lograr que la totalidad de las niñas y niños menores de un año de edad estén vacunados contra sarampión. Destaca como una intervención relevante para la atención de la salud de la infancia el Programa de Vacunación Universal, con la finalidad de aplicar un esquema básico de 13 inmunógenos y actualmente constituye uno de los más completos del mundo. Así mismo, se desarrollan las Semanas Nacionales de 17 Vacunación mediante las cuales se ofrece a la población infantil un paquete integral de intervenciones. OBJETIVO GENERAL Proporcionar los procedimientos para estandarizar las actividades de vigilancia epidemiológica de las enfermedades prevenibles por vacunación (EPV´s) para su aplicación en el ámbito local, jurisdiccional, estatal y federal de todas las instituciones del Sistema Nacional de Salud en el territorio nacional. OBJETIVOS ESPECÍFICOS Generar información para la oportuna identificación de riesgo para la ocurrencia de casos y brotes y emitir las recomendaciones correspondientes para el establecimiento de las medidas de prevención y control. Determinar los procedimientos para la operación de los diferentes sistemas de información de las EPV. Garantizar la información oportuna y de calidad para mantener actualizado el panorama epidemiológico de las EPV. Garantizar la sensibilidad y especificidad de los sistemas de vigilancia epidemiológica de las EPV. Estandarizar los procedimientos para la detección, notificación, estudios de casos y brotes, estudio de contactos, seguimiento y clasificación final de EPV. Realizar la caracterización clínico-epidemiológica de las EPV. Estandarizar los procedimientos de laboratorio. Verificar la aplicación de los lineamientos que permitan cumplir con indicadores internacionales. Realizar el análisis de la información y difundirlo a todos los niveles técnicoadministrativos de los servicios de salud y población en general. 18 Evaluar el impacto de las acciones de control. Evaluar el desempeño de la vigilancia de las EPV mediante el uso de indicadores. Promover la difusión y uso de la información epidemiológica para la toma de decisiones. DETERMINANTES DE SALUD La definición de los Determinantes de Salud, se refiere a los factores que influyen en la salud individual, que interactuando en diferentes niveles de organización, determinan el estado de salud de la población. Sobre la salud actúan diversos determinantes o factores, que es necesario tener en cuenta a la hora de delimitar el concepto de salud, y que hacen referencia a aspectos tan variados como los biológicos, hereditarios, personales, familiares, sociales, ambientales, alimenticios, económicos, laborales, culturales, de valores, educativos, sanitarios y religiosos. La casi totalidad de estos factores pueden modificarse, incluidos algunos factores de tipo biológico, dados los avances en el campo genético, científico, tecnológico y médico. La incidencia de unos sobre otros es tal que no pueden disociarse, a no ser que se quiera tender al reduccionismo simplista que no conduce a parte alguna. Los factores biológicos y hereditarios se refieren a la herencia genética recibida de nuestros padres y a la constitución personal. Los avances científicos pueden eliminar o mitigar enfermedades provenientes de la herencia genética. Los personales hacen referencia al estilo de vida que cada cual configura teniendo en cuenta las condiciones de vida y el contexto económico, social, laboral, cultural, familiar. Los factores familiares acerca del número de componentes, clima, los ingresos económicos, la educación, los valores, el lugar de residencia. El sexo y la edad también constituyen factores determinantes. Por lo anterior, a continuación se mencionan los principales determinantes para las enfermedades prevenibles por vacunación: Acceso limitado a los servicios de salud. Áreas con alta migración. 19 Alta densidad poblacional. Pobreza. Bajas coberturas de vacunación. Malos hábitos higiénicos: las personas que no se lavan las manos tienen un riesgo mayor de propagar y contraer cualquiera de las enfermedades prevenibles por vacunación. Hacinamiento. Personas que no hayan recibido ninguna dosis de vacuna de alguna(s) de las enfermedades prevenibles por vacunación. Niñas y niños menores de cinco años sin esquema de vacunación ó con esquemas incompletos. Manejo inadecuado de alimentos. Personal de salud. Oportunidades perdidas de vacunación. Rechazo a la vacunación. Movimientos migratorios. 20 MECANISMOS DE VIGILANCIA La vigilancia epidemiológica comúnmente se define como la recolección sistemática, continua, oportuna y confiable de información relevante y necesaria sobre algunas condiciones de salud de la población. El análisis e interpretación de los datos recolectados, debe proporcionar bases para la toma de decisiones por lo que debe garantizarse su pronta difusión. Dentro del proceso de vigilancia epidemiológica la notificación de los casos es de suma importancia ya que constituye el detonante de las acciones de control, por ello de acuerdo a la magnitud, trascendencia y vulnerabilidad de las EPV, la notificación de los casos debe realizarse de acuerdo al siguiente cuadro: PERIODICIDAD DE LA INFORMACIÓN Padecimiento Clave CIE Difteria Enteritis debida a rotavirus Infecciones invasivas por Haemophilus influenzae Poliomielitis Rubéola Sarampión Meningitis meningocócica Síndrome de rubéola congénita Tétanos Tétanos neonatal Tos ferina Enfermedad febril exantemática Parálisis flácida aguda Síndrome coqueluchoide A36 A08.0 A41.3 A80 B06 B05 A39.0 P35.0 A34, A35 A33 A37 S/C S/C S/C Inmediata X X X X X X X X X X X X Periodicidad de Notificación Diaria Semanal X X X X X X X X X X X X X X Sistema Especial X X X X X X X X X X X X X En la experiencia obtenida de la vigilancia universal, pasiva y rutinaria; se han planteado estrategias que consumen menos recursos y que permiten la identificación oportuna de casos para la alerta temprana. Esto ha llevado a que existan diversas formas de establecer un sistema de vigilancia epidemiológica (SVE), formas que varían en cobertura, en los objetivos, posibilidades presupuestales, humanas y de organización de los servicios de salud y en el interés de organismos gubernamentales o no gubernamentales. Los sistemas de vigilancia epidemiológica de las EPV tienen como estrategia central la vigilancia universal, rutinaria o convencional, la que es obligatoria en todas las unidades de salud del país, ésta, se complementa con otros tipos de vigilancia, como son la 21 vigilancia centinela, vigilancia sindrómica y búsqueda activa en instituciones entre otras. Como se muestra en la tabla de metodologías y procedimientos. METODOLOGÍAS Y PROCEDIMIENTOS PARA LA VIGILANCIA EPIDEMIOLÓGICA DE LAS EPV Procedimientos Metodologías Padecimiento Difteria Infecciones invasivas por Haemophilus influenzae Clave CIE Vigilancia convencional Búsqueda activa de casos Vigilancia basada en laboratorio ** Vigilancia centinela Vigilancia sindromática Vigilancia activa de la mortalidad Vigilancia especial Estudio epidemiológico de caso Estudio de brote Registros nominales * Red negativa Dictaminación por grupo de expertos X X X X X X X X X X X X X A36 X X X A41.3, G00.0, J14 X X X Poliomielitis A80 X X X X X X X X X Rubéola B06 X X X X X X X X X X Sarampión B05 X X X X X X X X X X A39.0 X X X X X X X X X X X X X X X X X X X X X Meningitis meningocócica Síndrome de rubéola congénita P35.0 X Tétanos A34, A35 X X X X X X Tétanos neonatal A33 X X X X X X X X X Tos ferina A37 X X X X X X X X X Enfermedad febril exantemática S/C X X X X X X X X X X X Parálisis flácida aguda S/C X X X X X X X X X X X Síndrome coqueluchoide S/C X X X X X X X X X X X *Red negativa: En situaciones circunstancias especiales, determinadas por los Comités de Vigilancia Epidemiológica. **Vigilancia centinela: Esta se realiza a través de NUTRAVE (Consultar manual de NUTRAVE). Metodologías: Los tipos de Sistemas de Vigilancia Epidemiológica (SVE) se mencionan a continuación: SVE universal, rutinaria o convencional: es aquel en el cual la totalidad del número de casos de una población definida se incluye en el sistema. Se conoce como “basado en la población”, y toma en cuenta todos los casos que se presentan. Requiere la participación de las instituciones del Sistema Nacional de Salud, para recolectar información de estos eventos. SVE por búsqueda activa en instituciones de salud: ésta, se realiza a través de la revisión de registros de consulta externa, urgencias y hospitalización, así como a 22 través de entrevistas con los trabajadores de salud. Esta búsqueda implica una acción proactiva para la detección de casos que por cualquier razón no fueron notificados o ingresados al sistema. Es una fuente de información más y un instrumento de control de calidad de la vigilancia de rutina, porque permite detectar casos que escapan al sistema. SVE de laboratorios: el cual se usa para confirmar diagnósticos o para evidenciar factores de riesgo adicionales. Su importancia se incrementa si el objetivo primordial de la recolección de información es la obtención de datos de laboratorio que puedan servir para establecer un posible riesgo de interés a la comunidad. También funciona como una fuente alterna para la detección de casos no reportados. SVE de carácter centinela: en el cual una o más unidades médicas se seleccionan para determinar la posible tendencia, identificar patrones de circulación de agentes etiológicos, focalizar actividades de vigilancia epidemiológica y sugerir intervenciones preventivas. En general no tienen representatividad poblacional pero sí el mérito de llamar la atención en forma especial sobre situaciones de riesgo y cumplen por ello una función clave para la toma de decisiones. SVE sindrómica: en los últimos años, esta vigilancia se ha establecido en muchos países debido a que son sistemas de vigilancia basados en síndromes, mismos que utilizan una definición de caso que es amplia y por lo tanto más sensible. Dichos sistemas son activados por signos comunes a varias enfermedades de interés en salud pública y no por la sospecha diagnóstica de una enfermedad. El diagnóstico diferencial se realiza a través de pruebas de laboratorio. Como ejemplos de estos sistemas de vigilancia sindrómica están los sistemas de vigilancia de parálisis flácida aguda, síndrome coqueluchoide y las enfermedades febriles exantemáticas. 23 SVE activa de la mortalidad: la vigilancia activa de la mortalidad, se realiza mediante la revisión de los certificados de defunción y muerte fetal recolectados previamente en las oficialías del Registro Civil; lo anterior en la búsqueda de casos con diagnósticos compatibles con alguna de las EPV, a fin de hacer la investigación clínica epidemiológica para elaborar la ratificación y/o rectificación de la causa de muerte. En caso de ratificarse se deberá verificar que los datos de la defunción se hayan ingresado en el registro nominal del padecimiento correspondiente, de no ser así se deberán ingresar los datos. Si fuera rectificación, se deberá verificar que la defunción se haya eliminado del registro nominal, en caso contrario hacer la eliminación. Cuando así corresponda la ratificación y/o rectificación de la causa básica de la defunción, se realizarán autopsias verbales, y se dictaminará ante un grupo de expertos. SVE especiales: es el conjunto de funciones, estructuras, procedimientos y criterios para llevar a cabo el registro, concentración, procesamiento, análisis y seguimiento de casos, brotes y situaciones especiales para su difusión oportuna a los distintos niveles técnico-administrativos del Sistema Nacional de Salud. El objetivo de vigilancia es establecer criterios uniformes para la obtención de información epidemiológica complementaria, oportuna y confiable que se requiere para la caracterización integral, clasificación clínico-epidemiológica, seguimiento, prevención y control, eliminación y/o erradicación de los padecimientos que aplican esta metodología. Comprenden la vigilancia de enfermedades transmisibles y no transmisibles. Enfermedades transmisibles: enfermedades prevenibles por vacunación EPV, estudio y seguimiento de enfermedades inmuno-prevenibles de mayor importancia nacional y mundial. Poliomielitis, PFA sarampión, rubéola, enfermedad febril exantemática (EFE), tos ferina, síndrome coqueluchoide, difteria, tétanos y tétanos neonatal, Infecciones invasivas por H Influenzae. 24 Procedimientos: Estudio epidemiológico de caso: es la investigación del entorno clínico epidemiológico, con apoyo de laboratorio cuando sea necesario, así como el llenado del formato de estudio epidemiológico de caso correspondiente para cada una de las enfermedades prevenibles por vacunación. Estudio de brote: es la investigación de los factores epidemiológicos de dos o más casos asociados en un área geográfica delimitada y tiempo. El estudio debe incluir la investigación epidemiológica individual de casos. Así como de situaciones de interés epidemiológico, dicha información se registra en el formato de estudio de notificación de brote establecido por el órgano normativo; desde el seguimiento hasta la resolución del mismo. El estudio debe iniciarse dentro de las primeras 48 horas de su conocimiento. La clasificación final del brote debe contar con el estudio de laboratorio específico cuando así se requiera. En algunos padecimientos la presencia de un caso se considera como brote (poliomielitis, tétanos neonatal, difteria, sarampión, rubéola y síndrome de rubéola congénita). Registros nominales: son un elemento de información epidemiológica y están constituidos por los casos nuevos de enfermedades, de los cuales se deberá registrar información comprobable que requiere en primera instancia el nombre, edad y sexo de un caso o contacto, dichos registros se elaboran a partir de la información generada en las unidades operativas, y se transmite al nivel inmediato superior de acuerdo a los niveles técnico- administrativos existentes. Red de notificación negativa semanal: es un mecanismo para mantener un sistema de vigilancia epidemiológica activo y alerta al trabajador de salud para la detección de casos sospechosos de enfermedades específicas en las enfermedades prevenibles por vacunación. La red de notificación negativa semanal tiene como objetivo asegurar la notificación de las unidades de salud, 25 existan o no casos. Las unidades notificantes deben informar la presencia o ausencia de casos, es decir no se trata de un espacio en blanco en la notificación semanal del sistema de notificación convencional, sino la ratificación por escrito de la ausencia de casos sospechosos. Obviar la notificación dentro del plazo previsto no significa ausencia de casos, por el contrario, indica que el sistema de información es deficiente. Este sistema necesita un acompañamiento sistemático. Las unidades médicas de notificación serán definidas, así como los responsables en cada nivel serán identificados. Para las EPV, todas las unidades de salud incluidas en la Red de Notificación Negativa Semanal deben informar, en circunstancias que determinen los comités de vigilancia epidemiológica, la presencia o ausencia de casos al nivel inmediato superior. Dictaminación por grupos de expertos: para este procedimiento se deberá contar con toda la información clínica-epidemiológica, así como los resultados de laboratorio y gabinete para la dictaminación por el Comité Estatal de Vigilancia Epidemiológica y/o el Grupo de Expertos del Nivel Nacional, lo anterior con la finalidad de ratificar o rectificar el diagnóstico. 26 VIGILANCIA EPIDEMIOLÓGICA DE SARAMPIÓN Y EFE El sarampión es una enfermedad vírica aguda sumamente contagiosa causada por el virus del sarampión, pertenece a la familia Paramixoviridae del género Morbillivirus, el reservorio son los seres humanos. Se transmite por diseminación de gotitas suspendidas en el aire o por contacto directo con secreciones nasales o faríngeas de personas infectadas. El período de incubación es de aproximadamente 10 días, pero puede ser de 7 a 18 días desde la exposición hasta el comienzo de la fiebre, y de unos 14 días hasta que aparece la erupción; ocasionalmente dura de 19 a 21 días. Se caracteriza por síntomas prodrómicos de fiebre, conjuntivitis, coriza, tos y manchas pequeñas con centro blanco o blanco azulado sobre una base eritematosa en la mucosa del vestíbulo de la boca (manchas de Köplik). Entre el tercero y séptimo día aparece una erupción característica con manchas rojas parduscas, que comienza en la cara y después se generaliza, dura de 4 a 7 días y a veces termina en descamación furfurácea. La enfermedad es más grave en los lactantes, malnutridos y en los adultos que en los niños. Las complicaciones pueden ser consecuencia de la réplica vírica o de una infección bacteriana sobreañadida como: otitis media, neumonía, laringotraqueobronquitis, diarrea y encefalitis. La vigilancia epidemiológica de sarampión se ubica actualmente en el contexto de la vigilancia sindrómica, que agrupa una serie de padecimientos con algunos signos y síntomas comunes llamados enfermedad febril exantemática (EFE): sarampión, rubéola, exantema súbito, escarlatina, erisipela, mononucleosis infecciosa, entre otras). Situación epidemiológica En México el sistema de vigilancia epidemiológica de Sarampión y Enfermedad Febril Exantemática (EFE) se inició en 1993 y garantiza el análisis de indicadores que incluyen la detección, notificación, estudio oportuno, toma de muestra y clasificación final, lo cual 27 permite la identificación de grupos y áreas de riesgo, útil para la toma de decisiones e implementación de medidas de control. Nuestro país ha adquirido compromisos internacionales que representan todo un reto como son la eliminación de Sarampión, Rubéola y Síndrome de Rubéola Congénita. Por tal motivo, es de interés primordial fortalecer y mantener las actividades de vigilancia epidemiológica. La notificación de las enfermedades exantemáticas ha sido variable, ya que para los años de 1993 al 2002 el reporte de casos estuvo en un rango entre 1,000 a 2,300 casos. A partir del año 2003 se realizaron cambios en las definiciones operacionales de caso y en las actividades de prevención y control, por lo que de ese año y hasta el 2011 la notificación osciló entre 4,000 y 7,700 casos de enfermedad febril exantemática. Casos de Enfermedad Febril Exantemática, México, 1993 a 2011 8000 7500 7000 6500 6000 5500 5000 4500 4000 3500 3000 2500 2000 1500 1000 500 0 7787 7594 6457 6552 5149 4258 4200 2261 2087 1252 1993 1458 1994 1995 1996 1997 1455 1392 1171 1998 1999 4464 2340 1739 1395 4504 2000 2001 2002 2003 2004 2005 2006 2007 2008 2009 2010 2011 Fuente: Base de datos de Enfermedad Febril Exantemática/DGE/SALUD La última epidemia de Sarampión en México fue en 1989 y 1990 (89,163 casos), trajo consigo la intensificación de las acciones de prevención y control que permitieron la reducción drástica de la morbilidad y mortalidad hasta lograr la eliminación de la transmisión autóctona en nuestro país en 1996. En el periodo de 1997 a 1999 no se presentaron casos de sarampión; sin embargo, en el año 2000 hubo una reintroducción del virus causando un brote de 30 casos (Baja California 1, Distrito Federal 23, Estado de México 4, Sinaloa 2). El genotipo identificado 28 fue el D6, importado de Europa. En el año de 2001 se detectaron tres casos confirmados de sarampión en Cancún, Quintana Roo, uno importado y dos relacionados a importación. No se logró identificar el genotipo circulante. En el 2002 no se reportaron casos y para el 2003 se presentó una nueva reintroducción del virus con 44 casos de sarampión (Distrito Federal 34, Hidalgo 1, Estado de México 9); el genotipo identificado fue H1. En el 2004 se reportaron 64 casos de sarampión (Campeche 1, Coahuila 2, Distrito Federal 43, Hidalgo 3, Estado de México 15). Se identificó el genotipo H1 que circulaba en Japón, Corea y China. Este brote se consideró continuación del iniciado en 2003. En abril del 2005 se reportó un caso aislado de sarampión importado (Distrito Federal) con antecedente de viaje a Los Ángeles, EUA, identificándose el genotipo D9. Y en diciembre inició un segundo brote, reportándose cinco casos de Sarampión en el Estado de México. Este mismo brote continuó en el 2006, confirmándose 22 casos (Estado de México 16, Distrito Federal 6). Y en diciembre se reportó un caso aislado. Se identificaron dos cadenas de trasmisión, una de ellas con inicio en el año 2005. El genotipo B3 circulante en Venezuela y Nueva York, EUA, se aisló en seis casos, (5 en 2005 y 1 en 2006). Desde el año 2007 al 2010 no se reportaron casos autóctonos ni importados. En el año 2011 se presentaron tres casos importados (Distrito Federal 2, Guanajuato 1). El genotipo identificado fue el D4 procedente de Francia, Canadá, Ucrania o EUA. En 1996 se presentaron los últimos casos endémicos de sarampión en nuestro país; sin embargo, existe el riesgo de la reintroducción del virus debido a que otros continentes continúan con brotes importantes. Por tal motivo, se debe fortalecer la vigilancia epidemiológica, con las acciones descritas en este manual y en la Guía de Procedimientos para la Vigilancia y Seguimiento de Casos Importados de Sarampión y Rubéola, (Anexo 1 y 1.1). Las defunciones por sarampión representaban un problema de salud pública, tan solo en el año de 1990 se notificaron 5,899 muertes, cifra que decreció notablemente para el año de 1991 con tan solo 97 decesos y continuó descendiendo hasta el año de 1995 en que se reportaron solo dos defunciones. 29 Casos de Sarampión, México, 1989 a 2011 100000 2038168782 5077 10000 846 1000 172 128 100 30 12 44 64 23 6 10 2 1 1989 1990 1991 1992 1933 1994 1995 1996 1997 1998 1999 2000 2001 2002 2003 2004 2005 2006 2007 2008 2009 2010 2011 Fuente: Base de datos de Enfermedad Febril Exantemática. 1994-2011./DGE/SALUD. Definiciones operacionales Caso Sospechoso: Toda persona de cualquier edad con cuadro de fiebre y exantema. Caso Probable: Persona de cualquier edad que presente fiebre, exantema maculopapular sin importar la duración del mismo y uno o más de los siguientes signos y síntomas: tos, coriza y/o conjuntivitis. Caso Confirmado: Todo caso probable en el que se demuestre infección reciente mediante técnicas de laboratorio, o caso probable que no cuente con muestra o resultado de laboratorio, y que esté asociado epidemiológicamente a otro caso confirmado. Caso Endémico: Todo caso confirmado de sarampión que forma parte de una cadena de transmisión local, la que se ha mantenido por más de doce o más meses por un mismo genotipo. Caso Importado: Caso confirmado que según evidencias epidemiológica y virológicas presentó la exposición fuera del país en los 7 a 21 días previos al inicio del exantema. Caso relacionado a Importación: Es el caso confirmado que forma parte de una cadena de transmisión local, originada por un caso importado, lo que está sustentado en evidencias epidemiológicas o virológicas o ambas. Si los casos persisten por un periodo superior o igual a 12 meses, ya no se consideran relacioandos a importación sino endémicos. 30 Caso confirmado relacionado a la vacuna: Caso probable que se ha presentado dentro de los 30 días posteriores a la administración de la vacuna contra sarampión y que después de haber terminado la investigación del caso, no se logra identificar alguna entidad nosológica específica, ajena a la vacunación, como causa de los signos y síntomas presentados. Caso de fuente desconocida: Caso confirmado en el que o se pudo identificar la fuente de la infección. Caso descartado: o Caso probable en el que se descarte infección reciente mediante técnicas de laboratorio. o Caso probable en el cual se demuestra mediante técnicas de laboratorio una etiología diferente a sarampión o rubéola. o Caso probable con muestras adecuadas con resultado negativo. o Caso probable donde las evidencias clínico epidemiológicas no son compatibles a sarampión o rubéola. Acciones ante caso por nivel técnico administrativo Nivel Local: Representado por las áreas aplicativas que son: Centro de Salud, Centro de Salud con Hospital y Unidades Hospitalarias. Consulta médica a casos sospechosos y probables. Verificar que el caso cumpla la definición operacional de caso probable para establecer el diagnóstico inicial. Si no cumple con los criterios de caso probable, se considera descartado y sólo se notifica en el Informe Semanal de Casos Nuevos SUIVE-1 (Anexo 2) con el diagnóstico correspondiente. En los casos con diagnóstico clínico inicial de Sarampión, iniciar las Actividades de prevención y control (cerco epidemiológico) referidas en el Anexo 4. 31 Notificar de manera inmediata al nivel superior los casos probables de acuerdo a lo establecido en el Proyecto de Norma Oficial Mexicana PROY-NOM-017-SSA22012. Notificar de manera inmediata los brotes por probable EFE o sarampión en el formato de Estudio de Brote (Anexo 21). Notificar la totalidad de los casos probables a través del “Informe Semanal de Casos Nuevos de Enfermedades” SUIVE-1 (Anexo 2), a la Jurisdicción Sanitaria. Elaborar el Estudio Epidemiológico de Caso EFE-1(Anexo 3) y enviarlo en un plazo no mayor de 48 horas a la jurisdicción sanitaria para su captura en el sistema correspondiente; de contar con equipo de informática, capturarlo en la misma unidad. Toma de muestras al 100% de los casos (serológica, orina y exudado faríngeo) enviarlas a la Jurisdicción Sanitaria o equivalente. Si se va realizar PCR en tiempo real, la muestra se debe tomar en los primeros cinco días, posterior a este período solo se podrá realizar muestra de serología. - Suero (0 a 35° día) - Exudado faríngeo (1° a 5° día) - Orina (1° a 5° día) En caso de brote, la notificación es inmediata por el medio más expedito al nivel superior. Coordinarse con la Jurisdicción Sanitaria para las actividades de prevención y control. Mantener actualizada la información epidemiológica. Participar en la investigación de brotes. Participar en capacitaciones en materia de vigilancia epidemiológica Recopilar y enviar los documentos e información epidemiológica para dictaminación de los casos o defunciones según la información epidemiológica, clínica y de laboratorio. Participar en la clasificación de los casos y defunciones en el seno del Comité Jurisdiccional de Vigilancia Epidemiológica. 32 En caso de defunción, personal de la unidad médica tratante deberá obtener copia del expediente clínico y estudio epidemiológico y enviarlo a la Jurisdicción Sanitaria correspondiente, en un periodo no mayor a 10 días hábiles posteriores a la detección de la defunción. En caso de que la unidad médica no cuente con personal de vigilancia epidemiológica, el epidemiólogo jurisdiccional será el responsable de la obtención del expediente clínico. Nivel jurisdiccional o equivalente: En este nivel las funciones como instancia de enlace técnico y administrativo para la vigilancia epidemiológica son: Verifiar y valiar la información enviada por las unidades de salud. Captar de manera inmediata la totalidad de los estudios epidemiológicos. Concentrar semanalmente la información del componente de Información Semanal de Casos enviada por las unidades de salud y envío al nivel estatal. Ratificar la información del estudio epidemiológico EFE-1. Notificar inmediatamente los casos o defunciones (en las primeras 24 horas de su conocimiento por los servicios de salud). Capturar de manera inmediata el 100% de los casos en las bases de datos en el programa EPI-INFO. Seguimiento de contactos. Toma de muestra serológica en los primeros 35 días después de iniciado el exantema y la toma de exudado faríngeo y orina durante los primeros 5 días de iniciado el exantema. Recabar el antecedente de aplicación de vacuna SR o SRP. En los casos con diagnóstico clínico inicial de Sarampión, iniciar las actividades de prevención y control (cerco epidemiológico)referidas en el Anexo 4. Emitir alerta sanitaria a las unidades médicas correspondientes. Búsqueda intencionada de casos con exantema. 33 Realizar encuesta rápida de cobertura. Aplicar vacunacon SR o SRP (Anexo 4). Coordinar o realizar la toma de muestras serológica, orina y exudado faríngeo y junto con el estudio epidemiológico remitirlas al laboratorio estatal, asegurándose de verificar la cantidad, envases, etiquetado, conservación y envío entre otras características. Atender y asesorar los brotes notificados o detectados en el área bajo su responsabilidad. Notificar de manera inmediata los brotes por probable EFE o sarampión en el formato de Estudio de Brote (Anexo 21). Seguimiento de los brotes hasta su resolución total. Participar en las acciones de prevención y control. Supervisar, asesorar y apoyar en la realización de los estudios de caso y defunciones hasta su clasificación final y el envío del Certificado de Defunción (Anexo 5) y el formato de “Reporte de causas de Muerte Sujetas a Vigilancia Epidemiológica” de INEGI (Anexo 6). Participar en la capacitación del personal en procedimientos de vigilancia, la vigilancia hospitalaria y en la toma de muestras para su envío al LESP. Realizar la supervisión y asesoría a las áreas operativas a efecto de identificar posibles omisiones a los procedimientos de vigilancia epidemiológica para la corrección inmediata de las mismas. Dictaminar todas las defunciones en el Comité Jurisdiccional en un periodo no mayor de 10 días posteriores al deceso y envío del acta correspondiente al estado. Debe contar con toda la información clínica-epidemiológica, así como los resultados del LESP o InDRE. Evaluar la información epidemiológica de EFE´s en el seno del Comité Jurisdiccional de Vigilancia Epidemiológica de acuerdo sus funciones y atribuciones, a efecto de orientar las medidas de prevención y control. Evaluar mensualmente el desempeño de los indicadores de evaluación y asegurar su cumplimiento. 34 Fortalecer la coordinación interinstitucional e intersectorial a través de los COJUVE. Evaluar el impacto de las acciones de prevención y control. Gestionar los recursos necesarios para las actividades de vigilancia epidemiológica. Envío semanal de las bases de datos actualizadas al nivel estatal. Mantener actualizado el panorama epidemiológico en los diversos municipios de la Jurisdicción Sanitaria. Elaborar avisos o alertas en el ámbito jurisdiccional. Retroalimentación de la situación epidemiológica a las unidades de salud. Difusión de los avisos y alertas emitidas por el nivel estatal o nacional. Difusión de la información epidemiológica generada. Nivel estatal o equivalente: De acuerdo con su función normativa y de línea jerárquica: Recibir, concentrar y evaluar la calidad de la información y de los estudios de casos. Concentrar semanalmente la información del componente de Información Semanal de Casos enviada por las unidades de salud y envío a la DGAE. Notificar inmediatamente los casos probables a la DGAE. Actualizar la base de datos de casos de EFE en el programa EPI-INFO y enviarla a la DGAE semanalmente. Coordinar las acciones de toma, manejo de muestras y envío al laboratorio estatal o al INDRE, ratificar la recepción y las condiciones de las muestras a su llegada, recuperar los resultados correspondientes, capturarlos en la base de datos y canalizarlos a la coordinación jurisdiccional y a la unidad o médico responsable. Validar y notificar de manera inmediata a la DGAE los brotes de EFE ocurridos en la entidad en Notificar de manera inmediata los brotes por probable EFE o sarampión en el formato de Estudio de Brote (Anexo 21). 35 Evaluar y supervisar las medidas de control aplicadas. Analisis permante de la información. Proponer y aplicar medidas de intervención. Supervisar, asesorar y evaluar las acciones de vigilancia en los niveles jurisdiccional y local. Supervisar, asesorar y apoyar en la realización de los estudios de caso, brote y seguimiento de defunciones hasta su clasificación final con envío de la dictaminación del Comité Estatal, el Certificado de Defunción (Anexo 5) y el formato de “Reporte de causas de Muerte Sujetas a Vigilancia Epidemiológica” de INEGI (Anexo 6) a la DGAE. Participar en la capacitación del personal en procedimientos de vigilancia y la vigilancia hospitalaria. Evaluar en el seno del Comité Estatal de Vigilancia Epidemiológica (CEVE) de acuerdo a las funciones y atribuciones establecidas en el Acuerdo Secretarial 130, la información epidemiológica a efecto de orientar las medidas de prevención y control; y realizar la dictaminación de casos y defunciones. Realizar la supervisión y asesoría a las áreas operativas a efecto de identificar posibles omisiones a los procedimientos de vigilancia epidemiológica para la corrección inmediata de las mismas. En situaciones especiales, implementar la red de notificación diaria o semanal. Validar las dictaminaciones del Comité Jurisdiccional en un periodo no mayor de cinco días posteriores a la dictaminación y envío de las actas correspondientes a la DGAE. Debe contar con toda la información clínica-epidemiológica, así como los resultados del LESP ó InDRE. Toda defunción en la cual no haya sido tomada muestra para diagnóstico de laboratorio deberá ser dictaminada mediante criterios clínico–epidemiológicos por el Comité Estatal. Envío del Certificado de Defunción (Anexo 5) y el formato de “Reporte de causas de Muerte Sujetas a Vigilancia Epidemiológica” de INEGI (Anexo 6) en un periodo no mayor de cuatro semanas a la Dirección General de Epidemiología, 36 donde se realiza la ratificación o rectificación de la defunción dictaminada por el Comité Estatal de Vigilancia Epidemiológica. Coordinar la capacitación del personal en materia de vigilancia de EFE’s. Evaluar mensualmente el desempeño de los indicadores de evaluación y asegurar su cumplimiento. Evaluar el impacto de las acciones de prevención y control. Gestionar los recursos necesarios para las actividades de vigilancia epidemiológica. Elaborar y difundir los avisos o alertas epidemiológicas en el ámbito estatal. Emitir recomendaciones basadas en el análisis de la información epidemiológica que oriente las acciones de control. Mantener actualizado el panorama epidemiológico en el estado incluyendo el análisis y los estudios de brote. Retroalimentar a las jurisdicciones sobre la situación epidemiológica. Coordinarse con el programa de vacunación para intercambio de información y aplicación de medidas de control ante casos y brotes. Difundir la información epidemiológica estatal. Acciones ante defunciones: Coordinarse con nivel local y Jurisdiccional Notificación inmediata de la defunción en las primeras 24 horas de su conocimiento por los servicios de salud. La notificación deberá incluir los signos y síntomas que avalen que corresponde a defunción por probable Sarampión. Elaboración y envío inmediato del estudio epidemiológico de caso en el formulario EFE-1. Obtención y envío inmediato hasta el nivel nacional del expediente clínico. Toma de muestra del paciente y envio al Laboratorio Estatal y/o al InDRE. Dictaminación de la defunción por el Comité Estatal de Vigilancia Epidemiológica, en un período no mayor de 10 días hábiles posteriores a la fecha 37 de la defunción, y envío de la dictaminación correspondiente a la Dirección General de Epidemiología. Revisión de la documentación (estudio de caso, expediente clínico y acta) por el CONAVE para avalar o no el dictamen. Nivel nacional: Normar o actualizar los procedimientos de vigilancia epidemiológica. Asesorar, supervisar y evaluar las actividades de vigilancia epidemiológica en todos los niveles operativos. Coordinar la cacapitación y asesorar al personal en salud en materia de vigilancia epidemiológica. Tener información completa y actualizada en base de datos programa EPI-INFO. Recibir, concentrar, analizar y difundir la información epidemiológica nacional del panorama epidemiológico. Fortalecer la coordinación con los LESP con el fin de obtener resultados en forma oportuna para la confirmación o descarte de los casos. Supervisar, asesorar y evaluar el sistema de vigilancia epidemiológica. Elaborar informes periódicos sobre la situación de las EFE en el país y los estados. Participar en estudios e investigaciones especiales. Fortalecer la coordinación interinstitucional mediante reuniones con el CONAVE con el propósito de analizar la situación epidemiológica a nivel nacional, reorientando las acciones de manera permanente. Elaborar boletín semanal de casos de EFE y sarampión, anuarios estadísticos. Coordinación con el CeNSIA para el intercambio de información y aplicación de medidas control ante situaciones especiales. Coordinar las reuniones con el Comité Nacional de Expertos para la dictaminación de los casos o defunciones según la información epidemiológica, clínica y de laboratorio. Evaluar el impacto de las acciones de control. 38 Evaluar mensualmente el desempeño de los indicadores de evaluación y asegurar el cumplimiento de los mismos. Envío de información de situación de casos de EFE y sarampión a OPS/OMS. Participación en reuniones nacionales e internacionales. Elaborar y difundir avisos o alertas epidemiológicas sobre situaciones de riesgo para su envío a los comités y unidades de vigilancia epidemiológica. Emitir recomendaciones basadas en el análisis de la información epidemiológica que oriente las acciones de control. Difundir la información sobre la situación del Sarampión y EFE en el país y los estados. Procedimientos de laboratorio Las muestras deberán venir acompañada con el Formato Único de Envío de Muestras (FREM-01) debidamente llenado, sin datos alterados o sobre escritos. Cada muestra deberá cumplir con los requisitos generales establecidos en el Instructivo para el Envío y Recepción de Muestras Foráneas. Las muestras que no cumplan con los requisitos técnicos y administrativos serán rechazadas de manera definitiva de acuerdo a los lineamientos establecidos en el Manual para la Toma, Envío y Recepción de Muestras del InDRE (REM-MA-03). 1. Criterios de aceptación: Muestra de Suero, Orina, Exudado Faríngeo y Exudado nasofaríngeo que cumpla con definición operacional de caso probable de EFE. Que cumpla con días de evolución: – Suero de 0-35 días de evolución. – Orina y Exudado Faríngeo de 0-5 días. Muestra en buenas condiciones (no contaminada y en condiciones de refrigeración). Con Formato Único de Envío de Muestras bien requisitado con datos personales (nombre, edad, sexo, en caso de embarazo cuantas semanas gestación), 39 dependencia que remite completos, fecha de inicio de exantema, fecha de toma y fecha de vacunación. 2. Criterios de rechazo: Se rechazaran las muestras que: No cumplan con definición operacional de EFE. No cumplan con los días de evolución requeridos. Muestras enviadas a temperatura ambiente. Formato único del InDRE incompleto (Información en criterios de aceptación). 3. Tipos de muestra TIPO DE MUESTRA Exudado Faríngeo y nasofaríngeo Orina MÉTODO MEDIO/CONTENEDOR /FORMA DE ENVÍO Hisopo: usar solo hisopo Tubo con medio de transporte viral con estéril de dacrón o rayón con 3.0mL mango de plástico y flexible Enviar con refrigerantes de 4 a 8°C Colectar el chorro medio En recipiente estéril con tapón de rosca, enviar con refrigerantes de 4 a 8°C TIEMPO 0 a 5 días de evolución 0 a 5 días de evolución TÉCNICA Aislamiento viral; RT-PCR, rRT-PCR, Secuenciación Aislamiento viral; RT-PCR , rRT-PCR, Secuenciación 0 a 35 días de evolución. En Suero Por Venopunción en tubo sin 2.5 mL. Enviar con refrigerantes de 4 a caso de segunda muestra, anticoagulante 8°C tomar 2 semanas después de ELISA la primera Procedimiento para la toma, manejo y envío de muestras: Muestra serológica 1. En todo caso probable de Sarampión y EFE se debe tomar una muestra de sangre completa por venopunción (aprox. 5 mililitros) sin usar anticoagulante y obtener el suero (aprox. 2.5 mililitros). Pueden utilizarse los tubos al vacío con un gel especial (tipo de tubo vacutainer), que permiten la separación del suero directamente en los tubos centrifugando a 3,000 rpm por 5 minutos. El suero será enviado al LESP que cuente con el ensayo dentro de su marco analítico. Las muestras deberán enviarse en red fría de 4-8°C. Una vez recibidas las muestras en el laboratorio, se deberán alícuotar y congelar inmediatamente; dejar solo una 40 alícuota en refrigeración (4-8 °C) para realizar el proceso de diagnóstico. El suero no debe estar hemolizado, ni lipémico, ni contaminado. 2. Es importante considerar que el criterio de tiempo evolución para diagnóstico de Sarampión y EFE obliga a tomar la muestra de suero entre el día cero y el día 35 posterior a la aparición del exantema. Aunque si se va realizar PCR en tiempo real, la muestra se debe tomar en los primeros cinco días, posterior a este periodo solo se podrá realizar serología. 3. Enviar al InDRE el 100% de las muestras positivas y el porcentaje de muestras negativas que el InDRE indique. Exudado faríngeo 1. Para obtener la muestra se debe sentar al paciente y colocar su cabeza hacia atrás para iluminar bien la cavidad orofaríngea, con un abatelenguas bajar la lengua para facilitar el acceso a la parte posterior de la orofarínge. Con un hisopo de dacrón o de rayón con mango de plástico, hacer un raspado firme girando el hisopo en las áreas dañadas, que se debe ver hiperémicas, purulentas o necróticas, así como en las membranas formadas sobre las lesiones o de las manchas de Köplik. Hay que evitar tocar la lengua, la úvula o los carrillos. Introducir el hisopo con la muestra en un tubo con tapón de rosca que contenga el medio de transporte viral. 2. La muestra de exudado faríngeo se puede refrigerar y transportar al InDRE en un lapso de 48 horas a una temperatura de 4-8°C. 3. El criterio de días de evolución obliga a tomar la muestra entre el día 0 y 5 posterior a la aparición del exantema, que corresponde al periodo de mayor carga viral, incrementándose la posibilidad de realizar un diagnóstico temprano mediante rT-PCR en tiempo real y aislamiento viral. Muestra de orina 1. Se debe instruir al paciente para que deseche la primera parte de la micción y colecte 10 a 50 ml del chorro medio en un recipiente estéril de boca ancha con tapa de rosca. 41 2. La orina se centrifuga a 1500 rpm durante 10 minutos a 4°C, se desecha el líquido sobrenadante y el sedimento se resuspende en 2 o 3 mL de medio de transporte viral. Mezclar y hacer tres alícuotas, dos congelarlas inmediatamente a -70°C y la última utilizar para procesar RT- PCR en tiempo real de sarampión. Si no es posible realizar el procesamiento de la muestra enviarla al InDRE en un lapso de 48 horas de 4-8°C. 3. El criterio de días de evolución obliga a tomar la muestra entre el día 0 y 5 posterior a la aparición del exantema, que corresponde al periodo de mayor carga viral, incrementándose la posibilidad de realizar diagnóstico temprano mediante rT-PCR en tiempo real y aislamiento viral. 42 ALGORITMO DIAGNÓSTICO: DIAGNÓSTICO DE SARAMPIÓN Y RUBÉOLA 43 ALGORITMO DE RRT-PCR Y AISLAMIENTO VIRAL PARA SARAMPION Y RUBEOLA *Para la secuenciación es necesario realizar la técnica de PCR punto final 44 PCR PUNTO FINAL 45 GENOTIPIFICACION PARA SARAMPION Muestras a analizar (Producto de PCR) Electroforesis capilar y lectura de datos Evaluación Aún existe la posibilidad de la reintroducción del virus a nuestro país, ya que en otros continentes se siguen presentando casos de Sarampión, por lo tanto, debemos mantener las actividades de vigilancia y control para asegurar la no circulación del virus en nuestro territorio y por consiguiente la ausencia de casos.Para la consolidación y seguimiento institucional del sistema de vigilancia de EFE se requiere de evaluación mensual de los indicadores nacionales e internacionales. Ante las acciones de documentación de la eliminación de Sarampión y Rubéola, es necesario reforzar la actuación en dos sentidos: 1. Asegurar la calidad de la vigilancia epidemiológica, y 2. Establecer el algoritmo diagnóstico que incluya diagnóstico diferencial. 46 Los indicadores de evaluación se enfocan por un lado a asegurar la continuidad con la calidad en la vigilancia epidemiológica, y por otro, monitorear la eliminación de estas enfermedades. INDICADOR Tasa casos probables* Tasa casos probables Seguimiento de contactos Tasa de casos de EFE por Municipio CONSTRUCCIÓN Total de casos probables notificados al sistema especial. Población estatal. Total de casos probables notificados al sistema especial. Población estatal. Casos confirmados con seguimiento de contactos Total de caso confirmados VALOR X 100,0000 =ó>2 X 20,0000 =ó>2 X 100 = ó > 80% X 100 = ó > 80% X 100 = ó > 80% X 100 = ó > 80% X 100 = ó > 80% X 100 = ó > 80% X 100 = ó > 80% X 100 = ó > 80% X 100 = ó > 80% x 100 = ó > 80% Municipios mayores de 20,000 habitantes que cumplen con tasa igual o mayor de 1 caso por 20 mil habitantes. Total de municipios mayores de 20,000 habitantes en el estado. Casos probables detectados por la unidad médica en los primeros 7 días posteriores al inicio del Detección Oportuna exantema. Total de casos probables notificados al sistema especial. Casos probables notificados al nivel superior en las primeras 24 horas posteriores a su detección Notificación Oportuna por la unidad médica. Total de casos probables notificados al sistema especial. Investigación adecuada Casos estudiados en las 48 horas posteriores a su notificación. Total de casos probables notificados al sistema especial. Número de casos probables con muestra serológica tomada entre el 1° y 35° días posteriores al Muestras Adecuadas inicio del exantema. Total de casos probables con muestra notificados Detección Viral Brotes con identificación de genotipo Total de brotes Casos probables notificados con nombre, edad, sexo, entidad, institución, fecha de estudio y Información Completa antecedente vacunal. Total de casos notificados al sistema especial. Envío Oportuno de la Muestra Resultado Oportuno de Laboratorio Número de casos probables con muestra de suero que llega al laboratorio en los primeros 5 días posteriores a la toma. Total de casos con muestra notificados al sistema especial. Número de muestras serológicas con resultado en 4 días posteriores a la fecha de recepción en el Laboratorio Total de muestras serológicas recibidas en el Laboratorio *Indicador Internacional. ** La muestra siempre se deberá obtener al primer contacto. De los indicadores referidos en los rubros anteriores, se consideran dentro de Caminando a la Excelencia los siguientes: Porcentaje de municipios mayores de 20 mil habitantes que cumplen con tasa igual o mayor de 1 caso de EFE por 20 mil habitantes: OPS considera que debe 47 haber por lo menos 1 caso de EFE por cada 20 mil habitantes. Por tal motivo los municipios mayores de 20 mil habitantes están obligados a notificar casos de EFE de acuerdo a la población de cada uno de ellos y así continuar con la vigilancia epidemiológica. Estudio Oportuno: Todos los casos de EFE notificados deben ser estudiados de forma exhaustiva de manera que se tenga toda la información para un llenado del formato EFE-1. Muestras adecuadas: La especificidad del sistema de vigilancia está dada por el laboratorio, por eso durante el seguimiento de los casos se debe de tomar una muestra de suero dentro de los 35 días de iniciado el exantema para determinarla titulación de anticuerpos IgM e IgG, así como muestras de exudado faríngeo y orina en las condiciones y tiempos establecidos, lo cual apoyará a la clasificación final del padecimiento. 48 RUBÉOLA Y SÍNDROME DE RUBÉOLA CONGÉNITA Es una enfermedad infecciosa y altamente contagiosa causada por el virus de la rubéola de la familia Togaviridae del género Robivirus. El período de incubación es de 14 a 17 días, con límites de 14 a 21 días. La transmisibilidad es aproximadamente de una semana antes y por lo menos 4 días después de comenzar la erupción. Se caracteriza por una erupción maculopapular y puntiforme difusa, que a veces se asemeja a la del sarampión o la escarlatina. Los menores de edad por lo regular presentan pocos signos generales o no lo muestran, los adultos sufren un pródromo de 1 a 5 días, constituido por hipertermia, cefalea, mal estado general, coriza y conjuntivitis. La linfopatía posauricular, occipital y cervical posterior es el signo más característico y se presenta de 5 a 10 días antes de la erupción. La rubeola congénita aparece cuando la madre adquiere la infección primaria durante el embazo; llegando a producir incluso la muerte del feto o el nacimiento de un bebe con defectos congénitos severos. El síndrome de rubeola congénita es causa importante de ceguera, sordera, enfermedad cardiaca y retraso mental. Situación Epidemiológica En México, la Rubéola fue considerada como una enfermedad endémica con afectación principalmente a los menores de edad, no obstante, en periodos interepidémicos, uno de cada cinco casos se presentaba en los grupos de edad reproductiva. Las encuestas seroepidemiológicas sugerían que en México existía una proporción relativamente elevada de mujeres en edad fértil susceptibles a Rubéola (20%), lo que implicaba un alto riesgo de casos de Síndrome de Rubéola Congénita (SRC). A partir del registro de la Rubéola se llegaron a identificar promedio de 41,000 casos anuales, (67,879 casos en 1993, 54,615 en 1994, 51,846 en 1998). Pero a raíz de que la vacuna contra Sarampión, Rubéola y Parotiditis (SR) se introdujo en 1997 y se consolidó como vacunación universal a niños de 1 a 6 y años en 1998, en el año 2000 se hizo vacunación con enfoque de riesgo a adultos trabajadores de la salud, educación, turismo 49 y defensa, en 2004 se hizo vacunación universal a adultos de hasta 39 años y en 2009 a personas de 13 a 29 años, la curva de casos descendió rápidamente. En 2012 se presentaron tres casos confirmado de Rubéola en el Distrito Federal, el genotipo determinado fue 2B importado de Europa. En el periodo de 1990 a 1999 se notificaron 68 defunciones por Rubéola y para el periodo de 2000 a 2010 solo se reportaron 10 defunciones, la última reportada fue en el año de 2004. CASOS DE RUBÉOLA, MÉXICO, 1978 A 2011 140,000 124841 120,000 100842 100,000 83937 80,000 64426 57777 56495 60,000 20,000 40194 33631 33060 40,000 67879 65591 65417 32415 54615 51846 51157 44102 38042 29708 21173 18102 17523 11751 48433685 1552699 537 74 102 46 7 5 0 0 1978 1980 1982 1984 1986 1988 1990 1992 1994 1996 1998 2000 2002 2004 2006 2008 2010 Fuente: Base de datos de Enfermedad Febril Exantemática. 2006-2011./DGE/SALUD. En el periodo del 2000 al 2011 se presento un descenso acelerado en la tendencia de rubéola en nuestro país, de tal forma que en el 2000 se notificaron 11,751 casos y para el 2010 descendió a 5 casos, con una tasa de incidencia de 0.06 por 100,000 habitantes. CASOS DE RUBÉOLA, 2000 A 2011 12000 11751 9000 6000 4843 3685 3000 1552 699 537 74 102 46 7 5 0 0 2000 2001 2002 2003 2004 2005 2006 2007 2008 2009 2010 2011 Fuente: Base de datos de Enfermedad Febril Exantemática. 2006-2011./DGE/SALUD. 50 Debido al riesgo potencial que implica la rubéola (clínica y subclínica) en embarazadas, con presencia de defectos al nacimiento de los productos, se considero a la vigilancia activa de este grupo de riesgo ante la presencia de brotes de EFE. México ha considerado como prioritaria la vigilancia de este grupo de riesgo. Lo anterior conlleva a la necesidad de un diagnóstico oportuno de la población en riesgo para identificar la ocurrencia de casos congénitos secundarios al padecimiento. Por lo anterior, nuestro país se adhirió al compromiso internacional de la eliminación de la Rubéola. Al igual que otros padecimientos inmunoprevenibles, el comportamiento epidemiológico del SRC no ha sido bien determinado en México, se sabe sin embargo, que del 40 al 60 % de las infecciones por rubéola son asintomáticas. En estudios realizados en embarazadas con infección por rubéola, se encontró que de las pacientes que se infectan en el primer trimestre de gestación, el 85 a 90% de sus productos presentaron algún defecto congénito durante los primeros cuatro años de vida. Los casos de SRC se registran de manera sistemática en México a partir de 1998 en que se instrumentó el sistema específico de vigilancia epidemiológica. La tendencia de rubéola congénita ha sido variable del año 2000 al 2011, se presentaron pocos casos en cada uno, de tal forma que en el 2000 se notificaron 5 casos y disminuyo a cero en el 2003. En el año 2004, se presentaron nuevamente 5 casos, en 2005 se presento 1 caso y de 2006 a 2011 sólo se presentó un caso en 2008. Casos anuales de Rubéola Congénita en México 2000-2011 10 8 6 4 2 5 5 2 1 0 1 0 0 1 0 0 0 0 2000 2001 2002 2003 2004 2005 2006 2007 2008 2009 2010 2011 Fuente: Anuarios estadísticos. 2000-2011/DGE/SALUD. 51 Definiciones operacionales Caso probable de rubeola: Persona de cualquier edad que presente fiebre, exantema maculopapular sin importar la duración del mismo y uno o más de los siguientes signos y síntomas: tos, coriza y/o conjuntivitis. Caso confirmado de rubeola: Todo caso probable en el que se demuestre infección reciente mediante técnicas de laboratorio, o caso probable que no cuente con muestra o resultado de laboratorio, y que esté asociado epidemiológicamente a otro caso confirmado. Caso probable de SRC: Lactante menor de un año en quien se sospecha de SRC debido a que: o Se detecta una o más anormalidades: patología ocular congénita (de tipo catarata, disminución de la visión, nistagmus, estrabismo, microoftalmos, glaucoma), defectos cardiacos congénitos, púrpura o hipoacusia y/o; o Historia de infección por Rubéola (confirmada o sospechosa) de la madre durante el embarazo. Caso confirmado de SRC: Un caso podrá ser confirmado por clínica o por laboratorio. Confirmación clínica de SRC: Aplicará en caso de que no se realice el diagnóstico de laboratorio de manera adecuada, y considerará: el caso identificado por un médico calificado (pediatra o infectólogo) con dos o más complicaciones como: catarata o glaucoma congénito, cardiopatía congénita, sordera, retinopatía pigmentaria; o al menos una de las siguientes: púrpura, esplenomegalia, microcefalia, retardo mental, meningoencefalitis, enfermedad radiolúcida de los huesos, ictericia que inicia 24 horas después del nacimiento. Confirmación por laboratorio de SRC: Un caso probable en el cual se demuestre resultado de laboratorio positivo. Criterios de laboratorio: o Demostración de anticuerpos IgM positivos los cuales pueden permanecer hasta los 12 meses de edad, ó 52 o En algunos casos los anticuerpos IgM pueden ser detectados hasta el mes de edad, por lo que a los niños altamente sospechos de SRC con un resultado negativo al nacimiento se les debe repetir la determinación al mes de edad. o En caso de que el título de anticuerpos IgG contra Rubéola en lactantes persista en un nivel más alto y por un periodo de tiempo mayor al esperado debido a la transferencia pasiva del anticuerpo materno ( es decir, el titulo del anticuerpo no disminuye en la tasa esperada de una dilución de dos veces por mes), y existe una fuerte sospecha clínica de SRC. o Detección del virus por reacción en cadena de la polimerasa de transcripción inversa (RT-PCR) en muestras de exudado faríngeo, nosofaríngeo y orina el cual puede permanecer positivo hasta los 12 meses de edad. o Aislamiento del virus de Rubéola en muestras de exudado faríngeo, nasofaríngeo y orina el cual puede permanecer positivo hasta los 12 meses de edad. o Una vez confirmado el caso, la recolección de la muestra debe continuar hasta que se obtengan dos cultivos virales negativos, recolectados a intervalos de un mes a fin de confirmar que el caso ya no esté excretando el virus. Caso endémico de rubeola: Todo caso confirmado de rubéola que forma parte de una cadena de transmisión local, la que se ha mantenido por más de doce o más meses por un mismo genotipo. Caso Importado: Caso confirmado que según evidencias epidemiológica y virológicas presentó la exposición fuera del país en los 7 a 21 días previos al inicio del exantema en los 12 a 23 días previos en el caso de rubéola. Caso importado de SRC: Es el caso confirmado con evidencias epidemiológicas y virológicas, de que la madre presentó exposición fuera del país en los 23 días previos al inicio de la concepción o hasta la semana 24 de gestación. 53 Caso relacionado a Importación: Es el caso confirmado que forma parte de una cadena de transmisión local, originada por un caso importado, lo que está sustentado en evidencias epidemiológicas o virológicas o ambas. Si los casos persisten por un periodo superior o igual a 12 meses, ya no se consideran relacioandos a importación sino endémicos. Caso de SRC relacionado con importación: Es el caso confirmado con evidencias epidemiológicas y virológicas, de que la madre formó parte de una cadena de transmisión local, originada por un caso importado. Caso confirmado relacionado a la vacuna: Caso probable que se ha presentado dentro de los 30 días posteriores a la administración de la vacuna contra Rubéola y que después de haber terminado la investigación del caso, no se logra identificar alguna entidad nosológica específica, ajena a la vacunación, como causa de los signos y síntomas presentados. Caso de fuente desconocida: Caso confirmado en el que o se pudo identificar la fuente de la infección. Infección congénita de rubéola (IRC):caso que sin presentar manifestaciones clínicas, presenta resultado de IgM positivo. Caso descartado: Un caso probable en el cual se demuestre resultado de laboratorio negativo o que después de estudiado el caso se identifique otro diagnóstico. Acciones ante caso por nivel técnico administrativo Nivel Local: Representado por las áreas aplicativas que son: Centro de Salud, Centro de Salud con Hospital y Unidades Hospitalarias. Consulta médica a casos sospechosos y probables. Verificar que el caso cumpla la definición operacional de caso probable para establecer el diagnóstico inicial: 54 o Si no cumple con los criterios de caso probable, se considera descartado y sólo se notifica en el Informe Semanal de Casos Nuevos (SUIVE-1) con el diagnóstico correspondiente. o En los casos con diagnóstico clínico inicial de Rubéola, iniciar las Actividades de prevención y control (cerco epidemiológico) referidas en el Anexo 4. Notificar de manera inmediata al nivel superior los casos probables de acuerdo a lo establecido en el Proyecto de Norma Oficial Mexicana PROY-NOM-017-SSA22012. Notificar la totalidad de los casos probables a través del “Informe Semanal de Casos Nuevos de Enfermedades” SUIVE-1 (Anexo 2), a la Jurisdicción Sanitaria. Elaborar el Estudio Epidemiológico de Caso EFE-1(Anexo 3) y enviarlo en un plazo no mayor de 24 horas a la jurisdicción sanitaria para su captura en el sistema correspondiente; de contar con equipo de informática, capturarlo en la misma unidad. Toma de muestras al 100% de los casos (serológica, orina y exudado faríngeo) enviarlas a la Jurisdicción Sanitaria. En caso de brote, la notificación es inmediata por el medio más expedito al nivel superior en el formato de Estudio de Brote (Anexo 21). Coordinarse con la Jurisdicción Sanitaria para las actividades de prevención y control. Mantener actualizada la información epidemiológica. Participar en la investigación de brotes. Participar en capacitaciones en materia de vigilancia epidemiológica Recopilar y enviar los documentos e información epidemiológica para dictaminación de los casos o defunciones según la información epidemiológica, clínica y de laboratorio. Participar en la clasificación de los casos y defunciones en el seno del Comité Jurisdiccional de Vigilancia Epidemiológica. 55 En caso de defunción, personal de la unidad médica tratante deberá obtener copia del expediente clínico y estudio epidemiológico y enviarlo a la Jurisdicción Sanitaria correspondiente, en un periodo no mayor a 10 días hábiles posteriores a la detección de la defunción. En caso de que la unidad médica no cuente con personal de vigilancia epidemiológica, el epidemiólogo jurisdiccional será el responsable de la obtención del expediente clínico. En los casos probables de SRC: Especificar el diagnóstico clínico de presunción. Notificación inmediata. Llenar estudio de caso en el Formato de Estudio epidemiológico de caso de Síndrome de Rubéola Congénita (Anexo 7). Cuando proceda, referencia del caso hasta 2do. o 3er. nivel de atención. Medidas preventivas de transmisión aérea y de contacto. Coordinar con la JS el seguimiento de caso y contactos por 11 meses. Revisar las coberturas de vacunación en las áreas de responsabilidad. Coordinar con la JS la toma de muestra de suero, exudado faríngeo, exudado nasofaríngeo y orina al nacimiento y si la muestra sérica es negativa monitorear cada mes durante al menos los primeros tres meses de edad. Realizar toma de muestra serológica a la madre, investigar antecedentes de la madre, sintomatología sugestiva de rubéola durante el embarazo o contacto con persona con exantema durante el mismo. Enviar expediente clínico para la investigación clínica epidemiológica, ya que estos casos son sujetos a dictamen por las autoridades de salud a nivel Estatal y Nacional. Nivel jurisdiccional o equivalente: En este nivel las funciones como instancia de enlace técnico y administrativo para la vigilancia epidemiológica son: Verificar y validar la información enviada por las unidades de salud. 56 Captar de manera inmediata la totalidad de los estudios epidemiológicos. Concentrar semanalmente la información del componente de Información Semanal de Casos enviada por las unidades de salud y envío al nivel estatal. Ratificar la información del estudio epidemiológico EFE-1. Notificar inmediatamente los casos o defunciones (en las primeras 24 horas de su conocimiento por los servicios de salud) al nivel estatal. Capturar de manera inmediata el 100% de los casos en las bases de datos en el programa EPI-INFO. Seguimiento de contactos. Corroborar la toma de muestra serológica en los primeros 35 días después de iniciado el exantema. Cooroborar la toma de muestras para aislamiento viral en los primeros 5 días de iniciado el exantema: 1 Muestra de orina y 1 muestra de exudado faríngeo. Recabar el antecedente de aplicación de vacuna SR o SRP. En los casos con diagnóstico clínico inicial de Rubéola, iniciar las actividades de prevención y control(cerco epidemiológico) referidas en el Anexo 4. Emitir alerta sanitaria a las unidades médicas correspondientes. Búsqueda intencionada de casos con exantema. Realizar encuesta rápida de cobertura. Aplicar vacuna con SR o SRP (Anexo 4). Coordinar o realizar la toma de muestras serológica, orina y exudado faríngeo y junto con el estudio epidemiológico remitirlas al laboratorio estatal, asegurándose de verificar la cantidad, envases, etiquetado, conservación y envío entre otras características. Atender y asesorar los brotes notificados o detectados en el área bajo su responsabilidad. Notificar de manera inmediata al nivel estatal los brotes en el formato de Estudio de Brote (Anexo 21). Seguimiento de los brotes hasta su resolución total. 57 Participar en las acciones de prevención y control. Supervisar, asesorar y apoyar en la realización de los estudios de caso y defunciones hasta su clasificación final y el envío del Certificado de Defunción (Anexo 5) y el formato de “Reporte de causas de Muerte Sujetas a Vigilancia Epidemiológica” de INEGI (Anexo 6). Coordinar la capacitación del personal en procedimientos de vigilancia epidemiológica y hospitalaria y, en la toma de muestras. Evaluar en el seno del Comité Jurisdiccional de Vigilancia de acuerdo a las funciones y atribuciones, la información epidemiológica a efecto de orientar las medidas de prevención y control. Realizar la supervisión y asesoría a las áreas operativas a efecto verificar el cumplimiento de los procedimientos de vigilancia epidemiológica de Rubéola. Dictaminar todas las defunciones en el Comité Jurisdiccional en un periodo no mayor de 10 días posteriores al deceso y envío del acta correspondiente al estado. Debe contar con toda la información clínica-epidemiológica, así como los resultados del LESP ó InDRE. Evaluar mensualmente el desempeño de los indicadores de evaluación y asegurar su cumplimiento. Fortalecer la coordinación interinstitucional e intersectorial a través de los COJUVE. Evaluar el impacto de las acciones de prevención y control. Gestionar los recursos necesarios para las actividades de vigilancia epidemiológica. Envío de las bases de datos actualizadas al nivel estatal. Elaborar y difundir avisos o alertas epdiemiológicas en el ámbito jurisdiccional. Mantener actualizado el panorama epidemiológico en los diversos municipios de la Jurisdicción Sanitaria. Retroalimentación de la situación epidemiológica a las unidades de salud. Difundir los avisos o alertas elaboradas por el Comité Estatal o Nacional de Vigilancia Epidemiológica. 58 Difusión de la situación epidemiológica de Rubéola. Nivel estatal o equivalente: De acuerdo con su función normativa y de línea jerárquica: Concentrar, verificar y validar la información enviada por las jurisdicciones. Evaluar la calidad de la información. Concentrar semanalmente la información del componente de Información Semanal de Casos enviada por las unidades de salud y envío a la DGAE. Notificar inmediatamente los casos y defunciones probables a la DGAE. Actualizar la base de datos de casos de EFE en el programa EPI-INFO y enviarla a la DGAE semanalmente. Coordinar las acciones de toma, manejo de muestras y envío al laboratorio estatal o al INDRE, ratificar la recepción y las condiciones de las muestras a su llegada, recuperar los resultados correspondientes, capturarlos en la base de datos y canalizarlos a la coordinación jurisdiccional y a la unidad o médico responsable. Validar y notificar de manera inmediata a la DGAE los brotes de EFE ocurridos en la entidad. Evaluar y supervisar las medidas de control aplicadas. Analisis permanente de la información epdiemiológica de Rubéola. Proponer y aplicar medidas de intervención. Supervisar, asesorar y evaluar las acciones de vigilancia en los niveles jurisdiccional y local. Supervisar, asesorar y apoyar en la realización de los estudios de caso, brote y acciones ante defunciones. Coordinar la capacitación del personal en procedimientos de vigilancia y la vigilancia hospitalaria. Evaluar en el seno del Comité Estatal de Vigilancia Epidemiológica (CEVE) de acuerdo a las funciones y atribuciones establecidas en el Acuerdo Secretarial 59 130, la información epidemiológica a efecto de orientar las medidas de prevención y control y realizar la dictaminación de casos y defunciones. Realizar la supervisión y asesoría a las áreas operativas a efecto de identificar verifiacr el cumplimiento de los procedimientos de vigilancia epdiemiológica. En situaciones especiales, implementar la red de notificación semanal o diaria. Validar las dictaminaciones de los Comités Jurisdiccionales en un periodo no mayor de cinco días posteriores a la dictaminación y envío de las actas correspondientes a la DGAE. Debe contar con toda la información clínicaepidemiológica, así como los resultados del LESP ó InDRE. Coordinar la clasificación final de defunciones con envío de la dictaminación del Comité Estatal, el Certificado de Defunción (Anexo 5) y el formato de “Reporte de causas de Muerte Sujetas a Vigilancia Epidemiológica” de INEGI (Anexo 6) a la DGAE. Envío del Certificado de Defunción (Anexo 5) y el formato de “Reporte de causas de Muerte Sujetas a Vigilancia Epidemiológica” de INEGI (Anexo 6) en un periodo no mayor de cuatro semanas a la DGAE, donde se realiza la ratificación o rectificación de la defunción dictaminada por el Comité Estatal de Vigilancia Epidemiológica. Toda defunción en la cual no haya sido tomada muestra para diagnóstico de laboratorio deberá ser dictaminada mediante criterios clínico–epidemiológicos por el Comité Estatal. Evaluar mensualmente el desempeño de los indicadores de evaluación y asegurar su cumplimiento. Evaluar el impacto de las acciones de prevención y control. Evaluar mensualmente el desempeño de los indicadores de evaluación y asegurar el cumplimiento de los mismos. Gestionar los recursos necesarios para las actividades de vigilancia epidemiológica. Elaborar y difundir avisos o alertas epidemiológicas e el ámbito estatal. 60 Difundir los avisos o alertas epidemiológicas a todos los niveles técnicoadministrativos bajo su responsabilidad. Emitir recomendaciones basadas en el análisis de la información epidemiológica que oriente las acciones de control. Mantener actualizado el panorama epidemiológico en el estado incluyendo el análisis y los estudios de brote. Retroalimentar a las jurisdicciones sobre la situación epidemiológica. Coordinarse con el programa de vacunación para intercambio de información y aplicación de medidas de control ante casos y brotes. En los casos con resultado positivo a Rubéola, además de las acciones iniciadas ante casos probables: o Comunicación inmediata de resultados de laboratorio al vocero oficial que a su vez informará a los responsables designados por nivel operativo. o Completar el estudio clínico epidemiológico del caso (verificar si hay complicaciones). o Intensificar la vigilancia hasta por cuatro periodos largos de incubación después de haber conocido el último caso. Coordinar, aplicar y evaluar las acciones de vigilancia epidemiológica y control. Difundir la información epidemiológica a nivel estatal. Acciones ante defunciones: Coordinarse con nivel local y Jurisdiccional Notificación inmediata de la defunción en las primeras 24 horas de su conocimiento por los servicios de salud. La notificación deberá incluir los signos y síntomas que avalen que corresponde a defunción por probable Rubeola. Elaboración y envío inmediato del Estudio Epidemiológico de Caso en el formulario EFE-1. Obtención y envío inmediato hasta el nivel nacional del expediente clínico. En caso de contar con muestra del paciente, enviarla al Laboratorio Estatal y al Instituto de Diagnóstico y Referencia Epidemiológicos. 61 Dictaminación de la defunción por el Comité Estatal de Vigilancia Epidemiológica, en un período no mayor de 10 días hábiles posteriores a la fecha de la defunción. Envio de la dictaminación a la DGAE para validación por el CONAVE. En los casos de SRC: Recabar el expediente clínico completo y estudio retrospectivo del caso. Emitir alerta sanitaria a las unidades médicas correspondientes. Clasificación del caso en el seno del comité de vigilancia epidemiológica. Coordinar con el Nivel local para el seguimiento de caso y contactos por 11 meses. Investigación clínica y epidemiológica del caso dentro de las 24 horas posteriores al nacimiento con la recopilación de expediente clínico completo. Investigación por laboratorio: Toma de muestras de Suero, exudado faríngeo y orina, para diagnóstico serológico y aislamiento viral. Investigación de los contactos con interrogatorio y exploración física; verificar antecedente vacunal y serológico, búsqueda de susceptibles y vacunación a mujeres en edad fértil. Seguimiento de mujeres embarazadas sin antecedente de vacuna. Cuando proceda, referencia del caso hasta 2do. o 3er. nivel de atención. Coordinar con la Jurisdicción Sanitaria la toma de muestra para aislamiento viral en los primeros 5 días de nacido y muestra sérica cada mes durante al menos los primeros tres meses de edad. Seguimiento del caso durante los primeros 12 meses de vida, ya que en este lapso de tiempo puede continuar excretando virus. Mantener la vigilancia de los contactos intra y extradomiciliarios. La localidad en donde ocurre el caso, no debe considerarse en alta sanitaria en tanto el caso continúe siendo excretor de virus. 62 Acciones ante defunciones: Coordinarse con nivel local y Jurisdiccional Notificación inmediata de la defunción en las primeras 24 horas de su conocimiento por los servicios de salud. La notificación deberá incluir los signos y síntomas que avalen que corresponde a defunción por probable Rubeola. Elaboración y envío inmediato del Estudio Epidemiológico de Caso en el formulario EFE-1. Obtención y envío inmediato hasta el nivel nacional del expediente clínico. En caso de contar con muestra del paciente, enviarla al Laboratorio Estatal y/o al Instituto de Diagnóstico y Referencia Epidemiológicos. Dictaminación de la defunción por el Comité Estatal de Vigilancia Epidemiológica, en un período no mayor de 10 días hábiles posteriores a la fecha de la defunción y envio de la dictaminación correspondiente a la Direccion General de Epidemiología. Nivel nacional: Normar o actualizar los procedimientos de vigilancia epidemiológica. Verificar y validar la información enviada por el nivel estatal. Asesorar, supervisar y evaluar las actividades de vigilancia epidemiológica en todos los niveles operativos. Coordinar la capacitación y asesorar al personal en salud en materia de vigilancia epidemiológica. Tener información completa y actualizada en base de datos programa EPI-INFO. Recibir, concentrar, analizar y difundir la información epidemiológica. Fortalecer la coordinación con los LESP con el fin de obtener resultados en forma oportuna para la confirmación o descarte de los casos. Supervisar, asesorar y evaluar el sistema de vigilancia epidemiológica. Elaborar informes periódicos sobre la situación de las EFE en el país y los estados. Participar en estudios e investigaciones especiales. 63 Fortalecer la coordinación interinstitucional mediante reuniones con el CONAVE con el propósito de analizar la situación epidemiológica a nivel nacional, reorientando las acciones de manera permanente. Difundir la información sobre la situación de la Rubéola y EFE en el país y los estados. Elaborar boletín semanal de número de casos y anuarios estadísticos. Coordinación con el CeNSIA para el intercambio de información y aplicación de medidas control ante situaciones especiales. Coordinar las reuniones con el Comité Nacional de Expertos para la dictaminación de los casos o defunciones según la información epidemiológica, clínica y de laboratorio. Evaluar el impacto de las acciones de control. Evaluar mensualmente el desempeño de los indicadores de evaluación y asegurar el cumplimiento de los mismos. Envío de información del sistema de vigilancia a OPS/OMS cuando sea requerida. Elaborar y difundir avisos o alertas epidemiológicas sobre situaciones de riesgo para su envío a los comités y unidades de vigilancia epidemiológica. Emitir recomendaciones basadas en el análisis de la información epidemiológica que oriente las acciones de control. Mantener actualizado el panorama epidemiológico de Rubéola y SRC a nivel nacional. En los casos de SRC, coordinar con Nivel estatal: Seguimiento de caso y contactos por 11 meses. Estudio retrospectivo del caso. Investigación clínica y epidemiológica del caso dentro de las 24 horas posteriores al nacimiento. Recopilación de expediente clínico completo. Investigación por laboratorio: Toma de muestras de Suero, exudado faríngeo y orina, para diagnóstico serológico y aislamiento viral. 64 Investigación de los contactos con interrogatorio y exploración física; verificar antecedente vacunal y serológico, búsqueda de susceptibles y vacunación a mujeres en edad fértil. Seguimiento de mujeres embarazadas sin antecedente de vacunal. Cuando proceda, referencia del caso hasta 2do. o 3er. nivel de atención. Toma de muestras para aislamiento viral en los primeros 5 días de nacido y muestra sérica cada mes durante al menos los primeros tres meses de edad. Seguimiento del caso durante los primeros 12 meses de vida, ya que en este lapso de tiempo puede continuar excretando virus. Mantener la vigilancia de los contactos intra y extradomiciliarios. La localidad en donde ocurre el caso, no debe considerarse en alta sanitaria en tanto el caso continúe siendo excretor de virus. Seguimiento de las recomendaciones emitidas por el Comité Nacional de Expertos. Procedimientos de laboratorio México se ha adherido al compromiso internacional de la eliminación de la rubéola y rubéola congénita, por tal motivo, se ha desarrollado una Guía Rápida para el Diagnóstico de Síndrome de Rubéola Congénita, lo cual nos ayudará a detectar los casos mencionados y así poder realizar actividades de prevención y control de manera más oportuna, además de dar seguimiento al caso y a los contactos (Anexo 8). Las muestras deberán venir acompañada con el Formato Único de Envío de Muestras (FREM-01) debidamente llenado, sin datos alterados o sobre escritos. Cada muestra deberá cumplir con los requisitos generales establecidos en el Instructivo para el Envío y Recepción de Muestras Foráneas. Las muestras que no cumplan con los requisitos técnicos y administrativos serán rechazadas de manera definitiva de acuerdo a los lineamientos establecidos en el Manual para la Toma, Envío y Recepción de Muestras del InDRE (REM-MA-03). 1. Criterios de aceptación: 65 Muestra de Suero, Orina, Exudado Faríngeo y Exudado nasofaríngeo que cumpla con definición operacional de caso probable de EFE. Que cumpla con días de evolución: – Suero de 0-35 días de evolución – Orina y Exudado Faríngeo de 0-5 días Muestra en buenas condiciones (no contaminada y en condiciones de refrigeración). Con Formato Único de Envío de Muestras bien requisitado con datos personales (nombre, edad, sexo, en caso de embarazo cuantas semanas gestación), dependencia que remite completos, fecha de inicio de exantema, fecha de toma y fecha de vacunación. 2. Criterios de rechazo: Se rechazaran las muestras que: No cumplan con definición operacional de EFE. No cumplan con los días de evolución requeridos. Muestras enviadas a temperatura ambiente. Formato único del InDRE incompleto (Información en criterios de aceptación). 3. Tipos de muestra Tipo de muestra Exudado Faríngeo y nasofaríngeo Orina Suero Método Medio/contenedor /forma de envío Hisopo: usar solo hisopo estéril de Tubo con medio de transporte viral con Tiempo Técnica Aislamiento viral; RT- dacrón o rayón con mango de 3.0mL plástico y flexible Enviar con refrigerantes de 4 a 8°C Secuenciación En recipiente estéril con tapón de rosca, Aislamiento viral; RT-PCR Colectar el chorro medio enviar con refrigerantes de 4 a 8°C Por venopunción en tubo sin 2.5 mL. Enviar con refrigerantes de 4 a anticoagulante 8°C 0 a 5 días de evolución 0 a 5 días de evolución PCR, rRT-PCR, , rRT-PCR, Secuenciación 0 a 35 días de evolución. En caso de segunda muestra, tomar 2 semanas ELISA después de la primera Procedimiento para la toma, manejo y envío de muestras: Muestra serológica 1. En todo caso probable de Rubéola y EFE se debe tomar una muestra de sangre completa por venopunción (aprox. 5 mililitros) sin usar anticoagulante y obtener 66 el suero (aprox. 2.5 mililitros). Pueden utilizarse los tubos al vacío con un gel especial (tipo de tubo vacutainer), que permiten la separación del suero directamente en los tubos centrifugando a 3,000 rpm por 5 minutos. El suero será enviado al LESP que cuente con el ensayo dentro de su marco analítico. Las muestras deberán enviarse en red fría de 4-8°C. Una vez recibidas las muestras en el laboratorio, se deberán alícuotar y congelar inmediatamente; dejar solo una alícuota en refrigeración (4-8 °C) para realizar el proceso de diagnóstico. El suero no debe estar hemolizado, ni lipémico, ni contaminado. 2. Es importante considerar que el criterio de tiempo evolución para diagnóstico de Rubéola y EFE obliga a tomar la muestra de suero entre el día cero y el día 35 posterior a la aparición del exantema. Aunque si se va realizar PCR en tiempo real, la muestra se debe tomar en los primeros cinco días, posterior a este periodo solo se podrá realizar serología. 3. Enviar al InDRE el 100% de las muestras positivas y el porcentaje de muestras negativas que el InDRE indique. Exudado faríngeo 1. Para obtener la muestra se debe sentar al paciente y colocar su cabeza hacia atrás para iluminar bien la cavidad orofaríngea, con un abatelenguas bajar la lengua para facilitar el acceso a la parte posterior de la orofarínge. Con un hisopo de dacrón o de rayón con mango de plástico, hacer un raspado firme girando el hisopo en las áreas dañadas, que se debe ver hiperémicas, purulentas o necróticas, así como en las membranas formadas sobre las lesiones o de las manchas de Köplik. Hay que evitar tocar la lengua, la úvula o los carrillos. Introducir el hisopo con la muestra en un tubo con tapón de rosca que contenga el medio de transporte viral. 2. La muestra de exudado faríngeo se puede refrigerar y transportar al InDRE en un lapso de 48 horas a una temperatura de 4-8°C. 3. El criterio de días de evolución obliga a tomar la muestra entre el día 0 y 5 posterior a la aparición del exantema, que corresponde al periodo de mayor carga 67 viral, incrementándose la posibilidad de realizar un diagnóstico temprano mediante rT-PCR en tiempo real y aislamiento viral. Muestra de orina 1. Se debe instruir al paciente para que deseche la primera parte de la micción y colecte 10 a 50 ml del chorro medio en un recipiente estéril de boca ancha con tapa de rosca. 2. La orina se centrifuga a 1500 rpm durante 10 minutos a 4°C, se desecha el líquido sobrenadante y el sedimento se resuspende en 2 o 3 mL de medio de transporte viral. Mezclar y hacer tres alícuotas, dos congelarlas inmediatamente a -70°C y la última utilizar para procesar RT- PCR en tiempo real de Rubéola. Si no es posible realizar el procesamiento de la muestra enviarla al InDRE en un lapso de 48 horas de 4-8°C. 3. El criterio de días de evolución obliga a tomar la muestra entre el día 0 y 5 posterior a la aparición del exantema, que corresponde al periodo de mayor carga viral, incrementándose la posibilidad de realizar diagnóstico temprano mediante rT-PCR en tiempo real y aislamiento viral. 68 Algoritmos diagnósticos: DIAGNÓSTICO DE RUBÉOLA NO EXANTEMÁTICA 69 70 71 72 Evaluación Aunque la incidencia de casos de Rubéola ha disminuido considerablemente, es importante mantener y fortalecer las acciones de vigilancia epidemiológica para cumplir con el compromiso de la eliminación de la Rubéola y Rubéola Congénita en nuestro país y en la Región de las Américas. Para la consolidación y seguimiento institucional del sistema de vigilancia de Rubéola se requiere de evaluación mensual de los indicadores nacionales e internacionales. Ante las acciones de documentación de la eliminación de Rubéola y Rubéola Congénita es necesario reforzar la actuación en dos sentidos: 1. Asegurar la calidad de la vigilancia epidemiológica, y 2. Establecer el algoritmo diagnóstico que incluya diagnóstico diferencial. Los indicadores de evaluación se enfocan por un lado a asegurar la continuidad con la calidad en la vigilancia epidemiológica, y por otro, monitorear su eliminación.. Rubeola: INDICADOR Tasa* Tasa VALOR CONSTRUCCIÓN Total de casos notificados Población estatal. MÍNIMO x 100,000 Total de casos notificados x Población estatal. 20,000 =ó>2 =ó>2 Casos probables notificados al nivel inmediato en las primeras 24 horas posteriores a su Notificación Oportuna detección x 100 = ó > 80% x 100 = ó > 80% x 100 = ó > 80% Total de casos probables notificados al sistema especial. Investigación adecuada Casos probables estudiados en las primeras 48 horas posteriores a su notificación. Total de casos probables notificados al sistema especial. Casos probables con muestra serológica tomada entre el 1° y 35° días posteriores al inicio del Muestras Adecuadas exantema. Total de casos probables con muestra notificados Detección Viral Caso Primario Envío Oportuno de Muestras Resultado Oportuno de Laboratorio Brotes con identificación de genotipo Total de brotes Casos confirmados con identifiación caso primario Total de casos confirmados de sarampión o rubéola Muestra recibidas en el laboratorio en primeros 5 días de su toma. Total de muestra notificados recibidas Resultado emitidos en los primeros 4 días posteriores a su recepción Total de muestras serológicas recibidas en el Laboratorio X 100 = ó > 80% x 100 = ó > 80% x 100 = ó > 80% x 100 = ó > 80% *Indicador Internacional. ** La muestra siempre se deberá obtener al primer contacto. 73 Rubeola congénita: INDICADOR Tasa Estudio Oportuno Confirmación por laboratorio Detección viral Monitoreo de la excreción VALOR MINIMO CONSTRUCCION Total de anual de casos probables de SRC en menores de un año Total de nacidos vivos registrados Casos probables estudiados por la JS o equivalente en las primeras 48 horas posteriores a su notificación Total de casos probables notificados al sistema especial. Número de casos probables que fueron confirmados por laboratorio Total de casos probables con muestra notificados al sistema especial. Número de casos probables con muestra adecuada de orina o exudado faringeo para detección viral Total de casos probables con muestra notificados al sistema especial. Número de casos confirmados con al menos 2 pruebas negativas para la detección o aislamiento viral, despues de los tres meses de edad, con un intervalo de 1 mes entre cada prueba. Total de casos confirmados notificados al sistema especial. x 10,000 =ó>1 x 100 = ó > 80% x 100 x 100 x 100 = ó > 80% = ó > 80% = ó > 80% ** La muestra siempre se deberá obtener al primer contacto. 74 POLIOMIELITIS Y PARÁLISIS FLÁCIDA AGUDA (PFA) La Parálisis Flácida Aguda es un síndrome clínico, caracterizado por una pérdida inmediata de la fuerza muscular de las extremidades, hasta la incapacidad total para realizar movimientos voluntarios incluyendo, aunque con menor frecuencia, debilidad de los músculos respiratorios y de la deglución, progresando a su severidad máxima en varios días o semanas por causas relacionadas con enfermedades neuromusculares de presentación aguda (menor a 5 días). La PFA, pueden ser ocasionada por diversas causas dentro de las que se encuentran: enfermedades infecciosas (bacterianas y virales), degenerativas (oncológicas), autoinmunes (distrofia muscular progresiva) e intoxicaciones (plomo, metales pesados, medicamentos, plaguicidas, Karwinskia). Dentro de este grupo de padecimientos se encuentran: la Poliomielitis, el Síndrome de Guillain-Barré, la Mielitis Transversa, algunas neuroinfecciones, lesión del nervio ciático, tumoraciones, intoxicaciones por Karwinskia y últimamente reportes de Infección por virus Zika. La Poliomielitis es una enfermedad aguda, grave, que afecta al sistema nervioso central, ocasionando parálisis flácida. Es causada por el virus de la Poliomielitis o Poliovirus de la familia Picornaviridae, del género Enterovirus. El periodo de incubación es de 7 a 14 días, con límite inferior de 5 y máximo de 35 días. El período de transmisibilidad una vez contagiado el paciente es de 7 a 10 días existiendo variaciones entre 3 a 35 días antes y después del comienzo de los síntomas. La susceptibilidad es universal, los niños menores de 5 años son más susceptibles que los adultos. Los casos leves de poliomielitis presentan fiebre, malestar general, cefalalgia, náusea y vómito. Los que evolucionan a la forma aguda y grave presentan mialgias con rigidez de cuello y espalda con parálisis flácida asimétrica, alcanzando su máximo a los tres o cuatro días. La parálisis se presenta de acuerdo a la localización de la destrucción de las células 75 en la médula espinal o en el tallo encefálico. Los miembros inferiores son afectados con mayor frecuencia más que los superiores. Es mortal si se afectan los músculos de la respiración y/o de la deglución. Durante la convalecencia hay mejoría de la parálisis, si permanece por más de 60 días, ésta será permanente. La vigilancia epidemiológica de la poliomielitis se ubica actualmente en el contexto de la vigilancia sindrómica de estos padecimientos. Situación epidemiológica Con relación a los casos de poliomielitis en las Américas cabe mencionar que en 1991 se identificó el último caso de poliovirus salvaje en el hemisferio occidental y en el año de 1994 se certificó la eliminación del poliovirus salvaje en las Américas. En México, los primeros registros de casos ocurrieron en 1937 con un promedio de casos durante esta década de 64 casos por año que se incrementaron hasta 1,200 en el periodo de 1947 a 1955. Posteriormente, con la aplicación de la vacuna tipo Salk se registraron 1,300 anuales casos hasta 1962 cuando se implementó la vacuna Sabin fecha a partir de la cual se da un franco descenso hasta el periodo 1985-1990 cuando el numero promedio de casos descendió a solo 40, hasta los últimos siete casos ocurridos en 1990, y el último de ellos en Tomatlán, Jalisco. En la década del 2000, se presentaron dos casos de poliomielitis asociados a la vacuna, en los estados de Tabasco e Hidalgo, en los años 2004 y 2006, respectivamente. Hasta la fecha no se han reportado nuevos casos. 76 Casos 2 1 1 0 0 0 0 0 1 0 0 0 0 0 0 0 0 0 0 2000 2001 2002 2003 2004 2005 2006 2007 2008 2009 2010 2011 2012 2013 2014 2015 Año Fuente: SINAVE/DGE/SS. Sistema de Vigilancia Epidemiológica de PFA. *Información preliminar a la semana 52 de 2015. Con el próposito de garantizar la vigilancia de Poliomielitis ésta se basa en el diagnóstico sindrómico de los casos de PFA. En México, en los últimos años se notifica un promedio de 550 casos con tasas por arriba de 1 por cada 100 mil habitantes que cumple durante toda la decáda con el indicador de 1 caso por cada 100 mil habitantes solicitado por la OMS. 700 600 Casos 500 400 300 200 100 0 1990 1992 1994 1996 1998 2000 2002 2004 2006 2008 2010 2012 2014 Año Fuente: SINAVE/DGE/SS. Sistema de Vigilancia Epidemiológica de PFA. *Información preliminar a la semana 52 de 2015. 77 Tasa* 2 1.8 1.6 1.4 1.2 1 0.8 0.6 0.4 0.2 0 1995 1997 1999 2001 2003 2005 2007 2009 2011 2013 2015 Año Fuente: SINAVE/DGE/SS. Sistema de Vigilancia Epidemiológica de PFA. *Por 100 mil habitantes menores de 15 años. **Información preliminar a la semana 52 de 2015. Definiciones operacionales Caso probable de PFA: todo persona que presente parálisis o paresia flácida aguda (con tono muscular disminuido o abolido), que se instala en no más de cinco días, o bien, enfermedad paralítica en una persona en la que se sospeche poliomielitis. Caso confirmado de Poliomielitis: Enfermedad paralítica aguda asociada al aislamiento de poliovirus salvaje del caso o de sus contactos, con o sin parálisis residual. Caso confirmado de Poliomielitis asociado a Vacuna: Enfermedad paralitica aguda en la cual se demuestra mediante técnicas de laboratorio que el poliovirus vacunal es la causa de la enfermedad. Caso descartado a Poliomielitis: Enfermedad paralítica aguda en la que se demuestra etiología diferente a la poliomielitis o el cuadro no es clínicamente compatible, y que tiene al menos una muestra de heces adecuadas y con resultado negativo. Caso probable de Síndrome de Guillain-Barré asociado a la infección por el virus del Zika. Todo caso de PFA que en los 21 días previos al inicio de la parálisis haya cumplido definición de caso probable de Infección por virus Zika. 78 Caso confirmado de Síndrome de Guillain-Barré asociado a la infección por el virus del Zika. Caso clasificado como SGB asociado a la infección por virus del Zika y con confirmación de laboratorio a este virus mediante la detección de ARN viral mediante RT-PCR en tiempo real. Caso descatado de Síndrome de Guillain-Barré asociado a la infección por el virus del Zika. Caso de SGB en quien se demuestre etiología diferente a la infección por virus Zika. Acciones ante casos por nivel técnico administrativo Acciones ante un caso probable de PFA: Notificar inmediatamente (en menos de 24 horas de su identificación por los servicios de salud) la totalidad de los casos a la Jurisdicción Sanitaria correspondiente. Realizar la captura del caso en el Sistema de Parálisis Flácida Águda del SINAVE. Incluir datos de identificación del caso así como los signos y síntomas descritos en las definiciones operacionales. Registro del caso en el reporte semanal de casos a través del Sistema Único Automatizado para la Vigilancia Epidemiológica (SUAVE). Realizar el estudio epidemiológico de caso de PFA y envío al nivel inmediato superior (Anexo 9). Llenar la totalidad del estudio para los casos de 0 a 14 años y requisitar solo las variables autorizadas para los de 15 y más; no llenar para este grupo de edad las variables que se encuentran marcadas en el estudio epidemiológico. Valoración neurológica detallada al inicio del padecimiento y entre 30 y 60 días de evolución (Anexo 10). Se realizarán dos valoraciones neurologicas a los casos 79 de 0 a 14 años y a los de 15 y más años solo se les realizara una valoración neurológica. A los casos de 0 a 14 años o de cualquier edad con diagnóstico clínico de poliomielitis se debe realizar una electromiografía y velocidad de conducción nerviosa a los 21 días de evolución (desde el inicio de la parálisis). Realizar, a criterio del médico tratante, los estudios clínicos de laboratorio: estudio de líquido cefalorraquídeo y gabinete para establecer un diagnóstico alternativo certero. Seguimiento del caso hasta su resolución definitiva. Integración del expediente clínico del caso. Los casos probables de 0 a 14 años deberán ser confirmados o descartados en un plazo máximo de 10 semanas posteriores al inicio de la parálisis, en tanto que los de 15 y más en un lapso de 30 días En los casos de 0 a 14 años con antecedente vacunal en los 21 días previos al inicio de la parálisis, debe recabarse información del tipo de vacuna: (SALK o SABIN), número de lote de la vacuna, personas vacunadas con el mismo lote y presencia de más casos entre las personas vacunadas conjuntamente con personal del Programa de Vacunación. En los menores de 15 años se tomará una muestra de heces al 100% de los casos durante los primeros 14 días posteriores a la fecha de inicio de la parálisis, y a contactos a criterio del epidemiólogo (casos clínicamente compatibles con poliomielitis, defunciones que no cuenten con muestra, casos de parálisis con aislamiento de virus salvaje o derivado de la vacuna, cuando se pierda el paciente y no se haya tomado muestra). En ocasiones especiales se podrá solicitar muestra para estudio histopatológico. En casos de PFA de 15 años y mayores no se tomará muestra de heces, excepto cuando presenten cuadro clínicoeídemiológico compatible con poliomielitis y no exista un diagnóstico alternativo. 80 A los casos de PFA que hayan presentado un cuadro clínico compatible de infección por virus Zika y que tengan como máximo 17 días entre el inicio de la parálisis y el antecedente de inicio de síntomas de caso probable de virus Zika se debe tomar una muestra de saliva de acuerdo a lo establecido en los procedimentos de toma de muestra de laboratorio. Acciones ante un caso confirmado de Poliomielitis: Completar el estudio epidemiológico de caso. Realizar las actividades de prevención y control correspondientes alrededor del domicilio del caso. Registrar su clasificación en forma definitiva en la Plataforma Informática de Parálisis Flácida Aguda. Seguimiento del caso durante su evolución y rehabilitación por lo menos durante un año después del inicio de la parálisis o paresia. Envío de toda la información al nivel inmediato superior en un plazo máximo de 10 semanas posteriores al inicio de la parálisis. Ante un caso confirmado de poliomielitis, el municipio donde enfermó el paciente será objeto de actividades de prevención y control específicas. Acciones ante Defunciones: Notificación inmediata de la defunción en las primeras 24 horas de conocida por los Servicios de Salud. La notificación deberá incluir los signos y síntomas descritos en las definiciones operacionales. Realizar y enviar de manera inmediata el Estudio Epidemiológico de Caso a la Jurisdicción Sanitaria o Delegación para su notificación y captura inmediata en el Sistema de Información Epidemiológica correspondiente. Personal de la unidad médica tratante deberá obtener copia del expediente clínico y enviarlo a la Jurisdicción Sanitaria correspondiente, en un periodo no mayor a 10 días hábiles posteriores a la detección de la defunción. 81 En caso de que la unidad médica no cuente con personal de vigilancia epidemiológica, el epidemiólogo jurisdiccional se hará responsable de la obtención del expediente clínico. En caso de probable poliomielitis garantizar la toma de muestra para diagnóstico, así como su envío al LESP. Asegurar la toma de muestra de contactos cuando proceda (ver criterios de toma) dentro de los primeros treinta días de la fecha de inicio de la parálisis del caso. Se deberá contar con toda la información clínica-epidemiológica, así como los resultados del LESP para la dictaminación de la defunción por el Comité Estatal en un periodo no mayor de 10 días posteriores al deceso y envío del acta correspondiente a la jurisdicción sanitaria. En las defunciones donde la clasificación final dependa del resultado de laboratorio, el periodo de tiempo para la dictaminación de la defunción se extenderá a un máximo de seis semanas. Nivel Local: Representado por las áreas aplicativas que son: Centro de Salud, Centro de Salud con Hospital y Unidades Hospitalarias. Las actividades asistenciales y de vigilancia epidemiológica llevadas a efecto por los centros de salud y las unidades hospitalarias son: Consulta médica a casos probables. Verificar que el caso cumpla la definición operacional de caso probable para establecer el diagnóstico inicial. Notificar la totalidad de los casos probables a través del “Informe Semanal de Casos Nuevos de Enfermedades” SUIVE-1 (Anexo 2). Notificar de manera inmediata a la jurisdicción sanitaria o equivalente la totalidad de los casos probables de acuerdo a lo establecido en el Proyecto de Norma Oficial Mexicana PROY-NOM-017 SSA2-2012. Participar en la investigación de brotes. 82 Referencia de los casos a unidades de segundo y tercer nivel. Toma de muestras de heces al 100% de los casos menores de 15 años y enviar a la Jurisdicción Sanitaria o equivalente. Toma de muestra de saliva a los casos de PFA que tengan como máximo 17 días entre el inicio de la parálisis y el antecedente de inicio de síntomas de caso probable de virus Zika y enviarla a la jurisdicción sanitaria. Elaborar el Estudio Epidemiológico de Caso (Anexo 9). Notificación inmediata de brotes por el medio más expedito al nivel inmediato superior en el formato de Estudio de Brote (SUIVE-3). En casos y defunciones, personal de la unidad médica tratante deberá obtener copia del expediente clínico y estudio epidemiológico y enviarlo a la Jurisdicción Sanitaria correspondiente, en un periodo no mayor a 10 días hábiles posteriores a la defunción. En caso de que la unidad médica no cuente con personal de vigilancia epidemiológica, el epidemiólogo jurisdiccional o equivalente será el responsable de la obtención del expediente clínico. Participar en la clasificación de los casos y defunciones cuando sea requerido en el seno del Comité Jurisdiccional de Vigilancia Epidemiológica. Nivel jurisdiccional o equivalente: En este nivel las funciones como instancia de enlace técnico y administrativo para la vigilancia epidemiológica son: Verificar y validar la información epidemiológica enviada por las unidades de salud. Notificar de manera inmediata los casos probables o defunciones por probable PFA al nivel estatal; dentro de las primeras 24 horas de su detección por los servicios de salud. Asegurar que la información de los estudios epidemiológicos sea completa, veraz y congruente; y asesorar a las unidades donde la información no cumpla con estas características. 83 Asegurar la captura del 100% de los casos Plataforma de PFA. Recibir y enviar al nivel estatal las muestras de heces de los menores de 15 años y de saliva de todos los casos de PFA que hayan cursado con cuadro clínico previo de probable infección por virus Zika con el Formato Único de Envío de Muestras (F-REM-01) (Anexo 22). Participar en las acciones de prevención y control. Notificación inmediata de brotes por el medio más expedito al nivel inmediato superior en el formato de Estudio de Brote (SUIVE-3). Seguimiento de los brotes hasta su resolución total. Supervisar, asesorar y apoyar en la realización de los estudios de casos, brotes y defunciones. Verificar la realización de la valoración neurológica y seguimiento del paciente hasta su clasificación final. En defunciones coordinar la clasificación final y el envío del Certificado de Defunción (Anexo 5) y el formato de “Reporte de causas de Muerte Sujetas a Vigilancia Epidemiológica” de INEGI (Anexo 6). Dictaminar todas las defunciones en el Comité Jurisdiccional en un periodo no mayor de 10 días hábiles posteriores al deceso y envío del acta correspondiente al estado. Deberá contar con toda la información clínica-epidemiológica, así como los resultados de laboratorio del InDRE. Coordinar la capacitación y adiestramiento del personal en procedimientos de vigilancia, la vigilancia hospitalaria y en la toma de muestras para su envío al LESP. Evaluar en el seno del Comité Jurisdiccional de Vigilancia de acuerdo a las funciones y atribuciones, la información epidemiológica a efecto de orientar las medidas de prevención y control. Realizar la supervisión y asesoría a las áreas operativas a efecto de identificar posibles omisiones a los procedimientos de vigilancia epidemiológica para la corrección inmediata de las mismas. 84 Realizar búsqueda activa de casos de PFA en unidades de segundo y tercer nivel que no notifiquen. Evaluar mensualmente el desempeño de los indicadores de evaluación y asegurar el cumplimiento de los mismos. Solo para los casos de 0 a 14 años. Evaluar el impacto de las acciones de prevención y control. Gestionar los recursos necesarios para las actividades de vigilancia epidemiológica. Elaborar y difundir avisos y alertas epidemiológicas en el ámbito jurisdiccional que deben ser validadas por el nivel estatal y nacional. Difudir los avisos y alertas epidemiológicas elaboradas por por los comités de vigilancia epidemiológica. Mantener actualizado el panorama epidemiológico en los diversos municipios de la Jurisdicción Sanitaria. Difundir la información epidemiológica a las instancias correpondientes para la toma de decisiones. Nivel estatal: De acuerdo con su función normativa y de línea jerárquica: Concentrar, verificar y validar la información enviada por las jurisdicciones. Evaluar la calidad de la información. Recibir, concentrar, analizar y difundir la información epidemiológica. Notificar inmediatamente los casos y defunciones probables a la DGE. Concentrar semanalmente la información del componente de Información Semanal de Casos enviada por las unidades de salud y envío a la DGE. Validar y notificar inmediatamente a la DGE los brotes por el medio más expedito en el formato de Estudio de Brote (SUIVE-3). Supervisar, asesorar y apoyar en la realización de los estudios de caso, brote y defunciones. Coordinar la capacitación del personal en procedimientos de vigilancia epidemiológica de PFA. 85 Evaluar en el seno del Comité Estatal de Vigilancia Epidemiológica (CEVE) de acuerdo a las funciones y atribuciones establecidas en el Acuerdo Secretarial 130, la información epidemiológica a efecto de orientar las medidas de prevención y control. Realizar la supervisión y asesoría a las áreas operativas a efecto de identificar posibles omisiones a los procedimientos de vigilancia epidemiológica para la corrección inmediata de las mismas. En defunciones coordinar la casificación final con envío de la dictaminación del Comité Estatal, el Certificado de Defunción (Anexo 5) y el formato de “Reporte de causas de Muerte Sujetas a Vigilancia Epidemiológica” de INEGI (Anexo 6) a la DGE. La dictaminación de los casos deberá estar encaminada a ratificar o descartar los casos o defunciones a poliomielitis. En caso de descartar el diagnóstico de poliomielitis, se deberá consignar el diagnóstico final del descarte. Dictaminar todas las defunciones en el Comité Jurisdiccional en un periodo no mayor de 10 días posteriores al deceso y envío del acta correspondiente a la DGAE. Deber contar con toda la información clínica-epidemiológica, así como los resultados de laboratorio de la Red validada por el InDRE. Toda defunción en la cual no haya sido tomada muestra para diagnóstico de laboratorio deberá ser dictaminada mediante criterios clínico–epidemiológicos por el Comité Estatal y el CONAVE. Envío del Certificado de Defunción (Anexo 5) y el formato de “Reporte de causas de Muerte Sujetas a Vigilancia Epidemiológica” de INEGI (Anexo 6) en periodo no mayor de cuatro semanas a la DGE, donde se realiza la ratificación o rectificación de la defunción dictaminada por el Comité Estatal de Vigilancia Epidemiológica. Evaluar mensualmente el desempeño de los indicadores de evaluación y asegurar el cumplimiento de los mismos. Evaluar el impacto de las acciones de prevención y control. Gestionar los recursos necesarios para las actividades de vigilancia epidemiológica. 86 Elaborar y difundir los avisos o alertas epidemiológicas en el ámbito estatal que deben contar con la validación del Comité Nacional. Difundir los avisos o alertas epidemiológicas a todos los niveles técnicoadministrativos bajo su responsabilidad. Emitir recomendaciones basadas en el análisis de la información epidemiológica que oriente las acciones de control. Mantener actualizado el panorama epidemiológico. Difundir la información epidemiológica que oriente la toma de decisiones. Nivel nacional: Normar o actualizar los procedimientos para la vigilancia epidemiológica. Verificar y validar la información enviada por los estados. Asesorar, supervisar y evaluar las actividades de vigilancia epidemiológica en todos los niveles operativos. Coordinar la capacitación y asesorar al personal de salud en materia de vigilancia epidemiológica. Validar la información epidemiológica capturada en la Plataforma de PFA. Analizar y difundir la información epidemiológica nacional. Fortalecer la coordinación con el InDRE con el fin de obtener resultados en forma oportuna para la confirmación o descarte de los casos. Supervisar, asesorar y evaluar el sistema de vigilancia epidemiológica. Elaborar informes periódicos sobre la situación de PFA en el país y los estados. Participar en estudios e investigaciones especiales. Fortalecer la coordinación interinstitucional mediante reuniones con el CONAVE con el propósito de analizar la situación epidemiológica a nivel nacional, reorientando las acciones de manera permanente. Coordinar las reuniones con el Comité Nacional de Expertos para la dictaminación de los casos o defunciones según la información epidemiológica, clínica y de laboratorio. 87 La dictaminación de los casos y defunciones deberá estar encaminada a ratificar o rectificar el diagnóstico de poliomielitis. Para los casos la rectificación deberá en el sistema de información correspondiente. Para las defunciones la rectificación se realizará a través del formato “Reporte de causas de Muerte Sujetas a Vigilancia Epidemiológica” de INEGI (Anexo 6). Las defunciones en las cuales no exista acuerdo en la dictaminación realizada por los comités estatales, serán dictaminadas por el Comité de Expertos con presencia del epidemiólogo estatal y el médico tratante, y se informará a los servicios de salud, el dictamen final que se ingresará a los registros oficiales. Evaluar el impacto de las acciones de control. Evaluar mensualmente el desempeño de los indicadores de evaluación y asegurar el cumplimiento de los mismos. Elaborar avisos o alertas epidemiológicas sobre situaciones de riesgo para su envío a los comités y unidades de vigilancia epidemiológica. Emitir recomendaciones basadas en el análisis de la información epidemiológica que oriente las acciones de control. Mantener actualizado el panorama epidemiológico. Vigilancia epidemiológica de las complicaciones asociadas a la infección por virus Zika Síndrome de Guillain-Barré Identificar los casos de PFA que hayan presentado previamente un cuadro clínico que cumpla la definición operacional de caso probable de infección por virus Zika. A los casos de PFA con cuadro previo de infección por virus Zika a los que no se haya tomado muestra de sangre y que hayan presentado la parálisis dentro de 17 días posteriores al inicio de los síntomas por virus Zika, se debe tomar una 88 muestra de saliva de acuerdo a lo establecido en los procedimentos de toma de muestra de laboratorio. Enviar la muestra de saliva a la jurisdicción sanitaria y de ésta al laboratorio estatal de salud pública. Identificar los casos de PFA clasificados como síndrome de Guillain Barré. Procesar las muestras para virus Zika de los casos de PFA que hayan presentado la parálisis dentro de 17 días posteriores al inicio de los síntomas por virus Zika Recabar el resultado de laboratorio de los casos . Clasificar la asociación de SGB e infección por virus Zika, de acuerdo a los siguientes criterios: Clasificación de Asociación de Casos de Síndrome de Guillain-Barré con ZIKV Resultado ZIKV Sindrome de Guillain-Barré Clasificación Caso confirmado a ZIKV Confirmado a SGB Caso de SGB confirmado a ZIKV Caso confirmado a ZIKV Descartado a SGB Caso descartado a SGB Caso negativo a ZIKV Confirmado a SGB Caso de SGB descartado a ZIKV Caso negativo a ZIKV Descartado a SGB Caso descartado a SGB Caso sin muestra con Confirmado a SGB antecedente de cuadro clínico de ZIKV Caso de SGB asociado a ZIKV Caso sin muestra con Descartado a SGB antecedente de cuadro clínico de ZIKV Caso descartado a SGB 89 Algoritmo de Vigilancia Epidemiológica de PFA Caso probable PFA Menores 15 años Igual o Mayor 15 años Estudio de caso Estudio de caso Notificación inmediata Notificación inmediata Toma de muestra heces Valoración neurológica Valoración neurológica Fin Acciones de Control Clasificación Algoritmo de Casos de Síndrome de Guillain-Barré e Infección por Virus Zika Caso de PFA Antecedente de Infección por Virus Zika Sí No Caso de SGB no asociado a ZIKV NO Diesisiete o menos días de inicio de síntomas de Zika e inicio de parálisis Sí Toma de muestra de saliva y procesamiento para ZIKV Caso de SGB asociado a ZIKV Negativo Caso de SGB Descartado a ZIKV Positivo Caso de SGB confirmado a ZIKV 90 Procedimientos de laboratorio El Laboratorio de Poliovirus del Instituto de Diagnóstico y Referencia Epidemiológicas (InDRE) participa en la vigilancia epidemiológica de la poliomielitis, mediante: 1. Aislamiento y tipificación de los serotipos de virus de la poliomielitis y otros enterovirus paralitogénicos, así como la diferenciación entre tipos vacunal, salvaje y virus derivado de vacuna (VDPV) de los poliovirus así como la secuenciación a través de los CDC de Atlanta. Próximamente se dispondrá de metodologías para el monitoreo ambiental de polio y otros enterovirus. 2. Titulación de anticuerpos, diagnóstico serológico del tipo viral, seroconversión a vacunas y determinación del estado inmunológico. Para ello se requieren muestras idóneas. Salvo situaciones especiales, se usará el servicio especializado de mensajería (con cargo a la DGAE), inmediatamente que hayan sido enviadas las muestras por cualquier vía, se llamará por teléfono al InDRE, a cualquiera de los siguientes números: 50 62 16 00 (Conmutador), Recepción de muestras, extensión 59340,59386 Laboratorio de Poliovirus, extensión 59590,59569 Dirección, 50 62 16 00 o en las extensiones: Cisco (Red): 59301, 59302 y 59303. Se deberá indicar el medio de transporte, la hora de entrega a la compañía transportadora, hora probable de llegada y el número de guía. El remitente deberá verificar la llegada y condiciones de las muestras 24 a 48 horas después de haber sido enviadas. Los casos probables no deberán ser vacunados hasta que se haya concluido el estudio y se tenga el diagnóstico definitivo; los contactos no recibirán la vacuna hasta la obtención de las muestras correspondientes. 91 Los resultados de los estudios realizados se envían a quien remitió las muestras, quien deberá informar a los distintos niveles e instituciones en el estado. Pruebas diagnósticas: El cultivo del virus de las muestras de heces, tanto de los casos de PFA como de sus contactos, es el método más sensible y eficaz para descartar la transmisión del poliovirus salvaje o del virus derivado de vacuna (Anexo 5). Es imprescindible obtener una muestra de heces del caso en los 14 días siguientes al inicio de la parálisis, y muestras de cinco contactos como mínimo, si hay indicación epidemiológica para tomarlas, a fin de confirmar la poliomielitis. Para fines de la vigilancia de las PFA solo está recomendada la toma de una muestra de heces del caso tan pronto como se decida que se trata de un caso probable. Heces. El virus por lo general se detecta en las heces dentro de un período de 72 horas a seis semanas posteriores a la infección; la detección es más probable dentro de las dos primeras semanas después de iniciada la parálisis. Líquido cefalorraquídeo (LCR). Es improbable que se detecte el virus, por lo tanto, no se recomienda obtener muestras. Garganta. Es improbable que se detecte el virus, por lo tanto, no se recomienda obtener muestras. Sangre. Es improbable que se detecte el virus, y con las pruebas serológicas actuales no se puede distinguir entre las cepas salvajes del virus y las de la vacuna. Se sabe por experiencia que, en los casos de poliomielitis, con frecuencia suele ser engañosa la interpretación de los datos serológicos. Por lo tanto, no se recomienda obtener muestras de sangre. Suero: Es improbable que se detecte el virus, y con las pruebas serológicas actuales no se puede distinguir entre las cepas salvajes del virus y las de la vacuna, solo en caso de defunción para la detección de anticuerpos contra poliovirus. 92 En caso de muerte de un caso probable, se puede confirmar o descartar el diagnóstico definitivo de poliomielitis mediante un examen de la médula espinal. Es importante que el examen lo realice un patólogo competente y experimentado, y que se envíe una muestra directamente al laboratorio de poliovirus del InDRE para que allí se realice el aislamiento del virus de la poliomielitis. Caso probable: Debe obtenerse UNA muestra de heces tan pronto como sea posible y siempre antes de los 14 días siguientes al inicio de la parálisis. Caso probable que fallece: Debe obtenerse muestras del contenido intestinal o de las heces ya formadas; también pueden tomarse muestras de tejidos (bulbo raquídeo, médula espinal) y de suero lo más pronto posible después de la defunción. Las muestras se enviarán al laboratorio donde se realizará el cultivo, la prueba de reacción en cadena de la polimerasa (RCP) y un análisis histopatológico. Asimismo, es necesario obtener un segmento del nervio de la extremidad afectada. Contactos: Si existe indicación específica del epidemiólogo se obtendrán muestras de heces de cinco o más contactos en las siguientes circunstancias: – En contactos menores de 5 años familiares y no familiares de un caso probable de parálisis flácida aguda que no hayan recibido la vacuna oral contra la poliomielitis en los 30 días precedentes. – En contactos menores de 5 años familiares y no familiares de un caso confirmado de poliomielitis importado nacional o extranjero, proveniente de cualquier región del mundo, con cuadro clínico de poliomielitis y con aislamiento de poliovirus salvaje de cualquier serotipo. – En contactos menores de 5 años familiares y no familiares de un caso probable de parálisis flácida aguda nacional o extranjero con aislamiento de poliovirus derivado de la vacuna de cualquier serotipo. – En contactos menores de 5 años familiares y no familiares de un caso probable de parálisis flácida aguda quién hubiese fallecido y que no cuente con muestra de heces. 93 – En contactos menores de 5 años familiares y no familiares de un caso probable de parálisis flácida aguda en quién se sospeche clínicamente de poliomielitis y no exista ningún diagnóstico clínico alternativo. – En contactos menores de 5 años familiares y no familiares de un caso probable de parálisis flácida aguda que se pierda durante su seguimiento que no cuente con muestra de heces. – En contactos menores de 5 años familiares y no familiares de un caso probable de PFA que sea un menor de 5 años, que presente una parálisis flácida aguda asimétrica y que presente fiebre y mialgias al inicio de la parálisis y que no cuente con un diagnóstico alternativo ni muestra de heces. Muestras para aislamiento y tipificación del virus: Colectar una muestra de materia fecal del caso y de cinco contactos menores de cinco años, que no hayan sido vacunados en los últimos 30 días. Procedimiento para la toma, manejo y envió de muestras: 1. Se colectan de 5 a 10 gramos de heces ( si el paciente no puede evacuar, tomar hisopo rectal manchado en 1 ml de solución salina fisiológica en tubo de plástico y tapón de rosca) dentro de los primeros catorce días de haber iniciado la parálisis. Debe utilizarse envases de plástico con tapa de rosca y de boca ancha. Mantener la red fría desde la toma de muestra hasta que llega al laboratorio del InDRE (de 0 a 10ºC). 2. Todas las muestras, independientemente de la institución que maneje al caso, serán entregadas a la Jurisdicción Sanitaria correspondiente o al Departamento de Epidemiología Estatal, quienes se encargarán de su envío. 3. El envío de las muestras deberá ser inmediato; en circunstancias especiales, se podrá esperar hasta cinco días después de tomadas (por ejemplo si un epidemiólogo acudiera a investigar el caso o en fin de semana). En esta situación las muestras para aislamiento (heces) deberán mantenerse en congelación y los sueros en refrigeración. 4. Las muestras se trasladarán en cajas térmicas bien selladas, cajas de aislamiento preferiblemente congeladas o con paquetes congelados de conservación; siempre 94 que sea posible se utilizará hielo seco. Se colocarán en bolsas de plástico opacas que las protejan de la luz y anudadas con ligas. Cada envase con muestras deberá ser identificado claramente, indicando nombre, fecha de toma, institución remitente y en caso de muestra de contacto, nombre del caso al que pertenece. 5. De las muestras de autopsia, una parte deberá enviarse al laboratorio de poliovirus del InDRE, para intentar el aislamiento viral. Estas se enviarán inmediatamente después de su recolección, en solución fisiológica y no deberán manejarse con conservadores o preservativos (alcohol, formol, acetona, etc.). La otra parte se enviará al servicio de histopatología de la unidad tratante y deberá ir contenida en un envase con formol al 10%. IMPORTANTE: En todo caso probable es obligatoria la toma y envío de muestras al Laboratorio de Poliovirus del InDRE. Deberá concluirse el estudio con el envío completo de muestras, aún si fuera descartado, ya que la poliomielitis puede ser causa de cuadros atípicos de parálisis. Los casos en estudio no deberán ser vacunados hasta concluir los estudios de laboratorio. Criterios de aceptación de muestra: La muestra de materia fecal ó hisopo rectal (diarreica, pastosa o formada) debe ser reciente( menos de 24 horas). Criterios de rechazo de muestras: Las heces obtenidas del suelo, excusado o pañal no son aceptadas por la contaminación ambiental a que fueron expuestas. Segundas muestras Muestras de mayores de 15 años Muestras de contactos sin evidencia de estudio epidemiológico. Las muestras enviadas en frascos de vidrio serán rechazadas. Muestras de suero, sangre, LCR e hisopo rectal en Medio Cary Blair. 95 ALGORITMO DIAGNÓSTICO: 96 97 Para la vigilancia de casos de Síndrome de Guillain-Barré asociados con infecciones por ZIKV mediante asociación epidemiológica y sin toma de muestra en fase aguda, la muestra de interés deberá ser la saliva, bajo las siguientes especificaciones: Tipo de muestra . Método Medio/Contened or/ Forma de envío Tiempo de la toma Saliva Toma de saliva 1.0 mL, Solo tomar a almacenado en casos que contenedor de tengan como plástico estéril máximo 17 debidamente días entre el identificado, inicio de la enviado en parálisis y el estricta red fría (0- antecedente 10°C) de inicio de síntomas de casos probable de virus Zika Técnica Estándar de servicio RT-PCR en tiempo real. 3 días hábiles NOTA: La extracción de ARN a partir de saliva se realiza de la misma manera, siguiendo los protocolos automatizados o manuales para detección de arbovirus. Evaluación La evaluación de los indicadores descritos a continuación permitirá medir los avances e identificar las áreas de oportunidad para mejorar el desempeño; es decir, permitirá detectar los puntos críticos e implementar con oportunidad las acciones que se requieran para asegurar una vigilancia epidemiológica efectiva que contribuya al logro de los objetivos del Programa. Dichos indicadores se sujetan a los compromisos nacionales e internacionales, definidos para PFA y su evaluación será responsabilidad de las áreas de vigilancia epidemiológica en todos los niveles, la cual debe realizarse mensualmente o con mayor frecuencia si la situación epidemiológica lo requiere. 98 La evaluación debe hacerse en forma integral (Sector Salud) y desglosada por Institución en cada uno de los niveles técnico-administrativos: Nivel Jurisdiccional: jurisdiccional y por municipio. Nivel estatal: estatal y por jurisdicción. Nivel federal: nacional y por estado. Indicadores de vigilancia epidemiológica: Para los casos de PFA de menores de 15 años, se deberá realizar la evaluación del sistema mediante los siguientes indicadores: INDICADOR Tasa de notificación* Estudio Oportuno Clasificación Oportuna Muestra Adecuada Casos de PFA con antecedente de cuadro de infección por virus Zika VALOR MINIMO CONSTRUCCION Casos de PFA de <15 años de las últimas 52 semanas acumuladas hasta la semana que se evalúa Promedio de la población <15 años de los 2 últimos años Casos de PFA en <15 años estudiados por la jurisdicción sanitaria en los primeros 2 días posteriores a la fecha de notificación a la jurisdicción sanitaria o equivalente, acumulados hasta la semana que se evalúa Total de casos de PFA en <15 años de las últimas 52 semanas acumuladas hasta la semana que se evalúa Casos de PFA de <15 años con 2da valoracion neurológica antes de 70 días posteriores entre la fecha de inicio de la parálisis y la fecha de la 2da valoración neurológica acumulados hasta 10 semanas antes de la semana que se evalúa Total de casos de PFA en <15 años del año en curso acumulados hasta 10 semanas antes de la semana que se evalúa Casos de PFA de <15 años de las últimas 52 semanas con una muestra de heces tomada en los primeros 14 días posteriores al inicio de la parálisis Total de casos de PFA <15 años de las últimas 52 semanas acumuladas hasta la semana que se evalúa Total de casos de PFA con antecedente de infección por ZIKV con toma muestra de saliva que estén dentro de los 17 días entre el inicio de parálisis y la fecha de inicio de cuadro de ZIKV Total de casos de SGB con antecedente de infección por ZIKV detectados dentro de los 17 días entre el inicio de parálisis y fecha de inicio de cuadro de ZIKV x 100,000 =ó>1 x 100 =ó>1 x 100 =ó> 80% x 100 =ó> 80% X 100 80% *Indicador Internacional. ** La muestra siempre se deberá obtener al primer contacto. De los indicadores referidos en los rubros anteriores, se consideran dentro de Caminando a la Excelencia los siguientes: Indicador de Tasa de notificación: Indicador internacional que evalúa la notificación de casos de manera anualizada, tomando en cuenta las últimas 52 semanas epidemiológicas, donde cada entidad debe reportar al menos un caso de PFA por cada 100,000 habitantes menores de 15 años, lo que indica la sensibilidad del sistema para detectar casos. 99 Indicador de clasificación final oportuna: Este indicador mide el periodo de tiempo en que el caso cuenta con una clasificación final de confirmado o descartado, así como el diagnóstico final, por ello es indispensable la clasificación final oportuna de cada caso probable dentro de las primeras 10 semanas de iniciada la parálisis. Indicador de Muestras adecuadas: El laboratorio es un elemento de la vigilancia epidemiológica que mide la especificidad del sistema. Para ello se debe tomar una muestra de heces dentro de los primeros 14 días de iniciada la parálisis. Este periodo es donde se considera de mayor excreción de poliovirus. 100 TOS FERINA Y SÍNDROME COQUELUCHOIDE La tos ferina o pertussis es una enfermedad infecciosa aguda de las vías respiratorias, también conocida como “ tos quintosa, canto de gallo o whooping cougth”, producida por la Bordetella pertussis (B. pertussis), es un cocobacilo gram negativo y su localización se restringe a los cilios de nasofarínge, tráquea, bronquios y bronquiolos del ser humano quien es el único reservorio y transmisor de la bacteria para el desarrollo de la enfermedad. Es altamente contagiosa, endémica en cualquier época del año y de distribución mundial, afecta del 80 al 90 % de las personas no inmunizadas especialmente en niños, donde es muy común y principalmente en los menores de 1 año de edad. La tos ferina se adquiere por contacto directo con secreciones mucosas de las vías respiratorias de las personas infectadas, probablemente en las gotitas arrojadas al aire. Tiene un periodo de incubación de 6 a 20 días, el cuadro clínico dura de seis a ocho semanas y se identifican tres períodos o fases en el cuadro clásico: Catarral: con duración de una a dos semanas, de inicio insidioso con catarro y tos irritante, es el periodo de máxima transmisibilidad de la enfermedad, Paroxística: dura de cuatro a seis semanas, aquí disminuye la transmisibilidad, se presenta un aumento progresivo en las crisis de tos intensa que evoluciona a paroxismos con accesos repetidos y violentos seguidos de un estridor inspiratorio de tono alto y característico de la enfermedad, durante los paroximos puede presentarse cianosis y vómito postusígeno. En esta fase por lo general no hay fiebre, salvo que aparezcan complicaciones. Convalecencia: puede durar varias semanas o meses, a pesar de continuar la tos, los enfermos ya no son contagiosos en este periodo. El término de síndrome coqueluchoide se ha empleado para denotar los signos y síntomas indistinguibles de la tos ferina, cuando no se puede demostrar la presencia de Bordetella pertussis o parapertussis, al mismo tiempo que se sospecha de una infección por otras causas. En este sentido el sistema de vigilancia pretende alcanzar una mayor sensibilidad en el diagnóstico clínico para detectar casos de tos ferina que de manera 101 subclínica puedan encubrirse para su estudio en otros diagnósticos clínicos como; bronquiolitis, bronquitis, neumonía, bronconeumonía, laringotraqueítis, laringotraqueobronquitis, menos frecuente asma bronquial y cuerpos extraños. Por ello deben utilizarse las definiciones operacionales de caso, suspicacia y criterio medico para la detección e inicio del estudio epidemiológico de los casos. La baja sensibilidad en la sospecha diagnóstica por los médicos, enfermeras, personal en formación del área de la salud, así como de la población en general, es causa principal de subregistro en casos de tos ferina, ya que este padecimiento es considerado como exclusivo de la infancia, y de manera errónea erradicado. Es prioritario trabajar en la difusión del conocimiento del padecimiento en la comunidad médica, ramas afines y población en general, además de las medidas de prevención y control. Situación Epidemiológica La OMS/OPS/CDC de Atlanta, dan evidencia de que altas cargas de tos ferina son causa de mayor morbilidad y mortalidad durante la infancia. Anualmente se estima que hay a nivel mundial de 20 a 50 millones de casos y de 200 a 400 mil muertes, el 90% de ellas en países en desarrollo, donde la tasa de letalidad puede llegar hasta un 4% en los menores de 12 meses. En las américas, la OPS estima la ocurrencia anual de 20 a 30 mil casos mostrando un incremento a partir del 2007. Es importante señalar que grandes brotes y epidemias de tos ferina se presentan en ciclos de cada 3 a 4 años. El ocurrido en el 2009 en países como Argentina, Chile, Colombia, Panamá, México, Estados Unidos de América, reportaron un aumento de 50 al 100% de casos de tos ferina que comúnmente registraban anualmente. Estados Unidos de América ha reportado más de 15 mil casos de tos ferina en los años 2011 y 2012 respectivamente. En México la tendencia de tos ferina durante la década de los 90´s presentó variaciones importantes a expensas de la dificultad para para el diagnóstico por el laboratorio y por el subregistro en la notificación. Durante el periodo 2000 al 2009 la tendencia del 102 síndrome coqueluchoide fue ascendente, debido a un aumento en la sensibilidad de la vigilancia epidemiológica y por brotes detectados, registrándose 258 casos en el año 2000 y 1796 casos para el año 2009, que equivale a una incidencia de 1.7 por 100 mil habitantes. La incidencia de Tos ferina durante el mismo período ha registrado un incremento importante, esto debido a la confirmación de casos solo por criterio clínico (casos sin muestra, número insuficiente de contactos estudiados, clasificación extemporánea) que representan el 50% del total de los casos de tos ferina, así como por el brote ocurrido en el año 2009. En el año 2000 se confirmaron 53 casos de tosferina y 579 casos en el 2009, con una tasa de incidencia nacional de 0.5 por 100 000 habitantes. El brote afectó principalmente a los estados de Nuevo León, Sonora, Tamaulipas, Jalisco, Durango, Chihuahua y Chiapas, y el grupo de edad más afectado fueron los menores de un año de edad en un 85 %. El diagnóstico de tos ferina por laboratorio se basa principalmente en el cultivo, pero dada la limitación para el aislamiento de B. pertussis, se esta utilizando paulatinamente en algunas entidades federativas a partir del año 2011, la Técnica de PCR en Tiempo Real, lo cual garantizara una mayor especificidad que se verá reflejada en la incremento de casos confirmados. Uno de los objetivos para el diagnóstico por laboratorio en B. pertussis es la transferencia de tecnología utilizando el PCR-Tiempo Real a nivel nacional y continuar con investigación por serología. Figura 1, 2. Figura 1. Casos de Síndrome Coqueluchoide y Tosferina, México, 1994-2011 Síndrome Coqueluchoide 2011 2010 2009 2008 2007 2006 2005 2004 2003 2002 2001 2000 1999 1998 1997 1996 1995 Tos ferina 1994 C A S O S 2600 2400 2200 2000 1800 1600 1400 1200 1000 800 600 400 200 0 Fuente: Sistema Nacional de Vigilancia Epidemiológica. Dirección General de Epidemiología. SSA. ** Por 100 mil habitantes Figura 2.Casos e incidencia de Tos ferina, México, 2000-2011 600 os Tos ferian 500 0.6 CASOS INCIDENCIA 0.5 0.4 400 0.3 300 200 0.2 103 Incidencia 700 Fuente: Sistema Nacional de Vigilancia Epidemiológica. Dirección General de Epidemiología. SSA. ** Por 100 mil habitantes Definiciones operacionales Caso sospechoso de tos ferina: Persona de cualquier edad con tos, sin importar los días de duración y con asociación epidemiológica (AE) con otro caso probable, confirmado o atípico. Caso probable de tos ferina: Persona de cualquier edad con tos de 14 o más días de evolución y tener dos o más de las siguientes características: o Tos paroxística o Tos en accesos o Tos espasmódica o Tos seguida de estridor laríngeo inspiratorio ("whoop o grito de gallo") Y, uno o más de los siguientes elementos: o Tos cianozante o Emetizante o Episodios de apnea o cianosis o Datos de hemorragia (conjuntival, petequias, epistaxis) o Biometría hemática con leucocitosis (más de 20,000) con predominio de linfocitos (60-80%) o Fiebre o Haber estado en contacto con casos similares en las últimas 2 a 4 semanas previas al inicio del padecimiento. IMPORTANTE: En esta definición se incluyen a los MENORES de tres meses, que 104 pueden presentar cianosis con o sin episodios de apnea, con o sin tos y se ingresaran al estudio. Caso confirmado de tos ferina: Todo caso probable con uno o más de los siguientes criterios: o Cultivo positivo a B. pertussis, o Técnica de PCR positivo a B. pertussis o Resultado positivo por ELlSA o Cultivo o PCR positivo a B. pertussis en conviviente o contacto con asociación epidemiológica (no necesariamente casos). o Asociación epidemiológica cuando el caso tenga con otro confirmado por laboratorio a B. pertussis. Caso de tos ferina clínica: Todo caso probable: o Con resultado negativo a B. pertussis y que no cumpla con el mínimo de 5 contactos con exudado nasofaríngeo con resultado negativo a B. pertussis. o Sin muestra de exudado nasofaríngeo para cultivo o PCR, aun cuando tenga sus cinco contactos negativos a B. pertussis. o En el que no se logra identificar la etiología pero hay datos sugestivos cómo aumento en la cuenta leucocitaria, anticuerpos específicos, factores epidemiológicos o ausencia de vacunación con anti pertussis. o Que fallece o se pierde durante su seguimiento y del cual no se dispone de estudios de laboratorio. o Con diagnóstico médico de tos ferina, pertussis o síndrome coqueluchoide y sin estudios de laboratorio. Caso de tos ferina atípico: Todo caso sospechoso, pero, con signos de enfermedad respiratoria leve, ocasional o esporádica y con resultado de cultivo o PCR positivo a B. pertussis. Portador asintomático de B. pertussis: Toda persona sin signos o síntomas de enfermedad respiratoria a quien se tomaron muestras por estar asociado epidemiológicamente con un caso probable o confirmado y cuyos resultados de cultivo o PCR son positivos para B. pertussis. 105 Caso descartado de tos ferina: Todo caso probable que su muestra y mínimo cinco contactos o convivientes son negativas a B. pertussis, quedará clasificado como síndrome coqueluchoide. Acciones ante caso por nivel técnico administrativo Nivel Local: Representado por las áreas aplicativas que son: Centro de Salud, Centro de Salud con Hospital y Unidades Hospitalarias. Las actividades asistenciales y de vigilancia epidemiológica llevadas a efecto por los centros de salud y las unidades hospitalarias son: Consulta médica a casos sospechosos y probables. Los casos sospechoso, no se notifica a menos que durante su evolución pase a otra categoría. Verificar que el caso cumpla la definición operacional de caso probable para establecer el diagnóstico inicial. Notificación de los casos a la Jurisdicción Sanitaria dentro de las primeras 24 horas de su conocimiento. Notificar la totalidad de los casos probables a través del “Informe Semanal de Casos Nuevos de Enfermedades” SUIVE-1 (Anexo 2), a la Jurisdicción Sanitaria. Elaborar el Estudio epidemiológico de caso de Síndrome coqueluchoide (Anexo 11) y enviarlo a la Jurisdicción Sanitaria dentro de las primeras 48 horas para su captura en el sistema correspondiente, de contar con el sistema informático, capturarlo en la misma unidad. Contar con el 100% de los estudios epidemiológicos. Notificación inmediata de brotes por el medio más expedito al nivel inmediato superior en el formato de Estudio de Brote (SUIVE-3). Participar en la investigación de brotes. En caso de defunción, personal de la unidad médica tratante deberá obtener copia del expediente y resumen clínico, y enviarlo a la Jurisdicción Sanitaria correspondiente, en un periodo no mayor a 10 días hábiles posteriores a la 106 detección de la defunción. En caso de que la unidad médica no cuente con personal de vigilancia epidemiológica, el epidemiólogo jurisdiccional será el responsable de la obtención del expediente clínico. Toma de muestras al 100% de los casos y enviar a la Jurisdicción Sanitaria. Coordinarse con el nivel jurisdiccional para tomar muestra minímo a cinco contactos. Refererir los casos que lo ameriten a unidades de segundo y tercer nivel de atención. Recopilar y enviar los documentos e información epidemiológica para dictaminación de los casos o defunciones según la información epidemiológica, clínica y de laboratorio. Participar en la clasificación de los casos y defunciones en el seno del Comité Jurisdiccional de Vigilancia Epidemiológica. Nivel jurisdiccional o equivalente: En este nivel las funciones como instancia de enlace técnico y administrativo para la vigilancia epidemiológica son: Verificar y validar la información enviada por las unidades de salud. Captar de manera inmediata la totalidad de los estudios epidemiológicos. Notificación al nivel estatal dentro de las primeras 24 horas del conocimiento del caso. Asegurar la captura del 100% de los casos en la base de datos programa EPI-INFO o en sistema de información correspondiente. Recibir la muestra del caso con el estudio epidemiológico y remitirlas al laboratorio con copia de estudio correspondiente (si es necesario tomar la muestra al caso). Coordinar la toma de muestras a los cinco o más contactos del caso y asegurar el envío al laboratorio estatal. Notificación inmediata de brotes por el medio más expedito al nivel inmediato superior en el formato de Estudio de Brote (SUIVE-3). Seguimiento de los brotes hasta su resolución total. Participar en las acciones de prevención y control. 107 Participar en la capacitación del personal en procedimientos de vigilancia y en la toma de muestras para su envío al LESP. Supervisar, asesorar y apoyar en la realización de los estudios de caso y defunciones. Notificar inmediatamente los casos o defunciones (en las primeras 24 de su conocimiento por los servicios de salud) al nivel estatal. Recopilar y enviar los documentos e información epidemiológica para dictaminación de los casos o defunciones según la información epidemiológica, clínica y de laboratorio. Ante ocurrencia de defunciones coordinar la clasificación final y el envío del Certificado de Defunción (Anexo 5) y el formato de “Reporte de causas de Muerte Sujetas a Vigilancia Epidemiológica” de INEGI (Anexo 6). Dictaminar todas las defunciones en el Comité Jurisdiccional en un periodo no mayor de 10 días posteriores al deceso y envío del acta correspondiente al estado. Deberá contar con toda la información clínica-epidemiológica, así como los resultados de laboratorio del InDRE. Evaluar en el seno del Comité Jurisdiccional de Vigilancia de acuerdo a las funciones y atribuciones, la información epidemiológica a efecto de orientar las medidas de prevención y control. Realizar la supervisión y asesoría a las áreas operativas para verificar el cumplimiento de los procedimientos de vigilancia epidemiológica. Evaluar mensualmente el desempeño de los indicadores por institución y asegurar el cumplimiento de los mismos. Evaluar el impacto de las acciones de prevención y control. Gestionar los recursos necesarios para las actividades de vigilancia epidemiológica. Coordinarse con el programa de vacunación para intercambio de información y aplicación de medidas de control ante casos y brotes. Elaborar y difundir avisos y alertas epidemiológicas en el ámbito jurisdiccional. 108 Difudir los avisos y alertas epidemiológicas elaboradas por el Comité Estatal o Nacional de Vigilancia Epidemiológica. Difundir la información epidemiológica a las instancias correspondientes para la toma de decisiones. Mantener actualizado el panorama epidemiológico en los diversos municipios de la Jurisdicción Sanitaria. Nivel estatal: De acuerdo con su función normativa y de línea jerárquica: Concentrar, verificar y validar la información enviada por las jurisdicciones. Evaluar la calidad de la información. Notificar inmediatamente los casos probables a la DGAE. Concentrar la información del componente de Información Semanal de Casos enviada por las unidades de salud y envío a la DGAE. Actualizar la base de datos de casos de Tos ferina en el programa EPI-INFO y enviarla a la DGAE semanalmente. Coordinar las acciones de toma, manejo de muestras y envío al laboratorio estatal o al INDRE, ratificar la recepción y las condiciones de las muestras a su llegada, recuperar los resultados correspondientes, capturarlos en la base de datos y canalizarlos a la coordinación jurisdiccional y a la unidad o médico responsable. Validar y notificar de manera inmediata a la DGAE los brotes de Tos ferina ocurridos en la entidad. Evaluar y supervisar las medidas de control aplicadas. Realizar el análisis permanente de la información. Proponer y aplicar medidas de intervención. Supervisar, asesorar y apoyar en la realización de los estudios de caso, brote y defunciones. Supervisar, asesorar y evaluar las acciones de vigilancia en los niveles jurisdiccional y local. 109 Participar en la capacitación del personal en procedimientos de vigilancia epidemiológica. Evaluar en el seno del Comité Estatal de Vigilancia Epidemiológica (CEVE) de acuerdo a las funciones y atribuciones establecidas en el Acuerdo Secretarial 130, la información epidemiológica a efecto de orientar las medidas de prevención y control. Realizar la supervisión y asesoría a las áreas operativas para verificar el cumplimiento de los procedimientos de vigilancia epidemiológica. En situaciones especiales, implementar una red de notificación diaria o semanal. Validar las dictaminaciones del Comité Jurisdiccional en un periodo no mayor de cinco días posteriores a la dictaminación y envío de las actas correspondientes a la DGAE. Debe contar con toda la información clínica-epidemiológica, así como los resultados del LESP ó InDRE. Coordinar la casificación final con envío de la dictaminación del Comité Estatal, el Certificado de Defunción (Anexo 5) y el formato de “Reporte de causas de Muerte Sujetas a Vigilancia Epidemiológica” de INEGI (Anexo 6) a la DGAE. Envío del Certificado de Defunción (Anexo 5) y el formato de “Reporte de causas de Muerte Sujetas a Vigilancia Epidemiológica” de INEGI (Anexo 6) en un periodo no mayor de cuatro semanas a la Dirección General de Epidemiología, donde se realiza la ratificación o rectificación de la defunción dictaminada por el Comité Estatal de Vigilancia Epidemiológica. Toda defunción en la cual no haya sido tomada muestra para diagnóstico de laboratorio deberá ser dictaminada mediante criterios clínico–epidemiológicos por el Comité Estatal y el CONAVE. Coordinar la capacitación del personal en materia de vigilancia de Tos ferina. Evaluar mensualmente el desempeño de los indicadores de evaluación y asegurar su cumplimiento. Evaluar el impacto de las acciones de prevención y control. Gestionar los recursos necesarios para las actividades de vigilancia epidemiológica. 110 Elaborar avisos o alertas epidemiológicas en el ámbito estatal. Difundir los avisos o alertas epidemiológicas a todos los niveles técnicoadministrativos bajo su responsabilidad. Emitir recomendaciones basadas en el análisis de la información epidemiológica que oriente las acciones de control. Retroalimentar a las jurisdicciones sobre la situación epidemiológica. Coordinarse con el CeNSIA para intercambio de información y aplicación de medidas de control ante casos y brotes. Difundir la información epidemiológica estatal. Mantener actualizado el panorama epidemiológico en el estado. Nivel nacional: Normar o actualizar los procedimientos de vigilancia epidemiológica. Verificar y validar la información enviada por los estados. Asesorar, supervisar y evaluar las actividades de vigilancia epidemiológica en todos los niveles operativos. Coordinar la capacitación y asesorar al personal en salud en materia de vigilancia epidemiológica. Tener información completa y actualizada en base de datos programa EPI-INFO. Recibir, concentrar, analizar y difundir la información epidemiológica. Fortalecer la coordinación con los LESP con el fin de obtener resultados en forma oportuna para la confirmación o descarte de los casos. Supervisar, asesorar y evaluar el sistema de vigilancia epidemiológica. Elaborar informes periódicos sobre la situación de las Tos ferina en el país y los estados. Participar en estudios e investigaciones especiales. Fortalecer la coordinación interinstitucional mediante reuniones con el CONAVE con el propósito de analizar la situación epidemiológica a nivel nacional, reorientando las acciones de manera permanente. 111 Elaborar boletín semanal, mensual, trimestral, anual, anuarios estadísticos. Coordinación con el CeNSIA para el intercambio de información y aplicación de medidas control ante situaciones especiales. Coordinar las reuniones con el Comité Nacional de Expertos para la dictaminación de los casos o defunciones según la información epidemiológica, clínica y de laboratorio. Evaluar el impacto de las acciones de control. Evaluar mensualmente el desempeño de los indicadores de evaluación y asegurar el cumplimiento de los mismos. Elaborar avisos o alertas epidemiológicas sobre situaciones de riesgo para su envío a los comités y unidades de vigilancia epidemiológica. Difundir la información epidemiológica a todos las entidades del país. Emitir recomendaciones basadas en el análisis de la información epidemiológica que oriente las acciones de control. Mantener actualizado el panorama epidemiológico. Procedimientos de laboratorio Las muestras deberán venir acompañada con el Formato Único de Envío de Muestras (FREM-01) debidamente llenado, sin datos alterados o sobre escritos. Cada muestra deberá cumplir con los requisitos generales establecidos en el Instructivo para el Envío y Recepción de Muestras Foráneas. Las muestras que no cumplan con los requisitos técnicos y administrativos serán rechazadas de manera definitiva de acuerdo a los lineamientos establecidos en el Manual para la Toma, Envío y Recepción de Muestras del InDRE (REM-MA-03). Toma de exudado nasofaríngeo: Condiciones de conservación de las muestras: El exudado nasofaríngeo es la muestra que se recomienda para el diagnóstico de Tos ferina y la búsqueda de contactos intradomiciliarios. Procedimiento: 112 1. Se utiliza un hisopo que NO sea de algodón, se recomienda que sea de alginato de calcio, rayón o dacrón con mango flexible (alambre de aluminio o plástico) para no lastimar al paciente. 2. Depositar el hisopo con la muestra en 1 ml de medio de transporte (solución salina con cefalexina a una concentración de 40 ug/ml) y trasladarlo lo más pronto posible al laboratorio en red fría (sin congelar). Nota. El tiempo de viabilidad de este microrganismo en la muestra en red fría es de 48 a 72 hrs. Cepas de Bordetella pertussi: Para enviar cepas de Bordetella pertussis u otras especies de Bordetella para control de calidad o confirmación (Referencia) a un laboratorio de referencia se debe emplear el medio de transporte de AMIES modificado con carbón activado. Procedimiento: 1. Realizar una siembra masiva de la cepa en el medio de cultivo Bordet-Gengou o Agar charcoal. 2. Incubar hasta 72 horas en aerobiosis y en bolsas de plástico. 3. Cosechar el desarrollo con asa esteril o con hisopo de dacrón o rayón e introducir el hisopo en un tubo que contiene el medio de transporte de AMIES, cerrar el tubo, sellar con parafilm y rotular el tubo con la clave de microrganismo, anexar la información solicitada (formato único de envío de muestras al InDRE y formato de estudio epidemiológico de caso de Tos ferina). 4. Enviar inmediatamente por un medio confiable de mensajería 5. Avisar por vía telefónica al laboratorio de referencia del envío de las cepas. 6. En caso de que no sea posible el envío inmediato, se puede mantener la cepa en este medio en refrigeración durante tres días como máximo. Información requerida: La muestra o la cepa debe de venir perfectamente bien etiquetada, señalando si es primera o segunda toma y diagnóstico solicitado, con el formato único de envío de muestras, resumen de la historia clínica y oficio de solicitud de estudio. 113 La falta de alguno de estos documentos o las condiciones inadecuadas de la muestra es causa de rechazo definitivo y se notificará al usuario responsable del envío. Determinación de anticuerpos anti-pertussis: Condiciones de conservación de las muestras: 1. Se requiere por lo menos de 1 a 3 ml de suero para la prueba, no debe estar hemolizado, lipémico ó contaminado. Se requiere de segunda muestra entre 15 y 21 días después de la primera toma. 2. Estas muestras se colectan en tubo estéril, sin anticoagulante y se transportan en red fría, sin congelar. Información requerida: La muestra debe venir perfectamente bien etiquetada, señalando si es primera o segunda toma y diagnóstico solicitado, con el formato único de envío de muestras, resumen de la historia clínica y oficio de solicitud de estudio. La falta de alguno de estos documentos o las condiciones inadecuadas de la muestra es causa de rechazo definitivo y se notificará al usuario responsable del envío. ALGORITMO DIAGNÓSTICO: 114 115 116 Evaluación Los indicadores de evaluación se enfocan por un lado a asegurar la continuidad con la calidad en la vigilancia epidemiológica, y por otro, monitorear la eliminación de estas enfermedades. INDICADOR Notificacion oportuna Estudio Oportuno Casos con Muestra Muestras a Contactos Envío Oportuno de Muestras al Laboratorio Resultado Oportuno de Laboratorio Clasificación Oportuna VALOR MINIMO CONSTRUCCION Casos notificados en las primeras 24hrs (fechas de primer contacto con servicios de salud contra la fecha de notificación a la JS) Total de casos. No. Casos estudiados en las primeras 48 horas (fecha de noticación a la jurisdicción contra la fecha de estudio por jurisdicción) Total de Casos No. de Casos con Muestras para Cultivo y/o PCR Total de Casos No. Casos con al menos 5 muestras de Contactos Total de Casos Casos con muestra de Cultivo y/o PCR enviados al laboratorio en los primeros 3 días (a partir de la fecha de toma de muestras contra la fecha de llegada de las muestras al laboratorio) Total de casos con muestra Casos con Resultado de Laboratorio en los primeros 10 días habiles (a partir de la fecha de llegada de las muestras de Cultivo y/o PCR al laboratorio contra la fecha de resultado emitido por el laboratorio) Total de Casos con Muestra Casos Clasificados dentro de 20 días (apartir de la fecha de estudio por la jurisdicción contra la fecha de entrega de resultados al nivel federal) Total de Casos Estudiados x 100 x 100 x 100 x 100 x 100 x 100 x 100 = ó > 80% = ó > 80% = ó > 80% = ó > 80% = ó > 80% = ó > 80% = ó > 80% ** La muestra siempre se deberá obtener al primer contacto. 117 DIFTERIA La difteria es una enfermedad de origen bacteriano causada por el Corynebacterium diphteriae de los biotipos gravis, mitis o intermedius. El biotipo belfanti también puede causar enfermedad aunque generalmente no es toxigénico. El periodo de incubación de la bacteria es d 2 a 5 días, y en ocasiones se prolonga; la transmisión es por contacto con el enfermo hasta que la bacteria desaparece de las lesiones, las cuales comúnmente tardan dos semanas. Los portadores pueden exportar microorganismos durante 6 meses o más. Esta enfermedad en forma aguda afecta las vías respiratorias y otras membranas mucosas o la piel, y en ocasionas las conjuntivas o la vagina. La lesión característica causada por la liberación de una citotoxina específica consiste en una membrana de color blanco grisácea, adherente, asimétrica, con inflamación en su periferia. En la zona perinoamigdalina se presenta dolor de moderado a intenso, con agrandamiento y dolor a la palpación de los ganglios linfáticos cervicales; en los casos moderados o graves hay notable aumento de volumen y edema del cuello, con membranas en la tráquea que pueden provocar obstrucción de las vías respiratorias; la miocarditis y la neuropatía periférica son las complicaciones más severas de la enfermedad. Situación Epidemiológica En la era pre-vacunal la difteria era rara en los lactantes menores de 6 meses, quizá debido a la presencia de anticuerpos maternos. La tasa de letalidad de la difteria extracutánea es de 5 a 10%, y ha permanecido en estos niveles durante los últimos 50 años. Los niños menores de 5 años de edad y las personas mayores de 40 años tienen un riesgo mayor de muerte. Además de la disminución de la incidencia, se ha registrado un cambio en el perfil epidemiológico de la enfermedad, que siempre ha tenido una marcada predilección por los lactantes y niños pequeños, sin embargo, en la última década, se ha podido observar 118 que ésta enfermedad ha comprometido a jóvenes, adultos y personas de la mediana edad. Las hipótesis sobre estos cambios incluyen posibles transformaciones en el microorganismo o en la población huésped que disminuyen los anticuerpos protectores a medida que aumenta la edad. Antes del establecimiento de Programa Ampliado de inmunización en 1977, se estima que cada año en el mundo se notificaban cerca de 1 millón de casos de difteria y de 50,000 a 60,000 muertes debidas a esta enfermedad y sus complicaciones. En el 2002, se notificaron 9,235 casos de difteria en todo el mundo. La incidencia y circulación de C. diphtheriae toxígeno en el medio se redujo a tal punto en los países industrializados que en los años 80´s la enfermedad estuvo a punto de ser erradicada. Sin embargo, a mediados de esa década, su frecuencia ha aumentado de nuevo en algunos países de Europa Oriental. En la Federación Rusia, la epidemia se intensificó marcadamente cada año a partir de 1990, propagandose a los estados independizados y a Mongolia. Entre 1990 y 1997 se notificaron más de 150,000 casos con 5,000 defunciones, y el mayor el número de casos en adultos jóvenes. En América, se declararon brotes epidémicos en Colombia, Ecuador, Haití, Paraguay y República Dominicana entre 1993 y 2004. El más extenso se produjo en ecuador entre 1993 y 1994, con más de 500 casos notificados. La mayoría en zonas de pobreza y hacinamiento y en personas con vacunación incompleta o sin antecedentes de vacunación. Los casos se presentaron en la edad de 15 años y más y adultos mayores. Colombia en 1992, presentó un brote de Difteria en el municipio de Buenaventura con 88 casos y 4 defunciones. En 1998, en el municipio de Cali, ocurrió el último caso de Difteria. Actualmente en América estos casos han disminuido, algunos países no presentan casos, su morbilidad y mortalidad ha descendido drásticamente en todos ellos. En México los casos de Difteria en todas sus formas clínicas ha presentado un decremento importante, durante el periodo de 1985 a 1990 se reportaron 71 casos. En octubre de 1991 en Lázaro Cárdenas, Michoacán, en un femenino de 12 años de edad, ocurrió el último caso de difteria en el país. 119 Casos de Difteria en México 2000-2009 5 4 3 2 1 0 El último caso de difteria fue reportado en el año 1991. 0 0 0 0 0 0 0 0 0 0 2000 2001 2002 2003 2004 2005 2006 2007 2008 2009 FUENTE: SINAVE/DGE/SALUD Definiciones operacionales Caso sospechoso de difteria: Toda persona de cualquier edad que presente algún proceso infeccioso de vías aéreas superiores, o bien, lesiones de cualquier tipo en piel. Caso probable de difteria: Todo caso sospechoso de cualquier edad que presente infección de vías aéreas con la presencia de placas blanco-grisáceas con dos o más de las siguientes características: borde hiperémico, consistencia dura, adherentes, fácilmente sangrantes, fétidas; y dos o más de los siguientes signos o síntomas: o Adenomegalias cervicales (cuello de toro) o Disfagia, odinofagia y/o disnea o Fiebre o Malestar general o Estado toxico infeccioso Caso confirmado de difteria: Todo caso probable al que se le agregue: o Aislamiento de Corynebacterium diphtheriae cepa toxigénica. o Aislamiento de Corynebacterium diphtheriae toxigénica a partir de convivientes, contactos o personas con asociación epidemiológica con el caso. o Asociación epidemiológica con otro caso confirmado. 120 Caso compatible de difteria: Todo caso probable de difteria en el que no se logra identificar la etiología, o que fallece o se pierde durante su seguimiento y no se dispone de estudios de laboratorio. Caso de difteria cutánea: Toda persona de la cual se aísle Corynebacterium diphtheriae toxigénica de alguna lesión en piel, en ausencia de infección aparente en vías aéreas u otro sitio, y tenga o no manifestaciones de la enfermedad. Portador asintomático: Toda persona de que se aísle Corynebacterium diphtheriae toxigénica, de cualquier muestra, y no presenta signos o síntomas de la enfermedad. Caso descartado de difteria: Todo caso probable en el cual se demuestra otra etiología, o bien, todo caso probable en el cual las muestras de laboratorio son negativas para Corynebacterium diphtheriae y los resultados de sus convivientes, contactos y personas con asociación epidemiológica son también negativos. Acciones ante caso por nivel técnico administrativo Nivel Local: Representado por las áreas aplicativas que son: Centro de Salud, Centro de Salud con Hospital y Unidades Hospitalarias. Las actividades asistenciales y de vigilancia epidemiológica llevadas a efecto por los centros de salud y las unidades hospitalarias son: Consulta médica a casos sospechosos y probables. Verificar que el caso cumpla la definición operacional de caso probable para establecer el diagnóstico inicial. Notifiación de los casos y defunciones probables a la jurisdicción sanitaria en las primeras 24 horas de su detección por las unidades de salud. Notificar la totalidad de los casos probables a través del “Informe Semanal de Casos Nuevos de Enfermedades” SUIVE-1 (Anexo 2), a la Jurisdicción Sanitaria. Elaborar el Estudio Epidemiológico de Caso de Difteria (Anexo 12). 121 Contar con el 100% de los estudios epidemiológicos y elaborar un Registro Nominal de Casos de Difteria. Notificación inmediata de brotes por el medio más expedito al nivel inmediato superior en el formato de Estudio de Brote (SUIVE-3). Participar en la investigación de brotes. Toma de muestras al 100% de los casos y enviar a la Jurisdicción Sanitaria. Referencia de los casos a segundo o tercer nivel. En caso de defunción, personal de la unidad médica tratante deberá obtener copia del expediente clínico (completo, visible, letra legible), y enviarlo a la Jurisdicción Sanitaria correspondiente, que a su vez enviará copia al estado y a la DGAE en un periodo no mayor a 5 días hábiles posteriores a la detección de la defunción. En caso de que la unidad médica no cuente con personal de vigilancia epidemiológica, el epidemiólogo jurisdiccional se hará responsable de la obtención del expediente clínico. Participar en la clasificación de los casos y defunciones en el seno del Comité Jurisdiccional de Vigilancia Epidemiológica. Nivel jurisdiccional o delegacional: En este nivel las funciones como instancia de enlace técnico y administrativo para la vigilancia epidemiológica son: Verificar y validar la información epdiemiológica enviada por las unidades de salud. Notificar de manera inmediata los casos probables o defuncions al nivel estatal; dentro de las primeras 24 horas de su detección por los servicios de salud. Captar de manera inmediata la totalidad de los estudios epidemiológicos. Asegurar la captura del 100% de los casos en la base de datos programa EPI-INFO v6.4 o registro nominal. Recibir la muestra con el estudio epidemiológico y remitirlas al laboratorio con copia de estudio correspondiente. 122 Actualizar la base de datos de casos de Difteria en el programa EPI-INFO y enviarla al estado semanalmente. Participar en las acciones de prevención y control. Notificación inmediata de brotes por el medio más expedito al nivel inmediato superior en el formato de Estudio de Brote (SUIVE-3). Seguimiento de los brotes hasta su resolución total. Supervisar, asesorar y apoyar en la realización de los estudios de casos y defunciones. Recopilar y enviar los documentos e información epidemiológica para dictaminación de los casos o defunciones según la información epidemiológica, clínica y de laboratorio. En defunciones coordinar la clasificación final y el envío del Certificado de Defunción (Anexo 5) y el formato de “Reporte de causas de Muerte Sujetas a Vigilancia Epidemiológica” de INEGI (Anexo 6). Dictaminar todas las defunciones en el Comité Jurisdiccional en un periodo no mayor de 10 días posteriores al deceso y envío del acta correspondiente al estado. Deberá contar con toda la información clínica-epidemiológica, así como los resultados de laboratorio del InDRE. Realizar la supervisión y asesoría a las áreas operativas para verificar el cumplimiento de los procedimientos de vigilancia epidemiológica. Realizar búsqueda activa de casos de Difteria en unidades de segundo nivel. Participar en la capacitación y adiestramiento del personal en procedimientos de vigilancia, la vigilancia hospitalaria y en la toma de muestras para su envío al LESP. Evaluar en el seno del Comité Jurisdiccional de Vigilancia de acuerdo a las funciones y atribuciones, la información epidemiológica a efecto de orientar las medidas de prevención y control. Realizar la supervisión y asesoría a las áreas operativas a efecto de identificar posibles omisiones a los procedimientos de vigilancia epidemiológica para la corrección inmediata de las mismas. 123 Evaluar mensualmente el desempeño de los indicadores de evaluación y asegurar el cumplimiento de los mismos. Evaluar el impacto de las acciones de prevención y control. Gestionar los recursos necesarios para las actividades de vigilancia epidemiológica. Elaborar y difundir avisos y alertas epidemiológicas en el ámbito jurisdiccional. Difudir los avisos y alertas epidemiológicas elaboradas por el Comité Estatal o Nacional de Vigilancia Epidemiológica. Mantener actualizado el panorama epidemiológico en los diversos municipios de la Jurisdicción Sanitaria. Difundir la información epidemiológica a las instancias correpondientes para la toma de decisiones. Nivel estatal: De acuerdo con su función normativa y de línea jerárquica: Concentrar, verificar y validar la información enviada por las jurisdicciones. Evaluar la calidad de la información. Notificar de manera inmediata los casos y defunciones a la DGAE. Concentrar semanalmente la información del componente de Información Semanal de casos enviada por las unidades de salud y envío a la DGAE. Actualizar la base de datos de casos de Difteria en el programa EPI-INFO y enviarla a la DGAE semanalmente. Coordinar las acciones de toma, manejo de muestras y envío al laboratorio estatal o al INDRE, ratificar la recepción y las condiciones de las muestras a su llegada, recuperar los resultados correspondientes, capturarlos en la base de datos y canalizarlos a la coordinación jurisdiccional y a la unidad o médico responsable. 124 Validar y notificar de manera inmediata a la DGAE los brotes de Difteria ocurridos en la entidad. Evaluar y supervisar las medidas de control aplicadas. Análisis permanente de la información epidemiológica Proponer y aplicar medidas de intervención. Supervisar, asesorar y evaluar las acciones de vigilancia en los niveles jurisdiccional y local. Supervisar, asesorar y apoyar en la realización de los estudios de caso, brote y defunciones. Coordinar la capacitación del personal en procedimientos de vigilancia y la vigilancia hospitalaria. Evaluar en el seno del Comité Estatal de Vigilancia Epidemiológica (CEVE) de acuerdo a las funciones y atribuciones establecidas en el Acuerdo Secretarial 130, la información epidemiológica a efecto de orientar las medidas de prevención y control; y realizar la dictaminación de casos y defunciones. Realizar la supervisión y asesoría a las áreas operativas a efecto de identificar posibles omisiones a los procedimientos de vigilancia epidemiológica para la corrección inmediata de las mismas. En situaciones especiales, implementar una red de notificación diaria. Validar las dictaminaciones del Comité Jurisdiccional en un periodo no mayor de cinco días posteriores a la dictaminación y envío de las actas correspondientes a la DGAE. Debe contar con toda la información clínica-epidemiológica, así como los resultados del LESP ó InDRE. Coordinar la clasificación final de las defunciones con envío de la dictaminación del Comité Estatal, el Certificado de Defunción (Anexo 5) y el formato de “Reporte de causas de Muerte Sujetas a Vigilancia Epidemiológica” de INEGI (Anexo 6) a la DGAE. 125 Envío del Certificado de Defunción (Anexo 5) y el formato de “Reporte de causas de Muerte Sujetas a Vigilancia Epidemiológica” de INEGI (Anexo 6) en un periodo no mayor de cuatro semanas a la Dirección General de Epidemiología, donde se realiza la ratificación o rectificación de la defunción dictaminada por el Comité Estatal de Vigilancia Epidemiológica. Toda defunción en la cual no haya sido tomada muestra para diagnóstico de laboratorio deberá ser dictaminada mediante criterios clínico–epidemiológicos por el Comité Estatal y el CONAVE. Coordinar la capacitación del personal en materia de vigilancia de Difteria. Evaluar mensualmente el desempeño de los indicadores de evaluación y asegurar su cumplimiento. Evaluar el impacto de las acciones de prevención y control. Gestionar los recursos necesarios para las actividades de vigilancia epidemiológica. Retroalimentar a las jurisdicciones sobre la situación epidemiológica Elaborar y difundir avisos y alertas epidemiológicas en el ámbito estatal. Difundir los avisos o alertas epidemiológicas emitidas por el nivel estatal o nacional. Coordinase con el programa de vacunación para intercambio de información y aplicación de medidas de control ante casos y brotes. Emitir recomendaciones basadas en el análisis de la información epidemiológica que oriente las acciones de control. Mantener actualizado el panorama epidemiológico en el estado. Difundir la información epidemiológica a las instancias correpondientes para la toma de decisiones. 126 Nivel nacional: Normar o actualizar los procedimientos de vigilancia epidemiológica. Verificar y validar la información enviada por los estados. Asesorar, supervisar y evaluar las actividades de vigilancia epidemiológica en todos los niveles operativos. Coordinar la capacitación y asesorar al personal en salud en materia de vigilancia epidemiológica. Tener información completa y actualizada en base de datos programa EPI-INFO. Analizar y difundir la información epidemiológica nacional. Fortalecer la coordinación con los LESP con el fin de obtener resultados en forma oportuna para la confirmación o descarte de los casos. Supervisar, asesorar y evaluar el sistema de vigilancia epidemiológica. Elaborar informes periódicos sobre la situación de Difteria en el país y los estados. Participar en estudios e investigaciones especiales. Fortalecer la coordinación interinstitucional mediante reuniones con el CONAVE con el propósito de analizar la situación epidemiológica a nivel nacional, reorientando las acciones de manera permanente. Elaborar boletín semanal y anuarios estadísticos. Coordinación con el CeNSIA para el intercambio de información y aplicación de medidas control ante situaciones especiales. Coordinar las reuniones con el Comité Nacional de Expertos para la dictaminación de los casos o defunciones según la información epidemiológica, clínica y de laboratorio. Evaluar mensualmente el desempeño de los indicadores de evaluación y asegurar el cumplimiento de los mismos. 127 Coordinarse con el CeNSIA para intercambio de información y aplicación de medidas de control. Elaborar boletín semanal y anuarios estadísticos. Evaluar el impacto de las acciones de control. Evaluar mensualmente el desempeño de los indicadores de evaluación y asegurar el cumplimiento de los mismos. Elaborar avisos o alertas epidemiológicas sobre situaciones de riesgo para su envío a los comités y unidades de vigilancia epidemiológica. Emitir recomendaciones basadas en el análisis de la información epidemiológica que oriente las acciones de control. Mantener actualizado el panorama epidemiológico. Difundir la información epidemiológica a todos las entidades del país. Procedimientos de laboratorio Las muestras deberán venir acompañada con el Formato Único de Envío de Muestras (F-REM-01) (Anexo 22) debidamente llenado, sin datos alterados o sobre escritos. Cada muestra deberá cumplir con los requisitos generales establecidos en el Instructivo para el Envío y Recepción de Muestras Foráneas. Las muestras que no cumplan con los requisitos técnicos y administrativos serán rechazadas de manera definitiva de acuerdo a los lineamientos establecidos en el Manual para la Toma, Envío y Recepción de Muestras del InDRE (REM-MA-03). Toma de exudado nasofaríngeo: Introducir ¾ partes del mango del hisopo por la fosa nasal hasta topar con la nasofaringe, rotar suavemente el hisopo y sacarlo lentamente y depositarlo en el medio de transporte. 128 Toma de exudado faríngeo: Es una de las muestras recomendadas para el diagnóstico por cultivo de Corynebacterium diphtheriae es el exudado faríngeo. Se recomienda tomar una parte de la pseudomembrana, si se encuentra presente y depositarla en el medio de transporte. Toma de biopsias: Las muestras para cultivo de tejidos se remiten rápidamente al laboratorio en un recipiente estéril con tapas adecuadas. Las muestras en formol no son adecuadas para su cultivo. Para la conservación y transporte de estas muestras se recomienda el medio de PAI, que es un medio sólido en tubo, inclinado. Toma de lesión de piel: Previo a la toma, se debe realizar una limpieza de la lesión con solución salina estéril y si hay material endurecido o costra remover. Presionar con el hisopo con firmeza en el interior de la lesión e introducirlo en el medio de transporte. Transporte: Depositar el hisopo con la muestra en el medio de transporte de PAI y trasladarlo a temperatura ambiente si el transporte es menor a 6 horas, o en red fría si el tiempo de transporte es mayor a 6 horas, debido a que después de este tiempo las proteínas digeridas por esta bacteria, permiten el desarrollo de la flora acompañante dificultando su aislamiento. Información requerida: La muestra debe de venir perfectamente bien etiquetada, señalando si es primera o segunda toma y el diagnóstico solicitado, con el formato único de envío de muestras 129 (formato de estudio epidemiológico de caso de Difteria), resumen de la historia clínica y oficio de solicitud de estudio. La falta de alguno de estos documentos o las condiciones inadecuadas de la muestra es causa de rechazo definitivo y se notificará al usuario responsable del envío. Determinación de anticuerpos antitoxina diftérica Se requiere de 1 a 3 ml de suero para la prueba, no debe estar hemolizado, lipémico ó contaminado. Las muestras se recolectan en tubo estéril, sin anticoagulante y se transportan en red fría, sin congelar. Información requerida: La muestra debe venir perfectamente bien etiquetada, señalando si es primera o segunda toma y el diagnóstico solicitado, con el formato único de envío de muestras (formato de estudio epidemiológico de caso de Difteria), resumen de la historia clínica y oficio de solicitud de estudio. La falta de alguno de estos documentos o las condiciones inadecuadas de la muestra es causa de rechazo definitivo y se notificará al usuario responsable del envío. 130 ALGORITMO DIAGNÓSTICO: 131 132 Evaluación La evaluación de los indicadores se realizará en todos los niveles técnicoadministrativos, así como en todas las instituciones integrantes del Sector, de forma mensual y cuando así se requiera por la situación epidemiológica. INDICADOR Estudio Oportuno CONSTRUCCION No. Casos estudiados en las primeras 48 horas (fecha de noticación a la jurisdicción contra la fecha de estudio por jurisdicción) VALOR MINIMO x 100 = ó > 80% x 100 = ó > 80% x 100 = ó > 80% x 100 = ó > 80% x 100 = ó > 80% x 100 = ó > 80% Total de Casos Casos con Muestra Muestras a Contactos Envío Oportuno de Muestras al Laboratorio No. de Casos con Muestras para Cultivo y/o PCR Total de Casos No. Casos con al menos 5 muestras de Contactos Total de Casos Casos con muestra de Cultivo y/o PCR enviados al laboratorio en los primeros 3 días (a partir de la fecha de toma de muestras contra la fecha de llegada de las muestras al laboratorio) Total de casos con muestra Resultado Oportuno de Laboratorio Casos con Resultado de Laboratorio en los primeros 15 días hábiles (a partir de la fecha de llegada de las muestras de Cultivo y/o PCR al laboratorio contra la fecha de resultado emitido por el laboratorio) Total de Casos con Muestra Clasificación Oportuna Casos Clasificados dentro de 20 días hábiles (apartir de la fecha de estudio por la jurisdicción contra la fecha de entrega de resultados al nivel federal) Total de Casos Estudiados ** La muestra siempre se deberá obtener al primer contacto. 133 INFECCIONES INVASIVAS POR HAEMOPHILUS INFLUENZAE B En México, existen retos epidemiológicos por lograr para mejorar la salud de la población infantil fundamentalmente en los menores de 5 años. Haemophilus influenzae (Hib) está asociada a una amplia variedad de padecimientos en la población infantil, desde infecciones leves de las vías respiratorias como faringitis, faringoamigdalitis, otitis media, sinusitis, hasta infecciones sistémicas e invasivas como meningitis, neumonía, epiglotitis empiema, celulitis, artritis séptica, infecciones intestinales, infecciones urinarias y pericarditis entre otras, provocando altas tasas de morbilidad y mortalidad en los menores de 5 años, así como secuelas permanentes en el caso de meningitis y artritis séptica. Hib, es un germen muy común en vías aéreas, pudiendo o no estar asociado a infección y enfermedad, por tanto, su participación como agente causal en muchos cuadros es difícil de demostrar (sobre todo en vías aéreas superiores), así como en otras infecciones invasivas (pericarditis, otitis o septicemia) en las que el diagnóstico no es factible con las técnicas que serán usadas en este sistema. Situación Epidemiológica En estudios recientes se ha demostrado mejoría en el desarrollo neurológico durante los primeros meses después de la meningitis, pero al año de edad el 8 por ciento de los niños presentan secuelas neurológicas o intelectuales como consecuencia de la misma; el número de niños con secuelas es discutible, pero no hay duda de que hay pérdida de aptitudes y habilidades neurológicas, así como del aprendizaje en los pacientes que tuvieron meningitis. En los países donde se ha implementado la vacunación se ha mostrado una reducción considerable en la incidencia de infecciones invasivas por Hib, sobre todo en los lactantes menores de 6 meses. 134 La elevada transmisibilidad de las infecciones por Hib entre contactos susceptibles en poblaciones de alto riesgo, como guarderías y salas pediátricas, son un problema de enorme importancia, por lo que se hace necesario la vigilancia médica, el diagnóstico oportuno y la realización de estudios epidemiológicos y microbiológicos de este microorganismo para contribuir a prevenir los procesos infecciosos causados por esta bacteria. Definiciones operacionales Caso sospechoso de meningitis por Hib: paciente que presente uno o más de los siguientes síndromes: meníngeo, hipertensión intracraneana o de daño neuronal. Caso probable de meningitis por Hib: caso sospechoso de meningitis que en el estudio citoquímico de LCR existen datos sugestivos de infección bacteriana. Caso confirmado de meningitis por Hib: caso probable de meningitis en quien el estudio de líquido cefalorraquideo por aglutinación en látex o cultivo confirma el diagnóstico de Haemophilus influenzae "b". Caso sospechoso de neumonía con derrame pleural por Hib: Paciente con tos, taquipnea o estertores y uno o más signos de dificultad respiratoria y uno o más signos clínicos de derrame pleural. Caso probable de neumonía con derrame pleural por Hib: Caso sospechoso con derrame pleural en quien se confirma el derrame por estudio radiológico. Caso confirmado de neumonía con derrame pleural por Hib: Caso probable con derrame pleural en el que el estudio de líquido pleural, confirma por aglutinación en látex o cultivo el diagnóstico de Haemophilus influenzae "b". Caso sospechoso de artritis por Hib: Cuadro clínico de infección localizada en alguna articulación. Caso probable de artritis por Hib: Caso sospechoso que en estudio radiológico se confirma aumento del espacio intraarticular. 135 Caso confirmado de artritis por Hib: Caso probable en quien el estudio de líquido sinovial, confirma por aglutinación en látex o cultivo el diagnóstico de Haemophilus influenzae "b". Caso compatible de meningitis, neumonía con derrame pleural o artritis séptica por Hib: Todo caso probable en el que no se realizaron pruebas de aglutinación en látex o cultivo, o bien, no tiene un diagnóstico alternativo sustentado. Caso descartado de meningitis, neumonía con derrame pleural o artritis séptica por Hib: Todo caso sospechoso que no cumpla con los criterios operacionales para ser clasificado como probable, así como todo caso probable donde una o ambas pruebas; aglutinación en látex y cultivo ha sido negativa, pudiendo o no tener otro diagnóstico etiológico comprobado por laboratorio. Acciones ante caso por nivel técnico administrativo Nivel Local: Brindar atención médica a los casos Verificar que el caso cumpla la definición operacional de caso probable para establecer el diagnóstico inicial. Notificación inmediata de casos a la jurisdicción sanitaria , en las primeras 24 horas de su conocimiento por los servicios de salud. Notificar de la totalidad de los casos probables a través del “Informe Semanal de Casos Nuevos de Enfermedades” SUIVE-1 (Anexo 2), a la Jurisdicción Sanitaria, al estado y a la DGAE. Realizar el estudio de caso con llenado del formato corespondiente. Toma de muestras para el laboratorio o estudio de gabinete. LLenar el formato de estudio epidemiológicode caso de Hib (Anexo 13). Realizar, en coordinación con el personal de la unidad, las actividades de control alrededor del caso. 136 Realizar el seguimiento de caso. Llenar el Formato de Registro de Casos (concentrado mensual) (Anexo14) para control de información que concentra la casuística mensual de la unidad y lo enviará al área de epidemiología de la Jurisdicción Sanitaria. Notificación inmediata de brotes por el medio más expedito al nivel inmediato superior en el formato de Estudio de Brote (SUIVE-3). Participar en la investigación de brotes. En caso de defunción, personal de la unidad médica tratante deberá obtener copia del expediente clínico (completo, visible, letra legible), y enviarlo a la Jurisdicción Sanitaria correspondiente, que a su vez enviará copia al estado y a la DGAE en un periodo no mayor a 5 días hábiles posteriores a la detección de la defunción. En caso de que la unidad médica no cuente con personal de vigilancia epidemiológica, el epidemiólogo jurisdiccional se hará responsable de la obtención del expediente clínico. Nivel jurisdiccional o delegacional: Verificar y validar la información epidemiológica enviada por las unidades de salud. Notificar de manera imediata los casos probables o defuncions al nivel estatal; dentro de las primeras 24 horas de su detección por los servicios de salud. Captar de manera inmediata la totalidad de los estudios epidemiológicos. Asegurar la captura del 100% de los casos en la base de datos correspondiente. Recibir la muestra con el estudio epidemiológico y remitirlas al laboratorio con copia de estudio correspondiente. Participar en las acciones de prevención y control. Notificación inmediata de brotes por el medio más expedito al nivel inmediato superior en el formato de Estudio de Brote (SUIVE-3). Seguimiento de los brotes hasta su resolución total. Supervisar, asesorar y apoyar en la realización de los estudios de casos y defunciones. 137 Recopilar y enviar los documentos e información epidemiológica para dictaminación de los casos o defunciones según la información epidemiológica, clínica y de laboratorio. Coordinar la clasificación final y el envío del Certificado de Defunción (Anexo 5) y el formato de “Reporte de causas de Muerte sujetas a Vigilancia Epidemiológica” de INEGI (Anexo 6). Dictaminar todas las defunciones en el Comité Jurisdiccional en un periodo no mayor de 10 días posteriores al deceso y envío del acta correspondiente al estado. Deberá contar con toda la información clínica-epidemiológica, así como los resultados de laboratorio del InDRE. Realizar la supervisión y asesoría a las áreas operativas para verificar el cumplimiento de los procedimientos de vigilancia epidemiológica. Realizar búsqueda activa de casos de H influenzae en unidades de segundo. Participar en la capacitación y adiestramiento del personal en procedimientos de vigilancia, la vigilancia hospitalaria y en la toma de muestras para su envío al LESP. Evaluar en el seno del Comité Jurisdiccional de Vigilancia de acuerdo a las funciones y atribuciones, la información epidemiológica a efecto de orientar las medidas de prevención y control. Realizar la supervisión y asesoría a las áreas operativas a efecto verificar el cumplimiento de los procedimientos de vigilancia epidemiológica. Evaluar mensualmente el desempeño de los indicadores de evaluación y asegurar el cumplimiento de los mismos. Evaluar el impacto de las acciones de prevención y control. Gestionar los recursos necesarios para las actividades de vigilancia epidemiológica. Elaborar y difundir avisos y alertas epidemiológicas en el ámbito jurisdiccional. Difudir los avisos y alertas epidemiológicas elaboradas por el Comité Estatal o Nacional de Vigilancia Epidemiológica. 138 Mantener actualizado el panorama epidemiológico en los diversos municipios de la Jurisdicción Sanitaria. Difundir la información epidemiológica a las instancias correpondientes para la toma de decisiones. Nivel estatal: Concentrar, verificar y validar la información enviada por las jurisdicciones. Evaluar la calidad de la información. Notificar de manera inmediata los casos y defunciones a la DGAE. Concentrar semanalmente la información del componente de Información Semanal de casos enviada por las unidades de salud y envío a la DGAE. Actualizarpermanentemente la base de datos de casos de H. influenzae. Coordinar las acciones de toma, manejo de muestras y envío al laboratorio estatal o al INDRE, ratificar la recepción y las condiciones de las muestras a su llegada, recuperar los resultados correspondientes, capturarlos en la base de datos y canalizarlos a la coordinación jurisdiccional y a la unidad o médico responsable. Validar y notificar de manera inmediata a la DGAE los brotes de H. influenzae. ocurridos en la entidad. Evaluar y supervisar las medidas de control aplicadas. Análisis permanente de la información epidemiológica. Proponer y aplicar medidas de intervención. Supervisar, asesorar y evaluar las acciones de vigilancia en los niveles jurisdiccional y local. Supervisar, asesorar y apoyar en la realización de los estudios de caso, brote y defunciones. 139 Enviar el Formato de Registro de Casos (concentrado mensual) (Anexo 11) para control de información que concentra la casuística mensual del estado y lo enviará al área de epidemiología del nivel nacional. Participar en la capacitación del personal en procedimientos de vigilancia y la vigilancia hospitalaria. Evaluar en el seno del Comité Estatal de Vigilancia Epidemiológica (CEVE) de acuerdo a las funciones y atribuciones establecidas en el Acuerdo Secretarial 130, la información epidemiológica a efecto de orientar las medidas de prevención y control; y realizar la dictaminación de casos y defunciones. Realizar la supervisión y asesoría a las áreas operativas a efecto de identificar posibles omisiones a los procedimientos de vigilancia epidemiológica para la corrección inmediata de las mismas. En situaciones especiales, implementar una red de notificación diaria. Validar las dictaminaciones del Comité Jurisdiccional en un periodo no mayor de cinco días posteriores a la dictaminación y envío de las actas correspondientes a la DGAE. Debe contar con toda la información clínica-epidemiológica, así como los resultados del LESP ó InDRE. Coordinar la clasificación final con envío de la dictaminación del Comité Estatal, el Certificado de Defunción (Anexo 5) y el formato de “Reporte de causas de Muerte Sujetas a Vigilancia Epidemiológica” de INEGI (Anexo 6) a la DGAE. Envío del Certificado de Defunción (Anexo 5) y el formato de “Reporte de causas de Muerte Sujetas a Vigilancia Epidemiológica” de INEGI (Anexo 6) en un periodo no mayor de cuatro semanas a la Dirección General de Epidemiología, donde se realiza la ratificación o rectificación de la defunción dictaminada por el Comité Estatal de Vigilancia Epidemiológica. Toda defunción en la cual no haya sido tomada muestra para diagnóstico de laboratorio deberá ser dictaminada mediante criterios clínico–epidemiológicos por el Comité Estatal y el CONAVE. 140 Coordinar la capacitación del personal en materia de vigilancia de Difteria. Evaluar mensualmente el desempeño de los indicadores de evaluación y asegurar su cumplimiento. Evaluar el impacto de las acciones de prevención y control. Gestionar los recursos necesarios para las actividades de vigilancia epidemiológica. Retroalimentar a las jurisdicciones sobre la situación epidemiológica. Elaborar y difundir avisos y alertas epidemiológicas en el ámbito estatal. Difundir los avisos o alertas epidemiológicas emitidas por el nivel estatal o nacional. Coordinase con el programa de vacunación para intercambio de información y aplicación de medidas de control ante casos y brotes. Emitir recomendaciones basadas en el análisis de la información epidemiológica que oriente las acciones de control. Mantener actualizado el panorama epidemiológico en el estado. Difundir la información epidemiológica a las instancias correpondientes para la toma de decisiones. Nivel nacional: Normar las funciones para la vigilancia epidemiológica. Verificar y validar la información enviada por los estados. Asesorar, supervisar y evaluar las actividades de vigilancia epidemiológica en todos los niveles operativos. Coordinar la capacitación y asesorar al personal en salud en materia de vigilancia epidemiológica. Tener información completa y actualizada de la situacion epidemiológica. Analizar y difundir la información epidemiológica nacional. 141 Fortalecer la coordinación con el InDRE con el fin de obtener resultados en forma oportuna para la confirmación o descarte de los casos. Supervisar, asesorar y evaluar el sistema de vigilancia epidemiológica. Promover reuniones con el propósito de analizar la situación epidemiológica a nivel nacional, reorientando las acciones de manera permanente. Elaborar informes periódicos sobre la situación de H. influenzae. Participar en estudios e investigaciones especiales. Fortalecer la coordinación interinstitucional mediante reuniones con el CONAVE con el propósito de analizar la situación epidemiológica a nivel nacional, reorientando las acciones de manera permanente. Coordinar las reuniones con el Comité Nacional de Expertos para la dictaminación de los casos o defunciones según la información epidemiológica, clínica y de laboratorio. Revisión de la documentación por el Comité de Expertos para avalar o no el dictamen. Verificar las dictaminaciónes de los casos y defunciones deberá estar encaminada a ratificar ó rectificar el diagnóstico de poliomielitis. Para las defunciones la rectificación se realizará a través del formato “Reporte de causas de Muerte Sujetas a Vigilancia Epidemiológica” de INEGI (Anexo 6). Las defunciones en las cuales no exista acuerdo en la dictaminación realizada por los comités estatales, serán dictaminadas por el Comité de Expertos con presencia del epidemiólogo estatal y el médico tratante, y se informará a los servicios de salud, el dictamen final que se ingresará a los registros oficiales. Evaluar el impacto de las acciones de control. Evaluar mensualmente el desempeño de los indicadores de evaluación y asegurar el cumplimiento de los mismos. 142 Elaborar avisos o alertas epidemiológicas sobre situaciones de riesgo para su envío a los comités y unidades de vigilancia epidemiológica. Elaborar boletín semanal y anuarios estadísticos. Coordinarse con el CeNSIA para intercambio de información y aplicación de medidas de control. Difundir la información epidemiológica a todos las entidades del país. Emitir recomendaciones basadas en el análisis de la información epidemiológica que oriente las acciones de control. Mantener actualizado el panorama epidemiológico. Procedimientos de laboratorio Las muestras deberán venir acompañada con el Formato Único de Envío de Muestras (FREM-01) (anexo 22) debidamente llenado, sin datos alterados o sobre escritos. Cada muestra deberá cumplir con los requisitos generales establecidos en el Instructivo para el Envío y Recepción de Muestras Foráneas. Las muestras que no cumplan con los requisitos técnicos y administrativos serán rechazadas de manera definitiva de acuerdo a los lineamientos establecidos en el Manual para la Toma, Envío y Recepción de Muestras del InDRE (REM-MA-03). Transporte y envío de cepas de H. influenzae: Para enviar cepas de H. influenzae para control de calidad o confirmación (referencia) a un laboratorio de referencia se debe emplear el medio de transporte de AMIES modificado con carbón activado. Procedimiento: 1. Realizar una siembra masiva de la cepa en el medio de cultivo agar chocolate enriquecido. 2. Incubar de 18 a 24 horas a 35 – 37°C en tensión parcial de CO2. 143 3. Cosechar el desarrollo con hisopo de dacrón o rayón e introducir el hisopo en un tubo que contiene el medio de transporte de AMIES, cerrar el tubo, sellar con parafilm y rotular el tubo con la clave de microrganismo, anexar la información solicitada (formato único de envío de muestras al InDRE). 4. Enviar inmediatamente por un medio confiable de mensajería (NO REFRIGERAR). 5. Avisar por vía telefónica al laboratorio de referencia del envío de las cepas. 6. En caso de que no sea posible el envío inmediato, se puede mantener la cepa en este medio a temperatura ambiente durante cinco días como máximo. 144 ALGORITMO DIAGNÓSTICO: 145 Evaluación INDICADOR CONSTRUCCION Notificación Oportuna No. Casos estudiados en las primeras 24 horas (fecha de noticación a la jurisdicción contra la fecha de estudio por jurisdicción) VALOR MINIMO x 100 100% x 100 = ó > 80% x 100 = ó > 80% x 100 = ó > 80% x 100 = ó > 80% Total de casos probables notificados al sistema especial. Estudio Oportuno No. Casos estudiados en las primeras 48 horas (fecha de noticación a la jurisdicción contra la fecha de estudio por jurisdicción) Total de casos probables notificados al sistema especial. Casos con Muestras No. de Casos con Muestras para Cultivo o Serología Total de casos probables notificados al sistema especial. Resultado Oportuno de Laboratorio Casos con Resultado de Laboratorio en los primeros 4 días (a partir de la fecha de llegada de las muestras para Cultivo o Serología al laboratorio contra la fecha de resultado emitido por el laboratorio) Total de Casos con Muestra Clasificación Oportuna Casos Clasificados dentro de los primeros 10 días (apartir de la fecha de estudio por la jurisdicción contra la fecha de entrega de resultados al nivel federal) Total de Casos Estudiados ** La muestra siempre se deberá obtener al primer contacto. 146 ENFERMEDADES INFLAMATORIAS DEL SISTEMA NERVIOSO CENTRAL La meningitis bacteriana aguda, es producto de la presencia de bacterias en el espacio subaracnoideo, con una consecuente reacción inflamatoria que comprende a su vez al parénquima cerebral y las meninges. Las meningitis se identifican en dos grupos las virales y bacterianas, las primeras son causadas por enterovirus, virus coxackie, echovirus, adenovirus, otros virus como los causantes de la gripa, herpes, varicela y parotiditis. Para las bacterianas los agentes más frecuentemente aislados son Streptococcus pneumoniae (Sp) y Neisseria meningitidis en el 80% de los casos, seguidos por Listeria monocytogenes y estafilococos. Los bacilos Gram negativos (E.coli, Klebsiella, Enterobacter y P. aeroginosa), contribuyen en menos del 10% de los casos. Haemophilus influenza tipo b, es una causa menos frecuente debido a la inmunización universal. El Haemophilus influenzae (Hib) y Streptococcus pneumoniae (Sp) están asociadas a una amplia variedad de padecimientos en la población infantil, desde infecciones leves de las vías respiratorias como faringitis, faringoamigdalitis, otitis media y sinusitis, hasta infecciones sistémicas e invasivas como la meningitis, neumonía, epiglotitis empiema, celulitis, artritis séptica, infecciones intestinales, infecciones urinarias y pericarditis, entre otras. Así mismo, una tercera bacteria de gran importancia relacionada con padecimientos invasivos es Neisseria meningitidis (Nm), que ocasiona meningitis. En la meningitis bacteriana el período de incubación es de 2 a 10 días a excepción de Haemophilus influenzae que va de horas hasta 5 días, los síntomas más frecuentes son rigidez de cuello (Brudzinski), fiebre elevada, alteraciones del estado mental (confusión), Otros signos y síntomas presentes son cefalea, náuseas, vómitos fotosensibilidad, Kerning, convulsiones y déficit neurológico focal (afectación de pares craneales, afasia, etc). Una forma menos frecuente pero aún más grave de enfermedad meningocócica es la septicemia meningocócica, que se caracteriza la presencia de fiebre súbita, grave ataque al estado general, postración acompañados de hipotensión que puede llegar a 147 choque y manifestaciones hemorrágicas (sobre todo a nivel cutáneo: petequias y equimosis). Puede ser mortal y debe considerarse siempre como una urgencia médica. El diagnóstico inicial de las meningitis puede establecerse a partir de la exploración física, seguida de una punción lumbar que muestra un líquido cefalorraquídeo (LCR) purulento. A veces se puede observar las bacterias en el examen microscópico del LCR. El diagnóstico es respaldado o confirmado por el cultivo positivo de la sangre o del LCR, las pruebas de aglutinación o la reacción en cadena de la polimerasa (PCR). La identificación de los serogrupos y el antibiótico son importantes para definir las medidas de control. El inicio del tratamiento antes de la punción puede dificultar el crecimiento de la bacteria en el cultivo de LCR y la confirmación del diagnóstico Situación Epidemiológica La OMS considera las meningitis bacterianas como una seria amenaza a la salud, estimando que ocurren 171 mil defunciones por año en el mundo; debido a que las epidemias que se producen en el “cinturón de la meningitis”, que va desde el Senegal al oeste hasta Etiopía al este, constituyen una enorme carga para la salud pública. Además propone una estrategia en dos frentes que comprende la preparación y la respuesta ante las epidemias. 1) La preparación se centra en la vigilancia, desde la detección e investigación de los casos hasta su confirmación de laboratorio. Esto requiere un reforzamiento de la vigilancia y de la capacidad de laboratorio para detectar tempranamente las epidemias, crear reservas nacionales y subregionales de vacunas y elaborar o actualizar planes de gestión de las epidemias que incluyan planes de preparación, de contingencia y de respuesta. 2) La respuesta a las epidemias consiste en el tratamiento rápido y apropiado de los casos con cloranfenicol oleoso o ceftriaxona y la vacunación reactiva en masa en los distritos afectados por las epidemias. Se calcula que, cuando se instaura rápidamente, una campaña de vacunación reactiva en masa puede prevenir hasta un 70% de los casos. 148 Meningitis Bacteriana. En México las meningitis bacterianas en el periodo del 2000 al 2009 se presentaron 10, 824 casos, para el 2009 se tuvo una tasa de incidencia de 0.67 por 100 000 habitantes (722 casos), para este año las entidades con mayor número de casos fueron: Distrito Federal (105), Nuevo León (100), Baja California (81), Sinaloa (74), y Jalisco (41). Por tasa de incidencia Sinaloa ocupó el primer lugar con una tasa de 2.79, Baja California con 2.56, Nuevo León con 2.25, Colima 2.16 y Baja California Sur 1.77 por 100 000 habitantes. De los 722 casos de 2009, el 57.1% fueron hombres y 42.9 mujeres, los menores de un año tuvieron una tasa de incidencia de 7.6 por 100 000 habitantes. Para el año 2010 se tuvieron 805 casos en 2011 se aumentaron 152 casos como se observa en la gráfica. Casos de Meningitis bacteriana, México 2005-2011 Fuente: SINAVE/DGAE/CENAVECE/SSA Meningitis Meningocócica En el período de 2000-2009 se notificaron 462 casos de meningitis meningocócica una mediana de 57 casos, se tiene una tendencia ascendente, dos brotes epidémicos en el 2003 y 2008 con 62 y 82 casos respectivamente; para 2009 se registraron 42 casos con una tasa de incidencia de 0.04 por 100 000 habitantes. En el año 2009, las entidades que reportaron más casos fueron Nuevo León (10 casos), Sinaloa y Chiapas (5 casos), Estado de México (4 casos), Baja California, Chihuahua, 149 Oaxaca (3 casos cada una). De acuerdo con la tasa de incidencia, Nuevo León ocupó el primer lugar con una tasa de 0.22, Sinaloa 0.19, Baja California Sur 0.18, Quintana Roo 0.15 y Chiapas 0.11 por 100 000 habitantes. Los grupos de edad más afectados son los menores 1 año y 1 a 4 años con tasas de 0.10 y 0.08 por cada 100 000 habitantes respectivamente, el sexo más afectado es el masculino. en el 2011 se presentaron 45 casos, 26 mujeres y 19 hombres, el grupo de edad mas afectado fue el 25 a 44 años. Casos de Meningitis Meningocócica, México 2005-2011 Fuente: SINAVE/DGAE/CENAVECE/SSA Definiciones operacionales Meningitis Se notificaran todas los casos de meningitis de etiología viral y bacteriana de todos los grupos de edad, excepto los casos de meningitis por Hib en menores de cinco años de edad, los cuales se notificaran en el Sistema de Vigilancia Epidemiológica de Infecciones Invasivas por Hib. Caso probable: Toda persona que presente fiebre (mayor de 38º C) y dos o más de los siguientes signos o síntomas: o Meníngeos: fontanela abombada (<1 año), rigidez de nuca, signo de Kernig, signo de Brudzinski, dolor lumbar o fotofobia. 150 o Encefálicos: irritabilidad, desorientación, confusión, sopor, somnolencia, estupor, coma, apatía, agresividad, cefalea, habla farfullada, ataque a pares craneales o convulsiones. o Líquido cefalorraquídeo sugestivo (presión aumentada, turbio, aumento de la celularidad, hipoglucorraquia, incremento de las proteínas, pleiocitosis a expensas de polimorfonucleares). o En lactantes la sola presencia de fiebre/hipotermia con rechazo al alimento e irritabilidad/letargia son sugestivos. Caso confirmado: Todo caso probable donde se identifique la presencia de Neisseria meningitidis (Nm), Haemophilus influenzae (Hib) y Streptococcus pneumoniae (Sp) bajo los criterios de confirmación establecidos por laboratorio; o en ausencia de prueba diagnóstica, asociación con un caso confirmado. Caso confirmado farmacorresistente: Todo caso confirmado con aislamiento por cultivo de Neisseria meningitidis, Haemophilus influenzae y Streptococcus pneumoniaei dentificado como no susceptible (resistencia intermedia o alta) a uno o más antimicrobianos. Meningococcemia (Sepsis por Meningococo) Caso probable de Meningococcemia: Todo paciente con fiebre de aparición brusca, malestar súbito, postración y uno o más de los siguientes: o Manifestaciones hemorrágicas de la piel: petequias, equimosis, rash maculopapular y/o purpúrico. o Datos de choque. o Nexo epidemiológico. Caso confirmado: Todo caso probable donde se identifique la presencia de Neisseria meningitidis mediante aislamiento en hemocultivo o liquido de lesiones petequiales, o asociado a un caso confirmado por laboratorio. Contacto: Cualquier persona que en el hogar, escuela, trabajo u otro sitio de reunión que se expone cara a cara a las gotas de saliva por estornudos, tos o hablar con un caso (probable o confirmado a una distancia máxima de 91 cm) o cuando 151 se comparte en proximidad por más de una hora en un espacio cerrado sin ventilación, ó personal de salud que se expone a secreciones en procedimientos de aspiración y/o broncoscopía. La OPS/OMS recomienda su tratamiento de acuerdo al siguiente cuadro: Prevención de casos secundarios a infección por Neisseria meningitidis: Se recomienda quimioprofilaxis a los contactos con una de las siguientes opciones: ANTIBIÓTICO DOSIS Adultos: 600 mg. Vía oral, cada 12 horas, por cuatro dosis. Rifampicina Niños >1 mes: 10 mg/Kg/cada 12 horas, por cuatro dosis, vía oral. Niños <1 mes: 5 mg/Kg/cada 12 horas, por cuatro dosis, vía oral. Ceftriaxona Adultos: 250 mg. I.M., una dosis (de elección durante el embarazo). Ciprofloxacina Niños <15 años: 125 mg. I.M. una dosis. Adultos: 500 mg. Vía oral, una dosis. Fuente: Organización Panamericana de la Salud. Tratamiento de Enfermedades Infecciosas, 2011-2012, 5ª. Edición. Washington, D.C., USA, 2011. Acciones ante caso por nivel técnico administrativo Nivel Local: Representado por las áreas aplicativas que son: Centro de Salud, Centro de Salud con Hospital y Unidades Hospitalarias. Las actividades asistenciales y de vigilancia epidemiológica llevadas a efecto por los centros de salud y las unidades hospitalarias son: Consulta médica a casos probables. Verificar que el caso cumpla la definición operacional de caso probable para establecer el diagnóstico inicial. Notificar los casos de manera inmediata a la Jurisdicción Sanitaria de acuerdo a lo establecido en el Proyecto de Norma Oficial Mexicana PROY NOM-017 SSA2-2012. Notificar la totalidad de los casos probables a través del “Informe Semanal de Casos Nuevos de Enfermedades” SUIVE-1 (Anexo 2), a la Jurisdicción Sanitaria. 152 Elaborar el Estudio epidemiológico de caso de Meningitis y enviarlo a la Jurisdicción Sanitaria dentro de las primeras 24 horas para su captura en el sistema correspondiente, de contar con informática capturarlo en la misma unidad. Notificación inmediata de brotes por el medio más expedito al nivel inmediato superior en el formato de Estudio de Brote (SUIVE-3). Participar en la investigación de brotes. Se deberá elaborar el estudio de caso en el formato de Estudio de caso de Meningitis (Anexo 16), de ser necesario agregar contactos, utilizar el Formato para estudio de contactos para Enfermedad Meningocóccica (Anexo 17). En caso de defunción, personal de la unidad médica tratante deberá obtener copia del expediente y resumen clínico, y enviarlo a la Jurisdicción Sanitaria correspondiente, en un periodo no mayor a 10 días hábiles posteriores a la detección de la defunción. En caso de que la unidad médica no cuente con personal de vigilancia epidemiológica, el epidemiólogo jurisdiccional será el responsable de la obtención del expediente clínico. Contar con el 100% de los estudios epidemiológicos. Toma de muestras al 100% de los casos y enviar a la Jurisdicción Sanitaria o al LESP. Proporcionar tratamiento a los contactos de acuerdo a lo establecido en el apartado de manejo y tratamiento a contactos. Refererir los casos a unidades de segundo y tercer nivel de atención. Recopilar y enviar los documentos e información epidemiológica para dictaminación de los casos o defunciones según la información epidemiológica, clínica y de laboratorio. Participar en la clasificación de los casos y defunciones en el seno del Comité Jurisdiccional de Vigilancia Epidemiológica. Implementarr la red negativa diaria con reporte de casos hospitalizados, defunciones o ausencia de casos “Formato de red negativa” (Anexo 15), cuando sea requerido por los comités de vigilancia. 153 Nivel jurisdiccional o equivalente: En este nivel las funciones como instancia de enlace técnico y administrativo para la vigilancia epidemiológica son: Verificar y validar la información epidemiológica enviada por las unidades de salud. Notificar de manera inmediata los casos probables o defunciones al estado; dentro de las primeras 24 horas de su detección por los servicios de salud. Captar de manera inmediata la totalidad de los estudios epidemiológicos. Asegurar la captura del 100% de los casos en la base de datos en el sistema de información correspondiente. Recibir la muestra del caso o la cepa con el estudio epidemiológico y remitirlas al laboratorio con copia de estudio correspondiente (si es necesario tomar la muestra al caso). Notificación inmediata de brotes por el medio más expedito al nivel inmediato superior en el formato de Estudio de Brote (SUIVE-3). Seguimiento de los brotes hasta su resolución total. Participar en las acciones de prevención y control. Participar en la capacitación del personal en procedimientos de vigilancia y en la toma de muestras para su envío al LESP. Supervisar, asesorar y apoyar en la realización de los estudios de casos y defunciones. Coordinar la clasificación final y el envío del Certificado de Defunción (Anexo 5) y el formato de “Reporte de causas de Muerte Sujetas a Vigilancia Epidemiológica” de INEGI (Anexo 6). Recopilar y enviar los documentos e información epidemiológica para dictaminación de los casos o defunciones según la información epidemiológica, clínica y de laboratorio. Dictaminar todas las defunciones en el Comité Jurisdiccional u homólogo en un periodo no mayor de 10 días posteriores al deceso y envío del acta correspondiente al estado. Debe contar con toda la información clínica-epidemiológica, así como los resultados del LESP e InDRE. 154 Evaluar en el seno del Comité Jurisdiccional de Vigilancia de acuerdo a las funciones y atribuciones, la información epidemiológica a efecto de orientar las medidas de prevención y control. Realizar la supervisión y asesoría a las áreas operativas para verificar el cumplimiento de los procedimientos de vigilancia epidemiológica. Realizar búsqueda activa de casos de meningitis en unidades de segundo nivel. Evaluar el desempeño de los indicadores de evaluación y asegurar el cumplimiento de los mismos. Evaluar el impacto de las acciones de prevención y control. Gestionar los recursos necesarios para las actividades de vigilancia epidemiológica. Informar de manera diaria respecto a la Red Negativa Hospitalaria al nivel inmediato superior. Elaborar y difundir avisos y alertas epidemiológicas en el ámbito jurisdiccional. Difundir los avisos y alertas epidemiológicas elaboradas por el Comité Estatal o Nacional de Vigilancia Epidemiológica. Emitir recomendaciones basadas en el análisis de la información epidemiológica que oriente las acciones de control. Difundir la información epidemiológica a las instancias correspondientes para la toma de decisiones. Mantener actualizado el panorama epidemiológico en los diversos municipios de la Jurisdicción Sanitaria. Nivel estatal: De acuerdo con su función normativa y de línea jerárquica: Concentrar, verificar y validar la información enviada por las jurisdicciones. Evaluar la calidad de la información. Notificar inmediatamente los casos y defunciones probables a la DGAE. Recibir, concentrar y evaluar la calidad de la información y de los estudios de casos. 155 Concentrar semanalmente la información del componente de Información Semanal de Casos enviada por las unidades de salud y envío a la DGAE. Actualizar la base de datos de casos de Meningitis en el sistema de información correspondiente y enviarla a la DGAE cuando se requiera. Coordinar las acciones de toma, manejo de muestras y envío al laboratorio estatal o al INDRE, ratificar la recepción y las condiciones de las muestras a su llegada, recuperar los resultados correspondientes, capturarlos en la base de datos y canalizarlos a la coordinación jurisdiccional y a la unidad o médico responsable. Validar y notificar de manera inmediata a la DGAE los brotes de Meningitis ocurridos en la entidad. Evaluar y supervisar las medidas de control aplicadas. Realizar el análisis permanente de la información. Proponer y aplicar medidas de intervención. Supervisar, asesorar y evaluar las acciones de vigilancia en los niveles jurisdiccional y local. Participar en la capacitación del personal en procedimientos de vigilancia y la vigilancia hospitalaria. Evaluar en el seno del Comité Estatal de Vigilancia Epidemiológica (CEVE) de acuerdo a las funciones y atribuciones establecidas en el Acuerdo Secretarial 130, la información epidemiológica a efecto de orientar las medidas de prevención y control; y realizar la dictaminación de casos y defunciones. Coordinar la casificación final de defunciones. Validar las dictaminaciones del Comité Jurisdiccional en un periodo no mayor de cinco días posteriores a la dictaminación y envío de las actas correspondientes a la DGAE. Debe contar con toda la información clínica-epidemiológica, así como los resultados del LESP ó InDRE. Realizar la supervisión y asesoría a las áreas operativas para verificar el cumplimiento de los procedimientos de vigilancia epidemiológica. En situaciones especiales, implementar la red negativa de notificación diaria o semanal. 156 Toda defunción en la cual no haya sido tomada muestra para diagnóstico de laboratorio deberá ser dictaminada mediante criterios clínico–epidemiológicos por el Comité Estatal y el CONAVE. Envío del Certificado de Defunción (Anexo 5) y el formato de “Reporte de causas de Muerte Sujetas a Vigilancia Epidemiológica” de INEGI (Anexo 6) en un periodo no mayor de cuatro semanas a la Dirección General de Epidemiología, donde se realiza la ratificación o rectificación de la defunción dictaminada por el Comité Estatal de Vigilancia Epidemiológica. Coordinar la capacitación del personal en materia de vigilancia de Meningitis. Evaluar el desempeño de los indicadores de evaluación y asegurar su cumplimiento. Evaluar el impacto de las acciones de prevención y control. Gestionar los recursos necesarios para las actividades de vigilancia epidemiológica. Difundir los avisos o alertas epidemiológicas a todos los niveles técnicoadministrativos bajo su responsabilidad. Emitir recomendaciones basadas en el análisis de la información epidemiológica que oriente las acciones de control. Mantener actualizado el panorama epidemiológico en el estado incluyendo el análisis y los estudios de brote. Retroalimentar a las jurisdicciones sobre la situación epidemiológica. Difundir la información epidemiológica estatal. Nivel nacional: Normar o actualizar los procedimientos de vigilancia epidemiológica. Asesorar, supervisar y evaluar las actividades de vigilancia epidemiológica en todos los niveles operativos. Capacitar y asesorar al personal en salud en materia de vigilancia epidemiológica. Tener información completa y actualizada en base de datos en el sistema de información correspondiente. Recibir, concentrar, analizar y difundir la información epidemiológica nacional del panorama epidemiológico. 157 Fortalecer la coordinación con los LESP con el fin de obtener resultados en forma oportuna para la confirmación o descarte de los casos. Supervisar, asesorar y evaluar el sistema de vigilancia epidemiológica. Elaborar informes periódicos sobre la situación de las Meningitis en el país y los estados. Participar en estudios e investigaciones especiales. Fortalecer la coordinación interinstitucional mediante reuniones con el CONAVE con el propósito de analizar la situación epidemiológica a nivel nacional, reorientando las acciones de manera permanente. Difundir la información sobre la situación de la Meningitis en el país y los estados. Elaborar boletín semanal, mensual, trimestral, anual, anuarios estadísticos. Coordinación con el CeNSIA para el intercambio de información y aplicación de medidas control ante situaciones especiales. Coordinar las reuniones con el Comité Nacional de Expertos para la dictaminación de los casos o defunciones según la información epidemiológica, clínica y de laboratorio. Evaluar el impacto de las acciones de control. Evaluar el desempeño de los indicadores de evaluación y asegurar el cumplimiento de los mismos. Participación en reuniones nacionales e internacionales. Elaborar avisos o alertas epidemiológicas sobre situaciones de riesgo para su envío a los comités y unidades de vigilancia epidemiológica. Difundir la información epidemiológica a todos las entidades del país. Emitir recomendaciones basadas en el análisis de la información epidemiológica que oriente las acciones de control. Mantener actualizado el panorama epidemiológico. Procedimientos de laboratorio 158 Los laboratorios de hospitales que puedan realizarán el cultivo de las muestras clínicas (sangre para hemocultivo, Líquído cefalorraquídeo, líquidos pleurales, u otros líquidos normalmente estériles y la determinación de antígenos con la técnica de aglutinación con látex. Deberán enviar el 100 % de los aislamientos sospechosos o confirmados al Instituto de Diagnóstico y Referencia Epidemiológicos (InDRE) a través de la Jurisdicción Sanitaria correspondiente para su confirmación, serotipificación y determinación de patrones de susceptibilidad o resistencia, (Especificando Género, especie y si se tiene serogrupo ). Las muestras deberán venir acompañadas con el Formato Único de Envío de Muestras (F-REM-01) debidamente llenado, sin datos alterados o sobre escritos. Cada muestra deberá cumplir con los requisitos generales establecidos en el Instructivo para el Envío y Recepción de Muestras Foráneas. Las muestras que no cumplan con los requisitos técnicos y administrativos serán rechazadas de manera definitiva de acuerdo a los lineamientos establecidos en el Manual para la Toma, Envío y Recepción de Muestras del InDRE (REM-MA-03). Los métodos rápidos para la identificación presuntiva en muestras de Líquido Cefalorraquídeo incluyen la observación al microscopio mediante frote teñido por Gram y la aglutinación en látex para la determinación de antígenos capsulares, la reacción en cadena de la polimerasa(PCR) y la prueba de oro la constituye el aislamiento e identificación de Neisseria meningitidis. Haemophilus influenzae y Streptococcus pneumoniae. La toma de muestra debe efectuarse en un hospital por personal médico bien entrenado quien deberá seguir de forma rigurosa en las condiciones de asepsia. Recuperar aproximadamente de 2 a 5 ml de LCR y verterlos en un tubo estéril con tapón de rosca, sangre de 5 a 10 ml en frasco para hemocultivo y liquido de lesiones petequiales (tomar con jeringa, hacer frote y cultivar directo). 159 Para la búsqueda de agentes bacterianos: Enviar las muestras rápidamente al laboratorio (en las primeras 3 horas) a temperatura ambiente y procesarlo de inmediato para evitar pérdida de viabilidad de los microrganismos sensibles a los cambios bruscos de temperatura. Condiciones de conservación de las muestras: El líquido cefalorraquídeo (LCR) es la muestra mas común en infecciones del sistema nervioso central y debe tomarse preferentemente antes del tratamiento con antibióticos para aumentar las posibilidades de aislamiento. Toma de Líquido Céfalo Raquídeo: El líquido cefalorraquídeo obtenido en condiciones estériles es separado en tres tubos estériles para las siguientes determinaciones: Tubo 1: Examen citológico: Recuento de células y tipo de células que lo constituyen. Tubo 2: Examen bioquímico: Análisis de proteínas, glucosa. Tubo 3: Examen microbiológico: Cultivo, tinción de Gram y aglutinación de látex. Transporte: El volumen requerido es de 2 a 5 ml. El tubo 3 debe ser llevado rápidamentea temperatura ambiente al laboratorio y procesarlo de inmediato para evitar la pérdida de viabilidad de los microrganismos sensibles a los cambios bruscos de temperatura. Si no se cuenta con recursos para procesar la muestra podrá separar una parte para la detección directa de antígeno capsular y almacenar por un máximo de 8 horas entre 2 y 8 oC y si no es posible enviarla, entonces congelar a -20 oC por un máximo de 2 días y enviarla en red fría. La otra parte del líquido cefalorraquídeo se puede inocular en un frasco para hemocultivo chico o en 1 ml de caldo infusión cerebro corazón enriquecido y transportarla al laboratorio a temeratura ambiente. Preferentemente no utilizar hemocultivos para adultos, ya que se corre el riesgo de diluir la muestra y perder la oportunidad de aislamiento del agente etiológico. 160 Para el enviar cepas de S. pneumonieae, H. influenzae, y N. meningitidis para control de calidad o confirmación (referencia) un laboratorio de referencia se deba emplear el medio de transporte de AIMES modificado con carbón activado. Procedimiento: 1. Realizar una siembra masiva de la cepa en el medio de cultivo de acuerdo al tipo de cepa como sigue: Si es Stretococcus penumoniae en agar sangre de carnero al 5%. Si es Haemophilus influenzae en agar chocolate enriquecido. Si es Neisseria meningitidis en agar chocolate enriquecido o agar sangre de carnero al 5%. 2. Incubar de 18 a 24 horas a 35-37 o C en tensión parcial de CO2. 3. Cosechar el desarrollo con hisopo de dacrón o rayón e introducir el hisopo en un tubo que contiene el medio de transporte de AIMES, cerrar el tubo, sellar con parafilm y rotular el tubo con la clave de microrganismo, anexar la información solicitada (formato único de envío de muestras al InDRE). 4. Enviar inmediatamente por un medio con confiable de mensajería. 5. Avisar por vía telefónica al laboratorio de referencia del envío de las cepas. En caso de que no sea posible el envío inmediato, se puede mantener la cepa en este medio a temperatura ambiente durante cinco días máximo. ALGORITMO DIAGNÓSTICO: 161 162 163 Evaluación 164 Los indicadores de evaluación permiten identificar áreas de oportunidad para mejorar el desempeño del sistema de vigilancia epidemiológica, es decir, permiten detectar puntos críticos, mostrando distintos aspectos de operación del sistema, como son: cobertura de notificación, casos con muestra para diagnóstico, notificación oportuna, letalidad, oportunidad de resultados, red negativa semanal, confirmación de resultados. La evaluación de los indicadores se realizará en todos los niveles técnicoadministrativos, así como en todas las instituciones integrantes del Sector, de forma mensual y cuando así se requiera por la situación epidemiológica. INDICADOR Casos estudiados Notificacion oportuna Red de notificación semanal VALOR MINIMO CONSTRUCCION Total de estudios realizados Total de casos probables Núm. casos reportados en 24 hrs Total de casos notificados x 100 100% x 100 100% x 100 100% x 100 1% x 100 100% x 100 80% x 100 80% Núm. Semanas de las que recibío la red negativa Total de semanas que debieron notificarse Casos que fallecieron Letalidad Total de casos Casos con muestra para diagnóstico Casos con muestras tomadas Oportunidad de resultados Casos con resultados en 5 días Confirmación de bacterias Total de casos probables Total de resultados Núm. estudios confirmados con bacterias en LCR Total de casos compatibles con el agente bacteriano ** La muestra siempre se deberá obtener al primer contacto. 165 TÉTANOS Y TÉTANOS NEONATAL El tétanos es una enfermedad aguda no contagiosa, producida por una endotoxina del bacilo Clostridium tetani el cual prolifera en anaerobiosis en el sitio lesionado y se, caracterizada por rigidez de los músculos esqueléticos de cualquier parte del cuerpo, espasmos de tipo tónico y convulsiones. Agente infeccioso y reservorio. El Clostrodium tetani es un bacilo gram positivo esporulado, móvil y anaerobio, se distribuye ampliamente en suelos o fomites contaminados con heces. Normalmente se halla en los intestinos de ganado equino, vacuno, ovino, perros, gatos, ratas, pollos, cobayos, y seres humanos sanos; además es altamente resistente a los agentes físicos y desinfectantes, variando esta resistencia cuando se trata de su forma vegetativa o de espora Las esporas son altamente resistentes al calor y a la deshidratación; se diseminan fácilmente, sobreviven durante años en el suelo y contaminan las heridas de todo tipo. De las toxinas producidas por el C. tetani, la tetanospasmina o neurotoxina es la más importante en la patogenicidad. Es una proteína y su dosis letal en seres humanos es de menos de 2.5 ug/Kg (microgramos/Kg); la acción de la tetanospasmina es nula en células aisladas. No hay transmisión directa de persona a persona, las esporas de tétanos comúnmente se introducen a través de heridas contaminadas con heces de animales, humanos o polvo, en pacientes quemados, cirugías contaminadas, abortos sépticos o jeringas contaminadas. En cuanto a la anatomía patológica, no hay lesiones características del tétanos, las alteraciones que se encuentran en el sistema nervioso son las que hablan de hiperactividad neuronal sin ninguna especificidad. Cuando los espasmos y contracturas son muy violentos y prolongados pueden producir fracturas, rupturas musculares o desgarros en ligamentos que no son específicos ni constantes. 166 El período de incubación es de 3 a 28 días, aunque puede variar de un día a varios meses, pero el promedio es de 7 días. El período de incubación tiene relación inversa de acuerdo con la cantidad de toxina inoculada, sea cual sea el sitio de la inoculación, la velocidad de transporte a lo largo de las ramas motoras es muy rápida y en pocas horas puede haber fijación de la neurotoxina en los gangliósidos. El tétanos neonatal (TNN) tiene un periodo corto de incubación por lo que los síntomas ocurren hasta en tan solo tres días de la exposición. Habitualmente el sitio de entrada es el muñón umbilical, el cual puede contaminarse en dos momentos: durante el corte del muñón umbilical o durante las curaciones del muñón. A menor tiempo de incubación mayor mortalidad. El primer síntoma en el neonato consiste en una súbita incapacidad para succionar, la disfagia es acentuada por los espasmos laríngeos, seguida de rigidez y espasmos generalizados. Los síntomas por lo común alcanzan su máxima expresión al séptimo día del nacimiento. De primera instancia se presenta rigidez en los músculos maseteros (trismus), siguiendo los músculos abdominales y los músculos paravertebrales, particularmente en los músculos extensores (opistótonos). Los espasmos musculares muestran fluctuaciones y varían según la gravedad del cuadro clínico; los músculos faciales son los más afectados produciendo la risa sardónica; los frecuentes espasmos en los músculos respiratorios, son capaces de producir periodos de apnea que pueden llegar a paro respiratorio, los espasmos son dolorosos, hay rigidez muscular entre uno y otro y son provocados por estímulos externos (luz, ruidos, manipulación del enfermo); la acción de la neurotoxina sobre el hipotálamo y la inmadurez del centro termorregulador en los recién nacidos hace que se registren temperaturas corporales elevadas. El diagnóstico diferencial y el manejo intrahospitalario de los casos se detallan en el Anexo 18. En la patogenia de esta enfermedad se presentan dos periodos definidos que permiten conocer la evolución y gravedad de la enfermedad: – Periodo de incubación: tiempo transcurrido desde la producción de la lesión hasta el primer signo de tétanos. 167 – Periodo de Cole: tiempo transcurrido desde el primer signo hasta el primer espasmo. Clasificación clínica del tétanos neonatal: Grado I o Leve – Período de incubación mayor de 14 días. – Período de Cole mayor de 6 días. – Incapacidad para la succión y la deglución. – Espasmos generalizados, cortos, no violentos. – Trismus leve. – Sin compromiso respiratorio. Grado II o Moderado – Período de incubación de 10 a 14 días. – Período de Cole de 3 a 6 días. – Trismus moderado. – Incapacidad para la deglución y succión. – Espasmos severos. – Sin apnea ni cianosis. Grado III o Grave – Período de incubación menor de 10 días. – Período de Cole menor de 3 días. – Trismus grave. – Incapacidad total para la succión y la deglución. – Rigidez que puede limitar la respiración. – Apnea, espasmo laríngeo. Situación Epidemiológica El tétanos ha tenido una tendencia decreciente en el numero de casos y en las tasas de incidencia en los años de 1945 a 2010. Según la OMS y OPS hasta 2005 aun fallecían 168 cerca de 200 000 casos por tétanos neonatal. Se advierte el mayor número de casos en la era prevacunal, en promedio se registraban de 600 a 800 casos por año. En 1954 se inició la vacunación con toxoide tetánico (TT) en México; al siguiente año se incluyó la vacuna DPT contra difteria, tos ferina y tétanos. A partir de 1961, se observa el continuo descenso de los casos por tétanos no neonatal y las tasas de incidencia estimadas van por debajo de 1 caso por cada 100 000 habitantes. Es decir, la enfermedad es poco frecuente en México. La tasa de letalidad de tétanos neonatal es alta, rebasa el 80 % en casos con periodo de incubación breve. El 5-20 % de niños que sobreviven tendrán secuelas neurológicas como retraso mental leve. Las causas más frecuentes de muerte son los espasmos respiratorios, edema pulmonar, paro respiratorio, bronconeumonía y fiebre muy elevada. De acuerdo con los datos de notificación, el tétanos neonatal en México ha tenido una tendencia decreciente, con 147 casos y una tasa de incidencia de 0.06 casos por cada mil nacimientos estimados en 1990. Para el 2010, se notificaron 2 casos, posterior a un año en el que no se presentaron casos. Sin embargo, la letalidad por este padecimiento ha sido del 70% en los últimos diez años y las secuelas neurológicas en más de 20%. Definiciones operacionales El diagnóstico se hace con base en datos clínicos y epidemiológicos. Los intentos por confirmar el diagnóstico a través de estudios de laboratorio son poco útiles y raramente se aísla el microrganismo y los anticuerpos no son detectables. Por ello el sistema de vigilancia epidemiológica estableció criterios para que el reporte de la enfermedad permita detectar todos los casos y clasificarlos de acuerdo con las definiciones establecidas; cuyo propósito es lograr uniformidad, simplicidad, flexibilidad, sensibilidad y especificidad, en la notificación. Caso probable de Tétanos (TT): Es toda persona mayor de 28 días de edad, que presenta Antecedente epidemiológico y cuadro clínico de comienzo agudo, con uno o más de los siguientes signos y/o síntomas: Trismus, opistótonos, espasmos 169 musculares y/o convulsiones tónico clónicas, posteriores a cualquier tipo de lesión con pérdida de continuidad en tejidos. Caso probable de Tétanos Neonatal (TNN): Se considera caso probable de Tétanos Neonatal a todo recién nacido que lloró al nacer, comió durante los primeros días de vida y que entre el 3° y 28° días posteriores al nacimiento presenta uno o más de los siguientes signos: Trismus, espasmos musculares y/o convulsiones. Criterios para orientar el diagnóstico de un caso probable de tétanos neonatal: Clínicos: trismus, rechazo al alimento o dificultad para la succión, irritabilidad, taquicardia, espasmos musculares al menor estímulo, empuñamiento de manos, rigidez generalizada, opistótonos. Epidemiológicos: madre sin antecedentes de vacunación con TT ó TD, madre con esquema incompleto de vacunación con TT ó TD, sin atención prenatal, atención del parto por partera o personal no capacitado, atención del parto fuera de una unidad médica, corte del cordón umbilical con material no estéril, cuidados del muñón umbilical con material inadecuado, residente en un municipio repetidor o en fase de ataque para tétanos neonatal, cobertura de vacunación en mujeres en edad fértil (MEF) del municipio o localidad, por debajo del 90%. Acciones ante caso por nivel técnico administrativo Nivel Local: 170 Verificar que el caso cumpla la definición operacional de caso probable para establecer el diagnóstico inicial. Notificar la totalidad de los casos probables a través del “Informe Semanal de Casos Nuevos de Enfermedades” SUIVE-1 (Anexo 2), a la Jurisdicción Sanitaria. Notificación al nivel inmediato superior y/o centro de salud más cercano, dentro de las primeras 24 hrs. de conocimiento del caso. Realización del Estudio epidemiológico de caso de TNN (Anexo 19) o Estudio epidemiológico de caso de TT (Anexo 20). Participación con el nivel nacional para el estudio retrospectivo del caso. Notificación inmediata de brotes por el medio más expedito al nivel inmediato superior en el formato de Estudio de Brote (SUIVE-3). En caso de defunción de TNN y TT, personal de la unidad médica tratante deberá obtener copia del expediente clínico (completo, visible, letra legible), y enviarlo a la Jurisdicción Sanitaria correspondiente, que a su vez enviará copia al estado y a la DGE en un periodo no mayor a 5 días hábiles posteriores a la detección de la defunción. En caso de que la unidad médica no cuente con personal de vigilancia epidemiológica, el epidemiólogo jurisdiccional se hará responsable de la obtención del expediente clínico. Nivel jurisdiccional o delegacional: Verificar y validar la información epidemiológica enviada por las unidades de salud. Notificar de manera inmediata los casos probables o defunciones a la Jurisdicción Sanitaria; dentro de las primeras 24 horas de su detección por los servicios de salud. Revisión del llenado correcto de los formatos y evaluación de los casos. Concentrar semanalmente la información del componente de Información Semanal de Casos enviada por las unidades de salud y envío al Nivel Estatal. Recopilación del expediente clínico del caso Apoyo a las actividades de vigilancia epidemiológica y acciones de control. 171 Toma de la muestra de sangre para envío al laboratorio local y al Instituto Nacional de Diagnóstico y Referencia Epidemiológicos (InDRE). Participación con el nivel nacional para el estudio retrospectivo del caso. Notificación inmediata de brotes por el medio más expedito al nivel inmediato superior en el formato de Estudio de Brote (SUIVE-3). Establecer coordinación entre el primero y segundo nivel de atención y otra institución involucrada, incluso institución privada. Requerir muestra de sangre de la madre y el niño o la persona enferma para estudio de anticuerpos específicos en el InDRE y seguimiento de los resultados Participar en las acciones de prevención y control. Participar en la capacitación y adiestramiento del personal en procedimientos de vigilancia, el seguimiento hospitalario y en la toma de muestras para su envío al Laboratorio Estatal de Salud Pública (LESP). Dictaminar todas las defunciones de TNN y TT en el Comité Jurisdiccional en un periodo no mayor de 10 días posteriores al deceso y envío del acta correspondiente a la DGAE. Es Obligatorio contar con toda la información clínicaepidemiológica, así como los resultados de laboratorio de la Red validada por el InDRE. Evaluar en forma mensual los indicadores por institución. Evaluar el impacto de las acciones de prevención y control. Gestionar los recursos necesarios para las actividades de vigilancia epidemiológica. Elaborar y difundir avisos y alertas epidemiológicas en el ámbito jurisdiccional. Difundir los avisos y alertas epidemiológicas elaboradas por el Comité Estatal o Nacional de Vigilancia Epidemiológica. Emitir recomendaciones basadas en el análisis de la información epidemiológica que oriente las acciones de control. Difundir la información epidemiológica a las instancias correspondientes para la toma de decisiones. 172 Mantener actualizado el panorama epidemiológico en los diversos municipios de la Jurisdicción Sanitaria. Nivel estatal: Concentrar, verificar y validar la información enviada por las jurisdicciones. Evaluar la calidad de la información. Notificar inmediatamente los casos y defunciones probables a la DGAE. Concentrar semanalmente la información del componente de Información Semanal de Casos enviada por las unidades de salud y envío a la DGAE. Notificación inmediata de brotes por el medio más expedito al nivel inmediato superior en el formato de Estudio de Brote (SUIVE-3). Supervisar, asesorar y apoyar en la realización de los estudios de caso, brote y defunciones. Participar en la capacitación y adiestramiento del personal en procedimientos de Vigilancia y la vigilancia hospitalaria. Evaluar en el seno del Comité Estatal de Vigilancia Epidemiológica (CEVE) de acuerdo a las funciones y atribuciones establecidas en el Acuerdo Secretarial 130, la información epidemiológica a efecto de orientar las medidas de prevención y control; y realizar la dictaminación de casos y defunciones. Realizar la supervisión y asesoría a las áreas operativas para verificar el cumplimiento de los procedimientos de vigilancia epidemiológica. La dictaminación de los casos deberá estar encaminada a ratificar o descartar los casos o defunciones por TNN. Participar en la capacitación y adiestramiento del personal en procedimientos de vigilancia y la vigilancia hospitalaria. Dictaminar todas las defunciones de TNN en el Comité Jurisdiccional en un periodo no mayor de 10 días posteriores al deceso y envío del acta correspondiente a la DGAE. Debe contar con toda la información clínicaepidemiológica, así como los resultados de laboratorio de la Red validada por el InDRE. 173 Envió del Certificado de Defunción (Anexo 5) y el formato “Reporte de causas de Muerte Sujetas a Vigilancia Epidemiológica” de INEGI (Anexo 6), en un periodo no mayor de cuatro semanas a la Dirección General de Epidemiología, donde se realizó la ratificación o rectificación de la defunción dictaminada por el Comité Estatal de Vigilancia Epidemiológica. Toda defunción en la cual no haya sido tomada muestra para diagnóstico de laboratorio deberá ser dictaminada mediante criterios clínico- epidemiológicos por el Comité Estatal y el CONAVE. Evaluar en forma mensual los indicadores por institución. Evaluar el impacto de las acciones de prevención y control. Gestionar los recursos necesarios para las actividades de vigilancia epidemiológica. Emitir recomendaciones basadas en el análisis de la información epidemiológica que oriente las acciones de control. Difundir los avisos o alertas epidemiológicas a todos los niveles técnicoadministrativos bajo su responsabilidad. Nivel nacional: Normar o actualizar los procedimientos para la vigilancia epidemiológica. Verificar y validar la información enviada por los estados. Coordinar la capacitación y asesorar al personal en salud en materia de vigilancia epidemiológica. Asesorar, supervisar y evaluar las actividades de vigilancia epidemiológica en todos los niveles operativos. Fortalecer la coordinación con el InDRE con el fin de obtener resultados en forma oportuna para la confirmación o descarte de los casos. Supervisar y evaluar las actividades de vigilancia epidemiológica en todos los niveles operativos. Evaluar el sistema de vigilancia epidemiológica. 174 Promover reuniones con el grupo del CONAVE con el propósito de analizar la situación epidemiológica a nivel nacional, reorientando las acciones de manera permanente. Participar en estudios e investigaciones especiales. Evaluar el impacto de las acciones de control. Fortalecer la coordinación interinstitucional mediante reuniones con el CONAVE con el propósito de analizar la situación epidemiológica a nivel nacional, reorientando las acciones de manera permanente. Dictaminar las defunciones por TNN encaminada a ratificar ó rectificar el diagnóstico Tétanos. Para los casos la rectificación deberá en el sistema de información correspondiente. Para las defunciones la rectificación se realizará a través del formato “Reporte de causas de Muerte Sujetas a Vigilancia Epidemiológica” de INEGI (Anexo 6). Evaluar mensualmente el desempeño de los indicadores de evaluación y asegurar el cumplimiento de los mismos. Elaborar avisos o alertas epidemiológicas sobre situaciones de riesgo para su envío a los comités y unidades de vigilancia epidemiológica. Emitir recomendaciones basadas en el análisis de la información epidemiológica que oriente las acciones de control. Mantener actualizado el panorama epidemiológico. Difundir la información epidemiológica. Procedimientos de laboratorio Debido a que el recién nacido presenta inmadurez del sistema inmune y retraso en la producción de anticuerpos, la determinación de antitoxina tetánica tanto en la madre como en el recién nacido, es de apoyo para el diagnóstico. Una mujer vacunada, cuyos títulos son mayores de 0.01u/ml (dilución de 1:4) se consideran 175 protectores, por tanto titulaciones mayores, hacen menos probable la presencia de tétanos neonatal. Debido a la dificultad para aislar el microrganismo el cultivo no es recomendado, y en caso de tener el recurso relacionar el resultado con la clínica. Pruebas diagnósticas: La identificación de anticuerpos de antitoxina tetánica es por hemaglutinación pasiva empleando eritrocitos de carnero tamizados. Se realiza control de calidad con sueros de referencia internacionales de 6 U.I. de antitoxina tetánica. Procedimiento para la toma y envío de muestras: Ante la presencia de un caso sospechoso de TNN se requiere 1ml de sangre venosa de la madre y 0.5ml del recién nacido, verificar que no se haya aplicado antitoxina ni toxoide tetánico o diftérico a la madre y antitoxina tetánica al producto. Las muestras deberán ser recolectadas en condiciones de asepsia y en un recipiente estéril con tapón de hule o de rosca. Se deberá anotar con tinta indeleble o lápiz en el tubo el nombre y la edad de cada uno, así como relacionar ambas muestras. Se deberá enviar el suero separado, para lo cual se empleará un aplicador estéril para remover el coágulo. Si no se cuenta con ello, deberá enviarse la sangre total en refrigeración (4-8°C) en las próximas 48 horas al INDRE. En el caso de haberse aplicado el toxoide, podemos tomar la muestra de ambos antes de ocho días de aplicado el toxoide ó la antitoxina. Criterios de aceptación de la muestra: La muestra debe llegar perfectamente etiquetada, señalando si es primera o segunda toma y el diagnóstico. Acompañada del formato único de envío de muestras (formato de estudio epidemiológico de caso de tétanos), resumen de la historia clínica y oficio de solicitud de estudio. 176 Criterios de rechazo de la muestra: La falta de alguno de los documentos mencionados en los criterios de aceptación de la muestra o las condiciones inadecuadas de la misma son causa de rechazo definitivo y se notificará de inmediato al usuario responsable del envío. 177 ALGORITMO DIAGNÓSTICO: 178 ALGORITMO DIAGNÓSTICO DE TÉTANOS NEONATAL: 179 ACTIVIDADES A REALIZAR EN TÉTANOS NEONATAL: 180 ALGORITMO DIAGNÓSTICO PARA TÉTANOS: 181 ACTIVIDADES A REALIZAR EN TÉTANOS: 182 Evaluación Los indicadores de evaluación permiten identificar áreas de oportunidad para mejorar el desempeño del sistema de vigilancia epidemiológica, es decir, permiten detectar puntos críticos, mostrando distintos aspectos de operación del sistema, como son: cobertura de notificación, oportunidad de la notificación, elaboración del estudio epidemiológico, información completa, clasificación final, letalidad. La evaluación de los indicadores se realizará en todos los niveles técnico-administrativos, así como en todas las instituciones integrantes del Sector, de forma mensual y cuando así se requiera por la situación epidemiológica. Indicadores de vigilancia epidemiológica: Para los casos de tétanos neonatal, se realizará la siguiente evaluación: INDICADOR Notificación oportuna CONSTRUCCION Casos notificados en menos de 24 horas posterior a la identificación del caso VALOR MINIMO x 100 100% x 100 80% x 100 80% x 100 80% x 100 <70% Total de casos notificados. Clasificación final oportuna de casos de TNN No. de casos probables con clasificación final dentro de los 7 días posteriores a su notificación. Total de casos probables notificados. Oportunidad de investigación de casos de TNN Calidad del diagnóstico clínico Letalidad No. de casos probables investigados dentro de los 7 días posteriores a su notificación. Total de casos probables notificados. Casos que cumplen definición operacional. Total de casos notificados. Casos que fallecieron. Total de casos. ** La muestra siempre se deberá obtener al primer contacto. 183 ACTIVIDADES A DESARROLLAR EN CASO DE BROTE El estudio de brote de EPV es la investigación de los factores epidemiológicos de dos o más casos asociados en un área geográfica delimitada. La existencia de un caso único bajo vigilancia especial en un área donde no existía el padecimiento se considera también como brote. Las acciones a desarrollar ante brotes de EPV incluyen: Notificación del brote por la unidad que lo detecte, ésta debe realizarse por el medio más expedito dentro de las 24 horas posteriores a su conocimiento al nivel inmediato superior, hasta ser del conocimiento del nivel federal en este período de tiempo. La notificación deberá ser acompañada de la información mínima que permita identificar el área afectada, el número de casos con los datos clínicos que sustenten su notificación. La investigación del brote deberá iniciarse en las primeras 48 horas de su conocimiento. La información deberá registrarse en los formatos avalados por el CONAVE; Notificación de Brote, SUIVE-3 (Anexo 21) el cual incluirá la investigación epidemiológica individual de los casos. Corresponde al nivel jurisdiccional realizar y dar seguimiento a la investigación de brotes. El estudio del brote debe incluir la investigación epidemiológica individual de los casos. La información mínima indispensable para la caracterización del brote debe incluir: – Número de casos probables y confirmados. – Tasa de ataque. – Caracterización epidemiológica de los casos. – Cuadro clínico. 184 – Diagnóstico presuntivo. – Curva epidémica, muestreo y hospitalizados. – Tendencias. – Acciones de prevención y control. – Impacto de acciones de control. Debe incorporarse la información individual de todos los casos en el sistema de información correspondiente. La clasificación final del brote debe contar con el estudio de laboratorio específico Los brotes deben ser sujetos a seguimiento en el seno de los comités de vigilancia epidemiológica. La conclusión del brote será cuando hayan pasado dos periodos de incubación del padecimiento sin ocurrencia de casos. Los comités de vigilancia epidemiológica deben evaluar el impacto de las acciones de prevención y control. Elaborar el informe final del brote. ANÁLISIS DE LA INFORMACIÓN El análisis epidemiológico debe incluir la caracterización de las variables de persona, tiempo y lugar; y debe incluir comparaciones con periodos anteriores, con otras áreas y tendencias. Si se observan cambios de patrón de una enfermedad es necesario realizar una investigación más detallada para definir si el cambio es real y tomar las medidas adecuadas. Se necesita conocer los patrones específicos de la ocurrencia de las enfermedades para poder identificar los cambios en la incidencia o el riesgo de una enfermedad y para orientar las intervenciones. Se puede obtener esta información solo a través de un proceso continuo y sistemático de consolidación y análisis de datos de vigilancia. 185 Los requerimientos mínimos de análisis para la caracterización descriptiva de los padecimientos por nivel técnico-administrativo, deben incluir: Nivel local: Caracterización de los casos de EPV en tiempo (días o semanas en que se presentan los casos), lugar (zonas o localidades donde se detecta la actividad) y persona (edad, sexo) de las poblaciones que serán monitoreadas por las unidades seleccionadas. Características clínicas de los casos de EPV. Calidad del llenado de los estudios de caso. Calidad de las bases de datos. Agentes etiológicos identificados. Canales endémicos. Brotes identificados. Nivel jurisdiccional o equivalente: Casos y defunciones por localidad y municipio de residencia. Caracterización de los casos de EPV en tiempo (días o semanas en que se presentan los casos), lugar (zonas, localidades o municipios donde se detecta la actividad) y persona (edad, sexo) de las poblaciones que serán monitoreadas por las unidades seleccionadas. Incidencia y mortalidad. Calidad del llenado de los estudios de caso. Base de datos local confiable, oportuna y completa. Canal endémico. Indicadores de evaluación con perioricidad mensual. Características clínicas de los casos de EPV. Indicadores de evaluación. Agentes, cepas y genotipos identificados. 186 Calidad de los estudio de brotes. Consistencia de información entre SUAVE y Sistema de Información de EPV, considerando que siempre debe haber igual o más casos reportados en el primero. Impacto de acciones de prevención y control. Ratificación y rectificación de la causa defunción Situación epidemiológica de las EPV a jurisdiccional. Nivel estatal y/o delegacional: Caracterización de los casos de EPV en tiempo (días o semanas en que se presentan los casos), lugar (zonas donde se detecta la actividad) y persona (edad, sexo) de las poblaciones que serán monitoreadas por las unidades médicas de la entidad. Características clínicas de los casos de EPV. Casos y defunciones por localidad, municipio y jurisdicción de residencia. Incidencia y mortalidad. Calidad del llenado de los estudios de caso. Base de datos confiable, oportuna y completa. Canal endémico. Indicadores de evaluación con periodicidad mensual. Ratificación y rectificación de la causa básica de las defunciones. Agentes, cepas y genotipos identificados. Calidad de los estudio de brotes. Consistencia de información entre SUAVE y Sistema de Información de EPV, considerando que siempre debe haber igual o más casos reportados en el primero. Impacto de acciones de prevención y control. Situación epidemiológica de las EPV a nivel estatal. 187 Nivel federal: Caracterización de los casos de EPV en tiempo (días o semanas en que se presentan los casos), lugar (zonas donde se detecta la actividad) y persona (edad, sexo) de las poblaciones que serán monitoreadas por las unidades médicas de la entidad. Casos y defunciones por estado de residencia. Incidencia y mortalidad. Análisis de la información contenida en la base de datos. Calidad de los estudios epidemiológico de casos. Canal endémico. Indicadores de evaluación con periodicidad mensual. Dictaminación de la causa básica de las defunciones. Características clínicas de los casos de EPV. Agentes, cepas y genotipos identificados. Calidad de los estudio de brote. Consistencia de información entre SUAVE y Sistema de Información de EPV, considerando que siempre debe haber igual o más casos reportados en el primero. Impacto de acciones de prevención y control en casos y brotes. Situación epidemiológica de las EPV a nivel nacional. 188 DIFUSIÓN DE LA INFORMACIÓN Dentro del proceso de vigilancia epidemiológica la notificación de los casos es de suma importancia ya que constituye el detonante de las acciones de control, por ello de acuerdo a la magnitud, trascendencia y vulnerabilidad de las EPV, la notificación es inmediata y semanal; el análisis de los datos recopilados en las unidades de vigilancia epidemiológica del país debe ser difundida a través de reportes impresos o electrónicos que favorezcan la accesibilidad a los datos de acuerdo con lo establecido en el Proyecto de Norma Oficial Mexicana NOM-017-SSA2-2012, en las EPV la difusión de la información es diferenciada y con opciones específicas como las monografías y reporte de encuestas que no tienen un lapso específico como se observa en el siguiente cuadro: Medios de difusión Grupo Subgrupo Padecimiento Código CIE-10 Enfermedades prevenibles por vacunación Enfermedades Transmisibles Semanal Mensual Anual Monografias Difteria Infecciones invasivas por Haemophilus influenzae Poliomielitis Rubéola Sarampión Síndrome de rubéola congénita Meningitis meningocócica Tétanos Tétanos neonatal Tos ferina Enfermedad febril exantemática Enfermedades bajo vigilancia sindromática Parálisis flácida aguda Síndrome coqueluchoide A36 A41.3, G00.0, J14 A80 B06 B05 X X X X X X X X X X X X P35.0 X X X A39.0 A34, A35 A33 A37 X X X X X X X X X X X X S/C S/C S/C X X X X X X X X X X X X Reporte de encuestas 189 CAPACITACIÓN Dado que la capacitación continua del capital humano en epidemiología es fundamental para el logro de los objetivos de la vigilancia epidemiológica de las EPV, los responsables de las unidades de epidemiología en todos los niveles operativos deberán contar con un Programa de Capacitación anual que contemple los siguientes aspectos en su carta descriptiva: 1. El epidemiólogo y su trascendencia en el ámbito de la salud pública. 2. El impacto de la calidad en el proceso de la vigilancia epidemiológica. 3. Panorama epidemiológico. 4. Procedimientos de laboratorio. 5. Medidas de prevención y control. 6. Análisis descriptivo de factores de riesgo. 7. Análisis de la información. 8. Estadística descriptiva (nivel básico). 9. Sistema de información (base de datos, plataforma). 10. Indicadores de evaluación. Los temas deberán sujetarse a los lineamientos descritos en este Manual. El Programa de Capacitación deberá estar dirigido al personal de salud encargado de llevar a cabo la vigilancia epidemiológica de las EPV´s en el nivel local, jurisdiccional y estatal; incluyendo a médicos, enfermeras, técnicos en estadística, y laboratorio de las instituciones del Sector Salud. Previo y posterior al desarrollo del curso los participantes realizaran evaluación escrita. Su periodicidad será definida acorde a la problemática de las enfermedades en la región pero mínimamente se realizará una vez por año. 190 El Programa de Capacitación (incluyendo la Carta Descriptiva y la Evaluación al participante) deberá contar con el aval del área de Enseñanza y Capacitación del nivel correspondiente y el curso constará en las actas de dicha área. COLABORACIÓN INTERINSTITUCIONAL La colaboración interinstitucional se realizará a través de los comités de vigilancia epidemiológica cuyas funciones por nivel técnico-administrativo son: Grupo Técnico del CONAVE: Elaborar, avalar y difundir procedimientos homogéneos para la vigilancia epidemiológica de las EPV. Ante situaciones especiales el grupo técnico modicara los lineamientos de Vigilancia Epidemiológica. Verificar el cumplimiento de los procedimientos de vigilancia epidemiológica de las EPV. Establecer mecanismos para asegurar la obtención de información epidemiológica veraz y oportuna. Analizar la información epidemiológica de manera integral y multidisciplinaria que oriente la toma de decisiones. Establecer las bases y mecanismos de concertación de acciones entre las dependencias y entidades del Sector Salud para consolidar el SINAVE. Coordinar las actividades de supervisión y evaluación en los diferentes niveles técnicos administrativos. Gestionar y participar en la capacitación del personal en los procedimientos de vigilancia, manejod e los sistemas de información, toma y envío de muestras. Proporcionar la asesoría requerida para la adecuada aplicación de los lineamientos de vigilancia epidemiológica de las EPV. 191 Apoyar las acciones de vigilancia epidemiológica en los diferentes niveles administrativos ante la ocurrencia de brotes o urgencias epidemiológicas. Mantener actualizado el panorama epidemiológico de las EPV a nivel nacional. Establecer los mecanismos de evaluación del impacto de las acciones de prevención y control de EPV. Emitir recomendaciones a los comités estatales ante la omisión o falta de cumplimiento de procedimientos establecidos en este documento. Elaborar y aplicar los indicadores de evaluación de las EPV. Garantizar la actualización de la situación epidemiológica de las EPV. Grupo Técnico del CEVE: Difundir los lineamientos de vigilancia epidemiológica de las EPV. Verificar el cumplimiento de los procedimientos de vigilancia epidemiológica de las EPV establecidos en este documento. Implementar los mecanismos para asegurar la obtención de información epidemiológica veraz y oportuna. Analizar la información epidemiológica de manera integral y multidisciplinaria que oriente la toma de decisiones. Coordinar las actividades de supervisión y evaluación del nivel jurisdiccional y local. Apoyar la capacitación del personal involucrado en la vigilancia epidemiológica. Coordinar las acciones y actividades de las instituciones del Sector Salud en aspectos de vigilancia epidemiológica. Proporcionar la asesoría requerida para la adecuada aplicación de los lineamientos de vigilancia epidemiológica de EPV. Apoyar las acciones de vigilancia epidemiológica ante la ocurrencia de brotes o urgencias epidemiológicas. Elaborar el panorama epidemiológico de las EPV. Evaluar el impacto de las acciones de prevención y control de las EPV. 192 Emitir recomendaciones a los comités jurisdiccionales ante la omisión o falta de cumplimiento de procedimientos establecidos para las EPV. Realizar revisiones permanentes de la situación de las EPV sujetos a vigilancia mediante reuniones mensuales o extraordinarias. Garantizar la actualización de la situación epidemiológica de las EPV sujetos a vigilancia epidemiológica. Vigilar la adecuada aplicación los indicadores de evaluación de las EPV. Gestionar y participar en la capacitación del personal en los procedimientos de vigilancia, manejo de los sistemas de información, toma y envío de muestras. Grupo Técnico del COJUVE: Difundir los lineamientos de vigilancia epidemiológica de los padecimientos y eventos sujetos a vigilancia epidemiológica. Verificar el cumplimiento de los procedimientos de vigilancia epidemiológica de las EPV establecidos en este documento. Implementar los mecanismos para asegurar la obtención de información epidemiológica veraz y oportuna. Analizar la información epidemiológica de manera integral y multidisciplinaria que oriente la toma de decisiones. Coordinar las actividades de supervisión y evaluación a nivel local. Gestionar y particpar en la capacitación del personal en los procedimientos de vigilancia, manejo de los sistemas de información, toma y envío de muestras. Coordinar las acciones y actividades de las instituciones del Sector Salud en aspectos de vigilancia epidemiológica. Proporcionar la asesoría requerida para la adecuada aplicación de los lineamientos de vigilancia epidemiológica de las EPV. Apoyar las acciones de vigilancia epidemiológica ante la ocurrencia de brotes o urgencias epidemiológicas. Elaborar el panorama epidemiológico de las EPV. Evaluar el impacto de las acciones de prevención y control. 193 Emitir recomendaciones a los responsables de las unidades de vigilancia epidemiológica ante la omisión o falta de cumplimiento de procedimientos establecidos en el presente documento. Realizar revisiones permanentes de la situación de las EPV sujetos a vigilancia mediante reuniones mensuales o extraordinarias. Garantizar la actualización de la situación epidemiológica de las EPV. Vigilar la adecuada aplicación de los indicadores de evaluación de las EPV. SUPERVISIÓN La supervisión es un proceso planificado y organizado de carácter formativo, de ayuda, asesoría y orientación; su objetivo principal es vigilar que las actividades para la vigilancia epidemiológica de las EPV se realicen acorde a los lineamientos vigentes. El análisis de la problemática de los procedimientos de la vigilancia epidemiológica de las EPV por los responsables de las unidades de vigilancia epidemiológica en todos los niveles operativos, deberá definir las necesidades de supervisión y como resultado se elaborará un Programa de Supervisión anual. Etapas de la supervisión: Diagnóstico de la situación epidemiológica: Comprende la obtención de toda la información epidemiológica de las EPV de las unidades a supervisar, la verificación de la información obtenida de las unidades, así como la evaluación de los indicadores de vigilancia correspondientes. Planeación: Consiste en la elaboración del plan de trabajo que incluye, entre otros aspectos, las actividades a realizar, responsables en los diferentes niveles, cronograma y áreas o unidades a supervisar. Ejecución: Es el proceso propiamente de interacción en el cual se interactúa con los supervisados y se coteja la información obtenida en cada nivel de supervisión. 194 Informe de supervisión: Todas las actividades encontradas, ya sea de buen o inadecuado funcionamiento, deben quedar plasmadas en informe escrito que deberá ser signado de conformidad. En dicho informe deberá quedar plasmados los acuerdos y compromisos derivados de la misma, precisándose los responsables y tiempos de ejecución Para la realización de la supervisión debe contarse con guías de supervisión para cada nivel técnico-administrativo. El contenido general de las guías debe incluir verificación de: Cumplimiento de normatividad. Estructura y Equipamiento. Organización y Coordinación. Vigilancia epidemiológica. Laboratorio. Sistemas de información. Coordinación. Análisis de información y proceso de inteligencia epidemiológica. Capacitación. Difusión. Supervisión. Los resultados de la supervisión y acuerdos establecidos deberán ser del conocimiento y seguimiento de los comités de vigilancia epidemiológica de cada uno de los niveles técnico administrativos, instancias que deberán dar seguimiento al cumplimiento de los mismos. Las supervisiones efectuadas deberán constar en el Informe de Actividades correspondiente a la fecha de su realización; dicho informe debe incluir: La situación encontrada. Los acuerdos establecidos. 195 El plazo de cumplimiento, y Los responsables de su cumplimiento. El informe debe ser elaborado en dos copias para asegurar el cumplimiento de los acuerdos: una para la unidad de vigilancia epidemiológica supervisora y otra para la unidad supervisada. Los resultados deberán ser sujetos a revisión por las áreas involucradas en la operación: CONAVE, CEVES, COJUVES, Vigilancia Epidemiológica, Programas de EPV, Promoción de la Salud, Laboratorio, Atención Médica y Enseñanza/Capacitación Esto con la finalidad de que el seguimiento se enfoque al área del proceso que habrá de fortalecerse. Su periodicidad será definida acorde a los resultados del análisis de la información en cada nivel (ver: Análisis de Información por Nivel) pero mínimamente se realizará una vez por año en las unidades ubicadas en áreas de baja endemia y con la frecuencia que se requiera en aquellas unidades cuyos indicadores de evaluación y/o canales endémicos evidencien silencios epidemiológicos y/o situación de alerta o epidemia. El responsable de la unidad de vigilancia epidemiológica en cada uno de los niveles normativos, (jurisdicción o equivalente, estatal o delegacional y federal de las instituciones del sistema nacional de salud) será el encargado de verificar el cumplimiento del Programa de Supervisión. 196 ANEXOS 197 Anexo 1. Guía de procedimientos para la Vigilancia y Seguimiento de casos importados de Sarampión y Rubéola Es frecuente la notificación de viajeros que han adquirido alguna infección durante su viaje y que son el detonante de acciones cuando representan un riesgo para la salud de la población. Dicho riesgo de transmisión varía de acuerdo a la enfermedad, la infectividad del caso, el modo de transmisión, la ventilación del medio de transporte utilizado (avión, barco, autobús, automóvil, etc.), la dosis de exposición (que depende de la duración del viaje y la proximidad de los pasajeros al caso confirmado) y la susceptibilidad en los viajeros. En los casos de enfermedades infecciosas en viajeros internacionales el riesgo va más allá de los pasajeros y la tripulación, ya que incluye a todos aquellos con los que la persona enferma mantenga contacto como son los trabajadores y otras personas en aeropuertos, puertos marítimos o cruces terrestres. Uno de los sistemas de transporte que por su rapidez de traslado y cantidad de operaciones internacionales diarias se debe priorizar, es el transporte aéreo. La información disponible para decidir cuándo deben ser contactados para su seguimiento los pasajeros en potencial riesgo de infectarse es limitada, sin embargo para tomar la decisión sobre si se deben o no localizar se debe considerar: 1. El riesgo de transmisión, 2. La severidad de la enfermedad, 3. La prevalencia de la enfermedad en el lugar de origen del enfermo o los lugares visitados por este, 4. La existencia de recomendaciones para su prevención, 5. La posibilidad de identificación de los pasajeros expuestos, 6. La factibilidad de implementar medidas de intervención que minimicen el riesgo, y; 7. La habilidad de rastrear a los pasajeros en el menor tiempo posible para establecer medidas de intervención. 198 La literatura refiere que en países como Australia la transmisión del sarampión entre contactos de vuelos internacionales es raro que ocurra aún en pasajeros sentados junto al caso confirmado en período de infectividad, y que su seguimiento es cuestionable dada la alta tasa de inmunidad en dicho país (>95% de cobertura de vacunación) y por los mecanismos de ventilación que se tienen en las aeronaves que filtran el aire de forma lateral e intercambian de manera regular el aire en toda la nave, lo que limita el intercambio de espacio aéreo entre pasajeros. En México se debe considerar la cobertura de vacunación contra sarampión que históricamente ha mantenido excelentes coberturas, y de acuerdo a la información proporcionada por el Centro Nacional para la Salud de la Infancia y la Adolescencia, CeNSIA, en niños de un año de edad se ha mantenido por arriba del 95% en el periodo 2007-2010 según el PROVAC. Asimismo debemos considerar la respuesta inmunológica individual. Objetivos General Establecer los lineamientos de vigilancia epidemiológica que permitan identificar oportunamente casos importados de sarampión y rubéola para orientar las acciones de prevención y control que eviten la reemergencia de la enfermedad en México. Específicos 1. Mantener la sensibilidad del sistema mediante la detección y notificación oportuna del 100% de los casos importados que cumplan con la definición operacional de Enfermedad Febril Exantemática (EFE). 2. Identificar oportunamente los casos importados de sarampión y rubéola y sus contactos con el fin de evitar la dispersión de la enfermedad. 199 3. Reforzar el envío oportuno y completo de muestras de laboratorio para diagnóstico y referencia al Instituto de Diagnóstico y Referencia Epidemiológicos (InDRE). 4. Mantener el monitoreo de la vigilancia virológica (genotipos) de sarampión y rubéola. 5. Fortalecer la coordinación interinstitucional e intersectorial para la atención eficaz y eficiente de potenciales riesgos de reintroducción de sarampión y rubéola a México. Definiciones operacionales Caso Importado: Caso confirmado con antecedente de viaje fuera del país en los 7 a 21 días previos al inicio del exantema en el caso de sarampión y en los 12 a 23 días previos en el caso de rubéola. Caso relacionado a Importación: Caso confirmado con antecedente de nexo epidemiológico con un caso importado en los 21 días previos al inicio del exantema. O bien, caso confirmado donde no se identifica nexo epidemiológico con un caso importado pero que el genotipo viral detectado sugiere importación reciente. (Sin antecedente de viaje). NOTA: Si estos casos persisten por un periodo igual o superior a 12 meses, se consideran endémicos. Consultar la calculadora de tiempos críticos en materia de sarampión disponible en www.dgepi.salud.gob.mx/información Contacto: Cualquier persona que haya estado en contacto directo con un caso confirmado de sarampión y rubéola en período de contagiosidad, por ejemplo: • Todos los miembros del hogar. • Todas las personas que duermen durante la noche en la misma habitación que el caso (hospitales, internados, cuarteles militares, etc.). • Todos los niños y adultos en el cuidado diurno familiar, cuidado infantil, preescolar, escuela o ambiente educativo que comparten un aula con el caso. 200 • Personas que compartieron una sala de espera con el caso confirmado (salas de espera de establecimientos de salud, aeropuertos, puertos marítimos o terrestres, etc.). • Todos los compañeros de trabajo que comparten la misma área. • Para otros que no pueden ser identificados individualmente, pero que pueden haber estado presentes en el área general donde se sabe de presencia de un caso confirmado (cines, centros comerciales o restaurantes, etc.) se debe considerar la necesidad de dar avisos por los medios de comunicación para informarles de su posible exposición. Procedimientos de vigilancia epidemiológica para casos importados de sarampión y rubéola Tomando en cuenta que existen otros factores de riesgo además de los descritos en la literatura, como el que un pasajero en fase infectante entre en contacto en diversos momentos con otros viajeros o la tripulación, como en salas de espera, al entregar documentos, desplazamiento en la nave, etc., se considera conveniente reforzar las campañas de comunicación de riesgos a la población y la estratificación del seguimiento a los contactos durante su viaje. El seguimiento de todos los contactos que haya tenido el caso confirmado en la nave durante su viaje, es una actividad desgastante que mediante mecanismos eficaces y eficientes para su estratificación y localización puede resultar en una actividad altamente efectiva. Acciones ante casos importados de EFE Identificar al 100% de casos de EFE en puntos de entrada internacional y en unidades de salud. Seguir las Estrategia de seguimiento de viajeros internacionales expuestos a un pasajero infeccioso anexo 1.1. Corroborar que en el país de origen del vuelo y/o países visitados por el caso importado durante el periodo de incubación, presenten casos o brotes de sarampión o rubéola. Verificar que el caso cumpla definición operacional de EFE. 201 Notificación inmediata del caso al nivel técnico administrativo superior; en las primeras 24 horas a partir de su detección. Realizar el estudio epidemiológico de caso EFE-1. o Investigar el comportamiento del pasajero durante su viaje (estado anímico, desplazamiento alrededor de la nave, etc.) para fortalecer el análisis de riesgo para los pasajeros que estuvieron en contacto. Registrar el caso en la base de datos de EFE. Reducir al máximo el contacto social del caso. Si el caso fue identificado en la comunidad iniciar las acciones de bloqueo epidemiológico. Determinar cobertura de vacunación en el área del bloqueo. Toma de muestras del caso de EFE al primer contacto con los servicios de salud que incluya en el 100% de los casos muestras de: suero, orina y exudado faríngeo. Envío inmediato de las muestras al Laboratorio Estatal de Salud Pública (LESP) y/o al InDRE de acuerdo al presente documento. Si la muestra es positiva o indeterminada a sarampión en el LESP, éste deberá enviar alícuota al InDRE en un período no mayor a 48 horas; en caso de resultado negativo se deben enviar al InDRE un 2% para control de calidad. Ante resultado negativo a sarampión se deben suspender las acciones del bloqueo epidemiológico. Estratificación de búsqueda de contactos en medios de transporte Definir la estratificación de los contactos con base en un análisis de riesgo que incluya edad, proximidad, actividad del caso dentro de la nave, período de contagiosidad: En caso de tratarse de una aeronave, los pasajeros se estratificarán de acuerdo a su edad y su proximidad al caso importado durante el viaje: • Se eliminarán de la lista de pasajeros a ser localizados a todos los mayores de 39 años. 202 • Se localizarán: A todos los pasajeros menores de 40 años que hayan viajado en la misma fila que el caso importado, así como a los que hayan viajado en las tres filas de adelante y tres filas de atrás (en total siete filas completas). A las familias de todos los pasajeros menores de ocho años sin importar el lugar que ocuparon en la aeronave. Una vez localizados se realizarán las siguientes actividades: • Confirmar que se trata de la persona que se quiere localizar, preguntar si viajó en el medio de transporte que se tiene registrado que fuera utilizado por el caso confirmado de sarampión o rubéola. • Informarles del riesgo de haber estado en contacto directo con el virus del sarampión o rubéola. • Investigar su estatus de vacunación y el de todas las personas que viven en ese domicilio. • En caso de que la comunicación haya ocurrido dentro de las primeras 72 horas de la exposición, ofrecer la vacunación a quienes no tengan el antecedente de acuerdo con lo recomendado por CeNSIA. • Invitarlos a que ante cualquier manifestación de enfermedad febril exantemática, acuda a su centro de salud más cercano a recibir atención. • Se notificará públicamente el caso de importado mencionando la aerolínea y número de vuelo y para alertar a cualquier otro pasajero del vuelo que no fue requerido en la estratificación prioritaria de contactos, que si presenta sintomatología compatible con enfermedad febril exantemática, acuda inmediatamente a su unidad de salud más cercana o lo notifique al número 01-8000044-800 de la Unidad de Inteligencia Epidemiológica y Sanitaria (UIES). Acciones ante casos importados Ante la confirmación de un caso importado deberán realizarse las siguientes acciones de vigilancia epidemiológica: 203 • Confirmación diagnóstica avalada por el InDRE, sin que esto retrase las acciones del bloqueo epidemiológico. • Establecer lugar y tiempo de probable infección de acuerdo a la Calculadora de sarampión, disponible en http://www.dgepi.salud.gob.mx. • Establecer una red negativa de notificación diaria de casos de EFE. • Seguimiento diario de casos probables que incluyan, entre otras actividades prioritarias: estudio de caso, toma y envío inmediato de muestras al laboratorio, valoración de su estado de salud, obtención oportuna de resultados de laboratorio y registro en base de datos. • Contactar a pasajeros de acuerdo a la estratificación realizada mediante el análisis de riesgo. • Identificar contactos del caso en la comunidad. • Seguimiento diario del estado de salud del caso y de los contactos hasta por un tiempo equivalente a dos periodos de incubación máximo (42 días) antes de levantar la alerta. • Continuar las acciones del bloqueo epidemiológico de acuerdo a lo normado por CeNSIA y el Centro Nacional de Programas Preventivos y Control de Enfermedades (CENAPRECE). • En caso de identificar casos secundarios iniciar acciones de bloqueo epidemiológico alrededor de la ubicación del nuevo caso. • Revisar diariamente la situación epidemiológica. • Emitir los reportes de la situación a través de vocero único. • Convocar de manera inmediata a un Grupo Técnico de Trabajo en Sarampión y Rubéola que deberá estar conformado por representantes de la Subsecretaría de Prevención y Promoción de la Salud, la Dirección General de Epidemiología, CeNSIA, CENAPRECE, Dirección General de Promoción de la Salud, Comisión Federal para Protección contra Riesgos Sanitarios (COFEPRIS), Dirección General de Aeronáutica Civil, Secretaría de Relaciones Exteriores y el Comité Nacional de Vigilancia Epidemiológica (CONAVE) para evaluar la situación epidemiológica y elaborar un plan de trabajo integral. 204 Un grupo similar con la equivalencia de las instituciones en cada entidad federativa afectada deberá ser convocado. Evaluar en el seno del grupo la situación epidemiológica y emitir las recomendaciones correspondientes. • Notificación del caso al Punto de Contacto de la Organización Mundial de la Salud (OMS) para el Reglamento Sanitario Internacional (RSI) por parte del Centro Nacional de Enlace para RSI, la Dirección General de Epidemiología. En caso de transmisión sostenida de sarampión (más de 100 casos confirmados o transmisión en todo el país por más de tres meses) la realización de bloqueos epidemiológicos deberá sujetarse a los siguientes lineamientos: 1. De contarse con los recursos para realizar los bloqueos epidemiológicos, estos se realizarán de acuerdo a lo establecido en los lineamientos de Vigilancia Epidemiológica de Enfermedad Febril Exantemática (http://www.dgepi.salud.gob.mx). 2. Cuando se carezca de los recursos materiales o humanos para la realización simultánea de múltiples bloqueos epidemiológicos las actividades a realizarse serán: a. Investigación inmediata de la cobertura global de vacunación contra sarampión en el área afectada por el caso confirmado: I. Si se encuentra por encima del 95%, se puede desistir de realizar el bloqueo epidemiológico de acuerdo a lo normado. II. Si se encuentra por debajo del 95%, revisar en todos los medios posibles la información disponible para acudir a vacunar de forma dirigida a quien no tenga aplicada la vacuna (ej. censo nominal). b. Establecer una campaña de promoción de la salud en la comunidad en la que se debió de hacer el bloqueo epidemiológico con mensajes claros de alerta ante la presencia de EFE, y de revisión de cartillas de vacunación en los domicilios por parte de los jefes de familia. 205 Se debe considerar que la continuación o suspensión de los bloqueos epidemiológicos está estrechamente relacionada con la oportuna toma y envío de muestras de laboratorio de los casos de EFE y la emisión del resultado, por lo que es indispensable cumplir con los procedimientos específicos para esta actividad. De no cumplirse es factible predecir elevados costos superfluos de operación y más importante, la detección tardía de casos y en consecuencia la dispersión del padecimiento en todo el territorio Mexicano. Anexo 1.1: Estrategia de seguimiento de viajeros internacionales expuestos a un pasajero infeccioso 206 Anexo 2. Formato SUIVE-1. Informe semanal de casos nuevos de enfermedades. (pág. 1) 207 Anexo 2. Formato SUIVE-1. Informe semanal de casos nuevos de enfermedades. (pág. 2) 208 Grupo Institución: Localidad: Unidad: ENFERMEDADES PREVENIBLES POR VACUNACIÓN ENFERMEDADES INFECCIOSAS Y PARASITARIAS DEL APARATO DIGESTIVO IMSS 2 83 87 32 42 SARAMPIÓN ( * + # ) B05 RUBÉOLA ( * + # ) B06 PAROTIDITIS INFECCIOSA B26 08 09 02 07 93 04 10 INTOXICACIÓN ALIMENTARIA BACTERIANA ( # ) A05 AMEBIASIS INTESTINAL A06.0-A06.3, A06.9 GIARDIASIS A07.1 OTRAS INFECCIONES INTESTINALES DEBIDAS A PROTOZOARIOS A07.0, A07.2, A07.9 ASCARIASIS B77 ENTEROBIASIS B80 ( + ) HACER ESTUDIO EPIDEMIOLÓGICO 05 INFECCIONES INTESTINALES POR OTROS ORGANISMOS Y LAS MAL DEFINIDAS A04, A08-A09 EXCEPTO A08.0 ( * ) NOTIFICACIÓN INMEDIATA 06 SHIGELOSIS A03 33 VARICELA ( # ) B01 01 90 INFLUENZA ( * + # ) J09-J11 FIEBRE TIFOIDEA ( # ) A01.0 176 ENFERMEDAD INVASIVA POR NEUMOCOCO ( * + # ) A40.3, G00.1, J13 CÓLERA ( * + # ) A00 40 POLIOMIELITIS ( * + # ) A80 101 75 INFECCIONES INVASIVAS POR HAEMOPHILUS INFLUENZAE ( * + # ) A41.3, G00.0, J14 INFECCIÓN POR VIRUS DEL PAPILOMA HUMANO B97.7 99 ENTERITIS DEBIDA A ROTAVIRUS ( * + # ) A08.0 MENINGITIS MENINGOCÓCICA ( * + # ) A39.0 37 137 HEPATITIS VÍRICA A (+ # ) B15 38 82 TOS FERINA ( * + # ) A37 100 86 DIFTERIA ( * + # ) A36 SÍNDROME DE RUBÉOLA CONGÉNITA ( * + # ) P35.0 85 TÉTANOS NEONATAL ( * + # ) A33 HEPATITIS VÍRICA B (+ # ) B16 44 F M 5-9 Semana No. ( # ) ESTUDIO DE BROTE M 1-4 Otras (especificar) 4 Municipio: F IMSS-Prospera 5 Jurisdicción: al: F M F M F M F M F M F M F M F M 65 Y > 60 - 64 50 - 59 45 - 49 SEDENA 8 25 - 44 PEMEX 7 Entidad o Delegación: 20 - 24 DIF 6 de: 15 - 19 Número de casos según grupo de edad y sexo de: 10 - 14 del: Instrucciones: Llene a máquina preferentemente; remita el original al nivel jerárquico inmediato superior y conserve una copia EPI < de 1 año Clave F M TÉTANOS ( * + # ) A34, A35 ISSSTE 3 MENINGITIS TUBERCULOSA ( * + ) A17.0 Diagnóstico y Código CIE 10a Revisión Secretaría de Salud 1 Clave: Informe semanal de casos nuevos de enfermedades SISTEMA NACIONAL DE SALUD M F SEMAR 9 Ign. de 20 M F Total SUIVE-1-2014 TOTAL Anexo 2. Formato SUIVE-1. Informe semanal de casos nuevos de enfermedades. (pág. 3) 209 Grupo ENFS INFECS Y PARASITARIAS DEL APARATO DIGESTIVO ENFERMEDADES INFECCIOSAS DEL APARATO RESPIRATORIO ENFERMEDADES DE TRANSMISIÓN SEXUAL ENFERMEDADES TRANSMITIDAS POR VECTOR 92 SÍFILIS CONGÉNITA ( * + ) A50 89 76 28 88 77 FIEBRE POR DENGUE ( + # ) A90 FIEBRE HEMORRÁGICA POR DENGUE ( * + # ) A91 PALUDISMO por Plasmodium falciparum ( * + # ) B50 PALUDISMO por Plasmodium vivax ( + ) B51 ENCEFALITIS EQUINA VENEZOLANA ( * ) A92.2 FIEBRE AMARILLA ( * + # ) A95 TIFO MURINO ( * + ) A75.2 OTRAS RICKETTSIOSIS ( + ) A79 ( + ) HACER ESTUDIO EPIDEMIOLÓGICO 80 180 TIFO EPIDÉMICO ( * + ) A75.0 ( * ) NOTIFICACIÓN INMEDIATA 78 175 PESTE ( * + # ) A20 81 27 SÍNDROME DE INMUNODEFICIENCIA ADQUIRIDA ( * + ) B20-B24 504 67 INFECCIÓN ASINTOMÁTICA POR VIRUS DE LA INMUNODEFICIENCIA HUMANA ( * + ) Z21 FIEBRE DEL OESTE DEL NILO ( * + # ) A92.3 59 VULVOVAGINITIS AGUDA N76.0 FIEBRE MANCHADA ( * + ) A77.0 20 179 CANDIDIOSIS UROGENITAL B37.3-B37.4 26 22 HERPES GENITAL A60.0 CHANCRO BLANDO A57 TRICOMONIASIS UROGENITAL A59.0 24 21 LINFOGRANULOMA VENÉREO POR CLAMIDIAS A55 25 17 NEUMONÍAS Y BRONCONEUMONÍAS J12-J18 EXCEPTO J18.2, J13 y J14 23 16 INFECCIONES RESPIRATORIAS AGUDAS J00-J06, J20, J21 EXCEPTO J02.0 Y J03.0 INFECCIÓN GONOCÓCICA DEL TRACTO GENITOURINARIO A54.0-A54.2 15 FARINGITIS Y AMIGDALITIS ESTREPTOCÓCICAS J02.0, J03.0 SÍFILIS ADQUIRIDA A51-A53 19 18 FIEBRE PARATIFOIDEA A A01.1 OTITIS MEDIA AGUDA H65.0-H65.1 178 OTRAS SALMONELOSIS A02 TUBERCULOSIS RESPIRATORIA ( + ) A15-A16 03 177 ABSCESO HEPÁTICO AMEBIANO A06.4 14 EPI < de 1 año Clave F M OTRAS HELMINTIASIS B65-B67, B70-B76, B78, B79, B81-B83 Diagnóstico y Código CIE 10a Revisión F M 5-9 ( # ) ESTUDIO DE BROTE M 1-4 F F M F M F M F M F M F M F M F M 65 Y > 60 - 64 50 - 59 45 - 49 25 - 44 20 - 24 15 - 19 Número de casos según grupo de edad y sexo 10 - 14 M Ign. F M F Total TOTAL Anexo 2. Formato SUIVE-1. Informe semanal de casos nuevos de enfermedades. (pág. 4) 210 Grupo Institución: Localidad: Unidad: ZOONOSIS OTRAS ENFERMEDADES EXANTEMÁTICAS OTRAS ENFERMEDADES TRANSMISIBLES ENFERMEDADES DE INTERES LOCAL O REGIONAL ENFERMEDADES BAJO VIGILANCIA SINDROMÁTICA IMSS 2 30 12 103 CISTICERCOSIS B69 TENIASIS B68 TRIQUINOSIS B75 MAL DEL PINTO A67 98 147 SÍNDROME FEBRIL ( # ) R50 M F F M 5-9 Semana No. ( # ) ESTUDIO DE BROTE M 1-4 Otras (especificar) 4 Municipio: F IMSS-Prospera 5 Jurisdicción: al: F M F M F M F M F M F M F M F M 65 Y > 60 - 64 50 - 59 45 - 49 SEDENA 8 25 - 44 PEMEX 7 Entidad o Delegación: 20 - 24 DIF 6 de: 15 - 19 Número de casos según grupo de edad y sexo de: 10 - 14 del: Instrucciones: Llene a máquina preferentemente; remita el original al nivel jerárquico inmediato superior y conserve una copia < de 1 año ( + ) HACER ESTUDIO EPIDEMIOLÓGICO 66 SÍNDROME COQUELUCHOIDE ( * + # ) U99 ( * ) NOTIFICACIÓN INMEDIATA 64 TRACOMA ( + ) A71 PARÁLISIS FLÁCIDA AGUDA ( * + # ) U98 74 ENFERMEDAD POR VIRUS CHIKUNGUNYA A92.0 ENFERMEDAD FEBRIL EXANTEMÁTICA ( * + # ) U97 69 146 ONCOCERCOSIS ( + ) B73 144 145 LEISHMANIASIS CUTÁNEA (+ # ) B55.1 AFECCIÓN NOSOCOMIAL ( + # ) Y95 LEISHMANIASIS VISCERAL(+ # ) B55.0 71 181 TRIPANOSOMIASIS AMERICANA (ENFERMEDAD DE CHAGAS) ( + # ) B57 68 72 CONJUNTIVITIS EPIDÉMICA AGUDA HEMORRÁGICA B30.3 105 36 ESCABIOSIS B86 TOXOPLASMOSIS B58 43 CONJUNTIVITIS H10 MENINGOENCEFALITIS AMEBIANA PRIMARIA ( * # ) B60.2 39 173 OTRAS HEPATITIS VÍRICAS B17-B19 excepto B17.1, B18.2 73 104 HEPATITIS VÍRICA C B17.1, B18.2 TUBERCULOSIS OTRAS FORMAS ( + ) A17.1, A17.8, A17.9, A18-A19 LEPRA ( + ) A30 35 45 ERISIPELA A46 34 31 RABIA HUMANA ( * + # ) A82 ESCARLATINA A38 29 102 EPI Clave LEPTOSPIROSIS ( + # ) A27 ISSSTE 3 BRUCELOSIS A23 Diagnóstico y Código CIE 10a Revisión Secretaría de Salud 1 Clave: Informe semanal de casos nuevos de enfermedades SISTEMA NACIONAL DE SALUD M F SEMAR 9 Ign. de 20 M F Total SUIVE-1-2014 TOTAL Anexo 2. Formato SUIVE-1. Informe semanal de casos nuevos de enfermedades. (pág. 5) 211 Grupo ENFERMEDADES BAJO VIGILANCIA SINDROMÁTIC A ENFERMEDADES NO TRANSMISIBLES NUTRICIÓN 57 58 94 INTOXICACIÓN POR PONZOÑA DE ANIMALES T63, X21, X27, EXCEPTO T63.2 INTOXICACIÓN POR PICADURA DE ALACRÁN T63.2, X22 106 153 174 125 149 150 114 115 116 135 155 INSUFICIENCIA VENOSA PERIFÉRICA I87.2 INTOXICACIÓN POR MONOXIDO DE CARBONO ( + ) T58 CONTACTO TRAUMATICO CON AVISPAS, AVISPONES Y ABEJAS X23 QUEMADURAS T20-T32 ADICCIONES F10-F19 EXCEPTO F10.0 CIRROSIS HEPÁTICA ALCOHÓLICA K70.3 DESNUTRICIÓN LEVE E44.1 DESNUTRICIÓN MODERADA E44.0 DESNUTRICIÓN SEVERA E40-E43 OBESIDAD E66 ANOREXIA Y BULIMIA F50 ( + ) HACER ESTUDIO EPIDEMIOLÓGICO 152 HIPOTERMIA T68 ( * ) NOTIFICACIÓN INMEDIATA 151 HIPERPLASIA DE LA PRÓSTATA N40 91 107 111 INTOXICACIÓN POR PLAGUICIDAS T60 EDEMA, PROTEINURIA Y TRANSTORNOS HIPERTENSIVOS EN EL EMBARAZO, PARTO Y PUERPERIO O10-O16 EFECTOS ADVERSOS TEMPORALMENTE ASOCIADOS A VACUNAS (ETAV) ( * + ) Y58, Y59 109 ENFERMEDAD CEREBROVASCULAR I60-I67, I69 ENFERMEDAD ALCOHÓLICA DEL HÍGADO K70 EXCEPTO K70.3 52 ENFERMEDAD ISQUÉMICA DEL CORAZÓN I20-I25 ÚLCERAS, GASTRÍTIS Y DUODENITIS K25-K29 51 HIPERTENSIÓN ARTERIAL I10-I15 54 47 FIEBRE REUMÁTICA AGUDA I00-I02 128 46 INTOXICACIÓN AGUDA POR ALCOHOL F10.0 GINGITIVIS Y ENFERMEDAD PERIODONTAL K05 112 DIABETES MELLITUS EN EL EMBARAZO O24.4 ASMA J45, J46 49 136 DIABETES MELLITUS NO INSULINODEPEDIENTE (TIPO II) E11-E14 48 127 DIABETES MELLITUS INSULINODEPEDIENTE (TIPO I) E10 110 INFECCIÓN DE VÍAS URINARIAS N30, N34, N39.0 BOCIO ENDÉMICO E01 41 148 EFECTOS DEL CALOR Y DE LA LUZ T67 EPI < de 1 año Clave F M MENINGITIS ( # ) G00-G03 excepto G00.0, G00.1 Diagnóstico y Código CIE 10a Revisión F M 5-9 ( # ) ESTUDIO DE BROTE M 1-4 F F M F M F M F M F M F M F M F M 65 Y > 60 - 64 50 - 59 45 - 49 25 - 44 20 - 24 15 - 19 Número de casos según grupo de edad y sexo 10 - 14 M Ign. F M F Total TOTAL Anexo 2. Formato SUIVE-1. Informe semanal de casos nuevos de enfermedades. (pág. 6) 212 Grupo Institución: Localidad: Unidad: DISPLASIAS Y NEOPLASIAS DEFECTOS AL NACIMIENTO ENFERMEDADES NEUROLÓGICAS Y DE SALUD MENTAL ACCIDENTES OTRAS ENFERMEDADES DE INTERÉS LOCAL Y/O REGIONAL IMSS 2 131 96 ESPINA BÍFIDA ( + ) Q05 LABIO Y PALADAR HENDIDO Q35-Q37 ANENCEFALIA ( + ) Q00 124 126 132 133 122 172 PEATÓN LESIONADO EN ACCIDENTE DE TRANSPORTE V01-V09 ACCIDENTES DE TRANSPORTE EN VEHÍCULOS CON MOTOR V20-V29, V40V79 MORDEDURAS POR PERRO W54 MORDEDURAS POR OTROS MAMÍFEROS W55 MORDEDURA POR SERPIENTE X20 LESIONES POR VIOLENCIA INTRAFAMILIAR Y07.0-Y07.2 HERIDA POR ARMA DE FUEGO Y PUNZOCORTANTES W32-W34 ( * ) NOTIFICACIÓN INMEDIATA 171 123 ENFERMEDAD DE ALZHEIMER G30 170 130 ENCEFALOCELE ( + ) Q01 ENFERMEDAD DE PARKINSON G20 129 DISPLASIA CERVICAL SEVERA Y CACU IN SITU ( + ) N87.2, D06 169 118 DISPLASIA CERVICAL LEVE Y MODERADA ( + ) N87.0-N87.1 DEPRESIÓN F32 97 117 TUMOR MALIGNO DEL CUELLO DE ÚTERO ( + ) C53 M F 1-4 Otras (especificar) 4 Municipio: M 5-9 Semana No. F IMSS-Prospera 5 Jurisdicción: al: F M F M F M F M F M F M F M F M 65 Y > 60 - 64 50 - 59 45 - 49 SEDENA 8 25 - 44 PEMEX 7 Entidad o Delegación: 20 - 24 DIF 6 de: 15 - 19 Número de casos según grupo de edad y sexo de: 10 - 14 del: Instrucciones: Llene a máquina preferentemente; remita el original al nivel jerárquico inmediato superior y conserve una copia EPI < de 1 año Clave F M 119 ISSSTE 3 TUMOR MALIGNO DE LA MAMA C50 Diagnóstico y Código CIE 10a Revisión Secretaría de Salud 1 Clave: Informe semanal de casos nuevos de enfermedades SISTEMA NACIONAL DE SALUD M F SEMAR 9 Ign. de 20 M F Total SUIVE-1-2014 TOTAL 213 Diagnóstico y Código CIE 10a Revisión EPI < de 1 año Clave F M M F 1-4 M 5-9 F F Vo. Bo. DEL EPIDEMIÓLOGO NOMBRE Y FIRMA DEL DIRECTOR Las claves U97 a U99 son códigos provisionales utilizados por el CEMECE y la Vigilancia Epidemiológica, estas causas y sus códigos deberán ser modificados luego de los resultados de la investigación o estudio epidemiológico. M F M F M F M F M F M F M F M 65 Y > 60 - 64 50 - 59 45 - 49 25 - 44 20 - 24 15 - 19 Número de casos según grupo de edad y sexo 10 - 14 Nota: Se debe notificar inmediatamente la presencia de brotes o epidemias de cualquier enfermedad, urgencias o emergencias epidemiológicas y desastres, así como los eventos que considere necesario incluir el Órgano Normativo. Grupo OTRAS ENFERMEDADES DE INTERÉS LOCAL Y/O REGIONAL M Ign. F M F Total TOTAL Anexo 3. Estudio de caso de EFE. SISTEMA NACIONAL DE SALUD FORMULARIO DE ESTUDIO DE CASOS DE ENFERMEDAD FEBRIL EXANTEMÁTICA EFE- 1 I. IDENTIFICACIÓN NÚM. DE CASO ____________ JURISDICCIÓN SANITARIA/EQUIVALENTE _________________________ NOMBRE:__________________________________________________________________________________ Apellidos Paterno Materno Nombre (S) FECHA DE NACIMIENTO ___/___/_____ SEXO: (M) (F) EDAD: ___ (AÑOS) ___ (MESES) DOMICILIO:________________________________________________________________________________ LOCALIDAD:_______________________MUNICIPIO: _____________________________ENTIDAD: ________ II. DATOS DE LA NOTIFICACIÓN-ESTUDIO FECHA NOTIFICANTE INSTITUCIÓN PRIMER CONTACTO CON SERV. DE SALUD ___/___/___ ____________________ _______________ NOTIFICACIÓN A LA JURIS. O EQUIV ___/___/___ ____________________ _______________ NOTIFICACIÓN A LA COORD. ESTATAL ___/___/___ ____________________ ___/___/___ ____________________ ESTUDIO POR UNIDAD O JURIS./EQUIV. ___/___/___ _____________________ _______________ NOTIFICACIÓN A LA DGE ______________ ______________ 214 III. UNIDAD QUE LO ATENDIÓ NOMBRE DE LA UNIDAD: _____________________________________ INSTITUCIÓN: ________________ DERECHOHABIENTE: (Sí) (No) NÚM. EXPEDIENTE: ______________________________________________ NOMBRE DEL MÉDICO TRATANTE: ___________________________ TEL. DE LA INSTITUCION: (01-_____ ) IV. ANTECEDENTES VACUNACIÓN: ANTISARAMPIÓN: ( SÍ ) ( NO ) NÚM. ___ FECHAS: 1a.___/___/____ 2a.___/___/____ 3a. ___/___/____ FECHA DE ÚLTIMA DOSIS ___/___/____ ANTIRRUBÉOLA: ( SÍ ) ( NO ) FECHA ___/___/_____ TIPO DE VACUNA: SARAMPION ( ) TRIPLE VIRAL ( ) RUBEOLA ( ) SARAMPIONRUBÉOLA ( ) PRESENTÓ OTRO EXANTEMA EN LOS TRES MESES PREVIOS A ESTE? ( SÍ ) ( NO ) ESPECIFIQUE LUGAR Y FECHA DE VIAJES REALIZADOS Y/O VISITAS RECIBIDAS EN LOS 21 DÍAS PREVIOS AL INICIO DEL EXANTEMA: __________________________________________________________________________________________ ¿ESTUVO EN CONTACTO CON ALGUNA PERSONA CON LOS MISMOS SÍNTOMAS? (SÍ) (NO) ESPECIFIQUE CON QUIEN, LUGAR Y FECHA:___________________________________________________ ¿ESTUVO EN CONTACTO CON MUJERES EMBARAZADAS? ( SÍ ) ( NO ) ESPECIFIQUE EL LUGAR Y FECHA:__________________________________________________________ V. CUADRO CLÍNICO FIEBRE: ( SÍ ) ( NO ) CUANTIFICACIÓN ____ °C FECHA DE INICIO: ____/____/______ EXANTEMA: ( SÍ ) ( NO FECHA DE INICIO: ____/____/____ FECHA DE TÉRMINO: ____/____/__ 215 TIPO DE EXANTEMA (MARQUE MÁS DE UNO SI ES EL CASO) CONTINÚA CON EXANTEMA: MACULOPAPULAR ( TOS ( SÍ ) ( NO ) ) ¿TERCER DÍA? (SÍ) ( NO ) ¿SEXTO DÍA? (SÍ) (NO) DISTRIBUCIÓN DEL EXANTEMA: _________________________ CORIZA ( SÍ ) ( NO ) CONJUNTIVITIS ( SÍ ) ( NO ) DIARREA ( SÍ ) ( NO ) MANCHAS DE KOPLIK ( SÍ ) ( NO ) ATAQUE AL ESTADO GENERAL ( SÍ ) ( NO ) ESPLENOMEGALIA ( SÍ ) ( NO ) ADENOMEGALIAS: CERVICALES ( ) RETROAURICULARES ( ) SUPRACLAVICULARES ( ) OTROS DATOS CLÍNICOS:___________________________________________________________________ DIAGNÓSTICO(S) DE PRESUNCIÓN: SARAMPIÓN ( ) RUBÉOLA ( ) EXANTEMA SÚBITO ( ) ESCARLATINA ( ) OTRO: _______________________________________________________________________________ VI. MUESTRAS DE LABORATORIO (SOLO PARA CASOS PROBABLES) FECHAS TOMA ENVÍO LLEGADA RESULTADOS SUERO 1 ___/___/_____ ___/___/_____ ___/___/_____ ___/___/_____ ___/___/_____ ___/___/_____ ___/___/_____ ___/___/_____ ___/___/_____ ___/___/_____ SUERO 2 ___/___/_____ ___/___/_____ ORINA ___/___/_____ ___/___/_____ E. FARINGEO ___/___/_____ ___/___/_____ OTROS:________________________________________________________________ RESULTADOS: POSITIVO ( + ) NEGATIVO ( - ) 216 SUERO 1 IGM: SARAMPIÓN ____ RUBÉOLA ____ OTRA ____________________ SUERO 2 IGM: SARAMPIÓN ____ RUBÉOLA ____ OTRA SARAMPIÓN ____ RUBÉOLA ____ OTRA SARAMPIÓN ____ RUBÉOLA ____ OTRA ___________________ ORINA: ___________________ E. FARINGEO: ___________________ PCR:________ GENOTIPO:_______________ OTRO (ESPECIFIQUE): __________________________ VII. ACCIONES DE CONTROL COBERTURA EN EL MUNICIPIO PREVIA AL BLOQUEO: _______% BLOQUEO: NO ( ) SI ( ) INICIO ___/___/_____ TERMINACIÓN ___/___/_____ DOSIS: _____ COBERT: _____% BÚSQUEDA INTENCIONADA DE CASOS: LOCALIDAD ( ) UNID. DE SALUD ( ) OTRAS ( ) ESPECIFIQUE: _________ VIII. SEGUIMIENTO ¿FUE HOSPITALIZADO? ( SÍ ) ( NO ) FECHA ___/___/_____ DÍAS DE HOSPITALIZACIÓN: _________ COMPLICACIONES: DIARREA ( ) NEUMONÍA ( ) OTITIS ( ) ENCEFALITIS ( ) OTRAS ( ) ESPECIFIQUE: ______________________________________ NINGUNA ( ) NÚMERO DE CONTACTOS ESTUDIADOS:____________ EVOLUCIÓN: SANO ( ) CONVALECIENTE ( ) DEFUNCIÓN ( ) FECHA ___/___/_____ SE IGNORA ( ) ¿DURANTE CUÁNTO TIEMPO SE HIZO EL SEGUIMIENTO? _____ DÍAS IX. CLASIFICACIÓN FECHA CRITERIO CRITERIOS: SOSPECHOSO ___/___/_____ ( ) 1.- CLÍNICA PROBABLE ___/___/_____ ( ) 2.- LABORATORIO 217 COMPATIBLE ___/___/_____ ( ) 3.- ASOCIACIÓN EPIDEMIOLÓGICA DESCARTADO ___/___/_____ ( ) ___/___/_____ ( ) 4.- Otro (especifique):___________ CONFIRMADO CASO ÍNDICE: ( SÍ ) ( NO ) CASO PRIMARIO: ( SÍ ) ( NO ) NÚMERO DE CADENA A LA QUE PERTENECE:_______ OTRO DIAGNÓSTICO (ESPECIFIQUE): ________________________________________________________ OBSERVACIONES:__________________________________________________________________________ __________________________________________________________________________________________ ELABORÓ EL ESTUDIO:_____________________________________________________________________ PUESTO: __________________________________ INSTITUCIÓN: __________ TELÉFONO: ____________ EN CASO DE SER MUJER EN EDAD FÉRTIL, LLENE LOS SIGUIENTES DATOS: SISTEMA NACIONAL DE SALUD REGISTRO DE CASOS SOSPECHOSOS DE RUBÉOLA CONGÉNITA ¿ESTA EMBARAZADA? SI ( ) NO ( ) LO IGNORA ( ) ¿PRESENTÓ CUADRO DE EFE DURANTE EL EMBARAZO? SI ( ) NO ( ) NO ( ) SEMANAS DE GESTACIÓN: ______ ¿ESTUVO EN CONTACTO CON UN CASO DE EFE? SI ( ) SEMANAS DE GESTACIÓN: ______ FECHA DE ULTIMA MENSTRUACIÓN: ___/___/_____ SEMANAS DE GESTACIÓN: ________ Anexo 4. Actividades de Prevención y Control 218 Cercos epidemiológicos: Búsqueda intencionada de casos y contactos alrededor del domicilio de los casos primarios en un área de 49 manzanas. Búsqueda activa de casos de EFE y casos de Sarampión en centros laborales, tianguis, mercados, escuelas, y otros establecimientos con potencial de transmisión Verificación de las coberturas de vacunación y aplicación de biológicos a población susceptible Aplicar vacuna de acuerdo a los siguientes criterios: 1. Completar esquema de SR o SRP. 2. Esquema completo con SRP: 1 y 6 años. Población <6 años: Dosis Cero o preliminar. De 6 a 11 meses de vida - una dosis de vacuna SRP. (Esta dosis no se toma en cuenta para el esquema de vacunación) Primera dosis: SRP a los 12 meses de vida. Segunda dosis: SRP a los 6 años de vida. Población de 6 a 39 años de edad: Dos dosis totales de vacuna se consideran protectoras. Si no cuenta con la segunda dosis de vacuna se aplica: ≤10 años: Una dosis de SRP. >10 años: Una dosis de SR Aplicar una dosis de SR a mujeres en edad fértil no embarazadas. Promoción de la salud e información al público. Mantener la vigilancia epidemiológica hasta por 4 periodos largos de incubación después de haber conocido el último caso. 219 RECORRIDOS SISTEMÁTICOS EN ZONAS URBANAS Establecer una secuencia de recorrido, iniciando con la manzana más próxima a la esquina superior del plano y seguir manzana por manzana hacia la derecha. Los edificios habitacionales deben ser considerados como si fueran una manzana, en ellos se deberá conseguir permiso para entrar a los inmuebles, visitar cada departamento que corresponda a viviendas, incluyendo los cuartos de servicio. Es recomendable tener presentes los siguientes puntos: 1. Cada manzana debe recorrerse iniciando en la esquina superior izquierda (NOROESTE) del plano y continuar en la dirección de las manecillas del reloj 2. Ahora bien, dada la diversidad de estructuras y edificios que presenta una zona urbana, como son las vecindades, condominios, unidades habitacionales, etc., es necesario especificar la manera en que se deben recorrer: Las viviendas que encuentren en calles cerradas o privadas, se deben recorrer viendo que éstas permanezcan siempre a la derecha del encuestador 220 El recorrido ordenado y sistemático del interior de los edificios de departamentos se debe iniciar en los pisos inferiores hasta terminar con los superiores Los edificios de una unidad habitacional se consideran, cada uno, como si fueran una sola manzana, siempre y cuando estén rodeados de andadores, pasillos o calles El recorrido al interior de una vecindad también debe efectuarse siguiendo el sentido de las manecillas del reloj, empezando por la puerta principal de la vecindad y dirigirse hacia la izquierda en relación con la posición del entrevistador En aquellas zonas con asentamientos irregulares, como es el caso de los "paracaidistas", ciudades perdidas, el recorrido debe efectuarse por un punto fácilmente identificable que sirva de referencia Todos aquellos refugios (viviendas en cuevas, tubos, puentes) y viviendas móviles (vagones de ferrocarril, trailers, ferias, circos, lanchas, etc.), se registrarán como si fueran una sola manzana, o si es factible, se agruparán con otras cercanas y se formará así un manzana; tal sería el caso de viviendas que se ubican sobre la calle, banquetas o camellones RECORRIDOS SISTEMÁTICOS EN ZONAS RURALES Al inicio, se deberán localizar los límites del área de trabajo asignada; generalmente los límites del área de trabajo coinciden con accidentes naturales (cerros, montañas, ríos, arroyos, etc.) o caminos y estructuras fácilmente identificables (cableados de teléfono y electricidad, presas, etcétera). Estos señalamientos facilitarán el trabajo de localización e identificación del área de trabajo. 221 Cabe mencionar que en las zonas rurales no se puede establecer un patrón único de recorrido, por la gran diversidad que presenta la distribución de las viviendas rurales. En dichas zonas se pueden localizar principalmente los siguientes tipos de localidades: 1. Localidades con manzanas bien definidas: Hay que tener presente que aún en las zonas rurales existen localidades que, por su tamaño e importancia, se disponen en manzanas, igual que ocurre en las áreas urbanas. 2. Localidades con caserío disperso: realizar el recorrido para elaborar, del interior a la periferia de la localidad. Luego se procede a dividir la localidad en pequeños conjuntos de viviendas, de acuerdo con los rasgos culturales y naturales. 3. Localidades ubicadas a lo largo de una vía de comunicación y en riberas: Se iniciará el croquis dibujando la vía de comunicación sobre la cual se encuentra la localidad, tomando como base las viviendas localizadas a la derecha del camino, y una vez cubierta esa área, se continuará con las viviendas del lado izquierdo. 4. Localidades en litorales o playas: siguiendo el procedimiento de los dos casos anteriores. En este caso deberá iniciar por el lado derecho de donde se llega a la localidad RECORRIDOS EN POBLACIÓN ABIERTA En las localidades de menos de 2 500 habitantes, se hará barrido de la población para la búsqueda intencionada de susceptibles, y su vacunación correlativa. Se realizará bloqueo también en localidades de menos de 2 500 habitantes circunvecinas a la del caso. Si alguna localidad circunvecina es mayor a 2 500 habitantes, se decidirá con criterios epidemiológicos la extensión del bloqueo, a partir de los antecedentes de movilidad geográfica del paciente y de las familias visitadas los 21 días previos al inicio de la enfermedad. 222 En las localidades mayores de 2 500 habitantes, se hará barrido de la población para la búsqueda intencionada de susceptibles, y se vacunará un área de 49 manzanas en torno al domicilio del caso confirmado; con criterios epidemiológicos se decidirá la extensión del bloqueo, a partir de los antecedentes de movilidad geográfica del paciente y de las familias visitadas durante los 21 días previos al inicio de la enfermedad, o ante la presencia de más casos. 223 Anexo 5. Certificado de defunción. 224 Anexo 6. Reporte de muerte. 225 226 Anexo 7. Formato de estudio epidemiológico caso de Síndrome de Rubéola Congénita. SISTEMA NACIONAL DE SALUD ESTUDIO EPIDEMIOLOGICO DE RUBÉOLA CONGÉNITA I. IDENTIFICACIÓN DEL PRODUCTO Número de caso ________ Jurisdicción Sanitaria/Equivalente ________ Nombre ______________________________________________________________ Edad ______ Sexo ____ Domicilio completo ____________________________________________________ Teléfono ______________ Localidad _______________________________ Municipio ____________________________ Estado _______ II. DATOS DE LA NOTIFICACIÓN-ESTUDIO Fecha Responsable Institución Primer contacto con Serv. Salud ____/____/______ ____________________ ______________ Notificación a la Jurisd. o Equiv. ____/____/______ ____________________ ______________ Notificación a la Coord. Estatal ____/____/______ ____________________ ______________ Notificación a la DGE ____/____/______ Estudio por Unidad o Juris/Equiv. ____/____/______ ____________________ ______________ ____________________ ______________ 227 III. UNIDAD TRATANTE DE LA MADRE Nombre _______________________________________________ Institución ___________________ Domicilio ______________________________________________ Teléfono _____________________ Diagnóstico ____________________________________________ No. de expediente ______________ IV. ANTECEDENTES Y CUADRO CLINICO DE LA MADRE Edad al momento del parto _________ Ocupación __________________________________ ¿Durante el embarazo presentó un cuadro de EFE? (SI) (NO) Si tuvo un cuadro de EFE: Exantema maculopapular (SI) (NO) Fecha de inicio ___/___/_____ Duración _______días Fiebre (SI) (NO) Fecha de inicio ___/___/_____ Duración _______días Tos (SI) (NO) Coriza (SI) (NO) Conjuntivitis (SI) (NO) Artralgias (SI) (NO) Linfadenopatías (SI) (NO) ¿Tuvo contacto con un caso de EFE o había un brote en su localidad? (SI) (NO) Semanas de gestación al momento del contacto o del cuadro de EFE ____________ ¿Se hizo diagnóstico de rubéola al momento de la enfermedad? (SI) (NO) Diagnóstico clínico (SI) (NO) Diagnóstico por laboratorio (NO) (SI) ¿Estuvo o tiene control prenatal? (SI) (NO) No. de visitas ____________ Vacunación antirrubéola: Dosis ________ Fecha de última dosis ___/___/___ V. ESTUDIOS DE LABORATORIO DE LA MADRE 228 Tipo Toma Envío Llegada ___/___/____ ___/___/____ ___/___/____ ___/___/____ ___/___/____ ___/___/____ ___/___/____ ___/___/____ ___/___/____ Resultado Muestra _________________ ___/___/____ Muestra _________________ ___/___/____ Muestra _________________ ___/___/____ Técnica empleada ________________ Resultado __________ VI. ANTECEDENTES DEL EMBARAZO Y PERIODO PERINATAL Aborto (SI) (NO) Retardo en el crecimiento intrauterino (SI) Parto pretérmino (NO) (SI) Muerte intrauterina (SI) (NO) Muerte precoz o hebdomadal (SI) (NO) Muerte neonatal (SI) (NO) (NO) VII. UNIDAD TRATANTE DEL PRODUCTO Nombre _______________________________________________ Institución ___________________ Domicilio ______________________________________________ Teléfono ____________________ Diagnóstico ____________________________________________ No. de expediente _____________ VIII. ANTECEDENTES Y CUADRO CLÍNICO DEL PRODUCTO 229 Semanas de gestación al nacimiento ________ Peso al nacimiento ______________ Fecha de nacimiento ___/___/_____ Malformaciones aparentes al nacimiento: (SI) Detectadas posteriormente (SI) (NO) (NO) Edad a la que se le (NO) Por cuánto tiempo detectó______________ Seguimiento (SI) ____________________ ¿Vive el niño? (SI) (NO) Fecha de defunción ___/___/___ Causa de la defunción __________________________________________________________________ Diagnóstico anatomopatológico __________________________________________________________ ____________________________________________________________________________________ Fecha de diagnóstico de Rubéola Congénita ___/___/_____ IX. ESTUDIOS DE LABORATORIO DEL PRODUCTO Tipo Toma Envío Llegada Resultado Muestra _______________ ___/___/___ ___/___/___ ___/___/___ ___/___/___ Muestra _______________ ___/___/___ ___/___/___ ___/___/___ ___/___/___ Muestra _______________ ___/___/___ ___/___/___ ___/___/___ ___/___/___ Técnica empleada ________________ Resultado __________ Malformaciones al nacimiento posnatales se desconoce * Anotar fecha de detección* Oculares Cataratas _______ _______ _______ Retinopatía pigmentaria _______ _______ _______ Microftalmia _______ _______ _______ Glaucoma _______ _______ _______ Estrabismo _______ _______ _______ 230 Auditivas Sordera por afección del nervio auditivo _______ _______ _______ Sordera central _______ _______ _______ Lesión del oído medio _______ _______ _______ Defectos motores ________ _________ _________ Retraso mental ________ _________ _________ Meningoencefalitis ________ _________ _________ Microcefalia ________ _________ _________ Alteraciones del comportamiento ________ _________ _________ Alteraciones centrales del lenguaje ________ _________ _________ Autismo ________ _________ _________ Cardiovasculares ________ _________ _________ Persistencia del conducto arterioso ________ _________ _________ Hipoplasia arterio-pulmonar ________ _________ _________ Estenosis supravalvular ________ _________ _________ Estenosis aórtica ________ _________ _________ Comunicación auriculoventricular ________ _________ _________ Tetralogía de Fallot _________ _________ Miocarditis y necrosis del miocardio ________ _________ _________ Proliferación fibromuscular de la íntima ________ _________ _________ ________ _________ _________ Hepatitis ________ _________ _________ Ictericia obstructiva ________ _________ _________ Neurológicas ________ Pulmonares Neumonitis intersticial Gastrointestinales 231 Ortopédicas Radiolucencias óseas ________ _________ _________ Púrpura trombocitopénica ________ _________ _________ Hematopoyesis extramedular ________ _________ _________ Hepatomegalia ________ _________ _________ Esplenomegalia ________ _________ _________ Linfadenopatía ________ _________ _________ Hematopoyéticas Reticuloendoteliales Otra alteración congénita de tipo no clasificable. Describa _______________________ X. CLASIFICACIÓN FINAL Rubéola congénita ( ) Fecha ___/___/____ Infección Intrauterina sin daño al neonato ( ) Fecha ___/___/____ Caso compatible ( ) Fecha ___/___/____ Caso descartado ( ) Fecha ___/___/____ Observaciones ______________________________________________________________ __________________________________________________________________________ Elaboró el estudio __________________________________ Institución _______________ Teléfono __________________________ Fax ___________________________________ Anexo 8. Guía Rápida para el Diagnóstico de Síndrome de Rubéola Congénita 232 Guía Rápida para el Diagnóstico de Síndrome de Rubéola Congénita El Síndrome de Rubéola Congénita (SRC) se presenta cuándo la madre del niño adquiere la infección con el virus de la rubéola durante el primer trimestre de embarazo. Diagnóstico clínico Realizar Historia Clínica completa con búsqueda dirigida de antecedentes maternos de: No haber recibido vacuna contra la rubéola (SR). Enfermedad exantemática durante el primer trimestre de embarazo. Antecedente de contacto con casos que presentaron enfermedad exantemática. Exploración Física, Estudios de Laboratorio y Gabinete: Si usted identifica uno o más de los siguientes signos clínicos: Aparato Visual Retinopatía pigmentaria, catarata: bilateral en el 50% de los casos, microftalmia, corioretinitis. Aparato Auditivo y Sistema Nervioso Central Microcefalia, crisis convulsivas, Sordera central, Sordera Neurosensorial. Aparato Cardiovascular Soplos en área cardiaca, Conducto Arterioso Persistente, defectos del tabique ventricular, estenosis de la arteria pulmonar. 233 Manifestaciones Neonatales Específicas o Todo Recién Nacido con datos de Bajo peso al nacer, hepatoesplenomegalia, Adenopatías, hepatitis, Trombocitopenia, meningoencefalitis, púrpura, focos de radiotransparencia ósea. Vigilancia y Seguimiento del caso probable Notificación inmediata a la Jurisdicción Sanitaria o equivalente. Estudio retrospectivo del caso. Investigación clínica y epidemiológica del caso dentro de las 48 horas posteriores al nacimiento. Recopilación de expediente clínico completo. Investigación por laboratorio: Toma de muestras de Suero, exudado faríngeo y orina, para diagnóstico serológico y aislamiento viral. Investigación de los contactos con interrogatorio y exploración física; verificar antecedente vacunal y serológico, búsqueda de susceptibles y vacunación a mujeres en edad fértil. Seguimiento de mujeres embarazadas sin antecedente de vacunal. Cuando proceda, referencia del caso hasta 2do. o 3er. nivel de atención. Medidas preventivas de transmisión aérea y de contacto. En Hospital: aislamiento del caso para prevención de contagio ó brote, lavado de manos antes y después del contacto con el caso, uso de cubrebocas, lentes, guantes, bata. En el domicilio: Aislamiento del caso, lavado de manos antes y después del contacto con el caso, lavado de ropa, uso de cubrebocas. Continuar con estas medidas hasta que los cultivos de orina y exudado faríngeo sean negativos. Seguimiento del caso hasta su clasificación final por el Comité Nacional de Expertos. Toma de Muestras 234 Tipo de muestra Condiciones de toma Técnica Del nacimiento hasta los 12 meses. Suero Determinación de Transportar en condiciones anticuerpos por de refrigeración dentro de ELISA IgM e IgG las primeras 48 horas Del nacimiento hasta los 12 meses. Exudado faríngeo o nasofaríngeo Hisopo en medio de transporte viral(MTV) Transportar en condiciones rRT-PCR y aislamiento viral de refrigeración dentro de las primeras 48 horas. Del nacimiento hasta los 12 meses. 10-50 mL. en recipiente Orina estéril Transportar en condiciones rRT-PCR y aislamiento viral de refrigeración dentro de las primeras 48 horas 235 Anexo 9. Estudio Epidemiológico de Caso de Parálisis Flácida Aguda PFA ESTUDIO EPIDEMIOLÓGICO DE CASO DE PARÁLISIS FLÁCIDA AGUDA PFA - PAG. 1 NO LLENAR LOS APARTADOS SOMBREADOS EN CASOS DE 15 AÑOS Y MÁS I. DATOS DE IDENTIFICACIÓN DEL PACIENTE NÚMERO DE AFILIACIÓN O EXPEDIENTE: FOLIO: NOMBRE: RFC: APELLIDO PATERNO APELLIDO MATERNO FECHA DE NACIMIENTO: SEXO: DÍA RESIDENCIA ACTUAL: MES CURP: NOMBRE (S) AÑO EDAD: AÑOS MASC. MESES FEM. CALLE: COLONIA: NUMERO EXTERIOR LOCALIDAD: NÚMERO INTERIOR MUNICIPIO: ENTRE CALLE: ESTADO: Y CALLE: AGEB: C.P.: - TELÉFONO: LADA: II. DATOS DE LA UNIDAD NOTIFICANTE ENTIDAD: JURISDICCIÓN: MUNICIPIO: INSTITUCIÓN: CLUES: LOCALIDAD: NOMBRE DE LA UNIDAD: III. DATOS DE LA NOTIFICACIÓN FECHA DE PRIMER CONTACTO CON LOS SERVICIOS DE SALUD: FECHA DE INICIO DE ESTUDIO EPIDEMIOLÓGICO: DÍA MES AÑO DÍA MES AÑO FECHA DE NOTIFICACIÓN A LA JURISDICCIÓN: DÍA MES AÑO IV. DIAGNÓSTICO PROBABLE DIAGNÓSTICO INICIAL: 1=POLIO, 2=PFA V. ANTECEDENTE VACUNAL *(MENORES DE 15 AÑOS DE EDAD) ¿CUENTA CON APLICACIÓN DE VACUNA DE POLIOMELITIS? FECHA DE LA ÚLTIMA DOSIS: 1=SALK, 2=SABIN, 3=NO, 9=SE DESCONOCE DÍA FUENTE: MES AÑO 1=CARTILLA, 2=COMPROBANTE, 3=CENSO NOMINAL, 9=SE DESCONOCE VI. ANTECEDENTES EPIDEMIOLÓGICOS PROCEDENCIA DEL CASO: 1=LOCAL (MISMA ENTIDAD), 2=IMPORTADO (NACIONAL), 3=IMPORTADO (OTRO PAÍS). ¿HA VISITADO LUGARES EN LOS ÚLTIMOS 30 DÍAS? FECHA EN QUE VISITÓ: 1=SI, 2=NO, 9=SE DESCONOCE DÍA SI ES IMPORTADO (NACIONAL): ENTIDAD: SI ES IMPORTADO (OTRO PAÍS): PAÍS: MES MUNICIPIO: AÑO LOCALIDAD: CIUDAD O LUGAR: ¿ESTUVO EN CONTACTO CON CASOS SIMILARES? 1=SI, 2=NO, 9=SE DESCONOCE VII. DATOS CLÍNICOS PRODROMOS (21 DÍAS ANTES DEL INICIO DE LA PARÁLISIS): FECHA DE INICIO DE SIGNOS Y SÍNTOMAS: DÍA MES AÑO INDIQUE EL NÚMERO QUE CORRESPONDA 1=Si / 2=No / 9=se ignora Fiebre Respiratorios Exantema Digestivos Conjuntivitis Mialgias Cefalea Artralgias FECHA DE INICIO DE LA PARÁLISIS/PARESIA: FECHA DE 1a VALORACIÓN NEUROLÓGICA ASCENDENTE Artritis Dolor retrococular Otros: ¿TUVO FIEBRE AL INICIO DE LA PARÁLISIS? DÍA MES AÑO DÍA MES AÑO FECHA DE ESTABILIZACIÓN DE LA PARÁLISIS: PROGRESIÓN Signos meníngeos ¿DÍAS DE INSTALACIÓN? DESCENDENTE 1=SI, 2=NO, 9=SE DESCONOCE MES AÑO IZQUIERDO DERECHO 1= 1 A 5 DÍAS, 2= 6 A 10 DÍAS, 3= 11 A 15 DÍAS, 4= 16 A 20 DÍAS, 9=SE DESCONOCE SIMÉTRICA FECHA DE INICIO PRESENCIA DE PARÁLISIS DÍA 1=SI, 2=NO, 9=SE DESCONOCE DÍA MES AÑO ASIMÉTRICA 1=SI, 2=NO, 9=SE DESCONOCE TIPO IZQUIERDO REFLEJOS DERECHO IZQUIERDO DERECHO SENSIBILIDAD IZQUIERDO DERECHO BRAZOS FECHA DE 2da VALORACIÓN NEUROLÓGICA MUSLOS DÍA MES ¿FUE HOSPITALIZADO? AÑO PIERNAS 1=SI, 2=NO, 9=SE DESCONOCE PIES OPCIONES FECHA DE INGRESO: 1=SI, 2=NO, 9=SE_DESCONOCE FECHA DE EGRESO: DÍA MES AÑO 1=PROXIMAL, 2=DISTAL, 3=AMBOS 1=AUMENTADO, 2=DISMINUIDO, 3=AUSENTE, 4=NORMAL, 9=SE_DESCONOCE 1=ANESTESIA, 2=HIPOESTESIA, 3=NORMAL, 4=HIPERESTESIA, 5=PARESTESIA 1=Si / 2=No / 9=se ignora DÍA MES AÑO Afectación de pares craneales Parálisis respiratoria PFA - PAG. 1 236 PFA - PAG. 2 VIII. GABINETE ELECTROMIOGRAFIA COMPATIBLE CON: POLIOMELITIS: 1=SI, 2=NO NORMAL: 1=SI, 2=NO ¿REALIZADO? 1=SI, 2=NO VELOCIDAD DE CONDUCCIÓN COMPATIBLE CON: POLIOMELITIS: 1=SI, 2=NO NORMAL: 1=SI, 2=NO ¿REALIZADO? 1=SI, 2=NO IX. LABORATORIO FOLIO InDRE ESTUDIO DE LÍQUIDO CEFALORRAQUÍDEO ASPECTO: FECHA: DÍA MES CÉLULAS: xmm3 LEUCOS: xmm3 LINFOS: GLUCOSA: % PROTEÍNAS mg/dl mg/dl AÑO TOMA HECES 1 RECEPCIÓN AL LESP ENVÍO AL InDRE RECEPCIÓN AL InDRE RESULTADO FECHAS DE: DÍA MUESTRA: MES AÑO DÍA MES AÑO DÍA MES AÑO DÍA MES AÑO DÍA MES AÑO 1=ADECUADA, 2=INADECUADA RESULTADO: AISLAMIENTO VIRAL: 1=POSITIVO, 2=NEGATIVO RT-PCR& SERONEUTRALIZACIÓN& RT-PCR TIEMPO REAL** |&| P1=POLIO 1, P2=POLIO 2, P3=POLIO 3, 123=POLIO 1.2. y 3, NP=NO POLIO, N=NEGATIVO, R=REVERTANTE, NR=NO REVERTANTE, S=SALVAJE, M=MEZCLA DE POLIO CON ENTEROVIRUS NO POLIO |**| N=NEGATIVO, EVNP=ENTEROVIRUS NO POLIO, PP=POSIBLE POLIO, PV1-NSL=POLIO 1 NO SABIN LIKE, PV2-NSL=POLIO 2 NO SABIN LIKE, PV3-NSL=POLIO 3 NO SABIN LIKE, PV1-SABIN, PV2 SABIN, PV3 SABIN X. ESTUDIO DE CONTACTOS No. EDAD NOMBRE SEXO AÑOS MESES MAS CONTACTO * FEM I E TOMA DE MUESTRA SI NO FECHA DE TOMA DE MUESTRA DÍA MES AÑO 1 2 3 4 5 6 7 8 *Información de CONTACTO: I=Intradomiciliarios, E=Extradomiciliarios XI. EVOLUCIÓN REVISADO POR: GRUPO DE EXPERTOS: 1=SI, 2=NO CEVE 1=SI, 2=NO COMITÉ NACIONAL: 1=SI, 2=NO FECHA DE REVISIÓN: DÍA DIAGNÓSTICO FINAL: DIAGNÓSTICO FINAL REALIZADO POR: ESTADO ACTUAL: MES AÑO K=POLIO, L=SGB, Q=MIELITIS TRANSVERSA, W=INT. POR KARWINSKIA, V=EVC, C=LESIÓN DEL NERVIO CIÁTICO, N=NEURO INFECCIÓN 1=LABORATORIO/GABINETE, 2=ESTUDIO ANÁTOMO-PATOLÓGICO, 3=ASOCIACIÓN EPIDEMIOLÓGICA 1=CONVALECIENTE, 2=RECUPERADO, 3=SECUELAS, 4=DEFUNCIÓN, 9=SE DESCONOCE CLASIFICACIÓN FINAL: 1=DESCARTADO, 2=CONFIRMADO A POLIOMELITIS POR VIRUS SALVAJE, 3=CONFIRMADO A POLIOMELITIS DERIVADO A LA VACUNA NÚMERO DE FOLIO DEL CERTIFICADO DE DEFUNCIÓN: FECHA DE DEFUNCIÓN: DÍA MES CAUSA BÁSICA: AÑO XII. OBSERVACIÓN OBSERVACIÓNES: XIII. ELABORACIÓN MÉDICO TRATANTE: MÉDICO QUE ELABORÓ EL ESTUDIO EPIDEMIOLÓGICO: MÉDICO QUE AUTORIZÓ: CARGO: TELÉFONO: LADA: PFA - PAG. 2 237 Anexo 10. Valoración Neurológica. Valoración Neurológica. Es frecuente que los casos de PFA acudan o sean referidos a hospitales de segundo o tercer nivel de atención, donde se cuenta con personal más calificado y con material y equipo que facilite su estudio, el diagnóstico y tratamiento. Sin embargo, en ocasiones los pacientes no acuden a atención médica especializada o no se dispone de recursos de laboratorio y gabinete, sumado a que son pocas las unidades que cuentan con servicio de rehabilitación que permita hacer el seguimiento idóneo del enfermo. La exploración neurológica inadecuada lleva a interpretaciones erróneas por lo que se requiere la mayor atención y objetividad por parte del explorador. En niños pequeños es especialmente difícil la evaluación de la sensibilidad y la fuerza muscular, la diferenciación entre normal y anormal es, en ocasiones, imposible, aún con la ayuda de estudios especiales. Por este motivo en los registros solamente serán anotados los datos de los cuales se tiene absoluta seguridad. La exploración requiere de un mínimo de instrumentos médicos que permitan disminuir la subjetividad de las apreciaciones. Para medir la sensibilidad es preciso tener a la mano un objeto con punta y una superficie suave, objetos fríos y calientes y, de mucha conveniencia, un diapasón para valorar la sensibilidad profunda. Para estudiar los reflejos, se debe utilizar un martillo de reflejos, evitando objetos improvisados y para medir la masa muscular es necesaria una cinta métrica, graduada en milímetros. La exploración debe ser sistemática, en forma secuencial (de pies a cabeza por ejemplo) y de manera comparativa (simétrica) en cada segmento del hemicuerpo. Las esferas de la exploración neurológica importantes para el estudio de un caso probable de poliomielitis pueden esquematizarse de la manera siguiente: Exploración de pares craneales, Sistema motor: masa, tono, fuerza y movimiento, reflejos, Sensibilidad, Signos meníngeos. 238 Pares craneales: Los procedimientos para la exploración de los pares craneales son similares a los de la exploración neurológica general. Se mencionan a continuación los aspectos más importantes de la exploración sensitiva y motora de los pares que, con mayor frecuencia, se afectan en la poliomielitis: III. Motor ocular común: su lesión se manifiesta por ptosis palpebral o disminución de la fuerza en el párpado; inerva los músculos ciliares, determinando la forma, tamaño, simetría del iris y la posición y reflejos de la pupila (fotomotor, motomotor y consensual). IV Patético: ausencia del movimiento del ojo hacia adentro y abajo. V Trigémino: se pide al paciente que presione las mandíbulas (mordiendo un abatelenguas), que mueva lateralmente la mandíbula y se palpa la contracción de los músculos temporal y masetero. Sensibilidad a la cara y mucosas, reflejos corneal y maseterino. VI. Motor ocular externo: se observa desviación del ojo hacia adentro y el paciente tiene imposibilidad para mover el ojo hacia afuera. Por lo general, los movimientos oculares (pares III, IV y VI) se exploran por confrontación examinador-paciente y, asimismo, los campos visuales. VII. Facial: proporciona ramas motoras a todos los músculos de la cara; se puede observar asimetría; se explora observando las gesticulaciones del paciente, solicitándole que ponga la cara en reposo, que enseñe los dientes, que silbe, que apriete los dientes, que apriete los ojos, que eleve las cejas, que infle los carrillos; incluye también el reflejo interciliar. La rama sensitiva inerva los dos tercios anteriores de la lengua, que se explora aplicando líquidos de diversos sabores, en cada mitad de la lengua IX y X.Glosofaríngeo y Vago: inervan la laringe, la faringe y el paladar blando. Se puede observar el movimiento y ubicación de la úvula y el paladar simulando el bostezo, observar ronquera o disfonía. XI. Espinal: inerva el esternocleidomastoideo y el trapecio. Se explora la fuerza y el tono de cuello y hombros, simetría de la cintura escapular. 239 XII. Motor de la lengua: inervación motora de la lengua, interviene en la fuerza, posición y movimientos de la lengua. Observar fasciculaciones o desviación de la lengua en reposo y resistencia a un abatelenguas. Los pares IX, X y XII determinan el mecanismo de la deglución. Sistema motor: Masa muscular: Se mide el volumen, requiere una estandarización por mediciones repetidas teniendo cuidado de que se haga en el mismo nivel en cada extremidad, por lo que se recomienda hacer una medición de referencia a partir de alguna de las articulaciones inmediatas; es importante comparar desde el periodo agudo hasta los 60 días. Tono muscular: El tono, dado por la tensión del músculo en reposo, se mide por la resistencia pasiva al movimiento. Se explora por palpación, determinando la consistencia del músculo y observando la resistencia al movimiento en flexiónextensión, supinación-pronación. Fuerza y movimiento: Marcha: Incluye la observación de actitud, conformación, posiciones anormales y la marcha en sí; en niños pequeños puede ser sustituida por la valoración de la motilidad espontánea. Indica fuerza muscular y alteraciones a otros niveles, como tono y trastornos cerebelosos. Se recomienda incluir marcha normal, de puntas, de talones, de "cojito", "punta-talón" y correr. Se debe tener en cuenta que el niño brinca mejor con la pierna de su "lateralidad", es decir, con la pierna derecha si es diestro. Movilidad de grupos musculares específicos: Debe incluir los movimientos espontáneos de todas las articulaciones, flexión-extensión, rotación, aducciónabducción; de manera pasiva, activa y contra diferentes grados de resistencia, con el propósito de valorar la fuerza. Para registrar la fuerza muscular se recomienda la siguiente clasificación. 1-. Ausencia de movimientos y contracción 2-- Esbozos de contracción, sin movimientos 3-. Movimientos leves, sin gravedad 240 4-. Movimientos contra gravedad 5-. Movimientos contra poca resistencia 6-. Fuerza normal Es importante registrar si la debilidad afecta más a grupos musculares proximales (poliomielitis) o distales (Guillain-Barré), y si es o no simétrica. Reflejos Músculo-esqueléticos: Consisten en la estimulación con un golpe rápido y de intensidad moderada del tendón de ciertos músculos, se recomienda explorar: plantar, aquileano, rotuliano, radial, cubital, bicipital y tricipital en las extremidades; en niños es importante el pectoral. La tensión provoca hiperreflexia, si es total y simétrica se considera normal, por lo que deberá evitarse la tensión en el niño, haciendo que cuente, que haga fuerza o que observe un objeto llamativo por ejemplo. Cutáneos: Es la estimulación con un objeto romo y con intensidad moderada de la superficie cutánea, los reflejos más comunes en la exploración son los abdominales, cremasteriano, anal y palpebral. Reflejos anormales: Son especialmente importantes: o Babinski: consiste en la estimulación de la parte externa de la planta del pie procediendo hacia la parte interna y hacia arriba. Normalmente provoca flexión de los dedos, la respuesta patológica (en mayores de un año) es la separación de los dedos "en abanico" y la extensión acentuada del dedo gordo, hacia arriba. o Clonus: se hace estimulando manualmente, en forma intensa, la rótula (clonus rotuleano), extendiendo el pie (clonus aquíleo) o la mano (clonus carpal); la respuesta positiva desencadena un movimiento rítmico de flexión y extensión que puede agotarse espontáneamente o al tacto. Signos meningeos. Rigidez de nuca: se explora con el niño en decúbito dorsal, hay resistencia a la flexión del cuello al levantarlo por la cabeza. 241 Brudzinsky: a) cefálico, en decúbito dorsal se flexiona la barba sobre el pecho, provocando dolor y flexión de las rodillas, y b) contralateral, se extiende la cabeza hacia un lado y al flexionar el cuello doble la rodilla contralateral. Kernig: En decúbito dorsal, se flexiona una pierna y rodilla en 90 grados, al flexionar el cuello se provoca la flexión de la otra pierna. Sensibilidad. En niños, la exploración de la sensibilidad es especialmente difícil, por lo que se recomienda seguir los siguientes puntos: a) Explicar el objetivo, el procedimiento y la forma de comunicación (respondiendo "sí o no", "igual, más o menos", "frío o caliente", o bien, "suave o áspero" por ejemplo). Deberá estar convencido de que no se le va a lastimar. b) Condicionamiento: que responda, viendo, de acuerdo a la forma estipulada de comunicación y al tipo de estímulo, en varias ocasiones, hasta que comprenda el mecanismo del examen. c) Examen en sí, con los ojos cerrados, alternando sitios y con los diversos estímulos. La exploración de la sensibilidad incluye: Superficial o cutánea: Comprende el estudio del tacto, dolor y temperatura, por medio de objetos suaves (hisopo), punzantes o ásperos (alfiler o palillo), y a diferentes, temperaturas (tubos con agua fría y tibia). Profunda o músculo-articular: Sensibilidad a la vibración, especialmente en superficies ósea y articulaciones, con la ayuda de un diapasón; y propioceptiva, sensibilidad a la palpación profunda de masas musculares. La sensibilidad, especialmente la superficial, debe explotarse teniendo en cuenta la distribución de los dermatomas, haciendo el estudio en círculo alrededor de las extremidades, con una separación aproximada de tres a cinco centímetros entre cada punto estudiado. Las alteraciones de la sensibilidad incluyen anestesia, hipoestesia, hiperestesia, disestesia y parestesia. Cuando haya un nivel sensorial se recomienda marcarlo con tinta para, en exploraciones subsecuentes, valorar su evolución. 242 Anexo 11. Estudio Epidemiológico de Tosferina SISTEMA NACIONAL DE SALUD ESTUDIO EPIDEMIOLOGICO DE TOS FERINA I. IDENTIFICACION - PACIENTE Núm ero de Cas o Nom bre y apellidos Dom icilio com pleto Localidad JS / DELEG No. Lab. Estatal No. InDRE Edad Telefono Sexo Municipio Es tado II. DATOS DE NOTIFICACION - ESTUDIO Fuente de notificación: Inmediata ( ), Rutinaria ( ), VEA ( ), Laboratorio ( ) Fecha Fecha Fecha Fecha Fecha Fecha Fecha BROTE Responsable SI( ) NO( ) Teléf ono Prim er Contacto con Serv. de Salud Ingres o al Hos pital Notificación a la Juris d. / Deleg. Notificación a la Coord. Es tatal Notificación a la DGE Es tudio por Unidad / Juris . / Deleg. Sem. Notif ic. III. UNIDAD TRATANTE Nom bre C.S./Hosp./Clin. Dom icilio Derechohabiente Médico Tratante SI( ) NO( Ins titución Teléfono Núm . de Expediente ) IV. ANTECEDENTES Vacunado contra Tos ferina ? SI( ) NO( ) No. Dos is Fecha de últim a dos is Tipo de vacuna ( 1- DP T, 2 - P entavalente, 3 - Hexavalente, 4 - Tdap, 5 - Otra, 6 - Ninguna, 9 - Igno ra ) Fuente de inform ación ( 1- Cartilla, 2 - Otro registro , 3 - Verbal, 9 - Igno rado ) ¿ Ha tenido contacto con cas os s im ilares en las últim as 6 s em anas ? SI( ) NO( ) ¿ Ha viajado o recibido vis itas en las últim as 6 s em anas ? SI( ) NO( ) Lugares vis itados y fechas V. CUADRO CLINICO Fecha de inicio de la To s Tos Tos Tos Tos Tos Tos SI( paroxís tica es pas m ódica en acces os em etizante cianotizante SI( SI( SI( SI( SI( ) ) ) ) ) ) NO( ) ) ) ) ) ) NO( NO( NO( NO( NO( Semana de inicio Duració n de la To s días Es tridor laríngeo ins piratorio Hem orragia conjuntival, otras Epis odios de apnea o cianos is Fiebre SI( ) NO( ) Cuantif icación SI( NO( SI( ) ) SI( ) NO( ) ) NO( ) ºC Otros datos clínicos Diagnós tico Inicial SI( Tratam iento con antibiótico: ) NO( a) Antibiótico b) Antibiótico c) Antibiótico d) Antibiótico e) Antibiótico Com plicaciones Evolución Fecha de Defunción SI( ) NO( ) ) Fecha Duración días Fecha Duración días Fecha Duración días Fecha Duración días Fecha Duración días Es pecificar (1- Sano , 2 - Co nvalenciente, 3 - Defunció n, 4 - Ho spitalizado , 5 - Traslado , 9 - Igno rado ) Fecha de Egres o Hos pitalario 243 SISTEMA NACIONAL DE SALUD ESTUDIO EPIDEMIOLOGICO DE TOS FERINA VI. ESTUDIOS DE LABORATORIO Y GABINETE Biometría hem. SI( ) NO( ) Fecha Leucocitos Linfocitos % D e t e c c i ón de B or de t e l l a p e r t u ssi s Fecha de To ma Fecha de Envio Cultivo PCR -TR Resultado Final Laboratorio Lab. que procesa la muestra Radiologia (Rx Torax) Fecha de Llegada Fecha de Resultado Resultado ( 1- P o sitivo , 2 - Negativo , 3 - P ro ceso , 4 - Sin muestra, 5 - Inadecuada, 9 - Igno rado ) ( 1- Lab. InDRE, 2 - Lab. Estatal, 3 - Lab. P rivado , 4 - Lab. Ho spital, 9 - Igno rado ) VII. ACCIONES DE CONTROL Bloqueo SI( ) NO( ) Fecha Inicio de Bloqueo Cobertura en el municipio antes del bloqueo Cobertura en el municipio posterior al bloqueo Búsqueda de Contactos o más Casos ? SI( ) NO( ) Fecha Término de Bloqueo % % Especifique el lugar Dosis aplicadas en Bloqueo VIII. CLASIFICACION DEL CASO Fecha Probable ( ) Atípico ( ) Confirmado ( ) Diágnos tico Fecha Descartado ( ) ( Caso co nfirmado po r labo rato rio , co n sinto mas respirato rio s inespecífico s, o casio nales o leves ) ( 1- Laboratorio, 2- Asociación epidemiológica, 3- Clínica ) Final Observaciones IX. IDENTIFICACION Y ESTUDIO DE CONTACTOS Estudio de Contactos SI( ) NO( ) Número de Contactos Nombre 1 Edad Contacto domiciliario SI( ) NO( ) Parentesco con el caso Tos o sintomas respiratoriosSI( ) NO( ) Días con tos Ha recibido dosis de vacuna contra la Tos ferina ? SI( ) NO( ) Cuantas dosis? ( 1- DP T, 2 - P entavalente, 3 - Hexavalente, 4 - Tdap, 5 -Otra, Tipo de vacuna aplicada Tiempo aprox. de última dosis de vacuna aplicada contra Tos ferina Fecha de toma del Cultivo Fecha de toma de PCR Clasificación de contacto 1 * Resultado del Cultivo * Resultado de PCR * 6 - Ninguna, 9 -Igno ra ) Tomó Antibiótico ? * ( 1- Posit ivo, 2 - Negat ivo, SI( ) NO( ) Semana de C lasif icicación 3 - Proceso, 4 - Sin M uest ra, 5 - Inadecuada ) (1-Conf irmado Lab., 2 - Conf . Asociación, 3 -Conf . Clí nica, 4 -Descart ado, 5 -Probable, 6 -Conf . At í pico, 7 -Port ador posit ivo Lab.) Nombre 2 Edad Contacto domiciliario SI( ) NO( ) Parentesco con el caso Tos o sintomas respiratoriosSI( ) NO( ) Días con tos Ha recibido dosis de vacuna contra la Tos ferina ? SI( ) NO( ) Cuantas dosis? ( 1- DP T, 2 - P entavalente, 3 - Hexavalente, 4 - Tdap, 5 -Otra, Tipo de vacuna aplicada Tiempo aprox. de última dosis de vacuna aplicada contra Tos ferina Fecha de toma del Cultivo Fecha de toma de PCR Clasificación de contacto 2 Sexo * Resultado del Cultivo * Resultado de PCR Sexo 6 - Ninguna, 9 -Igno ra ) Tomó Antibiótico ? * ( 1- Posit ivo, 2 - Negat ivo, SI( ) NO( ) Semana de C lasif icicación 3 - Proceso, 4 - Sin M uest ra, 5 - Inadecuada ) (1-Conf irmado Lab., 2 - Conf . Asociación, 3 -Conf . Clí nica, 4 -Descart ado, 5 -Probable, 6 -Conf . At í pico, 7 -Port ador posit ivo Lab.) P a ra re s pue s t a de re s ult a do de C ult iv o y P C R , ut iliza r lo s núm e ro s ubic a do s de nt ro de lo s c o rc he t e s 1- 2 - 3 - 4 - 5- 244 CONTINUA - IDENTIFICACION Y ESTUDIO DE CONTACTOS SISTEMA NACIONAL DE SALUD ESTUDIO EPIDEMIOLOGICO DE TOS FERINA Nombre 3 Edad Sexo Contacto domiciliario SI( ) NO( ) Parentesco con el caso Tos o sintomas respiratorios SI( ) NO( ) Días con tos Ha recibido dosis de vacuna contra la Tos ferina ?SI( ) NO( ) Cuantas dosis? ( 1- DP T, 2 - P entavalente, 3 - Hexavalente, 4 - Tdap, 5 -Otra, 6 - Ninguna, 9 -Igno ra ) Tipo de vacuna aplicada Tiempo aprox. de última dosis de vacuna aplicada contra Tos ferina Tomó Antibiótico ? * ( 1- Posit ivo, 2 - Negat ivo, Fecha de toma del Cultivo * Resultado del Cultivo Fecha de toma de PCR Clasificación de contacto 3 Fecha de toma de PCR Clasificación de contacto 4 * Resultado del Cultivo * Resultado de PCR * ( 1- Posit ivo, 2 - Negat ivo, * Resultado del Cultivo * Resultado de PCR * ( 1- Posit ivo, 2 - Negat ivo, Fecha de toma de PCR Clasificación de contacto 7 SI( ) NO( ) Semana de C lasif icicación SI( ) NO( ) Semana de C lasif icicación 3 - Proceso, 4 - Sin M uest ra, 5 - Inadecuada ) (1-Conf irmado Lab., 2 - Conf . Asociación, 3 -Conf . Clí nica, 4 -Descart ado, 5 -Probable, 6 -Conf . At í pico, 7 -Port ador posit ivo Lab.) * Resultado del Cultivo * Resultado de PCR * ( 1- Posit ivo, 2 - Negat ivo, SI( ) NO( ) Semana de C lasif icicación 3 - Proceso, 4 - Sin M uest ra, 5 - Inadecuada ) (1-Conf irmado Lab., 2 - Conf . Asociación, 3 -Conf . Clí nica, 4 -Descart ado, 5 -Probable, 6 -Conf . At í pico, 7 -Port ador posit ivo Lab.) Nombre 7 Edad Sexo Contacto domiciliario SI( ) NO( ) Parentesco con el caso Tos o sintomas respiratorios SI( ) NO( ) Días con tos Ha recibido dosis de vacuna contra la Tos ferina ?SI( ) NO( ) Cuantas dosis? ( 1- DP T, 2 - P entavalente, 3 - Hexavalente, 4 - Tdap, 5 -Otra, 6 - Ninguna, 9 -Igno ra ) Tipo de vacuna aplicada Tiempo aprox. de última dosis de vacuna aplicada contra Tos ferina Tomó Antibiótico ? Fecha de toma del Cultivo ) 3 - Proceso, 4 - Sin M uest ra, 5 - Inadecuada ) (1-Conf irmado Lab., 2 - Conf . Asociación, 3 -Conf . Clí nica, 4 -Descart ado, 5 -Probable, 6 -Conf . At í pico, 7 -Port ador posit ivo Lab.) Nombre 6 Edad Sexo Contacto domiciliario SI( ) NO( ) Parentesco con el caso Tos o sintomas respiratorios SI( ) NO( ) Días con tos Ha recibido dosis de vacuna contra la Tos ferina ?SI( ) NO( ) Cuantas dosis? ( 1- DP T, 2 - P entavalente, 3 - Hexavalente, 4 - Tdap, 5 -Otra, 6 - Ninguna, 9 -Igno ra ) Tipo de vacuna aplicada Tiempo aprox. de última dosis de vacuna aplicada contra Tos ferina Tomó Antibiótico ? Fecha de toma del Cultivo Fecha de toma de PCR Clasificación de contacto 6 NO( * Nombre 5 Edad Sexo Contacto domiciliario SI( ) NO( ) Parentesco con el caso Tos o sintomas respiratorios SI( ) NO( ) Días con tos Ha recibido dosis de vacuna contra la Tos ferina ?SI( ) NO( ) Cuantas dosis? ( 1- DP T, 2 - P entavalente, 3 - Hexavalente, 4 - Tdap, 5 -Otra, 6 - Ninguna, 9 -Igno ra ) Tipo de vacuna aplicada Tiempo aprox. de última dosis de vacuna aplicada contra Tos ferina Tomó Antibiótico ? Fecha de toma del Cultivo Fecha de toma de PCR Clasificación de contacto 5 ) Semana de C lasif icicación 3 - Proceso, 4 - Sin M uest ra, Resultado de PCR 5 - Inadecuada ) (1-Conf irmado Lab., 2 - Conf . Asociación, 3 -Conf . Clí nica, 4 -Descart ado, 5 -Probable, 6 -Conf . At í pico, 7 -Port ador posit ivo Lab.) Nombre 4 Edad Sexo Contacto domiciliario SI( ) NO( ) Parentesco con el caso Tos o sintomas respiratorios SI( ) NO( ) Días con tos Ha recibido dosis de vacuna contra la Tos ferina ?SI( ) NO( ) Cuantas dosis? ( 1- DP T, 2 - P entavalente, 3 - Hexavalente, 4 - Tdap, 5 -Otra, 6 - Ninguna, 9 -Igno ra ) Tipo de vacuna aplicada Tiempo aprox. de última dosis de vacuna aplicada contra Tos ferina Tomó Antibiótico ? Fecha de toma del Cultivo SI( * Resultado del Cultivo * Resultado de PCR * ( 1- Posit ivo, 2 - Negat ivo, SI( ) NO( ) Semana de C lasif icicación 3 - Proceso, 4 - Sin M uest ra, 5 - Inadecuada ) (1-Conf irmado Lab., 2 - Conf . Asociación, 3 -Conf . Clí nica, 4 -Descart ado, 5 -Probable, 6 -Conf . At í pico, 7 -Port ador posit ivo Lab.) Elaboró No mbre (s) A pellido P aterno A pellido M aterno Cargo / Puesto * Firma P a ra re s pue s t a de re s ult a do de C ult iv o y P C R , ut iliza r lo s núm e ro s ubic a do s de nt ro de lo s c o rc he t e s Institució n Teléfo no 1- 2 - 3 - 4 - 5- N o t a : P a ra re gis t ra r m á s c o nt a c t o s , f a v o r de e s c ribir a l re v e rs o de la ho ja o a djunt a r o t ra 245 Anexo 12. Estudio Epidemiológico de Difteria SISTEMA NACIONAL DE SALUD ESTUDIO EPIDEMIOLOGICO DE DIFTERIA I. Identificación: Número de caso ________ Jurisdicción Sanitaria/Delegación ______ Nombre ______________________________________________________________ Edad ______ Sexo ____ Domicilio ____________________________________________________________ Teléfono ______________ Localidad _______________________________ Municipio ____________________________ Estado _______ II. Datos de la Notificación-Estudio: Brote _______ Fecha Responsable Institución Primer contacto con Serv. de Salud ____/____/_____ ____________________ ______________ Notificación a la Jurisd. o Deleg. ____/____/_____ ____________________ ______________ Notificación a la Coord. Estatal ____/____/_____ ____________________ ______________ Notificación a la DGE ____________________ ______________ Estudio por Unidad o Juris/Deleg. ____/____/_____ ____________________ ______________ ____/____/_____ III. Unidad tratante: Nombre ________________________________________________________ Institución _________________ Domicilio ____________________________________________________________ teléfono ______________ Derechohabiente ( SI ) ( NO ) No. de Expediente ________________________________________ Diagnóstico _____________________________________ Médico __________________________________ IV. Antecedentes: Vacunación con DPT o Td: Dosis___________ Fuente de información: Cartilla ( ) Fecha de la última dosis ____/____/_____ Otro registro ( ) Verbal ( ) Ha tenido contacto con casos similares en las últimas 4 semanas? (NO) (SI) Especifique: __________________ 246 Ha viajado o recibido visitas en las últimas 4 semanas? (NO) (SI) Especifique: __________________________ V. Cuadro clínico: Fecha de inicio del cuadro clínico: ____/____/____ * Marque con una X los datos que presenta Membranas: Blanco-grisaceas ( ) duras ( ) borde hiperémico ( ) adherentes ( ) fácilmente sangrantes ( ) fétidas ( ) Localización: ___________________________________________________________________ Fiebre: ( SI ) Disfangia: ( SI ) Adenomegalías: SI ) ( NO ) ( NO ) ( SI ) Escalofrío: ( SI ) ( NO ) Disfonía: ( SI ) ( NO ) ( NO ) Cuello de toro: ( ( NO ) Malestar general: ( SI ) ( NO ) Edo. toxi-infeccioso ( SI ) ( NO ) Lesiones en la piel: Tipo ______________________________ Localización ___________________________ Otros datos clínicos: _________________________________________________________________________ Complicaciones: _____________________________________________________________________________ Tratamiento: Antibióticos ____________________________________________________________________ Fechas: a) ____/____/_____ b) ____/____/_____ c) ____/____/_____ d) ____/____/_____ Antitoxina: ( SI ) ( NO ) Fecha: ____/____/_____ Evolución: Fecha ____/____/_____ Sano ( Dosis: __________________________________ ) Convaleciente ( ) Defunción ( ) Se ignora ( ) VI. Estudios de laboratorio y gabinete: 247 Corynebacterium Toma Envío Llegada Resultado Cultivo 1 ____/____/____ ____/____/____ ____/____/____ ____/____/____ Cultivo 2 ____/____/____ ____/____/____ ____/____/____ ____/____/____ Cultivo 3 ____/____/____ ____/____/____ ____/____/____ ____/____/____ Cultivo 4 ____/____/____ ____/____/____ ____/____/____ ____/____/____ Descripción de los resultados positivos: ___________________________________________________________ Toxigenicidad: ______________________________________________________________________________ VII. Acciones de control: Cobertura en el municipio previa al bloqueo: ______% Bloqueo: ( SI ) ( NO ) Inicio ____/____/____ Termino ____/____/____ Cober. _________% Dosis ______ Búsqueda de casos: Comunidad ( ) Escuela o trabajo ( ) Unidades de salud ( ) Otras ( ) Especifique: _____________________________________________________________ VIII. Clasificación: Fecha Caso sospechoso: Caso probable: Caso confirmado: ( ) ____/____/____ ( ) ____/____/____ ( ) ____/____/____ Caso compatible ( ) ____/____/____ Difteria cutánea: ( ) ____/____/____ Portador asintomático: ( ) ____/____/____ Conviviente: ( ) ____/____/____ 248 Contacto: ( ) ____/____/____ Asoc. epidemiológica: ( ) ____/____/____ Caso descartado: ( ) ____/____/____ Diagnostico __________________ IX. Observaciones: ______________________________________________________________________ ______________________________________________________________________ ______________________________________________________________________ Elaboró el estudio __________________________________________________ Fecha: ___/____/_____ Cargo _____________________________ Inst. _________________________ Teléfono __________________ 249 Anexo 13. Estudio de caso de Infecciones Invasivas por Haemophilus influenzae b. SISTEMA NACIONAL DE SALUD FORMATO DE ESTUDIO DE CASO DE INFECCIONES INVASIVAS POR Haemophilus influenzae “b” Número de registro I__I__I I__I__I__I I__I__I Hospital Consecutivo Entidad No. I. I__I__I Juris/Deleg. Identificación. (años meses) (1=M 2=F) Nombre __________________________________ Edad I__I__I.I__I__I Sexo I__I Domicilio _______________________________________________ AGEB __________ Localidad ________________________________ Municipio ______________________ Entidad ________________________________ Jurisdicción I___I___I Nombre de la unidad tratante ________________________________________________ Institución I____I (1=SSA, 2=IMSSord., 5=IMSSsol., 3=ISSSTE, 4=Otros 6=DIF, 7=PEMEX, 8=SEDENA, 9=SEDEMAR). A continuación todas las preguntas donde la respuesta sea si, no o ignorado, se deberá colocar en el espacio asignado la clave correspondiente: 1=si, 2=no, 9=Ign. Y las fechas deberán anotarse en orden de: día, mes y año. II. Datos de la Notificación- Estudio Fecha de ingreso al Hospital I___I___I_____I Fecha de notificación a la Jurisdicción I___I___I_____I Fecha de notificación a Nivel Central Institucional I___I___I_____I III Antecedentes vacunales* Anote en el recuadro correspondiente al biológico y la fecha de aplicación. 1a. Dosis 2a.Dosis 3a.Dosis Refuerzo Otras H. influenzae b Pentavalente Heptavalente Datos corroborados por: Cartilla I___I Otro ¿cual? ______________________ IV. Otros antecedentes epidemiológicos Ha tenido contacto con otros pacientes con infecciones respiratorias agudas similares? I___I Ha tenido otro cuadro similar a éste? I___I Fecha I___I___I___I Acude a alguna guardería, escuela u otros I___I Nombre_______________ V. Cuadro clínico Fecha de inicio de signos y síntomas - Síndrome infeccioso I___I - Síndrome meníngeo I___I - Síndrome de hipertensión intracraneana I___I - Daño neuronal I___I I___I___I_____I - Dificultad respiratoria I___I - Derrame pleural I___I - Infección articular local I___I - Otros datos clínicos de importancia ____________________________________ 250 VI. Estudios de laboratorio y gabinete Diagnóstico radiológico ______________________________________________________ (para los casos de derrame pleural o artritis) Resultados de laboratorio: Tipo de muestra I____I (1=LCR, 2=liq. pleural., 3=liq. sinovial, 4=orina, 5=hemocultivo, 6=otro) ¿Se realizó estudio citoquímico? I___I Fecha I___I___I_____I Prueba Fecha de Toma Fecha de Resultado R e s u l t a d o, H.i. Positivo Negativo Aglutinación Látex Coaglutinación Cultivo Resultados del cultivo: Se envío cepa a laboratorio de referencia I___I Fecha I___I___I_____I Gérmen _____________________ Serotipo ____________ Biovariedad ____________ Resistencia antimicrobiana ___________________________________________________ Resultado final en caso de haber sido la muestra negativa a H.i. por aglutinación/coaglutinación _________________________________________________ VII. Complicaciones al momento del egreso ¿Presentó alguna complicación I___I ¿Cual? _______________________________ Fecha de egreso ___/___/____ Diagnóstico:____________________________________ ¿Presentó secuelas? I___I ¿Cual? _______________________________ (ej.: crisis convulsivas, higroma, hipoacusia, retraso psicomotor, CID, etc.) Tratamiento antimicrobiano _______________________________________________ Recibió tratamiento previo con esteroides I___I. Anote _______________________ VIII. Acciones de Control en caso de ser positivo a Haemophilus influenzae Bloqueo I___I Fecha Inicio I__I__I____I Término I__I__I____I Cobertura(%) I__I IX. Clasificación final (anote la fecha) Caso confirmado I___I___I_____I Caso descartado I___I___I_____I Caso compatible I___I___I_____I Diagnóstico final: _______________________________ _______________________________ El seguimiento a los 3, 6 y 18 meses, se anota en el Concentrado Mensual de Casos. Elaboró el estudio ______________________________ Fecha de elaboración I___I___I_____I Cargo:_________________________ 251 Anexo 14. Concentrado de actividades 252 Anexo 15. Red de Notificación Negativa Semanal SISTEMA DE VIGILANCIA EPIDEMIOLÓGICA DE ENFERMEDADES PREVENIBLES POR VACUNACIÓN RED DE NOTIFICACIÓN NEGATIVA SEMANAL Estado Semana Epidemiológica Núm. RED DE UNIDADES PRIORITARIAS INSTITUCIÓN UNIDADES NOTIFICADORAS UNIDADES NOTIFICANTES 0 0 PFA EFE TNN TOSFERINA TÉTANOS ADULTO Edad COBERTURA Fecha RED DE NOTIFICACIÓN NEGATIVA COBERTURA UNIDADES NOTIFICADORAS UNIDADES NOTIFICANTES 0 0 SX. COQUELUCHOIDE DIFTERIA TB MENÍNGEA INFLUENZA RUBÉOLA MENINGITIS ETAV HIB 0TROS Sexo Fecha de Nacimiento Domicilio Localidad Inicio Padecimiento % % SSA IMSS ISSSTE OTRAS SEDENA TOTAL Casos nuevos notificados Nombre SEMANA EPI Diagnóstico FUENTE: ESTUDIO EPIDEMIOLÓGICO Realizó Revisó Autorizó 253 Anexo 16. Estudio de caso para Meningitis FORMATO DE ESTUDIO DE CASO PARA ENFERMEDAD MENINGOCOCCICA I. DATOS DE IDENTIFICACIÓN DEL PACIENTE No. de afiliación o expediente Folio RFC NOMBRE Apellido paterno Apellido materno CURP Nombre (s) DATOS DEL NACIMIENTO Fecha de nacimiento Estado de nacimiento día mes año Municipio de nacimiento SEXO: m f EDAD: Años Meses RESIDENCIA ACTUAL Domicilio Callle y Número Colonia o localidad Localidad Municipio Entre calle Estado Y calle II. DATOS DE LA UNIDAD NOTIFICANTE C.P. Teléfono (Si = 1, No = 2, Ignorado = 9) CLUES: PRIMERA UNIDAD TRATANTE: ES PRIVADA PERTENECE A UNA INSTITUCIÓN CLAVE DE LA UNIDAD: NOMBRE: ESTADO: INSTITUCION: MUNICIPIO JURISDICCIÓN LOCALIDAD: DOMICILIO SEGUNDA UNIDAD TRATANTE ES PRIVADA PERTENECE A UNA INSTITUCIÓN CLAVE DE LA UNIDAD: NOMBRE: ESTADO: INSTITUCION: MUNICIPIO JURISDICCIÓN LOCALIDAD: DOMICILIO III. DATOS DE LA NOTIFICACIÓN FECHA DE PRIMER CONTACTO FECHA DE NOTIFICACIÓN A LA JURISDICCIÓN día CON SERVICIOS DE SALUD mes año FECHA DE INICIO DE ESTUDIO POR día LA JURISDICCIÓN mes año IV. DIAGNÓSTICO INICIAL Meningitis PB día mes año día mes año FECHA DE NOTIFICACIÓN A LA DGE DIAGNÓSTICO FINAL: Meningococcemia Meningitis Meningococcemia Otro Especifique: V. ANTECEDENTES EPIDEMIOLÓGICOS PROCEDENCIA: Local Foráneo HA VISITADO LUGARES en los últimos 10 días Si No FECHA en que visitó día País Estado HA TENIDO contacto con casos similares No Si FECHA de contacto ACUDE A una guardería, escuela u otro No Si Especifique ES PORTADOR de una enfermedad crónicaNo Si Cuál VI. CUADRO CLÍNICO mes año Municipio Localidad (Si = 1, No = 2, Ignorado = 9) Fecha de inicio de signos y síntomas: día Temp. Fiebre mes 37 año oC Postración Malestar súbito DATOS DE CHOQUE SX HEMORRÁGICO DATOS NEUROLÓGICOS Fecha de inicio Fecha de inicio Rechazo al alimento Hipertensión arterial Fecha de inicio Brudzinski día día mes año día mes mes año año Afectación de pares craneales Alteración del estado de alerta Taquicardia Petequias Vómitos Irritabilidad Convulsiones Palidéz Hemorragia Náuseas Rigidez de nuca Letargia *Fontanela abombada Cefalea Kerning Alt. del habla Otros Hipotensión arterial Oliguria VII. MANEJO ANTIMICROBIANO Nombre del antibiótico: 1) Vía de administración: oral parenteral Fecha de inicio: 2) Vía de administración: oral parenteral Fecha de inicio: 3) 4) 5) 5) Vía de administración: Vía de administración: Vía de administración: Vía de administración: oral oral oral oral parenteral parenteral parenteral parenteral Fecha de término: día mes año día mes año día mes año día mes año día mes año día mes año día mes año día mes año día mes año día mes año día mes año día mes año Fecha de término: Fecha de inicio: Fecha de término: Fecha de inicio: Fecha de término: Fecha de inicio: Fecha de término: Fecha de inicio: Fecha de término: 254 VIII. LABORATORIO CLÍNICO ESTUDIO DE LÍQUIDO CEFALORRAQUÍDEO*: Fecha: Aspecto: día mes Células: Leucos mm3 % Linfos % PMN % Glucosa mg/dl año Proteinas mg/dl Bacterias Tinción de gram Aglutinación en latex *Repetir de acuerdo a la evolución del enfermo IX. LABORATORIO DIAGNÓSTICO 1: LCR, 2= sangre, 3= lesiones petequiales, 4=Cepa Tipo de muestra Fecha de estudio en laboratorio Hospitalario: día Tipo de muestra Fecha de envío a la Jurisdicción: mes año día Prueba Fecha de resultado Fecha de envío al InDRE: día Fecha de estudio en laboratorio Hospitalario: mes año día Fecha de envío a la Jurisdicción: mes año mes año mes año Fecha de envío al InDRE: día mes año día Resultado : Diagnóstico InDRE: Fecha: Tinción de Gram día mes año día mes año día mes año día mes año día mes año día mes año Marque con una X el resultado al que fue positivo Aglutinación en latex 1=Si 2=No día mes Cultivo LCR 1=Si Hi Sp Nm Serogrupo Otra bacteria: Hi Sp Nm Serogrupo Otra bacteria: año día mes año día mes año 2=No Cultivo sangre Hi Producción de beta-lactamasa: Sp Nm Positivo Serogrupo Otra bacteria: Negativo CONCENTRACION INHIBITORIA MINIMA (CIM) E-Test ANTIBIOTICO LECTURA (mg/dl) Resultado* Sensibilidad antimicrobiana: Especifique el método utilizado Antibiótico probado Sensible: Intermedio: Resistente: CIM PENICILINA µg/mL CIM CEFTRIAXONA µg/mL CIM CIPROFLOXACINA µg/mL µg/mL CIM CLORANFENICOL µg/mL CIM RIFAMPICINA * 1=Sensible 2=Intermedio 3=Resistente X. ESTUDIO DE CONTACTOS sexo No. Nombre contacto edad M F profilaxis 1=intradomiciliario/ 1=Si / 2=No / 2=extradomiciliario 9=se ignora XI. EVOLUCIÓN Y CLASIFICACIÓN EVOLUCIÓN FUE HOSPITALIZADO No Si Fecha de ingreso ALTA POR DEFUNCIÓN mes año día Laboratorio mes Fecha de la defunción Urgencias mes Piso Terapia intensiva año Folio día CLASIFICACIÓN FINAL REALIZADA POR: INGRESO A : Fecha de egreso día ALTA POR MEJORÍA Causa básica año Asociación epidemiológica XII. OBSERVACIONES día NOMBRE Y FIRMA DE QUIEN LLENÓ EL FORMATO NOMBRE Y FIRMA DE QUIEN AUTORIZÓ mes año FECHA DE ELABORACIÓN 255 Anexo 17. Estudio de contactos para meningitis Nombre de quien elabora : NUM DEL CASO NOMBRE DEL CASO FORMATO PARA ESTUDIO DE CONTACTOS PARA ENFERMEDAD MENINGOCÓCCICA Fecha de estudio: NOMBRE DEL CONTACTO EDAD SEXO CONTACTO PROFILAXIS I E si no ANTIBIOTICO DIAS DE RELACION CON EL CASO ANTIBIOTICO Contacto : Cualquier persona que en el hogar, escuela, trabajo u otro sitio de reunión que se expone cara a cara a las gotas de saliva por estornudos, tos o hablar con un caso (probable o confirmado a una distancia máxima de 91 cm) o cuando se comparte en proximidad por más de una hora en un espacio cerrado sin ventilación, ó personal de salud que se expone a secreciones en procedimientos de aspiración y/o broncoscopía. 256 Anexo 18. Protocolo de manejo intrahospitalario PROTOCOLO DE MANEJO INTRAHOSPITALARIO El paciente con Tétanos Neonatal se debe manejar de forma integral y el tratamiento está encaminado hacia los siguientes componentes: 1. Sitio de entrada: En el recién nacido, el principal sitio de entrada de las esporas es el cordón umbilical, por lo que se debe realizar un aseo adecuado, curación diaria del muñón umbilical con agua, jabón y solución antiséptica así como eliminación del material necrótico y resección quirúrgica si es necesario. 2. Antibióticos: Eliminación de las formas vegetativas de C. tetani responsables de la producción de la neurotoxina. La penicilina sódica cristalina es el antibiótico de elección a dosis de 100,000UI/Kg/día dividido en 2 dosis en los menores de 7 días. Para los recién nacidos con más de 7 días de vida la dosis es de 100,000UI/Kg/día dividido en 4 dosis. La duración del tratamiento es de 10 a 14 días. 3. Asistencia respiratoria: Para evitar la hipoxia causada por los espasmos se debe asegurar un adecuado apoyo a la función ventilatoria. En los casos leves son suficientes las aspiraciones de secreciones y el aporte de oxígeno. Los neonatos con tétanos moderado-grave, debido al riesgo elevado que tienen para desarrollar complicaciones secundarias a los episodios frecuentes de hipoxia, deberán ser intubados en forma electiva y temprana. La intubación electiva tiene como ventaja facilitar el manejo con barbitúricos y con los relajantes neuromusculares. 257 4. Control de espasmos: El principal objetivo es controlar los espasmos con medicamentos que causen sedación y relajación. El diazepam en el recién nacido ha demostrado buenos resultados, la dosis debe ser individualizada de acuerdo a la gravedad y respuesta del paciente. En los casos de tétanos leve la dosis es de 1. 5- 4 mg/Kg/día por sonda orogástrica (SOG) dividida en 4 tomas, en infusión continua o en bolo. Cuando la ruta de administración es por la vía oral, el paciente debe estar exento de cualquier anormalidad en la función intestinal, que altere la adecuada absorción del medicamento. En tétanos moderados y graves la administración intravenosa es la indicada y la dosis es de 4-10 mg/Kg/día dividida cada 6 hrs en infusión continua o en bolo. Si los espasmos no se logran yugular con la dosis establecida, deberá ser ajustada con incrementos de 0.5 mg/Kg/dosis hasta alcanzar la respuesta deseada, puede pasarse por bolos no diluido. (Véase el flujograma para el manejo del diazepam) 5. Los medicamentos sedantes de segunda elección en el control de los espasmos son: - Fenobarbital a dosis de 10-15 mg/Kg/día por SOG dividido en 3 tomas la dosis. - Midazolam IV de 5-15 mg/hr en infusión continua. En casos graves o moderados de rápida evolución se puede requerir de relajantes neuromusculares del tipo de: - Bromuro de pancuronio 0.05-0.1 mg/Kg IV cada 4 a 6 hrs. - Vecuronio 0.01mg/Kg Dosis inicial y cada 2 hrs. por razón necesaria (PRN). 258 6. Inmunoterapia: Neutralizar la tetanospasmina que todavía no entra al SNC. Existen 2 antitoxinas la homóloga y la heteróloga. La antitoxina homóloga es la gammaglobulina hiperinmune antitetánica humana, se debe administrar tan pronto como se controlen los espasmos. Se ha demostrado que a dosis única de 500 U.I es tan efectiva como a dosis elevadas. La dosis es dividida en 2 sitios diferentes. La mitad se infiltra a nivel periumbilical. 7. Nutrición: Los pacientes con tétanos neonatal tienen elevados requerimientos nutritivos, por lo que es fundamental tenerlos en un balance nitrogenado positivo. Se puede iniciar con alimentación enteral por sonda orogástrica, pero si el vaciamiento gástrico esta alterado o existe alguna otra contraindicación de la vía oral, se deberá cambiar por nutrición parenteral. 8. Ambiente tranquilo: Evitar en lo posible cualquier estímulo (luz, ruidos, manipulación innecesaria del paciente) para no desencadenar los espasmos. De preferencia el paciente debe ser atendido en una sala de terapia intensiva, o por personal de enfermería entrenado en el manejo de estos pacientes. 9. Tratamiento de las complicaciones: - Hiperactividad simpática (hipertensión arterial y/o taquicardia persistente) Propanolol a dosis de 0.01-0.1 mg/Kg/dosis cada 6 hrs. -En atelectasias: drenaje postural, aspiración selectiva y/o broncoscopía. - En presencia de neumonía de adquisición intrahospitalaria: el manejo inicial deberá ser con dicloxacilina y amikacina por 2 semanas en dosis habituales. Dicloxacilina 100-200 mg. I.V. cada seis horas por siete días + amikacina 20 mg./Kg./día/cada 24 horas una sola dosis I.V. 259 10. Inmunización: Al remitir la enfermedad aplicación del esquema de vacuna permanente lo más apegado posible a lo establecido en el Esquema Nacional de Inmunizaciones. Esquemas de tratamiento para el manejo de tétanos neonatal. Medicamentos y Dosis Diazepam 1ª. elección Tétanos leve Tétanos grave V.OG 5-10mg/kg/ en 4 1.5-4 mg/Kg/día dosis día en en 4 tomas infusión o bolo Observe Función Intestinal Función respiratoria Función Fenobarbital 10-15 mg/kg/día 10-15 mg/kg día IV Intestinal y 2ª. elección Por sog en 3 en bolo o infusión respiratoria o tomas continua Intube 2ª. elección Midazolam 5-15 MG/H No hay En infusión Intubar continua Bromuro de 0.05-0.1 Pancuronio Bloqueador --------------- neuromuscular MG/KG/DOSIS C/4-6 H Bromuro de 10-15 Mg Vecuronio Kg/dosis Agente bloqueador ------------------ no despolarizante. Intubar Repetir Intubar c/1-2h Diagnósticos Diferenciales de tétanos neonatal. Padecimiento Hipocalcemia Estudios que deben solicitarse en caso de sospecha Hallazgos Determinación en sangre de Ca Ca menor de 7mEq sérico Q-T prolongado 260 ECG medición del intervalo Q-T Hemorragia USG cráneo Hemorragia parenquimatosa intracraneal TAC de Cráneo Hemorragia subaracnoidea por trauma Hemorragia subdural obstétrico Hemorragia ventricular Deficiencia USG cráneo congénita de los o factores de la TAC de cráneo coagulación Factores de la coagulación Hemorragia en el SNC Deficiencia del factor VIII, IX, XI, V, VII, X. Meningitis bacteriana Tiempos de coagulación Prolongados ** Punción lumbar Células > 35 Citoquímico Proteínas > 170 mg Glucosa baja PMNs > 61% Coaglutinación Positiva Cultivo de LCR Positivo Hemocultivo Positivo ** Recordar que en las meningitis bacterianas no hay trismus ni espasmos musculares, y la punción lumbar sólo estará indicada si la sospecha de meningitis es alta. Flujograma para el manejo del diazepam * Si con la dosis establecida no se logra el control de los espasmos y de la rigidez, se deberá ajustar la dosis, con incrementos de 0.5mg/Kg/dosis hasta obtener el control de los espasmos. Para lograr la sedación y la relajación muscular en los casos de tétanos neonatal moderados y graves, se utilizan dosis elevadas de barbitúricos y relajantes musculares; la depresión respiratoria es frecuente, por lo que estos pacientes deberán ser intubados en forma electiva. 261 Anexo 19. Estudio de caso de Tétanos neonatal 262 263 Anexo 20. Estudio de caso de Tétanos 264 265 Anexo 21. Estudio de brote SUIVE 3. 266 267 Anexo 22. Formato Único de Envío de Muestras (F-REM-01) 268 BIBLIOGRAFÍA 1. Secretaría de Salud, Manual simplificado para la vigilancia epidemiológica de las Enfermedades Prevenibles por Vacunación. México, 2005. 2. Ley General de Salud. Disponible en: http://www. diputados. gob.mx/ LeyesBiblio /pdf/142.pdf. Acceso el 15 de junio de 2012. 3. Acuerdo Secretarial No. 130. Diario Oficial de la Federación. Tomo DIV. Núm. 4. México 6 de septiembre de 1995. 4. Secretaría de Salud. Proyecto de Norma Oficial Mexicana PROY-NOM-017-SSA22012, Para la vigilancia epidemiológica. 5. Secretaría de Salud. Norma Oficial Mexicana NOM-040-SSA2-2004, en materia de información en salud. 6. Secretaría de Salud. Norma Oficial Mexicana NOM-031-SSA2-1999, para la atención a la salud del niño. 7. Secretaría de Salud .PROYECTO de Norma Oficial Mexicana PROY-NOM-045-SSA22005, para la vigilancia epidemiológica, prevención y control de las infecciones nosocomiales 8. Programa Nacional de Salud 2007-2012. 9. Disponible en: http://www.docstoc.com/docs/1764572/Determinantes-para-lasalud. Acceso el 19 de junio de 2012. 10. Disponible en: http://www.juntadeandalucia.es/averroes/vertie/motivadores/determsal.htm. Acceso el 19 de junio de 2012. 11. Disponible en: http://ujed.mx/ovsyg/documentos/Sistemas%20de%20vigilancia.pdf. Acceso el 19 de junio de 2012. 12. Disponible en: http://www.paho.org/spanish/HCP/HCN/vio/guidelines-5-sp.pdf. Acceso el 14 de junio de 2012. 269 13. Secretaría de Salud, Lineamientos para la vigilancia epidemiológica de Influenza. México, 2012. 14. Organización Panamericana de la Salud, Curso de gerencia para el manejo efectivo del Programa Ampliado de Inmunización (PAI), Módulo IV, Vigilancia Epidemiológica. 2006.p. 18-21, 25. Disponible en: http:// www. paho. org/ english/ ad/fch/ im/isis/epi_mod /spanish /docs/ modulo4.pdf. 15. Manual de Vigilancia Epidemiológica de Enfermedad Febril Exantemática. 16. Norma Oficial Mexicana NOM-017, SSA-2,1994, para la vigilancia epidemiológica. 17. Measles. Response Protocol for NSW Public Health Units. www.health.nsw.gov.au/factssheets/guideline/measles/html. 18. Measles: information for contacts. NSW Health. Communicable Diseases Factsheet. October 2008. 19. Revised guidelines for the follow-up of communicable diseases reported among travellers on aeroplanes. DRAFT 6 December 2006. Communicable Diseases Network Australia. 20. Follow-up of communicable diseases reported among travellers on aeroplanes. CDI Vol 28 No 2 2004. 21. Notes From the Field: Measles Transmission Associated With International Air Travel— Massachusetts and New York, July—August 2010. (Reprinted) JAMA, October 20, 2010—Vol 304, No. 15. 22. Organización Panamericana de la Salud. Eliminación del sarampión: guía práctica. Washington, D.C.: OPS, © 2007. (Publicación Científica y Técnica No. 605). 23. Multiple Cases of Measles After Exposure During Air Travel — Australia and New Zealand, January 2011. 24. Luna A. Revisión bibliográfica: Difteria. Universidad de Chile. http://epi.minsal.cl. 25. Laval, R.E. Difteria en Chile. Rev Chil Infect Edición aniversario 2003;42. 26. Laval E. El garrotillo en España (s. XVI y XVII). Rev Chil Infect 2006;23 (1): 78-80. 27. Amorós S. Ferrer B. Salavert F. La difteria y los médicos españoles del renacimiento. Acta ortorrinolaringol Esp 2002;53:146-150. 270 28. Control de la Difteria, tos ferina, tétanos, Hamophilus Influenza tipo B y Hepatitis B. Guía práctica. Publications. PAHO. ORG 2005, 87pp. 29. Brote de difteria en Calí (Valle) Colombia en Agosto-Octubre de 2000. Boletín Epidemiológico, Vol. 22 No 3, septiembre 2001. 30. Bol Oficina Sanit Panam 1995;119(5) 31. Brote de difteria en Calí (Valle) Colombia en Agosto-Octubre de 2000. Boletín Epidemiológico;2001:22 (3). 32. Instituto de Salud Carlos II. Centro Nacional de Epidemiología. Protocolo de vigilancia de difteria. Madrid: Ministerio de Sanidad y Consumo. España,1996 33. Boletín Epidemiológico semanal 1998;6 (25): 241-248 Dinamarca 34. De la Universidad del País Vasco, España. www. zerbitzuorokorrak. ehu.es/p258.../es/.../ informacion/.../difteria_c.pdf 35. OPS. Enfermedades inmuno prevenibles. Difteria. Publicación científica y técnica No 60 4. PAHO, 2006. 36. Bol Oficina Sanit Panam 119(5), 1995. 37. Protocolo para la vigilancia epidemiológica para Difteria. Colombia 38. Secretaria de Salud, Consejo Nacional de Vacunación, Programa de Atención a la Salud del Niño. Plan de Acción para la Eliminación del Tétanos Neonatal lineamientos generales. 3: 4, México 1998. 39. Kumate J. y cols. : Manual de Infectología, 268: 279, México 1998. 40. Escobedo J., Saltigeral P., Macias M., Infecciones por Microorganismos Específicos. 447: 462 41. SSA, Dirección General de Epidemiología, Quiroz H.G, Montesano R., Velázquez M. O, Manual para la Vigilancia Epidemiológica del tétanos neonatal. 12 : 38, México 1992. 42. Aguilar B.O, Cascajares M. T, Tétanos. Experiencia hospitalaria. Acta Pediatr. 4: 69 -74, México 1983. 43. Mussaret Z., Zamudio A., Patron A. Experiencia de siete años con tétanos neonatal en Yucatán, Bol. Med. Hosp. Infant. Vol. 50 Núm. 7: 475 - 480,México 1993. 271 44. R.E. Blak, D.H. Huber, G.T. Curlin, Reduction of neonatal by mass immunization of non-pregnant women: duration of protection provided by one or two doses of aluminium adsorbed tetanus toxoid. Bulletin of the World Healih Organization 58 (6): 927- 930, 1980. 45. CONAVA, Manual para el control de casos y brotes de Enfermedades Prevenibles por Vacunación, 15 : 24, México. 46. Gleckeman A., Manual of clinical Problems in infectous Disease, Little, Brown and Company, 184 , 1979. 47. Adams J., Keny J., Rudolp A., Modern management of tetanus neonatorum. Pediatrics 1979; 64 : 4720-0477. 48. Wassilak SG, Orentein, WA y Sutter r. En Vaccines 2ª Ed. Editado por Plotkin S Mortiner, E Saunders Company, Pennsylvania 1994 p 68 y 79. 49. CDC Epidemiology and prevention de Vaccine-preventable diseases. 50. Kishimoto,S.,Tomiro,S., Mitsuya, H. Y cols. “Age-related decline in the in vitro and in vivo syntheses of anti-tetanus toxid antibody in humans”, J. Immunobiol., 125: 2347,1980. 51. Bleck,T.P.; Tetanus: Pathophysiology, management and prophylaxis. Dis. Mon. 37: 545,1991. 52. Gendrel, D.,Lenoble,R.D., Massamba, M.B. y cols. :Placental transfer of tetanus antibodies and protection of the newborn. J. Trop. Pediatr. 36:279,1990. 53. Grolean,G. Tetanus. Emerg. Med. Clin. North. Am. 10: 351,1991. 54. Sugitha N, Suwendra B, Suraatmaja S.A. High dosage diazepam as single antispasmodic agent in the treatment of neonatal tetanus. Paediatr. Indones 1983, 23: 163- 172. 55. Husada T, Munir M. Failure of high dosage valium in the treatment of neonatal tetanus. Paediatr. Indones. 1980; 20: 51-56. 56. Chin, James. Control de las enfermedades transmisibles. Publicación científica y técnica 581 Organización Panamericana de la Salud. Decimoséptima edición 2001. 57. http://www.paho.org/spanish/ad/fch/ca/si-rubeola1.pdf 272 58. Secretaria de Salud. Consejo de Salubridad General. Guía de Práctica Clínica. Diagnóstico, tratamiento y prevención de la meningitis aguda bacteriana. Número de registro SSA 310-10. 59. Secretaría de Salud. Dirección General Adjunta de Epidemiología. Manual Para la Vigilancia Epidemiológica y de Laboratorio de las Enfermedades Invasivas por Bacterias (Versión Preliminar). 60. Secretaría de Salud. Dirección General de Epidemiologia. Manual para la Vigilancia epidemiológica de las infecciones invasivas por Haemophilus Influenzae. 61. Secretaría de Salud. Dirección General de Epidemiologia. Guía para la Vigilancia Epidemiológica de Meningítis Meningocócica y otras (Versión Preliminar). 62. SINAVE/DGE/SALUD/Descripción y comportamiento de las enfermedades de notificación semanal, Síntesis epidemiológica 2009. 63. RUVINSKY, Raúl et al. Infecciones invasivas por Streptococcus pneumoniae: estudio epidemiológico e importancia del desarrollo de un sistema de vigilancia. Arch. Pediatr. Urug. [online]. 2004, vol.75, n.1 [citado 2012-07-02], pp. 91-103. Disponible en: <http://www.scielo.edu.uy/scielo.php?script=sci_arttext&pid=S0004- 05842004000100014&lng=es&nrm=iso>. ISSN 0004-0584 64. Patricio Jiménez P. Mario Calvo A. y Comité de Microbiología de la Sociedad Chilena de Infectología Diagnóstico microbiológico de la neumonía del adulto adquirida en la comunidad Rev Chil Enf Respir 2005; 21: 95-101 65. Enfermedad Meningocócica. Información clave de apoyo para la confirmación y la respuesta para el manejo de eventos en América Latina y el Caribe. Nmeningitidis_FINAL20120109. http://new.paho.org/hq/index.php?option=com_content&task=blogcategory&id=3 609&Itemid=3953. 66. Procedimientos para el diagnóstico de Neumonías y Meningitis Bacterianas y la caracterización de cepas de Streptococcus pneumoniae y Haemophilus influenzae, SIREVA II http://new.paho.org/hq/index.php?option=com_content&task=blogcategory&id=3 609&Itemid=3953 273 67. Alerta Epidemiológica. Meningitis meningocócica. (Fiebre cerebroespinal). 24 de abril 2012. La meningitis meningocócica es una proporción variable de la ……….. http://new.paho.org/hq/index.php?option=com_docman&task=doc... 68. Secretaria de Salud Instituto de Diagnóstico y Referencia Epidemiológicos. Manual para toma, envió y recepción de muestras para diagnóstico (REMU-MA-01) 2012. 69. Meningitis meningocócica Nota descriptiva N°141 Diciembre de 2011 www.who.int/mediacentre/factsheets/fs141/es/index.html 70. Enfermedad meningocócica: situación en el cinturón africano de la meningitis www.who.int/csr/don/2012_05_24/es/index.html 71. Manual de Vigilancia Epidemiológica de Enfermedad Febril Exantemática. 72. Norma Oficial Mexicana NOM-017, SSA-2,1994, para la vigilancia epidemiológica. 73. Measles. Response Protocol for NSW Public Health Units. www.health.nsw.gov.au/factssheets/guideline/measles/html. 74. Measles: information for contacts. NSW Health. Communicable Diseases Factsheet. October 2008. 75. Revised guidelines for the follow-up of communicable diseases reported among travellers on aeroplanes. DRAFT 6 December 2006. Communicable Diseases Network Australia. 76. Follow-up of communicable diseases reported among travellers on aeroplanes. CDI Vol 28 No 2 2004. 77. Notes From the Field: Measles Transmission Associated With International Air Travel— Massachusetts and New York, July—August 2010. (Reprinted) JAMA, October 20, 2010—Vol 304, No. 15. 78. Organización Panamericana de la Salud. Eliminación del sarampión: guía práctica. Washington, D.C.: OPS, © 2007. (Publicación Científica y Técnica No. 605). 79. Multiple Cases of Measles After Exposure During Air Travel — Australia and New Zealand, January 2011. 274 275 Esta edición terminó de imprimirse en el mes de septiembre de 2012 en IEPSA, Impresora y encuadernadora Progreso, S.A. de C.V; San Lorenzo #244, Col, Paraje San Juan, Delegación Iztapalapa, C.P. 09830, México, D.F. El tiraje consta de 500 ejemplares 276