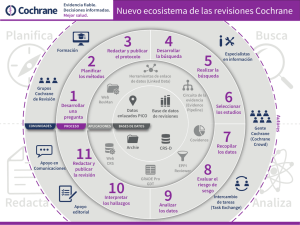
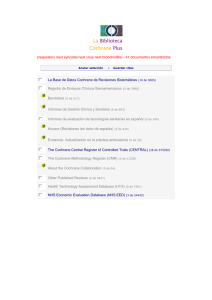
Expectativas Metodolgicas de las Revisiones Cochrane de
Anuncio

Expectativas metodológicas de las revisiones Cochrane de intervenciones Methodological expectations of Cochrane intervention reviews (MECIR) Estándares metodológicos para la realización y para el informe de nuevas revisiones Cochrane de intervenciones Traducción a cargo del Centro Cochrane Iberoamericano Estándares de realización correspondientes a la versión 2.2. y Estándares de informe correspondientes a la versión 1.1. Expectativas metodológicas de las revisiones Cochrane de intervenciones (MECIR) Contenido Estándares metodológicos para la realización de nuevas revisiones Cochrane de intervenciones Estándares para el informe de nuevas revisiones Cochrane de intervenciones 1 34 EXPECTATIVAS METODOLÓGICAS DE LAS REVISIONES COCHRANE DE INTERVENCIONES (MECIR) Estándares metodológicos para la realización de nuevas revisiones Cochrane de intervenciones Introducción Las revisiones Cochrane se consideran un ejemplo de las mejores prácticas en cuanto a la calidad de su realización y la presentación de la información. Las normas que aparecen a continuación resumen los aspectos de realización de las revisiones de intervenciones descritos en el Manual Cochrane que se han establecido como obligatorios (O) o muy convenientes (MC) para las nuevas revisiones Cochrane. En la siguiente tabla se muestra solamente un listado de los estándares metodológicos. Pueden acceder a la información completa del proyecto MECIR en: www.editorial-unit.cochrane.org/mecir Versión original a cargo de: Julian Higgins, Rachel Churchill, Toby Lasserson, Jackie Chandler y David Tovey 1 Formulación de la(s) pregunta(s) de investigación para informar el ámbito de la revisión Nº Tema Estándar Fundamentos y elaboración Manual Cochrane 1 Formulación de las preguntas de la revisión (O) Asegurar que la pregunta de la revisión y particularmente los resultados de interés abordan temas importantes para las partes implicadas, como los consumidores, los profesionales de la salud y los gestores sanitarios. La intención de las revisiones Cochrane es apoyar la práctica clínica y las políticas sanitarias, no sólo la curiosidad científica. Las necesidades de los pacientes desempeñan una función central en las Revisiones Cochrane y pueden desempeñar una función importante en la definición de la pregunta de la revisión. La investigación cualitativa, es decir los estudios que exploran la experiencia de las personas involucradas en la administración y la recepción de intervenciones, y los estudios que evalúan los factores que configuran la implementación de las intervenciones, podrían utilizarse de la misma manera. 2.3.2 2.3.4 17.2 20.2.2 2 Predefinición de los objetivos (O) Definir anticipadamente los objetivos de la revisión, incluyendo participantes, intervenciones, comparadores y desenlaces. Los objetivos determinan el foco de la revisión y deben estar claros antes de que puedan desarrollarse criterios adecuados de elegibilidad. Si la revisión considerará intervenciones múltiples, se necesita claridad en cuanto a cómo se considerarán las mismas (p. ej. resumidas por separado, combinadas o comparadas de forma explícita). 5.1.1 3 Consideración de los efectos adversos potenciales (O) Considerar cualquier potencial efecto adverso importante de la(s) intervención(es) y asegurar que se aborda este tema. Es importante considerar los efectos adversos para evitar resúmenes parciales de las pruebas. Como mínimo, la revisión deberá destacar el grado en el que se han evaluado los efectos adversos potenciales en cualquier estudio incluido. A veces los datos sobre los efectos adversos se obtienen mejor a partir de los estudios no aleatorios, o de los estudios de investigación cualitativa. Sin embargo, este hecho no significa que todas las revisiones deban incluir estudios no aleatorios. 5.4.3 14.1.1 14.3 2 4 Consideración de la equidad y poblaciones específicas (MC) Considerar anticipadamente si los temas de equidad y relevancia de la evidencia en poblaciones específicas son importantes para la revisión y, si lo son, planificar métodos apropiados para abordar estos temas. Se debe prestar atención a la relevancia de la pregunta de la revisión para poblaciones como grupos de bajo nivel socioeconómico, regiones de medios o bajos ingresos, mujeres, niños y personas de edad avanzada. De ser posible, las revisiones deben incluir descripciones explícitas del efecto de las intervenciones no sólo sobre la población general sino también describir su efecto sobre los colectivos desfavorecidos o su capacidad para reducir las desigualdades socioeconómicas en la salud y promover su uso en la comunidad. 3 Establecimiento de los criterios de elegibilidad para la inclusión de estudios en la revisión No Tema Estándar Fundamentos y elaboración Manual Cochrane 5 Predefinición de criterios inequívocos para los participantes (O) Definir anticipadamente los criterios de elegibilidad para los participantes en los estudios. Los criterios de elegibilidad predefinidos y sin ambigüedad son un requisito previo para una revisión sistemática. Los criterios para considerar los tipos de personas incluidas en los estudios en una revisión deben ser suficientemente amplios para abarcar la diversidad probable de estudios, aunque suficientemente específicos para asegurar que pueda obtenerse una respuesta significativa al considerar los estudios en conjunto. Las consideraciones al especificar los participantes incluyen el contexto, el diagnóstico o la definición de la enfermedad y los factores demográficos. Cualquier restricción a las poblaciones de estudio debe basarse en un fundamento sólido, debido a que es importante que las revisiones Cochrane sean ampliamente relevantes. 5.2 6 Predefinición de una estrategia para los estudios con un subconjunto de participantes elegibles (MC) Definir anticipadamente la gestión de los estudios que incluyen solo un subconjunto de participantes relevantes. A veces los estudios incluyen a algunos participantes “elegibles” y a algunos participantes “no elegibles”, por ejemplo cuando se establece una edad límite en los criterios de elegibilidad de la revisión. En caso de que no puedan recuperarse los datos de los participantes aptos, debe predefinirse un mecanismo para tratar esta situación. 5.2 4 7 Predefinición de los criterios inequívocos para las intervenciones y comparadores (O) Definir anticipadamente las intervenciones elegibles y las intervenciones con las que éstas se pueden comparar en los estudios incluidos. Los criterios de elegibilidad predefinidos y sin ambigüedad son un requisito previo fundamental para una revisión sistemática. La especificación de las intervenciones de comparación necesita una claridad particular: ¿las intervenciones experimentales van a compararse con una intervención de control inactivo (p.ej. placebo, ningún tratamiento, atención habitual, o un control en lista de espera), o con una intervención de control activo (p.ej. una variante diferente de la misma intervención, un fármaco diferente, un tipo diferente de tratamiento)? También debe predefinirse y explicarse cualquier restricción en las intervenciones y los comparadores, como las relacionadas con la administración, la dosis, la duración, la intensidad, las cointervenciones y las características de las intervenciones complejas. 5.3 8 Aclaración de la función de los desenlaces (O) Aclarar con antelación si los desenlaces que figuran en los "Criterios para la consideración de los estudios para esta revisión" se utilizan como criterios para la inclusión de los estudios (en lugar de como una lista de los resultados de interés en la que se incluya cualquier estudio). En general las medidas de resultado no siempre deben formar parte de los criterios para incluir estudios en una revisión. Sin embargo, algunas revisiones restringen legítimamente la elegibilidad a resultados específicos. Por ejemplo, la misma intervención puede estudiarse en la misma población para diferentes finalidades (p.ej. tratamiento de reemplazo hormonal, o aspirina); o una revisión puede considerar específicamente los efectos adversos de una intervención utilizada para varios trastornos. Si los autores excluyen los estudios sobre la base de los resultados, se debe tener cuidado y discriminar si no hay resultados relevantes disponibles debido a que no se han medido o a que sencillamente no fueron informados. 5.1.2 5 9 Predefinición de los diseños de los estudios (O) Definir anticipadamente los criterios de elegibilidad para los diseños de los estudios de una manera clara e inequívoca, con especial atención en las características del diseño del estudio más que en las denominaciones del diseño. Los criterios de elegibilidad predefinidos y sin ambigüedad son un requisito previo fundamental para una revisión sistemática. Lo anterior es particularmente importante cuando se consideran los estudios no aleatorios. Algunas denominaciones utilizadas comúnmente para definir los diseños de estudio pueden ser ambiguas. Por ejemplo un estudio "doble ciego" puede no dejar claro en quién se realizó el cegamiento; un estudio "de casos y controles" puede estar anidado en una cohorte, o realizarse de manera transversal; o un estudio "prospectivo" puede tener sólo algunas características definidas o realizadas de manera prospectiva. 5.5 13.2.2 10 Inclusión de ensayos aleatorios (O) Incluir ensayos aleatorios como elegibles para la inclusión en la revisión, si son factibles para las intervenciones y resultados de interés. Los ensayos aleatorizados son el mejor diseño de estudio para evaluar la eficacia de las intervenciones. Si son factibles para evaluar las preguntas que se están considerando en la revisión, deben considerarse aptos para la revisión. Sin embargo, pueden definirse criterios de exclusión adecuados, por ejemplo con respecto a la duración del seguimiento. 5.5 13.1.3 11 Justificación de la elección de los diseños de los estudios (O) Justificar la elección de los diseños de los estudios elegibles. Puede ser difícil considerar algunas intervenciones o algunos resultados en los ensayos aleatorizados. Los autores deben ser capaces de justificar por qué han elegido restringir la revisión a los ensayos aleatorizados o incluir estudios no aleatorios. Deben justificarse los diseños de estudio incluidos con respecto a la adecuación a la pregunta de la revisión y con respecto a la posibilidad de sesgo. 13.1.2 13.2.1.3 12 Exclusión de los estudios en base al estado de publicación (O) Incluir los estudios, independientemente de su estado de publicación, a menos que se justifique explícitamente. La obtención y la inclusión de los datos de estudios no publicados (incluida la literatura gris) pueden reducir los efectos del sesgo de publicación. Sin embargo, los estudios no publicados que pueden encontrarse podrían ser una muestra no representativa de todos los estudios no publicados. 6.2.3 10.3.2 6 13 Cambio de los criterios de elegibilidad (O) Justificar cualquier cambio de los criterios de elegibilidad o de los resultados estudiados. En particular, las decisiones post hoc acerca de la inclusión o exclusión de los estudios deben mantenerse fieles a los objetivos de la revisión más que a normas arbitrarias. El cumplimiento de los criterios de elegibilidad predeterminados es un atributo fundamental de una revisión sistemática. Sin embargo pueden surgir imprevistos. Los revisores deben tomar decisiones post hoc sensatas acerca de la exclusión de los estudios, y las mismas deben documentarse en la revisión, posiblemente acompañadas de los análisis de sensibilidad. No deben realizarse cambios en el protocolo sobre la base de los hallazgos de los estudios o la síntesis debido a que puede introducir sesgo. 7 5.2 5.7 Selección de los desenlaces que deben evaluarse en los estudios incluidos en la revisión No Tema Estándar Fundamentos y elaboración Manual Cochrane 14 Predefinición de los desenlaces (O) Definir anticipadamente los desenlaces primarios y los desenlaces secundarios. La definición previa de los resultados reduce el riesgo de informe selectivo de resultados. Los desenlaces primarios deben ser los mínimos posibles y normalmente deben reflejar al menos un beneficio potencial y al menos un área potencial de efecto perjudicial. Se espera que la revisión pueda resumir estos desenlaces si se identifican estudios aptos, y que las conclusiones de la revisión se basen en gran parte en los efectos de las intervenciones sobre estos desenlaces. 5.4.2 15 Elección de desenlaces (MC) Mantener el número total de desenlaces seleccionados para la inclusión en la revisión tan reducido como sea posible. Elegir desenlaces relevantes para las partes implicadas como consumidores, profesionales sanitarios y gestores sanitarios. Evitar desenlaces triviales y resultados bioquímicos, intermedios y del proceso, pero considerar la importancia de los desenlaces de uso de recursos. La intención de las revisiones Cochrane es apoyar la práctica clínica y las políticas sanitarias, y deben considerar desenlaces que sean importantes para los pacientes. Los mismos deben especificarse en la etapa del protocolo. Si están disponibles, deben utilizarse grupos establecidos de desenlaces clave. De ser posible deben incluirse desenlaces informados por los pacientes. También es importante evaluar si las pruebas sobre el uso de recursos y los costos podrían ser un componente importante en las decisiones de adoptar la intervención o estrategias de tratamiento alternativas en todo el mundo. Un gran número de desenlaces, aunque a veces es necesario, puede dar lugar a que las revisiones no posean un objetivo claro, y a que sean difíciles de manejar para el usuario y proclives al sesgo de informe selectivo de resultados. 5.4.2 16 Predefinición de los detalles de los desenlaces (MC) Definir anticipadamente los detalles de lo que se consideran medidas de resultado aceptables (p. ej., criterios de diagnóstico, escalas, resultados compuestos). Una vez que se ha decidido qué desenlaces son de interés para la revisión, los autores deben aclarar formas aceptables para la medición de dichos resultados. Sin embargo, puede ser difícil predefinir los efectos adversos. 5.4.1 8 17 Predefinición de opciones a partir de múltiples medidas de resultado (MC) Definir anticipadamente como se seleccionarán las medidas de resultado cuando hay varias posibles medidas (p.ej., múltiples definiciones, evaluadores o escalas). La especificación previa evita el informe selectivo de resultados y permite a los usuarios confirmar que las decisiones no fueron influenciadas excesivamente por los resultados. El uso de una jerarquía predefinida de las medidas de resultados puede ser útil. Sin embargo, puede ser difícil predefinir los efectos adversos. Debe proporcionarse un fundamento para la elección de las medidas de resultado. 5.4.1 18 Predefinición de puntos temporales de interés (MC) Definir anticipadamente el momento de la medición de los resultados. La especificación previa evita el informe selectivo de resultados y permite a los usuarios confirmar que las decisiones no fueron influenciadas excesivamente por los resultados. Los autores pueden considerar si se incluirán en la revisión todos los períodos de tiempo o sólo puntos temporales seleccionados. Estas decisiones deben basarse en los desenlaces importantes para la toma de decisiones sanitarias. Una estrategia para utilizar los datos disponibles podría ser agrupar puntos temporales en intervalos predefinidos para representar los resultados “a corto plazo”, “a plazo medio” y “a largo plazo” y en cada estudio tomar no más de uno de cada intervalo para cualquier desenlace. 5.4.1 9 Planificación de los métodos de la revisión en la etapa del protocolo No Tema Estándar Fundamentos y elaboración Manual Cochrane 19 Planificación de la búsqueda bibliográfica (O) Planificar anticipadamente los métodos a utilizar para identificar estudios. Diseñar búsquedas para captar tantos estudios como sea posible que cumplan los criterios de elegibilidad, asegurando que se incluyan los periodos de tiempo y las fuentes relevantes y no existan restricciones de idioma o estado de publicación. Las búsquedas deben estar motivadas directamente por los criterios de elegibilidad para la revisión, y es importante considerar todos los tipos de estudios elegibles al planificar la búsqueda. Existe la posibilidad de sesgo de publicación o sesgo de idioma (mediante el cual el idioma de publicación es seleccionado de una manera que depende de los hallazgos del estudio) cuando las búsquedas se restringen por el estado de publicación o por el idioma de la publicación. La eliminación de las restricciones de idioma en las bases de datos en idioma inglés no es un buen sustituto a la búsqueda en revistas y bases de datos en idiomas diferentes al inglés. 6.3 6.4 20 Planificación de la evaluación del riesgo de sesgo en los estudios incluidos (O) Planificar anticipadamente los métodos a utilizar para la evaluación del riesgo de sesgo en los estudios incluidos, entre ellos, la(s) herramienta(s) a emplear, como se usarán la(s) herramienta(s), y los criterios utilizados para valorar estudios, por ejemplo, como de bajo riesgo, alto riesgo y riesgo de sesgo incierto. La definición previa de los métodos y los criterios para evaluar el riesgo de sesgo es importante debido a que el análisis o la interpretación de los hallazgos de la revisión pueden ser afectados por las valoraciones realizadas durante este proceso. Para los ensayos aleatorizados, la herramienta Cochrane de riesgo de sesgo es obligatoria, por lo que es suficiente (y más fácil) referirse a las definiciones de riesgo bajo, riesgo poco claro y riesgo alto de sesgo proporcionadas en el Manual Cochrane. 8.3 10 21 Planificación de la síntesis de los resultados (O) Planificar anticipadamente los métodos a utilizar para sintetizar los resultados de los estudios incluidos, entre ellos, si se planifica una síntesis cuantitativa, cómo se evaluará la heterogeneidad, las opciones de medida del efecto (p. ej., odds ratio, razón de riesgos, diferencia de riesgo u otros para resultados dicotómicos), métodos para el metanálisis (p. ej., varianza inversa o Mantel Haenszel, modelo de efectos fijos o de efectos aleatorios). La definición previa de los métodos de síntesis, en particular los métodos estadísticos, es importante debido a que el análisis o la interpretación de los hallazgos de la revisión pueden ser afectados por las valoraciones realizadas durante este proceso. 9.1.2 22 Planificación de los análisis de subgrupos (O) Predefinir los potenciales modificadores del efecto (p.ej., para los análisis de subgrupos) en la etapa del protocolo; restringir éstos en número; y aportar un fundamento para cada uno de ellos. La especificación previa reduce el riesgo de que un gran número de análisis de subgrupos injustificados dé lugar a explicaciones erróneas de la heterogeneidad. 9.6.5 23 Planificación de una tabla ‘Resumen de los resultados" (MC) Planificar anticipadamente los métodos a utilizar para resumir los hallazgos de la revisión, incluyendo la evaluación de la calidad del conjunto de la evidencia. Si se anticipa una tabla formal ‘Resumen de los resultados", especificar qué resultados serán incluidos y qué comparaciones y subgrupos abarcará (si procede). Los métodos para las tablas de “Resumen de los resultados” deben predefinirse, en particular con respecto a la elección de los desenlaces, para evitar la presentación selectiva de resultados en la revisión. La tabla debe incorporar los desenlaces esenciales para la toma de decisiones (habitualmente hasta siete), que en general no deben incluir desenlaces indirectos ni intermedios. Estos desenlaces no deben elegirse sobre la base de cualquier magnitud prevista u observada del efecto, o debido a la probabilidad de que se hayan considerado en los estudios que se van a examinar. 11.5 11 Búsqueda de estudios No Tema Estándar Fundamentos y elaboración Manual Cochrane 24 Búsquedas en las bases de datos clave (O) Buscar en el Registro Especializado del Grupo Cochrane de Revisión (Cochrane Review Group's Specialized Register) (internamente, p. ej., vía Registro Cochrane de Estudios (Cochrane Register of Studies), o externamente vía CENTRAL). Asegurar que se han realizado búsquedas en CENTRAL y MEDLINE (p. ej., vía PubMed) [ya sea para la revisión o para el Registro Especializado del Grupo de Revisión (Review Group’s Specialized Register)]. Las búsquedas de los estudios deben ser tan extensivas como sea posible para reducir el riesgo de sesgo de publicación y para identificar la mayor cantidad posible de pruebas relevantes. Las bases de datos mínimas que deben cubrirse son el Registro Especializado del Grupo de Revisión Cochrane (si existe y estuviese diseñado para apoyar las revisiones de este modo), CENTRAL y MEDLINE. Puede necesitarse experiencia para evitar la duplicación innecesaria de esfuerzos. Algunos informes, aunque no todos, de los estudios elegibles de MEDLINE, Embase y los Registros Especializados del Grupo de Revisión Cochrane ya están incluidos en CENTRAL. Deben realizarse búsquedas complementarias según se describe en las secciones 6.3.2 y 6.3.3 del Manual Cochrane. 6.2.1.1 6.3.3 25 Búsquedas en bases de datos bibliográficas especializadas (MC) Buscar en bases de datos bibliográficas relevantes nacionales, regionales, y específicas del tema. Las búsquedas de los estudios deben ser tan extensivas como sea posible para reducir el riesgo de sesgo de publicación y para identificar la mayor cantidad posible de pruebas relevantes. Deben cubrirse las bases de datos relevantes al tema de la revisión (p.ej. CINAHL para temas relacionados con enfermería, PsychInfo para intervenciones psicológicas), y deben considerarse las bases de datos regionales (p.ej. LILACS). 6.2.1.4 6.2.1.5 6.4.1 12 26 Búsquedas de diferentes tipos de evidencia (O) Si la revisión aplica criterios específicos de elegibilidad respecto al diseño de los estudios para abordar los efectos adversos, las cuestiones económicas o las preguntas de investigación cualitativa, se deben realizar búsquedas que los consideren. A veces se llevarán a cabo diferentes búsquedas para diferentes tipos de evidencia, como los estudios no aleatorios con objeto de considerar los efectos adversos, o los estudios de evaluación económica. 13.3 14.5 15.3 20.3.2.1 27 Búsquedas en registros de ensayos (O) Buscar en registros de ensayos y en archivos de resultados, cuando sea relevante para el tema, mediante ClinicalTrials.gov, el portal de la WHO International Clinical Trials Registry Platform (ICTRP) y otras fuentes, según convenga. Las búsquedas de los estudios deben ser tan extensivas como sea posible para reducir el riesgo de sesgo de publicación y para identificar la mayor cantidad posible de pruebas relevantes. Aunque ClinicalTrials.gov está incluido como uno de los registros dentro del portal ICTRP de la OMS, se recomienda realizar búsquedas tanto en ClinicalTrials.gov como en el portal ICTRP por separado debido a las funcionalidades adicionales en ClinicalTrials.gov. 6.2.3.1 6.2.3.2 6.2.3.3 28 Búsquedas de literatura gris (MC) Buscar fuentes relevantes de literatura gris, como informes/disertaciones/bases de datos de tesis y bases de datos de resúmenes de congresos. Las búsquedas de los estudios deben ser tan extensivas como sea posible para reducir el riesgo de sesgo de publicación y para identificar la mayor cantidad posible de pruebas relevantes. 6.2.1.7 6.2.1.8 6.2.2 29 Búsquedas en otras revisiones (MC) Buscar en revisiones anteriores sobre el mismo tema. Las búsquedas de los estudios deben ser tan extensivas como sea posible para reducir el riesgo de sesgo de publicación y para identificar la mayor cantidad posible de pruebas relevantes. 6.2.2.5 30 Búsquedas en las listas de referencias (O) Verificar las listas de referencias de los estudios incluidos y cualquier revisión sistemática relevante identificada. Las búsquedas de los estudios deben ser tan extensivas como sea posible para reducir el riesgo de sesgo de publicación y para identificar la mayor cantidad posible de pruebas relevantes. 6.2.2.5 13 31 Búsquedas mediante contacto con personas y organizaciones relevantes (MC) Contactar con personas y organizaciones relevantes para obtener información sobre estudios no publicados o en curso. Las búsquedas de los estudios deben ser tan extensivas como sea posible para reducir el riesgo de sesgo de publicación y para identificar la mayor cantidad posible de pruebas relevantes. Es importante identificar los estudios en curso, para que cuando se actualice la revisión los mismos puedan evaluarse para su posible inclusión. 6.2.3 32 Estructuración de las estrategias de búsqueda para las bases de datos bibliográficas (O) Formular la estructura de las estrategias de búsqueda en las bases de datos bibliográficas en base a los conceptos principales de la revisión, utilizando los elementos adecuados de PICO y del diseño del estudio. Al estructurar la búsqueda, maximizar la sensibilidad al mismo tiempo que se intenta lograr una precisión razonable. Asegurar el uso correcto de los operadores AND y OR. Las estrategias de búsqueda inapropiadas o inadecuadas pueden no lograr identificar registros que están incluidos en las bases de datos bibliográficas. Es posible que se necesite apoyo experto, en particular del Coordinador de Búsqueda de Ensayos del Grupo de Revisión Cochrane. La estructura de una estrategia de búsqueda debe basarse en los conceptos principales examinados en una revisión. En las bases de datos generales, como MEDLINE, una estrategia de búsqueda para identificar los estudios para una Revisión Cochrane habitualmente tendrá tres grupos de términos: 1) términos para buscar la condición de interés, es decir la población; 2) términos para buscar la/s intervención/es evaluada/s; y 3) términos para buscar los tipos de diseño de estudio que van a incluirse (habitualmente un “filtro” para los ensayos aleatorizados). Sin embargo, hay excepciones. Por ejemplo, para las revisiones de intervenciones complejas, puede ser necesario buscar sólo la población o la intervención. Dentro de cada concepto, los términos se unen con el operador Booleano “OR”, y los conceptos se combinan con el operador Booleano “AND”. De ser posible, debe evitarse el operador “NOT” para que no exista el peligro de eliminar involuntariamente de la búsqueda registros que son relevantes. 6.4.2 6.4.4 6.4.7 14 33 Desarrollo de estrategias de búsqueda para bases de datos bibliográficas (O) Identificar vocabulario controlado apropiado (p. ej., MeSH, Emtree, incluyendo términos relacionados (exploded terms)) y términos de texto libre (freetext terms) (considerando por ejemplo, variantes ortográficas, sinónimos, acrónimos, operadores de truncamiento y proximidad). Las estrategias de búsqueda inapropiadas o inadecuadas pueden no lograr identificar los registros que están incluidos en las bases de datos bibliográficas. Las estrategias de búsqueda deben adaptarse a cada base de datos. Es importante que los términos MeSH sean “expandidos” cuando sea apropiado, para no omitir artículos relevantes. El mismo principio aplica a EMTREE al buscar en EMBASE y también a otras bases de datos. Los términos de búsqueda de vocabulario controlado de MEDLINE y EMBASE no son idénticos y tampoco lo es el enfoque de su indización. Con objeto de lograr una búsqueda lo más exhaustiva posible, es necesario incluir una gama amplia de términos de texto libre para cada uno de los conceptos seleccionados. Este procedimiento podría incluir el uso de truncamiento y comodines. La elaboración de una estrategia de búsqueda es un proceso iterativo en el cual se modifican los términos utilizados sobre la base de lo que ya se ha recuperado. 6.4.5 6.4.6 6.4.8 34 Utilización de filtros de búsqueda (MC) Utilizar filtros de búsqueda especialmente diseñados y probados cuando sea adecuado, incluyendo las Estrategias de Búsqueda Cochrane de Alta Sensibilidad (Cochrane Highly Sensitive Search Strategies) para identificar ensayos aleatorios en MEDLINE, pero no utilizar filtros en bases de datos prefiltradas, p. ej., no utilizar un filtro de ensayos aleatorios en CENTRAL o un filtro de revisiones sistemáticas en DARE. Las estrategias de búsqueda inapropiadas o inadecuadas pueden no lograr identificar los registros que están incluidos en las bases de datos bibliográficas. Los filtros de búsqueda deben utilizarse con cuidado. Deben evaluarse no sólo en cuanto a la fiabilidad de su desarrollo y el rendimiento informado sino también en cuanto a su exactitud, relevancia y efectividad actuales debido a los cambios frecuentes de interconexión e indización que afectan a las bases de datos. 6.4.11 6.4.2 13.3.1.2 14.5.2 15.3.1 17.5 20.3.2.1 15 35 Restricción de las búsquedas en las bases de datos (O) Justificar la aplicación de cualquier restricción de la estrategia de búsqueda, en la fecha de publicación, el formato o el idioma. Las restricciones de fechas en la búsqueda sólo deben usarse cuando hay restricciones de fechas en los criterios de elegibilidad de los estudios. Deben aplicarse sólo si se sabe que los estudios relevantes sólo podrían haberse realizado durante un período específico, por ejemplo si la intervención sólo estuviera disponible después de un punto temporal determinado. Las búsquedas de las actualizaciones de las revisiones podrían restringirse naturalmente por fecha de registro en la base de datos (en lugar de la fecha de publicación) para evitar la duplicación de esfuerzos. Las restricciones al formato de publicación (p.ej. exclusión de cartas) en general no deben usarse en las revisiones Cochrane, debido a que cualquier información acerca de un estudio elegible puede ser valiosa. 6.4.9 36 Documentación del proceso de búsqueda (O) Documentar el proceso de búsqueda detalladamente para asegurar que pueda ser presentado correctamente en la revisión. 6.6.1 37 Nueva ejecución de las búsquedas (O) Ejecutar de nuevo o actualizar las búsquedas para todas las bases de datos relevantes en el plazo de 12 meses antes de la publicación o actualización de la revisión, y examinar los resultados de los estudios potencialmente elegibles. El proceso de búsqueda (incluyendo qué fuentes fueron investigadas, cuándo, por quién y mediante qué términos) debe documentarse con suficientes detalles durante todo el proceso para asegurar que pueda informarse correctamente en la revisión, de modo que todas las búsquedas de todas las bases de datos sean reproducibles. La revisión publicada debe ser lo más actualizada posible. La búsqueda debe repetirse cerca de la publicación, si han transcurrido más de 12 meses (preferentemente seis meses) desde la fecha de búsqueda inicial hasta la fecha prevista de publicación, y los resultados deben filtrarse para identificar estudios potencialmente elegibles. En condiciones ideales los estudios deben incorporarse de forma completa. De lo contrario, los estudios potencialmente elegibles deben informarse como mínimo como una referencia en “Estudios pendientes de clasificación” o “Estudios en curso”. 16 38 Incorporación de los hallazgos de la nueva ejecución de las búsquedas (MC) Incorporar al completo todos los estudios identificados en la repetición o actualización de la búsqueda durante los 12 meses anteriores a la publicación o actualización de la revisión. 17 La revisión publicada debe ser lo más actualizada posible. Después de la repetición de la búsqueda, la decisión de incorporar cualquier estudio nuevo de forma completa en la revisión deberá sopesarse respecto al retraso en la publicación. Selección de estudios en la revisión No Tema Estándar Fundamentos y elaboración Manual Cochrane 39 Toma de decisiones de inclusión (O) Emplear (al menos) dos personas que trabajen de forma independiente para determinar si cada estudio cumple con los criterios de elegibilidad, y definir anticipadamente el proceso para resolver los desacuerdos. 7.2.4 40 Exclusión de los estudios sin datos utilizables (O) Incluir estudios en la revisión, independientemente de si los datos de resultados medidos se informan de una manera "utilizable". La selección de estudios por duplicado reduce tanto el riesgo de errores como la posibilidad de que la selección esté influida por sesgos de una única persona. De ser posible, las decisiones sobre la inclusión deben basarse en los textos completos de los estudios potencialmente elegibles, generalmente después de una selección inicial de los títulos y los resúmenes. Es aconsejable, aunque no obligatorio, que dos personas realicen esta selección inicial, y que trabajen de forma independiente. Las revisiones sistemáticas habitualmente deben procurar incluir a todos los participantes relevantes que se incluyeron en los estudios de diseños elegibles sobre las intervenciones relevantes y que habían medido los desenlaces de interés. Las revisiones no deben excluir los estudios exclusivamente sobre la base del informe de los datos de resultado, debido a que lo anterior puede introducir sesgo debido al informe selectivo de resultados. Aunque dichos estudios no pueden incluirse en los metanálisis, deben considerarse las implicaciones de su omisión. Debe observarse que los estudios pueden ser excluidos legítimamente debido a la falta de medición de los resultados. Además, puede haber cuestiones diferentes en cuanto a los desenlaces de efectos adversos, debido a que el conjunto de estudios puede ser mucho más grande y puede ser difícil de evaluar si se midieron dichos desenlaces. 18 5.4.1 41 Documentación de las decisiones sobre los registros identificados (O) Documentar el proceso de selección detalladamente para completar el diagrama de flujo PRISMA y la tabla "Características de los estudios excluidos". En la revisión final debe completarse un diagrama de flujo PRISMA y una tabla de “Características de los estudios excluidos”. Por lo tanto deben documentarse las decisiones sobre todos los registros identificados mediante la búsqueda. Los números de registros son suficientes para las exclusiones en el filtrado inicial por títulos y resúmenes. Las clasificaciones amplias son suficientes para los registros clasificados como potencialmente elegibles durante el filtrado inicial. Los estudios enumerados en la tabla de “Características de los estudios excluidos” deben ser los que el lector, de forma razonable, podría esperar encontrar en la revisión. Debe documentarse al menos una razón explícita de su exclusión. Los autores deberán decidir para cada revisión cuándo relacionar registros con estudios (si hay registros múltiples que se refieren a un estudio). Las listas de los estudios incluidos y excluidos deben basarse en los estudios en lugar de los registros. 6.6.1* 11.2.1* 42 Unificación de múltiples informes (O) Unificar los informes de un mismo estudio, de manera que cada estudio, en lugar de cada informe, sea la unidad de interés en la revisión. Es erróneo considerar informes múltiples del mismo estudio como si fueran estudios múltiples. Sin embargo, los informes secundarios de un estudio no deben descartarse, debido que pueden contener información valiosa acerca del diseño y la realización. Los revisores deben elegir y justificar qué informe utilizar como fuente para obtener los resultados del estudio. 7.2.1 7.2.2 7.6.4 * Estos números de la sección del Manual Cochrane son específicos de la versión 5.1. Los demás números de sección se aplican por igual a la edición de 2008 (y a las reimpresiones de 2009), publicada por Wiley-Blackwe ll. 19 Extracción de datos de los estudios incluidos No Tema Estándar Fundamentos y elaboración Manual Cochrane 43 Utilización de formularios de extracción de datos (O) Utilizar un formulario de extracción de datos que haya sido probado previamente. Los revisores a menudo tienen diferentes conocimientos y distintos niveles de experiencia sobre revisiones sistemáticas. El uso de un formulario de extracción de datos asegura cierta consistencia en el proceso de extracción de datos y es necesario para comparar los datos extraídos por duplicado. Los formularios completados de extracción de datos deben estar disponibles a petición para el CRG. Es sumamente aconsejable una prueba piloto del formulario por parte del equipo de revisión. Como mínimo, debe evaluarse la usabilidad del formulario de extracción de datos (o una variante muy parecida del mismo). 7.5 44 Descripción de los estudios (O) Recopilar las características de los estudios incluidos detalladamente para completar la tabla "Características de los estudios incluidos". Las características básicas de cada estudio deben presentarse como parte de la revisión, incluidos los detalles de los participantes, las intervenciones y los comparadores, los desenlaces y el diseño de estudio. Durante este proceso también deben obtenerse detalles de la fuente de financiación para cada estudio y la declaración de intereses de los investigadores primarios. 7.3 11.2 45 Extracción de las características de los estudios por duplicado (MC) Emplear (al menos) dos personas que trabajen de forma independiente para extraer las características de los estudios de los informes de cada estudio, y definir con antelación el proceso para resolver los desacuerdos. La extracción de datos por duplicado reduce tanto el riesgo de errores como la posibilidad de que la selección de datos esté influida por sesgos de una única persona. La extracción de datos por duplicado puede ser menos importante para las características del estudio que para los datos de resultado, de manera que no es una norma obligatoria para el primero. 7.6.2 7.6.5 20 46 Extracción de datos de resultados por duplicado (O) Emplear (al menos) dos personas que trabajen de forma independiente para extraer los datos de resultados de los informes de cada estudio, y definir con antelación el proceso para resolver los desacuerdos. La extracción de datos por duplicado reduce tanto el riesgo de errores como la posibilidad de que la selección de datos esté influida por sesgos de una única persona. La extracción de datos por duplicado es particularmente importante para los datos de resultado, que se incorporan directamente en las síntesis de la evidencia y en consecuencia en las conclusiones de la revisión. 7.6.2 47 Maximizar el uso de los datos (O) Recopilar y utilizar los datos numéricos más detallados que puedan facilitar análisis similares de los estudios incluidos. Cuando las tablas 2×2 ó las medias y desviaciones estándar no estén disponibles, se podrían incluir las estimaciones del efecto (p. ej., odds ratio, coeficientes de regresión), intervalos de confianza, pruebas estadísticas (p. ej., t, M, Z, ji cuadrado) o los valores de P, o incluso los datos de los participantes individuales. El registro de datos en RevMan es más fácil cuando se proporcionan tablas 2×2 para los desenlaces dicotómicos, y cuando se presentan las medias y las desviaciones estándar para los desenlaces continuos. A veces no se informan estos estadísticos pero puede realizarse alguna operación para obtenerlos de los datos informados. Por ejemplo, las tablas 2×2 a menudo pueden derivarse de los tamaños de la muestra y los porcentajes, mientras que las desviaciones estándar a menudo pueden calcularse mediante el uso de los intervalos de confianza o los valores de p. Además, el formato de registro de datos de la varianza inversa puede usarse incluso cuando la información detallada requerida para los datos dicotómicos o continuos no está disponibles, p.ej. cuando sólo se presentan los odds ratios y los intervalos de confianza. La calculadora de RevMan facilita muchas de estas operaciones. 7.7 21 48 Examen de las erratas (MC) Examinar cualquier declaración de retracción relevante y erratas para obtener información. Algunos estudios pueden haber sido fraudulentos o pueden haberse retractado por otras razones desde la publicación. La fe de erratas puede revelar limitaciones importantes o incluso fallas fatales en los estudios incluidos. Todo lo mencionado anteriormente puede dar lugar potencialmente a la exclusión de un estudio de una revisión o de un metanálisis. Se debe proceder con cuidado para asegurar la recuperación de esta información en todas las búsquedas de las bases de datos al descargar los campos apropiados junto con los datos de las citas. 6.4.10 49 Obtención de los datos no publicados (MC) Solicitar información clave inédita que se haya omitido en los informes de los estudios incluidos. El contacto con los autores de los estudios para obtener o confirmar datos hace que la revisión sea más completa, mejora potencialmente la precisión y reduce el impacto de los sesgos de informe. La información faltante puede ser detalles para justificar las evaluaciones del “Riesgo de sesgo”, detalles de las intervenciones y los desenlaces, y los resultados del estudio (incluido el desglose de resultados por subgrupos importantes). 7.4.2 50 Selección de los grupos de intervención en estudios con múltiples brazos (O) Si se incluye un estudio con más de dos brazos de intervención, incluir en la revisión sólo los grupos de intervención y de control que cumplan con los criterios de elegibilidad. No tiene sentido incluir a grupos de intervención irrelevantes en la revisión. Sin embargo los autores deben dejar claro en la “Tabla de características de los estudios incluidos” que dichos grupos de intervención estaban presentes en el estudio. 16.5.2 22 51 Verificación de la precisión de los datos numéricos de la revisión (O) Comparar la magnitud y dirección de los efectos presentados por los estudios tal como se presentan en la revisión, teniendo en cuenta las diferencias legítimas. 23 Esta es una forma razonablemente directa para que los autores verifiquen varios problemas potenciales, incluidos los errores tipográficos en los informes de los estudios, la exactitud de la extracción y la manipulación de los datos y el registro de datos en RevMan. Por ejemplo la dirección de una diferencia de medias estandarizada puede estar accidentalmente equivocada en la revisión. Un control básico es asegurar los mismos hallazgos cualitativos (p. ej. la dirección del efecto y la significación estadística) entre los datos presentados en la revisión y los datos disponibles en el estudio original. Los resultados de los diagramas de bosque deben coincidir con los datos del informe original (estimación puntual e intervalo de confianza) si se utiliza la misma medida del efecto y el mismo modelo estadístico. Evaluación del riesgo de sesgo en los estudios incluidos No Tema Estándar Fundamentos y elaboración Manual Cochrane 52 Evaluación del riesgo de sesgo (O) Evaluar el riesgo de sesgo para cada estudio incluido. Para los ensayos aleatorios, debe utilizarse la herramienta Cochrane "Riesgo de sesgo", que incluye criterios y apoyos para esas valoraciones a través de una serie de dominios de sesgo, como se describe en el Capítulo 8 del Manual Cochrane (versión 5 o posterior). Debe considerarse explícitamente el riesgo de sesgo de cada estudio incluido en una revisión Cochrane para determinar el grado de credibilidad de sus hallazgos, y debe tenerse en cuenta que los riesgos de sesgo pueden variar según la variable de resultado. Las recomendaciones para la evaluación del sesgo en los estudios aleatorios incluidos en las Revisiones Cochrane actualmente están bien establecidas. La nueva herramienta – según se describe en el Manual Cochrane – debe utilizarse para todos los ensayos aleatorizados de las nuevas revisiones y todos los ensayos aleatorizados recién incluidos en las revisiones actualizadas. Lo anterior no excluye el uso de otras herramientas. Las discusiones en los Capítulos 8 y 13 del Manual Cochrane deben utilizarse para informar la selección de una herramienta apropiada para los estudios no aleatorios. 8.5 8.9 8.10 8.15* 53 Evaluación del riesgo de sesgo por duplicado (O) La evaluación del riesgo de sesgo por duplicado reduce tanto el riesgo de errores como la posibilidad de que las evaluaciones sean influidas por sesgos de una única persona. 7.6.2 8.3.4 54 Apoyo a las valoraciones de riesgo de sesgo (O) Emplear (al menos) dos personas que trabajen de forma independiente para aplicar la herramienta riesgo de sesgo a cada estudio incluido, y definir con antelación el proceso para resolver desacuerdos. Justificar las valoraciones de riesgo de sesgo (alto, bajo e incierto) y proporcionar esta información en las tablas "Riesgo de sesgo" (como "Apoyo a la valoración"). La justificación de las valoraciones hace que el proceso sea transparente. Los ítems considerados en riesgo incierto de sesgo pero sin información adjunta que apoye la valoración aparecen como celdas vacías en los gráficos basados en la herramienta de riesgo de sesgo en la revisión publicada. 8.5.1 8.5.2 24 55 Aportación de fuentes de información para las evaluaciones del riesgo de sesgo (MC) Diferenciación entre el sesgo de realización y el sesgo de detección (MC) Identificar la fuente de información para cada valoración de riesgo de sesgo (por ejemplo, citas, resumen de la información de un informe de ensayo, correspondencia con el investigador, etc.). Debe indicarse cuando las valoraciones se realicen en base a información proporcionada fuera de los documentos públicamente disponibles. Los lectores/editores/evaluadores deben tener la oportunidad de ver por sí mismos cuando se ha obtenido apoyo a las valoraciones. 8.5.2 Considerar separadamente los riesgos de sesgo debido a la falta de cegamiento para (i) los participantes y el personal del estudio (sesgo de realización), y (ii) la evaluación de los resultados (sesgo de detección). 8.5.1 8.11.1* 8.12.1* 57 Evaluación del riesgo de sesgo debido a la falta de cegamiento para diferentes resultados (MC) Considerar el cegamiento separadamente para diferentes desenlaces clave. 58 Evaluación de la completitud de los datos para diferentes desenlaces (MC) Considerar el impacto de los datos faltantes separadamente para los diferentes desenlaces clave a los que un estudio incluido aporta datos. El uso de dominios mutuamente excluyentes de sesgo (p.ej. sesgo de selección, sesgo de realización, sesgo de detección, sesgo de desgaste y sesgo de informe) proporciona un marco más integral para considerar los sesgos en los ensayos aleatorizados. Los cambios en RevMan en marzo de 2011 dieron lugar a que este marco sea una parte más central del proceso que anteriormente. El riesgo de sesgo debido a la falta de cegamiento puede ser diferente para los diferentes desenlaces (p.ej. en una evaluación de resultados no cegada, el riesgo de sesgo para la mortalidad por todas las causas puede ser muy diferente del de una escala de dolor informada por el paciente). Cuando hay múltiples desenlaces, los mismos deben agruparse (p.ej. objetivos versus subjetivos). A menudo la valoración del riesgo de sesgo debido a los datos de resultado incompletos (faltantes) no puede realizarse de forma fiable para el estudio en su totalidad. El riesgo de sesgo debido a los datos de resultado faltantes puede ser diferente para diferentes desenlaces. Por ejemplo, puede haber menos abandonos para un desenlace a los tres meses que para un desenlace a los seis años. Cuando hay múltiples desenlaces, los mismos deben agruparse (p.ej. corto plazo versus largo plazo). Se debe intentar realizar valoraciones acerca de qué desenlaces se consideran en riesgo alto o bajo de sesgo. 56 25 8.5.1 8.11.2 8.12.2* 8.5.1 59 Resumen de las evaluaciones del riesgo de sesgo (MC) Resumir el riesgo de sesgo de cada desenlace clave para cada estudio. Este procedimiento refuerza la conexión entre las características del diseño del estudio y su posible impacto sobre los resultados del estudio, y es un prerrequisito importante para evaluar la calidad de la evidencia mediante el abordaje GRADE. 8.7 60 Consideración del riesgo de sesgo en la síntesis (MC) Considerar el riesgo de sesgo en la síntesis (ya sea cualitativo o cuantitativo) Por ejemplo, presentar los análisis estratificados según el resumen del riesgo de sesgo, o restringido a estudios con bajo riesgo de sesgo. Los revisores deben considerar en qué forma los sesgos del estudio afectan las conclusiones. Lo anterior es útil para determinar la solidez de las conclusiones y la forma en que debe diseñarse y realizarse la investigación futura. 8.8 61 Incorporación de las evaluaciones del riesgo de sesgo (O) Si los ensayos aleatorios se han evaluado utilizando una o más herramientas, además de la herramienta Cochrane "Riesgo de sesgo", utilizar la herramienta Cochrane como evaluación principal de sesgo para interpretar los resultados, eligiendo el análisis primario, y extrayendo conclusiones. Para lograr consistencia en el enfoque entre las revisiones Cochrane, la herramienta Cochrane de riesgo de sesgo debe tener prioridad cuando se apliquen dos o más herramientas. La herramienta Cochrane también se introduce directamente en el enfoque GRADE para evaluar la calidad de la evidencia. 8.5 * Estos números de la sección del Manual Cochrane son específicos de la versión 5.1. Los demás números de sección se aplican por igual a la edición de 2008 (y a las reimpresiones de 2009), publicada por Wiley-Blackwe ll. 26 Síntesis de los resultados de los estudios incluidos No Tema Estándar Fundamentos y elaboración Manual Cochrane 62 Combinación de diferentes escalas (O) Si se combinan estudios con diferentes escalas, asegurar que las puntuaciones más altas para los resultados continuos tienen el mismo significado para cualquier resultado en particular; explicar la dirección de la interpretación; e informar si las direcciones se invierten. A veces puntuaciones mayores de las escalas reflejan un “mejor” resultado y a veces las puntuaciones inferiores reflejan un “mejor” resultado. Cuando se combinan estimaciones del efecto con significados clínicos opuestos se obtienen resultados sin sentido (y engañosos). 9.2.3.2 63 Asegurar que los metanálisis son significativos (O) Realizar (o mostrar) un metanálisis sólo si los participantes, las intervenciones, las comparaciones y los resultados se consideran suficientemente similares para asegurar una respuesta clínicamente significativa. Los metanálisis de estudios muy diferentes pueden ser engañosos, por ejemplo de estudios que utilizan formas diferentes de control. La diversidad clínica no necesariamente indica que no debe realizarse un metanálisis. Sin embargo, los autores deben clarificar cuál es la cuestión fundamental que está considerando cada estudio. 9.1.4 64 Evaluación de la heterogeneidad estadística (O) Evaluar la presencia y nivel de variación entre los estudios al realizar un metanálisis. La presencia de heterogeneidad afecta el grado en que pueden establecerse conclusiones generalizables. Es importante identificar la heterogeneidad en caso de que haya información suficiente para explicarla y ofrecer nuevas apreciaciones. Los autores deben tener en cuenta que hay mucha incertidumbre en las medidas como I-cuadrado y tau-cuadrado cuando hay pocos estudios. Por lo tanto, debe evitarse el uso de umbrales simples para diagnosticar la existencia de heterogeneidad. 9.5.2 27 65 Consideración de la falta de datos de resultados (MC) Considerar las implicaciones de la falta de datos de resultados de los participantes individuales (debido a las pérdidas durante el seguimiento o exclusiones del análisis). Los datos de resultado incompletos pueden introducir sesgo. En la mayoría de las circunstancias, los autores deben seguir los principios de los análisis de intención de tratar en la medida de lo posible (lo anterior puede no ser apropiado para los efectos adversos o si se intenta demostrar equivalencia). El riesgo de sesgo debido a los datos de resultado incompletos se contempla en la herramienta Cochrane de riesgo de sesgo. Sin embargo, los análisis estadísticos y la interpretación cuidadosa de los resultados son formas adicionales en las que el tema puede ser considerado por los revisores. Pueden considerarse los métodos de imputación (en forma de análisis de sensibilidad o acompañados por los mismos). 16.2 66 Consideración de los datos asimétricos (MC) Considerar la posibilidad e implicaciones de los datos asimétricos al analizar los resultados continuos. Los datos asimétricos a veces no se pueden resumir de forma útil por medio de medias y desviaciones estándar. Aunque los métodos estadísticos son aproximadamente válidos para los tamaños de la muestra grandes, los datos de resultado asimétricos pueden dar lugar a resultados engañosos cuando los estudios son pequeños. 9.4.5.3 67 Consideración de los estudios con más de dos grupos (O) Si se incluyen estudios con múltiples brazos, analizar los grupos de intervención múltiple de manera adecuada que evite la omisión arbitraria de los grupos relevantes y el doble recuento de los participantes. La exclusión de grupos relevantes reduce la precisión y el doble recuento aumenta la precisión erróneamente; ambos son inapropiados e innecesarios. Las estrategias alternativas incluyen la combinación de los grupos de intervención, la separación de las comparaciones en diagramas de bosque diferentes y el uso de metanálisis de tratamientos múltiples. 7.7.3.8 16.5.4 28 68 Comparación de subgrupos (O) Si se van a comparar análisis de subgrupos, y se considera que hay suficientes estudios para hacerlo de forma significativa, utilizar una prueba estadística formal para compararlos. Si se realizan los análisis de subgrupos, seguir el plan de análisis de subgrupos especificado en el protocolo sin excesivo énfasis en los hallazgos particulares. 69 Interpretación de los análisis de subgrupos (O) 70 Consideración de la heterogeneidad estadística al interpretar los resultados (O) Considerar cualquier heterogeneidad estadística al interpretar los resultados, especialmente cuando existe una variación en la dirección del efecto. 71 Consideración de diseños no estándar (O) Considerar el impacto en el análisis de agrupamiento (cluster), el emparejamiento (matching) u otras características no estándar de diseño de los estudios incluidos. 29 La conclusión de que hay una diferencia en el efecto en diferentes subgrupos en base a las diferencias en el nivel de significación estadística en cada subgrupo puede ser muy engañosa. Debe evitarse el informe selectivo, o la sobreinterpretación, de los subgrupos particulares o los análisis de subgrupos particulares. Esto es especialmente un problema cuando se realizan múltiples análisis de subgrupos. Esto no impide la realización de análisis de subgrupos post hoc razonables y honestos. La presencia de heterogeneidad afecta el grado en que pueden establecerse conclusiones generalizables. Si se realiza un análisis de efectos fijos, los intervalos de confianza pasan por alto el grado de heterogeneidad. Si se usa un análisis de efectos aleatorios, el resultado se relaciona con el efecto promedio entre los estudios. En ambos casos, deben considerarse las implicaciones de una heterogeneidad importante. Puede ser posible comprender las causas de la heterogeneidad si hay estudios suficientes. Los ensayos aleatorizados por conglomerados, los ensayos cruzados, los estudios que incluyen mediciones de múltiples partes corporales, y otros diseños deben tratarse específicamente, debido a que un análisis ordinario podría subestimar o sobrestimar la precisión del estudio. No tener en cuenta el agrupamiento (clustering) suele llevar a sobrestimar la precisión del estudio - es decir, genera intervalos de confianza son demasiado estrechos y una potencia estadística demasiado elevada. No tener en cuenta la correlación suele llevar a subestimar la precisión del estudio - es decir, genera intervalos de confianza demasiado amplios y una potencia estadística demasiado elevada. 9.6.3.1 9.6.5.2 9.5.4 9.3 16.3 16.4 72 Análisis de sensibilidad (MC) Utilizar análisis de sensibilidad para evaluar la solidez de los resultados, tales como el impacto de hipótesis importantes, los datos imputados, decisiones cuestionables y estudios con alto riesgo de sesgo. Es importante determinar cuándo los resultados son consistentes, debido a que puede reforzarse o debilitarse la solidez de la conclusión. 9.7 73 Interpretación de los resultados (O) Interpretar un valor de P estadísticamente no significativo (por ejemplo, superior a 0,05) como un signo de incertidumbre, a menos que los intervalos de confianza sean suficientemente reducidos para descartar una magnitud importante de efecto. Los autores frecuentemente confunden la falta de evidencia del efecto con evidencia de una falta de efecto. 12.4.2 12.7.4 74 Investigación de los sesgos de información (MC) Considerar el impacto potencial de los sesgos de información en los resultados de la revisión o en los metanálisis que contiene. Hay pruebas abrumadoras de la existencia de sesgos de informe de diversos tipos. Los mismos pueden considerarse en diversos puntos en la revisión. Una búsqueda minuciosa, y los intentos por obtener resultados no publicados, podrían reducir al mínimo el riesgo. Los análisis de los resultados de los estudios incluidos, por ejemplo mediante el uso de gráficos de embudo (funnel plots), a veces pueden ayudar a determinar el posible alcance del problema, al igual que los intentos de identificar los protocolos de estudio, lo que debería ser un aspecto rutinario de toda revisión. 10.1 10.2 30 Resumen de los resultados No Tema Estándar Fundamentos y elaboración Manual Cochrane 75 Inclusión de la tabla ‘Resumen de los resultados" (MC) Incluir la tabla "Resumen de los resultados" según las recomendaciones descritas en el Capítulo 10 del Manual Cochrane (versión 5 o posterior). Específicamente: • incluir los resultados de un único grupo de población (con pocas excepciones); • indicar la intervención y la intervención de comparación; • incluir siete o menos desenlaces importantes para el paciente; • describir los desenlaces (por ejemplo, la escala, las puntuaciones, el seguimiento); • indicar el número de participantes y estudios para cada desenlace; • presentar al menos un riesgo inicial para cada desenlace dicotómico (por ejemplo, la población de estudio o el riesgo mediano/medio) y las puntuaciones iniciales para los desenlaces continuos (si procede); • resumir el efecto de la intervención (si procede); e • incluir una medida de la calidad del conjunto de la evidencia. Estas son normas que deben aplicarse sistemáticamente en las revisiones. Los autores deben justificar por qué no se incluye una tabla “Resumen de los resultados” si este es el caso. 11.5 31 76 Evaluación de la calidad del conjunto de la evidencia (O) Utilizar las cinco consideraciones GRADE (limitaciones del estudio, consistencia del efecto, imprecisión, falta de direccionalidad y el sesgo de publicación) para evaluar la calidad del conjunto de la evidencia para cada resultado, y para extraer conclusiones sobre la calidad de la evidencia en el texto de la revisión. GRADE es el sistema utilizado más ampliamente para resumir la confianza en los efectos de las intervenciones por desenlace entre estudios. Es preferible usar la herramienta GRADE (implementada en GRADEprofiler y descrita en el sistema de ayuda del software). Este procedimiento debe ayudar a asegurar que los equipos de autores estén obteniendo acceso a la misma información para fundamentar sus valoraciones. En condiciones ideales, la calidad de la evidencia debe ser evaluada por dos personas que trabajen de forma independiente. Las cinco consideraciones GRADE deben tratarse independientemente de si la revisión incluye una tabla de “Resumen de los resultados”. 12.2 77 Justificación de las evaluaciones de la calidad del conjunto de la evidencia (O) Justificar y documentar todas las evaluaciones de la calidad del conjunto de la evidencia (por ejemplo, disminución o aumento si se utiliza la herramienta GRADE). Al adoptar un enfoque estructurado, se asegura la transparencia al indicar cómo se han formulado las interpretaciones y el resultado es más informativo para el lector. 12.2.1 78 Formulación de implicaciones para la práctica (O) Basar las conclusiones sólo en los hallazgos de la síntesis (cuantitativa o narrativa) de los estudios incluidos en la revisión. Las conclusiones de la revisión deben transmitir la esencia de la síntesis de los estudios incluidos, sin un informe selectivo de los hallazgos particulares en base al resultado y sin basarse en datos que no se recopilaron sistemáticamente y no se evaluaron como parte de la revisión. 12.7.4 79 Evitar recomendacione s (O) Evitar proporcionar recomendaciones para la práctica. Las revisiones Cochrane no deben intentar decirle a los pacientes qué intervenciones deben o no deben utilizarse, debido a que las consideraciones particulares pueden ser relevantes. Sin embargo, deben tratarse las implicaciones de los hallazgos, y la presentación de diferentes escenarios puede ayudar a la toma de decisiones. 12.7.2 32 80 Formulación de implicaciones para la investigación (MC) Estructurar las implicaciones para la investigación para abordar la naturaleza de la evidencia necesaria, incluyendo la comparación de la población de la intervención, el resultado, y el tipo de estudio. 33 Cualquier persona que desee realizar un estudio sobre el tema de la revisión debe recibir una imagen clara de las dudas que quedan por resolver. Un marco útil para considerar las implicaciones para la investigación es EPICOT (evidence, population, intervention, comparison, outcome and time stamp [pruebas, población, intervención, comparación, desenlace y fecha de evaluación]). 12.7.3 EXPECTATIVAS METODOLÓGICAS DE LAS REVISIONES COCHRANE DE INTERVENCIONES (MECIR) Estándares para el informe de nuevas revisiones Cochrane de intervenciones Introducción Los estándares que aparecen a continuación resumen las cualidades propuestas de información que se consideran de carácter obligatorio (O) o muy convenientes (MC) para las revisiones Cochrane de intervenciones (Cochrane intervention reviews), con la justificación de este criterio. Por ahora, no se pretende que estos estándares sean aplicados a los protocolos o revisiones actualizadas; esta cuestión se abordará en futuros trabajos. También existe otro proyecto en curso dirigido a clarificar las expectativas para los resúmenes en términos sencillos. Con el fin de ofrecer al usuario un documento conciso y pertinente, la metodología de una revisión debe ser informada de tal manera que relacione los métodos directamente con los resultados de la presente versión de la revisión. Por lo tanto, los detalles de los métodos que se habían planificado en el protocolo, pero no se aplicaron, en general deben informarse en la sección dedicada a las diferencias entre el protocolo y la revisión, o en un apéndice. La Colaboración Cochrane ha adoptado las recomendaciones proporcionadas por la declaración PRISMA (PRISMA statement) [http://www.prisma-statement.org/]. Se considera que los estándares de información que aparecen a continuación aseguran el cumplimiento de estas recomendaciones. Algunos ítems han sido incluidos específicamente para facilitar esto (por ejemplo, el estándar relativo a la mención de que la revisión tiene un protocolo publicado). Las extensiones de la declaración PRISMA también pueden ser pertinentes para algunas revisiones particulares, como por ejemplo, las revisiones que abordan asuntos de equidad [http://equity.cochrane.org/equity-extension-prisma]. La ordenación de los estándares refleja la posición en la que cabría esperar que se aborde cada tema en el texto principal de la revisión. En algunos ítems, se ha especificado dónde debe presentarse la información (por ejemplo, para los contenidos de la tabla "Características de los estudios incluidos"). Para otros ítems, los autores de la revisión deben considerar si la información debe ser incluida en el texto principal, en las tablas, figuras o apéndices. Se pueden encontrar más detalles sobre el proyecto MECIR en el sitio web: www.editorial-unit.cochrane.org/mecir Versión original a cargo de: David Tovey, Editor de The Cochrane Library 34 Título y autores Nº Tema Estándar 1 Formato del título (MC) Autores (O) Seguir el formato estándar para el título de una revisión Cochrane. Tabla 4.2.a Listar los nombres y afiliaciones de todos los autores 4.2.2 2 Fundamentos y elaboración 35 Manual Cochrane Resumen Nº Tema Estándar Fundamentos y elaboración 3 Redactar el resumen (O) Los resúmenes son una síntesis importante de la revisión, de acceso público. Deben transmitir información clave sobre el tema de la revisión y sus hallazgos, y ser de carácter informativo para los lectores. [PRISMA ítem 2] 4 Resumen, Antecedentes (O) Resumen, Objetivos (O) Preparar un resumen estructurado que proporcione una breve síntesis de la revisión. Con el objeto de ser breves, es muy conveniente que los autores proporcionen un resumen de menos de 700 palabras y no debería tener una extensión superior a las 1000 palabras. Resumir los fundamentos y el contexto de la revisión. Indicar el(los) principal(es) objetivo(s), preferiblemente en una sola frase concisa El(los) objetivo(s) debe(n) expresarse en términos que se refieran a la(s) población(es), comparación(es) de la intervención y, cuando sea apropiado, a los resultados de interés. Proporcionar la fecha de la última búsqueda a partir de la cual se evaluaron los registros y los estudios identificados se incorporaron a la revisión, e indicar las bases de datos y otras fuentes consultadas. Los resúmenes deben tratar de dar a los lectores una información breve pero importante sobre la exhaustividad de la búsqueda y la actualidad de la información resumida en la revisión. 5 6 Resumen, Métodos de búsqueda (O) 11.8 El resumen debe incluir el mes y año de la serie de búsquedas hasta el cual las conclusiones de la revisión son válidas. Esta fecha debe reflejar la fecha de la serie más reciente de búsquedas a partir de las que se ha evaluado la relevancia de todos los registros y cualquier estudio que cumpliera los criterios de elegibilidad ha sido completamente incorporado a la revisión (los estudios pueden estar a la espera de clasificación si, por ejemplo, los autores de la revisión están a la espera de la traducción o aclaración por parte de los autores o patrocinadores). 36 Manual Cochrane 11.8 Cont. 6 Los resúmenes no deben informar necesariamente sobre las búsquedas recientemente repetidas o actualizadas cuyos resultados no hayan sido completamente incorporados a la revisión. Sin embargo, se debe ser prudente si tales búsquedas identifican un amplio conjunto de evidencias, cuya ausencia en los resultados de la revisión pueda afectar a la fiabilidad de las conclusiones. La cantidad de información con respecto a la búsqueda debe ser indicativa del proceso en lugar de proporcionar detalles específicos. Con el objeto de ser breves, puede que sea necesario trasladar ciertos detalles acerca del proceso general al texto completo de la revisión. Por ejemplo: “Se hicieron búsquedas en CENTRAL, MEDLINE, Embase, otras cinco bases de datos y tres registros de ensayos en [fecha] junto con la verificación de referencias, búsqueda de citas y contacto con autores de estudios para identificar estudios adicionales". 7 Resumen, Criterios de selección (O) Resumir los criterios de elegibilidad de la revisión, incluyendo la información sobre el diseño de los estudios, la población y la comparación. Cualquier ampliación de los criterios de elegibilidad para abordar los efectos adversos, los temas económicos o la investigación cualitativa debe ser mencionada. 8 Resumen, Obtención y análisis de los datos (O) Resumir cualquier método destacado para la selección de estudios, extracción de datos, evaluación del riesgo de sesgo y síntesis de los resultados. Para muchas revisiones, puede ser suficiente indicar "Se han utilizado procedimientos metodológicos estándar previstos por la Colaboración Cochrane." Esta sección del resumen debe indicar el rigor de los métodos que sustentan los resultados informados posteriormente en el resumen. No es necesario repetir la descripción detallada de los métodos que aparece en el texto principal de la revisión. 37 Cont. 8 Los detalles de cuántas personas estuvieron involucradas en el proceso de examen y recopilación de información acerca de los estudios incluidos no son necesarios en el resumen. Pueden indicarse los principales métodos estadísticos si no están claros a partir de los resultados que aparecen a continuación. El resumen debe dar prioridad a la descripción de los enfoques no convencionales. Por ejemplo, en lugar de describir todos los dominios aplicados en la evaluación de sesgo, se deben mostrar las variaciones importantes en el enfoque estándar, como las herramientas no estándar que se utilizaron. 9 Resumen, Resultados principales: número de estudios y participantes (O) Informar el número de estudios incluidos y de participantes. 38 Debe indicarse el número total de estudios incluidos. Puede ser conveniente proporcionar el número de estudios y de participantes para las comparaciones específicas y los resultados principales si la cantidad de evidencia difiere sustancialmente del total. Los números de participantes analizados generalmente deben presentarse en preferencia a los números de participantes reclutados (por ejemplo, aleatorizados); es aún más importante tener claro qué números están siendo informados. Para algunos tipos de datos, pueden existir alternativas preferibles al número de participantes (por ejemplo, persona-años de seguimiento, número de extremidades). 10 Resumen, Resultados principales: características de los estudios (O) Proporcionar una breve descripción de las características clave que determinarán la aplicabilidad del conjunto de la evidencia (por ejemplo, edad, gravedad de la afección, ámbito, duración del estudio). Resumir las características de los estudios proporcionará a los lectores del resumen información importante acerca de la aplicabilidad de los estudios incluidos. Esto es particularmente importante si los estudios incluidos reflejan solamente un subgrupo de los potencialmente elegibles para su inclusión en la revisión, por ejemplo, si la revisión pretendía abordar los efectos de las intervenciones en todos los grupos de edad, pero se incluyeron estudios que sólo reclutaron adolescentes. 11 Resumen, Resultados principales: evaluación del sesgo (O) Proporcionar un comentario sobre los hallazgos de la evaluación del sesgo. Las evaluaciones del riesgo de sesgo son un hallazgo clave y constituyen una parte fundamental de la fuerza de las conclusiones obtenidas en la revisión. Si los riesgos de sesgo difieren sustancialmente según las diferentes comparaciones y resultados, puede que sea necesario mencionarlo. 12 Resumen, Resultados principales: hallazgos (O) Informar los hallazgos para todos los resultados primarios, independientemente de la fuerza y dirección del resultado, y de la disponibilidad de datos. Generalmente, los hallazgos deberían incluir información concisa acerca de la calidad del conjunto de la evidencia para el resultado (por ejemplo, limitaciones del estudio, consistencia del efecto, imprecisión, evidencia indirecta y sesgo de publicación), por ejemplo, usando GRADE. Los desenlaces no deberían ser seleccionados únicamente en base a los hallazgos. Si ningún estudio midió los desenlaces primarios, entonces debería hacerse un comentario en este sentido. 13 Resumen, Resultados principales: efectos adversos (O) Asegurar que cualquier hallazgo relacionado con los efectos adversos sea informado. Si se buscaron los datos de los efectos adversos, pero su disponibilidad fue limitada, esto debería ser informado. El resumen de la revisión debe intentar reflejar una síntesis equilibrada de los beneficios y daños de la intervención. 39 11.8 14 Resumen, Resultados principales: formato de los resultados numéricos (O) 15 Resumen, Resultados principales: interpretabilidad de los hallazgos (O) 16 Resumen, Conclusiones de los autores (O) Indicar las conclusiones clave extraídas. 17 Completitud del texto principal de la revisión (O) Consistencia de las versiones resumidas de la revisión (O) Asegurar que todos los hallazgos informados en el resumen y en el resumen en términos sencillos, incluyendo las reexpresiones de los resultados del metanálisis, también aparecen en el texto principal de la revisión. Asegurar que la información de los objetivos, resultados importantes, resultados, advertencias y conclusiones es consistente en todo el texto, en el resumen, en el resumen en términos sencillos y en la tabla "Resumen de los resultados" (si se incluye). 18 Presentar resúmenes de los análisis estadísticos del mismo modo que se informan en la revisión y de una manera estándar, asegurando que los lectores comprenderán la dirección del beneficio y la escala de medición utilizada, y que los intervalos de confianza se incluyen cuando procede. Asegurar que los hallazgos clave son interpretables, o se reexpresan de forma interpretable. Por ejemplo, podrían ser reexpresados en términos absolutos (como los riesgos asumidos y correspondientes, NNT, medias grupales), y los resultados combinados con una escala estandarizada (por ejemplo, DME) podrían ser reexpresados en unidades que son comprensibles de manera más natural. 40 El formato estándar para informar los resultados del análisis estadístico incluye una indicación de la medida de resumen, la estimación puntual y el intervalo de confianza [por ejemplo, odds-ratio de 0,75 (intervalo de confianza del 95%: 0,62 a 0,89)]. Los efectos absolutos proporcionan una ilustración útil del posible impacto de la intervención, y suelen ser más fáciles de entender que los efectos relativos. Las unidades expresadas en una escala estandarizada reflejan la estimación del efecto como el número de desviaciones estándar. Esto no es intuitivo para muchos lectores que pueden estar más familiarizados con escalas específicas. Cualquier hallazgo reexpresado debe haber sido presentado de la misma manera en el texto principal de la revisión (ver estándar anterior). Las conclusiones de los autores pueden incluir tanto implicaciones para la práctica como para la investigación. Se debe tener precauc¡ón para evitar la interpretación de la falta de evidencia del efecto como evidencia de la falta de efecto. Deben evitarse las recomendaciones para la práctica 12.7.4 11.8 11.8 11.9 Las versiones resumidas de la revisión deberían ser escritas en la asunción de que es probable que sean leídas separadamente del resto de la revisión. Antecedentes Nº Tema Estándar Fundamentos y elaboración 19 Antecedentes (O) Proporcionar una descripción concisa de la condición o problema que aborda la pregunta de la revisión, la definición de la intervención y cómo podría funcionar, y por qué es importante realizar la revisión. 20 Encabezamientos de los Antecedentes (MC) Referencias de los Antecedentes (O) Incluir los cuatro encabezamientos (secciones) estándar al redactar los Antecedentes. Texto de los Antecedentes (O) Evitar el uso de texto plagiado. Las revisiones sistemáticas deben tener una justificación claramente definida y bien razonada, que se haya desarrollado en el contexto del conocimiento existente. Describir el contexto de la pregunta de la revisión es útil para los lectores y ayuda a establecer las principales dudas que la revisión se propone abordar. [PRISMA ítem 3] Se incluyen cuatro encabezamientos (secciones) estándar en RevMan ("Descripción de la condición","Descripción de la intervención", "¿Cómo podría funcionar la intervención", y "¿Por qué es importante realizar esta revisión"). Las afirmaciones o declaraciones relacionadas con aspectos como la carga de la enfermedad, morbilidad, prevalencia y mecanismos de acción deben ser corroboradas y, cuando sea posible, apoyadas por evidencia externa. No es aceptable copiar el trabajo de otras personas sin mencionarlas. Sin embargo, puede haber situaciones en las que el mismo texto aparezca en diferentes revisiones, por ejemplo, cuando un mismo equipo prepara las revisiones. Se está desarrollando una normativa formal sobre el plagio en las revisiones Cochrane. El contenido que es idéntico a, extraído o copiado de textos estándar puede ser aceptable, pero debe ser citado. Asegurar que cualquier cita textual de más de unas cuantas palabras aparece entre comillas y reconocer claramente (es decir, citar) todas las fuentes. 21 22 Justificar todas las afirmaciones clave de apoyo con referencias 41 Manual Cochrane 4.5 23 Objetivo principal (O) Indicar el objetivo principal, cuando sea adecuado, en una única frase concisa. El objetivo principal de una revisión Cochrane debe ser evaluar los efectos de una o más intervenciones sanitarias sobre los resultados que son importantes para las partes interesadas, tanto intencionales como no intencionales. El objetivo debe ser expresado en términos que se refieran a la(s) población(es), comparación(es) de la intervención y, cuando sea apropiado especificarlo explícitamente, a los resultados de interés. Las partes interesadas pueden ser pacientes, cuidadores, responsables de políticas de salud, clínicos u otros. MECIR conduct standard 2 (Definir anticipadamente los objetivos de la revisión, incluyendo participantes, intervenciones, comparadores y resultados.). Cuando sea posible, el formato debe seguir la siguiente estructura: "Evaluar los efectos de la [intervención o comparación] para [problema de salud] para/en [tipos de personas, enfermedad o problema y ámbito si se especifica]". [PRISMA ítem 4] 24 Objetivos secundarios (O) Indicar explícitamente (como objetivos secundarios) cualquier pregunta específica abordada por la revisión, como las relativas a grupos de participantes, comparaciones de la intervención o resultados en particular. Los objetivos deben ser expresados en términos que se refieran a la(s) población(es), comparación(es) de la intervención y, cuando sea apropiado, a los resultados de interés. MECIR conduct standard 4 (Considerar anticipadamente si los temas de equidad y relevancia de la evidencia para poblaciones específicas son importantes para la revisión y si lo son, planificar métodos apropiados para abordar estos temas. Se debe prestar atención a la relevancia de la pregunta de la revisión para poblaciones como grupos de bajo nivel socioeconómico, regiones de medios o bajos ingresos, mujeres, niños y personas de edad avanzada.) 42 25 Evidencia económica (O) Si se está revisando evidencia sobre economía de la salud, indicarlo explícitamente en los Objetivos (como objetivos secundarios). El objetivo principal de una revisión Cochrane debe ser evaluar los efectos de una o más intervenciones sanitarias sobre los resultados que son importantes para las partes interesadas, tanto intencionales como no intencionales. Estos resultados pueden incluir resultados económicos. Si se está revisando evidencia en economía de la salud como un componente económico integrado, esto debería indicarse como un objetivo secundario. 15.2.3 26 Evidencia de investigación cualitativa (O) Si se está revisando evidencia de investigación cualitativa, indicarlo explícitamente en los Objetivos (como objetivos secundarios). El objetivo principal de una revisión Cochrane debe ser evaluar los efectos de una o más intervenciones sanitarias sobre los resultados que son importantes para las partes interesadas, tanto intencionales como no intencionales. Si la evidencia de investigación cualitativa se está incluyendo para "ampliar" la revisión, esto debe indicarse como un objetivo secundario. 20.2.1 43 Métodos Nº Tema Estándar Fundamentos y elaboración 27 Protocolo de referencia (MC) Citar el protocolo de la revisión. El lector debe ser consciente de que la revisión está basada en un protocolo publicado. Esto es particularmente importante si la revisión se ha dividido en múltiples revisiones desde la publicación del protocolo. Dado que el protocolo no se incluye en la CDSR una vez publicada la revisión, éste debe ser citado utilizando la cita de la última publicación del protocolo. Se puede acceder a las versiones archivadas de los protocolos a través de la versión actual de la revisión. [PRISMA ítem 5] Manual Cochrane Criterios para la consideración de los estudios para esta revisión Nº Tema Estándar Fundamentos y elaboración 28 Criterios de elegibilidad según el tipo de estudios: diseño de los estudios (O) Indicar los diseños de estudio que son elegibles y proporcionar una justificación de la elección. No es necesario explicar por qué los ensayos aleatorios son elegibles (si ese es el caso), aunque puede ser importante explicar la elegibilidad o no elegibilidad de otros tipos de estudios. MECIR conduct standard 9 (Definir anticipadamente los criterios de elegibilidad según el diseño de los estudios de una manera clara e inequívoca, con especial atención a las características del diseño de los estudios más que a la denominación del diseño.) MECIR conduct standard 11 (Justificar la elección de los diseños de estudio que son elegibles.) [PRISMA ítem 6] 44 Manual Cochrane 29 Criterios de elegibilidad según el tipo de estudios: informes de los estudios (O) Si los estudios son excluidos en base al estado de publicación o idioma de publicación, explicar y justificar este punto. Los estudios deben ser incluidos independientemente de su estado de publicación e idioma de publicación, a menos que se justifique explícitamente. MECIR conduct standard 12 (Incluir estudios independientemente de su estado de publicación, a menos que se justifique explícitamente.) [PRISMA ítem 6] 30 Criterios de elegibilidad según el tipos de participantes (O) Indicar los criterios de elegibilidad según los participantes, incluidos los criterios relacionados con la localización, ámbito, diagnóstico o definición de la condición, los factores demográficos, y cómo se manejan los estudios que incluyen subconjuntos de participantes pertinentes. Se debe indicar y explicar cualquier restricción importante en los criterios de elegibilidad de la revisión (por ejemplo, la exclusión de personas menores o mayores de cierta edad, o ámbitos específicos de intervención). MECIR conduct standard 5 (Definir anticipadamente los criterios de elegibilidad según los participantes en los estudios.) MECIR conduct standard 6 (Definir anticipadamente cómo se manejarán los estudios que incluyen sólo un subconjunto de participantes relevantes.) [PRISMA ítem 6] 31 Criterios de elegibilidad según el tipo de intervenciones (O) Indicar los criterios de elegibilidad para las intervenciones y los comparadores, incluyendo cualquier criterio relativo a la provisión, la dosis, la duración, la intensidad, las cointervenciones y características de las intervenciones complejas. MECIR conduct standard 7 (Definir anticipadamente las intervenciones elegibles y las intervenciones con las que éstas se pueden comparar en los estudios incluidos.) [PRISMA ítem 6] 45 32 Papel de los resultados (O) Si la medición de resultados particulares se utiliza como criterio de elegibilidad, indicarlo y justificarlo. Los estudios no deben ser nunca excluidos de la revisión sólo porque no se informen desenlaces de interés. Sin embargo, en ocasiones será conveniente incluir sólo los estudios que hayan medido desenlaces concretos. Por ejemplo, una revisión de una intervención de salud pública de varios componentes que promueva estilos de vida saludables, y que se centre en la reducción de la prevalencia del tabaquismo, podría legítimamente excluir los estudios que no midieran las tasas de tabaquismo. MECIR conduct standard 8 [Aclarar con antelación si los desenlaces que figuran en los "Criterios para la consideración de los estudios para esta revisión" se utilizan como criterios para la inclusión de los estudios (en lugar de como una lista de los desenlaces de interés en la que se incluya cualquier estudio).] [PRISMA ítem 6] 33 Resultados de interés (O) Indicar los resultados primarios y secundarios de interés para la revisión, y definir las formas aceptables de medirlos. Explicar cómo se abordan las múltiples variantes de las medidas de resultado (por ejemplo, las definiciones, los evaluadores, las escalas, los puntos temporales). MECIR conduct standard 14 (Definir con antelación cuales son los desenlaces primarios y cuáles los desenlaces secundarios.) También MECIR conduct standards 15 – 18. 46 Métodos de búsqueda para la identificación de los estudios Nº Tema Estándar Fundamentos y elaboración 34 Fuentes de búsqueda (O) Listar todas las fuentes de búsqueda, incluyendo: bases de datos, registros de ensayos, sitios web y literatura gris. Los nombres de las bases de datos deberían incluir el nombre de la plataforma/del proveedor y las fechas de cobertura; los sitios web deben incluir el nombre completo y la dirección URL. Indicar si se hicieron búsquedas en listas de referencias y si se contactó con individuos u organizaciones. MECIR conduct standard 36 (Documentar el proceso de búsqueda detalladamente para asegurar que pueda ser descrito correctamente en la revisión.) También MECIR conduct standards 24 – 31. [PRISMA ítem 7] 35 Búsquedas más recientes (O) Proporcionar la fecha de la última búsqueda y el número/versión (cuando sea pertinente) para cada base de datos, cuyos resultados hayan sido evaluados e incorporados en la revisión. Si la búsqueda se repitió antes de su publicación y los resultados no fueron incorporados, explicar cómo se trataron los resultados y proporcionar la fecha. La revisión debe proporcionar la fecha de búsqueda de estudios que han sido recuperados y evaluados para su inclusión. Ésta es la fecha hasta la cual las conclusiones de la revisión son válidas. Debe reflejar la fecha de la serie más reciente de búsquedas de la cual todos los registros hayan sido cribados y para la cual todos los estudios que cumplen los criterios de elegibilidad se hayan incorporado plenamente a la revisión (los estudios pueden estar a la espera de clasificación si, por ejemplo, los autores de la revisión están esperando la traducción o una aclaración de los autores o patrocinadores). Puesto que probablemente la revisión se haya basado en búsquedas realizadas en múltiples bases de datos, es posible que esas búsquedas se realizaran en más de una fecha. La fecha más antigua de la serie más reciente de búsquedas debe indicarse en el texto de la revisión y en la casilla de registro de la última búsqueda. Las fechas restantes para otras bases de datos deben informarse en un anexo. 47 Manual Cochrane Si se realizó una búsqueda de actualización con posterioridad a la redacción de la revisión, cualquier estudio relevante que no haya sido aún evaluado para su inclusión debe aparecer listado en la sección "Estudios en espera de evaluación". Cont. 35 MECIR conduct standard 37 (Ejecutar de nuevo o actualizar las búsquedas para todas las bases de datos relevantes en el plazo de 12 meses antes de la publicación o actualización de la revisión, y examinar los resultados de los estudios potencialmente elegibles.) MECIR conduct standard 38 (Incorporar al completo cualquier estudio identificado en la repetición o actualización de la búsqueda durante los 12 meses anteriores a la publicación o actualización de la revisión.) [PRISMA ítem 7] 36 Marco temporal de la búsqueda (O) Indicar y justificar las restricciones impuestas al período de tiempo cubierto por la búsqueda. MECIR conduct standard 35 (Justificar la aplicación de cualquier restricción en la estrategia de búsqueda, en la fecha de publicación, el formato de publicación o el idioma.) 37 Búsquedas de diferentes tipos de evidencia (O) Si la revisión tiene criterios específicos de elegibilidad para incluir estudios adicionales, tales como estudios de efectos adversos, evidencia de economía de la salud o evidencia de investigación cualitativa , describir los métodos de búsqueda para la identificación de tales estudios. Algunas revisiones se extienden más allá de un enfoque en los efectos de las intervenciones sanitarias y abordan tipos de evidencia específica adicional. MECIR conduct standard 26 (Si la revisión tiene criterios específicos de elegibilidad en cuanto al diseño de los estudios para abordar los efectos adversos, las cuestiones económicas o preguntas de investigación cualitativa, realizar búsquedas para cubrir estos puntos.) 48 14 15 20 38 Estrategias de búsqueda para bases de datos bibliográficas (O) Presentar en un Apéndice la estrategia (o estrategias) literal de búsqueda utilizada al menos para una base de datos, incluyendo los límites y los filtros usados, de modo que pueda ser repetida. Las estrategias de búsqueda que están disponibles en otros lugares (por ejemplo, filtros metodológicos estándar o estrategias utilizadas para alimentar un registro especializado) pueden ser referenciadas en lugar de reproducidas. Es opcional incluir el número de resultados para cada línea de la estrategia. MECIR conduct standard 36 (Documentar el proceso de búsqueda detalladamente para asegurar que pueda ser informado correctamente en la revisión.) También MECIR conduct standards 32 – 35. [PRISMA ítem 8] 39 Estrategias de búsqueda para otras fuentes (O) Informar los términos de búsqueda utilizados para buscar en otras fuentes que no sean bases de datos bibliográficas (por ejemplo, registros de ensayos, la web), y las fechas de las búsquedas. Parte de esta información podría estar mejor ubicada en un Apéndice. MECIR conduct standard 36 (Documentar el proceso de búsqueda detalladamente para asegurar que pueda ser informado correctamente en la revisión.) 49 Obtención y análisis de los datos Nº Tema Estándar Fundamentos y elaboración 40 Decisiones acerca de la inclusión (O) Indicar cómo se tomaron las decisiones acerca de la inclusión (es decir, desde los resultados de la búsqueda a los estudios incluidos), aclarando cuántas personas participaron y trabajaron de forma independiente. MECIR conduct standard 39 Emplear (al menos) dos personas que trabajen de forma independiente para determinar si cada estudio cumple con los criterios de elegibilidad, y definir anticipadamente el proceso para resolver los desacuerdos.) [PRISMA ítem 9] 41 Proceso de recopilación de datos (O) Indicar cómo se extrajeron los datos de los informes de los estudios incluidos, aclarando cuántas personas participaron (y si lo hicieron de forma independiente), y cómo se manejaron los desacuerdos. Describir el proceso de recopilación de datos para cualquier informe que requiera traducción. MECIR conduct standard 43 Utilizar un formulario de recogida de datos que haya sido probado.) MECIR conduct standard 45 Emplear (al menos) dos personas que trabajen de forma independiente para extraer las características de los estudios a partir de los informes de cada estudio, y definir con antelación el proceso para resolver los desacuerdos.) [PRISMA ítem 10] 42 Solicitud de datos (MC) Describir los intentos para obtener o aclarar los datos por parte de personas u organizaciones. MECIR conduct standard 49 (Buscar información clave inédita que no se encuentra en los informes de los estudios incluidos). [PRISMA ítem 10] 43 Datos (O) Listar los tipos de información que se buscaron a partir de los informes de los estudios incluidos. MECIR conduct standard 44 Recopilar las características de los estudios incluidos con el suficiente detalle para completar la tabla "Características de los estudios incluidos".) [PRISMA ítem 11] 50 Manual Cochrane 44 Transformación de los datos (O) Explicar cualquier transformación de los datos antes de su presentación en la revisión, junto con las hipótesis formuladas. Explicar los procedimientos para la extracción de los datos numéricos de los gráficos. MECIR conduct standard 47 (Recopilar y utilizar los datos numéricos más detallados que puedan facilitar análisis similares de los estudios incluidos. Cuando las tablas 2×2 ó las medias y desviaciones estándar no estén disponibles, se podrían incluir las estimaciones del efecto (p. ej., odds ratio, coeficientes de regresión), intervalos de confianza, pruebas estadísticas (p. ej., t, F, Z, ji cuadrado) o los valores de P, o incluso los datos de los participantes individuales.) 45 Datos de resultados ausentes (valores missing) (MC) Explicar cómo se manejaron los datos de resultado ausentes (valores missing). Describir qué asunciones se han realizado para los datos ausentes (método de imputación), por ejemplo, arrastre de la última observación disponible (last observation carried forward), o asignación de valores particulares como el peor escenario o el mejor escenario posible. 46 Herramientas para evaluar el riesgo de sesgo en los estudios individuales (O) Indicar la herramienta(s) utilizada(s) para evaluar el riesgo de sesgo de los estudios incluidos, cómo se implementó(aron) la(s) herramienta(s), así como los criterios utilizados para asignar a los estudios, por ejemplo, los juicios de bajo riesgo, alto riesgo y riesgo de sesgo incierto. Si la guía del Manual Cochrane (Handbook) para la realización de las evaluaciones de riesgo de sesgo se siguió en su totalidad, entonces, una referencia al Manual Cochrane (Handbook) es suficiente para proporcionar los criterios utilizados para asignar las valoraciones. Justificar cualquier desviación de la herramienta. MECIR conduct standard 52 (Evaluar el riesgo de sesgo para cada estudio incluido. Para los ensayos aleatorios, debe utilizarse la herramienta Cochrane "Riesgo de sesgo", que incluye criterios y apoyos para esas valoraciones para una serie de dominios de sesgo. MECIR conduct standards 53 – 61. [PRISMA ítem12] 51 8,9 a 8,15* 8 (versión 5 o posterior) 47 Medidas del efecto (O) Indicar las medidas del efecto empleadas por los autores de la revisión para describir los tamaños del efecto (p. ej., razón de riesgos, diferencia de medias) en cualquier estudio incluido y/o metanálisis. 48 Síntesis cuantitativa (O) Describir los métodos para combinar los resultados entre los estudios (p. ej., metanálisis, análisis de subgrupos, metarregresión, análisis de sensibilidad), incluidos los métodos de evaluación de la heterogeneidad (p. ej., I2, tau-cuadrado, prueba estadística). Referenciar el software y el comando/macro/ programa utilizado para los análisis realizados fuera de RevMan. MECIR conduct standard 63 (Realizar (o mostrar) un metanálisis sólo si los participantes, las intervenciones, las comparaciones y los resultados se consideran suficientemente similares para asegurar una respuesta clínicamente significativa.) MECIR conduct standard 64 (Evaluar la presencia y el alcance de la variación entre los estudios al realizar un metanálisis.) [PRISMA ítems 12, 13, 14 y 16] 49 Consideración del riesgo de sesgo (O) Describir cómo se abordan en la síntesis los estudios con riesgo de sesgo alto o variable. MECIR conduct standard 60 Considerar el riesgo de sesgo en la síntesis (ya sea cualitativa o cuantitativa). Por ejemplo, presentar los análisis estratificados según el riesgo de sesgo global, o restringido a estudios con bajo riesgo de sesgo.) 50 Diseños no estándar (O) Si se incluyen otros diseños que no sean ensayos clínicos con diseño paralelo que aleatorizan individuos, describir los métodos utilizados para abordar los conglomerados (clusters), el apareamiento (matching) u otras características del diseño de los estudios incluidos. MECIR conduct standard 71 (Considerar el impacto en el análisis de los conglomerados (clusters), el apareamiento (matching) u otras características no estándar del diseño de los estudios incluidos.) 51 Estudios con más de dos grupos (O) Si se incluyen estudios con múltiples brazos, explicar cómo se abordan y se incorporan en las síntesis. MECIR conduct standard 67 (Si se incluyen estudios con múltiples brazos, analizar los grupos de intervención múltiple de manera adecuada que evite la omisión arbitraria de los grupos relevantes y el doble recuento de participantes.) 52 52 Riesgo de sesgo de información en los estudios (MC) Describir los métodos utilizados para evaluar el riesgo de los sesgos de información como el sesgo de publicación. [PRISMA ítem 15] 53 Análisis de subgrupos (O) Si se realizó un análisis de subgrupos (o metarregresión), indicar los potenciales modificadores del efecto y la justificación de cada uno, mencionando si se definieron a priori o post hoc. MECIR conduct standard 22 (Predefinir los potenciales modificadores del efecto (p. ej., para los análisis de subgrupos) en la etapa del protocolo; restringir su número; y aportar un fundamento para cada uno de ellos.) [PRISMA ítem 16] 54 Resumen de los resultados (MC) Indicar los métodos para resumir los hallazgos de la revisión, incluida la evaluación de la calidad del conjunto de la evidencia para cada resultado. MECIR conduct standard 75 (Incluir la tabla "Resumen de los resultados" según las recomendaciones descritas en el Capítulo 10 del Manual Cochrane (Handbook) (versión 5 ó posterior). Específicamente: incluir los resultados para un grupo de población (con pocas excepciones); indicar la intervención y la intervención de comparación; incluir siete o menos desenlaces importantes para los pacientes; describir los resultados (por ejemplo, la escala, las puntuaciones, el seguimiento); indicar el número de participantes y de estudios para cada resultado; presentar al menos un riesgo inicial para cada resultado dicotómico (por ejemplo, el riesgo de la población de estudio o el riesgo mediano/medio) y las puntuaciones iniciales para los resultados continuos (si procede); resumir el efecto de la intervención (si procede); e 53 incluir una medida de la calidad del conjunto de la evidencia) MECIR conduct standard 76 (Utilizar las cinco consideraciones GRADE (limitaciones del estudio, consistencia del efecto, imprecisión, evidencia indirecta y el sesgo de publicación) para evaluar la calidad del conjunto de la evidencia para cada desenlace, y para extraer conclusiones sobre la calidad de la evidencia en el texto de la revisión.) [PRISMA ítem 12] Cont. 54 54 Resultados Descripción de los estudios Nº Tema Estándar Fundamentos y elaboración 55 Flujo de los estudios (O) Proporcionar información sobre el flujo de estudios desde el número de referencias identificadas en la búsqueda al número de estudios incluidos en la revisión, idealmente utilizando un diagrama de flujo. Aclarar cómo múltiples referencias para el mismo estudio se relacionan con los estudios individuales. 56 Falta de estudios incluidos (MC) Si una revisión no identifica estudios elegibles, restringir la sección Resultados a una descripción del flujo de los estudios y a comentarios breves sobre las razones para la exclusión de los estudios. 57 Estudios excluidos (O) Listar los estudios clave excluidos y proporcionar justificación para cada exclusión. 58 Estudios en espera de clasificación (MC) Listar las características de los estudios que se han identificado como potencialmente elegibles, pero no han sido incorporados a la revisión. MECIR conduct standard 41 (Documentar el proceso de selección detalladamente para completar el diagrama de flujo PRISMA y la tabla "Características de los estudios excluidos".) MECIR conduct standard 42 (Recopilar todos los informes de un mismo estudio, de manera que cada estudio, en lugar de cada informe, sea la unidad de interés en la revisión.) [PRISMA ítem 17] En "Riesgo de sesgo en los estudios incluidos" y "Efectos de las intervenciones", indicar "Ningún estudio cumplió con los criterios de elegibilidad". Cualquier discusión de la evidencia que no cumpla los criterios de elegibilidad de la revisión debe aparecer en la sección Discusión. La tabla "Características de los estudios excluidos" se concibe como una ayuda a los usuarios en lugar de una lista exhaustiva de los estudios que se han identificado pero no incluido. Enumerar aquí cualquier estudio que un usuario pueda razonablemente esperar encontrar en la revisión para explicar por qué se excluye. Los usuarios de la revisión estarán interesados en conocer los estudios potencialmente relevantes que se han realizado y que son conocidos por el equipo de revisión, pero aún no han sido incorporados a la revisión. Esto les ayudará a evaluar la estabilidad de los hallazgos de la revisión. Éstos deben aparecer listados en la tabla "Características de los estudios en espera de clasificación", junto con la información que se conozca de los mismos. 55 Manual Cochrane 7.2.5 59 Estudios en curso (O) Proporcionar información de los estudios identificados que no han sido completados. 60 Tabla "Características de los estudios incluidos" (O) Estudios incluidos (O) Presentar una tabla de "Características de los estudios incluidos" utilizando un formato uniforme en todos los estudios. Tabla "Características de los estudios incluidos": tamaños de la muestra (O) Tabla "Características de los estudios incluidos": métodos (O) Tabla "Características de los estudios incluidos": participantes (O) Indicar el tamaño de la muestra para cada estudio incluido en la tabla "Características de los estudios incluidos". Si los tamaños de la muestra están disponibles para cada grupo de intervención, éstos deben ser incluidos. Un lugar conveniente es, a menudo, dentro de la columna para las Intervenciones (por ejemplo, insertando "(n =.))", después de cada grupo de intervención en la lista. Proporcionar el diseño básico del estudio o características del diseño (p. ej., ensayo aleatorio de grupos paralelos, ensayo aleatorio por clusters, estudio controlado tipo antes y después (before and after study). Proporcionar información suficiente sobre las poblaciones de estudio para permitir a un usuario de la revisión evaluar la aplicabilidad de los hallazgos de la revisión a su propio entorno. Incluso si la revisión se restringe a un único diseño de estudio, estas tablas deben proporcionar un resumen exhaustivo de cada estudio. Es importante que las etiquetas utilizadas para describir los diseños de estudio estén claramente definidas en la revisión. [PRISMA ítem 18] La información presentada en esta tabla debería reflejar las características demográficas iniciales de la muestra del estudio. Además, es útil para establecer los criterios de elegibilidad del estudio. [PRISMA ítem 18] 61 62 63 64 Los usuarios de la revisión estarán interesados en conocer los estudios potencialmente relevantes que no hayan sido completados. Esto les ayudará a evaluar la estabilidad de los hallazgos de la revisión. Éstos deben aparecer listados en la tabla "Características de los estudios en curso", junto con la información que se conozca de los mismos. MECIR conduct standard 44 (Recopilar detalladamente las características de los estudios incluidos para completar la tabla "Características de los estudios incluidos".) [PRISMA ítem 18] Proporcionar un breve resumen narrativo de los estudios incluidos. Éste debe incluir el número de participantes y un resumen de las características de las poblaciones de estudio y ámbitos, las intervenciones, los comparadores y las fuentes de financiación. 56 4.5 13.2 65 Tabla "Características de los estudios incluidos": intervencio-nes (O) Proporcionar información suficiente para permitir a los usuarios de la revisión evaluar la aplicabilidad de la intervención a su propio ámbito, y si es posible de una manera que permita que la intervención pueda ser reproducida. Por ejemplo, para las intervenciones farmacológicas, considerar la dosis, la vía, la frecuencia y la duración; o para intervenciones complejas, especificar los componentes principales de la intervención. Deben evitarse explicaciones extensas de las intervenciones. Pueden incluirse las citas de las fuentes de descripciones detalladas. [PRISMA ítem 18] 66 Tabla "Características de los estudios incluidos": desenlaces (O) Proporcionar información clara y consistente acerca de los desenlaces medidos (o informados), cómo fueron medidos y los momentos en que fueron medidos. Debe quedar claro si los principales desenlaces de interés de la revisión se midieron en el estudio. 67 Tabla "Características de los estudios incluidos": fechas (MC) Incluir las fechas en las que se realizó el estudio en la tabla "Características de los estudios incluidos". Si las fechas no están disponibles, entonces habrá que indicarlo (p. ej., "Fechas del estudio no informadas"). [PRISMA ítem 18] 68 Tabla "Características de los estudios incluidos": fuente de financiación (O) Tabla "Características de los estudios incluidos": declaraciones de interés (O) Incluir detalles sobre las fuentes de financiación para el estudio, cuando estén disponibles. Los detalles de las fuentes de financiación deben colocarse en esta tabla y no como parte de la tabla "Riesgo de sesgo". Se recomienda la inclusión de una fila adicional en la tabla "Características de los estudios incluidos". Incluir los detalles de cualquier declaración de interés entre los investigadores principales. Las declaraciones de interés deberían ser colocadas en esta tabla y no como parte de la tabla "Riesgo de sesgo". Se recomienda la inclusión de una fila adicional en la tabla "Características de los estudios incluidos". 69 57 70 Elección de los grupos de intervención en estudios con múltiples brazos (MC) Si se incluye un estudio con más de dos brazos de intervención, restringir los comentarios sobre los brazos irrelevantes a un breve comentario en la tabla "Características de los estudios incluidos". 71 Referencias a los estudios incluidos (O) Listar todos los informes de cada estudio incluido con el ID de estudio pertinente. Los brazos de la intervención que no son relevantes para la pregunta de la revisión no deben discutirse detalladamente, aunque es útil aclarar (en esta tabla) que esos brazos estaban presentes. MECIR conduct standard 50 (Si un estudio se incluye con más de dos brazos de intervención, incluir en la revisión sólo los grupos de intervención y de control que cumplan con los criterios de elegibilidad.) [PRISMA ítem 18] Riesgo de sesgo en los estudios incluidos Nº Tema Estándar Fundamentos y elaboración 72 Tabla "Riesgo de sesgo" (O) Presentar una tabla de "Riesgo de sesgo" para cada estudio incluido, con las valoraciones acerca de los riesgos de sesgo, y apoyos explícitos para estas valoraciones. 73 Resumen de las evaluaciones del riesgo de sesgo (MC) Riesgo de sesgo en los estudios incluidos (O) Resumir el riesgo de sesgo de todos los dominios para cada desenlace clave de cada estudio incluido, y asegurar que está apoyado por la información presentada en las tablas "Riesgo de sesgo". Se debe utilizar la tabla "Riesgo de sesgo" de RevMan, que es una extensión de la tabla "Características de los estudios incluidos". MECIR conduct standard 52 (Evaluar el riesgo de sesgo de cada estudio incluido. Para los ensayos aleatorios, debe utilizarse la herramienta Cochrane "Riesgo de sesgo", que incluye criterios y apoyos para esas valoraciones para una serie de dominios de sesgo. También MECIR conduct standards 54 – 61. [PRISMA ítem 19] MECIR conduct standard 59 (Resumir el riesgo de sesgo para cada resultado clave en cada estudio.) [PRISMA ítem 22] 74 Proporcionar un breve resumen narrativo de los riesgos de sesgo entre los estudios incluidos. 58 Puede ser útil identificar los estudios considerados de bajo riesgo de sesgo para determinados desenlaces clave. [PRISMA ítems 22 y 25] Manual Cochrane 8 (versión 5 o posterior) Efectos de las intervenciones Nº Tema Estándar Fundamentos y elaboración 75 Uso de encabezamientos en "Datos y análisis" (O) Asegurar el uso apropiado de la jerarquía de Comparaciones / Resultados / Subgrupos / Datos del estudio en la sección "Datos y análisis". El uso apropiado de la jerarquía garantiza la coherencia de la estructura entre las revisiones. Es confuso para el usuario si los desenlaces se listan bajo el título "Comparación" y las intervenciones bajo el título "Resultado o subgrupo". 76 Presentación de los datos (MC) Asegurar que, para cada estudio y para cada desenlace de interés de la revisión, se proporciona un resumen simple de los datos para cada grupo de intervención, así como las estimaciones del tamaño del efecto (para la comparación de los grupos de intervención). Éstos aparecen por defecto cuando se analizan los datos de resultados dicotómicos o continuos en RevMan. Cuando estén disponibles, deberían presentarse resúmenes simples, tales como el número de eventos, las medias y las desviaciones estándar para cada grupo de tratamiento. Esto se logra principalmente mediante el uso de la sección "Datos y análisis" de la revisión, para los resultados dicotómicos y continuos. Para otros resultados, éstos deberían presentarse típicamente en las tablas "Otros datos". Cuando estén disponibles por separado los datos de cada grupo de intervención para los resultados analizados como datos de "Varianza inversa genérica", éstos podrían presentarse en Tablas adicionales. [PRISMA ítem 20] 77 Número de estudios y participantes (O) Indicar cuántos estudios y cuántos participantes aportaron datos a los resultados para cada variable de resultado, junto con la proporción de los estudios incluidos y de participantes reclutados potencialmente disponibles para la comparación pertinente. Es poco probable que el mismo número de estudios aporte datos para cada desenlace de interés. Estudios específicos pueden aportar diferentes números de participantes para diferentes resultados. Por lo tanto, para cada comparación, es útil indicar a los lectores qué proporción de los estudios relevantes incluidos y de participantes reclutados aportan datos a cada resultado. No mostrar esta información puede llevar a conclusiones erróneas. [PRISMA ítem 9] 59 Manual Cochrane 78 Fuentes de datos (MC) Indicar la fuente de todos los datos presentados en la revisión, en particular, si se han obtenido a partir de la literatura publicada, por correspondencia, a partir de un registro de ensayos clínicos, de un archivo de datos en Internet, etc. La transparencia de la fuente de datos permite la validación o verificación de los datos por parte de otros, incluyendo editores o lectores de la revisión. 79 Datos de resultados múltiples (O) Describir cualquier decisión post hoc que pueda dar lugar a acusaciones de un informe selectivo de resultados, por ejemplo, cuando hay múltiples medidas de resultado (p. ej., diferentes escalas), múltiples puntos temporales o múltiples formas de presentación de los resultados. La descripción transparente de las decisiones tomadas post-hoc permitirá a los lectores de la revisión evaluar la credibilidad de los resultados de la revisión por sí mismos. MECIR conduct standard 16 (Definir anticipadamente los detalles de lo que se consideran medidas de resultado aceptables (p. ej., criterios de diagnóstico, escalas, resultados compuestos).) MECIR conduct standard 17 [Definir anticipadamente cómo se seleccionarán las medidas de resultado cuando existen varias medidas posibles (p. ej., múltiples definiciones, evaluadores o escalas)]. MECIR conduct standard 18 (Definir anticipadamente el momento de la medición de los resultados.) 80 Orden de los resultados y sección "Datos y análisis" (MC) Organizar los resultados para seguir el orden de las comparaciones y los resultados especificados en el protocolo, en particular la distinción entre los desenlaces primarios y secundarios. Los autores de la revisión deben evitar una información selectiva de resultados que dependa de los hallazgos. La mejor manera de lograr esto es seguir un protocolo bien estructurado y presentar los resultados como se indica en ese protocolo. Sin embargo, a veces debe tomarse una decisión pragmática y elegir una ordenación alternativa, particularmente con respecto a las comparaciones. Esta elección debe ser explícitamente justificada. 60 81 Resultados preespecificados (O) 82 Incertidumbre estadística (O) 83 84 85 Informar la síntesis de los resultados de todos los desenlaces especificados previamente, con independencia de la fuerza y dirección del resultado. Indicar si los datos no estaban disponibles para los desenlaces de interés, incluyendo si los daños fueron identificados. Acompañar todas las estimaciones del tamaño del efecto con una medida de incertidumbre estadística (p. ej., un intervalo de confianza con un nivel de confianza especificado como 90%, 95% o 99%). Para evitar el informe selectivo de los resultados (real o percibido), la revisión debe abordar todos los desenlaces especificados en el protocolo. [PRISMA ítem 20] Valores de P (MC) Si se informan los valores de P, proporcionar valores P exactos (p. ej., P = 0,08 en lugar de P > 0,05). Las estimaciones del efecto con intervalos de confianza son el método preferente de presentación de los resultados numéricos. Los valores de P no deben ser utilizados como una alternativa a los intervalos de confianza y no deben usarse para dividir los resultados en "significativos" o "no significativos"; los valores de P exactos reflejan la fuerza de la evidencia en contra de la hipótesis nula. Tablas y Figuras (O) Número de Tablas y Figuras (MC) Crear un enlace a cada Tabla y Figura. Restringir el número de Tablas y Figuras a un pequeño número para transmitir los hallazgos clave sin que ello afecte a la legibilidad del texto de la revisión. 61 Los intervalos de confianza son el método preferido para la expresión de la incertidumbre estadística. [PRISMA ítem 20] Pueden añadirse Tablas (normalmente implementadas como Tablas adicionales) y Figuras (incluyendo diagramas de flujo de RevMan, diagramas de bosque de RevMan y gráficos importados) a las revisiones e incluirlas en el cuerpo del texto. Las revisiones deben tratar de evitar la inclusión de más de seis Tablas y Figuras. Las Tablas y Figuras adicionales pueden ser incluidas como material complementario (p. ej., como diagramas de bosque de "Datos y análisis" o en apéndices). 12.4.2 86 87 88 Consistencia de los resultados (O) Diferentes escalas (O) Asegurar que todos los resultados estadísticos presentados en el texto de la revisión principal son consistentes entre el texto y las tablas de "Datos y análisis". Explicar cómo se combinaron los estudios que medían un desenlace de interés usando diferentes escalas (por ejemplo, escalas de calificación alternativas que miden síntomas o comportamientos), indicando si los valores positivos o negativos reflejan beneficio o daño. Interpretabilidad de los resultados (O) Asegurar que los hallazgos clave son interpretables, o se reexpresan de forma interpretable. Por ejemplo, pueden ser reexpresados en términos absolutos (como los riesgos asumidos y correspondientes, NNT, medias grupales), y los resultados combinados con una escala estandarizada (por ejemplo, DME) podrían ser reexpresados en unidades que son comprensibles de manera más natural. Si existen tamaños del efecto clínicamente importantes, deben proporcionarse para facilitar la interpretación. 62 Si los datos de diferentes escalas se combinan y se presentan en una escala estandarizada (tal como una diferencia de medias estandarizada), es importante aclarar que un tamaño del efecto positivo tiene el mismo significado para cada estudio. Debe indicarse la dirección del beneficio o daño. . MECIR conduct standard 62 (Si los estudios se combinan con diferentes escalas, asegurar que las puntuaciones más altas para los resultados continuos tienen el mismo significado para un desenlace en particular; explicar la dirección de la interpretación; e informar si las direcciones se invierten. Los efectos absolutos proporcionan una ilustración útil del posible impacto de la intervención, y suelen ser más fáciles de entender que los efectos relativos. Sin embargo, puede ser necesario acompañarlos de información sobre los riesgos iniciales asumidos. Deberían presentarse los intervalos de confianza para los NNT y medidas de resumen similares. Reexpresar los efectos relativos como efectos absolutos a menudo requiere la especificación de los riesgos asumidos (p.ej., sin tratar), debiéndose proporcionar la fuente de éstos. Los resultados expresados como diferencias de medias estandarizadas reflejan la diferencia (número) de desviaciones estándar entre las respuestas medias. Esto no es intuitivo para muchos lectores que pueden estar más familiarizados con escalas específicas. Los tamaños del efecto clínicamente importantes deberían idealmente especificarse en el protocolo. 89 Estudios sin datos utilizables (O) Comentar el impacto potencial de los estudios que aparentemente midieron desenlaces, pero no aportaron datos que permitieran su inclusión en la síntesis. 90 Falta de datos de resultados (MC) Discutir las implicaciones de la falta de datos de los resultados de participantes individuales (debido a las pérdidas durante el seguimiento o exclusiones del análisis). 91 Datos asimétricos (MC) Discutir la posibilidad de datos asimétricos y sus implicaciones en el análisis de los resultados continuos. MECIR conduct standard 66 (Considerar la posibilidad de datos asimétricos y sus implicaciones al analizar en el análisis de los resultados continuos). 92 Diagramas de bosque (MC) Presentar los datos de múltiples estudios en diagramas de bosque (utilizando la estructura de "Datos y análisis" de RevMan), cuando sea posible y razonable hacerlo. La presentación de los datos en diagramas de bosque puede ser útil, incluso si los estudios no se combinaron en un metanálisis. [PRISMA ítem 20] 93 Múltiples análisis de subgrupos y análisis de sensibilidad (MC) Si se presentan múltiples análisis de sensibilidad o diferentes formas de subagrupar los mismos estudios, presentarlos en forma de resumen (p. ej., en una única Tabla o Figura) y no en múltiples diagramas de bosque. [PRISMA ítem 23] 63 Existe buena evidencia de información selectiva de resultados entre los ensayos clínicos. Los desenlaces que se cree que se han medido, pero no se han informado en un formato utilizable pueden ser, por lo tanto, sistemáticamente diferentes de los que son utilizables, introduciendo sesgo. "Utilizable" en este sentido se refiere tanto a la incorporación del dato a un metanálisis como a su consideración en una síntesis no estadística de resultados. Los autores pueden considerar el uso de una tabla para indicar qué estudios aportan datos a los resultados de interés de la revisión. MECIR conduct standard 40 (Incluir estudios en la revisión, independientemente de si los datos de los desenlaces medidos se informan de una manera "utilizable. MECIR conduct standard 65 [Considerar las implicaciones de la falta de datos de los resultados de participantes individuales (debido a las pérdidas durante el seguimiento o a exclusiones del análisis)]. 94 Etiquetas en los diagramas (O) Etiquetar la dirección del efecto y los grupos de intervención en los diagramas de bosque con las intervenciones que se comparan. Por defecto, RevMan utiliza actualmente 'Experimental' y 'Control' como etiquetas. Es útil reemplazar éstas con nombres más específicos de la intervención, y es esencial si se intercambia el orden [o para las comparaciones directas (headto-head comparisons)]. La dirección del efecto se debería utilizar de la manera más coherente posible dentro de una revisión. 95 Riesgo de sesgo en los estudios (MC) Presentar los resultados de la evaluación del riesgo de sesgo en todos los estudios (y en todos los dominios) para cada desenlace clave, e indicar si esto conlleva dudas acerca de la validez de los hallazgos de la revisión. Se requiere considerar el riesgo de sesgo en los estudios para la evaluación de la calidad del conjunto de la evidencia (p. ej., utilizando GRADE). [PRISMA ítem 22] 96 Sesgos de información (MC) Presentar los resultados de cualquier evaluación del impacto potencial del sesgo de información en los hallazgos de la revisión. MECIR conduct standard 74 (Considerar el impacto potencial de los sesgos de información en los resultados de la revisión o en los metanálisis que contiene.) [PRISMA ítem 22] 97 Tabla "Resumen de los resultados" (MC) Presentar una tabla "Resumen de los resultados", según las recomendaciones descritas en el Capítulo 11 del Manual Cochrane (Handbook) (versión 5 o posterior). Específicamente: incluir los resultados para un grupo de población claramente definido (con pocas excepciones); indicar la intervención y la intervención de comparación; incluir siete o menos resultados importantes para el paciente; describir los resultados (p. ej., la escala, las puntuaciones, el seguimiento); indicar el número de participantes y de MECIR conduct standard 75 (Incluir una tabla "Resumen de los resultados" según las recomendaciones descritas en el Capítulo 75 del Manual Cochrane (Handbook) (versión 5 ó posterior). Específicamente: incluir los resultados de un grupo de población (con pocas excepciones); indicar la intervención y la intervención de comparación; incluir siete o menos resultados importantes para el paciente; describir los resultados (p. ej., la escala, las puntuaciones, el seguimiento); indicar el número de participantes y de estudios para cada resultado; 64 75 (versión 5 o posterior) Cont. 97 98 Evaluaciones de la calidad del conjunto de la evidencia (O) estudios para cada resultado; presentar al menos un riesgo inicial para cada resultado dicotómico (p. ej., el riesgo de la población de estudio o el riesgo mediano/medio) y las puntuaciones iniciales para los resultados continuos (si procede); resumir el efecto de la intervención (si procede); e incluir una medida de la calidad del conjunto de la evidencia para cada resultado. presentar al menos un riesgo inicial para cada resultado dicotómico (p. ej., riesgo de la población de estudio o riesgo mediano/medio) y las puntuaciones iniciales para los resultados continuos (si procede); resumir el efecto de la intervención (si procede); e incluir una medida de la calidad del conjunto de la evidencia.) [PRISMA ítem 24] Presentar una justificación o fundamento para cualquier medida de la calidad del conjunto de la evidencia para cada desenlace clave. Si se utiliza una tabla "Resumen de los resultados", usar notas a pie de página para explicar cualquier disminución o aumento según el sistema GRADE. MECIR conduct standard 76 [Utilizar las cinco consideraciones GRADE (limitaciones del estudio, consistencia del efecto, imprecisión, evidencia indirecta y sesgo de publicación) para evaluar la calidad del conjunto de la evidencia para cada desenlace, y para extraer conclusiones sobre la calidad de la evidencia en el texto de la revisión.) MECIR conduct standard 77 Justificar y documentar todas las evaluaciones de la calidad del conjunto de la evidencia (por ejemplo, disminución o aumento si se utiliza la herramienta GRADE)]. 65 Discusión Nº Tema Estándar Fundamentos y elaboración Manual Cochrane 99 Encabezamientos de la Discusión (MC) Incluir los encabezamientos estándar al redactar la Discusión Se incluyen cinco encabezamientos estándar en RevMan ("Resumen de los resultados principales", "Completitud y aplicabilidad de la evidencia", "Calidad de la evidencia", "Sesgos potenciales en el proceso de revisión, "Acuerdos y desacuerdos con otros estudios o revisiones"). 4.5 100 Limitaciones (O) Discutir las limitaciones de la revisión a nivel de los estudios y de los resultados (p. ej., en relación al riesgo de sesgo), y a nivel de la revisión (p. ej., identificación incompleta de estudios, sesgo de información). Los autores de la revisión deben especificar las limitaciones de su revisión. Un aspecto que se omite fácilmente es el de los efectos adversos. En particular, si los métodos de revisión no permiten la detección de eventos adversos graves y/o raros, los autores de la revisión deben indicar explícitamente esto como una limitación. MECIR conduct standard 74 (Considerar el impacto potencial de los sesgos de información en los resultados de la revisión o en los metanálisis que contiene.) [PRISMA ítem 25] 66 Conclusiones de los autores Nº Tema Estándar Fundamentos y elaboración 101 Conclusiones: Implicaciones para la práctica (O) Proporcionar una interpretación general de la evidencia para que pueda informar la toma de decisiones médicas o de políticas sanitarias. Evitar hacer recomendaciones para la práctica. MECIR conduct standard 79 (Evitar proporcionar recomendaciones para la práctica). 102 Conclusiones: Implicaciones para la investigación (O) Si se recomienda investigación adicional, estructurar las implicaciones para la investigación para abordar la naturaleza de la evidencia que se necesita, incluyendo la población, la comparación de la intervención, los desenlaces y el tipo de estudio. Los investigadores y los patrocinadores de la investigación son un grupo importante de usuarios de las revisiones Cochrane. Las recomendaciones para la futura investigación deben ofrecer orientación constructiva para abordar las incertidumbres no resueltas identificadas por la revisión. Esto es particularmente importante para las revisiones que identifican pocos o ningún estudio. MECIR conduct standard 80 (Estructurar las implicaciones para la investigación para abordar la naturaleza de la evidencia que se necesita, incluyendo la población, la comparación de la intervención, los desenlaces, y el tipo de estudio). 67 Manual Cochrane Agradecimientos Nº Tema Estándar Fundamentos y elaboración 103 Agradecimientos (O) Agradecer la contribución de las personas que no figuren como autores de la revisión, incluida cualquier ayuda del Grupo Cochrane de Revisión, aportaciones de otros en las búsquedas, recopilación de datos, evaluación de los estudios o análisis estadístico, y el papel de cualquier patrocinador. [PRISMA ítem 27] Manual Cochrane Contribuciones de los autores Nº Tema Estándar Fundamentos y elaboración 104 Contribuciones de los autores (O) Describir las contribuciones de cada autor Manual Cochrane 4.2.2 Declaraciones de interés Nº Tema Estándar Fundamentos y elaboración Manual Cochrane 105 Declaraciones de interés (O) Informar cualquier afiliación actual o pasada o la implicación en cualquier organización o entidad que tenga interés en los hallazgos de la revisión que pudiera dar lugar a un conflicto de interés real o percibido. La naturaleza y el alcance de la afiliación o implicación (tanto económica como no económica) deben ser descritos. Una consideración adicional para los autores de revisiones sistemáticas es la declaración de su participación en estudios que se incluyeron en la revisión. 2.6 68 Diferencias entre el protocolo y la revisión Nº Tema Estándar Fundamentos y elaboración 106 Cambios respecto del protocolo (O) Explicar y justificar cualquier cambio respecto el protocolo (incluyendo cualquier decisión post hoc sobre los criterios de elegibilidad o la adición de análisis de subgrupos). MECIR conduct standard 13 (Justificar cualquier cambio en los criterios de elegibilidad o desenlaces estudiados. En particular, las decisiones post hoc acerca de la inclusión o exclusión de estudios deben mantenerse fieles a los objetivos de la revisión más que a reglas arbitrarias. 107 Métodos no implementados (MC) Documentar aspectos del protocolo que no se hayan realizado (p. ej., porque se encontraron pocos o ningún estudio) en la sección "Diferencias entre el protocolo y la revisión", en lugar de en la sección de Métodos. Manual Cochrane 2.1 Fuentes de apoyo Nº Tema Estándar Fundamentos y elaboración 108 Financiación (O) Listar las fuentes de financiación para la revisión y el papel del financiador, si existe alguno. [PRISMA ítem 28] Manual Cochrane 4.10 * Estos números de la sección del Manual Cochrane (Handbook) son específicos de la versión 5.1. Los demás números de sección se aplican por igual a la edición de 2008 (y a las reimpresiones de 2009), publicada por Wiley-Blackwell. 69