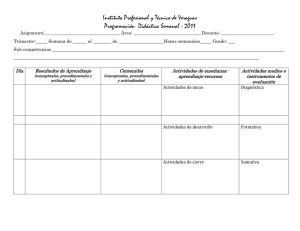
Programación Bachillerato
Anuncio

PROGRAMACIÓN DIDÁCTICA BACHILLERATO DEPARTAMENTO DE FÍSICA Y QUÍMICA I.E.S. MIGUEL DE CERVANTES INTRODUCCIÓN El bachillerato forma parte de la educación secundaria postobligatoria y comprende dos cursos académicos. Se desarrolla en modalidades diferentes, se organiza de modo flexible y, en su caso, en distintas vías dentro de cada modalidad, a fin de que pueda ofrecer una preparación especializada al alumnado acorde con sus perspectivas e intereses de formación o permita la incorporación a la vida activa una vez finalizado el mismo. El bachillerato tiene como finalidad proporcionar a los estudiantes formación, madurez intelectual y humana, conocimientos y habilidades que les permitan desarrollar funciones sociales e incorporarse a la vida activa con responsabilidad y competencia. Asimismo, capacitara a los alumnos para acceder a la educación superior. Para la siguiente programación, se ha tenido en cuenta la normativa vigente en relación al bachillerato. RD 1467/2007, por el que se establece la estructura del bachillerato y se fijan sus enseñanzas mínimas. (BOE 6-11-2007) DECRETO 416/2008, de 22 de julio, por el que se establece la ordenación y las enseñanzas correspondientes al Bachillerato en Andalucía. (BOJA 28-7-2008) ORDEN de 5-8-2008, por la que se desarrolla el currículo correspondiente al Bachillerato en Andalucía. (BOJA 26-8-2008) ORDEN de 15-12-2008, por la que se establece la ordenación de la evaluación del proceso de aprendizaje del alumnado de bachillerato en la Comunidad Autónoma de Andalucía. CONTEXTO EDUCATIVO Una programación para que verdaderamente se adapte a la realidad del aula se tiene que enmarcar en un contexto. La presente programación está contextualizada para el IES Miguel de Cervantes, de la localidad de Granada, enclavado en una zona residencial en un barrio compuesto por varias zonas, una más desfavorecida y otra de reciente construcción con un nivel económico más elevado. El Centro, recoge alumnado de otras zonas de la localidad, así como de otras localidades próximas como Cenes de la Vega, Pinos Genil, Quentar y Güejar Sierra. Las familias son de renta media y la mayoría de los padres de los alumnos tienen estudios secundarios y trabajan en el sector servicios. También se da el caso de que en muchas familias son trabajadores el padre y la madre. La oferta formativa del centro es el ciclo completo de la Educación Secundaria Obligatoria y el ciclo completo de Bachillerato con dos modalidades: Bachillerato de Humanidades y Ciencias Sociales y Bachillerato de Ciencias y Tecnología. OBJETIVOS GENERALES El bachillerato contribuirá a desarrollar en los alumnos y las alumnas las capacidades que les permitan: a) Ejercer la ciudadanía democrática, desde una perspectiva global, y adquirir una conciencia cívica responsable, inspirada por los valores de la Constitución española así como por los derechos humanos, que fomente la corresponsabilidad en la construcción de una sociedad justa y equitativa y favorezca la sostenibilidad. b) Consolidar una madurez personal y social que les permita actuar de forma responsable y autónoma y desarrollar su espíritu crítico. Prever y resolver pacíficamente los conflictos personales, familiares y sociales. c) Fomentar la igualdad efectiva de derechos y oportunidades entre hombres y mujeres, analizar y valorar críticamente las desigualdades existentes e impulsar la igualdad real y la no discriminación de las personas con discapacidad. d) Afianzar los hábitos de lectura, estudio y disciplina, como condiciones necesarias para el eficaz aprovechamiento del aprendizaje, y como medio de desarrollo personal. e) Dominar, tanto en su expresión oral como escrita, la lengua castellana y, en su caso, la lengua cooficial de su comunidad autónoma. f) Expresarse con fluidez y corrección en una o más lenguas extranjeras. g) Utilizar con solvencia y responsabilidad las tecnologías de la información y la comunicación. h) Conocer y valorar críticamente las realidades del mundo contemporáneo, sus antecedentes históricos y los principales factores de su evolución. Participar de forma solidaria en el desarrollo y mejora de su entorno social. i) Acceder a los conocimientos científicos y tecnológicos fundamentales y dominar las habilidades básicas propias de la modalidad elegida. j) Comprender los elementos y procedimientos fundamentales de la investigación y de los métodos científicos. Conocer y valorar de forma critica la contribución de la ciencia y la tecnología en el cambio de las condiciones de vida, así como afianzar la sensibilidad y el respeto hacia el medio ambiente. k) Afianzar el espíritu emprendedor con actitudes de creatividad, flexibilidad, iniciativa, trabajo en equipo, confianza en uno mismo y sentido critico. l) Desarrollar la sensibilidad artística y literaria, así como el criterio estético, como fuentes de formación y enriquecimiento cultural. m) Utilizar la educación física y el deporte para favorecer el desarrollo personal y social. FISICA Y QUIMICA 1º Bachillerato La materia de física y química ha de continuar facilitando la impregnación en la cultura científica, iniciada en la etapa anterior, para lograr una mayor familiarización con la naturaleza de la actividad científica y tecnológica y la apropiación de las competencias que dicha actividad conlleva. Al mismo tiempo, esta materia, de la modalidad de Ciencias y tecnología, ha de seguir contribuyendo a aumentar el interés de los estudiantes hacia las ciencias físico químicas, poniendo énfasis en una visión de las mismas que permita comprender su dimensión social y, en particular, el papel jugado en las condiciones de vida y en las concepciones de los seres humanos. Por otra parte, la materia ha de contribuir a la formación del alumnado para su participación como ciudadanos y ciudadanas —y, en su caso, como miembros de la comunidad científica— en la necesaria toma de decisiones en torno a los graves problemas con los que se enfrenta hoy la humanidad. Es por ello por lo que el desarrollo de la materia debe prestar atención igualmente a las relaciones entre ciencia, tecnología, sociedad y ambiente (CTSA), y contribuir, en particular, a que los alumnos y alumnas conozcan aquellos problemas, sus causas y medidas necesarias —en los ámbitos tecno científico, educativo y político— para hacerles frente y avanzar hacia un futuro sostenible. Los contenidos de la materia se organizan en bloques relacionados entre si. Se parte de un bloque de contenidos comunes destinados a familiarizar a los alumnos con las estrategias básicas de la actividad científica que, por su carácter transversal, deberán ser tenidos en cuenta al desarrollar el resto. En la primera parte, dedicada a la física, los contenidos se estructuran en torno a la mecánica y la electricidad. La mecánica se inicia con una profundización en el estudio del movimiento y las causas que lo modifican con objeto de mostrar el surgimiento de la ciencia moderna y su ruptura con dogmatismos y visiones simplistas de sentido común. Se trata de una profundización del estudio realizado en el último curso de la educación secundaria obligatoria, con una aproximación más detenida que incorpore los conceptos de trabajo y energía para el estudio de los cambios. Ello ha de permitir una mejor comprensión de los principios de la dinámica y de conservación y transformación de la energía y de las repercusiones teóricas y practicas del cuerpo de conocimientos construido. El estudio de la electricidad que se realiza a continuación a de contribuir a un mayor conocimiento de la estructura de la materia y a la profundización del papel de la energía eléctrica en las sociedades actuales, estudiando su generación, consumo y las repercusiones de su utilización. En la segunda parte, dedicada a la química, los contenidos se estructuran alrededor de dos grandes ejes. El primero profundiza en la teoría atómicomolecular de la materia partiendo de conocimientos abordados en la etapa anterior, así como la estructura del átomo, que permitirá explicar la semejanza entre las distintas familias de elementos, los enlaces y las transformaciones químicas. El segundo eje profundiza en el estudio de la química del carbono, iniciado en el curso anterior, y ha de permitir que el alumnado comprenda la importancia de las primeras síntesis de sustancias orgánicas, lo que supuso la superación del vitalismo —que negaba la posibilidad de dicha síntesis— contribuyendo a la construcción de una imagen unitaria de la materia e impulsando la síntesis de nuevos materiales de gran importancia por sus aplicaciones. Este estudio de las sustancias orgánicas dedicará una atención particular a la problemática del uso de los combustibles fósiles y la necesidad de soluciones para avanzar hacia un futuro sostenible. La enseñanza de la física y química en el bachillerato tendrá como finalidad contribuir al desarrollo de las siguientes capacidades. 1. Conocer los conceptos, leyes, teorías y modelos mas importantes y generales de la física y la química, así como las estrategias empleadas en su construcción, con el fin de tener una visión global del desarrollo de estas ramas de la ciencia y de su papel social, de obtener una formación científica básica y de generar interés para poder desarrollar estudios posteriores mas específicos. 2. Comprender vivencialmente la importancia de la física y la química para abordar numerosas situaciones cotidianas, así como para participar, como ciudadanos y ciudadanas y, en su caso, futuros científicos y científicas, en la necesaria toma de decisiones fundamentadas en torno a problemas locales y globales a los que se enfrenta la humanidad y contribuir a construir un futuro sostenible, participando en la conservación, protección y mejora del medio natural y social. 3. Utilizar, con autonomía creciente, estrategias de investigación propias de las ciencias (planteamiento de problemas, formulación de hipótesis fundamentadas; búsqueda de información; elaboración de estrategias de resolución y de diseños experimentales; realización de experimentos en condiciones controladas y reproducibles, análisis de resultados, etc.) relacionando los conocimientos aprendidos con otros ya conocidos y considerando su contribución a la construcción de cuerpos coherentes de conocimientos y a su progresiva interconexión. 4. Familiarizarse con la terminología científica para poder emplearla de manera habitual al expresarse en el ámbito científico, así como para poder explicar expresiones científicas del lenguaje cotidiano y relacionar la experiencia diaria con la científica. 5. Utilizar de manera habitual las tecnologías de la información y la comunicación, para realizar simulaciones, tratar datos y extraer y utilizar información de diferentes fuentes, evaluar su contenido y adoptar decisiones. 6. Familiarizarse con el diseño y realización de experimentos físicos y químicos, utilizando la tecnología adecuada para un funcionamiento correcto, con una atención particular a las normas de seguridad de las instalaciones. 7. Reconocer el carácter tentativo y creativo del trabajo científico, como actividad en permanente proceso de construcción, analizando y comparando hipótesis y teorías contrapuestas a fin de desarrollar un pensamiento critico, así como valorar las aportaciones de los grandes debates científicos al desarrollo del pensamiento humano. 8. Apreciar la dimensión cultural de la física y la química para la formación integral de las personas, así como saber valorar sus repercusiones en la sociedad y en el medio ambiente, contribuyendo a la toma de decisiones que propicien el impulso de desarrollos científicos, sujetos a los limites de la biosfera, que respondan a necesidades humanas y contribuyan a hacer frente a los graves problemas que hipotecan su futuro. Criterios de evaluación 1. Analizar situaciones y obtener información sobre fenómenos físicos y químicos utilizando las estrategias básicas del trabajo científico. Se trata de evaluar si los estudiantes se han familiarizado con las características básicas del trabajo científico al aplicar los conceptos y procedimientos aprendidos y en relación con las diferentes tareas en las que puede ponerse en juego, desde la comprensión de los conceptos a la resolución de problemas, pasando por los trabajos prácticos. Este criterio ha de valorarse en relación con el resto de los criterios de evaluación, para lo que se precisa actividades de evaluación que incluyan el interés de las situaciones, análisis cualitativos, emisión de hipótesis fundamentadas, elaboración de estrategias, realización de experiencias en condiciones controladas y reproducibles, análisis detenido de resultados, consideración de perspectivas, implicaciones CTSA del estudio realizado (posibles aplicaciones, transformaciones sociales, repercusiones negativas…), toma de decisiones, atención a las actividades de síntesis, a la comunicación, teniendo en cuenta el papel de la historia de la ciencia, etc. 2. Aplicar estrategias características de la actividad científica al estudio de los movimientos estudiados: uniforme, rectilíneo y circular, y rectilíneo uniformemente acelerado. Se trata de evaluar si el alumnado comprende la importancia de los diferentes tipos de movimientos estudiados y es capaz de resolver problemas de interés en relación con los mismos, poniendo en práctica estrategias básicas del trabajo científico. Se valorara asimismo si conoce las aportaciones de Galileo al desarrollo de la cinemática, así como las dificultades a las que tuvo que enfrentarse; en particular, si comprende la superposición de movimientos, introducida para el estudio de los tiros horizontal y oblicuo, como origen histórico y fundamento del calculo vectorial. 3. Identificar las fuerzas que actúan sobre los cuerpos, como resultado de interacciones entre ellos, y aplicar el principio de conservación de la cantidad de movimiento, para explicar situaciones dinámicas cotidianas. Se evaluara la comprensión del concepto newtoniano de interacción y de los efectos de fuerzas sobre cuerpos en situaciones cotidianas como, por ejemplo, las que actúan sobre un ascensor, un objeto que ha sido lanzado verticalmente, cuerpos apoyados o colgados, móviles que toman una curva, que se mueven por un plano inclinado con rozamiento, etc. Se evaluara así si los estudiantes son capaces de aplicar el principio de conservación de la cantidad de movimiento en situaciones de interés, sabiendo previamente precisar el sistema sobre el que se aplica. 4. Aplicar los conceptos de trabajo y energía, y sus relaciones, en el estudio de las transformaciones y el principio de conservación y transformación de la energía en la resolución de problemas de interés teórico práctico. Se trata de comprobar si los estudiantes comprenden en profundidad los conceptos de energía, trabajo y calor y sus relaciones, en particular las referidas a los cambios de energía cinética, potencial y total del sistema, así como si son capaces de aplicar el principio de conservación y transformación de la energía y comprenden la idea de degradación. Se valorara también si han adquirido una visión global de los problemas asociados a la obtención y uso de los recursos energéticos y los debates actuales en torno a los mismos, así como si son conscientes de la responsabilidad de cada cual en las soluciones y tienen actitudes y comportamientos coherentes. 5. Interpretar la interacción eléctrica y los fenómenos asociados, así como sus repercusiones, y aplicar estrategias de la actividad científica y tecnológica para el estudio de circuitos eléctricos. Con este criterio se pretende comprobar si los estudiantes son capaces de reconocer la naturaleza eléctrica de la materia ordinaria, están familiarizados con los elementos básicos de un circuito eléctrico y sus principales relaciones, saben plantearse y resolver problemas de interés en torno a la corriente eléctrica, utilizar aparatos de medida mas comunes e interpretar, diseñar y montar diferentes tipos de circuitos eléctricos. Se valorara, asimismo, si comprenden los efectos energéticos de la corriente eléctrica y el importante papel y sus repercusiones en nuestras sociedades. 6. Interpretar las leyes ponderales y las relaciones volumétricas de GayLussac, aplicar el concepto de cantidad de sustancia y su medida y determinar formulas empíricas y moleculares. Se pretende comprobar si los estudiantes son capaces de interpretar las leyes ponderales y las relaciones volumétricas de combinación entre gases, teniendo en cuenta la teoría atómica de Dalton y las hipótesis de Avogadro. Asimismo, deberá comprobarse que comprenden la importancia y el significado de la magnitud cantidad de sustancia y su unidad, el mol, y son capaces de determinarla en una muestra, tanto si la sustancia se encuentra sólida, gaseosa o en disolución. También se valorara si saben aplicar dicha magnitud fundamental en la determinación de formulas empíricas y moleculares. 7. Justificar la existencia y evolución de los modelos atómicos, valorando el carácter tentativo y abierto del trabajo científico y conocer el tipo de enlace que mantiene unidas las partículas constituyentes de las sustancias de forma que se puedan explicar sus propiedades. Se pretende comprobar si el alumnado es capaz de identificar que hechos llevaron a cuestionar un modelo atómico y a concebir y adoptar otro que permitiera explicar nuevos fenómenos, reconociendo el carácter hipotético del conocimiento científico, sometido a continua revisión. También se valorara si es capaz de explicar el sistema periódico y su importancia para el desarrollo de la química, así como si conoce los enlaces iónico, covalente, metálico e intermolecular y puede interpretar con ellos el comportamiento de diferentes tipos de sustancias y su formulación. 8. Reconocer la importancia del estudio de las transformaciones químicas y sus repercusiones, interpretar microscópicamente una reacción química, emitir hipótesis sobre los factores de los que depende la velocidad de una reacción, sometiéndolas a prueba, y realizar cálculos estequiométricos en ejemplos de interés práctico. Se evaluara si el alumnado conoce la importancia y utilidad del estudio de transformaciones químicas en la sociedad actual, tales como las combustiones y las reacciones acido base, así como ejemplos llevados a cabo en experiencias de laboratorio y en la industria química. Se valorará si sabe interpretar microscópicamente una reacción química, comprende el concepto de velocidad de reacción y es capaz de predecir y poner a prueba los factores de los que depende, así como su importancia en procesos cotidianos, y sabe resolver problemas sobre las cantidades de sustancia de productos y reactivos que intervienen. 9. Identificar las propiedades físicas y químicas de los hidrocarburos así como su importancia social y económica y saber formularlos y nombrarlos aplicando las reglas de la IUPAC y valorar la importancia del desarrollo de las síntesis orgánicas y sus repercusiones. Se evaluara si los estudiantes valoran lo que supuso la superación de la barrera del vitalismo, así como el espectacular desarrollo posterior de las síntesis orgánicas y sus repercusiones (nuevos materiales, contaminantes orgánicos permanentes, etc.). A partir de las posibilidades de combinación entre el carbono y el hidrogeno, el alumnado ha de ser capaz de escribir y nombrar los hidrocarburos de cadena lineal y ramificados, y conocer sus propiedades físicas y químicas, incluyendo reacciones de combustión y de adición al doble enlace. También habrán de conocer las principales fracciones de la destilación del petróleo y sus aplicaciones en la obtención de muchos de los productos de consumo cotidiano, así como valorar su importancia social y económica, las repercusiones de su utilización y agotamiento y la necesidad de investigaciones en el campo de la química orgánica que puedan contribuir a la sostenibilidad. FISICA 2º Bachillerato La física contribuye a comprender la materia, su estructura y sus cambios, desde la escala más pequeña hasta la más grande, es decir, desde las partículas, núcleos, átomos, etc., hasta las estrellas, galaxias y el propio universo. El gran desarrollo de las ciencias físicas producido en los últimos siglos ha supuesto un gran impacto en la vida de los seres humanos. Ello puede constatarse por sus enormes implicaciones en nuestras sociedades: industrias enteras se basan en sus contribuciones, todo un conjunto de artefactos presentes en nuestra vida cotidiana están relacionados con avances en este campo del conocimiento, sin olvidar su papel como fuente de cambio social, su influencia en el desarrollo de las ideas, sus implicaciones en el medio ambiente, etc. La física es una materia que tiene un carácter formativo y preparatorio. Como todas las disciplinas científicas, las ciencias físicas constituyen un elemento fundamental de la cultura de nuestro tiempo, que incluye no solo aspectos de literatura, historia, etc., sino también los conocimientos científicos y sus implicaciones. Por otro lado, un currículo, que también en esta etapa pretende contribuir a la formación de una ciudadanía informada, debe incluir aspectos como las complejas interacciones entre física, tecnología, sociedad y ambiente, salir al paso de una imagen empobrecida de la ciencia y contribuir a que los alumnos y alumnas se apropien de las competencias que suponen su familiarización con la naturaleza de la actividad científica y tecnológica. Asimismo, el currículo debe incluir los contenidos conceptuales, procedimentales y actitudinales que permitan abordar con éxito estudios posteriores, dado que la física es una materia que forma parte de todos los estudios universitarios de carácter científico y técnico y es necesaria para un amplio abanico de familias profesionales que están presentes en la formación Profesional de Grado Superior. Esta materia supone una continuación de la física estudiada en el curso anterior, centrada en la mecánica de los objetos asimilables a puntos materiales y en una introducción a la electricidad. Se parte de unos contenidos comunes destinados a familiarizar a los alumnos con las estrategias básicas de la actividad científica que, por su carácter transversal, deberán ser tenidos en cuenta al desarrollar el resto. El resto de los contenidos se estructuran en torno a tres grandes ámbitos: la mecánica, el electromagnetismo y la física moderna. En el primero se pretende completar y profundizar en la mecánica, comenzando con el estudio de la gravitación universal, que permitió unificar los fenómenos terrestres y los celestes. Seguidamente, se introducen las vibraciones y ondas en muelles, cuerdas, acústicas, etc., poniendo de manifiesto la potencia de la mecánica para explicar el comportamiento de la materia. A continuación, se aborda el estudio de la óptica y los campos eléctricos y magnéticos, tanto constantes como variables, mostrando la integración de la óptica en el electromagnetismo, que se convierte así, junto con la mecánica, en el pilar fundamental del imponente edificio teórico que se conoce como física clásica. El hecho de que esta gran concepción del mundo no pudiera explicar una serie de fenómenos origino, a principios del siglo XX, tras una profunda crisis, el surgimiento de la física relativista y la cuántica, con múltiples aplicaciones, algunas de cuyas ideas básicas se abordan en el último bloque de este curso. La enseñanza de la física en el bachillerato tendrá como finalidad contribuir a desarrollar en el alumnado las siguientes capacidades: 1. Adquirir y poder utilizar con autonomía conocimientos básicos de la física, así como las estrategias empleadas en su construcción. 2. Comprender los principales conceptos y teorías, su vinculación a problemas de interés y su articulación en cuerpos coherentes de conocimientos. 3. Familiarizarse con el diseño y realización de experimentos físicos, utilizando el instrumental básico de laboratorio, de acuerdo con las normas de seguridad de las instalaciones. 4. Expresar mensajes científicos orales y escritos con propiedad, así como interpretar diagramas, graficas, tablas, expresiones matemáticas y otros modelos de representación. 5. Utilizar de manera habitual las tecnologías de la información y la comunicación para realizar simulaciones, tratar datos y extraer y utilizar información de diferentes fuentes, evaluar su contenido, fundamentar los trabajos y adoptar decisiones. 6. Aplicar los conocimientos físicos pertinentes a la resolución de problemas de la vida cotidiana. 7. Comprender las complejas interacciones actuales de la física con la tecnología, la sociedad y el ambiente, valorando la necesidad de trabajar para lograr un futuro sostenible y satisfactorio para el conjunto de la humanidad. 8. Comprender que el desarrollo de la física supone un proceso complejo y dinámico, que ha realizado grandes aportaciones a la evolución cultural de la humanidad. 9. Reconocer los principales retos actuales a los que se enfrenta la investigación en este campo de la ciencia. Criterios de evaluación 1. Analizar situaciones y obtener información sobre fenómenos físicos utilizando las estrategias básicas del trabajo científico. Se trata de evaluar si los estudiantes se han familiarizado con las características básicas del trabajo científico al aplicar los conceptos y procedimientos aprendidos y en relación con las diferentes tareas en las que puede ponerse en juego, desde la comprensión de los conceptos a la resolución de problemas, pasando por los trabajos prácticos. Este criterio ha de valorarse en relación con el resto de los criterios, para lo que se precisa actividades de evaluación que incluyan el interés de las situaciones, análisis cualitativos, emisión de hipótesis fundamentadas, elaboración de estrategias, realización de experiencias en condiciones controladas y reproducibles, análisis detenido de resultados, consideración de perspectivas, toma de decisiones, atención a las actividades de síntesis, a la comunicación, teniendo en cuenta el papel de la historia de la ciencia, etc. 2. Valorar la importancia de la Ley de la gravitación universal y aplicarla a la resolución de situaciones problemáticas de interés como la determinación de masas de cuerpos celestes, el tratamiento de la gravedad terrestre y el estudio de los movimientos de planetas y satélites. Este criterio pretende comprobar si el alumnado conoce y valora lo que supuso la gravitación universal en la ruptura de la barrera cielos-Tierra, las dificultades con las que se enfrento y las repercusiones que tuvo, tanto teóricas, en las ideas sobre el Universo y el lugar de la Tierra en el mismo, como practicas, en los satélites artificiales. A su vez, se debe constatar si se comprenden y distinguen los conceptos que describen la interacción gravitatoria (campo, energía y fuerza), y saben aplicarlos en la resolución de las situaciones mencionadas. 3. Construir un modelo teórico que permita explicar las vibraciones de la materia y su propagación (ondas), aplicándolo a la interpretación de diversos fenómenos naturales y desarrollos tecnológicos. Se pretende evaluar si los estudiantes pueden elaborar modelos sobre las vibraciones y las ondas en la materia y son capaces de asociar lo que perciben con aquello que estudian teóricamente como, por ejemplo, relacionar la intensidad con la amplitud o el tono con la frecuencia, y conocer los efectos de la contaminación acústica en la salud. Comprobar, asimismo, que saben deducir los valores de las magnitudes características de una onda a partir de su ecuación y viceversa; y explicar cuantitativamente algunas propiedades de las ondas, como la reflexión y refracción y, cualitativamente otras, como las interferencias, la difracción y el efecto Doppler. 4. Utilizar los modelos clásicos (corpuscular y ondulatorio) para explicar las distintas propiedades de la luz. Este criterio trata de constatar que si se conoce el debate histórico sobre la naturaleza de la luz y el triunfo del modelo ondulatorio. también si es capaz de obtener imágenes con la cámara oscura, espejos planos o curvos o lentes delgadas, interpretándolas teóricamente en base a un modelo de rayos, es capaz de construir algunos aparatos tales como un telescopio sencillo, y comprender las múltiples aplicaciones de la óptica en el campo de la fotografía, la comunicación, la investigación, la salud, etc. 5. Usar los conceptos de campo eléctrico y magnético para superar las dificultades que plantea la interacción a distancia, calcular los campos creados por cargas y corrientes rectilíneas y la fuerzas que actúan sobre cargas y corrientes, así como justificar el fundamento de algunas aplicaciones practicas. Con este criterio se pretende comprobar si los estudiantes son capaces de determinar los campos eléctricos o magnéticos producidos en situaciones simples (una o dos cargas, corrientes rectilíneas) y las fuerzas que ejercen dichos campos sobre otras cargas o corrientes en su seno. Asimismo, se pretende conocer si saben utilizar y comprenden el funcionamiento de electroimanes, motores, instrumentos de medida, como el galvanómetro, etc., así como otras aplicaciones de interés de los campos eléctricos y magnéticos, como los aceleradores de partículas y los tubos de televisión. 6. Explicar la producción de corriente mediante variaciones del flujo magnético y algunos aspectos de la síntesis de Maxwell, como la predicción y producción de ondas electromagnéticas y la integración de la óptica en el electromagnetismo. Se trata de evaluar si se comprende la inducción electromagnética y la producción de campos electromagnéticos. también si se justifica críticamente las mejoras que producen algunas aplicaciones relevantes de estos conocimientos (la utilización de distintas fuentes para obtener energía eléctrica o de las ondas electromagnéticas en la investigación, la telecomunicación, la medicina, etc.) y los problemas medioambientales y de salud que conllevan. 7. Utilizar los principios de la relatividad especial para explicar una serie de fenómenos: la dilatación del tiempo, la contracción de la longitud y la equivalencia masa-energía. A través de este criterio se trata de comprobar que el alumnado conoce los postulados de Einstein para superar las limitaciones de la física clásica (por ejemplo, la existencia de una velocidad limite o el incumplimiento del principio de relatividad de Galileo por la luz), el cambio que supuso en la interpretación de los conceptos de espacio, tiempo, cantidad de movimiento y energía y sus múltiples implicaciones, no solo en el campo de las ciencias (la física nuclear o la astrofísica) sino también en otros ámbitos de la cultura. 8. Conocer la revolución científico-tecnológica que tuvo su origen en la búsqueda de solución a los problemas planteados por los espectros continuos y discontinuos, el efecto fotoeléctrico, etc., y que dio lugar a la física quántica y a nuevas y notables tecnologías. Este criterio evaluara si los estudiantes comprenden que los fotones, electrones, etc., no son ni ondas ni partículas según la noción clásica, sino que son objetos nuevos con un comportamiento nuevo, el cuántico, y que para describirlo fue necesario construir un nuevo cuerpo de conocimientos que permite una mejor comprensión de la materia y el cosmos, la física quántica. Se evaluara, asimismo, si conocen el gran impulso de esta nueva revolución científica al desarrollo científico y tecnológico, ya que gran parte de las nuevas tecnologías se basan en la física quántica: las células fotoeléctricas, los microscopios electrónicos, el láser, la microelectrónica, los ordenadores, etc. 9. Aplicar la equivalencia masa-energía para explicar la energía de enlace de los núcleos y su estabilidad, las reacciones nucleares, la radiactividad y sus múltiples aplicaciones y repercusiones. Este criterio trata de comprobar si el alumnado es capaz de interpretar la estabilidad de los núcleos a partir de las energías de enlace y los procesos energéticos vinculados con la radiactividad y las reacciones nucleares. Y si es capaz de utilizar estos conocimientos para la comprensión y valoración de problemas de interés, como las aplicaciones de los radioisótopos (en medicina, arqueología, industria, etc.) o el armamento y reactores nucleares, siendo conscientes de sus riesgos y repercusiones (residuos de alta actividad, problemas de seguridad, etc.). QUIMICA 2º Bachillerato Materia de modalidad del bachillerato de Ciencias y tecnología, la química amplia la formación científica de los estudiantes y sigue proporcionando una herramienta para la comprensión del mundo en que se desenvuelven, no solo por sus repercusiones directas en numerosos ámbitos de la sociedad actual, sino por su relación con otros campos del conocimiento como la medicina, la farmacología, las tecnologías de nuevos materiales y de la alimentación, las ciencias medioambientales, la bioquímica, etc. Ya en etapas anteriores los estudiantes han tenido ocasión de empezar a comprender su importancia, junto al resto de las ciencias, en las condiciones de vida y en las concepciones de los seres humanos. El desarrollo de esta materia debe contribuir a una profundización en la familiarización con la naturaleza de la actividad científica y tecnológica y a la apropiación de las competencias que dicha actividad conlleva, en particular en el campo de la química. En esta familiarización las practicas de laboratorio juegan un papel relevante como parte de la actividad científica, teniendo en cuenta los problemas planteados, su interés, las respuestas tentativas, los diseños experimentales, el cuidado en su puesta a prueba, el análisis critico de los resultados, etc., aspectos fundamentales que dan sentido a la experimentación. En el desarrollo de esta disciplina se debe seguir prestando atención a las relaciones Ciencia, tecnología, Sociedad y Ambiente (CTSA), en particular a las aplicaciones de la química, así como a su presencia en la vida cotidiana, de modo que contribuya a una formación critica del papel que la química desarrolla en la sociedad, tanto como elemento de progreso como por los posibles efectos negativos de algunos de sus desarrollos. El estudio de la química pretende, pues, una profundización en los aprendizajes realizados en etapas precedentes, poniendo el acento en su carácter orientador y preparatorio de estudios posteriores, así como en el papel de la química y sus repercusiones en el entorno natural y social y su contribución a la solución de los problemas y grandes retos a los que se enfrenta la humanidad. La química contemplada en la materia de física y química se centra fundamentalmente en el estudio del papel y desarrollo de la teoría de Dalton y, en particular, se hace énfasis en la introducción de la estequiometría química. En este curso se trata de profundizar en estos aspectos e introducir nuevos temas que ayuden a comprender mejor la química y sus aplicaciones. Los contenidos propuestos se agrupan en bloques. Se parte de un bloque de contenidos comunes destinados a familiarizar a los alumnos con las estrategias básicas de la actividad científica que, por su carácter transversal, deberán ser tenidos en cuenta al desarrollar el resto. Los dos siguientes pretenden ser una profundización de los modelos atómicos tratados en el curso anterior al introducir las soluciones que la mecánica quántica aporta a la comprensión de la estructura de los átomos y a sus uniones. En el cuarto y quinto se tratan aspectos energéticos y cinéticos de las reacciones químicas y la introducción del equilibrio químico que se aplica a los procesos de precipitación en particular. En el sexto y séptimo se contempla el estudio de dos tipos de reacciones de gran trascendencia en la vida cotidiana; las acido-base y las de oxidaciónreducción, analizando su papel en los procesos vitales y sus implicaciones en la industria y la economía. Finalmente, el ultimo, con contenidos de química orgánica, esta destinado al estudio de alguna de las funciones orgánicas oxigenadas y los polímeros, abordando sus características, como se producen y la gran importancia que tienen en la actualidad debido a las numerosas aplicaciones que presentan. La enseñanza de la química en el bachillerato tendrá como finalidad el desarrollo de las siguientes capacidades: 1. Adquirir y poder utilizar con autonomía los conceptos, leyes, modelos y teorías más importantes, así como las estrategias empleadas en su construcción. 2. Familiarizarse con el diseño y realización de experimentos químicos, así como con el uso del instrumental básico de un laboratorio químico y conocer algunas técnicas específicas, todo ello de acuerdo con las normas de seguridad de sus instalaciones. 3. Utilizar las tecnologías de la información y la comunicación para obtener y ampliar información procedente de diferentes fuentes y saber evaluar su contenido. 4. Familiarizarse con la terminología científica para poder emplearla de manera habitual al expresarse en el ámbito científico, así como para poder explicar expresiones científicas del lenguaje cotidiano, relacionando la experiencia diaria con la científica. 5. Comprender y valorar el carácter tentativo y evolutivo de las leyes y teorías químicas, evitando posiciones dogmáticas y apreciando sus perspectivas de desarrollo. 6. Comprender el papel de esta materia en la vida cotidiana y su contribución a la mejora de la calidad de vida de las personas. Valorar igualmente, de forma fundamentada, los problemas que sus aplicaciones puede generar y como puede contribuir al logro de la sostenibilidad y de estilos de vida saludables. 7. Reconocer los principales retos a los que se enfrenta la investigación de este campo de la ciencia en la actualidad. Criterios de evaluación 1. Analizar situaciones y obtener información sobre fenómenos químicos utilizando las estrategias básicas del trabajo científico. Se trata de evaluar si los estudiantes se han familiarizado con las características básicas del trabajo científico al aplicar los conceptos y procedimientos aprendidos y en relación con las diferentes tareas en las que puede ponerse en juego, desde la comprensión de los conceptos a la resolución de problemas, pasando por los trabajos prácticos. Este criterio ha de valorarse en relación con el resto de los criterios de evaluación, para lo que se precisa actividades de evaluación que incluyan el interés de las situaciones, análisis cualitativos, emisión de hipótesis fundamentadas, elaboración de estrategias, realización de experiencias en condiciones controladas y reproducibles, análisis detenido de resultados, consideración de perspectivas, implicaciones CTSA del estudio realizado (posibles aplicaciones, transformaciones sociales, repercusiones negativas…), toma de decisiones, atención a las actividades de síntesis, a la comunicación, teniendo en cuenta el papel de la historia de la ciencia, etc. 2. Aplicar el modelo mecánico-quántico del átomo para explicar las variaciones periódicas de algunas de sus propiedades. Se trata de comprobar si el alumnado conoce las insuficiencias del modelo de Bohr y la necesidad de otro marco conceptual que condujo al modelo quántico del átomo, que le permite escribir estructuras electrónicas, a partir de las cuales es capaz de justificar la ordenación de los elementos, interpretando las semejanzas entre los elementos de un mismo grupo y la variación periódica de algunas de sus propiedades como son los radios atómicos e iónicos, la electronegatividad y las energías de ionización. Se valorara si conoce la importancia de la mecánica cuántica en el desarrollo de la química. 3. Utilizar el modelo de enlace para comprender tanto la formación de moléculas como de cristales y estructuras macroscópicas y utilizarlo para deducir algunas de las propiedades de diferentes tipos de sustancias. Se evaluara si se sabe derivar la formula, la forma geométrica y la posible polaridad de moléculas sencillas, aplicando estructuras de Lewis y la repulsión de pares electrónicos de la capa de valencia de los átomos. Se comprobará la utilización de los enlaces intermoleculares para predecir si una sustancia molecular tiene temperaturas de fusión y de ebullición altas o bajas y si es o no soluble en agua. También ha de valorarse el conocimiento de la formación y propiedades de las sustancias iónicas, covalentes y de los metales. 4. Explicar el significado de la entalpía de un sistema y determinar la variación de entalpía de una reacción química, valorar sus implicaciones y predecir, de forma cualitativa, la posibilidad de que un proceso químico tenga o no lugar en determinadas condiciones. Este criterio pretende averiguar si los estudiantes comprenden el significado de la función entalpía así como de la variación de entalpía de una reacción, si determinan calores de reacción, aplican la ley de Hess, utilizan las entalpías de formación y conocen y valoran las implicaciones que los aspectos energéticos de un proceso químico tienen en la salud, en la economía y en el medioambiente. En particular, se han de conocer las consecuencias del uso de combustibles fósiles en el incremento del efecto invernadero y el cambio climático que esta teniendo lugar. También se debe saber predecir la espontaneidad de una reacción a partir de los conceptos de entropía y energía libre. 5. Aplicar el concepto de equilibrio químico para predecir la evolución de un sistema y resolver problemas de equilibrios homogéneos, en particular en reacciones gaseosas, y de equilibrios heterogéneos, con especial atención a los de disolución-precipitación. Se trata de comprobar a través de este criterio si se reconoce macroscópicamente cuando un sistema se encuentra en equilibrio, se interpreta microscópicamente el estado de equilibrio y se resuelven ejercicios y problemas tanto de equilibrios homogéneos como heterogéneos. También si se deduce cualitativamente la forma en la que evoluciona un sistema en equilibrio cuando se interacciona con el y si se conocen algunas de las aplicaciones que tiene en la vida cotidiana y en procesos industriales (tales como la obtención de amoniaco) la utilización de los factores que pueden afectar al desplazamiento del equilibrio. 6. Aplicar la teoría de Bronsted para reconocer las sustancias que pueden actuar como ácidos o bases, saber determinar el pH de sus disoluciones, explicar las reacciones acido-base y la importancia de alguna de ellas así como sus aplicaciones prácticas. Este criterio pretende averiguar si los alumnos saben clasificar las sustancias o sus disoluciones como acidas, básicas o neutras aplicando la teoría de Bronsted, conocen el significado y manejo de los valores de las constantes de equilibrio para predecir el carácter acido o base de las disoluciones acuosas de sales y si determinan valores de pH en disoluciones de ácidos y bases fuertes y débiles. También se valorara si se conoce el funcionamiento y aplicación de las técnicas volumétricas que permiten averiguar la concentración de un acido o una base y la importancia que tiene el pH en la vida cotidiana y las consecuencias que provoca la lluvia acida, así como la necesidad de tomar medidas para evitarla. 7. Ajustar reacciones de oxidación-reducción y aplicarlas a problemas estequiométricos. Saber el significado de potencial estándar de reducción de un par redox, predecir, de forma cualitativa, el posible proceso entre dos pares redox y conocer algunas de sus aplicaciones como la prevención de la corrosión, la fabricación de pilas y la electrolisis. Se trata de saber si, a partir del concepto de número de oxidación, se reconocen este tipo de reacciones y se ajustan y aplican a la resolución de problemas estequiométricos. También si se predice, a través de las tablas de los potenciales estándar de reducción de un par redox, la posible evolución de estos procesos y si se conoce y valora la importancia que, desde el punto de vista económico, tiene la prevención de la corrosión de metales y las soluciones a los problemas que el uso de las pilas genera. Asimismo, debe valorarse si se conoce el funcionamiento de las células electroquímicas y las electrolíticas. 8. Describir las características principales de alcoholes, ácidos y esteres y escribir y nombrar correctamente las formulas desarrolladas de compuestos orgánicos sencillos. El objetivo de este criterio es comprobar si se sabe formular y nombrar compuestos orgánicos oxigenados y nitrogenados con una única función orgánica, además de conocer alguno de los métodos de obtención de alcoholes, ácidos orgánicos y esteres. También ha de valorarse el conocimiento de las propiedades físicas y químicas de dichas sustancias así como su importancia industrial y biológica, sus múltiples aplicaciones y las repercusiones que su uso genera (fabricación de pesticidas, etc.). 9. Describir la estructura general de los polímeros y valorar su interés económico, biológico e industrial, así como el papel de la industria química orgánica y sus repercusiones. Mediante este criterio se comprobara si se conoce la estructura de polímeros naturales y artificiales, si se comprende el proceso de polimerización en la formación de estas sustancias macromoleculares y se valora el interés económico, biológico e industrial que tienen, así como los problemas que su obtención y utilización pueden ocasionar. Además, se valorara el conocimiento del papel de la química en nuestras sociedades y de la responsabilidad del desarrollo de la química y su necesaria contribución a las soluciones para avanzar hacia la sostenibilidad. METODOLOGÍA La enseñanza debe sustentarse en planteamientos didácticos que faciliten la participación del alumnado en el proceso de aprendizaje. Esto supone la utilización de una metodología activa, en la cual el profesorado tiene que actuar como elemento orientador y motivador, para canalizar las actividades de aprendizaje. Los métodos van a ser utilizados por cada profesor en el trabajo con el grupo y serán, fundamentalmente: Exposición: El profesor presenta la información de manera verbal o instrumental. Muestra: El profesor realiza algunos ejercicios como modelo para que el alumno los reproduzca después. Planteamiento: El profesor plantea una situación-problema. Orientación: El profesor da pautas, instrucciones, pistas, etc., para que el alumno pueda realizar una tarea o mientras la está realizando. Supervisión: El profesor corrige mientras el alumno realiza la tarea para garantizar el éxito de la misma remitiéndole a lo que el alumno ya sabe. Retroalimentación: El profesor señala al alumno sus aciertos y errores en el proceso seguido o en la estrategia utilizada y le indica como subsanar los errores. Asesoramiento: El profesor, al consultarle el alumno, mientras realiza una tarea, le asesora y ayuda. Comentario: El profesor o el alumno plantea una cuestión y se desarrolla una conversación interactiva. Evaluación: El profesor valora y califica el aprovechamiento del alumno, tomando nota de ello. Realización de problemas Un aspecto fundamental a tener en cuenta será la realización de problemas. Muchos alumnos muestran dificultades a la hora de abordar estos problemas debido a causas como la falta de suficientes conocimientos teóricos, el escaso dominio del aparato matemático, la lectura no comprensiva del enunciado, o el operativismo que les hace realizar directamente las operaciones sin cuestionarse formalmente el problema. Uno de los objetivos metodológicos es enseñar a pensar primero antes de realizar un problema, no se deben realizar de forma mecánica aplicando directamente las fórmulas. Las pautas propuestas a seguir en el modelo de resolución de problemas son: Estudio cualitativo de la situación intentando definir de una manera precisa el problema. Elaborar y explicitar posibles estrategias de resolución antes de proceder a esta, evitando el puro ensayo-error. Realizar la resolución verbalizando al máximo. Analizar cuidadosamente los resultados. En este sentido se realizarán a lo largo del curso algunos problemas con enunciados abiertos que son los que permiten seguir estas pautas, enseñando de esta forma a resolver los problemas de una forma lógica y razonada. Experimentación Otro aspecto a tener en cuenta será la realización de experimentos sencillos. La experimentación es básica en la enseñanza de las ciencias y tiene mucha importancia en el proceso de enseñanza ya que el alumno aprende a utilizar sus manos y su mente, a saborear el fracaso y sentir la satisfacción de alcanzar la meta que se propone. Sin embargo experimentar por experimentar no es suficiente, el alumno debe conocer la naturaleza del problema, y tras observar los resultados de un experimento y analizarlos, formular la conclusión. Algunos de los objetivos que se pretenden alcanzar con el trabajo experimental son: Familiarizar al alumno con los métodos básicos del trabajo experimental. Familiarizarse con algunos fenómenos naturales que previamente han estudiado teóricamente. Fomentar el trabajo en equipo con los compañeros. Desarrollar el sentido de la observación y la curiosidad. Desarrollar hábitos de limpieza en el trabajo, orden y disciplina en su desarrollo. Para que la experimentación sea productiva, se deben tener en cuenta una serie de recomendaciones como la de trabajar en grupos pequeños, que los experimentos sean sencillos, giren en torno a un problema definido y tengan instrucciones claras para su realización. La realización de las prácticas tendrá lugar en el laboratorio colocando a los alumnos en pequeños grupos. El alumno dispondrá de un guión con la práctica y tendrá que realizar el correspondiente informe. CONTENIDOS Los contenidos, objetivos y criterios de evaluación de cada materia, se concretan en la programación de cada curso. INSTRUMENTOS DE EVALUACIÓN Todo el proceso evaluador exige recoger información diversa para analizarla y poder mejorar y readaptar el proceso educativo con el fin de conseguir las finalidades de modo óptimo. Para ello necesitamos utilizar distintos instrumentos de evaluación que sean coherentes con los criterios utilizados, con los contenidos y con la metodología que defendemos. A continuación se exponen los instrumentos básicos que se utilizarán: Observación del trabajo diario recopilando información sobre actitudes, hábitos en el trabajo individual y en equipo, participaciones en la pizarra, dificultades encontradas, etc. Realización de pruebas escritas. Estas pruebas se valorarán siguiendo unos criterios: planteamiento razonado, ejecución correcta, redacción clara y detallada y buena presentación. Exposiciones orales de resoluciones de problemas, donde podamos evaluar la utilización de distintos conceptos, el modo de razonamiento, la capacidad de expresión, estrategias utilizadas, etc. Actividades de indagación en las que podamos evaluar actitudes propias de la investigación. CRITERIOS DE CALIFICACIÓN No se puede olvidar que la evaluación también comprende el proceso calificador. En este sentido, está establecido que la calificación se expresa mediante escala numérica de 1 a 10 sin decimales, considerándose positiva 5 o superior. Se propone otorgar el siguiente peso a cada parte, dependiendo del curso y que se detalla en la programación del mismo: La nota de las pruebas escritas tendrán un peso del 80% Trabajo en clase: 10% Comportamiento y actitud: 10% RECUPERACIÓN DE LA ASIGNATURA Y DE LAS PENDIENTES Para los alumnos calificados negativamente en algún trimestre se planteará la realización de una prueba basada en las actividades realizadas. Los alumnos tendrán la oportunidad de realizar una recuperación a finales de junio y los que no pasaran estas pruebas tendrían otra oportunidad en la convocatoria extraordinaria de septiembre. Para Alumnos con la asignatura de Física y Química pendiente de cursos anteriores se llevará a cabo unas pruebas objetivas, una de Física y otra de Química, en los meses de Enero y Abril respectivamente. PROGRAMACIÓN FÍSICA YQUÍMICA 1º BACHILLERATO. OBJETIVOS GENERALES - Proporcionar a los alumnos una madurez intelectual humana, y los conocimientos y habilidades necesarios para desempeñar funciones sociales con responsabilidad y competencia. - Cumplir la función de preparar a los alumnos hacia estudios superiores, universitarios o profesionales. - Ayudar al alumnado en la búsqueda de la comprensión de la Naturaleza desde la perspectiva química: estudio de la constitución y estructura de la materia, y el de sus transformaciones. - Aumentar el conocimiento y profundizar en los conceptos ya adquiridos previamente, fomentando el espíritu crítico con los problemas que tiene planteados la sociedad, y los que se derivan del mal uso de la ciencia. - Aproximar al alumnado al trabajo científico. El planteamiento general ha de contribuir a que los alumnos y alumnas sean capaces de plantear problemas, formular y contrastar hipótesis y diseñar e interpretar resultados de pequeñas experiencias científicas. CAPACIDADES 1. Adquirir y poder utilizar con autonomía los conceptos, leyes, modelos y teorías más importantes, así como las estrategias empleadas en su construcción. 2. Familiarizarse con el diseño y la realización de experimentos químicos, así como con el uso del instrumental básico de un laboratorio químico y conocer algunas técnicas específicas, todo ello de acuerdo con las normas de seguridad de sus instalaciones. 3. Utilizar las tecnologías de la información y la comunicación para obtener y ampliar información procedente de diferentes fuentes, y saber evaluar su contenido. 4. Familiarizarse con la terminología científica para poder emplearla de manera habitual al expresarse en el ámbito científico, así como para poder explicar expresiones científicas utilizadas en el lenguaje cotidiano. 5. Conocer las propiedades generales de sustancias y materiales así como las aplicaciones y usos de algunos de los más relevantes que se utilizan en la vida cotidiana. 6. Comprender el papel de esta materia en la vida cotidiana y su contribución a la mejora de la calidad de vida de las personas. Valorar igualmente, los problemas que su uso puede generar y cómo puede contribuir al logro de estilos de vida saludables. PROGRAMACIÓN DE LOS TEMAS Unidad 1: LA TEORÍA ATÓMICO-MOLECULAR. ESTADOS DE LA MATERIA. DISOLUCIONES. Nº de horas:16 OBJETIVOS GENERALES CRITERIOS DE EVALUACIÓN Realizar una descripción macroscópica de las formas en las que se presenta la materia. Reconocer los cambios físicos y los cambios químicos. Identificar los distintos tipos de sustancias puras y mezclas. Presentar las leyes ponderales y volumétricas de la química y los motivos que llevaron a su enunciado. Reconocer la teoría atómica de Dalton como fundamento de la química moderna. Introducir el concepto de mol como base de los cálculos químicos. Distinguir entre disolución concentrada, diluida y saturada. Identificar las principales propiedades de los sólidos, líquidos y gases y justificarlas mediante la teoría cinética. Identificar los distintos tipos de mezclas y diseñar procedimientos de separación. Resolver problemas y cuestiones sobre disoluciones y solubilidad. Diferenciar cambios físicos y cambios químicos. Identificar elementos y compuestos diseñando procedimientos de separación. Resolver cuestiones y problemas relativos a la ley de conservación de la masa. Conocer la ley de Proust y su aplicación para determinar la fórmula empírica de compuestos. Resolver problemas y cuestiones relativos al concepto de mol. Resolver cuestiones y problemas relativos a las leyes de los gases perfectos. Resolver cuestiones y problemas sobre la expresión de la concentración de las disoluciones. CONTENIDOS CONCEPTUALES La naturaleza discontinua de la materia. Los estados de agregación. Mezclas homogéneas y heterogéneas. Las disoluciones. Formas de expresar la concentración. Las dispersiones coloidales. Los cambios físicos y químicos. Las sustancias puras: elementos y compuestos. La ley de conservación de la masa. Ley de las proporciones definidas. Ley de las proporciones múltiples. La teoría atómica de Dalton. Concepto de mol. Hipótesis de Avogadro. Leyes de Boyle y de Gay-Lussac. Ecuación general de los gases ideales. Fórmulas empírica y molecular de los compuestos. PROCEDIMENTALES Representar mediante modelos de bolas un sólido, un líquido y un gas. Identificar sustancias puras por la constancia de sus puntos de ebullición. Determinar el punto de fusión de una sustancia pura. Llevar a cabo cambios físicos y químicos. Destacar el carácter relativo de las masas atómicas. Definir el número de Avogadro y, a través del mismo, el concepto de mol. Preparar disoluciones de concentración deseada. Ejemplificar casos de compuestos que tienen fórmula molecular y otros que poseen fórmula empírica. Comprobar la ley de conservación de la masa mezclando disoluciones que produzcan una precipitación. Buscar y leer biografías de los principales químicos de principios del siglo XIX. Preparar disoluciones de sales en agua. ACTITUDINALES Respeto a las normas de seguridad que se deben observar en el laboratorio de química y que deben ser explicadas por el profesor en cada caso. Interés por la observación rigurosa de la materia y sus propiedades. Reconocimiento del valor histórico del descubrimiento de los elementos ante las dificultades históricas para diferenciarlos de los compuestos. Cuidado e interés en la utilización de la balanza y otros instrumentos de medida en el laboratorio de química. Interés por la historia de la química, fundamentalmente en los siglos XVIII y XIX, en los que se enunciaron las leyes ponderales y volumétricas y se promulgó la teoría atómica. Desarrollo de hábitos de pensamiento basados en el método científico. ACTIVIDADES Esta unidad comprende los temas 1, 2 y 3 del libro de texto. Se realizarán las actividades propuestas en el mismo, tanto cuestiones como resolución de problemas. En cuanto a actividad práctica, se prepararán disoluciones de distinta concentración, tanto a partir de reactivos sólidos, como a partir de otras disoluciones. COMPETENCIAS Competencia en el conocimiento y la interacción con el mundo físico y competencia matemática. Conocer las diferentes formas en que se presenta la materia así como los procedimientos básicos para la separación de sus componentes, así como aplicar las leyes de la química moderna. Autonomía e independencia personal. Valorar la importancia de la aplicación del método científico en la descripción ordenada de la materia y sus propiedades. Competencia para aprender a aprender. Deducir las características de una sustancia a partir de la respuesta a las diferentes pruebas a las que se le puede someter. Competencia social y ciudadana. Reconocer el avance social y económico que produjo en los siglos XVIII y XIX el descubrimiento de las leyes sobre el comportamiento de las sustancias químicas. Unidad 2: EL ÁTOMO. ESTRUCTURA ATÓMICA. Nº de horas:10 OBJETIVOS GENERALES Conocer los hechos experimentales que sirvieron de base para el establecimiento de cada uno de los modelos atómicos Analizar, de forma crítica, la consistencia de cada modelo con nuevos hallazgos experimentales y modificarlos en consecuencia. Conocer, de forma cualitativa, los principios teóricos que sirvieron de base para el establecimiento del modelo atómico mecanocuántico. Comprender e interpretar espectros atómicos sencillos. Comprender el significado de los números cuánticos como determinantes del estado en que se encuentra un electrón en un átomo. Elaborar, de forma razonada, la configuración electrónica de un átomo. Reconocer el sistema periódico como una consecuencia de la configuración electrónica de los átomos. Definir las propiedades periódicas de los elementos que se estudian en esta unidad. Relacionar el valor de las propiedades periódicas de un conjunto de elementos con la configuración electrónica de sus átomos. CRITERIOS DE EVALUACIÓN Identificar, de forma cualitativa, los principios físicos que sustentan cada uno de los modelos atómicos. Obtener la configuración electrónica de un elemento poniendo de manifiesto los principios en los que se basa. Interpretar cada uno de los números cuánticos que definen el estado de un electrón en un átomo. Identificar la posición de un elemento en el sistema periódico a partir de la configuración electrónica de su capa de valencia, y viceversa. Definir las propiedades periódicas y predecir su valor en los distintos elementos del sistema periódico Asignar de forma razonada el valor de una propiedad periódica a un conjunto concreto de elementos químicos. CONTENIDOS CONCEPTUALES Evidencias experimentales que justifican cada uno de los modelos atómicos o que obligan a su reformulación. Principios físicos que sustentan cada uno de los modelos atómicos. Los números cuánticos y su significado en la definición del nivel energético en que se encuentra un electrón en un átomo. El significado de la configuración electrónica de un átomo y los principios en que se basa El sistema periódico de los elementos como resultado de la configuración electrónica. Propiedades periódicas de los elementos: relación entre su valor y la configuración electrónica de sus átomos. PROCEDIMENTALES Utilizar con soltura el método científico (elaborar teorías que justifiquen hechos experimentales, imaginar experiencias que las pongan a prueba y analizar los resultados de forma crítica). Adquirir destreza en la elaboración de la configuración electrónica de un elemento. Tener habilidad para relacionar la configuración electrónica de un elemento con su posición en el sistema periódico, y viceversa. Interpretar el significado de un conjunto de números cuánticos y analizar su viabilidad. Desarrollar una metodología adecuada para asignar valores de una serie de propiedades periódicas a un conjunto de elementos. ACTITUDINALES Reconocer el trabajo científico como un proceso en permanente construcción y revisión. Comprender la necesidad de unos sólidos conocimientos para ser capaz de proporcionar soluciones e interpretaciones imaginativas a los problemas que se plantean. Asumir la importancia de la física y la química para conocer y predecir las características de la materia que nos rodea. ACTIVIDADES Cuestiones y problemas del libro de texto. COMPETENCIAS Competencia en comunicación lingüística. Valorar el uso de los modelos en ciencia como instrumentos fundamentales para la comprensión de teorías complejas. Competencia social y ciudadana. Reconocer el esfuerzo de los científicos que con sus aportaciones construyeron la teoría atómica. Tratamiento de la información y competencia digital. Valorar la información que se obtiene a partir del orden del sistema periódico sobre las características de los elementos presentes en la naturaleza. Competencia para aprender a aprender. Deducir las propiedades de elementos no descubiertos mediante la aplicación de las propiedades periódicas. Deducir las propiedades de un elemento a partir de su configuración electrónica. Autonomía e independencia personal. Reconocer el carácter predictivo de la ciencia. Unidad 3: ENLACE QUÍMICO y FORMULACIÓN Nº de horas:12 OBJETIVOS GENERALES Comprender el enlace químico como un recurso de la naturaleza para evolucionar hacia estados energéticamente más favorables. Reconocer el enlace químico como el resultado de una interacción de tipo eléctrico. Distinguir el enlace entre átomos del enlace entre otras especies químicas (moléculas, moléculas e iones, etc.). Relacionar el tipo de enlace entre átomos con las características electrónicas de los átomos que están comprometidos en él. Conocer la estructura interna que proporciona un determinado tipo de enlace a las sustancias que resultan de él. Ser capaz de relacionar las propiedades macroscópicas que se observan en una sustancia con el enlace que se da entre sus átomos. Comprender que una misma propiedad se puede presentar en distintos grados dependiendo de las características concretas de los átomos presentes, lo que puede provocar que un mismo tipo de enlace origine sustancias aparentemente distintas. Ser capaz de predecir el comportamiento de una sustancia frente a otras analizando los enlaces que presenta. Comprender el tipo de enlace que es responsable de un fenómeno (cambio de estado, solubilidad en un disolvente, etc.). CRITERIOS DE EVALUACIÓN Analizar el tipo de enlace que se da cuando se combinan unos átomos determinados y, en su caso, predecir la fórmula del compuesto que se obtiene. Utilizar la regla del octeto para establecer los enlaces que se establecen entre los átomos de una sustancia. Utilizar el modelo de enlace covalente de Lewis para estudiar moléculas o iones que contengan algún enlace covalente dativo. Relacionar la polaridad de una molécula con la polaridad de sus enlaces y su geometría. Asignar propiedades a una serie de sustancias en función del tipo de enlace que se da entre sus átomos, iones o moléculas. Discutir el enlace que interviene en una serie de procesos como el cambio de estado de una sustancia o la solubilidad de una sustancia en otra. Asignar valores de propiedades a una serie de sustancias cuando están comprendidos enlaces en los que participan moléculas. . CONTENIDOS CONCEPTUALES La naturaleza del enlace químico. Tipos de enlace entre átomos: iónico, covalente o metálico. Características de los átomos que se unen con un determinado tipo de enlace. Estructura interna que resulta de cada tipo de enlace. Redes cristalinas y geometría de las moléculas. Enlaces en los que participan moléculas. Propiedades macroscópicas de las sustancias en función del tipo de enlace. Enlaces responsables de la mezcla de sustancias. PROCEDIMENTALES Desarrollar estrategias que lleven al alumnado a buscar las características internas de la materia responsable de su comportamiento externo. Relacionar el diferente valor de una propiedad (por ejemplo, el punto de fusión) en sustancias con el mismo tipo de enlace con las particulares diferencias de los átomos que se enlazan. Mostrar capacidad para el análisis multifactorial. Se debe utilizar un conjunto de datos de una sustancia para determinar el tipo de enlace y predecir otra serie de propiedades que puede presentar. Interpretar tablas de datos y gráficas de propiedades. Formular y nombrar diversos compuestos mediante las nomenclaturas tradicional, sistemática y funcional. ACTITUDINALES Reconocer que hay un orden interno que justifica el comportamiento observado de la materia. Apreciar la importancia, y de la ciencia en general y de la química en particular, como motores del cambio social, particularizando en su capacidad para proporcionar sustancias con propiedades adecuadas a una finalidad. Valorar la importancia de adoptar normas comunes para la formulación y la nomenclatura de las sustancias químicas. ACTIVIDADES Cuestiones y problemas del libro de texto. COMPETENCIAS de Competencia en comunicación lingüística. Reconocer la importancia que para la comunidad científica tiene el adoptar unas normas comunes para desarrollar la nomenclatura química. Competencia para aprender a aprender. Deducir la estructura química de las sustancias a partir de sus propiedades macroscópicas. Autonomía e independencia personal. Valorar el carácter predictivo de las propiedades de las sustancias en función del tipo enlace que presentan. Unidad 4: REACCIONES QUÍMICAS Nº de horas:16 OBJETIVOS GENERALES Reconocer cuándo se produce una reacción química identificando todas las sustancias que participan en ella. Interpretar las reacciones químicas a nivel atómico. Ser capaz de proponer algún método para alterar el curso de una reacción (acelerándola o retardándola). Manejar con soltura los balances de materia en las reacciones químicas. Ser capaz de hacer cálculos en reacciones cuyas sustancias participantes se encuentren en cualquier estado físico o en disolución. Trabajar con reacciones en las que participen sustancias con un cierto grado de riqueza o que transcurran con un rendimiento inferior al 100 %. Comprender el alcance del concepto «reactivo limitante». Realizar balances energéticos derivados de reacciones químicas. Ser capaz de aplicar lo aprendido a reacciones que se producen en el entorno próximo del alumnado (en su hogar o el medioambiente). Reflexionar acerca de las actuaciones individuales que pueden alterar procesos químicos en el sentido en que favorezcan un desarrollo sostenible. CRITERIOS DE EVALUACIÓN . Escribir la ecuación química ajustada de todas las sustancias que participan en una reacción. Predecir factores o condiciones que modifiquen la velocidad a la que se produce una reacción química concreta. Aplicarlo a reacciones que transcurran en el entorno próximo de los alumnos o que tengan interés industrial o medioambiental. Hacer balances de materia y energía en una reacción química, cualquiera que sea el estado en que se encuentren las sustancias (sólidos, líquidos, gases o sustancias en disolución). Hacer cálculos estequiométricos de reacciones en las que intervengan reactivos con un cierto grado de pureza y con un rendimiento inferior al 100 %. Realizar cálculos estequiométricos en procesos con un reactivo limitante. Completar un proceso conociendo el tipo de reacción que se produce. Identificar el tipo de reacción que tiene lugar en un proceso del entorno próximo del alumno. Por ejemplo, procesos ácido-base (empleo de antiácidos o productos de limpieza) o procesos de combustión. Analizar una reacción desde el punto de vista de su influencia en la construcción de un futuro sostenible. CONTENIDOS CONCEPTUALES La reacción química como cambio que experimenta la materia. Interpretación microscópica de la reacción química. Factores que influyen en la velocidad de una reacción química; posibilidad de alterarlos. La ecuación química como representación analítica de una reacción. Cálculos de materia y de energía en las reacciones químicas. Tipos de reacciones químicas. Reacciones químicas de interés. PROCEDIMENTALES Plantear la ecuación de una reacción química y balancearla por tanteo. Obtener el equivalente en moles de cierta cantidad de sustancia cualquiera que sean las unidades en las que se presente. Realizar balances de materia y energía relativos a una reacción química. Manejar con soltura los conceptos de riqueza, rendimiento y reactivo limitante. Reproducir reacciones sencillas en el laboratorio y adiestrarse en el reconocimiento de la aparición de nuevas sustancias. ACTITUDINALES Comprender el papel de la química en la construcción de un futuro sostenible y nuestra contribución personal y ciudadana a esa tarea, valorando el efecto de los productos químicos presentes en el entorno sobre la salud, la calidad de vida, el patrimonio artístico, etc. Adquirir responsabilidad en el trabajo de laboratorio, tanto en el cuidado del material como en la estrecha vigilancia de las reacciones que se llevan a cabo. Reconocimiento de la importancia del uso del lenguaje simbólico para representar procesos químicos. Sensibilidad por el orden y la limpieza del lugar de trabajo y el material utilizado. ACTIVIDADES Cuestiones y problemas del libro de texto. Realización de prácticas de reacciones químicas como por ejemplo precipitación. COMPETENCIAS Competencia en el conocimiento y la interacción con el mundo físico. Extraer datos y conclusiones de las ecuaciones químicas a partir de la aplicación de la teoría atómico- molecular. Tratamiento de la información y competencia digital. Valorar el uso de un lenguaje simbólico común en el tratamiento de ecuaciones químicas. Autonomía e independencia personal. Mostrar un espíritu crítico frente al uso indiscriminado que la sociedad hace de los productos químicos. Unidad 5: LA QUÍMICA DEL CARBONO Nº de horas:12 OBJETIVOS GENERALES Reconocer la importancia de la química orgánica por la cantidad de productos que comprende y su relevancia. Estudiar las características del átomo de carbono que justifican la gran cantidad de compuestos que forma. Identificar los principales grupos funcionales que aparecen en los compuestos orgánicos Aprender a formular y a nombrar compuestos orgánicos de manera sistemática. Asociar las características fisicoquímicas de un compuesto a los grupos funcionales que contiene. Comprender el fenómeno de la isomería y su relevancia en los compuestos orgánicos. Conocer algunas reacciones orgánicas sencillas. Utilizar las reacciones de combustión como técnica de análisis para conocer la fórmula de un compuesto orgánico. Reflexionar acerca de la importancia socioeconómica de los hidrocarburos. Estudiar cualitativa y cuantitativamente los procesos que implica la utilización de los hidrocarburos como fuente de energía. CRITERIOS DE EVALUACIÓN . Reconocer la cadena principal y los radicales de un compuesto orgánico. Identificar los grupos funcionales presentes en un compuesto orgánico. Formular y nombrar compuestos con un grupo funcional, siguiendo las normas de la IUPAC. Formular y nombrar compuestos sencillos con más de un grupo funcional, siguiendo las normas de la IUPAC. Reconocer relaciones concretas de isomería entre compuestos orgánicos. Completar reacciones orgánicas sencillas. Obtener la fórmula de un compuesto orgánico utilizando datos analíticos derivados de su reacción de combustión. Analizar las consecuencias medioambientales de la reacción de combustión de los compuestos orgánicos. CONTENIDOS CONCEPTUALES Definición de compuesto orgánico. Características estructurales de los esqueletos carbonados. Concepto de serie homóloga. Grupos funcionales presentes en los hidrocarburos, en compuestos oxigenados y nitrogenados. Formulación de compuestos con uno o más grupos funcionales. Concepto de isomería y formas que presenta en los compuestos orgánicos. Reacciones químicas sencillas frecuentes en los compuestos orgánicos. Los hidrocarburos como fuente de energía. PROCEDIMENTALES Reconocer con soltura los grupos funcionales presentes en un compuesto. Formular y nombrar compuestos orgánicos relativamente sencillos utilizando las normas de la IUPAC. Ser capaz de establecer relaciones de isomería entre distintos compuestos. Destreza para manejar con soltura distintas representaciones de un mismo compuesto. Adquirir soltura en los cálculos que se requieren para determinar la fórmula de un compuesto orgánico a partir de su reacción de combustión. ACTITUDINALES Reconocer la química orgánica como ciencia en permanente desarrollo que proporciona compuestos nuevos para satisfacer necesidades concretas. Asumir la importancia de los aprendizajes de una ciencia para facilitar el conocimiento de otras, como por ejemplo para el aprendizaje de la biología. Valoración de la capacidad de la ciencia para dar respuestas a las necesidades de la humanidad mediante la producción de materiales, como los plásticos, con nuevas propiedades. Reconocimiento de la importancia del uso del lenguaje simbólico para representar compuestos y procesos químicos. ACTIVIDADES Cuestiones y problemas del libro de texto. Formular y nombrar compuestos orgánicos según las normas IUPAC COMPETENCIAS Competencia en comunicación lingüística. Reconocer la importancia que para la comunidad científica tiene el adoptar unas normas comunes para desarrollar la nomenclatura química. Competencia en el conocimiento y la interacción con el mundo físico. Conocer las peculiaridades más importantes del átomo de carbono y las propiedades de los hidrocarburos de cadena . Autonomía e independencia personal. Valorar la importancia del uso discriminado de los recursos, tanto materiales como energéticos, en los productos derivados del petróleo. Unidad 6: CINEMÁTICA Nº de horas:18 OBJETIVOS GENERALES CRITERIOS DE EVALUACIÓN Conocer las leyes y modelos más importantes en la Física, así como las estrategias empleadas en su construcción con el fin de obtener una formación científica y generar interés para poder desarrollar estudios posteriores. Comprender la importancia de la Cinemática para abordar numerosas situaciones cotidianas. Utilizar con autonomía el planteamiento de problemas, elaboración de estrategias de resolución y análisis de resultados en diferentes tipos de movimiento. Familiarizarse con la realización de experimentos con una atención particular a las normas de seguridad de las instalaciones. Apreciar la dimensión cultural de la cinemática y valorar sus repercusiones en la sociedad y el medioambiente, contribuyendo al impulso del desarrollo científico. Distinguir los diferentes movimientos rectilíneos: uniforme y uniformemente acelerado. Estudiar la composición de movimientos y su aplicación al tiro parabólico: horizontal y oblicuo. Adquirir y utilizar los conocimientos básicos del movimiento circular: posición angular, velocidad angular y aceleración angular. Interpretar correctamente expresiones matemáticas, tablas y gráficas de los diferentes movimientos. Aplicar los conocimientos del movimiento para resolver problemas de la vida cotidiana. Analizar diferentes aspectos del movimiento y obtener información de ellos mediante estrategias básicas del trabajo científico. Comprender y distinguir los conceptos de desplazamiento y posición, velocidad media e instantánea, aceleración media e instantánea Utilizar los procedimientos adquiridos en la descomposición vectorial de la aceleración. Resolver problemas sencillos Analizar cualitativamente el movimiento para emitir hipótesis que ayuden a elaborar estrategias. Distinguir y .clasificar un movimiento según los valores de su velocidad y aceleración Realizar trabajos prácticos para el análisis de diferentes situaciones de movimiento e interpretar los resultados. Aplicar estrategias características al estudio del movimiento. Analizar diferentes aspectos del movimiento y obtener información de ellos mediante el análisis cualitativo del movimiento, emisión de hipótesis, elaboración de estrategias, realización de experimentos e interpretación de resultados. Aplicar estrategias características de la actividad científica al estudio de movimientos uniforme, rectilíneo y circular, y en el movimiento rectilíneo uniformemente acelerado. Comprender la composición de movimientos en el tiro horizontal y oblicuo. . CONTENIDOS CONCEPTUALES Posición y trayectoria. Desplazamiento y distancia recorrida. Velocidad media. Velocidad instantánea. Velocidad y sistemas de referencia inerciales. Aceleración media. Aceleración instantánea. Componentes de la aceleración. Movimiento rectilíneo uniforme y uniformemente acelerado. Composición de movimientos. El tiro horizontal y oblicuo. Movimiento circular. Velocidad angular y aceleración angular. Relación entre velocidad lineal y las componentes de la aceleración para el movimiento circular. PROCEDIMENTALES Diferenciar los conceptos de posición, desplazamiento y distancia recorrida en un movimiento. Comprender la diferencia entre la velocidad y la aceleración media e instantánea. Interpretar diferentes movimientos a través de sus gráficas. Dibujar las gráficas de diferentes movimientos. Entender y utilizar las componentes tangencial y normal de la aceleración. Relacionar el cambio de dirección de un movimiento con la componente normal de la aceleración. Aplicar los conocimientos físicos del movimiento a la resolución de problemas de la vida cotidiana Recordar el movimiento uniforme y sus aplicaciones. Revisar el tiro vertical, distinguiendo las situaciones en las que la aceleración de la gravedad dificulta o favorece el movimiento. Utilizar correctamente las diferentes ecuaciones de los movimientos rectilíneos uniforme y uniformemente acelerado. Componer correctamente diferentes movimientos en direcciones perpendiculares y aplicarlo al tiro parabólico. Comprender cómo el movimiento circular uniforme tiene aceleración normal no nula. Predicción de posiciones de un móvil aplicando las leyes de los movimientos rectilíneos y circulares. ACTITUDINALES Reconocer la capacidad de representar con gráficas y ecuaciones el movimiento de un móvil. Disfrutar del determinismo de la cinemática en la predicción de posiciones de diferentes movimientos conocidos su velocidad y aceleración. Despertar la curiosidad de la observación de los movimientos del entorno. Reconocer la utilidad de las ecuaciones de la cinemática para describir los movimientos más habituales de la vida cotidiana. ACTIVIDADES Cuestiones y problemas del libro de texto. COMPETENCIAS Valorar la importancia de tener un lenguaje propio que permite a los científicos de cualquier país del mundo comunicarse entre sí con independencia de su propia cultura. (Tratamiento de la información y competencia digital.) Aplicar de forma correcta las normas y herramientas matemáticas aceptadas, para expresar resultados científicos. (Competencia matemática.) Unidad 7: DINÁMICA Nº de horas:18 OBJETIVOS GENERALES Conocer cuáles son las causas del movimiento de los cuerpos y del cambio en el estado de su movimiento. Saber cuáles fueron los científicos que más contribuyeron a comprender los efectos de las fuerzas sobre los cuerpos. Aprender a sumar y restar de manera gráfica fuerzas de cualquier dirección. Identificar el peso con una fuerza. Utilizar las leyes de Newton para resolver problemas. Utilizar el teorema de conservación del momento lineal para resolver problemas. Relacionar la tercera ley de Newton con la conservación del momento lineal. Diferenciar los tipos de interacciones y fuerzas que se observan en la naturaleza. Conocer las magnitudes de las que depende la atracción gravitatoria entre dos cuerpos. Conocer el origen de la interacción eléctrica: la naturaleza eléctrica de la materia. Conocer las magnitudes de las que depende la atracción o repulsión eléctrica entre dos cuerpos. Conocer el efecto de la fuerza de rozamiento sobre un cuerpo que se desplaza sobre un plano horizontal o sobre un plano inclinado. Conocer el efecto de la fuerza de rozamiento en los vehículos que empleamos habitualmente para desplazarnos. Saber cuáles son las magnitudes de las que depende la fuerza de rozamiento. Conocer otro efecto de las fuerzas: las fuerzas deforman los objetos. Aplicar los conocimientos de dinámica aprendidos al caso del movimiento circular. CRITERIOS DE EVALUACIÓN Elaborar esquemas que muestran las fuerzas que actúan sobre un cuerpo. Resolver problemas numéricos en los que intervienen fuerzas que actúan en la misma o en distintas direcciones. Identificar la dirección y sentido de la fuerza resultante que actúa sobre un cuerpo a partir de las demás fuerzas. Emplear las razones trigonométricas convenientemente para descomponer fuerzas. Identificar las fuerzas acción-reacción. Predecir el estado de movimiento de un cuerpo a partir de las fuerzas que actúan sobre él. Predecir el valor y la orientación de la fuerza necesaria para hacer que un cuerpo permanezca en reposo, ya sea situado en un plano horizontal o bien cuando está situado en un plano inclinado. Elaborar esquemas que muestran las fuerzas que actúan sobre un cuerpo, incluyendo fuerzas de rozamiento contra una superficie o contra un fluido. Resolver problemas numéricos en los que intervienen fuerzas que actúan en la misma o en distintas direcciones, incluyendo fuerzas de rozamiento. Identificar la dirección y sentido de la fuerza resultante que actúa sobre un cuerpo a partir de las demás fuerzas. Predecir el estado de movimiento de un cuerpo a partir de las fuerzas que actúan sobre él. Predecir el valor y la orientación de la fuerza necesaria para hacer que un cuerpo permanezca en reposo, ya sea situado en un plano horizontal o bien cuando está situado en un plano inclinado, teniendo en cuenta las fuerzas de rozamiento. . CONTENIDOS CONCEPTUALES La inercia y la primera ley de Newton. Primeras ideas sobre las causas del movimiento: la inercia. La primera ley de Newton. La segunda ley de Newton. Las fuerzas son vectores. Las fuerzas son aditivas. El peso. Los efectos de la fuerza: el cambio en la velocidad. El impulso mecánico. El momento lineal. Momento lineal (o cantidad de movimiento). Relación entre el momento lineal y la fuerza La conservación del momento lineal. Las fuerzas como interacciones. La tercera ley de Newton. La tercera ley de Newton y la conservación del momento lineal. La fuerza normal. Las cuatro interacciones fundamentales. Interacción gravitatoria. Interacción electromagnética. Interacción nuclear fuerte. Interacción nuclear débil. Interacción gravitatoria. La ley de la gravitación universal de Newton. El valor de la aceleración de la gravedad: g. Otro significado de g. Aproximación a la idea de campo gravitatorio. Fuerzas eléctricas y magnéticas. Electrización y fuerzas entre cargas eléctricas. La ley de Coulomb. Las fuerzas magnéticas. Fuerzas de rozamiento. El rozamiento en una superficie. El rozamiento en líquidos y gases Características de la fuerza de rozamiento por deslizamiento. Rozamiento en superficies horizontales y en planos inclinados. Fuerzas elásticas. Las fuerzas deforman los objetos. La ley de Hooke. Dinámica del movimiento circular. Componentes de las fuerzas. PROCEDIMENTALES Calcular gráficamente la fuerza neta resultante de sumar vectorialmente varias fuerzas. Resolver problemas numéricos en los que aparecen fuerzas con diferentes direcciones. Interpretar esquemas a la hora de resolver problemas. Dibujar las fuerzas que actúan sobre un cuerpo. Elaborar esquemas claros que faciliten la resolución de problemas en los que intervienen fuerzas. Saber elegir los ejes más apropiados para la resolución de un problema en el que aparecen fuerzas con distintas direcciones. Comparar las interacciones eléctrica y gravitatoria. Elaborar esquemas que muestran las fuerzas que actúan sobre un cuerpo. Resolver problemas numéricos en los que intervienen fuerzas que actúan en la misma o en distintas direcciones, incluyendo fuerzas de rozamiento. Identificar la dirección y sentido de la fuerza resultante que actúa sobre un cuerpo a partir de las demás fuerzas. Predecir el estado de movimiento de un cuerpo a partir de las fuerzas que actúan sobre él, incluyendo fuerzas de rozamiento. Predecir el valor y la orientación de la fuerza necesaria para hacer que un cuerpo permanezca en reposo, ya sea situado en un plano horizontal o bien cuando está situado en un plano inclinado. Identificar la fuerza centrípeta presente en un movimiento circular. Resolver problemas en los que aparecen tensiones sobre hilos o cuerdas. ACTITUDINALES Mostrar interés por aprender conceptos científicos nuevos. Mostar interés por aplicar los contenidos aprendidos en la vida cotidiana. Valorar la importante del conocimiento de las fuerzas, los pesos, etc., en cuestiones de ingeniería. Valorar el conocimiento que las personas tenemos en la actualidad de los fenómenos naturales, que nos permite explicar hechos misteriosos para las personas que vivieron hace unos cuantos siglos. Valorar la importancia de los conocimientos científicos y técnicos que han hecho posible la utilización de satélites artificiales, tan importantes para las telecomunicaciones en la actualidad. Valorar la perseverancia de numerosos científicos que han hecho posible conocer cuáles son las interacciones que existen en la naturaleza. Adoptar una actitud de prudencia cuando se circula con un vehículo por superficies mojadas. Aplicar los conceptos estudiados sobre la fuerza de rozamiento para ahorrar energía en la medida de lo posible, por ejemplo, teniendo en cuenta que la fuerza de rozamiento depende del cuadrado de la velocidad para el caso del transporte por carretera. ACTIVIDADES Cuestiones y problemas del libro de texto. COMPETENCIAS Competencia en comunicación lingüística y competencia matemática. Conocer y dominar la terminología y el lenguaje propios de los problemas relacionados con las fuerzas. Competencia social y ciudadana. Valorar la importancia que en la evolución del conocimiento científico tuvieron en su época el conocimiento de las fuerzas y los enunciados de Newton. Unidad 8: TRABAJO Y ENERGÍA Nº de horas: 10 OBJETIVOS GENERALES Saber cuáles son los cambios que la energía puede producir en los cuerpos. Afianzar el concepto de conservación de la energía. Diferenciar el concepto de trabajo desde el punto de vista de la física del término empleado en el lenguaje cotidiano. Diferenciar trabajo físico y esfuerzo. Conocer las magnitudes de las que depende el trabajo útil desarrollado por una máquina. Comprender el concepto de rendimiento y el de energía consumida, pero no aprovechada. Relacionar trabajo y variación de energía cinética. Relacionar trabajo y variación de energía potencial gravitatoria. Relacionar la fuerza de rozamiento con la energía disipada cuando un móvil se desplaza. CRITERIOS DE EVALUACIÓN Señalar cuáles son los cambios que la energía producidos en los cuerpos. Diferenciar el concepto de trabajo desde el punto de vista de la física del término empleado en el lenguaje cotidiano. Diferenciar trabajo físico y esfuerzo. Indicar cuáles son las magnitudes de las que depende el trabajo útil desarrollado por una máquina. Explicar el concepto de rendimiento y el de energía consumida, pero no aprovechada. Relacionar trabajo y variación de energía cinética y aplicarlo a la resolución de problemas numéricos. Relacionar trabajo y variación de energía potencial gravitatoria y aplicarlo a la resolución de problemas numéricos. Resolver problemas relacionando la fuerza de rozamiento con la energía disipada cuando un móvil se desplaza. . CONTENIDOS CONCEPTUALES La energía y los cambios. Concepto de energía. Energía, trabajo y calor: primera ley de la termodinámica. Trabajo. Definición de trabajo. Interpretación gráfica del trabajo. Potencia y rendimiento. Relación entre potencia y trabajo. Unidades de potencia. Rendimiento de una máquina. Trabajo y energía cinética. Trabajo y energía potencial. Energía potencial gravitatoria. El trabajo y la energía potencial gravitatoria. Energía potencial elástica. Principio de conservación de la energía mecánica. Conservación de la energía con fuerzas no conservativas. PROCEDIMENTALES Interpretar gráficas. Interpretar esquemas donde aparecen fuerzas dibujadas y deducir a partir de ellos cuáles son algunas de las transformaciones energéticas que tienen lugar. Calcular la energía cinética o la energía potencial que posee un cuerpo. Resolver problemas numéricos aplicando el principio de conservación de la energía. Elaborar esquemas que muestran las fuerzas que actúan sobre un cuerpo. ACTITUDINALES Adoptar hábitos que contribuyan al ahorro energético. Valorar la importancia de comprender bien los conceptos de trabajo, potencia y rendimiento a la hora de diseñar máquinas. Relacionar los conceptos estudiados en la unidad con temas sobre seguridad vial. Interés por relacionar los contenidos estudiados con los fenómenos producidos a nuestro alrededor. ACTIVIDADES Cuestiones y problemas del libro de texto. COMPETENCIAS Competencia en el conocimiento y la interacción con el mundo físico. Analizar de forma razonada y con argumentos científicos las implicaciones que la demanda energética actual tiene sobre el medio ambiente. Competencia matemática Aplicar conocimientos matemáticos a los cálculos con las magnitudes descritas en la unidad. Autonomía e independencia personal Demostrar un espíritu crítico hacia las decisiones aceptadas por la sociedad en materia energética Unidad 9: ENERGÍA Y CALOR Nº de horas: 12 OBJETIVOS GENERALES Repasar los fundamentos básicos de la teoría cinético-molecular de la materia. Diferenciar claramente calor y temperatura. Saber cómo se transfiere la energía entre los cuerpos. Saber cuáles son los efectos que el calor causa sobre los cuerpos. Saber de qué depende la sensación de frío o de calor que tenemos cuando tocamos objetos situados en una misma habitación. Conocer la experiencia de Joule y su importancia para comprender los fenómenos relacionados con el calor. Entender el concepto de entropía y su relación con la teoría cinética. CRITERIOS DE EVALUACIÓN Interpretar gráficas y tablas relacionadas con el calentamiento de una sustancia. Resolver problemas numéricos en los que tiene lugar un equilibrio térmico. Con cambios de estado o sin ellos. Relacionar el movimiento microscópico de las partículas que forman la materia con la temperatura. Explicar el concepto de entropía. Calcular de manera cuantitativa los efectos que causa el calor: dilatación de cuerpos, cambios de estado o aumento de temperatura. . CONTENIDOS CONCEPTUALES Termodinámica. Sistemas formados por muchas partículas. Sistemas termodinámicos Relación entre energía, temperatura y calor. El principio cero de la termodinámica. Temperatura. Medida de la temperatura: termómetros. Significado microscópico de la temperatura. El cero absoluto. ¿Por qué usamos la escala Kelvin? Transferencias de energía. Calor y trabajo. Efectos del calor. Aumento de la temperatura: el calor específico. Cambios de estado: calor latente. Dilatación de sólidos, líquidos y gases. Mecanismos de transmisión del calor. Transmisión de calor por conducción. Transmisión de calor por convección. Transmisión de calor por radiación. Conservación de la energía: el primer principio de la termodinámica. La energía interna. El principio de conservación de la energía. El equivalente mecánico del calor: la experiencia de Joule. El segundo principio de la termodinámica: la entropía. PROCEDIMENTALES Interpretar gráficas y tablas. Resolver problemas numéricos en los que tiene lugar un equilibrio térmico. Interpretar esquemas en los que se indica el flujo de energía entre dos cuerpos o sistemas. Interpretar esquemas en los que se muestran las partículas que forman la materia y su movimiento, y relacionar este movimiento con la temperatura. Calcular de manera cuantitativa los efectos que causa el calor: dilatación de cuerpos, cambios de estado o aumento de temperatura. Elaborar gráficas que muestren el aumento de temperatura o los cambios de estado que se producen en una sustancia en función del tiempo. Interpretar gráficos de líneas, barras o sectores relacionados con el calentamiento global de la Tierra. ACTITUDINALES Adoptar hábitos encaminados a ahorrar energía. Valorar las medidas tomadas por los organismos correspondientes y encaminadas a solucionar el problema del calentamiento global. Mostar gusto por buscar explicaciones racionales a los fenómenos que se producen en la naturaleza. ACTIVIDADES Cuestiones y problemas del libro de texto. COMPETENCIAS Competencia en el conocimiento y la interacción con el mundo físico. Distinguir las diferentes teorías que en la historia de la humanidad han dado una explicación a los fenómenos relacionados con la transmisión de la energía mediante calor Autonomía e independencia personal. Reconocer los problemas con los que se enfrentan los países desarrollados para producir y transformar la energía con un rendimiento adecuado a sus necesidades. Unidad 10: ELECTRICIDAD Nº de horas:12 OBJETIVOS GENERALES Adquirir unos conocimientos básicos sobre la historia de la electricidad y de los conocimientos que las personas hemos tenido sobre los fenómenos eléctricos. Saber calcular la fuerza de atracción o de repulsión entre cargas eléctricas. Comprender cuál es la relación entre la intensidad del campo eléctrico y la fuerza ejercida sobre una partícula cargada introducida en dicho campo. Aprender a resolver problemas con circuitos eléctricos teniendo en cuenta la ley de Ohm y la ley de la conservación de la energía. Ser conscientes de la importancia de la electricidad en nuestros días. Saber cuáles son las magnitudes de las que depende el consumo energético de un aparato eléctrico. CRITERIOS DE EVALUACIÓN Calcular la fuerza de atracción o de repulsión entre cargas eléctricas. Dibujar las líneas de fuerza del campo eléctrico creado por una o varias cargas. Calcular la intensidad del campo eléctrico o el potencial eléctrico debidos a la presencia de una o varias cargas eléctricas del mismo tipo o de tipos distintos. Aplicar la teoría cinética y la ley de la conservación de la energía para explicar algunos de los fenómenos observados en los circuitos eléctricos. Resolver problemas con circuitos en los que aparecen varias resistencias y/o generadores acoplados en serie o en paralelo. Tomar medidas en circuitos eléctricos con la ayuda de un polímetro. Identificar algunos materiales buenos conductores de la corriente eléctrica. . CONTENIDOS CONCEPTUALES La carga eléctrica. La carga es una propiedad de las partículas. Fuerzas entre cargas eléctricas: ley de Coulomb. Constantes y unidades. Intercambio de cargas eléctricas en la Tierra. Comparación entre la fuerza electrostática y la fuerza de gravedad. Campo y potencial eléctricos. El campo eléctrico. Representación de campos eléctricos. La energía potencial electrostática. Potencial electrostático. La corriente eléctrica y la ley de Ohm. La intensidad de corriente. La ley de Ohm. La resistencia eléctrica. Resistividad. Conductores, semiconductores y aislantes. Circuitos eléctricos. Transformaciones energéticas en un circuito. Efecto Joule. La pila voltaica. Generadores. Las pilas. Generadores y fuerza electromotriz. Ley de Ohm generalizada. PROCEDIMENTALES Resolver problemas numéricos relacionados con las fuerzas eléctricas, el campo eléctrico o el potencial eléctrico. Analizar experiencias y obtener conclusiones a partir de los fenómenos observados durante el desarrollo de las mismas. Elaborar esquemas de circuitos eléctricos empleando la simbología de manera correcta. Resolver problemas sobre circuitos eléctricos a partir de un esquema de los mismos. Dibujar las líneas que describen los campos eléctricos. Utilizar esquemas a la hora de resolver problemas donde es necesario aplicar la ley de Coulomb. Utilizar adecuadamente algunos aparatos de medida relacionados con la electricidad: amperímetro, voltímetro y polímetro. ACTITUDINALES Fomentar hábitos de ahorro de la energía eléctrica. Valorar adecuadamente la importancia de los avances producidos en el campo de la electricidad. Valorar el trabajo de todos los científicos que han hecho posible que dispongamos en la actualidad de un conocimiento tan completo sobre los fenómenos eléctricos. Adoptar hábitos seguros a la hora de manipular aparatos eléctricos. ACTIVIDADES Cuestiones y problemas del libro de texto. COMPETENCIAS Competencia matemática y competencia en el conocimiento y la interacción con el mundo físico. Conocer las leyes básicas que definen las interacciones electrostáticas así como la notación matemática necesaria para su descripción. Competencia social y ciudadana. Reconocer el avance social y económico que produjo el descubrimiento de la electrostática. Autonomía e independencia personal. Reconocer el peligro que conlleva el uso de dispositivos cuyo funcionamiento esté basado en la corriente eléctrica y mostrar respeto por las normas de seguridad en las instalaciones eléctricas. Competencia en el conocimiento y la interacción con el mundo físico. Conocer y aplicar las leyes físicas que permiten la resolución de cualquier tipo de circuito eléctrico. CRITERIOS RESPECTO A LOS CUALES SE VA A EVALUAR A LOS ALUMNOS. 1. TRABAJO DIARIO DEL ALUMNO: realización de tareas en casa, así como el trabajo en el aula. 2. CONOCIMIENTOS PROPIOS DE LA MATERIA: Si posee los conceptos y si los aplica. También se valorarán los conocimientos de procedimientos referentes tanto a planteamiento y resolución de problemas, como a expresión y comprensión. 3. ASISTENCIA Y ACTITUD EN CLASE: La asistencia a clase y la participación en el desarrollo de la misma. 4. PRUEBAS ESCRITAS: Se realizará cómo mínimo 1 al trimestre. En cada prueba escrita se indicará de forma explicita la puntuación de cada pregunta y apartado. Para superar la asignatura será necesario obtener una calificación mínima de 5. PROGRAMACIÓN FÍSICA 2º BACHILLERATO. INTRODUCCIÓN En la confección de esta Programación hemos seguido las Instrucciones y Orientaciones elaboradas por los Coordinadores y Ponentes de la materia, designados por la Comisión Interuniversitaria de Coordinación de las Pruebas de Acceso a las Universidades Andaluzas ( Orientaciones en las que se ha tenido en cuenta, como no podía ser de otra manera, las opiniones de todo el profesorado que imparte la asignatura en los distintos Centros de Educación Secundaria de la Comunidad Autónoma, recogida por lo citados Ponentes en las reuniones mantenidas con este fin en todas y cada una de las provincias andaluzas). OBJETIVOS GENERALES La enseñanza de la Física en el Bachillerato tendrá como finalidad contribuir a desarrollar en el alumnado las capacidades siguientes: 1. Adquirir y poder utilizar con autonomía conocimientos básicos de la Física, así como las estrategias empleadas en su construcción. 2. Comprender los principales conceptos y teorías, su vinculación a problemas de interés y su articulación en cuerpos coherentes de conocimientos. 3. Familiarizarse con el diseño y realización de experimentos físicos, utilizando el instrumental básico de laboratorio, de acuerdo con las normas de seguridad de las instalaciones. 4. Expresar mensajes científicos orales y escritos con propiedad, así como interpretar diagramas, gráficas, tablas, expresiones matemáticas y otros modelos de representación. 5. Emplear de manera habitual las tecnologías de la información y la comunicación para realizar simulaciones, tratar datos y extraer y utilizar información de diferentes fuentes, evaluar su contenido, fundamentar los trabajos y adoptar decisiones. 6. Aplicar los conocimientos físicos pertinentes a la resolución de problemas de la vida cotidiana. 7. Comprender las complejas interacciones actuales de la Física con la tecnología, la sociedad y el ambiente, valorando la necesidad de trabajar para lograr un futuro sostenible y satisfactorio para el conjunto de la humanidad. PROGRAMACIÓN DE LOS TEMAS Unidad 1: CAMPOS GRAVITATORIO Y ELÉCTRICO Nº de horas:18 CONTENIDOS CONCEPTUALES Ideas previas a la teoría de la gravitación: Pitágoras, Aristóteles, Ptolomeo (sistema geocéntrico), Nicolás Copérnico, Galileo Galilei (sistema heliocéntrico), Johannes Kepler (sus leyes), Isaac Newton (teoría de la gravitación universal). Concepto de campo. Campos escalar y vectorial. Líneas de campo. Flujo del vector intensidad de campo a través de una superficie. Fuerza en los campos gravitatorio y eléctrico. Fuerza gravitatoria: ley de Newton de la gravitación universal. Fuerza eléctrica: ley de Coulomb. Principio de superposición. Intensidad de campo. Campo gravitatorio creado por una masa puntual. Campo eléctrico creado por una carga puntual. Principio de superposición. Trabajo y energía potencial. Trabajo y energía potencial gravitatoria. Trabajo y energía potencial electrostática. Potencial. Potencial gravitatorio. Potencial electrostático. Superficies equipotenciales. Relación entre el vector intensidad de campo y el escalar potencial. Campo gravitatorio terrestre. Satélites artificiales. Principio de conservación de la energía mecánica. Velocidad de escape de un satélite. Campo electrostático en la materia. Equilibrio electrostático. Analogías y diferencias entre los campos gravitatorio y eléctrico. PROCEDIMENTALES Recopilación de información de las diversas teorías sobre la posición de la Tierra en el universo. Identificación de las fuerzas gravitatorias que intervienen en la vida cotidiana. Interpretación del significado físico de las leyes de Kepler. Utilización de técnicas de resolución de problemas para abordar los relativos a las leyes de Kepler y a la ley de la gravitación universal de Newton. Representación de un campo gravitatorio mediante líneas de fuerza. Recopilación de información bibliográfica sobre el movimiento de planetas y satélites. Utilización de técnicas de resolución de problemas para abordar la interacción gravitatoria. Resolución de ejercicios numéricos de aplicación de los conceptos relacionados con el campo gravitatorio. Cálculo de las energías de escape y de puesta en órbita de un satélite en el campo gravitatorio terrestre. Planificación y realización de experiencias para analizar diferentes fenómenos y procesos relacionados con la electricidad. Identificación de fuerzas eléctricas en la vida cotidiana. Representar campos eléctricos mediante líneas de fuerza y superficies equipotenciales. Utilización de técnicas de resolución de problemas para abordar la interacción electrostática. Cálculo de la trayectoria de cargas eléctricas en campos eléctricos uniformes. ACTITUDINALES Valoración de la importancia de la teoría de la gravitación universal en el avance progresivo del conocimiento del mundo. Reconocimiento de la importancia de los modelos y su confrontación con los hechos empíricos. Valoración de la provisionalidad de las explicaciones como base del carácter no dogmático y cambiante de la ciencia. Interés por los temas de actualidad relacionados con el movimiento de planetas y satélites. Reconocimiento y valoración de la importancia de los hábitos de claridad y orden en la realización de trabajos. Valoración crítica de la técnica relacionada con los satélites artificiales en el progreso y bienestar de la humanidad. Valoración crítica de los riesgos que comporta el uso de los avances científicos y técnicos en el campo de los satélites artificiales. Reconocimiento de la importancia del modelo de campo eléctrico para superar las dificultades de la interacción a distancia entre las cargas. Respeto de las instrucciones de uso y de las normas de seguridad en la utilización de los aparatos eléctricos. Valoración de la importancia de la electricidad en las actividades cotidianas y en el desarrollo económico. CRITERIOS DE EVALUACIÓN Reconocer que el crecimiento de la física no es lineal sino que se produce de forma irregular, con períodos de estancamiento, retrocesos y grandes avances que rompen las concepciones establecidas y exigen, a veces, la remodelación completa del cuerpo teórico de la física. Conocer las principales explicaciones históricas dadas al problema de la posición de la Tierra en el universo. Comprender las leyes de Kepler y aplicarlas en casos sencillos. Valorar la importancia histórica de la gravitación universal y poner de manifiesto las razones que llevaron a su aceptación. Utilizar los procedimientos propios de la resolución de problemas para abordar situaciones en las que se aplique la ley de la gravitación universal. Utilizar el concepto de campo gravitatorio para superar las dificultades que plantea la acción a distancia. Utilizar el concepto de intensidad del campo para describir el campo gravitatorio remarcando su carácter vectorial. Aplicar los conceptos de energía potencial y de potencial para describir el campo gravitatorio. Aplicar los distintos conceptos que describen la interacción gravitatoria al estudio del movimiento de planetas y satélites, y analizar los resultados obtenidos. Utilizar el concepto de campo electrostático para superar las dificultades que plantea la interacción a distancia. Utilizar el concepto de intensidad del campo eléctrico remarcando su carácter vectorial. Aplicar los conceptos de energía potencial y de potencial para describir el campo electrostático. Relacionar la intensidad del campo electrostático con el potencial eléctrico. Describir el movimiento de cargas eléctricas en campos electrostáticos uniformes. Aplicar el teorema de Gauss al cálculo de campos eléctricos creados por elementos continuos. Unidad 2: MOVIMIENTO ARMÓNICO SIMPLE Nº de horas:12 CONTENIDOS CONCEPTUALES Movimiento oscilatorio: movimiento vibratorio armónico simple. Características. Ecuación del movimiento armónico simple: cálculo de la velocidad y de la aceleración. Dinámica del movimiento vibratorio armónico simple. Energía de un oscilador armónico o mecánico. Principio de conservación de la energía mecánica. Cuestiones y ejercicios. PROCEDIMENTALES Identificación de movimientos vibratorios en la vida cotidiana. Interpretación del significado físico de las fórmulas matemáticas que representan los movimientos vibratorios. Descripción de las características de las fuerzas que producen movimientos vibratorios. Diseño y realización de experiencias, con emisión de hipótesis y control de variables, para el análisis de movimientos vibratorios armónicos simples. Utilización de procedimientos de resolución de problemas para abordar los relativos al movimiento vibratorio. Análisis e interpretación de las transformaciones energéticas que se producen en un movimiento vibratorio. ACTITUDINALES Reconocimiento de la importancia de los modelos y su confrontación con los hechos empíricos en el análisis de los movimientos vibratorios. Reconocimiento y valoración de la importancia del trabajo en equipo en la planificación y realización de experiencias. Sensibilidad hacia la realización cuidadosa de experiencias sobre movimientos vibratorios, con elección adecuada de los instrumentos de medida y manejo correcto de los mismos. Disposición al planteamiento de interrogantes ante hechos y fenómenos del entorno relacionados con los movimientos vibratorios. CRITERIOS DE EVALUACIÓN Comprender las características del movimiento vibratorio armónico simple. Calcular el valor de una magnitud en la descripción del movimiento vibratorio armónico simple conocidas otras magnitudes del mismo. Relacionar el movimiento vibratorio armónico simple con la fuerza que lo produce. Analizar las transformaciones energéticas que tienen lugar en un oscilador armónico. Describir el movimiento de un péndulo simple y los intercambios energéticos que tienen lugar. Unidad 3: MOVIMIENTO ONDULATORIO Nº de horas:18 CONTENIDOS CONCEPTUALES Fenómenos ondulatorios. Ondas: mecánicas, electromagnéticas, longitudinales y transversales. Velocidad de propagación de una onda; descripción cualitativa de su dependencia de las propiedades físicas del medio. Magnitudes características de las ondas. Ondas armónicas: ecuación del movimiento ondulatorio y descripción de sus características. La ecuación de una onda armónica es doblemente periódica: en el espacio y en el tiempo. Energía e intensidad asociada a las ondas: potencia emisiva del foco e intensidad de una onda en punto. Atenuación: ondas esféricas y ondas planas. Absorción. Estudio cualitativo de algunas propiedades de las ondas. Principio de Huygens. Propagación de una onda; reflexión y refracción en la superficie de separación de dos medios: sus leyes e interpretación geométrica. Difracción. Diferencias de comportamiento de la luz y del sonido en los fenómenos cotidianos. Polarización. Superposición de ondas, descripción cualitativa de los fenómenos de interferencia de dos ondas. Interferencias: ondas coherentes. Ondas estacionarias en resortes y cuerdas. Ecuación de una onda estacionaria y análisis de sus características. Nodos y vientres. Frecuencia fundamental de vibración. PROCEDIMENTALES Observación y análisis de movimientos ondulatorios en la vida cotidiana. Representación gráfica de las relaciones entre las magnitudes que caracterizan los movimientos ondulatorios. Diseño y realización de montajes experimentales para estudiar las características de las ondas y su propagación. Utilización de técnicas de resolución de problemas para abordar los relativos a los movimientos y a los fenómenos ondulatorios. Elaboración de informes escritos sobre experiencias realizadas en relación con las medidas de las características de las ondas, sobre contaminación acústica, etc. Explicación de problemas de la vida cotidiana en relación con los fenómenos ondulatorios. Utilización correcta del lenguaje matemático y gráfico para la representación de los fenómenos ondulatorios. Planificación y realización de experiencias con la cubeta de ondas para estudiar los fenómenos ondulatorios. Planificación y realización de experiencias con diapasones, tubos, etcétera, para estudiar los fenómenos de interferencias de ondas, pulsaciones y ondas estacionarias. ACTITUDINALES Interés por los temas de actualidad relacionados con las ondas. Respeto por el material, las instalaciones y las normas de seguridad en el laboratorio. Reconocimiento y valoración de la importancia de los hábitos de claridad y orden en la redacción de informes. Valoración de la potencia del modelo de onda para explicar diversos fenómenos cotidianos, como la contaminación acústica, etc. Toma de conciencia de los efectos de la contaminación acústica sobre la salud. Disposición al planteamiento de interrogantes ante hechos cotidianos relacionados con los fenómenos ondulatorios. Sensibilidad por el orden y la limpieza del aula, del laboratorio y del material de trabajo utilizado. Reconocimiento y valoración crítica de la importancia de los fenómenos ondulatorios en la sociedad actual CRITERIOS DE EVALUACIÓN Explicar lo que es una onda y distinguir entre ondas longitudinales y transversales. Relacionar la velocidad de propagación de una onda con las características del medio. Comprender la doble periodicidad, en el espacio y en el transcurso del tiempo, de una onda armónica. Resolver problemas de determinación de las magnitudes características de una onda a partir de su ecuación, y viceversa. Relacionar la amplitud de una onda con la intensidad. Conocer y valorar los efectos de la contaminación sonora y las medidas para su prevención. Comprender los fenómenos de interferencias de ondas en el espacio y establecer las condiciones de máximos y mínimos de interferencia en casos sencillos. Comprender los fenómenos de interferencias de ondas en el tiempo y utilizar el concepto de onda modulada en casos sencillos. Calcular la frecuencia fundamental y los armónicos de ondas estacionarias en casos sencillos. Comprender y describir con la ayuda del principio de Huygens los fenómenos de reflexión, refracción y difracción de ondas. Unidad 4: CAMPO MAGNÉTICO Nº de horas:12 CONTENIDOS CONCEPTUALES Introducción al campo magnético. Fuerzas magnéticas. Las cargas eléctricas en movimiento crean campos magnéticos: experiencias de Oersted. Fuerza magnética sobre una carga en movimiento: ley de Lorentz. Definición de campo magnético. Movimiento de cargas en un campo magnético uniforme. Fuerza magnética sobre una corriente rectilínea. Momento sobre una espira: momento del par. Campo magnético creado por una corriente rectilínea: ley de Biot y Savart. Ley de Ampere: circulación del vector inducción magnética a lo largo de una circunferencia. Campo magnético creado por una espira circular, bobina, solenoide y electroimán. Fuerza magnética entre dos corrientes rectilíneas paralelas e indefinidas. Definición de Amperio. Magnetismo natural. Sustancias diamagnéticas, paramagnéticas y ferromagnéticas. PROCEDIMENTALES Identificación de fenómenos magnéticos en la vida cotidiana. Interpretación del significado físico de las fórmulas matemáticas que relacionan los campos magnéticos y las corrientes eléctricas. Representación de las líneas de fuerza de los campos magnéticos producidos por imanes y por corrientes eléctricas. Realización de experiencias de laboratorio para estudiar los campos magnéticos producidos por corrientes eléctricas y la acción de los campos magnéticos sobre conductores. Cálculo de los campos magnéticos creados por conductores rectilíneos, espiras y solenoides. Diseño y realización de máquinas y aparatos sencillos (electroimanes, galvanómetros, etc.), relacionados con la interacción entre campos magnéticos y corrientes eléctricas. ACTITUDINALES Disposición al planteamiento de interrogantes ante fenómenos de la vida cotidiana relacionados con el electromagnetismo. Sensibilidad hacia la realización cuidadosa de experiencias de laboratorio, con elección adecuada del material y de los instrumentos de medida y utilización correcta de los mismos. Valoración crítica de la contribución del electromagnetismo en la mejora de la vida cotidiana. Interés en recabar informaciones históricas sobre la evolución de los fenómenos magnéticos. CRITERIOS DE EVALUACIÓN Describir cualitativamente y calcular en casos sencillos la interacción entre un campo magnético y una corriente eléctrica. Describir cualitativamente y calcular en casos sencillos el campo magnético creado por cargas en movimiento. Aplicar la ley de Ampère en casos sencillos. Comprender la definición internacional de amperio. Explicar cualitativamente el magnetismo natural. Unidad 5: INDUCCIÓN ELECTROMAGNÉTICA Nº de horas:12 CONTENIDOS CONCEPTUALES Introducción elemental del concepto de flujo magnético. Unidades. Fenómenos de inducción electromagnética. Variación del flujo magnético que atraviesa una espira o una bobina: ley de Faraday - Lenz. Producción de corrientes eléctricas alternas. La energía eléctrica: su obtención, transporte y distribución. Generadores de corriente alterna. Centrales eléctricas. Transformadores. La energía eléctrica: importancia e impacto medio ambiental. PROCEDIMENTALES Planificación y realización de experiencias para analizar diversos fenómenos relacionados con la inducción electromagnética. Utilización del lenguaje matemático y gráfico en la formulación de las leyes de la inducción electromagnética. Manipulación y lectura de instrumentos eléctricos de medida. Utilización de técnicas de resolución de problemas relacionados con la inducción electromagnética. Identificación y análisis de las transformaciones energéticas que tienen lugar en las centrales eléctricas. ACTITUDINALES Respeto por el material, las instalaciones y las normas de seguridad en el laboratorio. Organización y constancia en el trabajo en el aula y en el laboratorio. Valoración crítica de la importancia de la electricidad para la calidad de vida y para el desarrollo tecnológico. Valoración crítica del impacto ambiental de la producción, el transporte y la distribución de la energía eléctrica. CRITERIOS DE EVALUACIÓN Relacionar y explicar la producción de una fuerza electromotriz inducida en un circuito con la variación del flujo magnético. Aplicar las leyes de Faraday-Henry y de Lenz en circuitos sencillos. Comprender los fundamentos de la producción de fuerzas electromotrices sinusoidales en los generadores de corriente alterna. Identificar en los generadores de los diferentes tipos de centrales eléctricas el fundamento de la producción de corriente eléctrica y de su distribución. Identificar la generación de corrientes inducidas en los transformadores que adecuan la corriente para su transporte y utilización. Valorar el impacto ambiental de la producción, transporte y distribución de energía eléctrica. Unidad 6: LA LUZ. ÓPTICA GEOMÉTRICA. Nº de horas:18 CONTENIDOS CONCEPTUALES Naturaleza de la luz: Euclides, Isaac Newton (teoría corpuscular de la luz), C. Huygens (naturaleza ondulatoria de la luz), T.Young y A. Fresnel., Jean Clerk Maxwell, Heinrich Hertz. Doble naturaleza de la luz: naturaleza corpuscular y ondulatoria. Plank y Louis de Broglie. Propagación de la luz. Sombras y penumbras. Índice de refracción absoluto y relativo. Reflexión de la luz. Reflexión especular y difusa. Elementos de la reflexión y leyes de Snell. Refracción de la luz. Elementos de la refracción. Leyes de Snell de la refracción. Ángulo límite y reflexión total. La fibra óptica, el endoscopio y las comunicaciones. Dispersión de la luz. El espectro de la luz visible. Espectroscopía. Fenómenos de interferencias. Experiencia de Young. Difracción. Óptica geométrica. Espejos planos y espejos esféricos. Elementos. Construcción de las imágenes en los espejos planos y en los espejos esféricos. Lentes: convergentes y divergentes. Elementos de una lente. Formación de imágenes por lentes convergentes y por lentes divergentes. Ecuación de una lente. Potencia de una lente. El ojo humano. Defectos de la visión más corrientes: miopía, hipermetropía, presbicia y astigmatismo. Instrumentos ópticos: lupa, cámara fotográfica, anteojo terrestre, proyector y microscopio. PROCEDIMENTALES Observación y análisis de fenómenos de propagación de la luz en la vida cotidiana. Utilización de técnicas de resolución de problemas para abordar los relativos a la propagación de la luz. Diseño y realización de experiencias relacionadas con la reflexión y la refracción de la luz. Confección de informes escritos sobre experiencias relacionadas con la propagación de la luz. Identificación de las aplicaciones de la óptica geométrica en la vida cotidiana. Determinación gráfica de la imagen en espejos y en lentes delgadas. Cálculo de la posición y del tamaño de la imagen en espejos y en lentes delgadas. Diseño y realización de montajes experimentales para estudiar la formación de imágenes en espejos y en lentes delgadas. Diseño y realización de instrumentos ópticos sencillos mediante combinación de lentes delgadas. Análisis y descripción del funcionamiento de instrumentos ópticos sencillos. ACTITUDINALES Interés en recabar informaciones históricas sobre la evolución de las explicaciones científicas de la naturaleza de la luz. Reconocimiento de la importancia de los modelos sobre la naturaleza de la luz y su confrontación con los hechos empíricos. Honestidad y rigor en la recogida de datos, en su tratamiento y en su comunicación. Reconocimiento de la importancia de los modelos en óptica geométrica y su confrontación con los hechos empíricos. Reconocimiento y valoración de la importancia del trabajo en equipo en la planificación y realización de experiencias. Reconocimiento y valoración de la importancia de las aplicaciones de la óptica geométrica en la vida cotidiana y en el desarrollo industrial y tecnológico. Reconocimiento y valoración de la importancia de las aplicaciones de la óptica geométrica de la medicina. CRITERIOS DE EVALUACIÓN Explicar las diferentes teorías dadas a lo largo de la historia sobre la naturaleza de la luz. Utilizar las leyes relacionadas con la propagación de la luz para explicar fenómenos cotidianos: la reflexión, refracción y dispersión de la luz y la percepción de los colores. Comprender los fenómenos de interferencia y difracción de la luz. Comprender los fenómenos relacionados con la polarización de la luz. Explicar la formación de imágenes en espejos planos y esféricos y determinar el tipo de imagen. Explicar la formación de imágenes en lentes delgadas y determinar el tipo de imagen. Utilizar la ecuación de las lentes delgadas para localizar la posición de la imagen y su tamaño. Describir el funcionamiento de instrumentos ópticos, como la lupa, el microscopio y el telescopio. Unidad 7: FÍSICA CUÁNTICA Nº de horas:12 CONTENIDOS CONCEPTUALES Radiación térmica. Ley de Wien. Ley de Stefan-Boltzmann.. Catástrofe del ultravioleta. Hipótesis de Planck: cuantización de la energía. Efecto fotoeléctrico. Teoría de Einstein: la luz se propaga transportando la energía en forma de "paquetes" o cuantos de luz, llamados fotones, Cuantización de la energía en los átomos: espectros discontinuos. Series de Lyman, Balmer, Paschen, Brackett y Pfund. Hipótesis de De Broglie. Dualidad onda- partícula. Ondas de materia. Principio de incertidumbre o indeterminación de Heisenberg. Ecuación de Schrödinger. Función de onda. PROCEDIMENTALES Utilización del lenguaje matemático y del lenguaje ordinario para explicar las leyes cuánticas. Diseño y realización de experiencias, con emisión de hipótesis y control de variables, para determinar los factores que intervienen en el efecto fotoeléctrico. Interpretación del significado físico de las fórmulas matemáticas relativas a la física cuántica. Realización de trabajos bibliográficos de recopilación y estudio de la información disponible sobre el origen y desarrollo histórico de la física cuántica. Descripción de algunas aplicaciones técnicas de la física cuántica. Valoración crítica de la importancia de la física cuántica en el avance progresivo del conocimiento del mundo. ACTITUDINALES Valoración crítica de la importancia de la física cuántica en el avance progresivo del conocimiento del mundo. Interés en recabar informaciones históricas sobre el origen y la evolución de la física cuántica. Interés por los temas de actualidad relacionados con las aplicaciones de la física cuántica. Valoración de la provisionalidad de las explicaciones científicas como elemento característico de la física. Reconocimiento de la importancia de los modelos y su confrontación con los hechos empíricos. Valoración crítica de la importancia de las aplicaciones tecnológicas de la física cuántica. CRITERIOS DE EVALUACIÓN Conocer y valorar la introducción de la física cuántica para superar las limitaciones de la física clásica. Comprender la hipótesis de Planck y la cuantización de la radiación electromagnética. Explicar con las leyes cuánticas el efecto fotoeléctrico y los espectros discontinuos. Aplicar las leyes de la física cuántica para explicar el comportamiento de electrones, fotones, etc. Conocer y valorar algunas aplicaciones tecnológicas de la física cuántica. Unidad 8: FÍSICA NUCLEAR Nº de horas:12 CONTENIDOS CONCEPTUALES Composición del núcleo del átomo: Protones y neutrones. Número atómico y número másico. Núclidos o nucleidos e isótopos. Unidad de masa atómica. Estabilidad de los núcleos. Interacción nuclear fuerte. Defecto de masa. Energía de enlace y energía de enlace por nucleón. Estabilidad nuclear. Radiactividad. Radiaciones alfa, beta y gamma. Interacción débil. Leyes de los desplazamientos radiactivos: reglas de Fajans y Soddy. principios de conservación del número de nucleones y conservación de la carga eléctrica. Serie o familia radiactiva. Ley de la desintegración radiactiva. Actividad o velocidad de desintegración. Período de semidesintegración. Vida media. Unidades: Bequerel, Curio y Rutherford. Reacciones nucleares: fisión y fusión nuclear. Reactores nucleares. Riesgos y aplicaciones tecnológicas de la radiactividad. Repercusiones sociales. La unificación de las interacciones fundamentales de la naturaleza. Estudio comparativo de sus características y dominios de influencia. La búsqueda de Teoría de la Gran Unificación. PROCEDIMENTALES Análisis e interpretación de las diversas transformaciones energéticas que se producen en un reactor nuclear. Análisis comparativo de la producción de energía mediante reactores nucleares y mediante otras formas de producción. Utilización de técnicas de resolución de problemas para abordar los relativos a la descripción de las reacciones nucleares y de la radiactividad. Utilización de distintas fuentes de información (prensa, revistas, etc.), acerca del uso de la radiactividad y de la energía nuclear en la sociedad actual. Descripción de las aplicaciones prácticas de la física nuclear. Identificación de la presencia de las interacciones fundamentales en la vida cotidiana. Descripción en lenguaje ordinario de los rasgos generales del modelo estándar de constitución de la materia. Aplicación de las leyes de conservación a la desintegración de partículas. Realización de trabajos bibliográficos de recopilación y estudio de la información disponible sobre las partículas e interacciones fundamentales . ACTITUDINALES Interés por los temas de actualidad relacionados con la física nuclear y con las partículas e interacciones fundamentales. Valoración y respeto de las opiniones de otras personas y tendencia a comportarse coherentemente con dicha valoración. Valoración crítica de la importancia de las aplicaciones de la física nuclear en la sociedad actual. Concienciación de los peligros que comporta el mal uso de los avances científicos y técnicos. Valoración crítica de la importancia de la física en el avance progresivo del conocimiento de la estructura de la materia. Valoración de la provisionalidad de las explicaciones como elemento intrínseco y como base del carácter objetivo y antidogmático de la física. Reconocimiento y valoración de los hábitos de claridad y orden en la elaboración de trabajos bibliográficos. CRITERIOS DE EVALUACIÓN Describir la estructura del núcleo atómico. Aplicar la ley de la desintegración radiactiva en casos sencillos. Aplicar las leyes de conservación de los números atómico y másico a las reacciones nucleares y a los procesos radiactivos. Calcular energías de enlace y energías de enlace por nucleón. Conocer las principales ventajas e inconvenientes del uso de la energía nuclear y de la radiactividad. Identificar y clasificar las partículas elementales según sus características. Conocer los aspectos generales de la teoría de los quarks. Identificar las interacciones fundamentales y conocer sus principales características. Aplicar las leyes de conservación en la desintegración de partículas elementales. Conocer los aspectos generales de las teorías de unificación. CRITERIOS RESPECTO A LOS CUALES SE VA A EVALUAR A LOS ALUMNOS. 1. TRABAJO DIARIO DEL ALUMNO: realización de tareas en casa, así como el trabajo en el aula. 2. CONOCIMIENTOS PROPIOS DE LA MATERIA: Si posee los conceptos y si los aplica. También se valorarán los conocimientos de procedimientos referentes tanto a planteamiento y resolución de problemas, como a expresión y comprensión. Los ejercicios para valorar los conocimientos serán similares a los de la prueba de Acceso a la Universidad 3. ASISTENCIA Y ACTITUD EN CLASE: La asistencia a clase y la participación en el desarrollo de la misma. 4. PRUEBAS ESCRITAS: Se realizará cómo mínimo 1 al trimestre. En cada prueba escrita se indicará de forma explicita la puntuación de cada pregunta y apartado. Para superar la asignatura será necesario obtener una calificación mínima de 5. PROGRAMACIÓN QUÍMICA 2º BACHILLERATO. INTRODUCCIÓN En la confección de esta Programación hemos seguido las Instrucciones y Orientaciones elaboradas por los Coordinadores y Ponentes de la materia, designados por la Comisión Interuniversitaria de Coordinación de las Pruebas de Acceso a las Universidades Andaluzas ( Orientaciones en las que se ha tenido en cuenta, como no podía ser de otra manera, las opiniones de todo el profesorado que imparte la asignatura en los distintos Centros de Educación Secundaria de la Comunidad Autónoma, recogida por lo citados Ponentes en las reuniones mantenidas con este fin en todas y cada una de las provincias andaluzas). OBJETIVOS GENERALES La materia de Química en el 2º curso de Bachillerato tiene por objeto ayudar a conseguir, desde la particularidad de la citada materia, finalidades de tipo general y finalidades más específicas. Finalidades de tipo general - Proporcionar a los alumnos una madurez intelectual humana, y los conocimientos y habilidades necesarios para desempeñar funciones sociales con responsabilidad y competencia. - Cumplir la función de preparar a los alumnos hacia estudios superiores, bien universitarios o profesionales. Finalidades específicas - Ayudar al alumnado en la búsqueda de la comprensión de la Naturaleza desde la perspectiva química: estudio de la constitución y estructura de la materia, y el de sus transformaciones. - Aumentar el conocimiento y profundizar en los conceptos ya adquiridos previamente, fomentando el espíritu crítico con los problemas que tiene planteados la sociedad, y los que se derivan del mal uso de la ciencia. - Aproximar al alumnado al trabajo científico. El planteamiento general ha de contribuir a que los alumnos y alumnas sean capaces de plantear problemas, formular y contrastar hipótesis y diseñar e interpretar resultados de pequeñas experiencias científicas. - Que el alumnado vea la conexión Ciencia-Tecnología-Sociedad-Ambiente. Si tenemos en cuenta que la sociedad moderna demanda cada vez más una industria muy diversificada, y que atiende a las necesidades de una sociedad cada vez más avanzada y cambiante, es fundamental que quede claro para los alumnos y alumnas a lo largo del libro esta relación. CAPACIDADES 1. Adquirir y poder utilizar con autonomía los conceptos, leyes, modelos y teorías más importantes, así como las estrategias empleadas en su construcción. 2. Familiarizarse con el diseño y la realización de experimentos químicos, así como con el uso del instrumental básico de un laboratorio químico y conocer algunas técnicas específicas, todo ello de acuerdo con las normas de seguridad de sus instalaciones. 3. Utilizar las tecnologías de la información y la comunicación para obtener y ampliar información procedente de diferentes fuentes, y saber evaluar su contenido. 4. Familiarizarse con la terminología científica para poder emplearla de manera habitual al expresarse en el ámbito científico, así como para poder explicar expresiones científicas utilizadas en el lenguaje cotidiano. 5. Conocer las propiedades generales de sustancias y materiales así como las aplicaciones y usos de algunos de los más relevantes que se utilizan en la vida cotidiana. 6. Comprender el papel de esta materia en la vida cotidiana y su contribución a la mejora de la calidad de vida de las personas. Valorar igualmente, los problemas que su uso puede generar y cómo puede contribuir al logro de estilos de vida saludables. METODOLOGÍA Debemos tener en cuenta que, normalmente, esta asignatura la cursa el alumno en el curso anterior a su ingreso en la Universidad o a su pase a los Ciclos Superiores de Formación Profesional Específica, por ello debe intentarse que se constituya en una buena y suficiente base de conocimientos químicos que va a necesitar con posterioridad. Sabemos que los temas relacionados con la estructura atómica, los enlaces químicos, los equilibrios químicos, los procesos de oxidación-reducción, etc. son precisamente aquellos en los que los alumnos de este nivel encuentran más dificultad para comprender y asimilar; por ello, debemos procurar desarrollar todas estas ideas y conceptos, en su gran mayoría nuevos para ellos, con la mayor claridad y de forma asequible a su grado de madurez y preparación en la materia. También debemos, en todo momento del desarrollo de la materia a lo largo del curso, intentar que el alumno comprenda y valore la estrecha relación existente entre la Química y la vida real y diaria, haciéndole tomar hacía la Química una actitud positiva. Igualmente, con el fin de que los alumnos comprendan y asimilen mejor los conceptos expuestos, en el desarrollo de cada tema se resolverán múltiples y variados ejercicios y problemas, tanto por parte del profesor como de los propios alumnos. Por otra parte, dado que “la Ponencia/coordinación de Química” ha acordado que en las Pruebas de Acceso a la Universidad se podrán hacer preguntas sobre trabajos prácticos (en concreto: “preparación de disoluciones” y “valoración de un ácido fuerte con una base fuerte”), se trabajarán con los alumnos los procedimientos y la metodología para realizarlos. PROGRAMACIÓN DE LOS TEMAS Unidad 1: Estructura atómica. Teoría cuántica. Nº de horas:10 OBJETIVOS GENERALES CRITERIOS DE EVALUACIÓN 1. Comprender algunos hechos experimentales de fines del siglo XIX y principios del XX que fueron determinantes en el conocimiento de la estructura del átomo. 2. Conocer los distintos modelos atómicos surgidos en el siglo XIX, haciendo especial hincapié en el modelo de Bohr. 3. Conocer las limitaciones del modelo de Bohr y que dieron lugar al modelo mecanocuántico. 4. Conocer los principales conceptos en los que está basada la mecánica cuántica: dualidad onda-corpúsculo, principio de incertidumbre y función de onda. 1.1. Aplica los conceptos estudiados sobre espectros atómicos. Comprende los conceptos de frecuencia, longitud de onda y sabe relacionarlos entre sí; asimismo sabe situar una radiación dada en el espectro electromagnético. 1.2. Conoce la diferencia de energía entre dos niveles electrónicos: ecuación de Planck y efecto fotoeléctrico. 2.1. Expone algún hecho experimental que justifique la validez del modelo de Bohr. 3.1. Expone algún hecho o fenómeno que muestre las limitaciones del modelo de Bohr. 4.1. Aplica adecuadamente los principales conceptos de la mecánica cuántica para resolver algunos sencillos ejercicios. . CONTENIDOS CONCEPTUALES - El átomo y la constitución de la materia. - Espectroscopía y análisis químico. Tubos de descarga y rayos catódicos. - Modelo de Thomson. El electrón. - Naturaleza electromagnética de la luz. - Naturaleza de la luz. Definición de onda. - Orígenes de la teoría cuántica. - Radiación térmica y cuerpo negro. Hipótesis de Planck. Efecto fotoeléctrico. Naturaleza dual de la luz. - Espectros atómicos. - Espectro continuo y discontinuo. Espectro de absorción o de emisión. El espectro del hidrógeno. - Identificación de algunos elementos químicos mediante ensayos a la llama. - Modelo atómico de Bohr. - Antecedentes al modelo de Bohr: modelo de Rutherford. - Modelo de Bohr: postulados. Número cuántico principal. Desarrollo y limitaciones del modelo de Bohr. - Niveles de energía en el átomo de hidrógeno. Nivel fundamental y niveles excitados. - Mecánica cuántica. - Hipótesis de De Broglie: dualidad onda-corpúsculo. - Principio de incertidumbre. - Justificación de la necesidad de nuevas teorías para el mundo microscópico: el modelo mecanocuántico. - Aplicación a ejemplos concretos y sencillos de las principales ideas de la mecánica cuántica. PROCEDIMENTALES y ACTITUDINALES - Interés por conocer cómo se han desarrollado los distintos modelos atómicos y los hechos experimentales con los que están relacionados. - Valoración la relación entre un mayor conocimiento de la materia, el desarrollo tecnológico y su aplicación en la sociedad. - Utilización las aportaciones de cada modelo atómico como una muestra de respeto hacia las opiniones e ideas de los demás. - Capacidad de autocrítica para mejorar nuestro trabajo diario. - Capacidad para rectificar y cambiar de opinión ante las evidencias experimentales encontradas, así como ante los hechos mostrados por otros compañeros. - Respeto por el medio en el que vivimos, procurando que la ciencia esté al servicio de la sociedad y minimizando al máximo el impacto de la evolución tecnológica en la naturaleza. - Valoración de la conexión entre la química, la tecnología y la sociedad como un medio de mejorar el mundo en el que vivimos. Unidad 2: Estructura electrónica de los átomos. Sistema Periódico. Nº de horas:8 OBJETIVOS GENERALES 1. Conocer el significado de los números cuánticos, así como los valores que pueden tomar. Justificar el tipo de orbitales y cuántos hay en cada nivel electrónico. 2. Utilizando los valores posibles de los números cuánticos, conocer las configuraciones electrónicas de los elementos químicos conocidos. 3. Conocer y comprender cómo se ha ido construyendo la Tabla Periódica y cómo está constituida: grupos y períodos. 4. Justificar el porqué de la ordenación de los elementos químicos, relacionándola con el número atómico. 5. Conocer algunas propiedades periódicas y cómo varían dentro del Sistema Periódico. CRITERIOS DE EVALUACIÓN 1.1. Justifica la validez o no de combinaciones de números cuánticos para un orbital o un electrón dado. 2.1. Utiliza el principio de construcción progresiva y escribe las configuraciones electrónicas de distintos elementos neutros y de sus iones. 3.1. Estudia el Sistema Periódico: grupos y períodos. 4.1. Relaciona la configuración electrónica de un elemento dado con el lugar que ocupa en el Sistema Periódico. 5.1. Analiza algunas propiedades periódicas. 5.2. Justifica la variación de las propiedades periódicas de una serie de elementos químicos en función del lugar que ocupen en la Tabla Periódica. CONTENIDOS CONCEPTUALES - Orbitales atómicos y números cuánticos. - Modelo mecanocuántico del átomo. - Números cuánticos. Significado y valores posibles. - Orbitales atómicos. Tipos de orbitales y distribución en el átomo. Energía de los orbitales. - Cálculo de los valores posibles que pueden tomar los números cuánticos para un orbital dado, y para los electrones que puede haber en él. - Justificación de los distintos tipos de orbitales presentes en cada nivel energético. Obtención de las energías relativas de los distintos orbitales. - Configuraciones electrónicas. - Distribución de los electrones en el átomo. Principio de exclusión de Pauli. Principio de máxima multiplicidad de Hund. Diamagnetismo y paramagnetismo. Principio de construcción progresiva. - Obtención de las configuraciones electrónicas de los distintos elementos, en su estado fundamental o en algún estado excitado. Configuraciones electrónicas de iones. - Sistema Periódico. - Desarrollo histórico del Sistema Periódico. - Descripción del Sistema Periódico actual. Número atómico y propiedades periódicas. Grupos. Períodos. - Localización correcta de los distintos elementos en la Tabla Periódica. - Propiedades periódicas. - Propiedades periódicas y su variación en el Sistema Periódico: radio atómico y radio iónico. Energía de ionización. Afinidad electrónica. Electronegatividad y carácter metálico. - Interpretación correcta de la Tabla Periódica, relacionando la configuración electrónica de un elemento dado con sus propiedades periódicas. - Justificación de la variación de las propiedades periódicas de una serie de elementos dados. PROCEDIMENTALES y ACTITUDINALES - Reflexión sobre la importancia de los trabajos de Meyer y Mendeléiev en la construcción del Sistema Periódico. - Interés por conocer el desarrollo histórico hasta el Sistema Periódico actual. - Valoración de la relación entre un mayor conocimiento de la materia, el desarrollo tecnológico y su aplicación en la sociedad. - Utilización del desarrollo histórico en el proceso de construcción de la Tabla Periódica como muestra del respeto hacia los trabajos de los demás. Unidad 3: Enlace químico. Nº de horas:12 OBJETIVOS GENERALES CRITERIOS DE EVALUACIÓN 1. Relacionar la configuración electrónica de la capa 1.1. Explica la tendencia electrónica de un elemento de valencia de los distintos elementos con el dado, razonando sus posibilidades de formar tipo de enlace químico que pueden formar. enlace iónico o enlace covalente. 2. Saber utilizar la regla del octeto y los diagramas 2.1. Utiliza la regla del octeto y los diagramas de de Lewis como un primer paso en el estudio del Lewis en moléculas sencillas. enlace químico. 3.1. Justifica el enlace que presentan las 3. Conocer las dos teorías cuánticas que describen sustancias covalentes, sus propiedades más el enlace covalente, justificando algunas características y cómo varían estas de una propiedades características de dicho enlace. sustancia a otra. 4. Describir el enlace iónico, justificando por qué 4.1. Justifica el enlace que presentan las ciertas sustancias presentan dicho enlace, así sustancias iónicas, sus propiedades más como sus propiedades. características y cómo varían estas de una 5. Describir el enlace metálico, justificando por sustancia a otra. qué los metales presentan dicho enlace, así 5.1. Justifica el enlace que presentan las como sus propiedades. sustancias metálicas, sus propiedades más características y cómo varían estas de una sustancia a otra. CONTENIDOS CONCEPTUALES - Enlace químico. - Formación de enlaces y estabilidad energética. Tipos de enlaces químicos. - Representar la configuración electrónica de un elemento dado, señalando su tendencia a formar enlace iónico o enlace covalente. - Teoría de Lewis del enlace químico. - Naturaleza electrónica del enlace químico. - Diagramas de Lewis: reglas. Representación de la estructura de algunos elementos y moléculas sencillas. - Multiplicidad y orden del enlace covalente. - Limitaciones y mejoras de la teoría de Lewis: octeto incompleto y octeto expandido. Resonancia. Aplicación a algunas moléculas. - Teorías cuánticas del enlace covalente. - Teoría del enlace de valencia. Valencia química y promoción. Enlaces múltiples en la TEV. Resolución de ejercicios y problemas. - Enlace covalente coordinado o dativo. - Propiedades del enlace covalente. - Longitud de enlace y multiplicidad. Energía de enlace. Polaridad del enlace covalente y electronegatividad. - Enlace iónico. - Transferencia electrónica: formación de pares iónicos. Energía reticular y ciclo de Born-Haber. Estructura interna de los cristales iónicos. Resolución de ejercicios y problemas. - Enlace metálico. - Modelo del gas de electrones. Teoría de bandas. - Propiedades de las sustancias según su enlace. - Compuestos iónicos. Metales. Sustancias covalentes. - Justificación de las propiedades más características de las sustancias covalentes. - Justificación las propiedades más características de las sustancias iónicas, así como su variación en función de los iones que se unan. - Justificación de las propiedades más características de los metales, y su variación dentro de un mismo grupo y un mismo período. PROCEDIMENTALES y ACTITUDINALES - Reflexión crítica sobre la importancia del conocimiento del enlace químico que presentan las diversas sustancias. - Interés por conocer las diversas teorías sobre el enlace químico. - Búsqueda de aplicaciones prácticas de lo estudiado teóricamente. Unidad 4: Moléculas y fuerzas intermoleculares. Nº de horas:8 OBJETIVOS GENERALES CRITERIOS DE EVALUACIÓN 1. Conocer el método RPECV para predecir la geometría de algunas moléculas sencillas. 2. Conocer la teoría de hibridación de orbitales para poder justificar la geometría de una molécula dada. 3. Conocer las propiedades físicas más características de las moléculas, destacando las propiedades magnéticas y las eléctricas. 4. Explicar correctamente los distintos tipos de fuerzas intermoleculares existentes en las sustancias covalentes, dedicando especial interés al enlace de hidrógeno. 5. Justificar las propiedades de las sustancias moleculares a partir del tipo de fuerza intermolecular. 1.1. Utiliza el método RPECV para predecir la geometría de algunas moléculas sencillas. 2.1. Utiliza la teoría de hibridación para justificar la geometría de una molécula dada, calculada previamente por el método RPECV. 3.1. Determina, de forma cualitativa, las propiedades físicas más características de algunas moléculas, destacando entre ellas la polaridad. 4.1. Justifica el tipo de fuerza intermolecular presente en una sustancia molecular dada. 4.2. Compara las fuerzas de Van der Waals y el enlace de hidrógeno para justificar la variación en las propiedades de dos sustancias. 5.1. Resuelve ejercicios que permitan justificar las propiedades de las sustancias covalentes moleculares. CONTENIDOS CONCEPTUALES - Moléculas y geometría molecular. - Electrones compartidos y no compartidos o solitarios. Estructuras de Lewis y geometría molecular. - Método RPECV. Tipos de moléculas según que el átomo central tenga o no pares de electrones solitarios. - Resolución de ejercicios y problemas de aplicación del método RPECV. - Teoría de la hibridación de orbitales atómicos. - Orbital híbrido. Tipos de orbitales híbridos. - La teoría de hibridación y el método RPECV. - Hibridación del átomo de carbono. - Representar distintos procesos de promoción electrónica necesarios para la formación de orbitales híbridos. - Resolución de ejercicios donde se justifiquen geometrías de moléculas a partir de la teoría de hibridación. - Propiedades físicas de las moléculas. - Diamagnetismo y paramagnetismo. - Polaridad en una molécula. Predicción de la polaridad de una molécula. - Fuerzas intermoleculares. - Fuerzas de dispersión o de London. Formación de dipolos: dipolos permanentes y dipolos inducidos. - Polarizabilidad. Fuerzas entre dipolos. - Enlace de hidrógeno. - Realización de ejercicios y problemas de aplicación de los conceptos estudiados. - Propiedades de las sustancias moleculares. - Sólidos moleculares. Líquidos moleculares. - Resolución de problemas para calcular la concentración de una disolución mediante una valoración. PROCEDIMENTALES y ACTITUDINALES - Reflexión sobre la importancia del concepto de molécula y de fuerza intermolecular. - Valoración de la importancia de las fuerzas intermoleculares en las distintas propiedades que presentan las sustancias moleculares. - Reflexión del papel que los métodos teóricos desempeñan en el conocimiento de la naturaleza. Unidad 5: Aspectos cuantitativos en química. Nº de horas:12 OBJETIVOS GENERALES 1. Representar con fórmulas químicas diversas sustancias y las ecuaciones químicas que muestran sus cambios. 2. Conocer y comprender los conceptos de masa atómica, mol, volumen molar y las relaciones existentes entre ellos. 3. Conocer y comprender las diversas leyes de los gases, dedicando especial atención a la ecuación de estado de un gas ideal. 4. Conocer y saber utilizar los distintos modos de expresar la concentración de una disolución. 5. Conocer las leyes fundamentales de los cálculos estequiométricos. CRITERIOS DE EVALUACIÓN 1.1. Resuelve ejercicios sencillos de ajuste de reacciones químicas. 2.1. Sabe utilizar y relaciona entre sí las distintas unidades de masa y volumen, dedicando especial atención al concepto de mol. 3.1. Resuelve problemas y ejercicios sencillos aplicando, entre otras, la ecuación general de los gases ideales. 4.1. Prepara disoluciones de concentración conocida. 4.2. Resuelve ejercicios y problemas sobre disoluciones. 4.3. Prepara una disolución de concentración dada a partir de otra disolución más concentrada. 5.1. Resuelve ejercicios y problemas sobre cálculos estequiométricos. CONTENIDOS CONCEPTUALES - Fórmula química. - Significado. Representación. Fórmula empírica y fórmula molecular. Fórmula estructural. Concepto de unidad-fórmula en los compuestos iónicos. - Realización de diagramas y modelos que representen las fórmulas de algunos compuestos sencillos. - Formulación y ajuste de diversos tipos de reacciones (método de tanteo). - La cantidad en química. Concepto de mol. - Unidad de masa atómica. Masa atómica promedio y masa molecular. El mol y el número de Avogadro. Masa molar. - Resolución de diversos ejercicios y problemas relacionando las distintas formas de expresar la cantidad en química: masas molares, volúmenes molares, etc. - Leyes de los gases. - Ley de Boyle, ley de Charles-Gay Lussac y ley de Avogadro. Ley de Dalton de las presiones parciales. - Gases ideales y gases reales. Ecuación de estado de los gases ideales. Aplicación de la ecuación general de los gases ideales. - Volumen molar. Densidad de un gas. Determinación de masas moleculares. - Composición de una sustancia y fórmula química. - Composición porcentual. Determinación de la fórmula de un compuesto. - Cálculo de fórmulas empíricas y fórmulas moleculares a partir del análisis químico elemental. - Disoluciones. - Soluto y disolvente. Solubilidad y saturación. - Unidades y modos de expresar la concentración. Cálculo de la concentración de una disolución en los distintos modos de expresarla. Preparación de una disolución a partir de otra más concentrada. - Cálculos estequiométricos. - Significado de una ecuación química. Reactivo limitante. Rendimiento de una reacción. - Representación, mediante las ecuaciones químicas correspondientes, de ejemplos de los principales tipos de reacciones. - Realización de cálculos estequiométricos, tanto en masa como en volumen, para diversas reacciones químicas. Determinación del reactivo limitante. - Cálculo de pureza de un reactivo o una muestra. - Realización de experiencias sencillas de laboratorio de cómo preparar una disolución de una concentración dada. PROCEDIMENTALES y ACTITUDINALES - Responsabilidad en el trabajo realizado en el laboratorio, así como las precauciones necesarias en el uso de sustancias químicas. - Capacidad para realizar pequeñas experiencias que permitan determinar la concentración de una disolución. - Reconocimiento de la importancia que tiene la medida en el proceso de hacer ciencia, así como los errores de los que va acompañada. Unidad 6: Termoquímica Nº de horas:12 OBJETIVOS GENERALES CRITERIOS DE EVALUACIÓN 1. Entender que toda reacción química lleva asociada un cambio energético: absorción o desprendimiento de energía. 2. Conocer y saber utilizar con autonomía las distintas magnitudes termodinámicas, así como las leyes que las relacionan: primer principio de la termodinámica y la ley de Hess como una particularización. 3. Entender los aspectos fundamentales del segundo principio de la termodinámica, y asociarlos al concepto de entropía o grado de desorden de un sistema. 4. Conocer y saber utilizar los factores de los que depende la espontaneidad de una reacción química. 1.1. Define y entiende los distintos conceptos fundamentales de la termoquímica. 2.1. Resuelve ejercicios y problemas aplicando el primer principio de la termodinámica. 2.2. Resuelve ejercicios y problemas de aplicación directa de la ley de Hess. 2.3. Aplica el primer principio de la termodinámica en el cálculo de energías de formación o energías de reacción. 3.1. Enuncia y comprende el segundo principio de la termodinámica. 4.1. Justifica la espontaneidad, o no, de una reacción química dada en función de la temperatura, variación de entropía y variación de entalpía. CONTENIDOS CONCEPTUALES - Energía química. - Energía. Tipos de energía. Energía química. Mecanismos de transferencia de energía. - Trabajo y calor. Efectos físicos del calor. Utilización de la ecuación fundamental en termología. - Planificación de experiencias sencillas de reacciones donde se pueda apreciar un desprendimiento o una absorción de calor. - Fundamentos de la termodinámica. - Sistemas termodinámicos. Sistema y entorno. Estados de equilibrio. - Variables termodinámicas. Funciones de estado. Calorimetría. - Primer principio de la termodinámica. - Energía interna. Primer principio de la termodinámica. Funciones de estado: energía interna y entalpía. - Termoquímica. - Ecuaciones termoquímicas. Condiciones estándar. Diagramas entálpicos. - Ley de Hess. Aplicaciones. Entalpías de formación. Energías de enlace. - Ciclo de Born-Haber. - Planificación de alguna experiencia sencilla de cálculo de una entalpía de reacción. - Aplicación de la ley de Hess en el cálculo de entalpías de reacción. - Segundo principio de la termodinámica. - Concepto de entropía. Entropía y desorden de un sistema. - Segundo principio de la termodinámica. - Entropías absolutas. - Valoración cualitativa en algunos ejemplos sencillos de la variación que experimenta la entropía en una reacción química dada. - Espontaneidad de las reacciones químicas. - Factores que influyen en la espontaneidad. Energía libre de Gibbs. Temperaturas de equilibrio. Energías libres de formación. Espontaneidad de los procesos físicoquímicos. - Justificar, en función de las variables de las que depende la energía libre de Gibbs, de la espontaneidad o no de una determinada reacción química. PROCEDIMENTALES y ACTITUDINALES - Reflexión crítica sobre la importancia del conocimiento de los aspectos energéticos de cualquier reacción química. - Valoración de la relación entre un mayor conocimiento de las reacciones químicas, el desarrollo tecnológico y su aplicación en la sociedad. - Valoración del proceso de búsqueda de combustibles más energéticos y menos contaminantes. - Observación de normas de seguridad en el laboratorio. Unidad 7: Cinética química Nº de horas:4 OBJETIVOS GENERALES CRITERIOS DE EVALUACIÓN 1. Conocer y explicar los principales conceptos cinéticos, destacando la ausencia de relación entre los aspectos energéticos y los cinéticos. 2. Comprender las ideas fundamentales acerca de la teoría de colisiones. 3. Conocer y comprender los distintos factores que inciden en la velocidad de una reacción química. 4. Valorar la importancia que tienen los catalizadores en la cinética de una reacción dada. 1.1. Resuelve ejercicios y problemas sencillos derivados del cálculo de las magnitudes cinéticas fundamentales en una reacción química dada. 2.1. Aplica la teoría de colisiones a una reacción química dada. 3.1. Justifica cómo afecta a la velocidad de una reacción la variación de diversos factores, tales como la temperatura, la concentración, etc. 4.1. Conoce los tipos de catalizadores y cómo modifican la velocidad de un proceso químico dado. CONTENIDOS CONCEPTUALES - Cinética química. - Concepto de velocidad de reacción. Unidades de velocidad. - Ecuación cinética de una reacción química. Ley diferencial de velocidad. Órdenes parciales y orden total de una reacción química. - Aplicación de los conceptos cinéticos para determinar la ecuación de velocidad. - Resolución de ejercicios y problemas sencillos sobre cinética química. - Mecanismo de las reacciones químicas. - Etapas elementales. Etapa limitante. Intermedios de reacción. Molecularidad. Algunos tipos de mecanismos de reacción. - Factores que influyen en la velocidad de reacción. - Naturaleza del proceso químico. Concentración y estado físico de los reactivos. Catalizadores. - Temperatura: ecuación de Arrhenius. - Energía de activación. - Predección y justificación de cómo varía la velocidad de una reacción química dada con algunos de los factores ya estudiados. - Teoría de las reacciones químicas. - Estudio de las reacciones químicas en términos de la teoría de colisiones. Choques eficaces. Energía de activación. Factor estérico. - Teoría del estado de transición. - Dibujo del diagrama entálpico de una reacción dada, ubicando en él las distintas magnitudes energéticas puestas en juego en el proceso a estudiar: entalpía de reacción, energía de activación, etc. - Catalizadores. - Propiedades de los catalizadores. Mecanismo general de la catálisis. - Tipos de catálisis. Catálisis heterogénea. Catálisis homogénea. Catálisis enzimática. - Aplicación del uso de catalizadores en las reacciones químicas, particularizando dicho uso en algún proceso industrial o biológico de especial relevancia. PROCEDIMENTALES y ACTITUDINALES - Interés por conocer los aspectos cinéticos y su influencia en las reacciones químicas. - Valoración de la importancia que tienen los catalizadores en diversos procesos industriales y biológicos. - Valoración de la relación entre un mayor conocimiento de las reacciones químicas, el desarrollo tecnológico y su aplicación en la sociedad. - Búsqueda de aplicaciones prácticas de lo estudiado teóricamente. Unidad 8 : Equilibrio químico Nº de horas:12 OBJETIVOS GENERALES 1. Conocer y saber aplicar la ley del equilibrio químico. 2. Conocer el concepto de cociente de reacción y utilizarlo para determinar si un sistema está, o no, en equilibrio químico. 3. Conocer los distintos tipos de equilibrio y saber aplicarlos a problemas concretos. 4. Relacionar los diversos conceptos estudiados en el equilibrio químico. 5. Conocer los factores que afectan al equilibrio químico y saber aplicarlos a algunos procesos industriales de especial interés. CRITERIOS DE EVALUACIÓN 1.1. Aplica la ley del equilibrio químico a diversas reacciones químicas para obtener la expresión de la constante de equilibrio. 1.2. Relaciona las constantes de equilibrio Kp y Kc para una reacción dada. 1.3. Resuelve ejercicios y problemas de aplicación de la ley del equilibrio químico: cálculos numéricos de constantes y determinación de las cantidades de todas las sustancias presentes en el equilibrio. 2.1. Resuelve ejercicios y problemas de cálculos de cociente de reacción, justificando el sentido en el que evolucionará el sistema en caso de no encontrarse en equilibrio. 3.1. Resuelve ejercicios y problemas de equilibrios heterogéneos. 3.2. Resuelve ejercicios y problemas de equilibrios de solubilidad. 4.1. Realiza ejercicios y problemas que relacionen todos los conceptos fundamentales estudiados para el equilibrio. 5.1. Aplica el principio de Le Châtelier a reacciones generales en equilibrio. 5.2. Aplica el principio de Le Châtelier a procesos de industriales, biológicos o medioambientales de especial relevancia. CONTENIDOS CONCEPTUALES - Sistemas en equilibrio. - Procesos físicos en equilibrio. Reacciones químicas reversibles y equilibrio. - Equilibrio químico: un equilibrio dinámico. Constante de equilibrio y ley de acción de masas. - Justificación cinética de la constante de equilibrio. Expresión de la constante de equilibrio. Equilibrios homogéneos. Equilibrios heterogéneos. - Cociente de reacción. Aplicación de este concepto para determinar si un proceso dado se encuentra o no en equilibrio, y cuál será su evolución posterior. - Grado de disociación. - Identificación de procesos de equilibrio y qué condiciones deben cumplir. - Utilización de la ley del equilibrio químico para obtener la expresión de la constante de equilibrio. - Relación, para ejemplos concretos, las constantes de equilibrio Kp y Kc. - Realización de diversos cálculos de las cantidades de las sustancias presentes en un equilibrio. - Resolución de ejercicios y problemas donde se apliquen las ideas generales del equilibrio químico. - Factores que afectan al equilibrio. Principio de Le Châtelier. - Efecto de la temperatura. Efecto de la presión. Efecto de las concentraciones. Adición de catalizadores. - Aplicación del principio de Le Châtelier a procesos de especial interés. - Resolución de ejercicios donde se estime cómo evolucionará un equilibrio químico cuando se varíen las condiciones en las que se encuentra. - Solubilidad y precipitación. - Equilibrios de solubilidad. Producto de solubilidad. Constante del producto de solubilidad. Relación entre solubilidad y producto de solubilidad. Precipitación fraccionada. - Alteraciones en los equilibrios de solubilidad. Efecto del ion común. Disolución de precipitados. - Aplicación de las leyes del equilibrio químico a procesos heterogéneos en general, y a los equilibrios de solubilidad como caso particular. - Importancia del equilibrio en algunos procesos industriales y medioambientales. - El proceso Haber. Formación de NO. PROCEDIMENTALES y ACTITUDINALES - Reconocimiento de la importancia que tiene el estudio del equilibrio químico a la hora de diseñar procesos industriales de especial relevancia. - Interés por el estudio de algunos equilibrios de especial relevancia por sus connotaciones medioambientales: formación de NO, descomposición de O 3, etc. - Valoración la relación entre un mayor conocimiento de la materia, el desarrollo tecnológico y su aplicación en la sociedad. Unidad 9: Equilibrios ácido-base. Nº de horas:12 OBJETIVOS GENERALES CRITERIOS DE EVALUACIÓN 1. Conocer y comprender los conceptos fundamentales en las distintas teorías ácidobase. 2. Aplicar la ley del equilibrio químico para calcular las concentraciones de las especies presentes en un equilibrio ácido-base, y saber relacionar las constantes de acidez y de basicidad de cualquier par ácido-base conjugado. 3. Conocer el concepto de pH y su relación con el producto iónico del agua. 4. Valorar la importancia del pH en diversos procesos biológicos, industriales, caseros, etc. 5. Comprender y saber estimar los procesos de hidrólisis de sales, de las disoluciones reguladoras y su influencia en el pH. 6. Conocer las valoraciones ácido-base, y entenderlas como una valiosa técnica en el análisis químico. 1.1. Aplica los conceptos de ácido-base de Arrhenius y Brönsted-Lowry en el reconocimiento de sustancias que puedan actuar como tales. 1.2. Completa reacciones entre pares ácido-base conjugados de Brönsted-Lowry. 2.1. Resuelve ejercicios y problemas en equilibrios de disociación de ácidos o bases débiles. Calcula grados de disociación. 3.1. Resuelve ejercicios y problemas de cálculos de pH de distintas disoluciones, tanto para electrólitos fuertes como débiles. 4.1. Describe situaciones de la vida diaria donde se manifieste la importancia del pH. 5.1. Justifica la variación del pH al producirse la disolución de algunas sales, y calcula en algunos casos sencillos, el pH de la disolución resultante. 6.1. Planifica alguna experiencia sencilla donde se aprecia la utilidad de las valoraciones ácidobase. 6.2. Calcula la concentración de una disolución desconocida, y elige el indicador adecuado en la detección del punto final. CONTENIDOS CONCEPTUALES - Electrólitos, ácidos y bases. - Propiedades electrolíticas. Primeras ideas sobre ácidos y bases. - Concepto de ácido y de base según la teoría de Arrhenius. Limitaciones de la teoría. - Concepto de ácido y de base según la teoría de Brönsted-Lowry. Pares conjugados ácido-base. Sustancias anfóteras. - Realización de pequeñas experiencias, ejercicios y problemas, para comprobar la validez de la teoría de Brönsted-Lowry. - Concepto de pH. - Autoionización del agua. Producto iónico del agua. - Concepto de pH. Medida del pH. Realización de experiencias sencillas en el laboratorio de medida del pH mediante el pH-metro, indicadores (papel), etc. Resolución de ejercicios y problemas de cálculos de pH de una disolución. - Fuerza relativa de ácidos y bases. - Disociación de ácidos y bases. Grado de ionización o de disociación. Constante de disociación o de ionización. - Resolución de ejercicios y problemas sobre disociación de ácidos y bases fuertes. Aplicación de las leyes del equilibrio químico en el estudio de la disociación de ácidos y bases débiles. - Relación entre la fuerza de un ácido y su base conjugada. - Hidrólisis de sales. - Casos posibles. Grado de hidrólisis y pH de la disolución resultante. Resolución de ejercicios y problemas sencillos de cálculo del pH de hidrólisis. - Disoluciones reguladoras del pH y sus aplicaciones. - Realización en el laboratorio de experiencias sencillas donde se manifieste la hidrólisis de sales. - Valoraciones ácido-base. - Fundamento teórico. Tipos de valoraciones. Curvas de valoración. - Indicadores. Criterios de elección de indicadores - Aplicación de la teoría de las valoraciones en el laboratorio: determinación de la concentración de una disolución. - Diseño práctico de una valoración de interés. PROCEDIMENTALES y ACTITUDINALES - Interés por conocer el papel que los ácidos y las bases tienen en nuestra vida diaria. - Reconocimiento de la importancia que tiene el estudio de los procesos ácido-base para poder obtener dichas sustancias en beneficio de la sociedad. - Interés por el estudio de algunos equilibrios ácido-base de especial relevancia en los organismos vivos. - Interés por aplicar los conceptos aprendidos en diversas situaciones de nuestra vida diaria. - Curiosidad científica y sentido crítico ante el papel de los ácidos y de las bases en la sociedad. Unidad 10: Reacciones de oxidación-reducción. Nº de horas:12 OBJETIVOS GENERALES CRITERIOS DE EVALUACIÓN - Interés por conocer el papel que los ácidos y las bases tienen en nuestra vida diaria. - Reconocimiento de la importancia que tiene el estudio de los procesos ácido-base para poder obtener dichas sustancias en beneficio de la sociedad. - Interés por el estudio de algunos equilibrios ácidobase de especial relevancia en los organismos vivos. - Interés por aplicar los conceptos aprendidos en diversas situaciones de nuestra vida diaria. - Curiosidad científica y sentido crítico ante el papel de los ácidos y de las bases en la sociedad. 1.1. Calcula números de oxidación para los átomos que intervienen en un proceso redox dado. 1.2. Identifica reacciones de oxidación y de reducción en procesos que puedan tener diversas aplicaciones en la sociedad. 2.1. Resuelve ejercicios de ajuste estequiométrico en procesos redox que transcurran en medio ácido. 2.2. Resuelve ejercicios de ajuste estequiométrico en procesos redox que transcurran en medio básico. 3.1. Determina masas equivalentes en procesos de oxidación-reducción. 4.1. Calcula la concentración de una disolución mediante una volumetría redox. 5.1. Resuelve ejercicios y problemas de representación de pilas y cálculo de su f.e.m. 5.2. Aplica los criterios de espontaneidad para predecir si una determinada reacción redox va a tener lugar. 6.1. Resuelve ejercicios y problemas relativos a fenómenos de electrólisis. CONTENIDOS CONCEPTUALES - Reacciones de oxidación-reducción. - Concepto de oxidación y de reducción y su evolución. Concepto actual. - La oxidación y la reducción como procesos complementarios. Interprétalos, por tanto, como un intercambio de electrones entre dos sustancias químicas. - Oxidantes y reductores. Pares redox. - Número de oxidación. Ajuste de reacciones redox: método del ion-electrón (en medio ácido y en medio básico). - Reglas para asignar números de oxidación. Diferencia con el concepto de carga eléctrica y el de valencia. - Ajuste de reacciones redox. Método del ion-electrón: ajuste en medio ácido y en medio básico. - Estequiometría de los procesos redox. - Tipos de procesos redox. Valoraciones redox. Cálculo de masas equivalentes. Indicadores redox. - Cálculos de equivalentes redox en diversos procesos. - Aplicar las leyes de la estequiometría a las reacciones redox. - Realización de experiencias sencillas de laboratorio, ejercicios y problemas, sobre las valoraciones redox. Determinación de la concentración de una disolución. - Celdas electroquímicas. - Elementos de una celda electroquímica. Puente salino. Pila Daniell. Electrodos de gases. Notación convencional de las celdas. Potenciales de electrodo y potencial de una celda. Potenciales estándar de electrodo. Efecto de la concentración en el potencial. - Predicción de reacciones redox. - Resolución de ejercicios y problemas sencillos de cálculo de la f.e.m. de una pila. - Justificación, a la vista de la tabla de potenciales, del porqué de determinados procesos de oxidaciónreducción. - Predicción de la espontaneidad, o no, de un determinado proceso de oxidación-reducción. - Realización en el laboratorio de experiencias sencillas donde se manifiesten algunos procesos redox. - Espontaneidad de las reacciones redox. - Criterio termodinámico de espontaneidad. Comportamiento de los metales con los ácidos. - Electrólisis. - Electrólisis de sales fundidas. Electrólisis del agua. Electrólisis de sales en disolución acuosa. - Aspectos cuantitativos de la electrólisis. Constante de Faraday. Resolución de ejercicios y problemas. - Aplicaciones de los procesos electrolíticos. Obtención de sustancias. Purificación de metales. Galvanizado. Corrosión de metales. - Diferencias y analogías entre pila electroquímica y cuba electrolítica. PROCEDIMENTALES y ACTITUDINALES - Valoración del impacto medioambiental que puede producir un mal uso de sustancias oxidantes o reductoras. - Interés por conocer y estudiar algunos procesos redox de nuestra vida diaria, y su importancia, tanto a nivel biológico como industrial, en beneficio de la sociedad. Unidad 11: La química del carbono Nº de horas:12 OBJETIVOS GENERALES CRITERIOS DE EVALUACIÓN 1. Conocer las peculiaridades del átomo de 1.1. Representa estructuralmente y en forma carbono: distintos tipos de hibridación, cadenas semidesarrollada diversos compuestos carbonadas, e isomería, relacionando estos orgánicos. aspectos con el elevado número de compuestos 1.2. Escribe los isómeros de un compuesto orgánico de carbono presentes en la naturaleza. dado. 2. Formular y nombrar hidrocarburos, y conocer sus 2.1. Formula y nombra hidrocarburos saturados, propiedades físicas más relevantes. tanto alifáticos como aromáticos. 3. Formular y nombrar los compuestos oxigenados 2.2. Formula y nombra hidrocarburos insaturados, más importantes, y conocer sus propiedades tanto alifáticos como aromáticos. físicas más relevantes. 2.3. Describe las propiedades físicas más 4. Formular y nombrar los compuestos nitrogenados relevantes de los hidrocarburos, más importantes, y conocer sus propiedades relacionándolas con el tipo de enlace y las físicas más relevantes. fuerzas intermoleculares. 3.1. Formula y nombra los compuestos de carbono con funciones oxigenadas más importantes. 3.2. Describe las propiedades físicas más relevantes de los compuestos oxigenados, relacionándolas con el tipo de enlace y las fuerzas intermoleculares. 4.1. Formula y nombra los compuestos de carbono con funciones nitrogenadas más importantes. 4.2. Describe las propiedades físicas más relevantes de los compuestos nitrogenados, relacionándolas con el tipo de enlace y las fuerzas intermoleculares. CONTENIDOS CONCEPTUALES - Los compuestos de carbono. - Cadenas carbonadas. Tipos de átomos de carbono. Representación de las moléculas orgánicas. Fórmulas estructurales. Fórmulas semidesarrolladas. Formas expandidas. - Isomería. Isomería estructural o plana. Estereoisomería, geométrica y óptica. - Grupos funcionales. Series homólogas. - Reglas de formulación y nomenclatura de los compuestos de carbono. - Representar mediante modelos moleculares diversas moléculas orgánicas. - Hidrocarburos - Tipos de hidrocarburos. - Alcanos, alquenos y alquinos. Reglas generales de formulación. Cadenas lineales y ramificadas. Radicales. Propiedades físicas. - Hidrocarburos alicíclicos y derivados halogenados. - Hidrocarburos aromáticos. Formulación y nomenclatura. Propiedades físicas. - Resolución de ejercicios de nomenclatura y formulación de hidrocarburos. - Comparación, a partir de las fuerzas intermoleculares, de la variación de las propiedades en los hidrocarburos. - Funciones oxigenadas. - Alcoholes, fenoles y éteres: formulación, nomenclatura y propiedades físicas. - Aldehídos y cetonas: formulación, nomenclatura y propiedades físicas. - Ácidos y ésteres: formulación, nomenclatura y propiedades físicas. - Resolución de ejercicios de formulación, nomenclatura de compuestos de carbono con funciones oxigenadas. - Comparar, a partir de las fuerzas intermoleculares de la variación en una misma propiedad para distintos compuestos oxigenados. - Funciones nitrogenadas. - Aminas y amidas: formulación, nomenclatura y propiedades físicas. - Nitrocompuestos y nitrilos: formulación, nomenclatura y propiedades físicas. - Resolución de ejercicios de formulación y nomenclatura de compuestos de carbono con funciones nitrogenadas. - Comparación, a partir de las fuerzas intermoleculares, de la variación en una misma propiedad para distintos compuestos nitrogenados. - Macromoléculas naturales. - Carbohidratos. Lípidos. Proteínas. PROCEDIMENTALES y ACTITUDINALES - Valoración del impacto medioambiental que puede producir un mal uso de los compuestos de carbono. - Interés por realizar pequeñas experiencias, tanto en casa como en el laboratorio, que manifiesten las propiedades de las sustancias orgánicas. Unidad 12: Reactividad de compuestos orgánicos. Nº de horas:10 OBJETIVOS GENERALES CRITERIOS DE EVALUACIÓN 1. Conocer los desplazamientos electrónicos y las rupturas de enlace que tienen lugar en una reacción química, asociándolos como una de las causas de la reactividad de los compuestos de carbono. 2. Conocer los principales tipos de reacciones orgánicas así como algunos de los mecanismos de reacción más usuales que siguen dichas reacciones. 3. Describir las principales reacciones de los hidrocarburos y los derivados halogenados, formulando y nombrando todos los productos que en ellas intervienen. 4. Describir las principales reacciones de los compuestos oxigenados, describiendo el mecanismo que siguen y formulando y nombrando todos los productos que en ellas intervienen. 5. Describir las principales reacciones de los compuestos nitrogenados, formulando y nombrando todos los productos que en ellas intervienen. 1.1. Explica los desplazamientos electrónicos para algunas moléculas orgánicas. 2.1. Clasifica las reacciones orgánicas más importantes dentro de los tipos estudiados en la unidad. 3.1. Resuelve ejercicios y problemas donde tengan lugar las reacciones más importantes de los hidrocarburos. 3.2. Resuelve ejercicios y problemas donde tengan lugar las reacciones más importantes de los derivados halogenados. 4.1. Resuelve ejercicios y problemas donde tengan lugar las reacciones más importantes de los alcoholes. 4.2. Resuelve ejercicios y problemas donde tengan lugar las reacciones más importantes de los aldehídos y cetonas. 4.3. Resuelve ejercicios y problemas donde tengan lugar las reacciones más importantes de los ácidos carboxílicos. 5.1. Resuelve ejercicios y problemas acerca de los principales tipos de reacciones orgánicas que presentan los compuestos nitrogenados. CONTENIDOS CONCEPTUALES - Introducción a las reacciones orgánicas. - Desplazamientos electrónicos. Efecto inductivo. Efecto mesómero. Resolución de ejercicios y problemas. - Rupturas de enlace. Ruptura homolítica. Ruptura heterolítica. Intermedios de reacción: radicales libres, carbocationes y carbaniones. Mecanismo de las reacciones orgánicas. - Observación en el laboratorio de algunos compuestos donde los desplazamientos electrónicos tengan especial interés; por ejemplo, el aumento de la acidez del ácido tricloroacético. - Tipos de reacciones orgánicas. - Sustitución. Adición. Eliminación. Transposición. Condensación. Oxidación-reducción. - Resolución de ejercicios y problemas sobre los diversos tipos de reacciones orgánicas. - Observación en el laboratorio de algunas reacciones estudiadas en la unidad. - Trabajos de consulta bibliográfica sobre las aplicaciones más importantes de las reacciones estudiadas en el texto. - Reacciones de los hidrocarburos y los derivados halogenados. - Consideraciones generales en las reacciones de hidrocarburos. Reacciones características: halogenación; adición a los enlaces múltiples; combustión. - Consideraciones generales en las reacciones de los derivados halogenados. Reacciones características: sustitución; eliminación. - Reacciones de los compuestos oxigenados. - Consideraciones generales en las reacciones de los compuestos oxigenados. Reacciones características: alcoholes: sustitución, eliminación y oxidación-reducción; aldehídos y cetonas: adición y oxidaciónreducción; ácidos carboxílicos: esterificación, amidación, oxidación-reducción. - Reacciones de los compuestos nitrogenados. - Consideraciones generales en las reacciones de los compuestos nitrogenados. - Reacciones características: aminas, adición electrófila; ámidas: hidrólisis. PROCEDIMENTALES y ACTITUDINALES - Interés por el estudio de algunas reacciones orgánicas de especial relevancia, tanto a nivel biológico como a nivel industrial. - Curiosidad científica y sentido crítico ante el papel que tienen los procesos de síntesis de sustancias orgánicas en nuestra sociedad. - Valoración del impacto medioambiental que puede producir un mal uso de las reacciones de los compuestos de carbono. - Interés por realizar pequeñas experiencias, tanto en casa como en el laboratorio, que manifiesten las características estudiadas para las reacciones de los compuestos de carbono. - Valoración de la relación entre un mayor conocimiento de la materia, el desarrollo tecnológico y su aplicación en la sociedad. CRITERIOS RESPECTO A LOS CUALES SE VA A EVALUAR A LOS ALUMNOS. 1. TRABAJO DIARIO DEL ALUMNO: realización de tareas en casa, así como el trabajo en el aula. 2. CONOCIMIENTOS PROPIOS DE LA MATERIA: Si posee los conceptos y si los aplica. También se valorarán los conocimientos de procedimientos referentes tanto a planteamiento y resolución de problemas, como a expresión y comprensión. Los ejercicios para valorar los conocimientos serán similares a los de la prueba de Acceso a la Universidad 3. ASISTENCIA Y ACTITUD EN CLASE: La asistencia a clase y la participación en el desarrollo de la misma. 4. PRUEBAS ESCRITAS: Se realizará cómo mínimo 1 al trimestre. En cada prueba escrita se indicará de forma explicita la puntuación de cada pregunta y apartado. Para superar la asignatura será necesario obtener una calificación mínima de 5.