Guía de ejercicios Propiedades periódicas
Anuncio
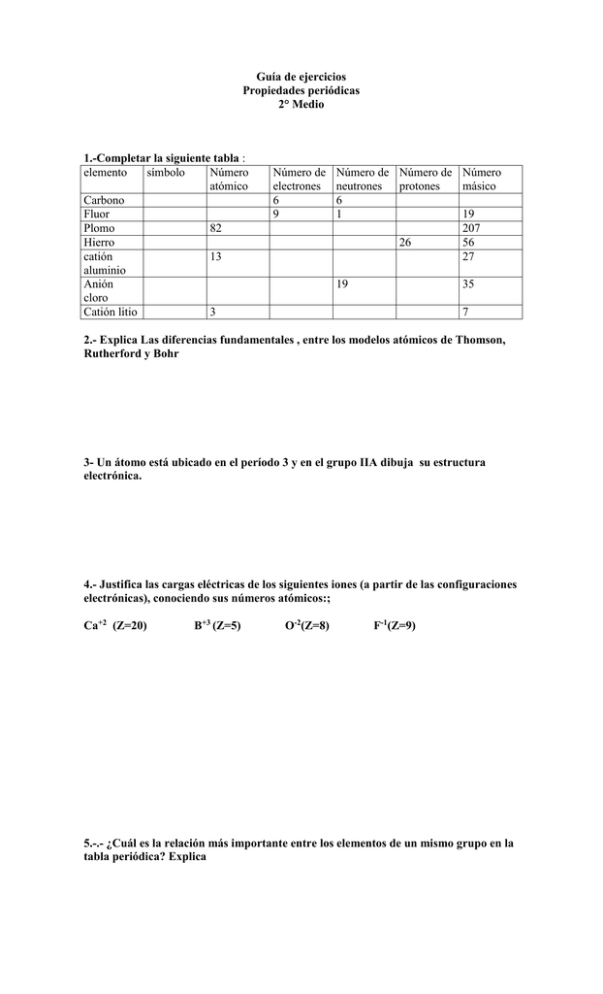
Guía de ejercicios Propiedades periódicas 2° Medio 1.-Completar la siguiente tabla : elemento símbolo Número atómico Carbono Fluor Plomo 82 Hierro catión 13 aluminio Anión cloro Catión litio 3 Número de electrones 6 9 Número de Número de Número neutrones protones másico 6 1 19 207 26 56 27 19 35 7 2.- Explica Las diferencias fundamentales , entre los modelos atómicos de Thomson, Rutherford y Bohr 3- Un átomo está ubicado en el período 3 y en el grupo IIA dibuja su estructura electrónica. 4.- Justifica las cargas eléctricas de los siguientes iones (a partir de las configuraciones electrónicas), conociendo sus números atómicos:; Ca+2 (Z=20) B+3 (Z=5) O-2(Z=8) F-1(Z=9) 5.-.- ¿Cuál es la relación más importante entre los elementos de un mismo grupo en la tabla periódica? Explica 6.- Dibuja un esquema general de la Tabla Periódica ( sin mayores detalles). Indica en ella donde se localizan los elementos representativos, los elementos de transición , los elementos de transición interna y los gases nobles; ¿Qué orbitales ocupan los electrones de valencia de cada tipo de elemento? 7.- Un átomo neutro de cierto elemento tiene 15 electrones . Escribe la configuración electrónica del elemento y clasifícalo ( Grupo, período, tipo de elemento) 7.- Agrupa las siguientes configuraciones en parejas, que puedan representar átomos con propiedades químicas semejantes: (justifica tu respuesta) a.- 1s22s22p63s2 b.- 1s22s22p3 c.- 1s22s2 d.- 1s22s22p6 e.- 1s22s22p63s23p3 8.- De acuerdo al Z, observando la configuración electrónica, ordena los siguientes átomos de menor a mayor radio atómico, explica el porqué de este orden Al (Z= 13) B (Z=5) In (Z=49) Ga (Z=31) 9.- Explica que es el potencial de ionización y como varía éste en la tabla periódica. Puedes tomar como ejemplo los elementos del ejercicio anterior. 10.- Dos átomos tienen las siguientes configuraciones electrónicas 1s22s22p6 y 1s22s22p63s1. El primer potencial de ionización de uno de ellos es 496 KJ/mol y el primer potencial de ionización del otro es: 2080 KJ/mol. Asigna cada uno de los potenciales de ionización a cada una de las configuraciones entregadas y justifica tu respuesta. II:_ Marca la alternativa correcta: 1) Con respecto a la variación de las propiedades de los elementos en la tabla periódica, sólo una de las siguientes afirmaciones es correcta: a) En el período, a mayor Z, mayor radio atómico; b) c) d) e) En el período, el PI aumenta hacia la derecha; En el grupo, a mayor Z, mayor PI; En el período, la EN aumenta hacia la izquierda. En el grupo, a mayor Z, menor radio atómico; 2) a) b) c) d) e) Un elemento tiene la siguiente configuración: Ar 4s23d2, por lo tanto el elemento: Es representativo; Se ubica en el grupo IV-B; Es inerte. Se ubica en el período 3; Tiene 2 electrones de valencia; 3) Los gases nobles tienen inercia para reaccionar químicamente porque desde el punto de vista electrónico presentan: a) Incompleto su primer nivel; b)Se ubica en el período 3; c)Tiene 2 electrones de valencia; d)Se ubica en el período 3; e)Tiene 2 electrones de valencia; 4) El elemento de Z = 11 presentará un catión con carga: a) +1 b) +2 c) +3 d) +4 e) -1 5) En un período, ¿cuál de las siguientes propiedades de los átomos aumenta en función de Z? a) Radio atómico. b) Reactividad frente a ácidos. c) Electronegatividad. d) Conductividad eléctrica. e) Solubilidad en agua. 6) Si el número atómico de un elemento X es 17 entonces su configuración electrónica es: a) 1s2 2s2 2p6 3s2 3p51s2 2s2 2p6 3s2 3p5 4s1 b) 1s2 2s2 2p6 3d8 c) 1s2 2s2 2p6 3s2 3p5 4s1 d) 1s2 2s2 2p6 3s2 3p6 e) ninguna de las anteriores 7) El elemento que posee la siguiente configuración electrónica en su último nivel: 4s2 4p1, pertenece al grupo y período: Grupo Período a) IA 4 b) IVA 3 c) IIIA 4 d) IB 4 8) Si para el átomo de litio, Z = 3, se escribiera la configuración 1s3, no se estaría cumpliendo: a) El principio de Heissenberg. b) El principio de Pauli c) La regla de Hund d) El principio de constitución. e) Ninguna alternativa es correcta 9) Respecto de un átomo que tiene la estructura electrónica que se indica, se puede afirmar que: 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p3 a) El átomo posee 5 electrones de valencia. b) Es un elemento de transición. c) El elemento se ubica en el grupo III de la tabla períodica. d) El elemento se ubica en el período V de la tabla períodica. e) Ninguna es correcta 10) Los elementos ubicados en un mismo período del sistema periódico poseen igual: a) número de capas o niveles electrónicos b) energía de ionización c) peso atómico d) configuración electrónica externa e) electronegatividad 11) La energía liberada en el siguiente proceso se llama: F(g) + eF-(g) + 328 KJ/ mol a) electroafinidad b) energía de enlace c) energía d) energía o potencial de ionización e) electronegatividad 12.- ¿Cuál de las siguientes parejas origina un ion? I 20 protones y 22 electrones II 20 protones y 21 electrones III 21 protones y 20 neutrones Son correctas: a) sólo II b) sólo II c) I, II y III d) I y II e) sólo I 13.- Sabiendo que el átomo de potasio K tiene un Z= 19 , el ion K posee un número de electrones igual a: a) 20 b) 18 c) 19 d) 0 e) 1 14.- ¿Cuál de las siguientes propiedades , no aumenta al aumentar el Z en el mismo período del sistema periódico a) número de capas o niveles b) potencial o energía de ionización c) número de electrones de la última capa d) número de protones e) número de electrones 15.- En base a los conocimientos de la estructura atómica, se define potencial o energía de ionización a: a) la energía que se libera frente a un cambio de posición de los orbitales atómicos de un átomo b) la energía potencial que tiene un electrón c) la energía necesaria para poder separar un electrón de un átomo neutro en estado gaseoso d) la energía del espectro visible de un ion e) la energía que libera un átomo cuando gana un electrón 16.- La ordenación en forma decreciente del tamaño de las especies químicas Ar, O, Ca, es: Z Ar = 18 O= 8 Ca = 20 a) O –Ar –Ca b) Ca –Ar – O c) Ar- Ca – O d) Ca –O- Ar e) Ar – O – Ca 17.a) b) c) d) e) El potencial o energía de ionización es más elevado en : Na Z = 11 Mg Z= 12 N Z = 14 S Z = 16 F Z=9 18.- Los gases nobles tienen inercia para reaccionar químicamente porque desde el punto de vista electrónico presentan: a) completos todos sus niveles a) incompleto su primer nivel b) incompleto su último nivel c) incompletos sus 2 últimos niveles d) incompletos sus 2 primeros niveles 19.-El flúor (F) tiene un Z= 9 , su configuración electrónica será: a) 1s22s22p23s23p1 b) 1s22s7 c) 1s32s32p3 d) 1s22s22p5 e) ninguna es correcta



