clase de DISOLUCIONES
Anuncio
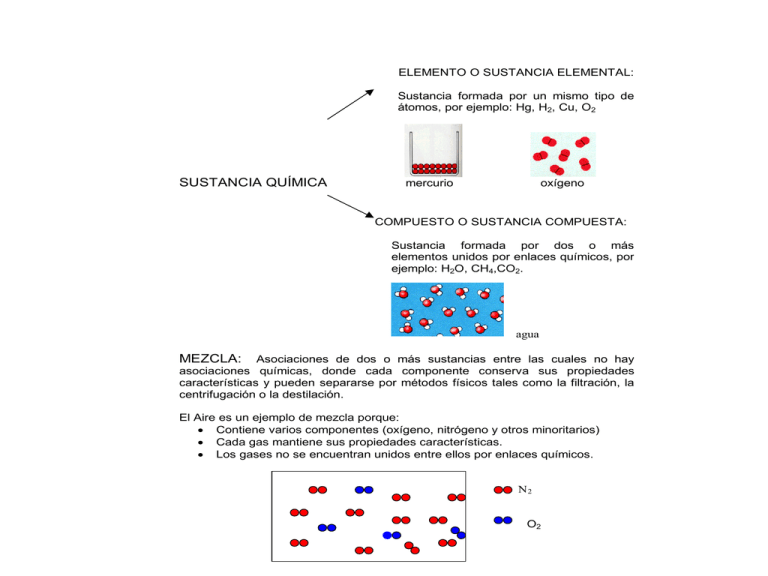
ELEMENTO O SUSTANCIA ELEMENTAL: Sustancia formada por un mismo tipo de átomos, por ejemplo: Hg, H2, Cu, O2 SUSTANCIA QUÍMICA mercurio oxígeno COMPUESTO O SUSTANCIA COMPUESTA: Sustancia formada por dos o más elementos unidos por enlaces químicos, por ejemplo: H2O, CH4,CO2. agua MEZCLA: Asociaciones de dos o más sustancias entre las cuales no hay asociaciones químicas, donde cada componente conserva sus propiedades características y pueden separarse por métodos físicos tales como la filtración, la centrifugación o la destilación. El Aire es un ejemplo de mezcla porque: Contiene varios componentes (oxígeno, nitrógeno y otros minoritarios) Cada gas mantiene sus propiedades características. Los gases no se encuentran unidos entre ellos por enlaces químicos. N2 O2 MEZCLA HOMOGÉNEA Sus componentes no se pueden distinguir a simple vista o mediante el uso de instrumentos ópticos y que presentan propiedades físicas y químicas iguales en cualquier porción de la mezcla. HETEROGÉNEA Sus componentes se pueden distinguir a simple vista o mediante el uso de instrumentos ópticos y presentan propiedades físicas y químicas diferentes en cualquier porción de la mezcla. Ejemplo: arena con agua Ejemplo: azúcar disuelta en agua DISOLUCIÓN: mezcla homogénea a escala atómica. Ejemplos: Suero fisiológico: formado por agua destilada y cloruro de sodio Agua Oxigenada: formado por peróxido de hidrógeno y agua Vinagre: formado por ácido acético y agua Té con azúcar: formado por té, agua y azúcar COMPONENTES DE UNA DISOLUCIÓN DISOLVENTE: componente de una mezcla que se encuentra en mayor proporción a escala atómica. En el se disuelven los solutos. SOLUTO: componente o componentes de una mezcla que se encuentra en menor proporción a nivel atómico que el disolvente. DISOLVENTE + SOLUTO DISOLUCIÓN Ejemplo: en el cloro doméstico el disolvente es el agua y el soluto es el hipoclorito de sodio (NaClO) En la Disolución siguiente ¿Cuál es el Soluto y Cuál es el Disolvente? Si mezclamos 5,0 mL de agua con 5,0 mL de alcohol se obtiene una disolución en donde no es evidente cual es el soluto y cual el disolvente. Por lo tanto primero debemos determinar el número de moléculas de cada componente. Datos: Densidad alcohol: 0,9 g/mL Densidad agua: 1,0 g/mL Masa molar alcohol: 46 g/mol Masa molar agua: 18 g/mol Utilizando la densidad tenemos que los 5,0 mL de alcohol corresponden a 4,5 g y los 5 mL de agua corresponden 5,0 g. Utilizando la masa molar se tiene que los 4,5 g de alcohol corresponden a 0,098 mol de moléculas y los 5,0 g de agua corresponden a 0,28 mol de moléculas. Por lo tanto el disolvente es el agua. Una disolución es una mezcla homogénea de un soluto (sustancia disuelta que está en menor proporción) distribuido en un disolvente (sustancia que produce la disolución, está en mayor proporción y determina el estado de agregación en el que se encuentra la disolución). Disolución Componentes Disoluciones gaseosas Aire N2, O2, H2 y otros Gas Natural CH4, C2H6 Disoluciones Líquidas Agua de mar H2O, NaCl, y muchos otros Vinagre H2O y ácido acético Gaseosa H2O, CO2, sacarosa, y otros Disoluciones Sólidas Latón amarillo Cu-Zn Amalgama para dientes Ag-Sn-Hg Disolución de un soluto en un solvente Cuando el soluto se disuelve en el solvente, las partículas de soluto se dispersan en el solvente formando una mezcla homogénea, de acuerdo a las siguientes etapas: Etapa 1: Separación de las moléculas o iones de disolvente. En esta etapa se absorbe energía. Por ejemplo si el solvente es agua líquida se deben romper puentes de hidrógeno para permitir que el soluto penetre al seno del solvente. E1 Disolvente Etapa 2: Separación de las moléculas o iones de soluto. En esta etapa se absorbe energía. Por ejemplo si el soluto es sal común (NaCl) se deben separar los iones Na+ y Cl- a través del rompimiento del enlace iónico que mantiene la cohesión del cristal. E2 Soluto Etapa 3: Mezcla homogénea de las partículas de soluto y solvente. Las partículas de soluto penetran el solvente generándose interacciones específicas atractivas, fundamentalmente de tipo electrostático. Solución Solución de NaCl en agua: se producirá la SOLVATACIÓN (HIDRATACIÓN) de los iones Na+ y Cl-. A nivel molecular se observa que las moléculas de disolvente rodean a las moléculas de soluto. Las moléculas de soluto quedan envueltas por las de disolvente. Na+ Cl- H O Disolución de compuestos polares en agua: la solvatación de compuestos polares es favorecida por la interacción que se genera entre los polos opuestos de las moléculas. Ejemplo etanol solvatado: + - Disolución de compuestos no polares en agua: los compuestos no polares no se disuelven en agua porque no existen interacciones que favorezcan la solvatación. En general, solventes polares como el agua y los alcoholes disuelven eficientemente solutos polares a través de la formación de puentes de hidrógeno. Mientras que solventes apolares como el tetracloruro de carbono (CCl4) o el benceno (C6H6) favorecen la disolución de solutos no polares. SOLUBILIDAD: cantidad máxima de soluto que se puede disolver en una determinada cantidad de disolvente. Es una propiedad del soluto. Líquido Sólido insoluble sólido Solución Homogénea Solución Saturada FACTORES QUE AFECTAN LA SOLUBILIDAD: Naturaleza de los reactantes Temperatura Presión a.- Naturaleza de los reactantes: "Lo semejante disuelve a lo semejante" El aceite no se mezcla con el agua. b.- Efecto de la temperatura: Reactantes + Q Productos Rx.Endotérmica Aumento de la Tº mejora la solubilidad Reactantes Productos + Q Rx. Exotérmica Aumento de la temperatura disminuye la solubilidad c.- Presión: a mayor presión mayor solubilidad La presión tiene un efecto importante sobre la solubilidad para los sistemas gaseosos. A una Tª determinada, el aumento de presión implica un incremento en la solubilidad del gas en el líquido. Cantidades Químicas: El mol En la vida diaria nos resulta familiar utilizar ciertas unidades cuando nos referimos a un número determinado de objetos: un par de zapatos (2 unidades) una docena de huevos (12 unidades) etc. El químico también necesita cuantificar la materia. Para esto se precisa una "unidad de conteo" suficientemente grande de modo que las partículas que conforman la unidad sean de una magnitud "manipulable". La unidad de conteo que usan los químicos es el MOL, del latín moles que significa "montón". MOL: cantidad de sustancia que contiene 6,02x1023 entidades elementales, que pueden ser átomos, moléculas u otras partículas. Este número inmenso (602.000.000.000.000.000.000.000) corresponde al número de Avogadro. "Hipótesis de Avogadro": que en las mismas condiciones de P y T, en volúmenes iguales de cualquier gas, están contenidas el mismo número de partículas (T=0º C, P=1 atm, V=22,4 L, siempre había 6,02x1023 partículas). Ejemplo: 1 mol de átomos de hidrógeno contiene 6,02x1023 átomos de hidrógeno ó 1 mol de moléculas de agua contiene 6,02x1023 moléculas de agua. Masa Molar (M): es la masa de un mol de sustancia expresada en gramos. Ejemplo: M del sodio es 22,99 g/mol; es decir un mol de sodio pesa 22,99 g ó M del agua es 18 g/mol (MA H x 2 + MA O) es decir un mol de agua pesa 18 g. CUANTIFICANDO LA CONCENTRACIÓN DE UNA SOLUCIÓN. La composición de una disolución es la relación entre el soluto y la disolución o entre el soluto y el disolvente. En esta relación, tanto el soluto como la disolución y el disolvente pueden expresarse en unidades de masa, de volumen y de cantidad. Para saber exactamente la cantidad de soluto y de disolvente, los químicos han convenido una serie de Unidades de Concentración, donde la más frecuente es la MOLARIDAD. MOLARIDAD (M): cantidad de soluto expresada en moles que hay disueltos en 1 L de disolución. Ejemplo: Una solución acuosa 1M de NaCl significa que hay 1 mol de NaCl disueltos en 1 L de solución, donde la solución está formada por el soluto(NaCl) y el solvente (agua). Ejercicios de Aplicación: 1.¿Cuántos gramos de HNO3 hay presentes en 1500 mL de una solución 2M de HNO3? 2 moles HNO3 X moles 1000 mL 1500 mL X = 3 moles M HNO3 = MA H + MA N + 3x MA O = 1 + 14 + (3x16) = 63g/mol 1 mol HNO3 3 mol HNO3 63 g xg X = 189 g Composición de una disolución La composición de una solución puede expresarse a través del porcentaje peso-peso (% p/p). El cual corresponde a la masa de soluto, expresada en gramos, presente en 100 g de solución. Por ejemplo, si se tiene 5 g de NaCl en 50 g de solución, el % p/p de la solución es 10 % p/p. La composición de una solución puede expresarse también a través del porcentaje peso-volumen (% p/v). El cual corresponde a la masa de soluto, expresada en gramos, presente en 100 mL de solución. Por ejemplo, si se tiene 5 g de NaCl en 50 mL de solución, el % p/v de la solución es 10 % p/v. La composición de una solución puede expresarse también a través del porcentaje volumen-volumen (% v/v). El cual corresponde al volumen de soluto, expresado en mililitros (mL) presente en 100 mL de solución. Por ejemplo, si se tiene 5 mL de etanol en 50 mL de solución, el % v/v de la solución es 10 % v/v. Actividad en clases • 1) Si Ud. necesita preparar 250mL de solución 0,2 molar (0,2M). Determine que cantidad de NaCl necesita. • 2) Se dice que se puede disolver como máximo 5g de un compuesto en 100mL de disolvente. Si se desea disolver 25g de este compuesto, ¿Qué volumen mínimo de solvente, en mL, se necesita? 3) ¿Qué masa de nitrato de potasio (KNO3) se necesita para preparar 500mL de una solución 2 mol/L. 4) Se desea preparar 250 mL de solución de H2SO4 2 mol/L. Indique como hacerlo, si se dispone de una solución de ácido sulfúrico al 98% en masa y densidad 1,84g/mL. 5) Se disuelve 4g de NaOH en 250 mL de solución. Calcule la molaridad de la solución resultante. • 6) ¿Qué volumen de una solución acuosa de ácido perclórico (HClO4) de densidad 1,410g/mL y 50% en masa se necesita para preparar 600 mL de solución del ácido 0,1mol/L?



