INSTITUCIÓN EDUCATIVA SANTA TERESA DE
Anuncio
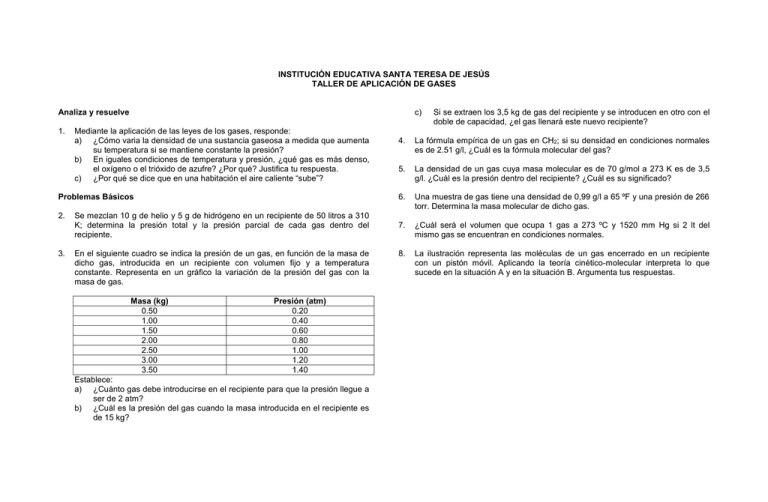
INSTITUCIÓN EDUCATIVA SANTA TERESA DE JESÚS TALLER DE APLICACIÓN DE GASES Analiza y resuelve 1. c) Mediante la aplicación de las leyes de los gases, responde: a) ¿Cómo varia la densidad de una sustancia gaseosa a medida que aumenta su temperatura si se mantiene constante la presión? b) En iguales condiciones de temperatura y presión, ¿qué gas es más denso, el oxígeno o el trióxido de azufre? ¿Por qué? Justifica tu respuesta. c) ¿Por qué se dice que en una habitación el aire caliente “sube”? Problemas Básicos 2. 3. Se mezclan 10 g de helio y 5 g de hidrógeno en un recipiente de 50 litros a 310 K; determina la presión total y la presión parcial de cada gas dentro del recipiente. En el siguiente cuadro se indica la presión de un gas, en función de la masa de dicho gas, introducida en un recipiente con volumen fijo y a temperatura constante. Representa en un gráfico la variación de la presión del gas con la masa de gas. Masa (kg) 0.50 1.00 1.50 2.00 2.50 3.00 3.50 Presión (atm) 0.20 0.40 0.60 0.80 1.00 1.20 1.40 Establece: a) ¿Cuánto gas debe introducirse en el recipiente para que la presión llegue a ser de 2 atm? b) ¿Cuál es la presión del gas cuando la masa introducida en el recipiente es de 15 kg? Si se extraen los 3,5 kg de gas del recipiente y se introducen en otro con el doble de capacidad, ¿el gas llenará este nuevo recipiente? 4. La fórmula empírica de un gas en CH2; si su densidad en condiciones normales es de 2.51 g/l, ¿Cuál es la fórmula molecular del gas? 5. La densidad de un gas cuya masa molecular es de 70 g/mol a 273 K es de 3,5 g/l. ¿Cuál es la presión dentro del recipiente? ¿Cuál es su significado? 6. Una muestra de gas tiene una densidad de 0,99 g/l a 65 ºF y una presión de 266 torr. Determina la masa molecular de dicho gas. 7. ¿Cuál será el volumen que ocupa 1 gas a 273 ºC y 1520 mm Hg si 2 lt del mismo gas se encuentran en condiciones normales. 8. La ilustración representa las moléculas de un gas encerrado en un recipiente con un pistón móvil. Aplicando la teoría cinético-molecular interpreta lo que sucede en la situación A y en la situación B. Argumenta tus respuestas. INSTITUCIÓN EDUCATIVA SANTA TERESA DE JESÚS TALLER DE APLICACIÓN DE GASES INTERPRETA SITUACIONES Mediante la aplicación de las leyes de los gases, responde: 1. Te vas de viaje con un grupo del colegio. Llevas un balón para jugar baloncesto. Ustedes parten de una ciudad que está a 2.600 metros sobre el nivel del mar y llegan a otra ciudad que está a 350 metros sobre el nivel del mar. El balón va desinflado. ¿Cómo llegará el balón? Explica tu respuesta. 2. ¿Cómo varia la densidad de una sustancia gaseosa a medida que aumenta su temperatura si se mantiene constante la presión? 3. En iguales condiciones de temperatura y presión, ¿qué gas es más denso, el oxígeno (O2) o el trióxido de azufre (SO3)? ¿Por qué? Justifica tu respuesta. 4. Los globos aerostáticos fueron las primeras aeronaves y las más sencillas de todas. Un globo aerostático es un recipiente de plástico o de tejido impermeabilizado que se mantiene suspendido en el aire, gracias a la expansión y la contracción del gas helio en su interior. Debido a los cambios de temperatura de la atmósfera, el helio se expande y ejerce una presión sobre las paredes internas del globo, logrando su elevación. Si la temperatura disminuye, el helio se contrae, permitiendo la entrada del aire desde el exterior, lo que hace que la aeronave pierda altura. Este mecanismo de expansión y contracción del helio permite que el globo viaje a través del aire sin necesidad de usar combustible. Con base en el texto anterior, responde: a. ¿Cuál de las variables, presión, temperatura o volumen permanece constante? b. ¿Cuál de las leyes de los gases se aplica en este caso? c. Escribe la expresión matemática que ilustre dicha ley. d. 5. ¿Por qué se dice que en una habitación el aire caliente “sube”? ESTABLECE CONDICIONES 6. Cierta cantidad de amoníaco ocupa un volumen de 2.500 ml a una presión de 589 Torr y a una temperatura de 68º C. ¿Cuál será su volumen en condiciones normales? 7. Se mezclan 10 gr de helio y 5 gr de hidrogeno en un recipiente de 50 litros a 310 kelvin; determina la presión total y la presión parcial de cada gas dentro del recipiente. 8. La densidad de un gas cuya masa molecular es de 70 gr / mol a 273 kelvin es de 3,5 gr / lt. ¿Cuál es la presión dentro del recipiente? 9. Una lata de fijador de cabello en aerosol contiene un gas con una presión 1,25 atm, a 25ºC. La lata explota cuando la presión alcanza un valor de 2,50 atm. ¿A que temperatura ocurrirá este fenómeno? 10. ¿Cuál es el peso de 6 lt de amoníaco NH3 en condiciones normales? INSTITUCIÓN EDUCATIVA SANTA TERESA DE JESÚS TALLER DE APLICACIÓN DE GASES INTERPRETA SITUACIONES Mediante la aplicación de las leyes de los gases, responde: 1. Te vas de viaje con un grupo del colegio. Llevas un balón para jugar baloncesto. 2. 3. 4. 5. Ustedes parten de una ciudad que está a 2.600 metros sobre el nivel del mar y llegan a otra ciudad que está a 350 metros sobre el nivel del mar. El balón va desinflado. ¿Cómo llegará el balón? Explica tu respuesta. Los globos aerostáticos fueron las primeras aeronaves y las más sencillas de todas. Un globo aerostático es un recipiente de plástico o de tejido impermeabilizado que se mantiene suspendido en el aire, gracias a la expansión y la contracción del gas helio en su interior. Debido a los cambios de temperatura de la atmósfera, el helio se expande y ejerce una presión sobre las paredes internas del globo, logrando su elevación. Si la temperatura disminuye, el helio se contrae, permitiendo la entrada del aire desde el exterior, lo que hace que la aeronave pierda altura. Este mecanismo de expansión y contracción del helio permite que el globo viaje a través del aire sin necesidad de usar combustible. Con base en el texto anterior, responde: a. ¿Cuál de las variables, presión, temperatura o volumen permanece constante? b. ¿Cuál de las leyes de los gases se aplica en este caso? c. Escribe la expresión matemática que ilustre dicha ley. En iguales condiciones de temperatura y presión, ¿qué gas es más denso, el oxígeno (O2) o el trióxido de azufre (SO3)? ¿Por qué? Justifica tu respuesta. ¿Cómo varia la densidad de una sustancia gaseosa a medida que aumenta su temperatura si se mantiene constante la presión. ¿Por qué se dice que en una habitación el aire caliente “sube”? ESTABLECE CONDICIONES 6. Cierta cantidad de amoníaco ocupa un volumen de 2.500 ml a una presión de 589 Torr y a una temperatura de 68º C. ¿Cuál será su volumen en condiciones normales? 7. Se mezclan 10 gr de helio y 5 gr de hidrogeno en un recipiente de 50 litros a 310 kelvin; determina la presión total y la presión parcial de cada gas dentro del recipiente. 8. La densidad de un gas cuya masa molecular es de 70 gr / mol a 273 kelvin es de 3,5 gr / lt. ¿Cuál es la presión dentro del recipiente? 9. Una lata de fijador de cabello en aerosol contiene un gas con una presión 1,25 atm, a 25ºC. La lata explota cuando la presión alcanza un valor de 2,50 atm. ¿A que temperatura ocurrirá este fenómeno? 10. ¿Cuál es el peso de 6 lt de amoníaco NH3 en condiciones normales?
